ЦИНКА СЕМЕЙСТВО | это… Что такое ЦИНКА СЕМЕЙСТВО?
Толкование
- ЦИНКА СЕМЕЙСТВО
ПОДГРУППА IIB. СЕМЕЙСТВО ЦИНКА
ЦИНК, КАДМИЙ, РТУТЬ
Положение элементов семейства цинка как членов рядов переходных металлов, рассмотрено ранее (см. разд. Подгруппа IB и Переходные элементы). Хотя валентный электрон, отличающий их от элементов подгруппы IB, поступает на ns-уровень и у каждого из них заполнена (n1)d 10-орбиталь, по своим химическим и физическим свойствам они все-таки очень отличаются от B-подгрупп; в то же время существует некоторое сходство с непереходными металлами. Так, есть аналогия с элементами подгруппы IIA все они проявляют степень окисления II. Эти переходные металлы имеют сравнительно невысокую плотность, низкие температуры плавления и кипения, проявляя тем самым сходство с непереходными металлами. Температуры плавления и кипения, в целом, увеличиваются к серединам рядов переходных металлов и затем постепенно, но нерегулярно, уменьшаются, поэтому металлы, завершающие серии переходных элементов, должны иметь относительно низкие значения этих величин, что мы и видим в табл.
Другой тенденцией, отличающей их от непереходных элементов, т.е. элементов A-подгрупп, является то, что цинк проявляет только степень окисления II, а кадмий реализует степень окисления II как наиболее стабильную, но может давать соединения и со степенью окисления I, и, наконец, для ртути стабильны обе степени окисления (I и II). Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы.
Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы. Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода.
Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода. Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха.
Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха.
Применение. Металлы подгруппы находят разнообразное применение. Большие количества цинка применяют для коррозионной защиты железа и стали. Металлический цинк достаточно активен, но первоначально в природных условиях образуется инертное защитное покрытие из основного карбоната Zn2(OH)2CO3. Цинковое покрытие можно получать разными способами горячим погружением, как в электролитических методах, испарением цинка с последующей конденсацией на защищаемую поверхность, разбрызгиванием, распылением, напылением и сушкой сформованного материала в больших печах. Много цинка расходуется в производстве бронз и латуней из меди и цинка (см. табл. 17б). Эти сплавы применяют для придания высокой коррозионной стойкости, например, марганцевая бронза (90% Cu, 5% Zn, 3% Sn и 2% Mn) отличается особой коррозионной стойкостью. Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре).
Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре).
Реакции. Цинк и кадмий активно реагируют со всеми кислотами и даже с водой (при достаточном нагревании), вытесняя из них h3. Реакции с кислотой протекают следующим образом:Цинк растворяется в щелочах с выделением водорода и образованием цинкат-иона Zn(OH)42. Ртуть реагирует только с сильными кислотами-окислителями, такими, как HNO3 и царская водка. При этом могут образовываться нитраты ртути(I) и ртути(II), Hg2(NO3)2 и Hg(NO3)2. В этом заключается, в частности, ее отличие от меди, которая тоже способна проявлять степени окисления I и II, но с азотной кислотой образует только Cu(NO3)2.
В зависимости от ряда факторов (размера реагирующих частиц, концентрации кислоты и температуры) медь реагирует с HNO3 с образованием различных соединений. Из раствора выделяются газообразные оксиды азота, азот и частично водород, в растворе образуются ион Cu(II), Nh3OH, N2h5, Nh5+, может образовываться осадок CuO.
Оксиды. Все металлы подгруппы (Zn, Cd, Hg) при нагревании реагируют с кислородом. Цинк образует белый ZnO, который при повышении температуры желтеет. Белый ZnO получается при термической диссоциации солей оксокислот; его используют как пигмент. Кадмий при прямом окислении образует коричневый оксид CdO, который при повышении температуры до ЦИНКА СЕМЕЙСТВО700° C разлагается на кадмий и кислород. Напротив, ZnO исключительно стабилен (см. в табл. 18 более отрицательное значение энтальпии образования ZnO). Ртуть медленно окисляется до HgO на воздухе при ЦИНКА СЕМЕЙСТВО300° С и вновь разлагается до металла при температурах чуть выше этой. HgO имеет желтую и красную модификации.
Амфотерность. Оксид цинка проявляет типичные амфотерные свойства, реагируя как с основаниями, так и с кислотами и образуя соответственно цинкат-ион Zn(OH)42и Zn2+. Гидроксид цинка Zn(OH)2 получается по реакции с основанием, но в избытке основания растворяется, образуя растворимый цинкат:
Zn(OH)2 +2OH- = Zn(OH)4 2-При использовании раствора аммиака в качестве основания тоже образуется вначале гидроксид, который в избытке Nh4 образует комплексный ион тетраамминцинка: Zn(OH)2 + 4Nh4 = [[Zn(Nh4)4]]2+ + 2OH
Кадмий образует аналогичный ион тетраамминкадмия [[Cd(Nh4)4]]2.
Оксид и гидроксид кадмия в отличие от таких же соединений цинка не проявляют амфотерных свойств. Кадмиат CdO22образуется только при сплавлении оксида кадмия(II) со щелочью. Оксид ртути(II) тоже устойчив к действию оснований, но амфотерность ртути проявляется в том, что HgS растворяется в растворе Na2S с образованием тиомеркурат(II)-иона HgS22.
Взаимодействие с кислотами. При обработке оксидов элементов подгруппы IIB кислотами образуются соли нитраты, сульфаты, галогениды, фосфаты и карбонаты. Карбонаты, нитраты и сульфаты при термической диссоциации разлагаются с образованием CO2, NO2, SO3 (SO2 + O2) соответственно. Карбонат ртути(I) Hg2CO3 получается при смешении растворов Hg2(NO3)2 и карбоната щелочного металла. Образование Hg2CO3 свидетельствует об отсутствии гидролиза иона Hg(I). Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема), в отличие от хлорида ртути(I) Hg2Cl2, растворим в воде. HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2
Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема), в отличие от хлорида ртути(I) Hg2Cl2, растворим в воде. HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2
Хлорид ртути(II) практически полностью неионное соединение с ковалентным типом связи. Однако то, что при действии h3S на раствор HgCl2 или на раствор с ионом Hg22+ выделяется только HgS, подтверждает наличие определенного количества ионов Hg2+. Аналогично при действии гидроксид-иона образуется только гидроксид ртути(II) Hg(OH)2. Галогениды металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов при реакциях растворимых галогенидов или псевдогалогенидов, например:
Галогениды металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов при реакциях растворимых галогенидов или псевдогалогенидов, например:Комплексообразование настолько сильно выражено у Cd, что аутокомплексы существуют в растворах солей кадмия (например, в растворе CdCl2): 2CdCl2 = Cd[[CdCl4]] В соединениях XHgX (X галоген) ковалентная связь столь прочна, что комплексные соединения ртути намного менее стабильны, чем соответствующие соединения цинка или кадмия. Поэтому в растворе HgCl2 преобладают ионы HgCl+ и Cl, а добавление Cl-иона к раствору HgCl2 не увеличивает стабильность комплексных ионов типа HgCl42. При взаимодействии галогенидов (а также других солей) ртути с аммиаком в зависимости от его физического состояния (газ или раствор) получается белый плавкий либо неплавкий осадок: HgCl2 + 2Nh4 (газ) = Hg(Nh4)2Cl2 (плавкий белый осадок) HgCl2 + 2Nh4 (водн.) = Nh5Cl + HgNh3Cl (неплавкий белый осадок) Вторая реакция тормозится в присутствии больших количеств хлорида аммония Nh5Cl.
 Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4
Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4
Очевидно, что ртуть имеет координационное число 2 (как в HgCl2 или [[Hg(Nh4)2]]2+, оба линейного строения) или 4, как в [[Hg(Nh4)4]]2+ (тетраэдрического строения).
Гидриды. Все металлы подгруппы IIB образуют гидриды состава Mh3. Так, гидрид цинка Znh3 получается при взаимодействии ZnI2 с LiAlh5 или LiH. Все гидриды реагируют с водой, выделяя водород, аналогично поведению гидридов элементов подгрупп IA и IIA. Термическая устойчивость гидридов убывает в ряду Znh3 > Cdh3 > Hgh3, причем Hgh3 начинает разлагаться при 125° С.
Термическая устойчивость гидридов убывает в ряду Znh3 > Cdh3 > Hgh3, причем Hgh3 начинает разлагаться при 125° С.
Сульфиды. Сульфиды двухвалентных металлов образуются по реакции прямого синтеза, а также при действии сероводорода на растворы солей. Сульфид цинка ZnS белое и растворимое в кислотах вещество, одно время он как пигмент в смеси с наполнителем BaSO4 (литопон) широко применялся для приготовления красок, в производстве пластмасс, линолеума и т.п. Сульфид кадмия CdS светложелтое вещество также применяют как пигмент, но он растворяется только в сильных кислотах или с окислителями. Для ртути известен только сульфид HgS, так как Hg22+ при обработке сероводородом образует только HgS:
Hg22+ + h3S -> Hg0 + HgS + 2H+ Приведенная реакция является реакцией диспропорционирования и хорошим доказательством чрезвычайной нерастворимости HgS: только смесь HNO3 + HCl растворяет этот сульфид.
Реакции Льюиса. Все ионы рассматриваемых металлов Zn, Cd, Hg обладают большим сродством к электронной паре, и поэтому можно полагать, что они являются сильными кислотами Льюиса, однако ртуть в меньшей степени, чем цинк и кадмий. Координационное число цинка преимущественно равно 4, но может достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической структурой приведено ниже: Zn2+ + 6Nh4 = [[Zn(Nh4)6]]2+ Zn2+ + 3Nh3Ch3Ch3Nh3 = [[Zn(en)3]]2+
Координационное число цинка преимущественно равно 4, но может достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической структурой приведено ниже: Zn2+ + 6Nh4 = [[Zn(Nh4)6]]2+ Zn2+ + 3Nh3Ch3Ch3Nh3 = [[Zn(en)3]]2+
Последнее соединение представляет собой комплексный ион с бидентатными лигандами: en молекула этилендиамина Nh3Ch3Ch3Nh3, донор двух электронных пар.Энциклопедия Кольера. — Открытое общество. 2000.
Игры ⚽ Поможем решить контрольную работу
- МЕТАЛЛЫ ДЛЯ ЧЕКАНКИ МОНЕТ
- АКТИНОИДЫ
Полезное
Цинк
| Цинк | |
|---|---|
| Атомный номер | 30 |
| Внешний вид простого вещества |
хрупкий металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
65,39 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 138 пм |
|
Энергия ионизации (первый электрон) |
905,8(9,39) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 |
| Химические свойства | |
| Ковалентный радиус | 125 пм |
| Радиус иона | (+2e) 74 пм |
|
Электроотрицательность (по Полингу) |
1,65 |
| Электродный потенциал | -0,763 |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,133 г/см³ |
| Молярная теплоёмкость | 25,4[1]Дж/(K·моль) |
| Теплопроводность | 116 Вт/(м·K) |
| Температура плавления | 692,73 K |
| Теплота плавления | 7,28 кДж/моль |
| Температура кипения | 1180 K |
| Теплота испарения | 114,8 кДж/моль |
| Молярный объём | 9,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,665 c=4,947 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
| Zn | 30 |
| 65,39 | |
| [Ar]3d104s2 | |
| Цинк | |
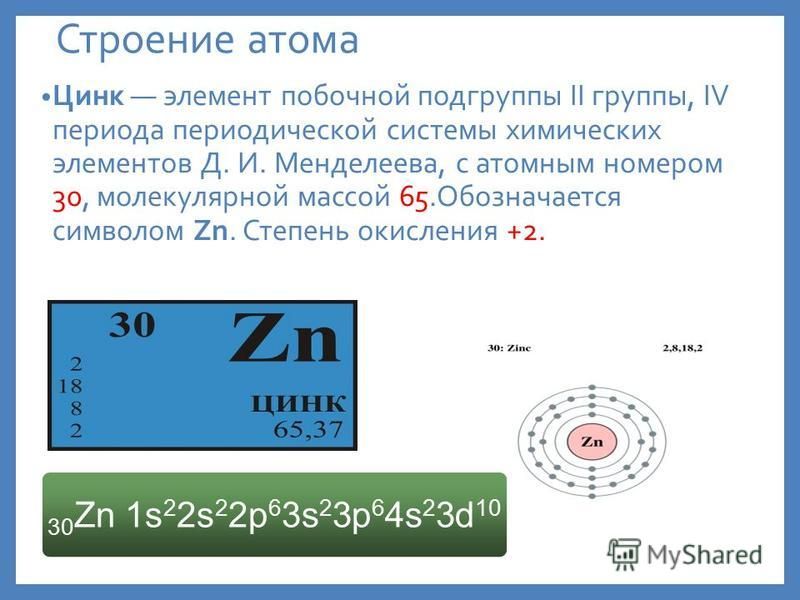
Цинк —элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История
Сплав цинка с медью — латунь — был известен еще в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Схема атома цинка
Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Получение
Цинк в природе как самородный метал не проявляется. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты.
Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты.
От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл.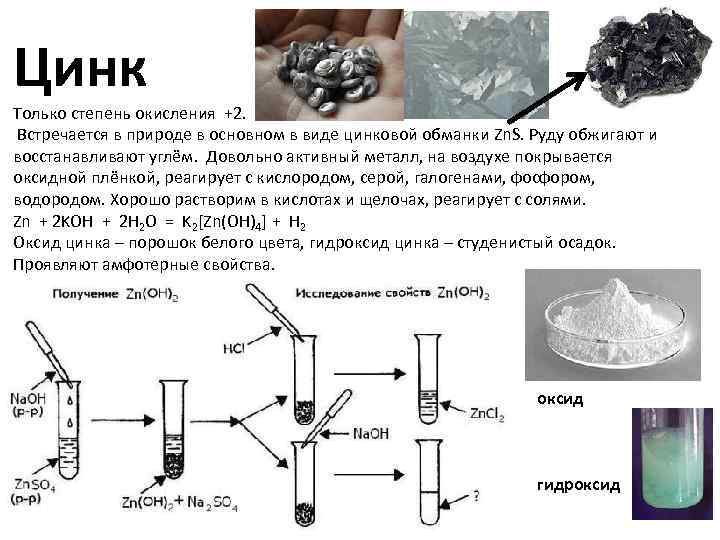 Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2↑,
Zn + H2SO4(разб. ) = ZnSO4 + H2↑
) = ZnSO4 + H2↑
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
- Цинкование — 45-60%
- В медицине (оксид цинка как антисептик) — 10%
- Производство сплавов — 10%
- Производство резиновых шин — 10%
- Масляные краски — 10%
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Также используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи, ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др). Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»):
| Список стран по производству цинка |
|---|
Биологическая роль
Цинк:
- необходим для продукции спермы и мужских гормонов.
- необходим для метаболизма витамина E, который является предшественником половых гормонов и включается в продукцию тестостерона.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 грамм устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек.
Содержание цинка:
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зеленые овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
- ~2—8 мг/кг — малина, черная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свекла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.
- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зеленый чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зерна пшеницы, тыквенные семечки, семечки подсолнечника.
Токсичность
Ионы Zn2+ токсичны.
Дополнительная информация
Категория:Соединения цинка
К какому семейству относится цинк?
Место, где весь мир собирается для
гальваники, анодирования и отделки. Вопросы и ответы с 1989 года.
——
2006
В. Я хочу знать, к какому семейству относится элемент цинка?
Brianna G [фамилия удалена редактором из соображений конфиденциальности]
— Ausza, California, USA
Любимая книга редактора на протяжении многих лет…
из Элементы
Книги Эйба
или
Доп. Ссылка
Ваши покупки делают отделку.com возможной
2006
Дорогая Брианна,
Вы абсолютно уверены, что точно знаете, что означает этот вопрос 🙂
Дав правильный ответ на вопрос, который вы не понимаете, ваши учителя и родители получат неверную информацию о том, где им нужно сосредоточить свои усилия. Пожалуйста, сообщите нам атомный номер цинка, и я буду рад ответить на ваш вопрос. В вашем учебнике по химии почти наверняка есть таблица Менделеева. Удачи.
Пожалуйста, сообщите нам атомный номер цинка, и я буду рад ответить на ваш вопрос. В вашем учебнике по химии почти наверняка есть таблица Менделеева. Удачи.
Тед Муни, ЧП
Стремление жить Алоха
finish.com — Пайн-Бич, Нью-Джерси
2007
Q. Насколько верно, вы можете мне его дать?
цинк — символ Zn; атомный номер 30; атомная масса 65,409; протоны 30; # нейтронов 35; # электронов 30; температура плавления = 787,15°С; температура кипения = 1665 °С; нормальная фаза = твердая; стоимость = 0,50 доллара за фунт; классификация = металл; и я знаю, что номер группы 12, и это переходный металл. Но есть ли официальное название его семейства? Спасибо. И да, я уверен, что знаю, что означает вся эта информация.
Джеймс К. [фамилия удалена редактором из соображений конфиденциальности]
— Оук-Айленд, Северная Каролина, США
Думаю, Джеймс, ты уже понял. Хотя «семейство» означает разные вещи в разных контекстах, я полагаю, что принято считать, что «семейство» в данном случае — это «переходные металлы», как вы сказали.
Хотя «семейство» означает разные вещи в разных контекстах, я полагаю, что принято считать, что «семейство» в данном случае — это «переходные металлы», как вы сказали.
Но некоторые старомодные люди вроде меня называют ее группой IIb, а не группой 12, и ее также называют «группой цинка», в которую также входят кадмий и ртуть. Хорошая работа.
Тед Муни, ЧП
Стремление жить Алоха
finish.com — Пайн-Бич, Нью-Джерси
2 ноября 2015 г.
В. В какой группе находится Zinc?
meghan G [фамилия удалена редактором из соображений конфиденциальности]
— Alibon Pennsylvania
Ноябрь 2015
Привет, Меган. Вы видели эту страницу и, по-видимому, вам не нравятся ответы, представленные до сих пор — переходные металлы, группа IIB, группа 12 или группа цинка 🙂
Итак, задайте вопрос с несколькими вариантами ответов, и держу пари, я смогу ответить на него правильно для вас.
С уважением,
Тед Муни, ЧП RET
Стремление жить Алоха
finish.com — Пайн-Бич, Нью-Джерси
«Продвинутая неорганическая химия»
от Bochmann, Wilkinson, Murillo, & Cotton
от Книги Эйба
или
Доп. Ссылка
Ваши покупки делают отделку.com возможной
12 ноября 2015 г.
В своей книге
<== «Продвинутая неорганическая химия» Коттон и Уилкинсон имеют отдельную главу под названием «Цинк, кадмий и ртуть».
Цинк — фальшивый переходный металл, ИМХО. В отличие от своего гораздо более интересного родственника, кадмия.
Дэйв Вичерн
Консультант — Бронкс, Нью-Йорк
adv.:
(Здесь нет «мертвых тем»! Если эта страница в настоящее время не находится на горячей линии, ваши вопросы, ответы или комментарии восстановят ее)
Вопрос, ответ или комментарий в ЭТОЙ теме -или- Начать НОВУЮ тему
Отказ от ответственности. С помощью этих страниц невозможно полностью диагностировать проблему отделки или опасность операции. Вся представленная информация предназначена для общего ознакомления и не является профессиональным мнением или политикой работодателя автора. Интернет в значительной степени анонимен и непроверен; некоторые имена могут быть вымышленными, а некоторые рекомендации могут быть вредными.
С помощью этих страниц невозможно полностью диагностировать проблему отделки или опасность операции. Вся представленная информация предназначена для общего ознакомления и не является профессиональным мнением или политикой работодателя автора. Интернет в значительной степени анонимен и непроверен; некоторые имена могут быть вымышленными, а некоторые рекомендации могут быть вредными.
Если вы ищете продукт или услугу, связанную с отделкой металлов, проверьте следующие каталоги:
О нас/Контакты — Политика конфиденциальности — — обзор современного понимания их биологической и патофизиологической роли
Обзор
. 2013 апрель-июнь;34(2-3):548-60.
doi: 10.1016/j.mam.2012.05.008.
Липин Хуан 1 , Сурапун Тепааморндеч
принадлежность
- 1 USDA/ARS/Western Human Nutrition Research Center and Department of Nutrition, Калифорнийский университет в Дэвисе, 430 West Health Sciences Drive, Davis, CA 95616, USA.
 [email protected]
[email protected]
- PMID: 23506888
- DOI: 10.1016/j.mam.2012.05.008
Обзор
Liping Huang et al. Мол Аспекты Мед. 2013 апрель-июнь.
. 2013 апрель-июнь;34(2-3):548-60.
doi: 10.1016/j.mam.2012.05.008.
Авторы
Липин Хуан 1 , Сурапун Тепааморндеч
принадлежность
- 1 USDA/ARS/Western Human Nutrition Research Center and Department of Nutrition, Калифорнийский университет в Дэвисе, 430 West Health Sciences Drive, Davis, CA 95616, USA.
 [email protected]
[email protected]
- PMID: 23506888
- DOI: 10.1016/j.mam.2012.05.008
Абстрактный
Два семейства переносчиков цинка (Zn(2+)) участвуют в гомеостазе цинка в организме: SLC30 (ZnT, переносчик цинка) и SLC39 (ZIP, цинк(Zn(2+))-железо(Fe(2+))). Пермеаз). Два члена семейства переносчиков цинка функционируют в противоположных направлениях для поддержания клеточного гомеостаза цинка. Белки ZnT вносят вклад в цитоплазматический баланс цинка, экспортируя цинк во внеклеточное пространство или секвестрируя цитоплазматический цинк во внутриклеточные компартменты, когда уровни клеточного цинка повышены. Напротив, белки ZIP функционируют для увеличения концентрации цитоплазматического цинка, когда клеточный цинк истощается. С момента клонирования первого переносчика цинка (ZnT1) в 1995, было достигнуто много успехов в исследованиях переносчиков цинка, включая открытие новых представителей переносчиков цинка, идентификацию паттернов и регуляций экспрессии генов, распознавание паттернов распределения белков в тканях и клетках и понимание их физиологических и патологических ролей у людей и животных. модели. К настоящему времени идентифицировано десять членов семейства ZnT. Здесь мы даем обзор этих достижений и обсуждаем патологические последствия и будущее профилактическое или терапевтическое применение ZnT.
С момента клонирования первого переносчика цинка (ZnT1) в 1995, было достигнуто много успехов в исследованиях переносчиков цинка, включая открытие новых представителей переносчиков цинка, идентификацию паттернов и регуляций экспрессии генов, распознавание паттернов распределения белков в тканях и клетках и понимание их физиологических и патологических ролей у людей и животных. модели. К настоящему времени идентифицировано десять членов семейства ZnT. Здесь мы даем обзор этих достижений и обсуждаем патологические последствия и будущее профилактическое или терапевтическое применение ZnT.
Опубликовано Elsevier Ltd.
Похожие статьи
Семейство транспортеров цинка SLC39.
Чон Дж., Эйде Д.Дж. Чон Дж. и др. Мол Аспекты Мед. 2013 апрель-июнь;34(2-3):612-9. doi: 10.1016/j.mam.2012.05.011. Мол Аспекты Мед.
 2013.
PMID: 23506894
Бесплатная статья ЧВК.
Обзор.
2013.
PMID: 23506894
Бесплатная статья ЧВК.
Обзор.Белки-транспортеры цинка.
Балтач А.К., Юце К. Baltaci AK, et al. Нейрохим Рез. 2018 март; 43(3):517-530. doi: 10.1007/s11064-017-2454-y. Epub 2017 14 декабря. Нейрохим Рез. 2018. PMID: 29243032 Обзор.
Транспортеры цинка млекопитающих.
Лиуцци Дж. П., Казинс Р. Дж. Лиуцци Дж. П. и соавт. Анну Рев Нутр. 2004; 24:151-72. doi: 10.1146/annurev.nutr.24.012003.132402. Анну Рев Нутр. 2004. PMID: 15189117 Обзор.
[Обзор и обновленная информация о физиологических функциях переносчиков цинка у млекопитающих].

Камбе Т. Камбе Т. Нихон Эйсейгаку Засси. 2013;68(2):92-102. дои: 10.1265/jjh.68.92. Нихон Эйсейгаку Засси. 2013. PMID: 23718971 Обзор. Японский язык.
In silico идентификация и экспрессия генов семейства SLC30: стратегия интеллектуального анализа данных экспрессированной последовательности тегов для характеристики экспрессии транспортеров цинка в тканях.
Сев М., Чимьенти Ф., Деверньяс С., Фавье А. Сев М. и др. Геномика BMC. 2004 23 мая; 5 (1): 32. дои: 10.1186/1471-2164-5-32. Геномика BMC. 2004. PMID: 15154973 Бесплатная статья ЧВК.
Посмотреть все похожие статьи
Цитируется
Воздействие наночастиц оксида металла пищевого качества изменяет микробные популяции кишечника, функциональность и морфологию мембраны щеточной каймы, in vivo ( Gallus gallus ).

Ченг Дж., Колба Н., Гарсия-Родригес А., Маркес К.Н.Х., Малер Г.Дж., Тако Э. Ченг Дж и др. Антиоксиданты (Базель). 2023 9 февраля; 12 (2): 431. doi: 10.3390/antiox12020431. Антиоксиданты (Базель). 2023. PMID: 36829990 Бесплатная статья ЧВК.
Существующие знания о биомаркерах статуса Zn (1963-2021) с особым акцентом на диагностические характеристики FADS1 и FADS2 и рекомендации для дальнейших исследований.
Кнез М., Бой Э. Кнез М. и др. Фронт Нутр. 2023 12 января; 9:1057156. doi: 10.3389/фнут.2022.1057156. Электронная коллекция 2022. Фронт Нутр. 2023. PMID: 36712514 Бесплатная статья ЧВК. Обзор.
Пищевая добавка, содержащая цинк, в период до зачатия и во время беременности повышает концентрацию цинка в грудном молоке.

Хан С.М., Деварадж С., Деррайк Дж.Г.Б., Викерс М.Х., Хуанг Ф., Дубаску С., Годфри К.М., Чан С.И., Панг В.В., Таккар С.К., Катфилд В.С.; Исследовательская группа NiPPeR. Хан С.М. и др. Фронт Нутр. 2023 10 января; 9:1034828. doi: 10.3389/фнут.2022.1034828. Электронная коллекция 2022. Фронт Нутр. 2023. PMID: 36704795 Бесплатная статья ЧВК.
Локализованные инфекции штаммами P. aeruginosa , дефектными по поглощению цинка, показывают, что эмбрионы рыбок данио повторяют пищевые иммунные реакции высших эукариот.
Секли В., Ди Бьяджо С., Мартини А., Микетти Э., Пачелло Ф., Аммендола С., Баттистони А. Секли В. и др. Int J Mol Sci. 2023 4 января; 24 (2): 944. doi: 10.3390/ijms24020944. Int J Mol Sci. 2023. PMID: 36674459 Бесплатная статья ЧВК.
Цинк в здоровье человека и инфекционных заболеваниях.



 Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы.
Эта тенденция к проявлению низких степеней окисления нехарактерна для непереходных элементов. 6s2-Электронная пара ртути близка по поведению к инертной электронной паре. Например, у висмута инертная электронная пара стабилизирует состояние в низшей степени окисления III и дестабилизирует состояние V. Внутренний заполненный слой из 18 электронов сохраняется у каждого элемента, так как эти электроны не участвуют в образовании химической связи. В этой подгруппе больше сходства между Zn и Cd, чем между Cd и Hg, тогда как у непереходных элементов, наоборот, первый член подгруппы отличается от других. Цинк и кадмий не так явно различаются, как медь и серебро. Между подгруппами IB и IIB имеется небольшое сходство, при этом элементы IIB-подгруппы более реакционноспособны. Первые члены действительно имеют существенно более высокие электродные потенциалы. Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода.
Перед переработкой сульфидную руду цинка (сфалерит или цинковую обманку) подвергают обогащению, после грубого измельчения примерно до размера гравия добавляют к гомогенному шламу (в больших танках), состоящему из ферросилиция FeSi (получают в обжиговых печах сталеплавильной промышленности). Плотность этого жидкообразного шлама достаточна для флотации кремнистого материала из более тяжелых сульфидных руд ZnS в присутствии примеси PbS. Дальнейшее обогащение руды достигается после пенной флотации. Сульфид цинка при обжиге превращают в ZnO и затем восстанавливают до металла коксом при температурах, достаточных для испарения цинка из зоны восстановления. Если в руде присутствовал кадмий, его отделяют благодаря его большей летучести. Чистый цинк получают электролизом аналогично процессу рафинирования меди. Ртуть может быть как в свободном состоянии, так и в связанном в виде киновари HgS. При обжиге на воздухе металл улетучивается из печи, так как при температурах обжига HgO неустойчив и разлагается на ртуть с выделением кислорода. Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха.
Сульфидная сера образует SO2. Очистку загрязненного материала проводят, отжимая через замшевый фильтр с последующей обработкой азотной кислотой и повторной перегонкой без доступа воздуха. Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре).
Кадмирование один из способов коррозионной защиты стальных поверхностей, однако это покрытие неустойчиво к кислотам. Кадмий используют в технологии низкоплавких сплавов, например, сплава Вуда (12,5% Cd), сплава Липовича (10% Cd). Кроме того, кадмий часто добавляют в подшипниковые сплавы. Все металлы подгруппы IIB находят широкое применение в технологии аккумуляторов и батарей. Например, цинк используют как оболочку в сухих батареях, где он выполняет двоякую функцию, контейнера и анода; кадмий используют как анод в никель-кадмиевых элементах типа щелочного аккумулятора Эдисона, в котором ставят кадмиевый анод вместо железного; оксид ртути(II) применяют в ртутных элементах; в стандартном элементе Вестона анод состоит из амальгамы Cd-Hg, а электролит из раствора CdSO4, такой элемент отличается стабильным и хорошо сохраняющимся напряжением. Ртуть единственный из металлов, который является жидкостью при обычной температуре (кроме ртути только галлий и цезий имеют очень низкие (около 29° С) температуры плавления, но они твердые при комнатной температуре).


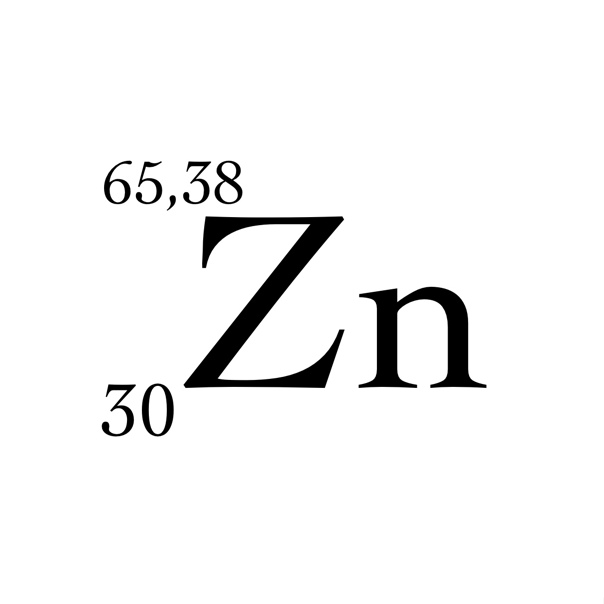 Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема), в отличие от хлорида ртути(I) Hg2Cl2, растворим в воде. HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2
Ртуть образует галогениды ртути(I) и ртути(II). Хлорид ртути(II) (сулема), в отличие от хлорида ртути(I) Hg2Cl2, растворим в воде. HgCl2 получают по реакции обмена HgSO4 + 2NaCl -> HgCl2 + Na2SO4 Из раствора его выделяют сублимацией. Сулема высокотоксичное вещество. Хлорид ртути(I) (каломель) нерастворим в воде, неядовит и находит ограниченное применение в медицине как слабительное. Водному слою над осадком каломель придает красивый шелковистый оттенок. Ион ртути(I) Hg22+, или [[Hg:Hg]]2+, имеет необычный для ионов металлов состав, но он существует, что подтверждено результатами химических, электрохимических и спектральных исследований. Ртуть металлическая и HgCl2 находятся в равновесии с Hg2Cl2: Hg0 + HgCl2 = Hg2Cl2 Галогениды металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов при реакциях растворимых галогенидов или псевдогалогенидов, например:
Галогениды металлов подгруппы IIB проявляют тенденцию к образованию галогено- и псевдогалогенокомплексов при реакциях растворимых галогенидов или псевдогалогенидов, например: Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4
Среди других реакций для обнаружения аммиака в воде используется реактив Несслера щелочной раствор K2[[HgI4]]. При его взаимодействии с Nh4 и солями аммония образуется красно-коричневый осадок: 2[[HgI4]]2+ Nh4 + 3OH -> [[OHg2Nh3]]I + 7I+ 2h3O Образование этого осадка возможно уже при ничтожных количествах аммиака в растворе. Таким способом можно обнаруживать начало разложения (гниения) продуктов животного или растительного происхождения. Известны и другие соединения ртути с азотом, например, аммиачные комплексы типа иона тетраамминртути(II) [[Hg(Nh4)4]]2+, получаемого из аммиака и соли ионного типа: Hg(ClO4)2 + 4Nh4 [[Hg(Nh4)4]]2+ + 2ClO4 Термическая устойчивость гидридов убывает в ряду Znh3 > Cdh3 > Hgh3, причем Hgh3 начинает разлагаться при 125° С.
Термическая устойчивость гидридов убывает в ряду Znh3 > Cdh3 > Hgh3, причем Hgh3 начинает разлагаться при 125° С. Координационное число цинка преимущественно равно 4, но может достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической структурой приведено ниже: Zn2+ + 6Nh4 = [[Zn(Nh4)6]]2+ Zn2+ + 3Nh3Ch3Ch3Nh3 = [[Zn(en)3]]2+
Координационное число цинка преимущественно равно 4, но может достигать и 6. Получение двух 6-координационных комплексных ионов с октаэдрической структурой приведено ниже: Zn2+ + 6Nh4 = [[Zn(Nh4)6]]2+ Zn2+ + 3Nh3Ch3Ch3Nh3 = [[Zn(en)3]]2+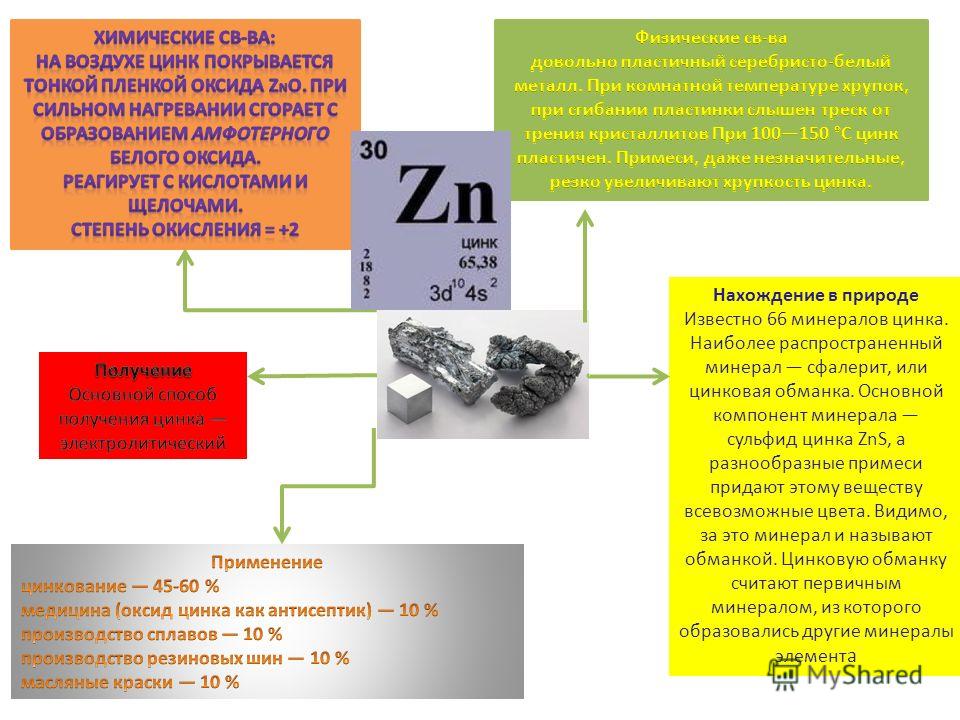

 2013.
PMID: 23506894
Бесплатная статья ЧВК.
Обзор.
2013.
PMID: 23506894
Бесплатная статья ЧВК.
Обзор.