Почему слабеет иммунитет? / Статьи специалистов / Семейная клиника «Танар»
Мы не раз слышали о том, что крепкий иммунитет защитит нас от вирусов и простуд, поможет в борьбе с серьезными заболеваниями. Почему у одних людей он сильный, а у других слабый? Можно ли «контролировать» иммунитет? Об этом наш разговор с врачом аллергологом-иммунологом, педиатром Семейной клиники «ТАНАР», кандидатом медицинских наук — Ириной Соловьевой.
— Ирина Николаевна, мы часто привыкли винить плохой иммунитет во всех своих болезнях, но так ли это? Все заболевания происходят от неполадок с иммунитетом?
— При многих заболеваниях, особенно инфекционных, вовлекается в процесс иммунная система. Иммунная система – это совокупность клеток и органов в организме человека, обеспечивающая нам непосредственную защиту от чужеродных веществ. Если человек заболел — это не значит, что иммунитет ослаб. Сама болезнь – это и есть борьба организма, иммунная система не дает вирусам и бактериям жить в клетках и тканях человека.
— С хорошим иммунитетом рождаются или его «нарабатывают» каким-то способами?
— Иммунитет бывает естественным врожденный (наследуется ребенком от матери) и приобретенным (появляется после инфекции). Кроме того есть искусственный иммунитет — активный (появляется после прививки) и пассивный появляется после лечебной сывороротки (это когда вводят готовые антитела человеку у которого был контакт, например, укусила лиса или собака и вводят сыворотку от бешенства). Если беременной женщине поставить прививку от гриппа, то тогда у ребенка с 13-й недели внутирутробного развития образуются антитела, защищающие его от этого штамма вируса до трех лет.
Кроме того есть искусственный иммунитет — активный (появляется после прививки) и пассивный появляется после лечебной сывороротки (это когда вводят готовые антитела человеку у которого был контакт, например, укусила лиса или собака и вводят сыворотку от бешенства). Если беременной женщине поставить прививку от гриппа, то тогда у ребенка с 13-й недели внутирутробного развития образуются антитела, защищающие его от этого штамма вируса до трех лет.
— Выражение «ослаб иммунитет» довольно расхожее. Объясните его, пожалуйста, с медицинской точки зрения.
— Мы привыкли говорить об ослабленном иммунитете, когда люди начинают часто болеть. Но простое ОРЗ или же ОРВИ не означает, что иммунитет ослаб. Если человек болеет три-четыре раза в год, особенно в крупнопромышленном городе, — это нормальное явление. Другое дело, если инфекция усугубляется, человек начинает болеть часто, длительно, инфекция спускается глубже, возникают часто тонзилиты, отиты, стоматиты, бронхиты или пневмонии.
— Почему снижается иммунитет?
— Человек может же родиться с врожденным дефектом иммунной системы -это когда отсутствует ряд клеток иммунной системы или они не вырабатывают определенные вещества. И первый маркер – это реакция на прививку: возникают осложнения на вакцинацию, то чего так боятся родители и от чего идут отказы. На самом деле вакцина позволяет вовремя диагностировать врожденный иммунодефицит. На вакцину у здорового человека болезнь не развивается. Вторичные иммунодефициты возникают в процессе жизни. К снижению иммунитета может привести острый и хронический стресс, ионизирующая радиация, оперативное лечение, химиотерапия при лечении онкологических больных.
— Как можно узнать, в каком состоянии находится иммунная система?
— Для начала можно просто собрать анамнез (расспрос больного: как часто и какими заболеваниями болеет человек).
Если есть подозрение на иммунодефицит, проводится иммунологическоре обследование
— А в каких случаях врач просит сделать иммунограмму? Стоит ли проводить это исследование крови в профилактических целях?
— Иммунограмма – исследование, при помощи которого удается установить наличие или отсутствие иммунодефицита. Это дорогостоящий анализ, но если есть настораживающие симптомы, то стоит его сделать
— Как повысить иммунитет в сезон простуд?
— Иммунитет целесообразно не повышать, а укреплять. Для этого стоит вести здоровый образ жизни. Соблюдать режим сна и отдыха, правильно питаться и заниматься физкультурой. Стрессы, перенапряжения, низкая двигательная активность могут стать одной из причин заболеваний. Белковая пища — один из источников поддержания иммунитета. В рационе человека обязательно должны присутствовать каша, мясо, творог, молоко, рыба. Пищу целесообразно витаминизировать: добавлять имбирь, лимон, шиповник, приправы корицу, кукурму, гвоздику, если нет противопоказаний. Воспалительные заболевания органов пищеварения, приводят к нарушению всасывания витаминов и микроэлементов даже при достаточном их потреблении, поэтому в феврале и проводится противорецидивное лечение желудочно-кишечного тракта. Эффективен самомассаж биологически активных точек. Гимнастика для горла. А вот закаливающие процедуры, если ранее не начали закаливаться, в эпидемический сезон начинать не стоит. Важно проветривать помещения и дезинфицировать с помощью ультрафиолетовых облучателей, дезаров, озонаторов, солевых ламп. Если нет аллергии, можно использовать аромотерапию. Перед выходом на улицу или в общественное место наиболее эффективны маски-фильтры, которые фиксируют вирусы и бактерии или барьерные спреи.
Стрессы, перенапряжения, низкая двигательная активность могут стать одной из причин заболеваний. Белковая пища — один из источников поддержания иммунитета. В рационе человека обязательно должны присутствовать каша, мясо, творог, молоко, рыба. Пищу целесообразно витаминизировать: добавлять имбирь, лимон, шиповник, приправы корицу, кукурму, гвоздику, если нет противопоказаний. Воспалительные заболевания органов пищеварения, приводят к нарушению всасывания витаминов и микроэлементов даже при достаточном их потреблении, поэтому в феврале и проводится противорецидивное лечение желудочно-кишечного тракта. Эффективен самомассаж биологически активных точек. Гимнастика для горла. А вот закаливающие процедуры, если ранее не начали закаливаться, в эпидемический сезон начинать не стоит. Важно проветривать помещения и дезинфицировать с помощью ультрафиолетовых облучателей, дезаров, озонаторов, солевых ламп. Если нет аллергии, можно использовать аромотерапию. Перед выходом на улицу или в общественное место наиболее эффективны маски-фильтры, которые фиксируют вирусы и бактерии или барьерные спреи.
Беседовала Арина Лаврова
Нет, иммунитет весной не слабеет. Какие представления о нем на самом деле мифы?
Иммунитет — сложная система молекул, клеток, тканей и органов, которую чаще всего сравнивают с войском или стражей. Это «министерство внутренних дел» отслеживает в нашем теле чужаков, чтобы их уничтожить или просто выдворить. Но это не единственная функция. «Иммунитет — это еще и толерантность к собственным тканям, микро- и макроорганизмам внутри человека», — объясняет заведующий кафедрой клинической иммунологии и аллергологии Сеченовского университета Александр Караулов.
На эту тему
Иммунная система вводит в организме пропускной режим, но и свои, и чужие иногда получают разрешение, а иногда попадают в черный список. Раковые и мертвые клетки — свои, но с ними иммунная система борется. Кишечные бактерии, которые помогают переварить пищу, пришли извне, но пока они ведут себя хорошо, их не трогают. Как это происходит и к каким последствиям приводит, медики и ученые понимают не до конца. К примеру, есть предположения, что иммунная система как-то связана с психическими расстройствами и способна повлиять на черты личности. Но многое в иммунных процессах все-таки ясно.
Иммунитет нельзя «укрепить»
Когда говорят об укреплении иммунитета, трудно понять, что же имеется в виду. Некоторые составляющие иммунной системы воздействуют на организм противоположным образом. Например, одни молекулы усиливают воспаление, а другие, наоборот, его ослабляют. Если воспаление протекает медленно, то вредные вирусы и микроорганизмы могут чересчур навредить человеку.
Иммунная система подобна музыкальному инструменту, который изначально правильно настроен. «Если мы ничем не болеем, наш иммунитет работает хорошо — нет нужды его «укреплять». Лучшее — враг хорошего, вмешиваться в такой тонкий механизм может быть опасно», — объясняет старший научный сотрудник ФГБНУ «Институт экспериментальной медицины» и автор недавно вышедшей книги «Как устроен иммунитет» Екатерина Умнякова.
Большинство распространенных иммуномодуляторов не работает
На иммунитет тем не менее можно повлиять. Вещества, способные это сделать, называются иммуномодуляторами. Некоторые из них продаются как лекарства в аптеках, но не стоит торопиться с покупкой. «Большинство из них бесполезные, особенно если мы говорим о гомеопатических препаратах, а также о лекарствах, эффективность которых не была доказана в двойных слепых плацебо-контролируемых клинических испытаниях на приличной выборке», — говорит Екатерина Умнякова.
Двойное слепое плацебо-контролируемое тестирование считается наилучшим способом проверить эффективность вещества. Участников произвольно (тогда эксперимент называется рандомизированным) делят на две группы — одним дают препарат, а другим пустышку (плацебо). Иногда групп больше, чтобы сравнить несколько лекарств. Ни врачи, ни пациенты не знают, кому что досталось (поэтому тестирование дважды слепое).
Продолжение
Но большинству людей не нужны иммуномодуляторы, даже если они уже простудились или заболели чем-то еще. По словам Екатерины Умняковой, для поддержания иммунной системы в порядке нужно просто правильно питаться, чтобы в организм поступало достаточно белков, жиров, углеводов, минералов и витаминов. При этом врачи советуют не принимать добавки с витаминами и минералами для профилактики — только если недостаток этих веществ выявлен анализами.
Вероятно, тренировки не ослабляют иммунитет
Считается, что после тяжелых тренировок просто заболеть. По словам Александра Караулова, первые исследования на эту тему показали, что во время занятий спортом количество иммунных клеток увеличивается до десяти раз, но вскоре после этого их уровень, наоборот, опускается ниже обычного. Результаты интерпретировали как подавление иммунитета. Но клетки не исчезают без следа и не разрушаются.
Недавнее исследование показало, что иммунные клетки из крови отправляются в легкие и другие органы, через которые могут попасть патогены. Его авторы считают, что после тренировки сопротивляемость организма только усиливается, во всяком случае если говорить о вирусах гриппа. Но занятия спортом все же отнимают силы. «Нужно питание, богатое витаминами, макро- и микроэлементами, очень важна антиоксидантная терапия, потому что тренировки неизбежно вызывают окислительный стресс», — объясняет Александр Караулов.
Кесарево сечение нарушает формирование иммунитета
Иммунная система, которую долго рассматривали только как защиту от чужаков, без некоторых «пришельцев» часто дает сбои. Когда ребенок проходит по родовому каналу, бактерии матери колонизируют малыша и настраивают его иммунную систему. Дети, появившиеся на свет с помощью кесарева сечения, этого лишены. «К сожалению, они чаще страдают хроническими заболеваниями с вовлечением иммунитета», — говорит Александр Караулов.
На эту тему
«Но это не всегда критично и не всегда это нельзя компенсировать. Иногда бывают показаны и кесарево сечение, и искусственное вскармливание», — уточняет Екатерина Умнякова. Искусственное вскармливание тоже может нарушить правильное формирование иммунитета, потому что в материнском молоке содержатся нужные вещества не только для ребенка, но и для полезных бактерий, живущих вместе с ним. Поэтому детям дают специальные формулы, приближенные по составу к грудному молоку.
«Самое главное — это не паниковать: лучше это ребенку не сделает. Надо просто собраться и сделать все возможное, чтобы соблюдалось как можно больше естественных условий», — считает Екатерина Умнякова.
Что еще нужно знать про иммунитет
Весной иммунитет не слабеет, а болеют люди обычно по другим причинам. «С приходом тепла активнее размножаются всякие вирусы и бактерии — это да; витаминов и правда может быть меньше, чем летом; смена времен года может вызвать небольшой стресс, особенно когда люди не угадывают с одеждой, но в целом ничего не ослабляется», — рассуждает Екатерина Умнякова.
Во время вспышек гриппа от масок на лице мало пользы. «Вирусные частицы во много раз меньше пор ткани, из которой сделана маска. Она создает препятствие, если вдыхаемые или выдыхаемые частицы довольно крупные, а если мелкие, то защита значительно снижается. Носить маску рекомендуют не дольше двух часов, потом ее надо менять», — объясняет Екатерина Умнякова. Также следует помнить, что некоторые штаммы гриппа могут проникнуть в организм через слизистую глаз, которую маска не закрывает, — достаточно потереть их рукой. Александр Караулов напоминает, что руки надо тщательно мыть. А во время эпидемий по возможности лучше избегать людей.
- Недетская инфекция: как предотвратить заражение корью и что делать, если уже заболел
- Что такое коллективный иммунитет? Надо ли прививаться взрослым? Вопросы о вакцинации
Польза от вакцинации намного перевешивает риски. «Противники прививок обычно не хотят «вредить» организму излишней, на их взгляд, нагрузкой и провоцировать аллергию или другие побочные эффекты.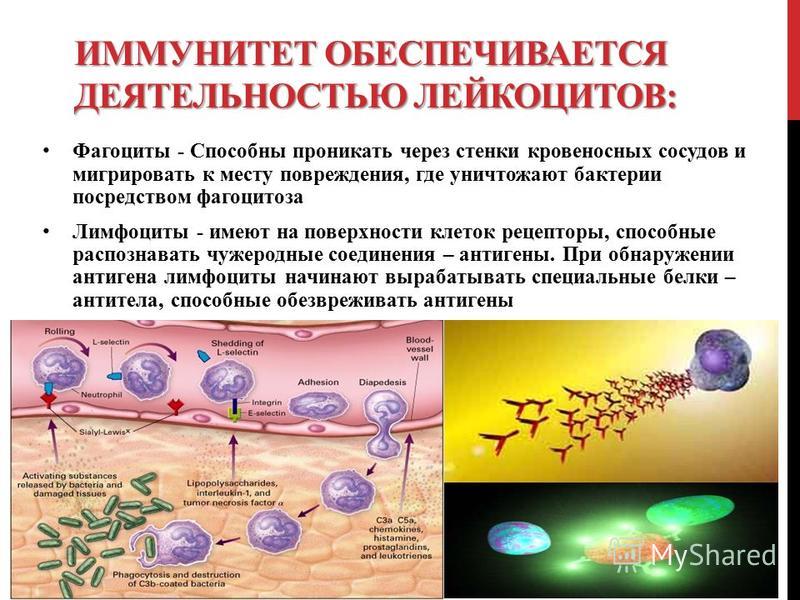 Ведь есть вероятность, что ни они, ни их дети никогда не встретятся с возбудителями серьезных инфекционных заболеваний. Но, как правило, они забывают о том, что сами заболевания, от которых проводится вакцинация, гораздо более опасны, чем побочные действия», — говорит Екатерина Умнякова. Александр Караулов напоминает, что вирус кори иногда приводит к тяжелым осложнениям спустя годы после перенесенной болезни и дети от них умирают.
Ведь есть вероятность, что ни они, ни их дети никогда не встретятся с возбудителями серьезных инфекционных заболеваний. Но, как правило, они забывают о том, что сами заболевания, от которых проводится вакцинация, гораздо более опасны, чем побочные действия», — говорит Екатерина Умнякова. Александр Караулов напоминает, что вирус кори иногда приводит к тяжелым осложнениям спустя годы после перенесенной болезни и дети от них умирают.
Не стоит переоценивать закаливание. «Закаливание, если проводится грамотно, может повысить устойчивость организма, например, на холоде. Но все же действие на иммунитет оказывается опосредованно, а в разных условиях организм может отреагировать по-разному», — говорит Екатерина Умнякова. Правда, холодный душ и похожие процедуры могут принести другую пользу. По словам Александра Караулова, закаливание снижает тревогу, улучшает настроение, а иммунитет зависит и от состояния психики.
Из-за лекарств иммунная система не «разучивается» работать самостоятельно. Есть мнение, что если принимать слишком много лекарств, то со временем иммунная система не сможет справляться без них. Препараты, подавляющие иммунитет, действительно существуют. Подчас это их основное назначение: без них, например, была бы невозможна пересадка органов, которые отторгались бы как чужаки. Но если врач назначил лекарства, нужно следовать его предписанию. «От лекарств иммунитет не разучится делать то, что было создано миллионами лет эволюции», — считает Екатерина Умнякова.
Есть мнение, что если принимать слишком много лекарств, то со временем иммунная система не сможет справляться без них. Препараты, подавляющие иммунитет, действительно существуют. Подчас это их основное назначение: без них, например, была бы невозможна пересадка органов, которые отторгались бы как чужаки. Но если врач назначил лекарства, нужно следовать его предписанию. «От лекарств иммунитет не разучится делать то, что было создано миллионами лет эволюции», — считает Екатерина Умнякова.
Марат Кузаев при участии Веры Клюевой
«Снижение иммунитета длится полтора-два месяца после COVID-19» | Статьи
В разных регионах страны число переболевших COVID-19 варьируется от 21% до 60%, если судить по наличию антител у пациентов. Причем крупнейшие мегаполисы с самой высокой среднесуточной заболеваемостью — Москва и Санкт-Петербург — отнюдь не в лидерах, а в середнячках, рассказал «Известиям» ученый-иммунолог, академик РАН, директор НИИ эпидемиологии и микробиологии имени Пастера Роспотребнадзора Арег Тотолян. Кроме того, в ходе исследования специалисты обнаружили маркеры снижения общего иммунитета у переболевших COVID-19, сообщил он. По словам иммунолога, такое состояние длится два месяца. Также ученый рассказал о том, что опаснее: сначала привиться, а потом заразиться, или наоборот.
Кроме того, в ходе исследования специалисты обнаружили маркеры снижения общего иммунитета у переболевших COVID-19, сообщил он. По словам иммунолога, такое состояние длится два месяца. Также ученый рассказал о том, что опаснее: сначала привиться, а потом заразиться, или наоборот.
— Арег Артемович, началась массовая вакцинация. Она проходит на пике пандемии, и остается высоким риск встретить инфекцию во время формирования иммунитета. Что безопаснее: допустим, если вирус уже попал в организм, но, не зная об этом, человек сделает прививку, либо если заражение произойдет после первой или второй инъекции, когда иммунитет к SARS—CoV-2 еще формируется?
— Вопрос правильный и справедливый. Если контакт с вирусом был, но никакой клинической картины при этом нет, то есть вирус не размножается в дыхательных путях, этой ситуации опасаться не нужно. В этом случае вакцина нанести вред не может.
Другая ситуация, если есть определенная клиническая картина: признаки ОРЗ, температура даже на уровне субфебрильных значений (37,1–38 градусов. — «Известия»), есть более специфичная симптоматика — потеря обоняния, надо воздержаться от вакцинации, перенести ее на более поздний период. При потере обоняния надо повременить с прививкой даже при отсутствии других признаков заболевания. Я бы рекомендовал всем помнить, что разрешение или «допуск» на вакцинацию должен давать врач, специалист по вакцинопрофилактике. Так что в любом случае самостоятельно решения приниматься не должны.
Фото: ИЗВЕСТИЯ/Павел Волков
— Всё как с вакциной против гриппа?
— Конечно! На фоне активной инфекции любая вакцинация противопоказана. Мы же имеем дело не с лечебными вакцинами, а с профилактическими.
На сегодня у нас две вакцины допущены до массового применения. Они не изучались в качестве терапевтических препаратов. Исследования, которые проводились для регистрации, и пострегистрационные исследования были посвящены именно профилактическому действию вакцины, а не лечебному.
— А если контакт с инфекцией произошел после вакцинации, но до того, как сформировался иммунитет?
— Да, может быть такая ситуация, что уже после вакцинации человек попал под высокую вирусную нагрузку, от этого никто не застрахован. Страшнее вакцинироваться, если человек уже болен. Но давайте разделим: на что мы можем повлиять, а на что мы повлиять не можем. Отсрочить вакцинацию при признаках заболевания мы можем.
Нужно помнить, что сразу иммунитет не развивается, сам факт инъекции еще не дает защиты. В случае введения вакцин «Спутник-V» и «ЭпиВакКорона» предусмотрено две инъекции с интервалом в три недели. Общий срок наблюдения — 42 дня (шесть недель, или полтора месяца), в течение этого времени необходимо продолжать соблюдать все меры социального дистанцирования, использовать средства индивидуальной защиты. В противном случае надо садиться на самоизоляцию, но, я думаю, вряд ли кто-то пойдет по такому сценарию.
Фото: ИЗВЕСТИЯ/Павел Волков
Если иммунная система человека нормально ответила на вакцинацию, уровень антител стал достаточно высоким, то тогда можно себя чувствовать защищенным.
— Некоторые пытаются просто пересидеть пандемию. В каких случаях эта стратегия верна?
— Для суперпожилых людей под 90 или 90+. У нас страна большая, есть и люди в возрасте 130 лет, у большинства из которых есть хронические заболевания, и это является относительным противопоказанием для прививки. Некоторые заболевания относятся к абсолютным противопоказаниям к вакцинации — первичные иммунодефициты. У таких больных выключены из функционирования целые звенья иммунной системы. Им стоит дождаться ситуации, когда сформируется коллективный иммунитет, это вполне корректная тактика. Людей в возрасте от 18 до 70–75 лет я бы призвал не идти по пути жесткой самоизоляции.
Лучшая защита— Что лучше защищает — антитела, образовавшиеся в случае перенесенного заболевания или в результате вакцинации? Они одинаковые?
— Разные. Применительно к большинству вакциноуправляемых инфекций действует правило: иммунитет, который вырабатывается естественным путем, более стойкий, он сохраняется более длительный период, нежели поствакцинальный иммунитет. Я не распространял бы это правило на сегодняшнюю актуальную инфекцию. Во-первых, мы видим, что после перенесенной коронавирусной инфекции не у всех вырабатываются нейтрализующие антитела. У некоторых появляются антитела, но не той специфичности, которая позволяет защититься от повторного инфицирования.
Я не распространял бы это правило на сегодняшнюю актуальную инфекцию. Во-первых, мы видим, что после перенесенной коронавирусной инфекции не у всех вырабатываются нейтрализующие антитела. У некоторых появляются антитела, но не той специфичности, которая позволяет защититься от повторного инфицирования.
Фото: Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора
Во-вторых, обе вакцины — и «Спутник-V», и «ЭпиВакКорона» — нацелены на взаимодействие с S-белком. «Спутник-V» направлен на тот участок, который отвечает за нейтрализующую активность антител, а в «ЭпиВакКороне» используются пептиды, которые являются фрагментами S-белка. Поэтому в случае вакцинации обеими российскими вакцинами больше шансов получить антитела, которые будут защищать, нежели в случае пассивно перенесенной инфекции, если речь идет о легких и бессимптомных формах заболевания. В случае же инфекции средней тяжести и уровень антител, и качество антител значительно выше.
— На что в организме коронавирус «нападает» прежде всего?
— Прежде всего он выводит из строя эпителиальные клетки носоглотки. Они первыми сталкиваются с вирусом, и происходит блокировка системы интерферонов внутри клеток. Они становятся неполноценными из-за размножения в них вируса. Это важно, потому что качество гуморального иммунного ответа зависит в том числе и от функциональной полноценности эпителиальных клеток. Повреждение эпителиальных клеток — это одна из причин неполноценного иммунного ответа организма на воздействие вируса SARS-CoV-2.
Фото: Depositphotos
— Торможение вирусом иммунного ответа — это отличительная черта SARS-CoV-2? Другие вирусы на такое не способны?
— Да, это специфика новой коронавирусной инфекции.
Биомаркеры— Как быстро у переболевших восстанавливается нормальный иммунный ответ на инфекцию?
— Мы проводим иммунологическое обследование и больных, и переболевших, которые относятся к категории реконволюсцентов (находятся в таком периоде выздоровления, когда явные признаки заболевания окончились, но еще нет полного восстановления прежнего состояния организма. — «Известия») на разных сроках, и уже есть первые результаты. Мы обнаружили биомаркеры некоторой иммунологической недостаточности, иммунной депрессии. Такое снижение иммунитета длится полтора-два месяца после перенесенного COVID-19 и носит обратимый характер. Клинически это проявляется как синдром астенизации. Люди страдают от повышенной утомляемости, сонливости, человек хуже справляется с нагрузками, страдают когнитивные функции. Мы исследовали иммунологические последствия перенесенного COVID-19 и выявили иммунологические маркеры этих последствий. Подробнее пока рассказывать не могу. Эти данные сейчас готовятся к публикации в научной печати.
— «Известия») на разных сроках, и уже есть первые результаты. Мы обнаружили биомаркеры некоторой иммунологической недостаточности, иммунной депрессии. Такое снижение иммунитета длится полтора-два месяца после перенесенного COVID-19 и носит обратимый характер. Клинически это проявляется как синдром астенизации. Люди страдают от повышенной утомляемости, сонливости, человек хуже справляется с нагрузками, страдают когнитивные функции. Мы исследовали иммунологические последствия перенесенного COVID-19 и выявили иммунологические маркеры этих последствий. Подробнее пока рассказывать не могу. Эти данные сейчас готовятся к публикации в научной печати.
— Это ваша самая интересная находка в процессе исследования новой коронавирусной инфекции?
— На данный момент да. Подробнее смогу рассказать чуть позже, когда работа будет завершена. Но, пожалуй, самая интересная и самая труднореализуемая задача — другая. Мы хотим найти биомаркеры у тех, кто не болеет, даже работая в красных зонах.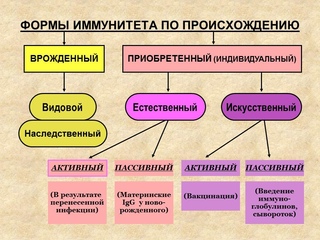 Требуется длительный процесс наблюдения, и мы его ведем.
Требуется длительный процесс наблюдения, и мы его ведем.
Фото: ИЗВЕСТИЯ/Павел Бедняков
— Недавно вышла статья, авторы которой говорят о том, что у переболевших вирус может прятаться в экзосомах. Вы можете объяснить, как это происходит и не означает ли это, что COVID-19 нужно считать хроническим заболеванием?
— Когда вирус разрушает эпителиальные клетки, они не исчезают бесследно. От них остаются микровезикулы, и вирус там может сохраняться. Экспериментальные данные позволяют говорить о правомочности такой модели. Но это предположение требует доказательств на клиническом материале, необходимо провести обследование больных и переболевших. Пока таких данных в научной литературе я не видел.
Когда мы говорим о хронизации инфекции, это означает, что вирус остался в организме человека, он постоянно там существует в каких-то органах и клетках, размножается и элиминировать (полностью изгнать. — «Известия») его из организма невозможно. Так происходит с вирусным гепатитом В, с ВИЧ, который живет в лимфоцитах. Пока нет данных о том, что SARS-CoV-2 живет постоянно в каких-то органах или клетках. Пока это не будет доказано, считать COVID-19 хронической болезнью нельзя, хотя в некоторых случаях COVID-19 носит характер затяжной инфекции. Например, у иммунокомпрометированных больных, у онкологических пациентов, которые находятся на длительной или постоянной иммуносупрессии.
Так происходит с вирусным гепатитом В, с ВИЧ, который живет в лимфоцитах. Пока нет данных о том, что SARS-CoV-2 живет постоянно в каких-то органах или клетках. Пока это не будет доказано, считать COVID-19 хронической болезнью нельзя, хотя в некоторых случаях COVID-19 носит характер затяжной инфекции. Например, у иммунокомпрометированных больных, у онкологических пациентов, которые находятся на длительной или постоянной иммуносупрессии.
— Уже больше полугода ученые НИИ имени Пастера проводят исследование популяционного иммунитета, причем в динамике. Охвачено 75 тыс. человек в 26 регионах страны, которые сдают тесты на антитела к SARS-CoV-2. Расскажите, пожалуйста, как меняется картина, каковы последние данные?
Фото: РИА Новости/РФПИ и Центр имени Гамалеи
— Это большая программа Роспотребнадзора, в которой принимают участие восемь научно-исследовательских институтов и 20 территориальных управлений и центров гигиены Роспотребнадзора. В общей сложности проведено более 167 тыс. исследований. Уже реализовано три этапа программы, последний — в декабре. Первый этап начался в июне и продолжался до середины августа. Мы получили очень разнообразную картину в целом по стране: в разных регионах сероположительных лиц (имеющих антитела к SASRS-CoV-2. — «Известия») было от 4% до 51%. Это объясняется тем, что различные регионы в разное время входили в эпидемию. Для второго этапа исследований мы выбрали начало учебного года — сентябрь-октябрь, обследовали тех же волонтеров. Когорта ожидаемо сузилась с 75 тыс. до 50 тыс. человек, а по итогам мы большой динамики не увидели: диапазон немного сократился от 5,5% до тех же самых 51%. Зато увидели, что наибольшую долю сероположительных лиц составили дети дошкольного и младшего школьного возраста. Они имеют антитела.
В общей сложности проведено более 167 тыс. исследований. Уже реализовано три этапа программы, последний — в декабре. Первый этап начался в июне и продолжался до середины августа. Мы получили очень разнообразную картину в целом по стране: в разных регионах сероположительных лиц (имеющих антитела к SASRS-CoV-2. — «Известия») было от 4% до 51%. Это объясняется тем, что различные регионы в разное время входили в эпидемию. Для второго этапа исследований мы выбрали начало учебного года — сентябрь-октябрь, обследовали тех же волонтеров. Когорта ожидаемо сузилась с 75 тыс. до 50 тыс. человек, а по итогам мы большой динамики не увидели: диапазон немного сократился от 5,5% до тех же самых 51%. Зато увидели, что наибольшую долю сероположительных лиц составили дети дошкольного и младшего школьного возраста. Они имеют антитела.
— Для детей варианта вакцинации пока нет, но получается, что именно эта возрастная группа оказалась наиболее иммунизирована?
— Да. Вакцины для детей действительно нет, но, к счастью, она для них и не столь актуальна, как для взрослых и пожилых. Дети в большинстве случаев переносят инфекцию или бессимптомно, или в легкой форме. И действительно дети иммунизируются быстрее остальных групп населения. Даже при минимальных клинических проявлениях или их полном отсутствии антитела у детей вырабатываются и защита появляется. В ходе исследования мы это отчетливо увидели.
Дети в большинстве случаев переносят инфекцию или бессимптомно, или в легкой форме. И действительно дети иммунизируются быстрее остальных групп населения. Даже при минимальных клинических проявлениях или их полном отсутствии антитела у детей вырабатываются и защита появляется. В ходе исследования мы это отчетливо увидели.
Фото: ИЗВЕСТИЯ/Павел Волков
— Третий этап завершен?
— Да, он проходил в декабре, данные обработаны и в основном проанализированы. Здесь мы уже увидели значительную динамику: происходит постепенное выравнивание ситуации по разным регионам. Диапазон лиц, имеющих антитела, составляет от 21% до 60%.
— Москва и Петербург в лидерах?
— Нет. Москва и Петербург в середняках.
— Ведь именно в двух самых крупных мегаполисах страны среднесуточный прирост заболевших самый большой. Как это можно объяснить?
— Система формирования популяционного иммунитета очень многофакторная, и прямой зависимости между фиксируемым уровнем заболеваемости и уровнем коллективного иммунитета мы не видим. Однако окончательного ответа на вопрос, почему так, у нас еще нет.
Однако окончательного ответа на вопрос, почему так, у нас еще нет.
Фото: ИЗВЕСТИЯ/Дмитрий Коротаев
— Будет ли исследование продолжено? Если да, то как оно изменится в связи добавившимся фактором вакцинации?
— Четвертый этап исследований запланирован на март. Он будет иметь целый ряд особенностей по сравнению с предыдущими тремя этапами. Предыдущие три этапа проходили в условиях приобретения популяционного иммунитета естественным путем, мы имели дело только с переболевшими. На четвертом этапе у нас будет уже определенная доля провакцинированных, причем разными вакцинами, находящихся на разных стадиях вакцинации. Данные будут очень гетерогенные, и потребуется более детальный анализ.
Наша стратегическая задача — продолжать исследование популяционного иммунитета. Ведь массовая вакцинация проводится ради того, чтобы мы вышли на уровень коллективного иммунитета, который будет защищать всё население в целом, всю популяцию.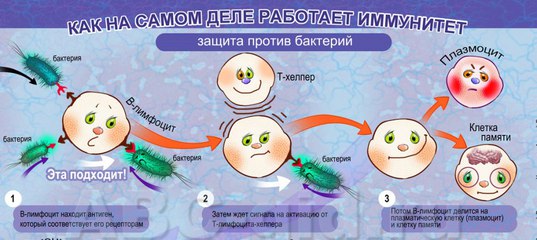 Пока мы не достигнем такой ситуации, мы будем продолжать исследование. По моим прогнозам, это займет весь 2021 год.
Пока мы не достигнем такой ситуации, мы будем продолжать исследование. По моим прогнозам, это займет весь 2021 год.
— Как вы считаете, если бы вакцинации не было, коллективный иммунитет когда-либо сформировался бы?
— Когда-нибудь — конечно, да. Только это был бы длительный процесс, который бы занял несколько лет.
Врачи рассказали, как эмоциональное состояние влияет на иммунитет
Тревожные люди в два раза чаще болеют респираторными инфекциями, чем спокойные, считают ученые. Однако в последнее время из-за страха перед коронавирусом у некоторых из нас уровень стресса вырос настолько, что это может значительно влиять на иммунитет и повышать риски заражения COVID-19. Врачи объяснили «Газете.Ru», как именно ментальное состояние связано с физическим.
Тревога из-за коронавируса может вызвать серьезные проблемы со здоровьем, а также ухудшить само течение болезни. Об этом радиостанции Sputnik сообщил психотерапевт Игорь Салынцев.
По его словам, эмоциональное состояние человека непосредственно влияет на физиологию.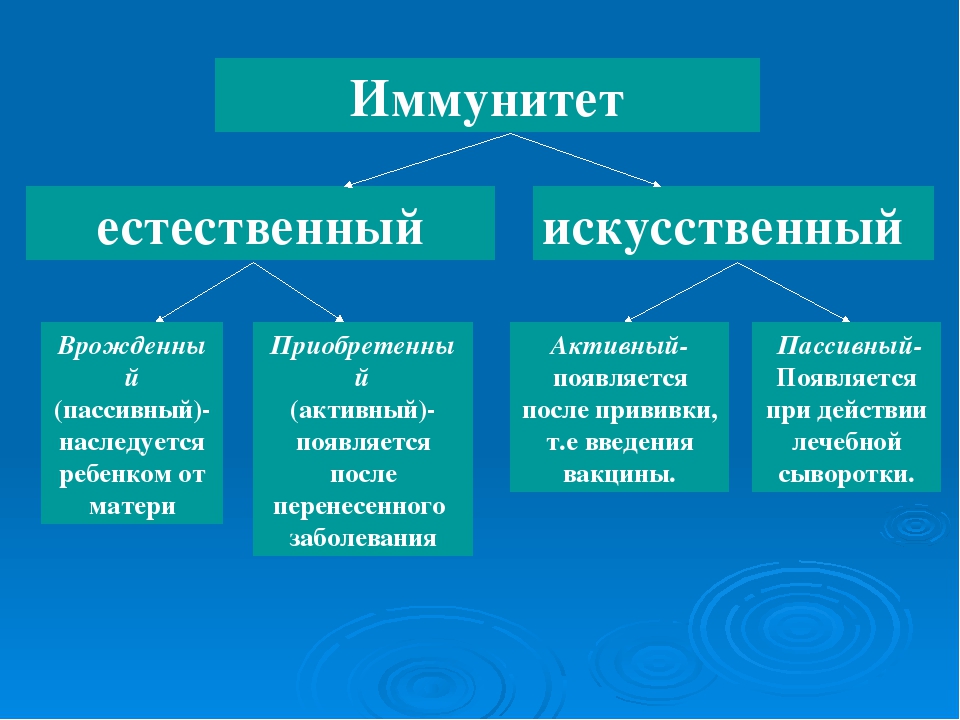 «Нарастающая, излишняя тревожность, если ею не заниматься, не лечить, снижает уровень стойкости психики, снижает обменные процессы в организме и его силу. Соответственно, иммунитет будет снижаться, и уязвимость к разным патологиям будет усиливаться. Тревожный человек более уязвим, в том числе и к вирусной патологии», – объяснил Салынцев.
«Нарастающая, излишняя тревожность, если ею не заниматься, не лечить, снижает уровень стойкости психики, снижает обменные процессы в организме и его силу. Соответственно, иммунитет будет снижаться, и уязвимость к разным патологиям будет усиливаться. Тревожный человек более уязвим, в том числе и к вирусной патологии», – объяснил Салынцев.
Ранее ученые Университета Карнеги Меллон в Питтсбурге (США) также выяснили, что тревожные люди заболевают ОРВИ в два раза чаще, чем эмоционально устойчивые.
Исследователи провели два эксперимента. В первом случае они спросили у 276 взрослых людей, что за последний год вызывало у них сильный стресс — работа, отношения или финансы. Затем участникам дали капли в нос, которые содержали небольшое количество вируса, вызывающего обычную простуду. 39% испытуемых заболели – все они перед этим сообщали о высоких уровнях стресса.
Во втором эксперименте ученые проанализировали уровень тревожности 79 участников, после чего также ввели им респираторную инфекцию. Затем исследователи проследили за производством в организме участников цитокинов, мобилизующих воспалительный ответ. У людей с более высоким уровнем стресса вырабатывалось больше цитокинов.
Затем исследователи проследили за производством в организме участников цитокинов, мобилизующих воспалительный ответ. У людей с более высоким уровнем стресса вырабатывалось больше цитокинов.
«Способность иммунной системы регулировать воспаления позволяет выявить того, кто заболеет простудой. Более того, это объясняет то, как стресс провоцирует болезнь, — пояснял автор исследования доктор Шелдон Коэн. – При стрессе клетки иммунной системы не способны реагировать на гормональную регуляцию, следовательно, вызывают такой уровень воспалений, который приводит к болезни».
Психиатр Олеся Носенко уверена, что такая связь между эмоциями и физическим здоровьем проявляется за счет активации гормональной системы. «Когда наступает нервное истощение, гормональная система, которая регулирует активность иммунной защиты, дает сбои. В результате иммунная система становится уязвимой», — заметила она в беседе с «Газетой.Ru».
На биохимическом уровне страх провоцирует увеличение в крови гормона кортизола, уточнил психиатр Константин Ковалев.
«Это гормон стресса, который напрямую влияет на клеточный и гуморальный иммунитет (механизм реализации защитных свойств организма в жидкостной среде, — «Газета.Ru»). Он подавляет их. Именно поэтому прием препаратов кортизона запрещен при симптомах коронавируса»,
— рассказал медик «Газете.Ru».
Увеличение уровня кортизола можно проследить по явным физиологическим проявлениям. Например, гормон стресса способствует набору лишнего веса даже при соблюдении нормы калорий и высоком уровне физической активности. Также это может приводить к хронической усталости, нервозности, бессоннице, проблемам с пищеварением (вздутию живота, запорам, диарее), потливости и частому мочеиспусканию. Кроме того, у мужчин может наблюдаться нарушения потенции.
Вместе с тем стресс и паника от коронавируса уменьшают выработку лимфоцитов в организме, которые отвечают за стабильную работу иммунитета, заявила Носенко. «Выработка лимфоцитов зависит от количества глюкокортикоидов (гормоны, регулирующие обмен веществ, — «Газета. Ru») в крови. Чем их больше, тем меньше в организме лимфоцитов. Таким образом, боясь коронавируса и постоянно паникуя от негативных новостей, человек может спровоцировать у себя и другие заболевания, а также обострение хронических болезней», — сказала психиатр.
Ru») в крови. Чем их больше, тем меньше в организме лимфоцитов. Таким образом, боясь коронавируса и постоянно паникуя от негативных новостей, человек может спровоцировать у себя и другие заболевания, а также обострение хронических болезней», — сказала психиатр.
Как считает Игорь Салынцев, прививка от COVID-19 может стать отличным решением сразу двух проблем: она и защитит организм от инфекции, и снизит уровень тревожности. Вместе с тем психотерапевт посоветовал не обращать внимание на слухи о коронавирусе и стараться получать информацию только из надежных источников.
«Чем человек более информирован, тем он меньше тревожится и боится. Люди боятся, когда чего-то не знают, недостаточно понимают или опираются на недостоверную информацию и слухи», – заявил эксперт.
Анализ крови на иммунитет | Семейная клиника А-Медия, Санкт-Петербург
В хроническую стадию большинство инфекционных заболеваний переходят по причине сниженного иммунитета, т. е. когда защитные силы не могут обеспечить полноценную защиту организма человека от внешних и внутренних раздражающих факторов. Чтобы определить, в каком состоянии находится ваша иммунная система, необходимо сделать иммунограмму (анализ на иммунитет).
Чтобы определить, в каком состоянии находится ваша иммунная система, необходимо сделать иммунограмму (анализ на иммунитет).
Сегодня существует порядка 10 видов иммунограмм, и все они определяют разные показатели. Выбор конкретного анализа должен производиться врачом, так как, выбирая самостоятельно, можно ошибиться и не получить необходимого результата, что приведет к напрасной трате денег и времени. Наиболее распространенным является анализ крови на иммунитет. Он дает полноценную информацию о состоянии клеточного и гуморального иммунитета.
В каких случаях необходим анализ крови на иммунитет?
Взрослым и детям рекомендуется сдать анализ на иммунитет в случае:
- частых ОРВИ и др. вирусных инфекций
- упорной молочницы
- гнойничковых высыпаний
- аллергических заболеваний
- аутоиммунных патологий
- рецидивирующего герпеса
- хронического гайморита и бронхита.
Данный вид иммунного тестирования поможет выявить, не вызваны ли вышеперечисленные состояния ослаблением иммунной системы, а также даст возможность вовремя предпринять необходимые лечебно-профилактические меры.
Из чего состоит анализ?
Анализ на иммунитет требуется людям с подозрением на отклонения в работе иммунной системы. Данная процедура представляет собой исследование нескольких компонентов иммунитета:
- гуморального
- клеточного
- неспецифического.
Врач самостоятельно решает, какие анализы на иммунитет необходимо делать, учитывая сложность ситуации, историю болезней и результаты уже проведенных исследований.
Подготовка к анализу крови на иммунитет
1. Процедура проводится исключительно натощак – последний прием пищи должен быть не менее чем за 8 часов до планируемого времени сдачи анализа.
2. За 2 недели рекомендуется исключить прием каких-либо лекарственных препаратов. В случае постоянного приема медикаментов, например, при гипертонической болезни или сахарном диабете, в обязательном порядке следует предупредить врача.
3. Не рекомендуется употреблять в пищу острые и жирные блюда за 2-3 дня до процедуры.
4. Запрещено употреблять алкоголь за сутки до исследования и курить за полчаса до забора крови.
5. Не следует проводить обследование во время острого инфекционного заболевания или обострения хронического.
Достоверные результаты анализа на иммунитет может обеспечить только строгое выполнение всех вышеперечисленных рекомендаций.
Результаты анализа
Возможности современной иммунодиагностики позволят любому из вас узнать о состоянии своей иммунной системы и, в случае необходимости, вовремя принять необходимые меры.
Полученные результаты со всей тщательностью изучает врач аллерголог-иммунолог, который может не только правильно их интерпретировать, но и дать квалифицированные рекомендации по дальнейшей тактике ведения выявленного заболевания.
Если вам необходимо определить свой иммунный статус (сдать анализ на иммунитет), то вы можете воспользоваться услугами нашей клиники. Квалифицированный врач аллерголог-иммунолог, имеющий многолетний опыт научной и практической работы, сможет определить причину нарушений в вашем организме и избавить от беспокоящих вас проблем.
Подробнее об услуге вас проинформирует наш администратор по телефону или через форму обратного звонка. Обращайтесь, мы готовы ответить на все ваши вопросы!
Каждое утро говорите «спасибо» иммунитету
Иммунитет – способность организма поддерживать себя, избавляться от чужеродных веществ и клеток. Почему он однажды резко снижается, и как надолго сохранить этот инструмент защиты?
Иркутянке Наташе 15 лет. Три года назад девочка резко выросла сразу на несколько сантиметров. Обеспокоенная мама заподозрила нелады со щитовидкой. После УЗИ медики поставили диагноз, связанный с аутоиммунными заболеваниями.
– Эндокринолог предложил пройти курс синтетических гормонов. Мы отказались, начали искать другие возможности лечения. Я изучала тему, слушала медицинские вебинары. После консультаций со специалистами мы пришли к выводу, что какие-то продукты организм не переносит, иммунная система против них буквально бунтует. Анализы показали, что у дочки аллергия на лактозу, какао, кулинарные дрожжи. Теперь у нас другой протокол питания, ушел дискомфорт, стала лучше кожа, мы лечимся, наблюдаемся, – рассказала мама Ирина.
Теперь у нас другой протокол питания, ушел дискомфорт, стала лучше кожа, мы лечимся, наблюдаемся, – рассказала мама Ирина.
Можно ли поправить иммунитет правильным питанием?
– Можно, – соглашается профессор кафедры микробиологии, вирусологии и иммунологии ИГМУ Елена Симонова. – Микрофлора утилизирует ненужное, она препятствует поражению организма человека.
Иммунная система формируется в утробе матери и с рождения ребенка поддерживается материнским молоком. Вакцинация усиливает иммуность и защищает от смертельных болезней.
В организме нет ничего лишнего, поясняет Елена Симонова. Поражение кожи, удаленные аппендикса или аденоидов, поражение слизистой оболочки рта могут привести к снижению иммунитета, потому что участвуют в защите организма. Некоторые наши современницы, бесконтрольно худея, используя диеты, также теряют полезную микрофлору.
Чаще всего резкое снижение иммунитета возникает при стрессах и больших нагрузках. Поэтому в группе риска те, кто так или иначе с этим сталкиваются. Пожилые люди тоже подвержены снижению иммунных сил.
Поэтому в группе риска те, кто так или иначе с этим сталкиваются. Пожилые люди тоже подвержены снижению иммунных сил.
Клетки иммунной системы работают в наших тканях и органах как вечный дозор, узнают «чужаков» на генетическом уровне. И когда этот дозор состоятелен, погибает все чужеродное, от вирусов до раковых клеток.
– ОРЗ служит тренировкой для иммунитета?
– Все респираторные заболевания связаны с циркуляцией вирусов, иммунитет должен знать, на что ему реагировать. Мы живем благодаря иммунитету. С врожденным иммунитетом мы появляемся на свет. Это первая линия защиты организма от инфекции. Приобретенный иммунитет более сложный, за него отвечают лимфоциты, которые приходят на помощь клеткам врожденного иммунитета, – продолжает врач.
Приобретенный иммунитет зависит от того, с какими бактериями и вирусами человеку прошлось столкнуться. Удивительно, но клетки иммунной системы имеют память, запоминают «врага».
– Ничего лучше вакцинации человечество не придумало, – констатирует Елена Симонова. – Благодаря памяти лимфоцитов мы не болеем дважды, например, ветряной оспой. Наша иммунная система – многокомпонентная, работает на благо организма, и мы должны постоянно ее поддерживать.
– Благодаря памяти лимфоцитов мы не болеем дважды, например, ветряной оспой. Наша иммунная система – многокомпонентная, работает на благо организма, и мы должны постоянно ее поддерживать.
– Каковы причины снижения иммунитета?
– Их несколько – агрессивная атака бактерий, вирусов, грибков, плохая экология, вредные привычки, нездоровый образ жизни. Бесконтрольный прием антибиотиков тоже не идет на пользу иммунной системе. Многие БАДы сегодня могут стимулировать бесконтрольное деление клеток, а это может привести даже к онкологии. Потребление БАДов надо строго регламентировать, – предупреждает специалист.
– Как диагностируют иммунные заболевания?
– Есть набор тестов, которые сигнализируют о наличии проблемы.
– Как сохранить иммунитет?
– Менять образ жизни, становиться активным. Важно правильно питаться – в кишечнике находится 80% «клеток» иммунной системы. Организму обязательно нужны продукты, которые увеличивают в нем рост полезных бактерий. Полноценный сон, закаливание тоже помогают укреплению иммунитета. Каждое утро говорите «спасибо» иммунной системе за то, что она справилась со своей задачей, и утром мы встаем невредимыми и идем на работу, – советует Елена Симонова.
Организму обязательно нужны продукты, которые увеличивают в нем рост полезных бактерий. Полноценный сон, закаливание тоже помогают укреплению иммунитета. Каждое утро говорите «спасибо» иммунной системе за то, что она справилась со своей задачей, и утром мы встаем невредимыми и идем на работу, – советует Елена Симонова.
Как повысить иммунитет беременной | Энциклопедия Барьер
Во время вынашивания ребенка защитные свойства женского организма снижаются. Ухудшение здоровья будущей мамы может негативно влиять на малыша, поэтому женщине следует особенно тщательно подходить к вопросу, как поднять иммунитет беременной. В этот период, особенно на фоне пандемии коронавируса, очень важно следить за своим состоянием, заниматься профилактикой заболеваний и поддерживать иммунную систему на высоте. В таком случае и беременность будет протекать без осложнений.
Причины снижения иммунитета у беременных
Иммуносупрессия (угнетение иммунитета) во время беременности – это нормальный процесс, который предупреждает отторжение эмбриона. Женский организм воспринимает плод как чужеродное тело, поэтому если иммунные функции мамочки не снижаются, высокая вероятность, что беременность прервется сама собой. С другой стороны, иммунитет может ухудшаться в силу сторонних причин, которые делают женщину уязвимой к инфекциям. К ним относятся:
Женский организм воспринимает плод как чужеродное тело, поэтому если иммунные функции мамочки не снижаются, высокая вероятность, что беременность прервется сама собой. С другой стороны, иммунитет может ухудшаться в силу сторонних причин, которые делают женщину уязвимой к инфекциям. К ним относятся:
- неправильное питание;
- нарушение гормонального фона;
- стрессы, тревожные состояния;
- низкая физическая активность;
- плохая экология;
- недостаток минералов и витаминов;
- неправильный режим сна;
- плохая работа органов ЖКТ.
На фоне этих причин крайне важно позаботиться о поддержке иммунитета беременным, чтобы получить дополнительные силы для вынашивания ребенка и предупредить развитие различных заболеваний.
Признаки ухудшения иммунитета
При снижении защитных функций женщина испытывает общее недомогание, которое связано с гормональной перестройкой организма. Токсикоз хоть и вызывает некоторую тревогу, но является естественным состоянием, которое сопровождает процессы вынашивания. Другое дело, если у женщины иммунитет сильно снижается, что сопровождается следующими симптомами:
Другое дело, если у женщины иммунитет сильно снижается, что сопровождается следующими симптомами:
- головные боли;
- бледность, сухость кожи;
- головокружение;
- повышенная потливость;
- подверженность простудам;
- бессонница;
- расслаивание ногтей;
- ломкость волос;
- кровоточивость десен.
Все эти признаки указывают на то, что женщине стоит задуматься об улучшении работы своей иммунной системы.
Беременность и коронавирус
Как показывает статистика, за весь период пандемии коронавируса не было зафиксировано ни одного случая смерти беременной. Однако это вовсе не означает, что женщинам можно забыть про меры предосторожности. Как и другие люди, они подвержены заражению, причем вирусная инфекция является дополнительным риском для малыша. Иммунитет беременных к коронавирусу до конца не изучен, а заболевание может обернуться самопроизвольным выкидышем, замершей беременностью, преждевременными родами. Поэтому будущим мамочкам необходимо соблюдать стандартную профилактику:
Поэтому будущим мамочкам необходимо соблюдать стандартную профилактику:
- избегать контактов с заболевшими;
- часто мыть руки, выполнять их обработку дезинфекторами;
- свести к минимуму походы по магазинам и салонам красоты;
- рационально питаться;
- носить маску при посещении мест большого скопления людей.
Как поднять иммунитет у беременных
При беременности рекомендуется максимально ограничить прием лекарственных средств, поэтому в повышении защитных свойств женского организма могут помочь только общие способы укрепления здоровья.
Здоровое питание
Примерно на 70 % иммунитет зависит от правильной работы кишечника. По этой причине женщине очень важно поддерживать здоровый и питательный рацион, который содержит большое количество фруктов и овощей. При беременности лучше отказаться от консервации, жареной, жирной, копченой пищи. Предпочтение стоит отдавать нежирным сортам мяса, кисломолочной продукции, орехам, сыру, хлебу грубого помола. Питаться стоит чаще, но небольшими порциями, чтобы избежать чрезмерного повышения веса.
Питаться стоит чаще, но небольшими порциями, чтобы избежать чрезмерного повышения веса.
Витамины
Рассматривая, как повысить иммунитет беременной женщине, не стоит забывать про витамины. Помимо полезных веществ, которые входят в продукты питания, будущим мамам нужно употреблять витаминные комплексы для беременных, содержащие необходимые минералы, макро- и микроэлементы. Особенно важными при вынашивании ребенка являются фолиевая кислота, йод, цинк, железо, кальций, магний, витамины Е, С, группы В. О том, какие именно витамины принимать при беременности, расскажет лечащий врач.
Свежий воздух и физические нагрузки
Чтобы улучшить здоровье, женщине следует активно двигаться и чаще бывать на свежем воздухе. Будущим мамочкам рекомендуется регулярно выходить на прогулки в скверы или парки, а при возможности – выезжать за город на природу. Однако не стоит излишне усердствовать с физическими нагрузками. Чтобы поддерживать мышцы в тонусе, достаточно зарядки по утрам.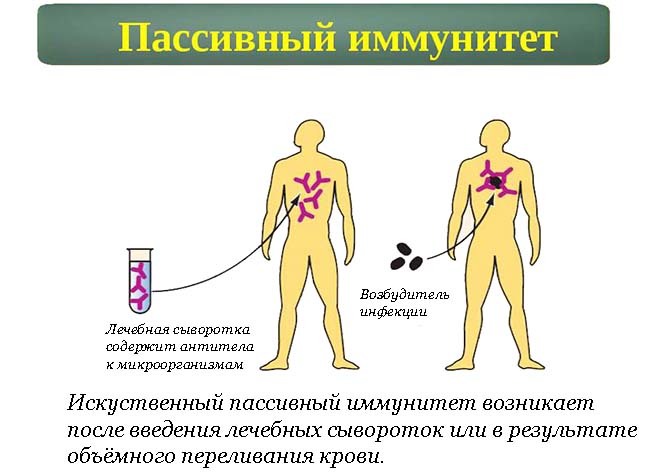 Кроме того, существуют различные упражнения при беременности, которые не только повышают иммунитет, но и помогают будущей маме подготовиться к родам.
Кроме того, существуют различные упражнения при беременности, которые не только повышают иммунитет, но и помогают будущей маме подготовиться к родам.
Питьевая вода
При беременности женщинам советуют потреблять больше жидкости. Но помните, что обычная водопроводная вода содержит много вредных примесей, поэтому перед приемом ее следует тщательно очищать. Помогут в этом фильтры «Актив Сила иммунитета» от производителя БАРЬЕР, которые специально разработаны для повышения защитных свойств организма. Системы фильтрации выполняют следующие функции:
- удаляют из воды хлористые соединения и другие вредные вещества;
- обогащают воду магнием и цинком;
- убирают посторонние привкусы и запахи;
- предупреждают образование накипи в чайниках.
Обогащение воды магнием помогает женщинам легче справляться со стрессами и нервозностью, поддерживает иммунную систему, улучшает работу легких и сердца. Цинк повышает способность иммунных клеток препятствовать угрозам извне, нормализует гормональный фон, снижает риски развития аллергических реакций и простудных заболеваний. Благодаря этому фильтры БАРЬЕР обеспечивают эффективное укрепление иммунитета беременным и позволяют легче переносить недомогания, связанные с вынашиванием малыша.
Питание и иммунитет | Источник питания
Во время сезона гриппа или болезней люди часто ищут специальные продукты или витаминные добавки, которые, как считается, повышают иммунитет. Популярными примерами являются витамин С и такие продукты, как цитрусовые, куриный суп и чай с медом. Тем не менее, структура нашей иммунной системы сложна и зависит от идеального баланса многих факторов, не только диеты, и особенно какой-либо конкретной пищи или питательного вещества. Однако сбалансированная диета, состоящая из ряда витаминов и минералов, в сочетании с такими факторами здорового образа жизни, как достаточный сон, физические упражнения и низкий уровень стресса, наиболее эффективно подготавливает организм к борьбе с инфекциями и болезнями.
Что такое наша иммунная система?
Ежедневно мы постоянно подвергаемся воздействию всевозможных потенциально вредных микробов. Наша иммунная система, сеть сложных этапов и путей в организме, защищает нас от этих вредных микробов, а также от некоторых заболеваний. Он распознает чужеродных захватчиков, таких как бактерии, вирусы и паразиты, и немедленно принимает меры. У человека есть два типа иммунитета: врожденный и адаптивный.
Наша иммунная система, сеть сложных этапов и путей в организме, защищает нас от этих вредных микробов, а также от некоторых заболеваний. Он распознает чужеродных захватчиков, таких как бактерии, вирусы и паразиты, и немедленно принимает меры. У человека есть два типа иммунитета: врожденный и адаптивный.
Врожденный иммунитет — это защита первой линии от патогенов, которые пытаются проникнуть в наш организм, достигаемая через защитные барьеры.Эти барьеры включают:
- Кожа, защищающая от большинства болезнетворных микроорганизмов
- Слизь, задерживающая болезнетворные микроорганизмы
- Желудочная кислота, уничтожающая болезнетворные микроорганизмы
- Ферменты в нашем поту и слезах, которые помогают создавать антибактериальные соединения
- Клетки иммунной системы, атакующие все инородные клетки, попадающие в организм
Адаптивный или приобретенный иммунитет — это система, которая учится распознавать патоген. Он регулируется клетками и органами нашего тела, такими как селезенка, тимус, костный мозг и лимфатические узлы.Когда чужеродное вещество попадает в организм, эти клетки и органы вырабатывают антитела и приводят к размножению иммунных клеток (включая различные типы лейкоцитов), которые специфичны для этого вредного вещества, атакуют и разрушают его. Наша иммунная система затем адаптируется, запоминая чужеродное вещество, так что, если оно снова входит, эти антитела и клетки еще более эффективны и быстро уничтожают его.
Он регулируется клетками и органами нашего тела, такими как селезенка, тимус, костный мозг и лимфатические узлы.Когда чужеродное вещество попадает в организм, эти клетки и органы вырабатывают антитела и приводят к размножению иммунных клеток (включая различные типы лейкоцитов), которые специфичны для этого вредного вещества, атакуют и разрушают его. Наша иммунная система затем адаптируется, запоминая чужеродное вещество, так что, если оно снова входит, эти антитела и клетки еще более эффективны и быстро уничтожают его.
Другие состояния, вызывающие иммунный ответ
Антигены — это вещества, которые организм маркирует как чужеродные и вредные, вызывающие активность иммунных клеток.Аллергены являются одним из типов антигенов и включают пыльцу травы, пыль, пищевые компоненты или шерсть домашних животных. Антигены могут вызывать гиперреактивный ответ, при котором выделяется слишком много лейкоцитов. Чувствительность людей к антигенам широко варьируется. Например, аллергия на плесень вызывает симптомы свистящего дыхания и кашля у чувствительного человека, но не вызывает реакции у других.
Например, аллергия на плесень вызывает симптомы свистящего дыхания и кашля у чувствительного человека, но не вызывает реакции у других.
Воспаление — важная нормальная ступень врожденного иммунного ответа организма. Когда патогены атакуют здоровые клетки и ткани, иммунные клетки, называемые тучными клетками, контратакуют и выделяют белки, называемые гистаминами, которые вызывают воспаление.Воспаление может вызвать боль, отек и выделение жидкости, чтобы помочь вывести патогены. Гистамины также посылают сигналы к выделению еще большего количества лейкоцитов для борьбы с патогенами. Однако длительное воспаление может привести к повреждению тканей и подавить иммунную систему.
Аутоиммунные заболевания , такие как волчанка, ревматоидный артрит или диабет 1 типа, частично являются наследственными и вызывают гиперчувствительность, при которой иммунные клетки атакуют и разрушают здоровые клетки.
Расстройства иммунодефицита могут подавлять или полностью отключать иммунную систему и могут быть генетическими или приобретенными.Приобретенные формы более распространены и включают СПИД и такие виды рака, как лейкемия и множественная миелома. В этих случаях защитные силы организма настолько снижаются, что человек становится очень восприимчивым к болезням из-за вторжения патогенов или антигенов.
Какие факторы могут подавлять нашу иммунную систему?
- Пожилой возраст: С возрастом наши внутренние органы могут стать менее эффективными; Связанные с иммунитетом органы, такие как вилочковая железа или костный мозг, производят меньше иммунных клеток, необходимых для борьбы с инфекциями.Старение иногда связано с дефицитом питательных микроэлементов, что может ухудшить иммунную функцию.
- Экологические токсины (дым и другие частицы, способствующие загрязнению воздуха, чрезмерное употребление алкоголя): Эти вещества могут нарушать или подавлять нормальную активность иммунных клеток.
- Избыточный вес: Ожирение связано с хроническим воспалением слабой степени. Жировая ткань вырабатывает адипоцитокины, которые могут способствовать воспалительным процессам. [1] Исследования проводятся рано, но ожирение также было определено как независимый фактор риска для вируса гриппа, возможно, из-за нарушения функции Т-клеток, типа белых кровяных телец.[2]
- Плохое питание: Недоедание или диета с недостатком одного или нескольких питательных веществ может нарушить производство и активность иммунных клеток и антител.
- Хронические болезни: Аутоиммунные и иммунодефицитные расстройства атакуют и потенциально выводят из строя иммунные клетки.
- Хронический психический стресс: Стресс высвобождает гормоны, такие как кортизол, которые подавляют воспаление (воспаление изначально необходимо для активации иммунных клеток) и действие лейкоцитов.
- Недостаток сна и отдыха: Сон — это время восстановления организма, во время которого выделяется определенный тип цитокинов, который борется с инфекцией; Недостаток сна снижает количество этих цитокинов и других иммунных клеток.
Существует ли диета, повышающая иммунитет?
Потребление достаточного количества питательных веществ в рамках разнообразного рациона необходимо для здоровья и функционирования всех клеток, включая иммунные. Определенные режимы питания могут лучше подготовить организм к атакам микробов и чрезмерному воспалению, но маловероятно, что отдельные продукты питания обеспечивают особую защиту.Каждая стадия иммунного ответа организма зависит от наличия множества питательных микроэлементов. Примеры питательных веществ, которые были определены как важные для роста и функции иммунных клеток, включают витамин C, витамин D, цинк, селен, железо и белок (включая аминокислоту глутамин). [3,4] Они содержатся в разнообразной растительной и животной пище.
Диеты с ограниченным разнообразием и низким содержанием питательных веществ, например, состоящие в основном из сверхпереработанных пищевых продуктов и без минимально обработанных пищевых продуктов, могут негативно повлиять на здоровую иммунную систему.Также считается, что западная диета с высоким содержанием рафинированного сахара и красного мяса и низким содержанием фруктов и овощей может способствовать нарушениям в здоровых кишечных микроорганизмах, что приводит к хроническому воспалению кишечника и связанному с этим подавленному иммунитету. [5]
Микробиом — это внутренний мегаполис, состоящий из триллионов микроорганизмов или микробов, обитающих в наших телах, в основном в кишечнике. Это область интенсивных и активных исследований, поскольку ученые обнаруживают, что микробиом играет ключевую роль в иммунной функции.Кишечник является основным участком иммунной активности и производства антимикробных белков. [6,7] Диета играет большую роль в определении того, какие виды микробов живут в нашем кишечнике. Рацион с высоким содержанием клетчатки и большим количеством фруктов, овощей, цельнозерновых и бобовых, по-видимому, поддерживает рост и поддержание полезных микробов. Некоторые полезные микробы расщепляют волокна на жирные кислоты с короткой цепью, которые стимулируют активность иммунных клеток. Эти волокна иногда называют пребиотиками, потому что они питают микробы.Следовательно, диета, содержащая пробиотические и пребиотические продукты, может быть полезной. Продукты с пробиотиками содержат живые полезные бактерии, а продукты с пребиотиками содержат клетчатку и олигосахариды, которые питают и поддерживают здоровые колонии этих бактерий.
- Пробиотические продукты включают кефир, йогурт с живыми активными культурами, ферментированные овощи, квашеную капусту, темпе, чайный гриб, кимчи и мисо.
- Пребиотические продукты включают чеснок, лук, лук-порей, спаржу, топинамбур, зелень одуванчика, бананы и водоросли.Однако более общим правилом является употребление в пищу пребиотиков различных фруктов, овощей, бобов и цельнозерновых продуктов.
Теплая тарелка куриного супа — популярное блюдо, когда мы плохо себя чувствуем. Есть ли научные доказательства того, что это помогает в исцелении? Короткий ответ — нет; Нет никаких клинических испытаний, которые показали бы, что куриный суп ускоряет заживление больше, чем другие продукты. Но если разложить ингредиенты, это действительно стоящее средство, которое стоит попробовать. Во-первых, куриный суп легкий и приятный для желудка, когда у нас плохой аппетит.Во-вторых, он обеспечивает жидкость и электролиты для предотвращения обезвоживания, которое легко может возникнуть при лихорадке. Наконец, традиционный рецепт куриного супа содержит различные питательные вещества, задействованные в иммунной системе: белок и цинк из курицы, витамин А из моркови, витамин С из сельдерея и лука, а также антиоксиданты в луке и травах. Это вкусная и успокаивающая пища, которую следует включать, когда вы плохо себя чувствуете, и для нее не требуется рецепт врача.
Помогают ли витамины или травяные добавки?
Дефицит отдельных питательных веществ может изменить иммунный ответ организма.Исследования на животных показали, что дефицит цинка, селена, железа, меди, фолиевой кислоты и витаминов A, B6, C, D и E может изменять иммунные реакции. [8] Эти питательные вещества помогают иммунной системе несколькими способами: действуют как антиоксидант для защиты здоровых клеток, поддерживают рост и активность иммунных клеток и вырабатывают антитела. Эпидемиологические исследования показывают, что те, кто плохо питается, подвергаются большему риску бактериальных, вирусных и других инфекций.
Роль витамина D в регулировании иммунной системы побудила ученых изучить два параллельных направления исследований: способствует ли дефицит витамина D развитию рассеянного склероза, диабета 1 типа и других так называемых «аутоиммунных» заболеваний, при которых иммунная система организма атакует собственные органы и ткани? И могут ли добавки с витамином D помочь повысить защитные силы нашего организма в борьбе с инфекционными заболеваниями, такими как туберкулез и сезонный грипп?
Узнать большеСоблюдение диеты хорошего качества, как показано на тарелке здорового питания, может предотвратить дефицит этих питательных веществ.Однако есть определенные группы населения и ситуации, в которых нельзя всегда есть разнообразную питательную пищу или которые имеют повышенные потребности в питательных веществах. В этих случаях витаминные и минеральные добавки могут помочь восполнить пробелы в питании. Исследования показали, что витаминные добавки могут улучшить иммунный ответ в этих группах. [8-10] Семьи с низкими доходами, беременные и кормящие женщины, младенцы и дети ясельного возраста, а также тяжелобольные являются примерами групп риска.
Пожилые люди относятся к группе особенно высокого риска.Иммунный ответ обычно снижается с возрастом, так как количество и качество иммунных клеток уменьшается. Это приводит к более высокому риску ухудшения результатов, если у пожилых людей развиваются хронические или острые заболевания. Кроме того, около одной трети пожилых людей в промышленно развитых странах испытывают дефицит питательных веществ. [8] Некоторые причины включают плохой аппетит из-за хронических заболеваний, депрессии или одиночества; несколько лекарств, которые могут мешать усвоению питательных веществ и аппетиту; нарушение всасывания из-за проблем с кишечником; и повышенная потребность в питательных веществах из-за гиперметаболических состояний с острыми или хроническими состояниями.Разнообразие диеты также может быть ограничено из-за бюджетных ограничений или меньшего интереса к приготовлению пищи для одного человека; плохая прикуса; умственная отсталость; или отсутствие транспорта и общественных ресурсов для получения здоровой пищи.
В этих случаях может использоваться обычная поливитаминная / минеральная добавка, обеспечивающая рекомендуемую диету (RDA), если иное не предписано врачом. Добавки мегадозы (во многих случаях рекомендуемая суточная норма) не кажутся оправданными и иногда могут быть вредными или даже подавлять иммунную систему (например,г., как и с цинком). Помните, что витаминные добавки не следует рассматривать как замену хорошей диеты, потому что никакие добавки не содержат всех преимуществ здоровой пищи.
Травы
Было предложено несколько травяных добавок для повышения иммунной функции. Что говорится в исследовании?
- Эхинацея: Клеточные исследования показали, что эхинацея может уничтожать вирусы гриппа, но ограниченные исследования на людях не дали окончательных результатов в определении активных компонентов эхинацеи.Не было доказано, что прием эхинацеи после простуды сокращает ее продолжительность, но прием в здоровом состоянии может дать небольшой шанс защиты от простуды. [11,12]
- Чеснок: Предполагается, что активный ингредиент чеснока, allicin sativum, оказывает противовирусное и противомикробное действие при простуде, но отсутствуют качественные клинические испытания, сравнивающие добавки чеснока с плацебо. Кокрановский обзор выявил только одно испытание разумного качества с участием 146 человек.У тех, кто принимал чесночную добавку в течение 3 месяцев, было меньше случаев простуды, чем у тех, кто принимал плацебо, но после заражения вирусом простуды обе группы имели одинаковую продолжительность болезни. [13] Обратите внимание, что эти результаты получены в результате одного исследования, которое необходимо повторить.
- Катехины чая: Исследования клеток показали, что катехины чая, такие как те, что содержатся в зеленом чае, могут предотвращать размножение вирусов гриппа и некоторых вирусов простуды, а также повышать иммунную активность. Испытания на людях все еще ограничены.Два рандомизированных контролируемых исследования показали, что капсулы зеленого чая вызывают меньше симптомов простуды / гриппа или заболеваемости гриппом, чем плацебо; однако оба исследования финансировались или были связаны авторами с чайной промышленностью. [14]
8 шагов для поддержки здоровой иммунной системы
- Соблюдайте сбалансированную диету с цельными фруктами, овощами, нежирным белком, цельнозерновыми злаками и большим количеством воды. Средиземноморская диета — это один из вариантов, который включает эти типы продуктов.
- Если сбалансированная диета недоступна, можно использовать поливитамины, содержащие RDA для нескольких питательных веществ.
- Не курите (или бросьте курить, если курите).
- Пейте алкоголь в умеренных количествах.
- Выполняйте умеренные регулярные упражнения.
- Старайтесь спать 7-9 часов каждую ночь. Постарайтесь придерживаться режима сна, просыпаясь и ложась спать каждый день в одно и то же время. Наши биологические часы, или циркадный ритм, регулируют чувство сонливости и бодрствования, поэтому постоянный график сна поддерживает сбалансированный циркадный ритм, чтобы мы могли войти в более глубокий и спокойный сон.
- Стремитесь справиться со стрессом.Легче сказать, чем сделать, но постарайтесь найти несколько здоровых стратегий, которые хорошо подходят вам и вашему образу жизни — будь то упражнения, медитация, конкретное хобби или разговор с надежным другом. Еще один совет — практиковать регулярное сознательное дыхание в течение дня и при возникновении стресса. Это не должно быть долгим — даже несколько вдохов могут помочь. Если вам нужен совет, попробуйте это короткое внимательное дыхательное упражнение.
- Мыть руки в течение дня: приходя с улицы, до и после приготовления и приема пищи, после посещения туалета, после кашля или сморкания.
Связанные
Пандемия COVID-19 оказывает ряд уникальных и индивидуальных последствий — от проблем с доступом к продовольствию, перебоев в доходах, эмоциональных потрясений и т. Д. Для получения дополнительных советов и обсуждения того, как справиться в это трудное время, посетите серию еженедельных интерактивных онлайн-форумов Гарварда Чана.Безопасность пищевых продуктов, питание и благополучие во время COVID-19
Спросите эксперта: роль диет и пищевых добавок во время COVID-19
Каталожные номера- Чайлдс CE, Calder PC, Miles EA.Диета и иммунная функция. Питательные вещества . 2019 16 августа; 11 (8).
- Грин ВД, Бек Массачусетс. Ожирение нарушает адаптивный иммунный ответ на вирус гриппа. Анналы Американского торакального общества . 2017 ноя; 14 (Приложение 5): S406-9.
- Guillin OM, Vindry C, Ohlmann T, Chavatte L. Селен, селенопротеины и вирусная инфекция. Питательные вещества . 2019 Сен; 11 (9): 2101.
- Wessels I, Maywald M, Rink L. Цинк как привратник иммунной функции. Питательные вещества .2017 Декабрь; 9 (12): 1286.
- Molendijk I, van der Marel S, Maljaars PW. К пищевой аптеке: иммунологическая модуляция с помощью диеты. Питательные вещества . 2019 июн; 11 (6): 1239.
- Caballero S, Pamer EG. Воспаление, опосредованное микробиотой, и антимикробная защита кишечника. Ежегодный обзор иммунологии . 2015 21 марта; 33: 227-56.
- Li XV, Леонарди I, Илиев ИД. Микобиота кишечника влияет на иммунитет и воспалительные заболевания. Иммунитет . 2019 18 июня; 50 (6): 1365-79.
- Чандра РК. Питание и иммунная система: введение. Американский журнал клинического питания . 1 августа 1997 г .; 66 (2): 460S-3S.
- Hemilä H, Louhiala P. Витамин C для профилактики и лечения пневмонии. Кокрановская база данных систематических обзоров . 2013 (8).
- Мартино А. Р., Джоллифф Д. А., Хупер Р. Л., Гринберг Л., Алоя Дж. Ф., Бергман П., Дубнов-Раз Г., Эспозито С., Ганмаа Д., Гинде А. А., Гудолл ЕС. Добавки витамина D для профилактики острых респираторных инфекций: систематический обзор и метаанализ данных отдельных участников. BMJ . 2017 15 февраля; 356: i6583.
- Национальный центр дополнительного и комплексного здоровья. Эхинацея. https://www.nccih.nih.gov/health/echinacea. Дата обращения 02.04.20.
- Karsch ‐ Völk M, Barrett B, Kiefer D, Bauer R, Ardjomand ‐ Woelkart K, Linde K. Echinacea для профилактики и лечения простуды. Кокрановская база данных систематических обзоров . 2014 (2).
- Лиссиман Э, Бхасале А.Л., Коэн М. Чеснок от простуды. Кокрановская база данных систематических обзоров .2014 (11).
- Фурушима Д., Иде К., Ямада Х. Влияние катехинов чая на грипп и простуду с акцентом на эпидемиологические / клинические исследования. Молекулы . 2018 Июль; 23 (7): 1795.
Условия использования
Содержание этого веб-сайта предназначено для образовательных целей и не предназначено для предоставления личных медицинских консультаций. Вам следует обратиться за советом к своему врачу или другому квалифицированному поставщику медицинских услуг с любыми вопросами, которые могут у вас возникнуть относительно состояния здоровья.Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте. Nutrition Source не рекомендует и не одобряет какие-либо продукты.
Причины, последствия и обращение старения иммунной системы
J Clin Invest. 1 марта 2013 г .; 123 (3): 958–965.
Отделение патологии и лабораторной медицины Медицинской школы Дэвида Геффена при Калифорнийском университете в Лос-Анджелесе, Калифорния, США.
Адресная корреспонденция: Kenneth Dorshkind, Школа медицины Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, 10833 Le Conte Avenue, Лос-Анджелес, Калифорния , США.Телефон: 310.206.9535; Факс: 310.206.9391; Эл. адрес: ude.alcu.tendem@ikhsrodk. © Американское общество клинических исследований, 2013 г.Abstract
Влияние старения на иммунную систему проявляется на нескольких уровнях, включая снижение продукции В- и Т-клеток в костном мозге и тимусе и снижение функции зрелых лимфоцитов во вторичных лимфоидных тканях. В результате пожилые люди не реагируют на иммунный вызов так же активно, как молодые.Важной целью исследований старения является определение клеточных изменений, происходящих в иммунной системе, и лежащих в их основе молекулярных событий. В этом отношении был достигнут значительный прогресс, и эта информация послужила основанием для клинических испытаний по омоложению стареющей иммунной системы.
Введение
Одним из наиболее известных последствий старения является снижение иммунной функции. Хотя пожилые люди никоим образом не обладают иммунодефицитом, они часто не реагируют эффективно на новые или ранее встречавшиеся антигены.Это иллюстрируется повышенной уязвимостью людей в возрасте 70 лет и старше к гриппу (1), ситуация усугубляется их плохой реакцией на вакцинацию (2–4).
Влияние старения на иммунную систему широко распространено и влияет на скорость производства наивных В- и Т-клеток, а также на состав и качество пула зрелых лимфоцитов. Целью данной статьи является обзор последних достижений с акцентом на адаптивный иммунитет в понимании клеточных и молекулярных событий, лежащих в основе этих возрастных изменений, и обсуждение их значения для разработки стратегий омоложения иммунной системы у пожилых людей. .
Влияние старения на развитие иммунной системы
После образования в костном мозге и тимусе наивные В- и Т-клетки мигрируют во вторичные лимфоидные ткани, такие как селезенка (5–7). Этот процесс особенно эффективен у молодых людей, чтобы генерировать разнообразный иммунный репертуар и заполнять периферические лимфоидные компартменты. Напротив, у пожилых людей первичный лимфопоэз значительно снижен, о чем свидетельствует инволюция тимуса (8-10). Причины этого возрастного снижения развития лимфоцитов являются многофакторными и включают изменения в HSC и клетках-предшественниках (11, 12), а также в местной тканевой и системной среде (13, 14).
HSC демонстрируют множественные возрастные изменения, которые включают нарушение адгезии к стромальным клеткам и, у некоторых линий мышей (15, 16) и пожилых людей (17), увеличение их числа. С иммунологической точки зрения, наиболее сильным эффектом старения стволовых клеток как у мышей (11, 18), так и у людей (17) является снижение способности продуцировать лимфоциты и увеличение миелоидного потенциала. Этот сдвиг коррелирует с повышенной экспрессией генов миелоидного клона и подавлением генов, определяющих судьбу лимфоидного клона (11, 17).
Способность идентифицировать, по крайней мере, у мышей, отдельные подмножества HSC с лимфоидным или миелоидным смещением, или которые демонстрируют сбалансированный лимфомиелоидный потенциал, позволила по-новому взглянуть на то, как старение влияет на пул стволовых клеток (рисунок и ссылки 19, с. 20). Поскольку каждая из этих клон-отрицательных (Lin — ) популяций CD117 + (c-kit + ) Sca-1 + может быть определена на основе их относительной экспрессии CD150, члена семейства сигнальных молекул активации лимфоцитов. (Рисунок и ссылки.21–23), теперь понятно, что количество стволовых клеток с лимфоидным смещением снижается с возрастом одновременно с увеличением количества HSC с смещением по миелоиду (19). Связанное с возрастом увеличение экспрессии генов миелоидных клонов в исследованиях, упомянутых выше (11, 17), вероятно, было результатом накопления смещенных миелоидных клеток HSC, поскольку эти анализы были выполнены на неразделенных пулах HSC. Несмотря на увеличение их числа, миелоидно-смещенные стволовые клетки не так устойчивы, как их молодые аналоги (24), что, в свою очередь, может лежать в основе многочисленных возрастных недостатков, наблюдаемых в зрелых миелоидных клетках, таких как нейтрофилы и макрофаги (25, 26). .
Влияние старения на HSC и предшественники лимфоцитов.Лимфопоэз у молодых (слева) характеризуется устойчивым образованием В- и Т-клеток в костном мозге и тимусе. Пул HSC включает относительно большое количество лимфоидных стволовых клеток, которые эффективно генерируют лимфоидные предшественники с высоким пролиферативным потенциалом. Однако с возрастом (справа) количество HSC с лимфоидным смещением снижается и преобладают стволовые клетки с миелоидным смещением, что способствует уменьшению количества лимфоидных предшественников.Кроме того, предшественники В-клеток в костном мозге и предшественники Т-клеток в тимусе демонстрируют пониженную скорость пролиферации и более высокие уровни апоптоза по сравнению с их молодыми аналогами. Повышенная экспрессия Ink4a и Arf в про-B-клетках и Ink4a в ETP способствует снижению пролиферации / усилению апоптоза. Снижение первичного лимфопоэза, в свою очередь, приводит к уменьшению количества наивных клеток, которые мигрируют во вторичные лимфоидные ткани, такие как селезенка.
Лимфоидные HSC у старых мышей, по-видимому, также накапливают дефициты, которые, как обсуждается ниже, могут поставить под угрозу их потенциал самообновления и способствовать сокращению этой популяции (27). Ввиду этого неудивительно, что количество предшественников В-клеток (28–31) и Т-клеток (32, 33) в костном мозге и тимусе заметно снижается с возрастом. Кроме того, низкое качество лимфоидных предшественников, которые образуются у пожилых людей, еще больше усугубляет снижение лимфопоэза (29, 32, 34).Например, обычные лимфоидные предшественники, пре-про-В-клетки и про-В-клетки от старых мышей не пролиферируют так интенсивно, как молодые клетки, и они демонстрируют значительно более высокие показатели апоптоза. Наиболее незрелые интратимические предшественники, которые были названы предшественниками ранних Т-линий (ETP), генерируют CD4 — двойно-отрицательные (DN) потомства CD8 — , которые в конечном итоге становятся зрелыми CD4 + Th-клетками и CD8 + цитотоксическими. Т-клетки (35). Подобно предшественникам B-клеток, ETP и DN-клетки старых мышей также обнаруживают возрастные дефекты пролиферации и высокие показатели апоптоза (см.32 и рисунок).
Почему старение приводит к снижению количества лимфоидных HSC и снижению качества лимфоидных предшественников, до конца не изучено. С одной стороны, могут действовать внутренне запрограммированные события в стволовых клетках и клетках-предшественниках, что предполагает наличие у этих клеток каких-то внутренних часов, которые регулируют их функцию и продолжительность жизни. Однако накопленные данные свидетельствуют о том, что на снижение лимфопоэза влияют возрастные изменения окружающей среды.Точные возрастные факторы окружающей среды, которые приводят к истощению лимфоидно-зависимых HSC, не были идентифицированы, хотя могут быть вовлечены изменения в уровнях трансформирующего фактора роста β-1 (21). Ухудшение микросреды костного мозга, возможно, в результате снижения секреции ИЛ-7 стромальными клетками, вовлечено в старение клонов В-клеток (36, 37). Связанные с возрастом изменения микросреды также оказывают большое влияние на тимус, где развитие Т-клеток зависит от интактной среды тимуса, состоящей из фибробластов, макрофагов, дендритных клеток и эпителиальных клеток тимуса.Очевидно, что количество эпителиальных клеток тимуса со временем снижается и что они не замещаются в результате нарушения пролиферации (38). Кроме того, с возрастом увеличивается продукция медиаторов воспаления, которые могут быть тимоцитотоксичными (39). Тимус, особенно у людей, все больше инфильтрируется адипоцитами, побочные продукты которых могут быть токсичными для развивающихся тимоцитов и оставшихся популяций стромальных клеток (40). Происходит аналогичное жировое ухудшение микросреды костного мозга (41), но роль факторов, происходящих из адипоцитов, в подавлении В-лимфопоэза изучена недостаточно.
Системные изменения, происходящие во время старения, также могут влиять на продукцию лимфоцитов (14) и, в частности, на тимопоэз. Например, многочисленные отчеты продемонстрировали, что гормон роста (GH) и IGF-1 могут стимулировать тимопоэз (13, 42). Поскольку производство этих гормонов снижается с возрастом (43), это привело к выводу, что возрастные изменения в эндокринной системе способствуют снижению лимфопоэза. Эта точка зрения легла в основу клинических испытаний с использованием GH, которые мы обсудим ниже.
Старение и снижение иммунной функции
Хотя количество наивных В- и Т-клеток, которые мигрируют из первичных во вторичные лимфоидные органы, уменьшается с возрастом, развитие В- и Т-клеток не прекращается полностью. Действительно, некоторые функциональные ткани тимуса остаются даже у пожилых людей (44). Продолжающееся производство лимфоцитов, хотя и ограниченное, и наличие относительно нормального количества лимфоцитов в таких органах, как селезенка, поднимают вопрос о том, почему функциональный иммунитет снижается у пожилых людей.Ответ заключается в том, что состав и качество пула зрелых лимфоцитов в корне меняются с возрастом.
Например, увеличение количества Т-клеток памяти в настоящее время является хорошо узнаваемым признаком старения. Эти клетки, которые образуются после первоначального контакта с антигеном, сохраняются еще долго после того, как первоначальное заражение исчезло, и являются источником эффекторов, которые могут быстро реагировать на повторное воздействие антигена. Воздействие нескольких патогенов с течением времени приводит к разнообразному иммунному репертуару, который включает увеличенный пул защитных клеток памяти.Однако хроническая стимуляция стойкими вирусными инфекциями, такими как ЦМВ, может истощить наивный пул клеток и привести к размножению олигоклональных клеток памяти. Этот феномен считается основным фактором, способствующим накоплению клеток памяти CD8 + у пожилых людей (45), хотя также может происходить антиген-независимая экспансия Т-клеток CD8 + (46). Эти олигоклональные увеличенные Т-клетки памяти CD8 + дополнительно различаются у людей по потере экспрессии костимулирующей молекулы CD28 (47, 48) и нарушению иммунной функции.Накопление CD8 + CD28 — Т-клеток и серопозитивность по ЦМВ являются компонентами профиля иммунного риска, который был предложен в качестве предиктора смертности у лиц 65 лет и старше (49), но как именно сочетание этих событий приводит к увеличению смертности неясно (50).
Профиль иммунного риска также включает В-клетки с нарушенной функцией. Количество В-клеток у мышей не изменяется с возрастом, но в периферической крови человека их абсолютное количество снижается (51).Это снижение, вероятно, связано с уменьшением количества В-клеток памяти IgM + и переключаемых В-клеток памяти, поскольку общее количество наивных В-клеток остается неизменным при старении (51, 52). Человеческие и мышиные В-клетки также демонстрируют нарушенную рекомбинацию переключателя классов, которую связывают со сниженной индукцией индуцированного активацией фермента цитидиндезаминазы (AID) (53). Принимая во внимание критическую роль, которую играют Т-клетки CD4 + в организации иммунного ответа, некоторые из возрастных дефицитов, наблюдаемых в В-клетках (51, 53, 54), включают уменьшение количества развивающихся плазмобластов. в ответ на вакцинацию против гриппа (55) и выработку некачественных антител к углеводным антигенам (56–58) может происходить вторично по отношению к дефициту Т-клеток.
Определено несколько субпопуляций В-клеток, и необходимы дополнительные исследования, чтобы определить, как старение влияет на них. Таким образом, гуморальный иммунитет к вирусу гриппа проявляется в виде Т-клеточно-независимых и Т-клеточно-зависимых волн, которые могут включать B1, маргинальную зону и фолликулярные B-клетки (59). Недавно сообщалось, что количество В-клеток в маргинальной зоне снижается у старых мышей (60), но неизвестно, влияет ли это на выработку антител к специфическим антигенам и как это происходит. Хотя B1 B-клетки присутствуют на низкой частоте (61), они играют решающую роль в ответе на S.pneumoniae у мышей путем секреции антиуглеводных антител (62). Однако очень мало известно о влиянии старения на их функции. Популяция CD20 + CD27 + CD43 + CD70 — клеток B1 человека была недавно описана (63), но опять же, ничего не известно о том, как старение влияет на их развитие или функцию.
Воспаление (64), состояние, при котором происходит накопление медиаторов воспаления в тканях, связано со старением.Было высказано предположение, что источником этих воспалительных факторов являются клетки, которые приобрели секреторный фенотип, связанный со старением (SASP) (65). SASP может быть приобретен клетками после того, как они стареют, или он может происходить постепенно в различных популяциях с течением времени, поскольку они приобретают повреждения ДНК, которые, в свою очередь, запускают повышенную продукцию медиаторов воспаления, таких как IL-6 (66, 67). Независимо от того, как происходит переход от благотворной среды к воспалительной, конечным результатом может быть отрицательное влияние на способность наивных лимфоцитов из костного мозга или тимуса оседать в таком органе, как селезенка, а также на функцию зрелых лимфоцитов. лимфоциты, уже находящиеся в этой ткани.В последнем случае, например, Т-клетки CD8 + , которые накапливаются у пожилых людей, плохо пролиферируют (68, 69), и, как более подробно обсуждается в следующем разделе, Т-клетки CD4 + демонстрируют пониженный уровень Т-клеточного рецептора. интенсивность передачи сигналов и измененная продукция различных цитокинов после связывания антигена (70, 71).
Точный источник различных медиаторов воспаления может варьироваться от человека к человеку. В одном сценарии возрастные изменения в элементах микросреды, таких как стромальные или дендритные клетки (72), приведут к переходу от благотворной среды к воспалительной.Однако не менее вероятно, что изменения, происходящие в стареющих В- и Т-клетках или врожденных эффекторах (26), могут изменять элементы микроокружения. Например, с возрастом наивные CD4 + Т-клетки демонстрируют предвзятую дифференцировку в Th27 вместо Th2 и Th3 клеток, а медиаторы воспаления, секретируемые последними клетками, могут, в свою очередь, влиять на стромальные клетки или другие популяции окружающей среды (73). Развитие клеток Th27 зависит от основного фактора транскрипции лейциновой молнии ATF-подобного (BATF) фактора транскрипции (74), но почему его экспрессия может увеличиваться с возрастом, неясно.Точно так же CD8 + CD28 — Т-клетки памяти, которые накапливаются у пожилых людей, также могут быть источником воспалительных цитокинов (68, 69), которые влияют на функцию стромальных элементов. Конкретные клетки и порядок, в котором происходят возрастные изменения в них, могут различаться у разных людей в результате различий в генетическом фоне и воздействии окружающей среды. Однако, как только эффекты старения проявляются в одной или нескольких целевых популяциях, может начаться порочный круг, ведущий к нисходящей спирали все более ослабленной иммунной функции (рисунок).
Сила иммунного ответа снижается с возрастом.Множественные возрастные изменения могут влиять на состав и функцию лимфоцитов во вторичных лимфоидных тканях. CD4 + Th-клетки обнаруживают дефекты активации и повышенную дифференцировку в Th27-клетки. CD8 + Т-клетки подвергаются олигоклональной экспансии и потере CD28 у людей и проявляют нарушенную функцию. Количество В-клеток, которые реагируют на грипп, снижается, а авидность антител в ответ на углеводные антигены снижается.Кроме того, тканевая среда включает повышенную концентрацию воспалительных цитокинов, которые могут продуцироваться стромальными элементами, дендритными клетками или стареющими В- и Т-клетками. Повышенное количество клеток памяти, которые занимают тканевые ниши и воспалительную среду, в свою очередь, может поставить под угрозу способность наивных В- и Т-клеток, мигрирующих из костного мозга и тимуса, оседать в ткани. Вместе эти изменения приводят к снижению иммунной функции у пожилых людей.
Внутриклеточные изменения в развивающихся и зрелых лимфоцитах
Анализ стволовых клеток и клеток-предшественников из различных тканей показал, что старение часто приводит к нарушению регуляции сходных молекулярных путей (75).Например, изменения пути PI3K часто проявляются стареющими клетками. В соответствии с этим наблюдением, HSCs истощаются из-за накопления ROS у мышей, у которых удален FOXO, ключевой нижестоящий компонент PI3K (76). Уровни ROS в клетках также могут регулироваться киназой, мутированной при атаксии и телеангиэктазии (ATM), а возрастное снижение экспрессии ATM может привести к увеличению ROS в клетках (77, 78). Повышенная экспрессия белков-супрессоров опухолей, таких как p16 Ink4a и ARF, также происходит в стареющих клетках из нескольких тканей (79, 80).Экспрессия p16 Ink4a приводит к активации ретинобластомы, что приводит к ингибированию клеточного цикла, тогда как p19 Arf способствует активности p53, которая вызывает остановку клеточного цикла и / или апоптоз. У нас был особый интерес к пониманию того, почему качество лимфоидных предшественников снижается с возрастом, и недавние исследования показали, что экспрессия Ink4a и Arf увеличивается в про-В-клетках старых мышей и что подавление их экспрессии может частично обратить вспять эффекты старения (81).Мы также наблюдали повышенную экспрессию Ink4a , но не Arf , в ETP и их потомстве DN (82).
Другие возрастные изменения могут быть более специфичными для системы кроветворения. Например, предполагается, что измененная экспрессия различных факторов транскрипции B-линии лежит в основе снижения B-лимфопоэза (83). В последнее время интерес сосредоточен на BATF, экспрессия которого наиболее высока в системе кроветворения, в снижении количества лимфоидно-зависимых HSC во время старения.Ван и его коллеги продемонстрировали, что уровни BATF увеличиваются в HSC в ответ на повреждение ДНК и что это приводит к дифференцировке HSC с лимфоидным смещением за счет их самообновления (27). Это особенно интересное открытие, потому что оно обеспечивает молекулярный механизм связанного с возрастом снижения количества лимфоидно-зависимых HSC, обсужденных выше.
Несмотря на то, что большое внимание уделяется стволовым клеткам и клеткам-предшественникам, старение также влияет на паттерны экспрессии генов в зрелых B- и T-клетках.Как обсуждалось ранее, рекомбинация переключения классов нарушается в стареющих В-клетках мыши и человека из-за снижения экспрессии ферментов, таких как AID (53, 84). Аберрантная передача сигналов Т-клетками также была связана со старением (48, 85), и список нерегулируемых генов продолжает расти, как указано в нескольких недавних отчетах (86-88), два из которых были посвящены измененной экспрессии фосфатаз с двойной специфичностью ( ДУСП). DUSP деактивируют киназы-мишени, в том числе те, которые находятся в пути MAPK, активность которых критична для активации, дифференцировки и продукции цитокинов Т-клеток.В одном исследовании сообщалось об индукции и устойчивой транскрипции DUSP4 в активированных Т-клетках памяти CD4 + у людей 65 лет и старше, что коррелировало с их измененной продукцией цитокинов и нарушенной способностью оказывать помощь В-клеткам (87). В последующем отчете из той же лаборатории описывается повышенная экспрессия DUSP6 в наивных CD4 + Т-клетках человека, что приводит к активации более низкой фракции Th-клеток, особенно в ответ на низкоаффинные стимулы (88).
Эти нарушения передачи сигналов в HSC, лимфоидных предшественниках и зрелых B- и T-клетках могут возникать, по крайней мере частично, в результате возрастных изменений в системной и локальной тканевой среде, описанной выше. Например, со временем воздействие воспалительной среды может вызвать эпигенетические модификации, которые влияют на экспрессию генов, необходимых для роста, выживания или дифференциации (89, 90). Наблюдение, что изменения статуса метилирования в результате дифференциальной экспрессии различных ДНК-метилтрансфераз (DNMTs) могут влиять на поведение HSC, согласуется с этой точкой зрения.В связи с этим потеря DNMT3a нарушает дифференцировку HSC, в то время как их количество увеличивается в костном мозге (91), а мыши с гипоморфной экспрессией DNMT1 демонстрируют относительно нормальный миелоэритроидный потенциал, но демонстрируют значительную блокировку лимфоидного развития (92). Тем не менее, клеточно-автономные события также могут способствовать старению. Таким образом, повторное деление клеток может привести к прогрессивному укорачиванию теломер, что, в свою очередь, приводит к повреждению ДНК, которое больше не может быть эффективно восстановлено из-за возрастных дефектов в механизмах репарации ДНК (75).Интересно, что дисфункция теломер была связана с изменениями митохондриального метаболизма (93), учитывая исследование, связывающее нарушение функции митохондрий и угнетение тимопоэза (94).
Омоложение стареющей иммунной системы
Конечная цель исследования старения иммунной системы — использовать полученную информацию для разработки стратегий стимулирования иммунитета у пожилых людей (суммированных в таблице). Как обсуждалось выше, был идентифицирован ряд молекул, аберрантная экспрессия которых способствует старению, и нацеливание на эти молекулы может потенциально замедлить или обратить вспять процесс старения.Например, фармакологическое ингибирование Cdc42, маленькой ГТФазы Rho, повышенная экспрессия которой была связана со старением HSC мышей, с помощью селективного ингибитора активности Cdc42 омолаживала HSC (95), и другие исследования показали потенциал антиоксидантов для улучшения функции старых ГСК (76, 96). По мере определения дополнительных возрастных изменений в экспрессии факторов транскрипции, промежуточных продуктов передачи сигналов, регуляторов клеточного цикла и микроРНК (97, 98), вероятно, появятся новые фармакологические вмешательства.В связи с этим повышенная экспрессия DUSP6 в наивных CD4 + Т-клетках, описанная выше, была связана с возрастным снижением экспрессии miR-181a (88).
Таблица 1
Возможные вмешательства для омоложения стареющей иммунной системы
Из-за ключевой роли Т-лимфоцитов в иммунном ответе и явного влияния старения на зрелые клетки CD4 + и CD8 + , омоложение Инволютивный тимус для пополнения пула периферических Т-клеток представляет значительный интерес.Полное обсуждение различных гормонов и факторов роста было рассмотрено в других источниках (99, 100), но существует значительный интерес к использованию классических эндокринных гормонов, таких как GH и IGF-1, а также других агентов, таких как IL-7 и FGF7 для стимуляции тимопоэза (рисунок).
Избранные стратегии омоложения инволютивного тимуса.Способность некоторых гормонов и факторов роста омолаживать инволютивную вилочковую железу была проверена в различных доклинических и клинических испытаниях.Многие из этих факторов можно разделить на три категории. Те, что в первом (i), такие как IL-7, связываются с предшественниками в костном мозге и тимусе и оказывают лишь умеренное влияние на тимопоэз. Существует мало доказательств того, что IL-7 влияет на стромальные клетки тимуса. Вместо этого преимущество IL-7 может заключаться в его способности стимулировать выживание / размножение периферических Т-клеток. Вторая категория (ii) включает гормоны, такие как GH, которые, как было продемонстрировано в доклинических и клинических испытаниях, стимулируют тимопоэз и увеличивают размер тимуса.Многие эффекты GH опосредуются индукцией IGF-1. IGF-1 может связываться с рецепторами стромы тимуса и тимоцитов, хотя его действие в основном опосредуется воздействием на первые клетки. Факторы, происходящие из стромальных клеток, предположительно затем действуют на тимоциты (изогнутая стрелка). Третья категория факторов (iii), представленная FGF7, связывается со стромальными клетками, но не с тимоцитами. Факторы, индуцируемые стромальными клетками, затем действуют на тимоциты (изогнутая стрелка), и мы недавно продемонстрировали, что эффекты включают подавление Ink4a в ETPs (82).Были оценены тимопоэтические эффекты нескольких дополнительных факторов, и для получения дополнительной информации следует обращаться к недавним подробным обзорам (99, 100).
GH и IGF-1 связываются с рецепторами, экспрессируемыми на тимоцитах (101) и эпителиальных клетках тимуса (102), и многочисленные исследования (42) показали, что размер тимуса увеличивается у старых мышей, которым вводили один из этих гормонов (101, 103). Эти доклинические данные послужили основой для клинических испытаний на людях, чтобы определить, может ли ежедневный прием гормона роста в течение одного года омолодить тимус у ВИЧ-инфицированных взрослых.Несмотря на низкую вирусную нагрузку, у участников этого исследования было низкое количество Т-лимфоцитов CD4 + . Обработка GH приводила к увеличению массы тимуса, увеличению выхода тимуса, как измерено с помощью кругов вырезания реаранжировки рецепторов Т-клеток в циркулирующих Т-клетках, и к увеличению числа наивных Т-клеток CD4 + . Многие эффекты GH опосредованы индукцией продукции IGF-1, и повышенные уровни IGF-1 у пациентов, получавших GH, соответствовали этому. Введение IGF-1 старым мышам усиливает тимопоэз преимущественно за счет воздействия на эпителиальные клетки тимуса, а не на тимоциты (104).Последние наблюдения предполагают, что GH у людей приводил к индукции IGF-1, который функционировал аналогичным образом. Важно отметить, что эффекты гормона роста не были специфичными для тимуса, поскольку у субъектов также было увеличено количество наивных периферических CD4 + Т-клеток (105).
В отличие от GH и IGF-1, которые увеличивают количество клеток тимуса примерно в два раза у мышей (101), FGF7 особенно примечателен тем, что его введение старым мышам приводит к обновлению микроокружения тимуса, увеличению количества ETP, и восстановление клеточности тимуса до уровней, наблюдаемых у молодых (106, 107).FGF7, также известный как фактор роста кератиноцитов и продаваемый как Kepivance (палифермин; Биовитрум), одобрен FDA для лечения мукозита полости рта у пациентов, проходящих миелотоксическую терапию. Мы предположили, что усиление тимопоэза у старых мышей, получавших FGF7, происходило из-за того, что сигналы от омоложенного микроокружения, в свою очередь, снижали экспрессию Ink4a в ETP. Как и предполагалось, уровни экспрессии Ink4a в ETP и DN-клетках, собранных от мышей, обработанных FGF7, были подавлены, и эти клетки продемонстрировали усиленную пролиферацию (82).Эти наблюдения согласуются с недавним отчетом, показывающим, что условная делеция Ink4a в тимоцитах DN может значительно замедлить инволюцию тимуса (108). Таким образом, будет интересно идентифицировать фактор (ы), высвобождаемый из стимулированных FGF7 эпителиальных клеток тимуса, которые затем действуют на старые ETP и DN-клетки, поскольку они могут иметь терапевтический потенциал.
Стратегии, ориентированные на зрелые В- и Т-клетки, также могут иметь значение для стимулирования иммунитета у пожилых людей. Например, если наивные лимфоциты не могут эффективно размещаться в селезенке, потому что ниши заняты клетками памяти, удаление последних клеток может создать пространство.Истощение зрелых лимфоцитов может иметь обратную связь с первичными лимфоидными органами, поскольку отмена зрелых В-клеток у стареющих мышей, как сообщается, стимулирует первичный В-лимфопоэз костного мозга (109). Также возможно воздействовать на определенные пути в старых лимфоцитах. Например, в доклинических исследованиях было показано, что ингибирование mTOR, промежуточного звена пути PI3K, рапамицином стимулирует Т-клеточные ответы CD8 + (110). Нацеливание на экспрессию DUSP4 (87) или DUSP6 (88) в старых Т-клетках памяти или наивных CD4 + Т-клетках, соответственно, также может иметь терапевтический потенциал.В подтверждение этого, снижение уровней DUSP6 за счет увеличения экспрессии miR-181a или репрессивной активности с помощью аллостерического ингибитора BCI улучшило ответную реакцию старых наивных CD4 + Т-клеток (88).
Коррекция возрастной недостаточности предшественников лимфоцитов или зрелых Т- и В-клеток может привести к значительному восстановлению иммунной функции у пожилых людей. Однако эти клетки по-прежнему будут находиться в старом микросреде, что может в конечном итоге ослабить их потенциал созревания или функционирования.В соответствии с этой точкой зрения, Хейнс и его коллеги (111) обнаружили, что CD4 + Т-клетки, генерируемые из старых HSC, функционируют у молодых, но не у старых хозяев, что подразумевает, что стареющая тимусная или периферическая микросреда критически влияют на степень, в которой омоложение иммунной системы может происходить. В связи с этим может потребоваться оптимальное вмешательство, направленное на устранение воздействия старения на несколько клеточных мишеней.
Подходы к замедлению или обращению вспять старения должны быть широко доступны и применимы к большой когорте.В дополнение к фармакологическим вмешательствам этим критериям также может соответствовать ограничение калорийности (CR). Сообщалось, что CR оказывает множество положительных эффектов на иммунную систему как грызунов, так и нечеловеческих приматов, включая задержку накопления стареющих Т-клеток (112) и стимуляцию тимопоэза (113). Этот последний эффект поначалу вызывает недоумение, поскольку CR, как сообщается, снижает секрецию IGF-1 (114), а низкие уровни IGF-1, как обсуждалось выше, были связаны с инволюцией тимуса.Однако CR может также увеличивать уровни GH (114), которые могут быть тимопоэтическими, или могут работать через IGF-1-независимые пути. Например, сообщалось, что CR блокирует возрастное повышение проадипогенного главного регулятора тимуса, PPARγ (113). В дополнение к дальнейшим исследованиям, чтобы улучшить наше понимание того, как CR влияет на иммунную систему, нам также необходимо узнать больше о том, когда он должен начинаться, учитывая сообщение о том, что положительные эффекты наблюдались, когда они начинались у взрослых, но не были очевидными, когда они начались в приматы препубертатного или пожилого возраста (112).Наконец, хотя CR особенно привлекателен, поскольку это неинвазивный подход, заставить большое количество людей принять этот режим может быть непросто.
Предостережения при омоложении иммунной системы
Исследования, рассмотренные выше, предоставляют подтверждающие данные о том, что фармакологическая стимуляция иммунитета у пожилых людей возможна, и предполагают, что такие вмешательства могут быть применены к большой группе людей. Однако по мере развития области необходимо учитывать несколько моментов.Во-первых, как долго нужно вводить агенты и сколько необходимо омоложения, чтобы наблюдать положительное влияние на иммунную функцию? Эти проблемы имеют отношение к использованию GH, IGF-1 и FGF7 для стимуляции тимуса, поскольку их эффекты временны и тимус возвращается к своему прежнему размеру после прекращения лечения. Еще одно предостережение заключается в том, что такие факторы, как GH, IGF-1 и FGF7, обладают широко распространенными системными эффектами из-за экспрессии их рецепторов на клетках во многих тканях.Проблема с использованием некоторых агентов заключается в том, что неопластические клетки могут также экспрессировать рецепторы, что приводит к росту опухоли (115). Таким образом, как и любое лекарство, использование этих гормонов для омоложения тимуса должно быть сбалансировано с потенциальными побочными эффектами. Также крайне важно обеспечить нормальное функционирование омоложенной иммунной системы. В частности, будет важно установить, что эффекторные популяции, которые развиваются, были надлежащим образом толеризованы и не являются аутореактивными. Тот факт, что многие аутоиммунные заболевания возникают в позднем взрослом возрасте, делает эту проблему особенно важной (116).
Выводы и перспективы
Как указано выше, сейчас известно огромное количество клеточных изменений, которые происходят в стареющей иммунной системе, и лежащих в их основе молекулярных событий. Таким образом, есть основания ожидать, что эта информация будет по-прежнему использоваться в терапии для омоложения стареющей иммунной системы.
Вероятно, что влияние старения на иммунную систему не будет одинаковым для разных людей. Таким образом, конечной целью будет определение ключевых биомаркеров и проведение простых лабораторных тестов для определения профиля старения каждого человека.Такую информацию затем можно было бы использовать для разработки индивидуального подхода, при котором целевые вмешательства могли бы быть направлены на специфический дефицит старения человека. Однако какой бы стандарт лечения ни был принят в конечном итоге для стимулирования иммунитета, не обязательно делать акцент на увеличении продолжительности жизни. Скорее, цель состоит в том, чтобы увеличить продолжительность здорового образа жизни, определяемую как годы здоровой жизни (117).
Благодарности
Работа авторской лаборатории поддержана грантом NIH AG034875.
Сноски
Конфликт интересов: Авторы заявили, что конфликта интересов не существует.
Цитата для этой статьи: J Clin Invest. 2013; 123 (3): 958–965. DOI: 10,1172 / JCI64096.
Ссылки
1. Томпсон У. Смертность, связанная с гриппом и респираторно-синцитиальным вирусом в Соединенных Штатах. ДЖАМА. 2003. 289 (2): 179–186. DOI: 10.1001 / jama.289.2.179. [PubMed] [CrossRef] [Google Scholar] 2. McElhaney JE, Dutz JP.Лучшие вакцины против гриппа для пожилых людей: что для этого нужно? J Infect Dis. 2008. 198 (5): 632–634. DOI: 10,1086 / 5. [PubMed] [CrossRef] [Google Scholar] 3. Райхерт Т., Симонсен Л., Шарма А., Пардо С., Федсон Д., Миллер М. Грипп и повышение смертности зимой в Соединенных Штатах. Am J Epidemiol. 2004. 160 (5): 492–502. DOI: 10,1093 / AJE / kwh327. [PubMed] [CrossRef] [Google Scholar] 4. Флеминг Д., Эллиот А. Влияние гриппа на здоровье и использование медицинских услуг пожилыми людьми. Вакцина.2005; 23: S1 – S9. DOI: 10.1016 / j.vaccine.2005.04.018. [PubMed] [CrossRef] [Google Scholar] 5. Харди Р.Р., Кинкейд П.В., Доршкинд К. Протеиновая природа клеток в линии B-лимфоцитов. Иммунитет. 2007. 26 (6): 703–714. DOI: 10.1016 / j.immuni.2007.05.013. [PubMed] [CrossRef] [Google Scholar] 8. Линтон П.Дж., Доршкинд К. Возрастные изменения в развитии и функции лимфоцитов. Nat Immunol. 2004. 5 (2): 133–139. DOI: 10,1038 / NI1033. [PubMed] [CrossRef] [Google Scholar] 9. Линч Х., Голдберг Дж., Чиджи А., Ван ден Бринк М., Бойд Р., Семповски Г.Инволюция тимуса и восстановление иммунитета. Trends Immunol. 2009. 30 (7): 366–373. DOI: 10.1016 / j.it.2009.04.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Steinmann GG. Изменения вилочковой железы человека при старении. Curr Top Pathol. 1986; 75: 43–48. [PubMed] [Google Scholar] 11. Росси DJ и др. Внутренние изменения клеток лежат в основе старения гемопоэтических стволовых клеток. Proc Natl Acad Sci U S. A. 2005; 102 (26): 9194–9199. DOI: 10.1073 / pnas.0503280102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12.Зедиак В.П., Майяр И., Бхандула А. Множественные претимические дефекты лежат в основе возрастной потери компетентности в отношении Т-предшественников. Кровь. 2007. 110 (4): 1161–1167. DOI: 10.1182 / кровь-2007-01-071605. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Тауб Д., Мерфи В., Лонго Д. Омоложение стареющего тимуса: пути, опосредованные гормоном роста, и пути передачи сигналов, опосредованные грелином. Curr Opin Pharmacol. 2010. 10 (4): 408–424. DOI: 10.1016 / j.coph.2010.04.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14.Song Z и др. Изменения системной среды являются основной причиной нарушения В- и Т-лимфопоэза у мышей с дисфункцией теломер. Кровь. 2010. 115 (8): 1481–1489. DOI: 10.1182 / кровь-2009-08-237230. [PubMed] [CrossRef] [Google Scholar] 15. de Haan G, Van Zant G. Динамические изменения количества гемопоэтических стволовых клеток мышей во время старения. Кровь. 1999. 93 (10): 3294–3301. [PubMed] [Google Scholar] 16. Харрисон Д., Астл С., Стоун М. Число и функции трансплантируемых примитивных иммуногематопоэтических стволовых клеток.Влияние возраста. J Immunol. 1989. 142 (11): 3833–3840. [PubMed] [Google Scholar] 17. Панг В. и др. Гемопоэтические стволовые клетки костного мозга человека с возрастом увеличиваются по частоте и становятся миелоидными. Proc Natl Acad Sci U S. A. 2011; 108 (50): 20012–20017. DOI: 10.1073 / pnas.1116110108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Sudo K, Ema H, Morita Y, Nakauchi H. Возрастные характеристики гемопоэтических стволовых клеток мыши. J Exp Med. 2000. 192 (9): 1273–1280. DOI: 10.1084 / jem.192.9.1273.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Чо Р., Зибург Х., Мюллер-Зибург С. Новый механизм старения гемопоэтических стволовых клеток: старение изменяет клональный состав компартмента стволовых клеток, но не отдельных стволовых клеток. Кровь. 2008. 111 (12): 5553–5561. DOI: 10.1182 / кровь-2007-11-123547. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 20. Muller-Sieburg C, Cho R, Karlsson L, Huang J, Sieburg H. Гематопоэтические стволовые клетки с миелоидным смещением обладают большой способностью к самообновлению, но производят уменьшенное лимфоидное потомство с нарушенной реактивностью IL-7.Кровь. 2004. 103 (11): 4111–4118. DOI: 10.1182 / кровь-2003-10-3448. [PubMed] [CrossRef] [Google Scholar] 21. Challen G, Boles N, Chambers S, Goodel M. Отдельные подтипы гемопоэтических стволовых клеток по-разному регулируются TGF-β1. Стволовая клетка. 2010. 6 (3): 265–278. DOI: 10.1016 / j.stem.2010.02.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 22. Морита Й., Эма Х., Накаучи Х. Гетерогенность и иерархия внутри самого примитивного компартмента гемопоэтических стволовых клеток. J Exp Med. 2010. 207 (6): 1173–1182.DOI: 10.1084 / jem.20091318. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Бирман I и др. Функционально отличные гемопоэтические стволовые клетки модулируют потенциал гемопоэтических клонов во время старения посредством механизма клональной экспансии. Proc Natl Acad Sci U S. A. 2010; 107 (12): 5465–5470. DOI: 10.1073 / pnas.1000834107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Dykstra B, Olthof S, Schreuder J, Ritsema M, De Haan G. Клональный анализ выявляет множественные функциональные дефекты старых гемопоэтических стволовых клеток мышей.J Exp Med. 2011. 208 (13): 2691–2703. DOI: 10.1084 / jem.20111490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Солана Р., Таразона Р., Гайосо И., Лесур О., Дюпюи Г., Фулоп Т. Врожденное иммунное старение: влияние старения на клетки и рецепторы врожденной иммунной системы человека. Semin Immunol. 2012; 24 (5): 331–341. DOI: 10.1016 / j.smim.2012.04.008. [PubMed] [CrossRef] [Google Scholar] 27. Ван Дж. И др. Контрольная точка дифференцировки ограничивает самообновление гемопоэтических стволовых клеток в ответ на повреждение ДНК.Клетка. 2012. 148 (5): 1001–1014. DOI: 10.1016 / j.cell.2012.01.040. [PubMed] [CrossRef] [Google Scholar] 28. Miller JP, Allman D. Снижение B-лимфопоэза у старых мышей отражает потерю очень ранних предшественников B-линии. J Immunol. 2003. 171 (5): 2326–2330. [PubMed] [Google Scholar] 29. Мин Х, Монтесино-Родригес Э., Доршкинд К. Влияние старения на переход общих лимфоидных предшественников к про-В-клеткам. J Immunol. 2006. 176 (2): 1007–1012. [PubMed] [Google Scholar] 30. Шервуд Э.М., Сюй В., Кинг А.М., Бломберг Б.Б., Райли Р.Л.Снижение экспрессии суррогатных легких цепей в предшественниках В-клеток от стареющих мышей BALB / c связано со снижением белков E2A. Mech Aging Develop. 2000. 118 (1–2): 45–59. DOI: 10.1016 / S0047-6374 (00) 00157-3. [PubMed] [CrossRef] [Google Scholar] 31. Джонсон К.М., Оуэн К., Витте П.Л. Старение и переходы в развитии в линии B-клеток. Int Immunol. 2002. 14 (11): 1313–1323. DOI: 10.1093 / intimm / dxf092. [PubMed] [CrossRef] [Google Scholar] 32. Мин Х, Монтесино-Родригес Э., Доршкинд К. Снижение потенциала развития предшественников интратимических Т-клеток с возрастом.J Immunol. 2004. 173 (1): 245–250. [PubMed] [Google Scholar] 33. Хенг Т.С.П., Голдберг Г.Л., Грей Д.Х.Д., Сазерленд Дж.С., Чиджи А.П., Бойд Р.Л. Влияние кастрации на развитие тимоцитов в двух различных моделях инволюции тимуса. J Immunol. 2005. 175 (5): 2982–2993. [PubMed] [Google Scholar] 34. Мин Х, Монтесино-Родригес Э., Доршкинд К. Влияние старения на раннее развитие В- и Т-клеток. Immunol Rev.2005; 205: 7-17. DOI: 10.1111 / j.0105-2896.2005.00263.x. [PubMed] [CrossRef] [Google Scholar] 35. Allman D, et al.Тимопоэз не зависит от общих лимфоидных предшественников. Nat Immunol. 2003. 4 (2): 168–174. DOI: 10,1038 / NI878. [PubMed] [CrossRef] [Google Scholar] 36. Лабри Дж. Э., Сах А. П., Оллман Д. М., Канкро М. П., Герштейн Р. М.. Изменения микросреды костного мозга лежат в основе снижения RAG-опосредованной рекомбинации и генерации В-клеток у старых мышей. J Exp Med. 2004. 200 (4): 411–423. DOI: 10.1084 / jem.20040845. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 37. Стефан Р.П., Рейли ЧР, Витте П.Л. Нарушение способности стромальных клеток костного мозга поддерживать В-лимфопоэз.Кровь. 1998. 91 (1): 75–88. [PubMed] [Google Scholar] 38. Мэнли Н., Ричи Е., Блэкберн С., Конди Б., Сейдж Дж. Структура и функция микросреды тимуса. Передние биоски. 2011; 17: 2461–2477. DOI: 10,2741 / 4065. [PubMed] [CrossRef] [Google Scholar] 39. Чинн И.К., Блэкберн СС, Мэнли Н.Р., Семповски Г.Д. Изменения первичных лимфоидных органов с возрастом. Semin Immunol. 2012. 24 (5): 309–320. DOI: 10.1016 / j.smim.2012.04.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Диксит В. Влияние иммуно-метаболических взаимодействий на возрастную гибель тимуса и старение Т-клеток.Semin Immunol. 2012. 24 (5): 321–330. DOI: 10.1016 / j.smim.2012.04.002. [PubMed] [CrossRef] [Google Scholar] 41. Naveiras O, Nardi V, Wenzel P, Hauschka P, Fahey F, Daley GQ. Адипоциты костного мозга как негативные регуляторы кроветворного микроокружения. Природа. 2009. 460 (7252): 259–264. DOI: 10,1038 / природа08099. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42. Доршкинд К, Всадник Н.Д. Роль пролактина, гормона роста, инсулиноподобного фактора роста-I и гормонов щитовидной железы в развитии и функции лимфоцитов: выводы из генетических моделей гормонов и дефицита рецепторов гормонов.Endocr Rev.2000; 21 (3): 292–312. DOI: 10.1210 / er.21.3.292. [PubMed] [CrossRef] [Google Scholar] 43. Ламбертс С., ван ден Бельд А., ван дер Лели А. Эндокринология старения. Наука. 1997. 278 (5337): 419–424. DOI: 10.1126 / science.278.5337.419. [PubMed] [CrossRef] [Google Scholar] 44. Джеймисон Б.Д. и др. Генерация функциональных тимоцитов у взрослого человека. Иммунитет. 1999. 10 (5): 569–575. DOI: 10.1016 / S1074-7613 (00) 80056-4. [PubMed] [CrossRef] [Google Scholar] 45. Николич-Жугич Дж., Ли Дж., Урлауб Дж. Л., Ренкема К. Р., Смитхи М. Дж..Возрастные изменения гомеостаза Т-лимфоцитов CD8 и иммунитета к инфекции. Semin Immunol. 2012. 24 (5): 356–364. DOI: 10.1016 / j.smim.2012.04.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 46. Clambey E, White J, Kappler J, Marrack P. Идентификация двух основных типов связанных с возрастом клональных объяснений CD8 с сильно расходящимися свойствами. Proc Natl Acad Sci U S. A. 2008; 105 (35): 12997–13002. DOI: 10.1073 / pnas.0805465105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Эффрос РБ.Потеря экспрессии CD28 на Т-лимфоцитах: маркер репликативного старения. Dev Comp Immunol. 1997. 21 (6): 471–478. DOI: 10.1016 / S0145-305X (97) 00027-X. [PubMed] [CrossRef] [Google Scholar] 48. Goronzy JJ, Li G, Yu M, Weyand CM. Сигнальные пути в старых Т-клетках — отражение дифференцировки Т-клеток, клеточного старения и окружающей среды хозяина. Semin Immunol. 2012. 24 (5): 365–372. DOI: 10.1016 / j.smim.2012.04.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Стриндхолл Дж. И др. Отсутствие профиля иммунного риска у лиц, достигших 100-летнего возраста: результаты шведского лонгитюдного иммунного исследования NONA.Exp Gerontol. 2007. 42 (8): 753–761. DOI: 10.1016 / j.exger.2007.05.001. [PubMed] [CrossRef] [Google Scholar] 50. McElhaney J, et al. Неудовлетворенная потребность пожилых людей: как иммунное старение, инфекция ЦМВ, сопутствующие заболевания и слабость являются проблемой для разработки более эффективных противогриппозных вакцин. Вакцина. 2012. 30 (12): 2060–2067. DOI: 10.1016 / j.vaccine.2012.01.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Ши Ю., Ямадзаки Т., Окубо Ю., Уэхара Ю., Суган К., Агемацу К. Регулирование гуморальной иммунной защиты пожилых людей против пневмококковых бактерий с помощью B-клеток памяти IgM.J Immunol. 2005. 175 (5): 3262–3267. [PubMed] [Google Scholar] 53. Frasca D, et al. Старение подавляет фактор транскрипции E2A, индуцированную активацией цитидиндезаминазу и переключение класса Ig в В-клетках человека. J Immunol. 2008. 180 (8): 5283–5290. [PubMed] [Google Scholar] 55. Sasak S, et al. Ограниченная эффективность инактивированной вакцины против гриппа у пожилых людей связана со снижением выработки специфичных для вакцины антител. J Clin Invest. 2011. 121 (8): 3109–3119. DOI: 10.1172 / JCI57834. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56.Усингер В., Лукас А. Авидность как детерминанта защитной эффективности человеческих антител к пневмокковым капсульным полисахаридам. Infect Immun. 1999. 67 (5): 2366–2370. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Westerink M, Schroeder HJ, Nahm M. Иммунные ответы на пневмококковые вакцины у детей и взрослых: обоснование возрастной вакцинации. Aging Dis. 2012. 3 (1): 51–67. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Romero-Steiner S, et al. Снижение функциональной активности антител против Streptococcus pneumoniae у вакцинированных пожилых людей сильно коррелирует со снижением авидности антител IgG.Clin Infect Dis. 1999. 29 (2): 281–288. DOI: 10,1086 / 520200. [PubMed] [CrossRef] [Google Scholar] 60. Бирджанди С., Ипполито Дж., Рамадораи А., Витте П.Л. Изменения в макрофагах маргинальной зоны и В-клетках маргинальной зоны у старых мышей. J Immunol. 2011; 186 (6): 3441–3451. DOI: 10.4049 / jimmunol.1001271. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Баумгарт Н. Двойная жизнь клетки B-1: самореактивность выбирает защитные эффекторные функции. Nat Rev Immunol. 2011; 11 (1): 34–46. DOI: 10,1038 / NRI2901.[PubMed] [CrossRef] [Google Scholar] 62. Хаас К.М., По Дж.С., Стибер Д.А., Теддер Т.Ф. Клетки B-1a и B-1b предъявляют различные требования к развитию и играют уникальную функциональную роль в врожденном и адаптивном иммунитете к S. pneumoniae. Иммунитет. 2005. 23 (1): 7–18. DOI: 10.1016 / j.immuni.2005.04.011. [PubMed] [CrossRef] [Google Scholar] 63. Гриффин Д.О., Холодик Н.Е., Ротштейн Т.Л. Клетки B1 человека в пуповине и периферической крови взрослых экспрессируют новый фенотип CD20 + CD27 + CD43 + CD70 — .. J Exp Med. 2011. 208 (1): 67–80. DOI: 10.1084 / jem.20101499. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64. Franceschi C, et al. Воспаление и противовоспалительное действие: системный взгляд на старение и долголетие появился в исследованиях на людях. Mech Aging Develop. 2007. 128 (1): 92–105. DOI: 10.1016 / j.mad.2006.11.016. [PubMed] [CrossRef] [Google Scholar] 65. Коппе Дж. П., Деспрез П. И., Кртолика А., Кампизи Дж. Секреторный фенотип, связанный со старением: темная сторона подавления опухоли. Анну Рев Патол.2010; 5: 99–118. DOI: 10.1146 / annurev-pathol-121808-102144. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 66. Кавана М., Вейанд С., Горонзи Дж. Хроническое воспаление и старение: повреждение ДНК нарушает баланс. Curr Opin Immunol. 2012. 24 (4): 488–493. DOI: 10.1016 / j.coi.2012.04.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Родье Ф. и др. Передача сигналов о стойком повреждении ДНК запускает секрецию воспалительных цитокинов, связанных со старением. Nat Cell Biol. 2009. 11 (8): 973–979. DOI: 10,1038 / ncb1909.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Эффрос РБ. Роль репликативного старения Т-лимфоцитов в эффективности вакцины. Вакцина. 2007. 25 (4): 599–604. DOI: 10.1016 / j.vaccine.2006.08.032. [PubMed] [CrossRef] [Google Scholar] 69. Weng N, Akbar A, Gornzy J. CD28 (-) T-клетки: их роль в возрастном снижении иммунной функции. Тенденции Genet. 2009. 30 (7): 306–312. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Maue AC, Yager E, Swain S, Woodland D, Blackman M, Haynes L. Иммуносенесценция Т-клеток: уроки, извлеченные из мышиных моделей старения.Curr Opin Immunol. 2009. 30 (7): 301–305. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Larbi A, Pawelec G, Wong SC, Goldeck D, Tai JJ, Fulop T. Влияние возраста на передачу сигналов Т-клеток: общий дефект или специфические изменения? Aging Res Rev. 2011. 10 (3): 370–378. DOI: 10.1016 / j.arr.2010.09.008. [PubMed] [CrossRef] [Google Scholar] 73. Хуанг М.С., Ляо Дж.Дж., Бонасера С., Лонго Д.Л., Гетцл Э.Дж. Ядерный фактор-каппаВ-зависимая реверсия вызванных старением изменений в цитокинах Т-клеток. FASEB J. 2008; 22 (7): 2142–2150.DOI: 10.1096 / fj.07-103721. [PubMed] [CrossRef] [Google Scholar] 75. Сахин Э., ДеПиньо РА. Связывание функционального снижения теломер, митохондрий и стволовых клеток во время старения. Природа. 2010. 464 (7288): 520–528. DOI: 10,1038 / природа08982. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Tothova Z, Gilliland DG. Факторы транскрипции FoxO и гомеостаз стволовых клеток: выводы из системы кроветворения. Стволовая клетка. 2007. 1 (2): 140–152. DOI: 10.1016 / j.stem.2007.07.017. [PubMed] [CrossRef] [Google Scholar] 77.Feng Z, Hu W, Teresky A, Hernando E, Cordon-Cardo C, Levine A. Снижение функции p53 в процессе старения: возможный механизм увеличения заболеваемости опухолями у пожилых людей. Proc Natl Acad Sci U S. A. 2007; 104 (42): 16633–16638. DOI: 10.1073 / pnas.0708043104. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Ито К. и др. Активные формы кислорода действуют через p38 MAPK, ограничивая продолжительность жизни гематопиетических стволовых клеток. Nat Med. 2006. 12 (4): 446–451. DOI: 10,1038 / нм1388. [PubMed] [CrossRef] [Google Scholar] 80.Шарплесс NE. Ink4a / Arf связывает старение и старение. . Exp Gerontol. 2004. 39 (11–12): 1751–1759. DOI: 10.1016 / j.exger.2004.06.025. [PubMed] [CrossRef] [Google Scholar] 81. Подписавший RAJ, Montecino-Rodriguez E, Witte ON, Dorshkind K. Старение и устойчивость к раку в лимфоидных предшественниках — это связанные процессы, обеспечиваемые p16 Ink4a и Arf. . Genes Dev. 2008. 22 (22): 3115–3120. DOI: 10.1101 / gad.1715808. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Берент-Маоз Б., Монтесино-Родригес Э., подписант Р.А., Доршкинд К.Фактор роста фибробластов-7 частично обращает вспять старение предшественников тимоцитов мыши путем репрессии Ink4a. Кровь. 2012. 119 (24): 5715–5721. DOI: 10.1182 / кровь-2011-12-400002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Фраска Д., Нгуен Д., Райли Р., Бломберг Б. Снижение активности фактора транскрипции E12 и / или E47 в костном мозге, а также в селезенке старых мышей. J Immunol. 2003. 170 (2): 719–726. [PubMed] [Google Scholar] 84. Frasca D, Landin AM, Riley RL, Blomberg B. Механизмы снижения функции B-клеток у старых мышей и людей.J Immunol. 2008. 180 (5): 2741–2746. [PubMed] [Google Scholar] 85. Гарсия Г., Миллер Р. Возрастные дефекты сигнальных путей цитоскелета CD4 Т-клеток. Aging Res Rev.2011; 10 (1): 26–34. DOI: 10.1016 / j.arr.2009.11.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Лонг Д. и др. Профилирование одноклеточной сети мононуклеарных клеток периферической крови от здоровых доноров выявляет возрастные и расовые различия в активации иммунных сигнальных путей. J Immunol. 2012. 188 (4): 1717–1725.DOI: 10.4049 / jimmunol.1102514. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 87. Ю. М. и др. Подавление сигнала фосфатазой 4 с двойной специфичностью с возрастом ухудшает Т-клеточно-зависимые В-клеточные ответы. Proc Natl Acad Sci U S. A. 2012; 109 (15): 879–888. DOI: 10.1073 / pnas.1109797109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 88. Ли Г. и др. Снижение экспрессии miR-181a с возрастом снижает чувствительность Т-клеточного рецептора за счет увеличения активности DUSP6. Nat Med. 2012. 18 (10): 1518–1524. DOI: 10.1038 / нм.2963. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90. Рандо Т., Чанг Х. Старение, омоложение и эпигенетическое перепрограммирование: сброс часов старения. Клетка. 2012. 148 (1–2): 46–57. DOI: 10.1016 / j.cell.2012.01.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Broske A, et al. Метилирование ДНК защищает мультипотентность гемопоэтических стволовых клеток от ограничения миелоэриторидом. Нат Жене. 2009. 41 (11): 1207–1215. DOI: 10,1038 / нг.463. [PubMed] [CrossRef] [Google Scholar] 95. Флориан М. и др.Активность Cdc42 регулирует старение и омоложение гемопоэтических стволовых клеток. Стволовая клетка. 2012. 10 (5): 520–530. DOI: 10.1016 / j.stem.2012.04.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 96. Ито К. и др. Регулирование окислительного стресса с помощью АТМ необходимо для самообновления гемопоэтических стволовых клеток. Природа. 2004. 431 (7011): 997–1002. DOI: 10,1038 / природа02989. [PubMed] [CrossRef] [Google Scholar] 101. Монтесино-Родригес Э., Кларк Р., Доршкинд К. Влияние введения инсулиноподобного фактора роста и трансплантации костного мозга на тимопоэз у старых мышей.Эндокринология. 1998. 139 (10): 4120–4126. DOI: 10.1210 / en.139.10.4120. [PubMed] [CrossRef] [Google Scholar] 102. Kermani H, et al. Экспрессия оси гормона роста / инсулиноподобного фактора роста во время онтогенеза тимуса Balb / c и влияние гормона роста на дифференцировку Т-клеток ex vivo. Нейроиммуномодуляция. 2012. 19 (3): 137–147. DOI: 10,1159 / 000328844. [PubMed] [CrossRef] [Google Scholar] 103. Велняк Л., Сан Р., Мерфи В. Роль гормона роста в развитии и восстановлении Т-клеток. J Leuk Biol.2002. 71 (3): 381–387. [PubMed] [Google Scholar] 104. Чу Й и др. Экзогенный инсулиноподобный фактор роста 1 усиливает тимопоэз преимущественно за счет размножения эпителиальных клеток тимуса. Кровь. 2008. 112 (7): 2836–2846. DOI: 10.1182 / кровь-2008-04-149435. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 106. Мин Д., Паноскальцис-Мортари А., Куро-О М., Холландер Г.А., Блазар Б.Р., Вайнберг К.И. Устойчивый тимопоэз и улучшение функционального иммунитета, индуцированные введением экзогенного KGF на мышиных моделях старения.Кровь. 2007. 109 (6): 2529–2537. DOI: 10.1182 / кровь-2006-08-043794. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 107. Росси С.В. и др. Фактор роста кератиноцитов (KGF) усиливает постнатальное развитие Т-клеток за счет увеличения пролиферации и функции эпителиальных клеток тимуса. Кровь. 2007. 109 (9): 3803–3811. DOI: 10.1182 / кровь-2006-10-049767. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 109. Керен З. и др. Истощение B-клеток реактивирует B-лимфопоэз в BM и омолаживает B-линию при старении.Кровь. 2011. 117 (11): 3104–3112. DOI: 10.1182 / кровь-2010-09-307983. [PubMed] [CrossRef] [Google Scholar] 111. Eaton SM, Maue AC, Swain SL, Haynes L. Клетки-предшественники костного мозга от старых мышей генерируют CD4 T-клетки, которые хорошо функционируют в первичных ответах и ответах памяти. J Immunol. 2008. 181 (7): 4825–4831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Messaoudi I, et al. Оптимальное окно начала ограничения калорийности ограничивает его положительное влияние на старение Т-клеток у приматов. Ячейка старения. 2008. 7 (6): 908–919.DOI: 10.1111 / j.1474-9726.2008.00440.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 113. Yang H, Youm Y, Dixit V. Ингибирование адипогенеза тимуса за счет ограничения калорийности сочетается с уменьшением возрастной инволюции тимуса. J Immunol. 2009. 183 (5): 3040–3052. DOI: 10.4049 / jimmunol.02. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 114. Sonntag W и др. Плейотроические эффекты гормона роста и инсулиноподобного фактора роста (IGF) -1 на биологическое старение: выводы из животных с умеренным ограничением калорийности.J Gerontol A Biol Sci Med Sci. 1999; 54 (12): B521 – B538. DOI: 10.1093 / gerona / 54.12.B521. [PubMed] [CrossRef] [Google Scholar] 115. Поллак М. Инсулин и передача сигналов инсулиноподобного фактора роста при неоплазии. Нат Рев Рак. 2008. 8 (12): 915–928. DOI: 10,1038 / nrc2536. [PubMed] [CrossRef] [Google Scholar] 117. Доршкинд К., Монтесино-Родригес Э., подписавший Р.А. Старение иммунной системы: неужели когда-нибудь слишком стар, чтобы снова стать молодым? Nat Rev Immunol. 2009. 9 (1): 57–62. DOI: 10,1038 / NRI2471. [PubMed] [CrossRef] [Google Scholar]9 удивительных способов ослабления иммунной системы
Неудивительно, что частое мытье рук, полная вакцинация, достаточный сон и здоровое питание являются эффективными способы защиты от вирусов и других микробов.Вы можете не осознавать, что другие факторы в вашей жизни могут поставить под угрозу способность вашего тела защитить себя.
То, как вы проводите свободное время, уровень стресса, как часто вы пьете, сколько физической активности вы получаете, и даже воздух, которым вы дышите, может сказаться на вашей иммунной системе.
Стресс
По данным Национального института рака, длительные периоды интенсивного стресса могут повлиять на иммунную систему. Стресс заставляет мозг стимулировать выработку гормона кортизола, который ухудшает функцию Т-лимфоцитов, борющихся с инфекциями, — объясняет Джон Спэнглер, доктор медицины, профессор семейной и общественной медицины в Баптистском медицинском центре Уэйк Форест в Северной Каролине.
Поддержка друзей, расстановка приоритетов, регулярные занятия спортом и практика расслабляющих техник, таких как йога и тай-чи, могут помочь уменьшить стресс, говорит Национальный институт психического здоровья (NIMH).
Одиночество
Одиночество может ослабить вашу иммунную систему, согласно исследованию, опубликованному в Журнале нейроиммунологии в декабре 2014 года. Исследование, проведенное на крысах, показало, что повышенная тревожность, связанная с одиночеством, приводит к большему подавлению иммунной системы. система и более окислительный стресс, или повреждение, вызванное свободными радикалами.Исследование, опубликованное в журнале Psychological Science в феврале 2015 года, предполагает, что простое объятие кого-то может иметь эффект буферизации стресса и снизить восприимчивость к болезням.
Сидячий образ жизни
Согласно исследованию, опубликованному в Американском журнале профилактической медицины (American Journal of Preventive Medicine), со временем чрезмерное сидение и отказ от физических упражнений могут повлиять на способность вашего организма бороться с инфекциями. Независимо от возраста, пола и других вредных привычек, таких как курение и употребление алкоголя, малоподвижный образ жизни связан с повышенным риском преждевременной смерти.Исследование предупреждает, что в конечном итоге бездействие может привести к ослаблению иммунной системы, воспалениям и другим хроническим заболеваниям. NIMH рекомендует выделить 30 минут регулярных упражнений в свой распорядок дня.
Слишком много упражнений
Быть бездельником ослабляет вашу иммунную систему, но противоположная крайность также может сказаться. Согласно обзору, опубликованному в Acta Clinica Croatica за декабрь 2012 года, чрезмерные физические нагрузки, называемые синдромом перетренированности, могут истощить организм и сделать его более уязвимым для инфекций.Но исследование 2014 года показывает, что регулярная умеренная физическая активность может снизить восприимчивость к вирусам.
Никотин
Независимо от того, курите ли вы традиционные сигареты или электронные сигареты, вы все равно подвергаетесь воздействию никотина, который может оказать вредное воздействие на вашу иммунную систему. Никотин увеличивает уровень кортизола, одновременно снижая образование антител к В-клеткам и реакцию Т-клеток на антигены, — объясняет д-р Спанглер. Согласно результатам исследования на мышах, опубликованного в PLOS One в феврале 2015 года, пар от электронных сигарет может повредить легкие и сделать их более восприимчивыми к инфекции.Исследователи предупредили, что электронные сигареты небезопасны, потому что их пары содержат свободные радикалы, которые могут вызывать воспаление дыхательных путей и нарушать реакцию на бактерии и вирусы.
Ультрафиолетовое излучение
Растущие уровни определенных загрязнителей воздуха разрушают озоновый слой, увеличивая уровень вредного ультрафиолетового (УФ) излучения солнца. По данным Агентства по охране окружающей среды (EPA), это может привести к более высокому уровню заболеваемости раком кожи, катаракты и ослаблению иммунной системы.Всемирная организация здравоохранения предупреждает, что воздействие ультрафиолетовых лучей окружающей среды также может повлиять на клетки, ответственные за запуск иммунных ответов, повышая риск заражения и, возможно, снижая защиту от рака кожи. EPA рекомендует носить солнцезащитные очки, защитную одежду и солнцезащитный крем с SPF 30 или выше.
Диета
Диета с высоким содержанием насыщенных жиров ослабляет иммунную систему, а соль и сахар также могут иметь отрицательные эффекты, согласно обзору, опубликованному в журнале Nutrition Journal за июнь 2014 года.Согласно обзору, опубликованному в журнале Proceedings of the Nutrition Society, ожирение влияет на иммунную систему, уменьшая количество и функцию белых кровяных телец, необходимых для борьбы с инфекцией. Американская академия питания и диетологии подчеркивает, что правильное питание необходимо для здоровой иммунной системы.
Алкоголь
Даже один приступ чрезмерного употребления алкоголя может снизить реакцию иммунной системы на вторжение патогенов, говорит Спанглер. «Главный метаболит алкоголя, ацетальдегид, вероятно, нарушает функцию ресничек в легких, делая их более подверженными бактериальному и вирусному вторжению», — объясняет он.По его словам, алкоголь также ухудшает процесс атаки и разрушения бактерий и вирусов, и это подвергает людей, злоупотребляющих алкоголем, более высокому риску заражения.
Горе
Внезапное или трагическое событие может ослабить иммунную реакцию вашего организма, согласно NIMH. Например, потеря любимого человека может увеличить выработку нервных химикатов и гормонов, которые увеличивают риск более частых и тяжелых вирусных инфекций, таких как грипп, сообщает агентство. Согласно обзору, опубликованному в июне 2012 года в журнале Dialogues in Clinical NeuroSciences, тяжелая утрата связана с повышенным ответом кортизола и иммунным дисбалансом.Согласно NIMH, некоторые вакцины, включая прививку от гриппа, могут быть менее эффективными для тех, кто переживает тяжелую утрату.
Снижение антител и иммунитета к COVID-19 — чего волноваться?
Большинство людей знают, что анализ на антитела в крови человека может показать, есть ли у кого-то конкретное заболевание, например COVID-19. Эти антитела обеспечивают защиту от повторного заражения.
Но в статье, опубликованной в Медицинском журнале Новой Англии, исследователи обнаружили, что у людей, выздоровевших от COVID-19, уровень антител снижается наполовину каждые 36 дней.Означает ли это, что люди, вылечившиеся от COVID-19, потеряли иммунитет?
Я генетик, интересующийся врожденным иммунным ответом — частью иммунной системы, которая у нас есть при рождении — и тем, как клетки врожденного иммунитета «информируют» продуцирующие антитела клетки о патогене и о том, как его идентифицировать и уничтожить. Как я объясню, антитела важны для иммунитета, но не только они имеют значение.
Два плеча иммунной системы
Иммунная система состоит из двух частей: врожденного иммунитета и адаптивного — или приобретенного — иммунитета.
Врожденная иммунная система, которая включает белые кровяные тельца, называемые дендритными клетками, моноцитами и нейтрофилами, присутствует при рождении и мгновенно реагирует на захватчиков. Эта группа белых кровяных телец бомбардирует болезнетворные микроорганизмы разрушительными химическими веществами, проглатывает и уничтожает вирусы и бактерии. Врожденная иммунная система обеспечивает мгновенную реакцию на патоген. Проблема в том, что это грубый инструмент — он одинаково реагирует на все предполагаемые угрозы.
Адаптивная иммунная система, состоящая из В-клеток и Т-клеток, должна узнавать о патогене и его характеристиках от клеток врожденного иммунитета.Эта система требует больше времени, но ее положительная сторона заключается в том, что она очень специфична и во многих случаях действует всю жизнь.
Память иммунной системы
История воздействия патогенов хранится в так называемых Т-клетках памяти и В-клетках памяти. Когда инфекция побеждена и уходит, эти клетки находятся в периферических тканях тела, таких как лимфатические узлы или селезенка, и служат памятью о вызывающем болезнь вирусе. Эта иммунологическая память отвечает за защиту хозяина и срабатывает в случае второй волны или атаки патогена.
Понижение уровня антител после выздоровления — это нормально. Но статья журнала New England Journal of Medicine вызвала обеспокоенность, поскольку в ней говорится о том, что мы теряем нашу иммунологическую память, что так же плохо, как потеря реальной памяти.
Базофилы, нейрофилы, эозинофилы и моноциты (слева) составляют врожденную иммунную систему. В-клетки и Т-клетки являются частью адаптивной иммунной системы. Виталий Дума / Getty Images, CC BY-SAКакую роль Т-клетки играют в иммунитете?
В-клетки и антитела — только часть иммунного ответа.Т-клетки помогают В-клеткам вырабатывать антитела — белки, которые могут связываться с определенным патогеном и разрушать его.
Это происходит так: сначала В-клетки заглатывают вирус и начинают вырабатывать антитела.
Т-клетки не могут проглотить вирус. Но тип белых кровяных телец, называемых антигенпредставляющими клетками, может. После этого он «показывает» различные части вируса Т-клеткам. Затем Т-клетки узнают о вирусе, который они теперь могут искать и уничтожать.
Т-клетки также прикрепляются к В-клеткам и посылают им сигналы активации, которые помогают В-клеткам увеличивать выработку антител.
Если количество антител снижается, что это означает для иммунитета COVID-19?
Это говорит о том, что чем меньше антител в крови, тем выше вероятность того, что ряд отдельных вирусных частиц, называемых вирионами, выживут и избежат разрушения. Следовательно, оставшиеся вирионы будут продолжать размножаться и вызывать заболевание.
[ Глубокие знания, ежедневно. Подпишитесь на рассылку новостей The Conversation.]
Что означает снижение уровня антител для формирования коллективного иммунитета?
Коллективный иммунитет относится к популяции и возникает, когда достаточно большое количество людей в сообществе невосприимчивы к вирусу и неспособны передавать его.Это обеспечивает защиту тем, кто все еще уязвим. Например, если 60% людей защищены от COVID — потому что они пережили инфекцию и являются носителями антител — это может защитить (посредством менее частых взаимодействий) оставшиеся 40% от заболевания.
Но результаты, опубликованные в Медицинском журнале Новой Англии, предполагают, что люди с более низким уровнем антител могут все еще иметь вирус и не иметь симптомов болезни.
Это означает, что если эти люди с низким уровнем антител находятся рядом со здоровыми, неинфицированными людьми, они представляют для них опасность, поскольку могут передавать вирус.
Когда снижается уровень антител, исчезает ли иммунитет?
В общем, нет. Если вирус пытается вызвать вторую инфекцию, В- и Т-клетки памяти способны распознать это, умножиться в миллионы раз и защитить организм от вируса, не давая ему вызвать еще одну полномасштабную инфекцию.
Защита, обеспечиваемая Т- и В-клетками памяти, является причиной того, что защита на основе вакцин работает.
Однако бывают исключения.Пожизненная вакцина против гриппа не работает, потому что генетический код гриппа быстро меняется, изменяя внешний вид гриппа, и, следовательно, требует новой вакцины каждый сезон.
Но с SARS-CoV-2 проблема, на мой взгляд, заключается в том, что эти Т-клетки и В-клетки памяти, похоже, уничтожены.
Антитела — это белки, которые находятся в кровотоке от трех до четырех недель. Чтобы поддерживать высокий уровень антител, В-клетки должны пополнять их свежим запасом.Но в случае COVID-19 снижение уровня антител предполагает, что клеток, вырабатывающих эти антитела, недостаточно, что объясняет снижение уровня антител. Исследования того, как долго сохраняется иммунитет от COVID-19, могут пролить больше света, но пока мы не знаем, почему.
Понимание того, как работают вакцины | CDC
- Macrophagesmedia icon — это лейкоциты, которые поглощают и переваривают микробы, а также мертвые или умирающие клетки. Макрофаги оставляют после себя части вторгшихся микробов, называемых антигенами.Организм определяет антигены как опасные и побуждает антитела атаковать их.
- B-лимфоциты — защитные лейкоциты. Они производят антитела, которые атакуют антигены, оставленные макрофагами.
- Т-лимфоциты — еще один тип защитных лейкоцитов. Они атакуют клетки в организме, которые уже были инфицированы.
Когда организм впервые сталкивается с микробом, может потребоваться несколько дней, чтобы изготовить и использовать все средства борьбы с микробами, необходимые для преодоления инфекции.После заражения иммунная система запоминает, что она узнала о том, как защитить организм от этого заболевания.
В организме остается несколько Т-лимфоцитов, называемых клетками памяти, которые быстро вступают в действие, если организм снова встречает тот же самый микроб. Когда знакомые антигены обнаруживаются, В-лимфоциты вырабатывают антитела, чтобы атаковать их.
Как работают вакцины
Вакцины помогают развить иммунитет, имитируя инфекцию. Однако этот тип инфекции почти никогда не вызывает болезни, но заставляет иммунную систему вырабатывать Т-лимфоциты и антитела.Иногда после вакцинации имитационная инфекция может вызывать незначительные симптомы, например повышенную температуру. Такие незначительные симптомы являются нормальным явлением, и их следует ожидать, поскольку организм формирует иммунитет.
Как только имитационная инфекция уходит, в организме остается запас Т-лимфоцитов «памяти», а также В-лимфоцитов, которые будут помнить, как бороться с этой болезнью в будущем. Однако обычно организму требуется несколько недель для производства Т-лимфоцитов и В-лимфоцитов после вакцинации. Следовательно, возможно, что у человека, инфицированного болезнью непосредственно до или сразу после вакцинации, могут развиться симптомы и заразиться, потому что вакцина не успела обеспечить защиту.
Типы вакцин
Ученые используют разные подходы к разработке вакцин. Эти подходы основаны на информации об инфекциях (вызванных вирусами или бактериями), которые вакцина предотвращает, например, о том, как микробы заражают клетки и как на них реагирует иммунная система. Практические соображения, такие как регионы мира, где будет использоваться вакцина, также важны, потому что штамм вируса и условия окружающей среды, такие как температура и риск воздействия, могут быть разными в разных странах мира.Доступные варианты доставки вакцины также могут отличаться географически. Сегодня существует пять основных типов вакцин, которые младенцы и маленькие дети обычно получают в США:
- Живые аттенуированные вакцины борются с вирусами и бактериями. Эти вакцины содержат ослабленную версию живого вируса или бактерий, так что они не вызывают серьезных заболеваний у людей со здоровой иммунной системой. Поскольку живые ослабленные вакцины наиболее близки к естественной инфекции, они являются хорошими учителями для иммунной системы.Примеры живых аттенуированных вакцин включают вакцину против кори, эпидемического паротита и краснухи (MMR) и вакцину против ветряной оспы (ветряной оспы). Несмотря на то, что они очень эффективны, не все могут получить эти вакцины. Дети с ослабленной иммунной системой, например, те, кто проходит курс химиотерапии, не могут получать живые вакцины.
- Инактивированные вакцины также борются с вирусами и бактериями. Эти вакцины производятся путем инактивации или уничтожения микробов в процессе создания вакцины.Инактивированная вакцина против полиомиелита является примером вакцины этого типа. Инактивированные вакцины вызывают иммунный ответ иначе, чем живые аттенуированные вакцины. Часто для создания и / или поддержания иммунитета необходимы несколько доз.
- Анатоксиновые вакцины предотвращают заболевания, вызываемые бактериями, которые производят токсины (яды) в организме. В процессе изготовления этих вакцин токсины ослабевают, поэтому они не могут вызвать болезнь. Ослабленные токсины называют анатоксинами. Когда иммунная система получает вакцину, содержащую анатоксин, она учится бороться с естественным токсином.Вакцина DTaP содержит анатоксины дифтерии и столбняка.
- Субъединичные вакцины включают только части вируса или бактерии или субъединицы, а не весь зародыш. Поскольку эти вакцины содержат только основные антигены, а не все другие молекулы, составляющие микроб, побочные эффекты встречаются реже. Компонент вакцины DTaP от коклюша (коклюша) является примером субъединичной вакцины.
- Конъюгированные вакцины борются с различными типами бактерий.Эти бактерии имеют антигены с внешней оболочкой из сахароподобных веществ, называемых полисахаридами. Этот тип покрытия маскирует антиген, из-за чего незрелой иммунной системе маленького ребенка трудно распознать его и отреагировать на него. Конъюгированные вакцины эффективны для этих типов бактерий, потому что они связывают (или конъюгируют) полисахариды с антигенами, на которые иммунная система очень хорошо реагирует. Эта связь помогает незрелой иммунной системе реагировать на покрытие и развивать иммунный ответ.Примером вакцины этого типа является вакцина Haemophilus influenzae типа B (Hib).
Вакцины требуют более одной дозы
Есть четыре причины, по которым младенцам — и даже подросткам или взрослым — которые получают вакцину впервые, может потребоваться более одной дозы:
- Для некоторых вакцин (в первую очередь инактивированных) первая доза не обеспечивает максимально возможного иммунитета. Таким образом, для создания более полного иммунитета требуется более одной дозы.Вакцина, защищающая от бактерии Hib, вызывающей менингит, является хорошим примером.
- Для некоторых вакцин через некоторое время иммунитет начинает ослабевать. В этот момент необходима «бустерная» доза, чтобы восстановить уровень иммунитета. Эта бустерная доза обычно назначается через несколько лет после введения первой серии доз вакцины. Например, в случае вакцины DTaP, которая защищает от дифтерии, столбняка и коклюша, первая серия из четырех прививок, которые дети получают в рамках иммунизации младенцев, помогает укрепить иммунитет.Но бустерная доза необходима в возрасте от 4 до 6 лет. Еще один бустер против этих заболеваний нужен в 11 или 12 лет. Этот бустер для детей старшего возраста — а также подростков и взрослых — называется Tdap.
- Исследования показали, что для некоторых вакцин (в первую очередь живых), для развития наилучшего иммунного ответа каждому требуется более одной дозы. Например, после одной дозы вакцины MMR у некоторых людей может не выработаться достаточно антител для борьбы с инфекцией. Вторая доза помогает убедиться, что почти все защищены.
- Наконец, что касается вакцины против гриппа, взрослые и дети (от 6 месяцев и старше) должны получать дозу каждый год. Детям в возрасте от 6 месяцев до 8 лет, которые никогда не получали вакцину от гриппа в прошлом или получали только одну дозу в прошлые годы, нуждаются в двух дозах в первый год вакцинации. Затем необходима ежегодная вакцинация от гриппа, потому что вирусы гриппа, вызывающие заболевание, могут быть разными от сезона к сезону. Каждый год вакцины от гриппа производятся для защиты от вирусов, которые, как показывают исследования, будут наиболее распространенными.Кроме того, иммунитет, который ребенок получает от вакцинации против гриппа, со временем ослабевает. Ежегодная вакцинация от гриппа помогает защитить ребенка, даже если вирусы вакцины не меняются от сезона к сезону.
Итог
Некоторые люди считают, что естественный иммунитет — иммунитет от самой болезни — лучше, чем иммунитет, обеспечиваемый вакцинами. Однако естественные инфекции могут вызывать серьезные осложнения и быть смертельными. Это верно даже для болезней, которые многие люди считают легкими, например ветряной оспы.Невозможно предсказать, кто заразится серьезными инфекциями, которые могут привести к госпитализации.
Вакцины, как и любые лекарства, могут вызывать побочные эффекты. Наиболее частые побочные эффекты легкие. Однако многие симптомы болезней, которые можно предотвратить с помощью вакцин, могут быть серьезными или даже смертельными. Хотя многие из этих заболеваний редки в этой стране, они циркулируют по всему миру и могут быть занесены в США, подвергая риску невакцинированных детей. Даже с учетом достижений в области здравоохранения болезни, которые предотвращают вакцины, могут быть очень серьезными, и вакцинация — лучший способ их предотвратить.
Адаптировано из внешнего значка Национального института аллергии и инфекционных заболеваний, Understanding Vaccines.
Для получения дополнительной информации о вакцинах позвоните по телефону 800-CDC-INFO (800-232-4636) или посетите сайт https://www.cdc.gov/vaccines.
Старение снижает иммунитет | Живая наука
Вопрос : Кажется, в последнее время я много болею, и меня беспокоит, что моя иммунная система работает неправильно. Может это быть причиной?
Ответ : Снижение иммунной системы может быть причиной ваших проблем.Обратитесь к врачу для осмотра и диагностики.
Иммунная система — это сеть клеток, тканей и органов, которые работают вместе, чтобы защитить организм от атак таких организмов, как бактерии, паразиты и грибки, которые могут вызывать инфекции.
Клетки, которые являются частью этой защитной системы, — это белые кровяные тельца или лейкоциты. Посторонние вещества, попавшие в организм, называются антигенами.
Нет двух людей с одинаковой иммунной системой. Некоторые люди, кажется, одеты в доспехи от инфекций, в то время как другие падают в тупик, когда появляются насекомые.
Когда дело доходит до микробов, старение имеет свои преимущества и недостатки.
С возрастом наша иммунная система вырабатывает защиту от антигенов. Мы приобретаем антитела к микробам, которых победили в прошлом. Из-за этого явления взрослые реже болеют простудными заболеваниями, чем дети.
А теперь плохие новости:
- Вилочковая железа, расположенная за грудиной, является одним из органов иммунной системы. В тимусе созревают иммунные клетки, белые клетки крови, называемые Т-лимфоцитами (Т-лимфоцитами).Вилочковая железа начинает сокращаться, когда мы молоды. К среднему возрасту он составляет всего около 15 процентов от максимального размера.
- Некоторые Т-клетки убивают антигены напрямую. Другие помогают координировать другие части иммунной системы. Хотя количество Т-клеток не уменьшается с возрастом, функция Т-клеток снижается. Это вызывает ослабление частей иммунной системы и увеличивает риск заболевания.
- Макрофаги, белые кровяные тельца, которые поглощают антигены, работают не так быстро, как раньше.Это замедление может быть одной из причин того, что рак чаще встречается среди пожилых людей.
- Меньше белых кровяных телец, способных реагировать на новые антигены. Таким образом, когда пожилые люди сталкиваются с новым антигеном, организм теряет способность запоминать его и защищаться от него.
- Количество антител, вырабатываемых в ответ на антиген, у пожилых людей меньше, и антитела менее способны прикрепляться к антигену. Эти изменения могут частично объяснить, почему пневмония, грипп, инфекционный эндокардит и столбняк чаще встречаются среди пожилых людей и чаще вызывают смерть.Эти изменения могут также частично объяснить, почему вакцины менее эффективны для пожилых людей.
- В более позднем возрасте иммунная система, кажется, становится менее терпимой к собственным клеткам организма. Иногда развивается аутоиммунное заболевание; нормальная ткань ошибочно принимается за чужеродную ткань, а иммунные клетки атакуют определенные органы или ткани. Среди аутоиммунных заболеваний: волчанка, ревматоидный артрит, склеродермия и анкилозирующий спондилит.
- Диабет, который также чаще встречается с возрастом, также может привести к снижению иммунитета.
Есть прививки, которые важны с возрастом. Прививки от столбняка следует делать взрослым каждые 10 лет; ревакцинацию можно дать раньше, если есть грязная рана.
Ваш лечащий врач может порекомендовать другие прививки, включая Pneumovax (для предотвращения пневмонии или ее осложнений), вакцину от гриппа, иммунизацию против гепатита или другие. Эти дополнительные прививки необходимы не всем пожилым людям, но подходят для некоторых.
Если вы хотите прочитать больше столбцов, вы можете заказать копию «Как быть здоровым чудаком» на сайте www.Healthygeezer.com.
Все права защищены
Глубокая невосприимчивость | Институт Линуса Полинга
1. Най К.Э. Основы иммунологии для неиммунолога. В: Hughes DA, Darlington LG, Bendich A, eds. Диета и иммунная функция человека. Тотова, Нью-Джерси: Humana Press; 2004: 3-15.
2. Деверо Г. Иммунная система: обзор. В: Calder PC, Field CJ, Gill HS, eds. Питание и иммунная функция. Нью-Йорк: CABI Publishing; 2002: 1-20.
3. Иммунная система. В: Альбертс Б., Брей Д., Льюис Дж., Рафф М., Робертс К., Уотсон Дж. Д., ред. Молекулярная биология клетки. 3 -е изд. Нью-Йорк: Гарланд Паблишинг, Инк .; 1994: 1195-1254.
4. Пархем П. Т-клеточный иммунитет. Иммунная система. 2 -й изд. Нью-Йорк: издательство Garland Science Publishing; 2005: 145-178.
5. Паркин Дж., Коэн Б. Обзор иммунной системы. Ланцет. 2001; 357 (9270): 1777-1789. (PubMed)
6.Делвес П.Дж., Ройтт И.М. Иммунная система. Первая из двух частей. N Engl J Med. 2000; 343 (1): 37-49. (PubMed)
7. Дункельбергер-младший, Песня WC. Комплемент и его роль в врожденных и адаптивных иммунных ответах. Cell Res. 20 (1): 34-50. (PubMed)
8. Уолпорт MJ. Дополнение. Вторая из двух частей. N Engl J Med. 2001; 344 (15): 1140-1144. (PubMed)
9. Уолпорт MJ. Дополнение. Первая из двух частей. N Engl J Med. 2001; 344 (14): 1058-1066. (PubMed)
10.Мак Т.В., Сондерс М.Э. Врожденный иммунитет. Иммунный ответ: основные и клинические принципы. Амстердам: Elsevier Academic Press; 2004: 70-92.
11. Ивасаки А., Меджитов Р. Регулирование адаптивного иммунитета системой врожденного иммунитета. Наука. 2010; 327 (5963): 291-295. (PubMed)
12. Коль Дж. Я, не-я и опасность: дополнительный взгляд. Adv Exp Med Biol. 2006; 586: 71-94. (PubMed)
13. Calder PC. Питание иммунной системы. Proc Nutr Soc. 2013; 72 (3): 299-309.(PubMed)
14. Катона П., Катона-Апте Дж. Взаимодействие между питанием и инфекцией. Clin Infect Dis. 2008; 46 (10): 1582-1588. (PubMed)
15. Schaible UE, Kaufmann SH. Недоедание и инфекции: сложные механизмы и глобальные последствия. PLoS Med. 2007; 4 (5): e115. (PubMed)
16. Продовольственная и сельскохозяйственная организация Объединенных Наций. Состояние отсутствия продовольственной безопасности в мире в 2006 году: искоренение голода в мире — подведение итогов через десять лет после Всемирного продовольственного саммита.Доступно по адресу: http://www.fao.org/docrep/009/a0750e/a0750e00.htm. Дата обращения 01.04.2010.
17. Чепмен И.М. Нарушения питания у пожилых людей. Med Clin North Am. 2006; 90 (5): 887-907. (PubMed)
18. Пауэлл Дж., Борчерс А.Т., Йошида С., Гершвин М.Э. Оценка иммунной системы хозяина, подвергающегося риску питания. В: Gershwin ME, German JB, Keen CL, eds. Питание и иммунология: принципы и практика. Тотова, Нью-Джерси: Humana Press; 2000: 21-31.
19.Турнем Д.И., Нортроп-Клюз, Калифорния. Влияние инфекции на питание и иммунный статус. В: Hughes DA, Darlington LG, Bendich A, eds. Диета и иммунная функция человека. Тотова, Нью-Джерси: Humana Press; 2004: 35-64.
20. Джолли К.А., Фернандес Г. Белково-энергетическая недостаточность и инфекционные заболевания. В: Gershwin ME, German JB, Keen CL, eds. Питание и иммунология: принципы и практика. Тотова, Нью-Джерси: Humana Press; 2000: 195-202.
21. Батул Р., Батт М.С., Султан М.Т., Саид Ф., Наз Р.Белково-энергетическая недостаточность: фактор риска различных недугов. Crit Rev Food Sci Nutr. 2015; 55 (2): 242-253. (PubMed)
22. де Онис М., Монтейро С., Акре Дж., Глугстон Г. Мировые масштабы белковой и энергетической недостаточности питания: обзор из Глобальной базы данных ВОЗ по росту детей. Bull World Health Organ. 1993; 71 (6): 703-712. (PubMed)
23. Каннингем-Рандлс С., Макнили Д.Ф., Мун А. Механизмы модуляции иммунного ответа питательными веществами. J Allergy Clin Immunol.2005; 115 (6): 1119-1128; викторина 1129. (PubMed)
24. Grover Z, Ee LC. Белковая энергетическая недостаточность. Pediatr Clin North Am. 2009; 56 (5): 1055-1068. (PubMed)
25. Санчес Гарсия Е., Монтеро Эрраскен Б., Санчес Кастеллано С., Крус-Джентофт А.Дж. Важность нутритивной поддержки у пожилых людей. Серия семинаров Института питания Nestle. 2012; 72: 101-108.
26. Акнер Г., Седерхольм Т. Лечение белково-энергетической недостаточности при хронических незлокачественных заболеваниях.Am J Clin Nutr. 2001; 74 (1): 6-24. (PubMed)
27. Чандра РК. Влияние послеродовой белковой недостаточности и задержки внутриутробного развития на иммунитет и риск инфицирования. В: Calder PC, Field CJ, Gill HS, eds. Питание и иммунная функция. Нью-Йорк: CABI Publishing; 2002: 41-56.
28. Чандра РК. Белково-энергетическая недостаточность и иммунологические реакции. J Nutr. 1992; 122 (3 доп.): 597-600. (PubMed)
29. де Пабло М.А., Пуэртольяно М.А., де Сьенфуэгос Г.А.Функции иммунных клеток, липиды и естественная резистентность хозяина. FEMS Immunol Med Microbiol. 2000; 29: 323-328.
30. Совет по пищевым продуктам и питанию, Институт медицины. Пищевые жиры: общие жиры и жирные кислоты. Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей. Вашингтон, округ Колумбия: The National Academies Press; 2002: 422-541. (The National Academies Press)
31. Cunnane SC. Проблемы с незаменимыми жирными кислотами: время для новой парадигмы? Prog Lipid Res.2003; 42 (6): 544-568. (PubMed)
32. Маскиет Ф.А., Фоккема М.Р., Шаафсма А., Боерсма Э.Р., Кроуфорд М.А. Необходима ли докозагексаеновая кислота (ДГК)? Уроки регулирования статуса DHA, нашей древней диеты, эпидемиологии и рандомизированных контролируемых исследований. J Nutr. 2004; 134 (1): 183-186. (PubMed)
33. Галли С., Колдер П.С.. Влияние потребления жиров и жирных кислот на воспалительные и иммунные реакции: критический обзор. Энн Нутр Метаб. 2009; 55 (1-3): 123-139. (PubMed)
34.Calder PC. Взаимосвязь между составом жирных кислот иммунных клеток и их функцией. Простагландины Leukot Essent Fatty Acids. 2008; 79 (3-5): 101-108. (PubMed)
35. Calder PC. n-3 жирные кислоты, воспаление и иммунитет: новые механизмы, объясняющие старые действия. Proc Nutr Soc. 2013; 72 (3): 326-336. (PubMed)
36. Calder PC. Полиненасыщенные жирные кислоты и воспаление. Простагландины Leukot Essent Fatty Acids. 2006; 75 (3): 197-202. (PubMed)
37.Calder PC. Диетическая модификация воспаления липидами. Proc Nutr Soc. 2002; 61 (3): 345-358. (PubMed)
38. Harbige LS. Жирные кислоты, иммунный ответ и аутоиммунитет: вопрос существенности n-6 и баланса между n-6 и n-3. Липиды. 2003; 38 (4): 323-341. (PubMed)
39. Фентон Дж. И., Хорд Н. Г., Гош С., Гурзелл Э. А.. Иммуномодуляция пищевых длинноцепочечных жирных кислот омега-3 и возможность неблагоприятных последствий для здоровья. Простагландины Leukot Essent Fatty Acids.2013; 89 (6): 379-390. (PubMed)
40. Тис Ф., Небе-фон-Карон Г., Пауэлл Дж. Р., Якуб П., Ньюсхолм Э. А., Колдер П. С.. Добавка к пище с эйкозапентаеновой кислотой, но не с другими длинноцепочечными полиненасыщенными жирными кислотами n-3 или n-6, снижает активность естественных клеток-киллеров у здоровых людей в возрасте> 55 лет. Am J Clin Nutr. 2001; 73 (3): 539-548. (PubMed)
41. Тис Ф., Небе-фон-Карон Г., Пауэлл Дж. Р., Якуб П., Ньюсхолм Э.А., Колдер П.С. Пищевые добавки с гамма-линоленовой кислотой или рыбьим жиром снижают пролиферацию Т-лимфоцитов у здоровых пожилых людей.J Nutr. 2001; 131 (7): 1918-1927. (PubMed)
42. Thies F, Miles EA, Nebe-von-Caron G, et al. Влияние пищевых добавок с длинноцепочечными полиненасыщенными жирными кислотами n-3 или n-6 на популяции и функции воспалительных клеток крови и на растворимые в плазме молекулы адгезии у здоровых взрослых. Липиды. 2001; 36 (11): 1183-1193. (PubMed)
43. Майлз Э.А., Банерджи Т., Уэллс С.Дж., Колдер П.С. Ограниченное влияние эйкозапентаеновой кислоты на количество и функции Т-лимфоцитов и естественных клеток-киллеров у здоровых молодых мужчин.Питание. 2006; 22 (5): 512-519. (PubMed)
44. Рис Д., Майлз Э.А., Банерджи Т. и др. Дозозависимые эффекты эйкозапентаеновой кислоты на врожденную иммунную функцию у здоровых людей: сравнение молодых и пожилых мужчин. Am J Clin Nutr. 2006; 83 (2): 331-342. (PubMed)
45. О’Ши М., Бассаганья-Риера Дж., Мохеде IC. Иммуномодулирующие свойства конъюгированной линолевой кислоты. Am J Clin Nutr. 2004; 79 (6 доп.): 1199С-1206С. (PubMed)
46. Сонг Х. Дж., Грант I, Ротондо Д. и др.Влияние добавок CLA на иммунную функцию у молодых здоровых добровольцев. Eur J Clin Nutr. 2005; 59 (4): 508-517. (PubMed)
47. Акахоши А., Гото Ю., Мурао К. и др. Конъюгированная линолевая кислота снижает уровень жиров и цитокинов в организме мышей. Biosci Biotechnol Biochem. 2002; 66 (4): 916-920. (PubMed)
48. Сугано М., Цудзита А., Ямасаки М., Ногучи М., Ямада К. Конъюгированная линолевая кислота модулирует тканевые уровни химических медиаторов и иммуноглобулинов у крыс. Липиды.1998; 33 (5): 521-527. (PubMed)
49. Альберс Р., ван дер Вилен Р.П., Бринк Э.Дж., Хендрикс Х.Ф., Доровска-Таран В.Н., Мохеде И.К. Влияние изомеров цис-9, транс-11 и транс-10, цис-12 конъюгированной линолевой кислоты (CLA) на иммунную функцию у здоровых мужчин. Eur J Clin Nutr. 2003; 57 (4): 595-603. (PubMed)
50. Келли Д.С., Саймон В.А., Тейлор П.С. и др. Добавка к пище конъюгированной линолевой кислоты увеличивала ее концентрацию в мононуклеарных клетках периферической крови человека, но не изменяла их функцию.Липиды. 2001; 36 (7): 669-674. (PubMed)
51. Kelley DS, Taylor PC, Rudolph IL, et al. Конъюгированная с пищей линолевая кислота не влияла на иммунный статус молодых здоровых женщин. Липиды. 2000; 35 (10): 1065-1071. (PubMed)
52. Гарсия ОП, Лонг KZ, Росадо Ж.Л. Влияние дефицита питательных микроэлементов на ожирение. Nutr Rev.2009; 67 (10): 559-572. (PubMed)
53. Эймс Б.Н. Низкое потребление питательных микроэлементов может ускорить развитие дегенеративных заболеваний, связанных со старением, за счет распределения дефицитных питательных микроэлементов путем сортировки.Proc Natl Acad Sci U S. A. 2006; 103 (47): 17589-17594. (PubMed)
54. Moshfegh A, Goldman J, Cleveland L. 2005. Что мы едим в Америке, NHANES 2001-2002: Обычное поступление питательных веществ с пищей по сравнению с диетическими рекомендациями. Министерство сельского хозяйства США, Служба сельскохозяйственных исследований. Доступно по адресу: http://www.ars.usda.gov/Services/docs.htm?docid=13793. Дата обращения 05.08.16.
55. Holick MF. Дефицит витамина D. N Engl J Med. 2007; 357 (3): 266-281. (PubMed)
56.Semba RD. Витамин А. В: Hughes DA, Darlington LG, Bendich A, eds. Диета и иммунная функция человека. Тотова, Нью-Джерси: Humana Press Inc .; 2004: 105-131.
57. Шамбон П. Десятилетие молекулярной биологии рецепторов ретиноевой кислоты. Фасеб Дж. 1996; 10 (9): 940-954. (PubMed)
58. Балмер Дж. Э., Бломхофф Р. Регулирование экспрессии генов ретиноевой кислотой. J Lipid Res. 2002; 43 (11): 1773-1808. (PubMed)
59. Бхаскарам П. Иммунобиология легкой недостаточности питательных микроэлементов.Br J Nutr. 2001; 85 Приложение 2: S75-80. (PubMed)
60. Stephensen CB. Витамин А, инфекции и иммунная функция. Анну Рев Нутр. 2001; 21: 167-192. (PubMed)
61. Макдауэлл Е.М., Кинан К.П., Хуанг М. Эффекты лишения витамина А на эпителий трахеи хомяков. Количественное морфологическое исследование. Вирхова Arch B Cell Pathol Incl Mol Pathol. 1984; 45 (2): 197-219. (PubMed)
62. Хатчелл Д.Л., Соммер А. Обнаружение аномалий глазной поверхности при экспериментальной недостаточности витамина А.Arch Ophthalmol. 1984; 102 (9): 1389-1393. (PubMed)
63. Баррето М.Л., Сантос Л.М., Ассис А.М. и др. Влияние добавок витамина А на диарею и острые инфекции нижних дыхательных путей у детей младшего возраста в Бразилии. Ланцет. 1994; 344 (8917): 228-231. (PubMed)
64. Браун К.Х., Гаффар А., Аламгир С.М. Ксерофтальмия, белково-калорийная недостаточность и инфекции у детей. J Pediatr. 1979; 95 (4): 651-656. (PubMed)
65. Твининг СС, Чжоу X, Шульте Д.П., Уилсон П.М., Фиш Б., Моулдер Дж.Влияние дефицита витамина А на ранний ответ на экспериментальный кератит, вызванный псевдомонадой. Инвестируйте Ophthalmol Vis Sci. 1996; 37 (4): 511-522. (PubMed)
66. Sommer A, Katz J, Tarwotjo I. Повышенный риск респираторных заболеваний и диареи у детей с уже существующим умеренным дефицитом витамина A. Am J Clin Nutr. 1984; 40 (5): 1090-1095. (PubMed)
67. Рожанапо В., Лэмб А.Дж., Олсон Дж. Распространенность, метаболизм и миграция бокаловидных клеток в кишечнике крысы после индукции быстрого синхронного дефицита витамина А.J Nutr. 1980; 110 (1): 178-188. (PubMed)
68. Бак Дж., Дергини Ф., Леви Э., Наканиши К., Хаммерлинг У. Внутриклеточная передача сигналов с помощью 14-гидрокси-4,14-ретро-ретинола. Наука. 1991; 254 (5038): 1654-1656. (PubMed)
69. Blomhoff HK, Smeland EB, Erikstein B, et al. Витамин А является ключевым регулятором роста клеток, продукции цитокинов и дифференцировки нормальных В-клеток. J Biol Chem. 1992; 267 (33): 23988-23992. (PubMed)
70. Pasatiempo AM, Bowman TA, Taylor CE, Ross AC.Истощение и восполнение запасов витамина А: влияние на реакцию антител на капсульный полисахарид Streptococcus pneumoniae, тип III (SSS-III). Am J Clin Nutr. 1989; 49 (3): 501-510. (PubMed)
71. Wiedermann U, Hanson LA, Kahu H, Dahlgren UI. Аберрантная функция Т-клеток in vitro и нарушение зависимого от Т-клеток ответа антител in vivo у крыс с дефицитом витамина А. Иммунология. 1993; 80 (4): 581-586. (PubMed)
72. Смит С.М., Хейс К.Э. Контрастные нарушения в ответах IgM и IgG у мышей с дефицитом витамина А.Proc Natl Acad Sci U S. A. 1987; 84 (16): 5878-5882. (PubMed)
73. Гарбе А., Бак Дж., Хаммерлинг У. Ретиноиды являются важными кофакторами активации Т-клеток. J Exp Med. 1992; 176 (1): 109-117. (PubMed)
74. Mayo-Wilson E, Imdad A, Herzer K, Yakoob MY, Bhutta ZA. Добавки витамина А для предотвращения смертности, болезней и слепоты у детей в возрасте до 5 лет: систематический обзор и метаанализ. BMJ. 2011; 343: d5094. (PubMed)
75. Фавзи В.В., Чалмерс Т.С., Эррера М.Г., Мостеллер Ф.Добавки витамина А и детская смертность. Метаанализ. ДЖАМА. 1993; 269 (7): 898-903. (PubMed)
76. Villamor E, Fawzi WW. Добавки витамина А: последствия для заболеваемости и смертности у детей. J Infect Dis. 2000; 182 Приложение 1: S122-133. (PubMed)
77. Имдад А., Якуб М.Ю., Судфельд С., Хайдер Б.А., Блэк Р.Э., Бхутта З.А. Влияние добавок витамина А на младенческую и детскую смертность. BMC Public Health. 2011; 11 Приложение 3: S20. (PubMed)
78.Торн-Лайман А, Фавзи У. Добавки витамина А, инфекционные заболевания и детская смертность: резюме доказательств. Nestle Nutr Inst Мастерская Сер. 2012; 70: 79-90. (PubMed)
79. Стивенсен С.Б., Франки Л.М., Эрнандес Х., Кампос М., Гилман Р.Х., Альварес Дж. Побочные эффекты высоких доз витамина А у детей, госпитализированных с пневмонией. Педиатрия. 1998; 101 (5): E3. (PubMed)
80. Возможные меры по профилактике детской пневмонии в развивающихся странах: метаанализ данных полевых испытаний для оценки воздействия добавок витамина А на заболеваемость и смертность от пневмонии.Рабочая группа по витамину А и пневмонии. Bull World Health Organ. 1995; 73 (5): 609-619. (PubMed)
81. Аукруст П., Мюллер Ф., Уеланд Т., Свардал А.М., Берге Р.К., Фроланд СС. Снижение уровня витамина А при общем вариабельном иммунодефиците: добавление витамина А in vivo усиливает выработку иммуноглобулинов и подавляет воспалительные реакции. Eur J Clin Invest. 2000; 30 (3): 252-259. (PubMed)
82. Саттон А.Л., Макдональд П.Н. Витамин D: больше, чем гормон «косточки».Мол Эндокринол. 2003; 17 (5): 777-791. (PubMed)
83. Гробер Ю., Шпиц Дж., Райхрат Дж., Кистерс К., Холик М.Ф. Витамин D: обновление 2013 г .: от профилактики рахита до общей профилактики. Дерматоэндокринол. 2013; 5 (3): 331-347. (PubMed)
84. Brennan A, Katz DR, Nunn JD, et al. Дендритные клетки тканей человека экспрессируют рецепторы иммунорегуляторного метаболита витамина D3, дигидроксихолекальциферола. Иммунология. 1987; 61 (4): 457-461. (PubMed)
85.Provvedini DM, Tsoukas CD, Deftos LJ, Manolagas SC. Рецепторы 1,25-дигидроксивитамина D3 в лейкоцитах человека. Наука. 1983; 221 (4616): 1181-1183. (PubMed)
86. Велдман С.М., Канторна М.Т., ДеЛука Х.Ф. Экспрессия рецептора 1,25-дигидроксивитамина D (3) в иммунной системе. Arch Biochem Biophys. 2000; 374 (2): 334-338. (PubMed)
87. Бхалла А.К., Аменто Е.П., Клеменс Т.Л., Холик М.Ф., Крейн С.М. Специфические высокоаффинные рецепторы 1,25-дигидроксивитамина D3 в мононуклеарных клетках периферической крови человека: присутствие в моноцитах и индукция в Т-лимфоцитах после активации.J Clin Endocrinol Metab. 1983; 57 (6): 1308-1310. (PubMed)
88. Хьюисон М., Зендер Д., Чакраверти Р., Адамс Дж. С.. Витамин D и барьерная функция: новая роль внепочечной 1-альфа-гидроксилазы. Mol Cell Endocrinol. 2004; 215 (1-2): 31-38. (PubMed)
89. Заслофф М. Борьба с инфекциями с помощью витамина D. Nat Med. 2006; 12 (4): 388-390. (PubMed)
90. Гомбарт А.Ф. Путь действия витамина D и антимикробного пептида и его роль в защите от инфекции.Future Microbiol. 2009; 4: 1151-1165. (PubMed)
91. Weber G, Heilborn JD, Chamorro Jimenez CI, Hammarsjo A, Torma H, Stahle M. Витамин D индуцирует антимикробный белок hCAP18 в коже человека. J Invest Dermatol. 2005; 124 (5): 1080-1082. (PubMed)
92. Gombart AF, Borregaard N, Koeffler HP. Ген антимикробного пептида кателицидина человека (САМР) является прямой мишенью рецептора витамина D и сильно активируется в миелоидных клетках 1,25-дигидроксивитамином D3.Фасеб Дж. 2005; 19 (9): 1067-1077. (PubMed)
93. Лю П.Т., Стенгер С., Ли Х. и др. Запуск Toll-подобным рецептором антимикробного ответа человека, опосредованного витамином D. Наука. 2006; 311 (5768): 1770-1773. (PubMed)
94. Кэмпбелл Y, Fantacone ML, Gombart AF. Регулирование экспрессии гена антимикробного пептида питательными веществами и побочными продуктами микробного метаболизма. Eur J Nutr. 2012; 51 (8): 899-907. (PubMed)
95. Мора-младший, Ивата М., фон Андриан У. Влияние витаминов на иммунную систему: витамины A и D занимают центральное место.Nat Rev Immunol. 2008; 8 (9): 685-698. (PubMed)
96. Chen WC, Vayuvegula B, Gupta S. 1,25-дигидроксивитамин D3-опосредованное ингибирование дифференцировки B-клеток человека. Clin Exp Immunol. 1987; 69 (3): 639-646. (PubMed)
97. Muller K, Heilmann C, Poulsen LK, Barington T, Bendtzen K. Роль моноцитов и Т-клеток в опосредованном 1,25-дигидроксивитамином D3 ингибировании функции В-клеток in vitro. Иммунофармакология. 1991; 21 (2): 121-128. (PubMed)
98. Мюллер К., Одум Н., Бендцен К.1,25-дигидроксивитамин D3 избирательно снижает уровень интерлейкина-2 и пролиферацию линий Т-клеток человека in vitro. Immunol Lett. 1993; 35 (2): 177-182. (PubMed)
99. Лемир Дж. М., Арчер Д. К., Бек Л., Шпигельберг Х. Л.. Иммунодепрессивное действие 1,25-дигидроксивитамина D3: преимущественное угнетение функций Th2. J Nutr. 1995; 125 (6 доп.): 1704S-1708S. (PubMed)
100. Mathieu C, Adorini L. Достижение совершеннолетия аналогов 1,25-дигидроксивитамина D (3) в качестве иммуномодулирующих средств.Тенденции Мол Мед. 2002; 8 (4): 174-179. (PubMed)
101. Boonstra A, Barrat FJ, Crain C, Heath VL, Savelkoul HF, O’Garra A. 1альфа, 25-дигидроксивитамин d3 оказывает прямое действие на наивные CD4 (+) T-клетки, усиливая развитие Th3-клеток. J Immunol. 2001; 167 (9): 4974-4980. (PubMed)
102. Cantorna MT, Woodward WD, Hayes CE, DeLuca HF. 1,25-дигидроксивитамин D3 является положительным регулятором двух антиэнцефалитогенных цитокинов TGF-beta 1 и IL-4. J Immunol. 1998; 160 (11): 5314-5319.(PubMed)
103. Грегори С., Джарратана Н., Смирольдо С., Ускокович М., Адорини Л. Аналог 1альфа, 25-дигидроксивитамина D (3) усиливает регуляторные Т-клетки и останавливает аутоиммунный диабет у мышей NOD. Диабет. 2002; 51 (5): 1367-1374. (PubMed)
104. Barrat FJ, Cua DJ, Boonstra A, et al. Генерирование in vitro регуляторных CD4 (+) Т-клеток, продуцирующих интерлейкин 10, индуцируется иммунодепрессантами и ингибируется цитокинами, индуцирующими Т-хелперы 1 (Th2) и Th3. J Exp Med.2002; 195 (5): 603-616. (PubMed)
105. Baeke F, Etten EV, Overbergh L, Mathieu C. Витамин D3 и иммунная система: поддержание баланса между здоровьем и болезнями. Nutr Res Rev.2007; 20 (1): 106-118. (PubMed)
106. Deluca HF, Cantorna MT. Витамин D: его роль и использование в иммунологии. Фасеб Дж. 2001; 15 (14): 2579-2585. (PubMed)
107. Агмон-Левин Н., Теодор Э., Сегал Р.М., Шенфельд Ю. Витамин D при системных и органоспецифических аутоиммунных заболеваниях. Clin Rev Allergy Immunol.2013; 45 (2): 256-266. (PubMed)
108. Antico A, Tampoia M, Tozzoli R, Bizzaro N. Могут ли добавки с витамином D снизить риск или изменить течение аутоиммунных заболеваний? Систематический обзор литературы. Autoimmun Rev.2012; 12 (2): 127-136. (PubMed)
109. Duan S, Lv Z, Fan X, et al. Статус витамина D и риск рассеянного склероза: систематический обзор и метаанализ. Neurosci Lett. 2014; 570: 108-113. (PubMed)
110. Ян Ц.Ю., Люн П.С., Адамопулос И.Е., Гершвин М.Э.Значение витамина D и аутоиммунитет: всесторонний обзор. Clin Rev Allergy Immunol. 2013; 45 (2): 217-226. (PubMed)
111. Cantorna MT, Mahon BD. Растущее количество доказательств того, что витамин D является фактором окружающей среды, влияющим на распространенность аутоиммунных заболеваний. Exp Biol Med (Maywood). 2004; 229 (11): 1136-1142. (PubMed)
112. Симпсон С. младший, Близзард Л., Отахал П., Ван дер Мей И., Тейлор Б. Широта в значительной степени связана с распространенностью рассеянного склероза: метаанализ.J Neurol Neurosurg Psychiatry. 2011; 82 (10): 1132-1141. (PubMed)
113. Munger KL, Ascherio A. Профилактика и лечение рассеянного склероза: изучение эффектов витамина D. Mult Scler. 2011; 17 (12): 1405-1411. (PubMed)
114. Dong JY, Zhang WG, Chen JJ, Zhang ZL, Han SF, Qin LQ. Потребление витамина D и риск диабета 1 типа: метаанализ обсервационных исследований. Питательные вещества. 2013; 5 (9): 3551-3562. (PubMed)
115. Сон Г.Г., Бэ СК, Ли Ю.Х. Связь между потреблением витамина D и риском ревматоидного артрита: метаанализ.Clin Rheumatol. 2012; 31 (12): 1733-1739. (PubMed)
116. Hyppönen E, Laara E, Reunanen A, Jarvelin MR, Virtanen SM. Потребление витамина D и риск диабета 1 типа: когортное исследование при рождении. Ланцет. 2001; 358 (9292): 1500-1503. (PubMed)
117. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Уровни 25-гидроксивитамина D в сыворотке и риск рассеянного склероза. ДЖАМА. 2006; 296 (23): 2832-2838. (PubMed)
118. Munger KL, Zhang SM, O’Reilly E, et al.Потребление витамина D и заболеваемость рассеянным склерозом. Неврология. 2004; 62 (1): 60-65. (PubMed)
119. Озгокмен С., Булут С., Ильхан Н., Гулькесен А., Ардикоглу О., Озкан Ю. Дефицит витамина D и снижение минеральной плотности костной ткани при рассеянном склерозе: влияние амбулаторного статуса и функциональной способности. J Bone Miner Metab. 2005; 23 (4): 309-313. (PubMed)
120. Ван дер Мей И.А., Понсонби А.Л., Дуайер Т. и др. Уровни витамина D у людей с рассеянным склерозом и общественный контроль в Тасмании, Австралия.J Neurol. 2007; 254 (5): 581-590. (PubMed)
121. Мерлино Л.А., Кертис Дж., Микулс Т.Р., Серхан Дж. Р., Крисуэлл Л.А., Сааг К.Г. Потребление витамина D обратно связано с ревматоидным артритом: результаты исследования здоровья женщин Айовы. Ревматоидный артрит. 2004; 50 (1): 72-77. (PubMed)
122. Джеймс Э., Добсон Р., Куле Дж., Бейкер Д., Джованнони Г., Рамагопалан С.В. Влияние вмешательств, связанных с витамином D, на рецидивы рассеянного склероза: метаанализ. Мульт Склер. 2013; 19 (12): 1571-1579.(PubMed)
123. Pozuelo-Moyano B, Benito-Leon J, Mitchell AJ, Hernandez-Gallego J. Систематический обзор рандомизированных, двойных слепых, плацебо-контролируемых исследований, изучающих клиническую эффективность витамина D при рассеянном склерозе. Нейроэпидемиология. 2013; 40 (3): 147-153. (PubMed)
124. Бхаргава П., Кассард С., Стил С.У. и др. Исследование витамина D для лечения рассеянного склероза (VIDAMS): дизайн многоцентрового рандомизированного двойного слепого контролируемого исследования витамина D при рассеянном склерозе.Клинические испытания Contemp. 2014; 39 (2): 288-293. (PubMed)
125. Smolders J, Hupperts R, Barkhof F, et al. Эффективность витамина D3 в качестве дополнительной терапии у пациентов с ремиттирующим рассеянным склерозом, получающих подкожно интерферон бета-1а: Фаза II, многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование. J Neurol Sci. 2011; 311 (1-2): 44-49. (PubMed)
126. Dörr J, Ohlraun S, Skarabis H, Paul F. Эффективность добавок витамина D при рассеянном склерозе (испытание EVIDIMS): протокол исследования для рандомизированного контролируемого исследования.Испытания. 2012; 13:15. (PubMed)
127. Принц В., Борц Р., Брегин Б., Херш М. Влияние добавок аскорбиновой кислоты на некоторые параметры системы иммунологической защиты человека. Int J Vitam Nutr Res. 1977; 47 (3): 248-257. (PubMed)
128. Валланс С. Взаимосвязь между аскорбиновой кислотой и белками сыворотки иммунной системы. Br Med J. 1977; 2 (6084): 437-438. (PubMed)
129. Кеннес Б., Дюмон И., Брохи Д., Хуберт С., Неве П. Влияние добавок витамина С на клеточный иммунитет у пожилых людей.Геронтология. 1983; 29 (5): 305-310. (PubMed)
130. Пануш Р.С., Делафуэнте Дж. К., Кац П., Джонсон Дж. Модуляция определенных иммунологических ответов витамином С. III. Усиление ответа лимфоцитов in vitro и in vivo. Int J Vitam Nutr Res Suppl. 1982; 23: 35-47. (PubMed)
131. Джаривалла Р.Дж., Хараке С. Противовирусная и иммуномодулирующая активность аскорбиновой кислоты. В: Харрис-младший, изд. Субклеточная биохимия. Аскорбиновая кислота: биохимия и биомедицинская клеточная биология.Нью-Йорк: Пленум Пресс; 1996: 215-231.
132. Андерсон Р., Остхейзен Р., Мариц Р., Терон А., Ван Ренсбург А.Дж. Влияние увеличения еженедельных доз аскорбата на определенные клеточные и гуморальные иммунные функции у нормальных добровольцев. Am J Clin Nutr. 1980; 33 (1): 71-76. (PubMed)
133. Леви Р., Шрикер О., Порат А., Ризенберг К., Шлеффер Ф. Витамин С для лечения рецидивирующего фурункулеза у пациентов с нарушенными функциями нейтрофилов. J Infect Dis. 1996; 173 (6): 1502-1505.(PubMed)
134. Андерсон Р. Иммуностимулирующие, противовоспалительные и противоаллергические свойства аскорбата. Adv Nutr Res. 1984; 6: 19-45. (PubMed)
135. Huijskens MJ, Walczak M, Koller N, et al. Технический прогресс: аскорбиновая кислота индуцирует развитие двойных положительных Т-клеток из гемопоэтических стволовых клеток человека в отсутствие стромальных клеток. J Leukoc Biol. 2014; 96 (6): 1165-1175. (PubMed)
136. Schwager J, Bompard A, Weber P, Raederstorff D.Аскорбиновая кислота модулирует миграцию клеток в дифференцированных клетках HL-60 и лейкоцитах периферической крови. Mol Nutr Food Res. 2015; 59 (8): 1513-1523. (PubMed)
137. Bozonet SM, Carr AC, Pullar JM, Vissers MC. Повышение статуса витамина С у нейтрофилов человека, хемотаксиса и образования оксидантов после приема пищевых добавок с богатыми витамином С киви SunGold. Питательные вещества. 2015; 7 (4): 2574-2588. (PubMed)
138. Feigen GA, Smith BH, Dix CE, et al. Повышение выработки антител и защита от системной анафилаксии за счет больших доз витамина С.Res Commun Chem Pathol Pharmacol. 1982; 38 (2): 313-333. (PubMed)
139. Принц В., Блох Дж., Гилич Г., Митчелл Г. Систематическое исследование влияния добавок витамина С на гуморальный иммунный ответ у аскорбат-зависимых млекопитающих. I. Антительный ответ на эритроциты барана (Т-зависимый антиген) у морских свинок. Int J Vitam Nutr Res. 1980; 50 (3): 294-300. (PubMed)
140. Haskell BE, Джонстон CS. Активность компонента комплемента C1q и содержание аскорбиновой кислоты у морских свинок.Am J Clin Nutr. 1991; 54 (6 доп.): 1228S-1230S. (PubMed)
141. Джонстон С.С., Карти Г.Д., Хаскелл BE. Влияние питания аскорбиновой кислотой на связанный с белком гидроксипролин в плазме морской свинки. J Nutr. 1985; 115 (8): 1089-1093. (PubMed)
142. Джонстон К.С., Колб В.П., Хаскелл Б.Э. Влияние витамина С на концентрацию компонента комплемента C1q в плазме морской свинки. J Nutr. 1987; 117 (4): 764-768. (PubMed)
143. Шилотри П.Г., Бхат К.С. Влияние мегадоз витамина С на бактерицидную активность лейкоцитов.Am J Clin Nutr. 1977; 30 (7): 1077-1081. (PubMed)
144. Фогель Р.И., Ламстер И.Б., Векслер С.А., Маседо Б., Хартли Л.Дж., Маседо Дж.А. Влияние мегадоз аскорбиновой кислоты на хемотаксис PMN и экспериментальный гингивит. J Periodontol. 1986; 57 (8): 472-479. (PubMed)
145. Ludvigsson J, Hansson LO, Stendahl O. Влияние больших доз витамина C на функцию лейкоцитов и некоторые лабораторные параметры. Int J Vitam Nutr Res. 1979; 49 (2): 160-165. (PubMed)
146.Delafuente JC, Prendergast JM, Modigh A. Иммунологическая модуляция витамином C у пожилых людей. Int J Immunopharmacol. 1986; 8 (2): 205-211. (PubMed)
147. Бергстен П., Амитаи Г., Керл Дж., Даривал К.Р., Кляйн Г.Г., Левин М. Миллимолярные концентрации аскорбиновой кислоты в очищенных мононуклеарных лейкоцитах человека. Истощение и повторное накопление. J Biol Chem. 1990; 265 (5): 2584-2587. (PubMed)
148. Эванс Р.М., Карри Л., Кэмпбелл А. Распределение аскорбиновой кислоты между различными клеточными компонентами крови у нормальных людей и его связь с концентрацией в плазме.Br J Nutr. 1982; 47 (3): 473-482. (PubMed)
149. Дифференцированные клетки и поддержание тканей. В: Alberts B BD, Lewis J, Raff M, Roberts K, Watson JD, ed. Молекулярная биология клетки. 3-е изд. Нью-Йорк: Гарланд Паблишинг, Инк .; 1994: 1139-1193.
150. Джаривалла Р.Дж., Хараке С. Механизмы, лежащие в основе действия витамина С при вирусных заболеваниях и иммунодефицитных заболеваниях. В: L. P, J. F, eds. Витамин С в здоровье и болезнях. Нью-Йорк: Macel Dekker, Inc .; 1997: 309-322.
151. Полинг Л. Иммунная система. Как жить дольше и чувствовать себя лучше. 20 -е юбилейное изд. Корваллис: Издательство Государственного университета Орегона; 2006: 105-111.
152. Даль Х., Дегре М. Влияние аскорбиновой кислоты на выработку человеческого интерферона и противовирусную активность in vitro. Acta Pathol Microbiol Scand B. 1976; 84B (5): 280-284. (PubMed)
153. Карр А.С., Фрей Б. К новой рекомендованной диетической дозе витамина С, основанной на антиоксидантных свойствах и влиянии на здоровье человека.Am J Clin Nutr. 1999; 69 (6): 1086-1107. (PubMed)
154. Hemilä H, Louhiala P. Витамин C для профилактики и лечения пневмонии. Кокрановская база данных Syst Rev.2013; 8: CD005532. (PubMed)
155. Трабер М.Г., Аткинсон Дж. Витамин Е, антиоксидант и ничего более. Free Radic Biol Med. 2007; 43 (1): 4-15. (PubMed)
156. Моригути С., Мурага М. Витамин Е и иммунитет. Vitam Horm. 2000; 59: 305-336. (PubMed)
157. Ву Д., Мейдани С.Н. Возрастные изменения иммунной функции: влияние витамина Е и лежащие в основе механизмы.Endocr Metab — мишени для лечения иммунных расстройств. 2014; 14 (4): 283-289. (PubMed)
158. Молано А., Мейдани С. Н.. Витамин Е, сигналосомы и экспрессия генов в Т-клетках. Мол Аспекты Мед. 2012; 33 (1): 55-62. (PubMed)
159. Де ла Фуэнте М., Эрнанц А., Гуайербас Н., Виктор В.М., Арналич Ф. Прием витамина Е улучшает некоторые иммунные функции у пожилых мужчин и женщин. Free Radic Res. 2008; 42 (3): 272-280. (PubMed)
160. Мейдани С. Н., Мейдани М., Блумберг Дж. Б. и др.Добавки витамина Е и иммунный ответ in vivo у здоровых пожилых людей. Рандомизированное контролируемое исследование. ДЖАМА. 1997; 277 (17): 1380-1386. (PubMed)
161. Pallast EG, Schouten EG, de Waart FG, et al. Влияние добавок 50 и 100 мг витамина E на клеточную иммунную функцию у неинституционализированных пожилых людей. Am J Clin Nutr. 1999; 69 (6): 1273-1281. (PubMed)
162. Мейдани С.Н., Лека Л.С., Файн BC и др. Витамин Е и инфекции дыхательных путей у пожилых жителей домов престарелых: рандомизированное контролируемое исследование.ДЖАМА. 2004; 292 (7): 828-836. (PubMed)
163. Грувер А.Л., Хадсон Л.Л., Семповски Г.Д. Иммунное старение. J Pathol. 2007; 211 (2): 144-156. (PubMed)
164. Миллер Р.А. Иммунная система старения: грунтовка и проспект. Наука. 1996; 273 (5271): 70-74. (PubMed)
165. Ван И, Хуанг Д.С., Уотсон Р.Р. Диетическое регулирование выработки витамина Е цитокинов спленоцитами и тимоцитами мышей, получавших алкоголь. Alcohol Clin Exp Res. 1994; 18 (2): 355-362. (PubMed)
166.Ван И, Уотсон Р.Р. Добавки витамина E на различных уровнях изменяют выработку цитокинов тимоцитами во время ретровирусной инфекции, вызывающей СПИД у мышей. Тимус. 1994; 22 (3): 153-165. (PubMed)
167. Серафини М. Диетический витамин Е и функция Т-лимфоцитов у пожилых людей: эффективность и механизм действия. Int J Dev Neurosci. 2000; 18 (4-5): 401-410. (PubMed)
168. Хан С. Н., Мейдани С. Н.. Витамин Е и инфекционные заболевания у пожилых людей. Proc Nutr Soc. 1999; 58 (3): 697-705.(PubMed)
169. Харман Д., Миллер Р.А.. Влияние витамина Е на иммунный ответ на вакцину против вируса гриппа и частоту инфекционных заболеваний у человека. Возраст. 1986; 9: 21-23.
170. Graat JM, Schouten EG, Kok FJ. Влияние ежедневного приема витамина Е и поливитаминно-минеральных добавок на острые инфекции дыхательных путей у пожилых людей: рандомизированное контролируемое исследование. ДЖАМА. 2002; 288 (6): 715-721. (PubMed)
171. Хемила Х., Виртамо Дж., Албанес Д., Каприо Дж.Влияние витамина Е на частоту простуды зависит от возраста, курения и проживания. J Am Coll Nutr. 2006; 25 (4): 332-339. (PubMed)
172. Чандра Р.К., Судхакаран Л. Регулирование иммунных ответов витамином B6. Ann N Y Acad Sci. 1990; 585: 404-423. (PubMed)
173. Тракателлис А., Димитриаду А., Тракателли М. Дефицит пиридоксина: новые подходы к иммуносупрессии и химиотерапии. Postgrad Med J. 1997; 73 (864): 617-622. (PubMed)
174.Rall LC, Meydani SN. Витамин B6 и иммунная компетентность. Nutr Rev.1993; 51 (8): 217-225. (PubMed)
175. Пол Л., Уиланд П.М., Селхуб Дж. Механистический взгляд на взаимосвязь между пиридоксаль-5′-фосфатом и воспалением. Nutr Rev.2013; 71 (4): 239-244. (PubMed)
176. Мейдани С. Н., Рибая-Меркадо Д. Д., Рассел Р. М., Сахён Н., Морроу Ф. Д., Гершофф С. Н.. Дефицит витамина B-6 снижает выработку интерлейкина 2 и пролиферацию лимфоцитов у пожилых людей. Am J Clin Nutr.1991; 53 (5): 1275-1280. (PubMed)
177. Talbott MC, Miller LT, Kerkvliet NI. Добавки пиридоксина: влияние на реакцию лимфоцитов у пожилых людей. Am J Clin Nutr. 1987; 46 (4): 659-664. (PubMed)
178. Бейли Л. Б., Грегори Дж. Ф., 3-й. Фолиевая кислота. В: Bowman BA, Russell RM, eds. Настоящие знания в области питания. 9 -е изд. Вашингтон, округ Колумбия: ILSI Press; 2006: 278-301.
179. Бейли Л. Б., Грегори Дж. Ф., 3-е. Метаболизм фолиевой кислоты и потребности.J Nutr. 1999; 129 (4): 779-782. (PubMed)
180. Dhur A, Galan P, Hercberg S. Статус фолиевой кислоты и иммунная система. Prog Food Nutr Sci. 1991; 15 (1-2): 43-60. (PubMed)
181. Гросс Р.Л., Рид Дж. В., Ньюберн П.М., Берджесс Б., Марстон Р., Хифт В. Подавленный клеточный иммунитет при мегалобластной анемии из-за дефицита фолиевой кислоты. Am J Clin Nutr. 1975; 28 (3): 225-232. (PubMed)
182. Шейн Б. Фолиевая кислота, витамин B-12 и витамин B-6. В кн .: Стипанук М, под ред. Биохимические и физиологические аспекты питания человека.2 -й изд. Филадельфия: Сондерс Эльзевьер; 2006: 693-732.
183. Эркурт М.А., Айдогду И., Дикилитас М. и др. Влияние цианокобаламина на иммунитет у пациентов с пернициозной анемией. Med Princ Pract. 2008; 17 (2): 131-135. (PubMed)
184. Тамура Дж., Кубота К., Мураками Х. и др. Иммуномодуляция витамином B12: увеличение количества CD8 + T-лимфоцитов и активности естественных киллеров (NK) у пациентов с дефицитом витамина B12 с помощью лечения метил-B12. Clin Exp Immunol.1999; 116 (1): 28-32. (PubMed)
185. Прасад А.С. Цинк в здоровье человека: влияние цинка на иммунные клетки. Mol Med. 2008; 14 (5-6): 353-357. (PubMed)
186. Cousins RJ. Цинк. В: Bowman BA, Russell RM, eds. Настоящие знания в области питания. Вашингтон, округ Колумбия: ILSI Press; 2006: 445-457.
187. Ibs K-H, Rink L. Zinc. В: Hughes DA, Darlington LG, Bendich A, eds. Диета и иммунная функция человека. Тотова, Нью-Джерси: Human Press Inc .; 2004: 241-259.
188.Kruse-Jarres JD. Значение цинка для гуморального и клеточного иммунитета. J Trace Elem Electrolytes Health Dis. 1989; 3 (1): 1-8. (PubMed)
189. Аллен Дж. И., Перри Р. Т., Макклейн С. Дж., Кей Н. Э.. Изменения активности естественных клеток-киллеров человека и цитотоксичности моноцитов, вызванные дефицитом цинка. J Lab Clin Med. 1983; 102 (4): 577-589. (PubMed)
190. Ибс К.Х., Ринк Л. Цинк-измененная иммунная функция. J Nutr. 2003; 133 (5 доп. 1): 1452S-1456S. (PubMed)
191.Шанкар А.Х., Прасад А.С. Цинк и иммунная функция: биологическая основа измененной устойчивости к инфекции. Am J Clin Nutr. 1998; 68 (2 доп.): 447С-463С. (PubMed)
192. Бонавентура П., Бенедетти Г., Альбареде Ф., Миосек П. Цинк и его роль в иммунитете и воспалении. Autoimmun Rev.2015; 14 (4): 277-285. (PubMed)
193. Прасад А.С., Бек Ф.В., Бао Б. и др. Добавление цинка снижает частоту инфекций у пожилых людей: влияние цинка на выработку цитокинов и окислительный стресс.Am J Clin Nutr. 2007; 85 (3): 837-844. (PubMed)
194. Бао Б., Прасад А.С., Бек Ф.В. и др. Цинк снижает С-реактивный белок, перекисное окисление липидов и воспалительные цитокины у пожилых людей: потенциальное значение цинка как атеропротекторного агента. Am J Clin Nutr. 2010; 91 (6): 1634-1641. (PubMed)
195. Фостер М., Самман С. Цинк и регуляция воспалительных цитокинов: последствия для кардиометаболических заболеваний. Питательные вещества. 2012; 4 (7): 676-694. (PubMed)
196.Ма Дж., Беттс Н.М. Потребление цинка и меди и их основные источники пищи для пожилых людей в продолжающемся обследовании потребления пищи людьми (CSFII) в 1994-96 гг. J Nutr. 2000; 130 (11): 2838-2843. (PubMed)
197. Брифель Р. Р., Биалостовский К., Кеннеди-Стивенсон Дж., Макдауэлл М. А., Эрвин Р. Б., Райт Дж. Д.. Потребление цинка населением США: результаты третьего Национального исследования здоровья и питания, 1988-1994 гг. J Nutr. 2000; 130 (5S Доп.): 1367S-1373S. (PubMed)
198.Хотц С., Пирсон Дж. М., Браун К. Х. Предлагаемые нижние пороговые значения концентраций цинка в сыворотке для оценки статуса цинка: повторный анализ данных второго Национального исследования здоровья и питания (1976-1980). Am J Clin Nutr. 2003; 78 (4): 756-764. (PubMed)
199. Ravaglia G, Forti P, Maioli F, et al. Концентрация микроэлементов в крови и гормонов щитовидной железы у пожилых людей. J Clin Endocrinol Metab. 2000; 85 (6): 2260-2265. (PubMed)
200. Wong CP, Ho E. Цинк и его роль в возрастном воспалении и иммунной дисфункции.Mol Nutr Food Res. 2012; 56 (1): 77-87. (PubMed)
201. Прасад А.С., Фитцджеральд Дж. Т., Хесс Дж. В., Каплан Дж., Пелен Ф., Дарденн М. Дефицит цинка у пожилых пациентов. Питание. 1993; 9 (3): 218-224. (PubMed)
202. Boukaiba N, Flament C, Acher S, et al. Физиологическое количество добавок цинка: влияние на состояние питания, липидов и тимуса у пожилого населения. Am J Clin Nutr. 1993; 57 (4): 566-572. (PubMed)
203. Fortes C, Forastiere F, Agabiti N, et al.Влияние добавок цинка и витамина А на иммунный ответ у пожилого населения. J Am Geriatr Soc. 1998; 46 (1): 19-26. (PubMed)
204. Kahmann L, Uciechowski P, Warmuth S, et al. Прием цинка пожилым людям снижает спонтанное высвобождение воспалительных цитокинов и восстанавливает функции Т-клеток. Rejuvenation Res. 2008; 11 (1): 227-237. (PubMed)
205. Мокчегиани Э., Джаккони Р., Костарелли Л. и др. Дефицит цинка и полиморфизм IL-6 -174G / C у пожилых людей из разных европейских стран: влияние добавок цинка.ZINCAGE исследование. Exp Gerontol. 2008; 43 (5): 433-444. (PubMed)
206. Гладышев В.Н. Селенопротеины и селенопротеомы. В: Хэтфилд Д.Л., Берри М.Дж., Гладышев В.Н., ред. Селен: его молекулярная биология и роль в здоровье человека. 2 -й изд. Нью-Йорк: Спрингер; 2006: 99-114.
207. Артур JR, McKenzie RC, Beckett GJ. Селен в иммунной системе. J Nutr. 2003; 133 (5 доп. 1): 1457S-1459S. (PubMed)
208. McKenzie RC, Beckett GJ, Arthur JR.Влияние селена на иммунитет и старение. В: Хэтфилд Д.Л., Берри М.Дж., Гладышев В.Н., ред. Селен: его молекулярная биология и роль в здоровье человека. 2 -й изд. Нью-Йорк: Спрингер; 2006: 311-323.
209. Spallholz JE, Boylan LM, Larsen HS. Успехи в понимании роли селена в иммунной системе. Ann N Y Acad Sci. 1990; 587: 123-139. (PubMed)
210. Киремиджиан-Шумахер Л., Рой М., Више Х.И., Коэн М.В., Стоцки Г. Добавки с селеном и функции иммунных клеток человека.II. Воздействие на цитотоксические лимфоциты и естественные клетки-киллеры. Biol Trace Elem Res. 1994; 41 (1-2): 115-127. (PubMed)
211. Рой М., Киремиджиан-Шумахер Л., Више Х.И., Коэн М.В., Стоцки Г. Добавки с селеном и функции иммунных клеток человека. I. Влияние на пролиферацию лимфоцитов и экспрессию рецептора интерлейкина 2. Biol Trace Elem Res. 1994; 41 (1-2): 103-114. (PubMed)
212. Киремиджиан-Шумахер Л., Рой М., Гликман Р. и др. Селен и иммунокомпетентность у больных раком головы и шеи.Biol Trace Elem Res. 2000; 73 (2): 97-111. (PubMed)
213. Hoffmann PR, Berry MJ. Влияние селена на иммунные реакции. Mol Nutr Food Res. 2008; 52 (11): 1273-1280. (PubMed)
214. Брум С.С., МакАрдл Ф., Кайл Дж. А. и др. Увеличение потребления селена улучшает иммунную функцию и эффективность обращения с полиовирусом у взрослых с маргинальным селеновым статусом. Am J Clin Nutr. 2004; 80 (1): 154-162. (PubMed)
215. Баум М.К., Мигес-Бурбано М.Дж., Кампа А., Шор-Познер Г.Селен и интерлейкины у лиц, инфицированных вирусом иммунодефицита человека типа 1. J. Infect Dis. 2000; 182 Дополнение 1: S69-73. (PubMed)
216. Хуанг З., Роуз А. Х., Хоффманн ПР. Роль селена в воспалении и иммунитете: от молекулярных механизмов до терапевтических возможностей. Сигнал антиоксидантного окислительно-восстановительного потенциала. 2012; 16 (7): 705-743. (PubMed)
217. Броуди Т. Биохимия питания. 2 -й изд. Сан-Диего: Academic Press; 1999.
218. Борода Дж.Железо. В: Bowman BA, Russell RM, eds. Настоящие знания в области питания. 9 -е изд. Вашингтон, округ Колумбия: ILSI Press; 2006: 430-444.
219. Wood RJ, Ronnenberg AG. Железо. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, ред. Современное питание в здоровье и болезнях. 10 -е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2006: 248-270.
220. Доэрти С.П. Взаимодействия «хозяин-патоген»: роль железа. J Nutr. 2007; 137 (5): 1341-1344. (PubMed)
221.Борода JL. Биология железа в иммунной функции, метаболизме мышц и функционировании нейронов. J Nutr. 2001; 131 (2С-2): 568С-579С; обсуждение 580S. (PubMed)
222. Cassat JE, Skaar EP. Железо в инфекции и иммунитете. Клеточный микроб-хозяин. 2013; 13 (5): 509-519. (PubMed)
223. Прентис AM. Метаболизм железа, малярия и другие инфекции: о чем идет речь? J Nutr. 2008; 138 (12): 2537-2541. (PubMed)
224. Сазавал С., Блэк Р. Э., Рамсан М. и др. Влияние обычных профилактических добавок с железом и фолиевой кислотой на госпитализацию и смертность детей дошкольного возраста в условиях высокой передачи малярии: рандомизированное плацебо-контролируемое исследование на уровне сообщества.Ланцет. 2006; 367 (9505): 133-143. (PubMed)
225. Окебе Ю.Ю., Яхав Д., Шбита Р., Пол М. Пероральные добавки железа для детей в эндемичных по малярии районах. Кокрановская база данных Syst Rev.2011 (10): CD006589. (PubMed)
226. Ходжкинсон В., Петрис М.Дж. Гомеостаз меди на границе «хозяин-патоген». J Biol Chem. 2012; 287 (17): 13549-13555. (PubMed)
227. Williams DM. Дефицит меди у человека. Semin Hematol. 1983; 20 (2): 118-128. (PubMed)
228.Персиваль СС. Медь и иммунитет. Am J Clin Nutr. 1998; 67 (5 доп.): 1064S-1068S. (PubMed)
229. Failla ML, Hopkins RG. Является ли низкий уровень меди иммунодепрессивным? Nutr Rev.1998; 56 (1, часть 2): S59-64. (PubMed)
230. Heresi G, Castillo-Duran C, Munoz C, Arevalo M, Schlesinger L. Фагоцитоз и уровни иммуноглобулинов у детей с гипокупремией. Nutr Res 1985; 5: 1327-1334.
231. Келли Д.С., Дауду П.А., Тейлор П.С., Макки Б.Э., Тернлунд-младший. Влияние диет с низким содержанием меди на иммунный ответ человека.Am J Clin Nutr. 1995; 62 (2): 412-416. (PubMed)
232. Бонэм М., О’Коннор Дж. М., Ханниган Б. М., Штамм Дж. Дж. Иммунная система как физиологический индикатор маргинального статуса меди? Br J Nutr. 2002; 87 (5): 393-403. (PubMed)
233. Turnlund JR, Jacob RA, Keen CL, et al. Долгосрочное высокое потребление меди: влияние на показатели статуса меди, антиоксидантный статус и иммунную функцию у молодых мужчин. Am J Clin Nutr. 2004; 79 (6): 1037-1044. (PubMed)
234. Борчерс А. Т., Селми К., Мейерс Ф. Дж., Кин С. Л., Гершвин М. Е..Пробиотики и иммунитет. J Gastroenterol. 2009; 44 (1): 26-46. (PubMed)
235. Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr. 2000; 71 (6 доп.): 1682С-1687С; обсуждение 1688С-1690С. (PubMed)
236. Вест Н. П., Пайн Д. Б., Пик Дж. М., Криппс А. В.. Пробиотики, иммунитет и упражнения: обзор. Exerc Immunol Rev.2009; 15: 107-126. (PubMed)
237. де Врезе М., Шрезенмейр Дж. Пробиотики, пребиотики и синбиотики. Adv Biochem Eng Biotechnol.2008; 111: 1-66. (PubMed)
238. Ruemmele FM, Bier D, Marteau P, et al. Клинические доказательства иммуномодулирующего действия пробиотических бактерий. J Педиатр Гастроэнтерол Нутр. 2009; 48 (2): 126-141. (PubMed)
239. Виейра А.Т., Тейшейра М.М., Мартинс Ф.С. Роль пробиотиков и пребиотиков в формировании иммунитета кишечника. Фронт Иммунол. 2013; 4: 445. (PubMed)
240. Oelschlaeger TA. Механизмы действия пробиотиков — обзор. Int J Med Microbiol. 300 (1): 57-62.(PubMed)
241. Шерман П.М., Осса Дж. К., Джонсон-Генри К. Раскрытие механизмов действия пробиотиков. Nutr Clin Pract. 2009; 24 (1): 10-14. (PubMed)
242. Гольденберг Дж. З., Ма С. С., Сакстон Дж. Д. и др. Пробиотики для профилактики диареи, связанной с Clostridium difficile, у взрослых и детей. Кокрановская база данных Syst Rev.2013; 5: CD006095. (PubMed)
243. Паттани Р., Палда В.А., Хван С.В., Шах П.С. Пробиотики для профилактики антибиотико-ассоциированной диареи и инфекции Clostridium difficile среди госпитализированных пациентов: систематический обзор и метаанализ.Open Med. 2013; 7 (2): e56-67. (PubMed)
244. Якуб П. Старение, иммунитет и грипп: роль пробиотиков? Proc Nutr Soc. 2014; 73 (2): 309-317. (PubMed)
245. Maidens C, Childs C, Przemska A, Dayel IB, Yaqoob P. Модуляция ответа на вакцину путем сопутствующего введения пробиотиков. Br J Clin Pharmacol. 2013; 75 (3): 663-670. (PubMed)
246. Национальные институты здравоохранения НОЭИ. Клинические рекомендации по выявлению, оценке и лечению избыточного веса и ожирения у взрослых.Сентябрь 1998 г. Доступно в Интернете по адресу: http://www.nhlbi.nih.gov/guidelines/obesity/ob_gdlns.pdf.
247. Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath CW, Jr. Индекс массы тела и смертность в предполагаемой когорте взрослых США. N Engl J Med. 1999; 341 (15): 1097-1105. (PubMed)
248. Олефский Ю.М., Стекло СК. Макрофаги, воспаление и инсулинорезистентность. Анну Рев Физиол 72: 219-246. (PubMed)
249. Xu H, Barnes GT, Yang Q, et al. Хроническое воспаление жира играет решающую роль в развитии инсулинорезистентности, связанной с ожирением.J Clin Invest. 2003; 112 (12): 1821-1830. (PubMed)
250. de Heredia FP, Gomez-Martinez S, Marcos A. Ожирение, воспаление и иммунная система. Proc Nutr Soc. 2012; 71 (2): 332-338. (PubMed)
251. Эксли М.А., Хэнд Л., О’Ши Д., Линч Л. Взаимодействие между иммунной системой и жировой тканью при ожирении. J Endocrinol. 2014; 223 (2): Р41-48. (PubMed)
252. Мраз М., Халузик М. Роль иммунных клеток жировой ткани в ожирении и слабом воспалении.J Endocrinol. 2014; 222 (3): Р113-127. (PubMed)
253. Матарезе G, Moschos S, Mantzoros CS. Лептин в иммунологии. J Immunol. 2005; 174 (6): 3137-3142. (PubMed)
254. Освал А., Йео Г. Лептин и контроль массы тела: обзор его различных центральных мишеней, сигнальных механизмов и роли в патогенезе ожирения. Ожирение (Серебряная весна). 18 (2): 221-229. (PubMed)
255. Энриори П.Дж., Эванс А.Е., Синнаяха П., Коули М.А. Лептиновая резистентность и ожирение.Ожирение (Серебряная весна). 2006; 14 Прил. 5: 254С-258С. (PubMed)
256. Лаго Р., Гомес Р., Лаго Ф., Гомес-Рейно Дж., Гуалилло О. Лептин за пределами регулирования массы тела — современные концепции относительно его роли в иммунной функции и воспалении. Cell Immunol. 2008; 252 (1-2): 139-145. (PubMed)
257. Matarese G, Leiter EH, La Cava A. Leptin при аутоиммунных заболеваниях: многие вопросы, некоторые ответы. Тканевые антигены. 2007; 70 (2): 87-95. (PubMed)
258. Эспехо Б., Торрес А., Валентин М. и др.Ожирение способствует развитию хирургических и инфекционных осложнений после трансплантации почки. Transplant Proc. 2003; 35 (5): 1762-1763. (PubMed)
259. Canturk Z, Canturk NZ, Cetinarslan B, Utkan NZ, Tarkun I. Внутрибольничные инфекции и ожирение у хирургических пациентов. Obes Res. 2003; 11 (6): 769-775. (PubMed)
260. Фалагас М.Е., Компоти М. Ожирение и инфекции. Lancet Infect Dis. 2006; 6 (7): 438-446. (PubMed)
261. Уилсон Дж. А., Кларк Дж. Дж. Ожирение: препятствие для заживления послеоперационной раны.Adv Уход за кожными ранами. 2004; 17 (8): 426-435. (PubMed)
262. Scheinfeld NS. Ожирение и дерматология. Clin Dermatol. 2004; 22 (4): 303-309. (PubMed)
263. Janniger CK, Schwartz RA, Szepietowski JC, Reich A. Intertrigo и общие вторичные кожные инфекции. Я семейный врач. 2005; 72 (5): 833-838. (PubMed)
264. Milner JJ, Beck MA. Влияние ожирения на иммунный ответ на инфекцию. Proc Nutr Soc. 2012; 71 (2): 298-306. (PubMed)
265.Чандра РК, Кутти КМ. Иммунокомпетентность при ожирении. Acta Paediatr Scand. 1980; 69 (1): 25-30. (PubMed)
266. Милнер Дж. Дж., Бек М. А.. Влияние ожирения на иммунный ответ на инфекцию. Proc Nutr Soc. 2012; 71 (2): 298-306. (PubMed)
267. Чандра Р.К., Кутти К.М. Иммунокомпетентность при ожирении. Акта Педиатр Сканд . 1980; 69 (1): 25-30. (PubMed)
.