Имунная система. Информация об иммунитете человека, естественный, приобретенный иммунитет, неспецифические факторы защиты организма
Иммунная система человека защищает организм от инфекционных заболеваний, идентифицируя и уничтожая клетки вредных микроорганизмов, которые попадают в организм человека из внешней среды.
Иммунитет — защитная реакция организма, помогающая противостоять вторжению и распространению инфекции.В основе естественной защиты организма находятся клетки иммунной системы — макрофаги, лимфоциты и натуральные киллеры, которые опознают и уничтожают «чужаков», вторгшихся в организм. Именно от этих клеток зависит эффективность работы иммунной системы.
Конечной целью работы иммунитета является уничтожение болезнетворных бактерий
и вирусов, которые могут вызывать инфекционные заболевания. При этом чужеродные микроорганизмы постоянно меняются, поэтому иммунная система человека постоянно находится в активном состоянии, ни на минуту не прекращая свою работу.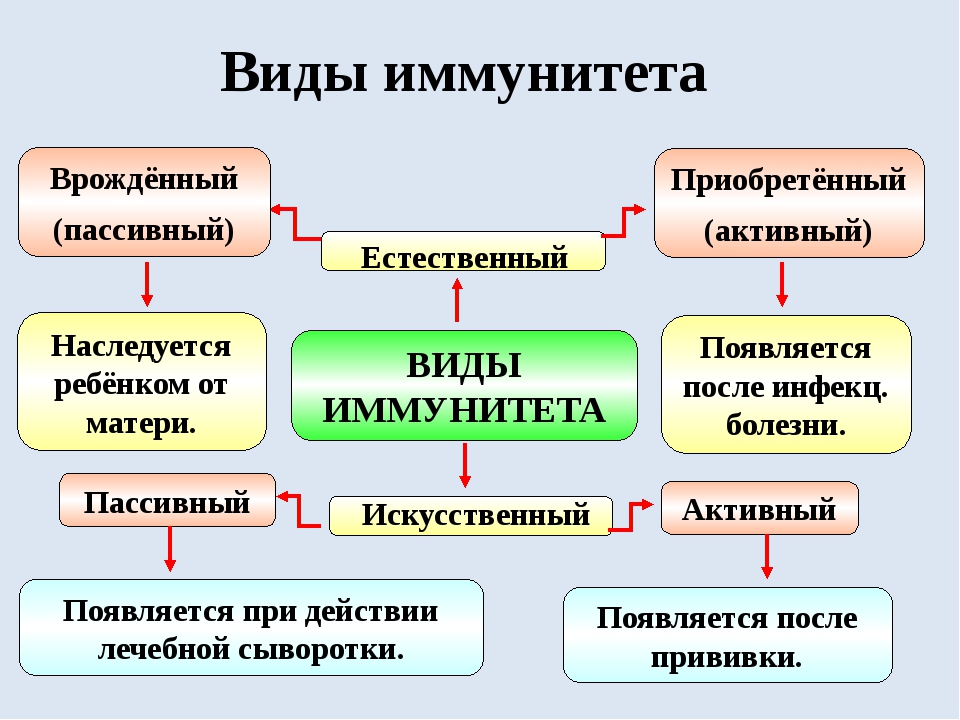
Иммунитет бывает врожденный и приобретенный. Врожденный иммунитет защищает организм от большинства рядовых возбудителей, а приобретенный возникает после перенесенного заболевания. Например, у перенесших ветряную оспу (корь, дифтерию) людей часто возникает пожизненный иммунитет к этим заболеваниям.
За работу врожденного иммунитета отвечают неспецифические механизмы иммунной защиты, в основе которых находится процесс поглощения и переваривания чужеродных микроорганизмов (фагоцитоз). В неспецифической защите участвуют и клетки—киллеры (NK—клетки), которые атакуют клеточную мембрану и вызывают разрушение зараженной вирусом клетки.
Неспецифическую защиту также обеспечивают белки, называемые интерферонами. Они вырабатываются клетками, инфицированными вирусами и ограничивают распространение вируса по организму.
Врожденный иммунитет требует более комплексного и тщательного поддержания
и укрепления, чтобы справляться со всем спектром возбудителей, встречающихся современному городскому человеку.
Сильная и крепкая иммунная система стоит на страже здоровья, естественным образом защищая организм человека от заболеваний.
Иммунитет: защита и нападение
Воспаление представляет собой реакцию ткани на инфекцию или повреждение и имеет следующие симптомы:
- покраснение вследствие усиления кровотока;
- отек вследствие накопления жидкости и клеток в тканях;
- боль вследствие повреждения ткани и раздражения нервных волокон;
- повышение температуры — местное (вследствие усиления кровотока) и/или системное (повышение температуры тела).
В процесс воспаления включаются белки плазмы крови — комплемент и цитокины. Комплементом называется ряд белков плазмы, вступающих в серию каскадных химических реакций в ответ на инфекцию. Это своего рода многоступенчатая сигнальная система, которая маркирует чужеродные микроорганизмы и привлекает в очаг инфекции специальные клетки — «убийцы» патогенов.
В ответ на сигнал тревоги начинается контратака защитной системы организма — запускается клеточный иммунный ответ. В неспецифическом иммунном ответе принимают участие два типа клеток крови — фагоциты и NK-клетки (или натуральные киллеры).
Фагоциты представляют собой крупные лейкоциты, поглощающие и буквально переваривающие внутри себя микроорганизмы и другие чужеродные частицы. Этот процесс называется фагоцитозом. Фагоциты наиболее чувствительны к микроорганизмам, помеченным белком-комплементом или антителами (эти частицы — уже часть адаптивного или специфического иммунного ответа). Кроме клеток, которые атакуют нарушителя по тревоге, в кровотоке также циркулирует регулярный «патруль» или особый вид лейкоцитов — натуральные киллеры. Их мишенью являются злокачественные клетки и клетки, инфицированные вирусами. Врожденный иммунитет быстро активируется на ранних стадиях инфекции. Его механизмы защиты могут ограничивать распространение патогенов в организме, но возможности для устранения чужеродных частиц ограничены и остаются прежними при повторном заражении тем же патогеном.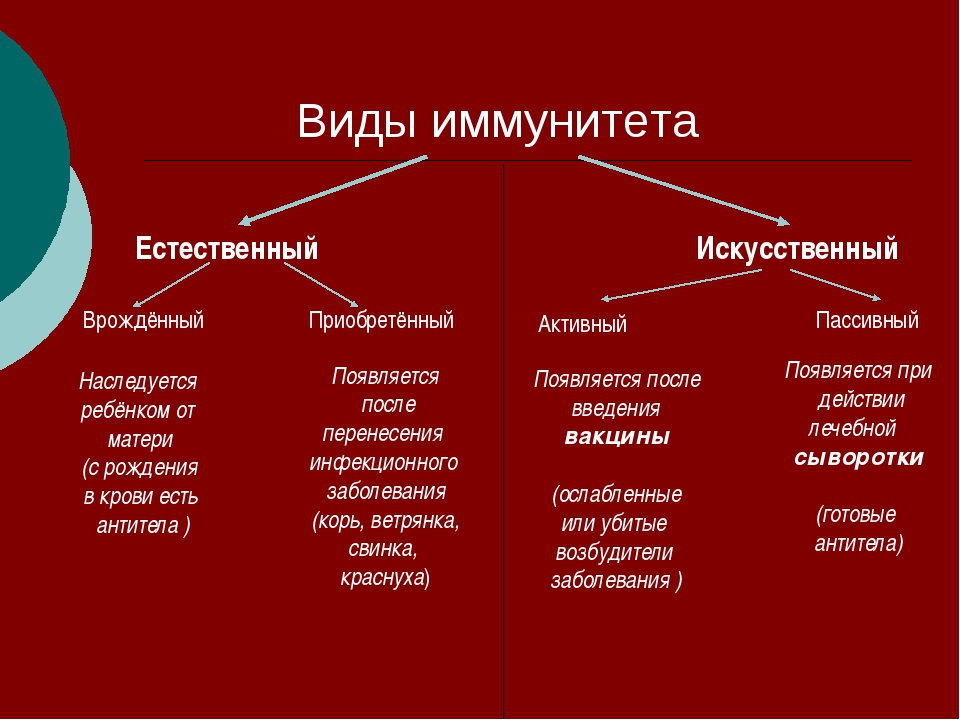
Адаптивный (приобретенный) иммунитет развивается после первой встречи с чужеродным агентом. Основными его качествами являются специфичность и иммунологическая память.
У специфического иммунитета в ответ на попадание в организм «чужака» в запасе имеется целая стратегия, которой позавидовали бы многие полководцы. «Основные войска» специфического иммунитета — лимфоциты. Это — специализированные лейкоциты, находящиеся в лимфатической системе. Лимфоциты характеризуются очень длительным периодом жизни — от нескольких лет до десятилетий! Известны три типа лимфоцитов: B-клетки, Т-клетки и натуральные киллеры (о них мы уже рассказывали).
Для развития адаптивного иммунитета требуется специфическая мишень — антиген. Антиген представляет собой вещество (обычно крупную молекулу), которая активирует иммунный ответ. Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Сначала происходит выработка В-клетками оружия против нарушителей — белка, который прореагирует с антигеном и сделает его безвредным. Эти белки носят название антител, называемых также иммуноглобулинами (Ig). Антитела очень специфичны и способны связываться только с антигеном той же структуры, что изначально стимулировал их образование. Когда антитело находит соответствующий ему антиген, они соединяются наподобие ключа, вставляемого в замочную скважину.
Затем приобретенный иммунитет начинает действовать сразу на два фронта: гуморальный иммунный ответ направлен на антигены, присутствующие в плазме крови, а клеточный иммунный ответ — на патогены, присутствующие внутри клеток.
В процессе гуморального иммунного ответа В-клетки, активированные специфическими антигенами, начинают усиленно делиться с образованием большого количества идентичных клеток-клонов, каждая из которых способна бороться с данным антигеном.
Клеточный иммунитет использует «специализированные силы» — T-хелперы и цитотоксические T-клетки, непосредственно атакующие и уничтожающие «войска противника» — инфицированные клетки.
После того, как война с инфекцией выиграна, В- и Т-клетки, активированные антигенами, переходят в состояние покоя и становятся лимфоцитами памяти, специфичными по отношению к данному антигену или патогену. При повторном заражении аналогичным или очень похожим (антигенно-аналогичным) микроорганизмом, они обеспечивают быстрый и мощный иммунный ответ. Высокие концентрации нужных антител достигаются уже через 1 — 2 дня после инфицирования.
Итак, приобретенный иммунитет характеризуется тремя основными особенностями:
-
Специфичность: каждое антитело или активированная Т-клетка реагирует только со специфичным антигеном, вызвавшим ее образование.
 При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
- Память: после того, как в процессе адаптивного иммунного ответа произошло образование специфичного антитела или Т-клетки, производство антител или активация Т-клеток происходит быстрее и в больших количествах. Данная особенность является основой эффекта многих вакцин.
- Толерантность к собственным тканям: механизмы адаптивного иммунного ответа в норме способны отличать собственные структуры организма от чужеродных.
что это такое, чем он характеризуется, как его поддержать?
Иммунная система влияет на качество жизни человека и его общее самочувствие. Она представляет собой единое целое, результат работы которого – человеческое здоровье. Выделяют несколько видов иммунитета.
Для чего нужен иммунитет?
Человека постоянно атакуют различные бактерии и микроорганизмы.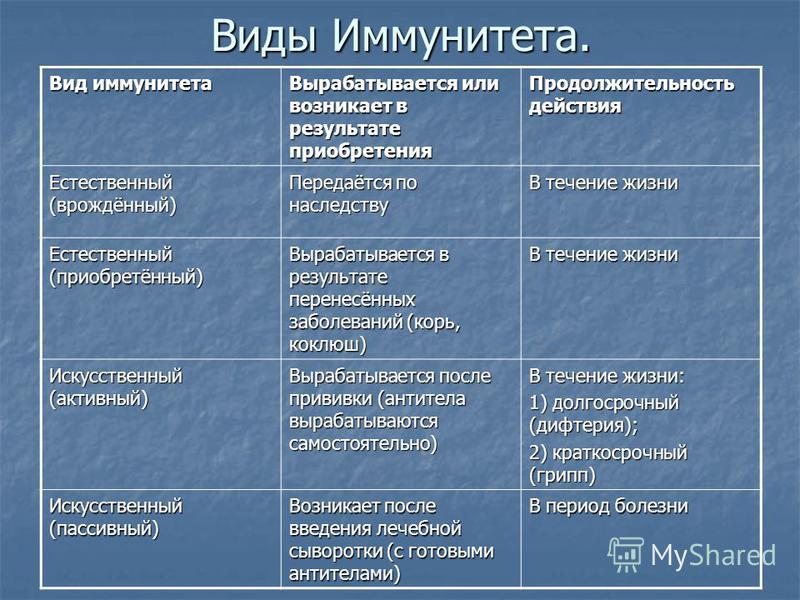 Они могут оказаться в организме через дыхательные пути, кожу, пищу, телесные отверстия. Люди, у которых ослаблена защитная система, в большей степени подвержены заболеваниям.
Они могут оказаться в организме через дыхательные пути, кожу, пищу, телесные отверстия. Люди, у которых ослаблена защитная система, в большей степени подвержены заболеваниям.
Иммунитет помогает вырабатывать антитела, которые предназначены для борьбы с инфекциями. Когда атака побеждена, в теле человека срабатывает иммунная память. Это нужно для того, чтобы в случае следующей атаки защитные силы справились с ней быстрее.
Виды иммунитета
Существует несколько классификаций, определяющих вид защитных сил. Все они построены на основании различных факторов.
- Естественный и искусственный. Эту классификацию считают самой распространенной и общепринятой.
- Общий и локальный. Общий – это все защитные силы, вместе взятые. Локальный отвечает за защиту какой-либо части или органа человеческого тела. Например, иммунитет горла.
- Врожденный и приобретенный.
 Основа такого разделения зависит от происхождения.
Основа такого разделения зависит от происхождения. - Инфекционный и неинфекционный. Классификация, основанная на направлении действия.
Естественный иммунитет
Задача естественного иммунитета – помогать организму противостоять вредным воздействиям. Эту форму защитных сил человек получает в наследство от своих родителей.
Внимание! Если ребенок рождается без иммунитета, то высока вероятность, что он умрет в младенчестве. Существует целый ряд заболеваний, которые возникают у новорожденных и опасны для них.
Природный иммунитет помогает ребенку распознавать угрозы извне и бороться с ними. Он различает полезные для организма факторы и сохраняет их. Если система не умеет различать факторы полезные и вредные, то организм будет уничтожать то, что жизненно важно для него. В таких случаях также велика вероятность осложнений, вплоть до летального исхода.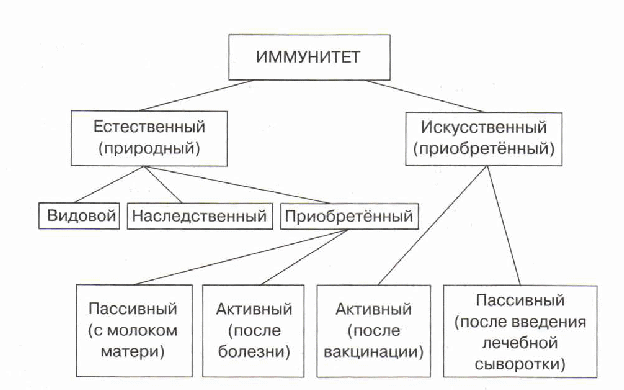
Работа природных защитных сил тела тесно связана с антигенами. Антигены помогают создать иммунную память, чтобы потом лучше бороться с поступающими угрозами. Когда ребенок еще мал, и такая память не сформировалась, за это отвечает естественный иммунитет. В дальнейшей его жизни, через вакцинацию, прививки или перенесение каких-либо болезней в организме начинает создаваться целая «библиотека» целенаправленных реакций.
Как укрепить иммунитет?
Защитные особенности начинают формироваться еще в утробе матери. От наследственных факторов они зависят на 50%. Остальные 50% приходятся на образ жизни самого человека. То есть даже если наследственный механизм ослаблен, то имеется возможность повлиять на приобретенный. Для этого требуется:
- Нормализовать режим сна. Многое зависит от сна и полноценного отдыха. Взрослый человек должен спать не менее 8 часов в сутки. Систематический недосып ведет к тому, что защита ослабляется.

- Быть физически активным. Доказано, что здоровье быстрее изнашивается, если человек ведет пассивный образ жизни.
- Отказаться от вредных привычек. Чрезмерное употребление спиртных напитков повышает риск развития инфекционных заболеваний.
- Скорректировать рацион питания. В меню здорового человека должна быть белковая пища, продукты с бета-каротином, свежие фрукты и овощи, еда, богатая цинком и селеном.
- Соблюдать правила личной гигиены. Соблюдение правил личной гигиены снижает риск заражения инфекционными заболеваниями.
За естественный иммунитет у ребенка отвечают его родители. От их наследственности и образа жизни будет зависеть степень защиты организма новорожденного.
О вакцинации
Подробно с информацией обо всех аспектах вакцинации (календарь прививок, прививки во время беременности и лактации, вакцинация путешественников, поствакцинальные осложнения, документы по вакцинопрофилактике, правила подготовки и поведения при проведении вакцинации и многое другое) Вы можете получить информацию на сайте: http://www.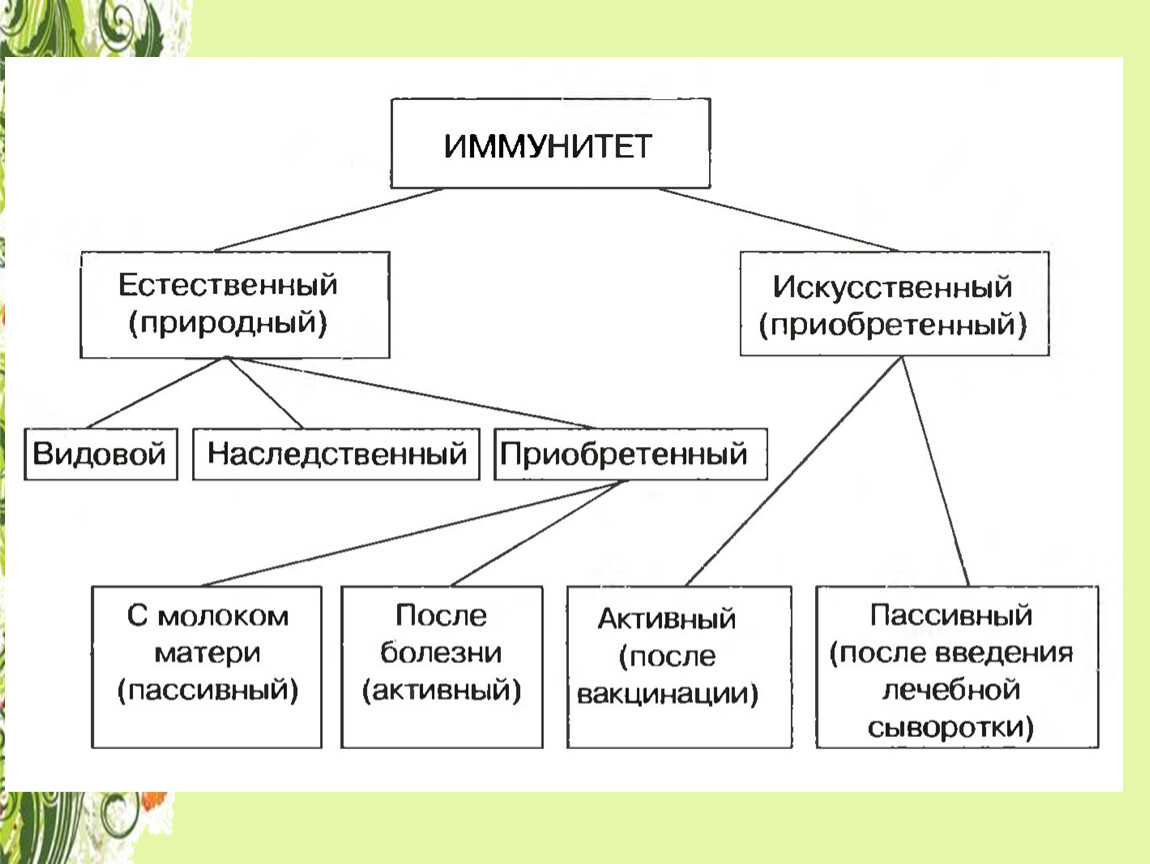 privivka.ru
privivka.ru
Вакцины — это иммунобиологические препараты, при введении которых в организм формируется активный, специфический иммунитет против определенной инфекции.
Активный потому, что организм сам вырабатывает защиту (специальные белки — антитела и клеточную защиту), искусственный потому, что нужно искусственно ввести вакцину в организм, специфический, так как иммунитет формируется против той конкретной инфекции, против которой проводится вакцинация.
Помимо искусственного, человек может иметь активный естественный иммунитет, который развивается после перенесенной инфекции. Кроме активного, существует пассивный иммунитет против инфекции. Естественный пассивный иммунитет ребенок приобретает внутриутробно при передаче от матери через плаценту готовых антител и при естественном вскармливании через грудное молоко. Искусственный пассивный иммунитет можно создать путем введения иммуноглобулинов (препаратов крови) или лечебных сывороток, которые содержат готовые антитела. Пассивный иммунитет, в отличие от активного, не длительный и обычно через 1-2 месяца пропадает, так как введенные антитела чужеродны для организма и постепенно разрушаются.
Вакцинные препараты получают из бактерий, вирусов или продуктов их жизнедеятельности. В зависимости от того, что является основным действующим началом (антигеном) выделяют вакцины инактивированные (неживые), живые и анатоксины. Антигенами называют любые вещества чужеродные для организма, способные вызвать реакцию клеток иммунной системы с последующим образованием антител и (или) специфической клеточной защиты.
Инактивированные (убитые, не живые) вакцины.
Это вакцины, в состав которых входит целиком инактивированный химическим или физическим воздействием микроорганизм (бактерия или вирус). Для химической обработки бактерий или вирусов используют формалин, спирт или фенол. Для физической — температурное воздействие или ультрафиолетовое облучение. Примером убитой, бактериальной вакцины, содержащей целиком весь микроорганизм является коклюшная вакцина, входящая в состав препарата АКДС. Примером вакцин, содержащих убитые вирусы, могут служить вакцины против гепатита А, клещевого энцефалита.
Вариантом неживых вакцин являются химические вакцины, в которых использованы отдельные части микроорганизма (антигены), отвечающие за выработку иммунитета к инфекции. К таким вакцинам относят безклеточную коклюшную вакцину и полисахаридные вакцины, содержащие полисахариды клеточной стенки микробов (вакцины против менингококков групп А и С, пневмококков, гемофильной инфекции типа b). Полисахариды низкомолекулярные вещества, иммунная система детей до 18 мес. не способна распознать такие антигены , поэтому их рекомендуют применять в возрасте старше18 месяцев. Чтобы можно было защитить от менингококковой, пневмококковой и гемофильной тип В инфекции маленьких детей до 1 года, необходимо их сделать крупными молекулами. Это достигается «сшиванием» полисахаридов белками (протеинами), такие вакцины уже называют конъюгированными и их можно применять с 2-х месячного возраста. В нашей стране зарегистрированы две конъюгированные вакцины против гемофильной инфекции тип В – Акт-Хиб и Хиберикс.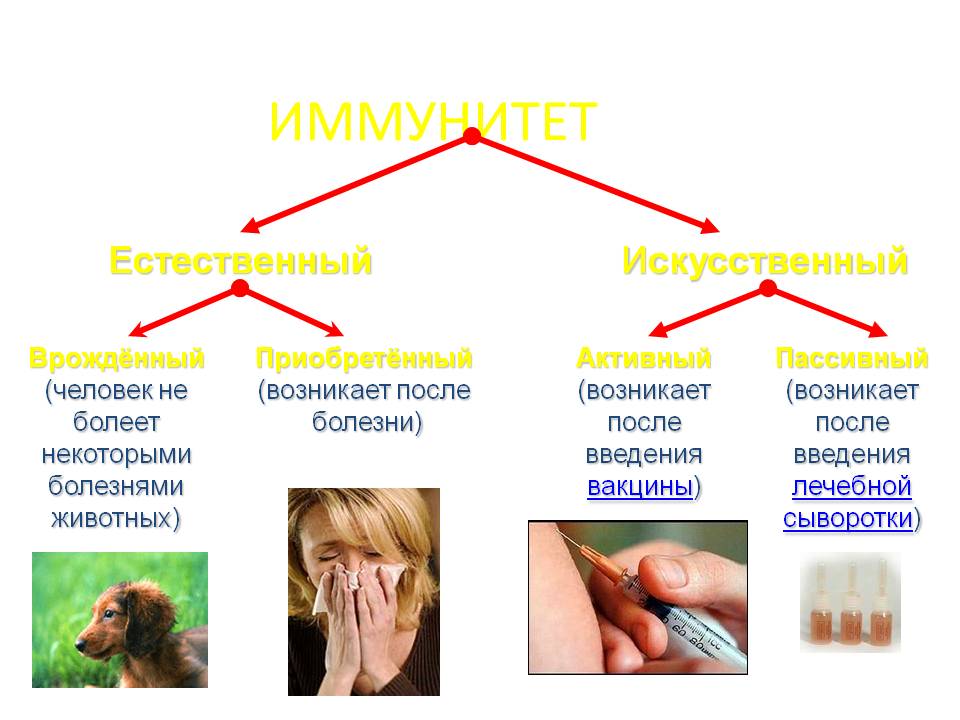
К неживым вакцинам относятся и рекомбинантные вакцины, которые производят генноинженерным путем. Эти вакцины не содержат никаких элементов вирусов или бактерий, так как действующий антиген построен дрожжевыми клетками.
Еще одним вариантом неживых вакцин являются анатоксины — это обезвреженные экзотоксины бактерий, обработанные формалином при повышенной температуре, а затем очищенные от балластных веществ. Пример – дифтерийный, столбнячный анатоксины, которые могут применяться раздельно или совместно.
Большинство неживых вакцин содержит дополнительные вещества – адсорбенты (адъюванты) и консерванты (стабилизаторы).
Адъюванты (адсорбенты) усиливают иммунный ответ на вакцину, но на них могут развиваться местные реакции в виде отека и гиперемии. В качестве адъювантов можно использовать различные вещества. Чаще всего в применяют гидроксид алюминия и полиоксидоний.
Консерванты обеспечивают длительное сохранение свойств вакцины. В качестве консервантов используют мертиолят (соль ртути) и формальдегид.
Важным общим свойством неживых вакцин является то, что они не размножаются в организме, не вызывают никаких вакциноассоциированных заболеваний и могут быть использованы даже у пациентов с иммунодефицитными состояниями. Следует знать и об особенности формирования иммунитета при применении инактивированных вакцин. Для создания полноценной защиты требуются повторные двух- или трехкратные введения препарата и последующие ревакцинации, проводимые через определенные интервалы. Такие схемы введения длительно поддерживают защиту на высоком уровне, но если сроки ревакцинаций нарушаются, иммунитет может снизиться или даже исчезнуть.
Живые вакцины
Живые вакцины производят из возбудителей, не вызывающих заболевания у человека, но создающих защиту к инфекции человека. Так, например, вакцина БЦЖ сделана на основе бычьих микобактерий, но иммунитет к ним защищает от туберкулеза человека.
Вторым вариантом получения живых вакцин является ослабление (аттенуация) диких микроорганизмов (например, вирусные вакцины против кори, свинки, краснухи, желтой лихорадки, живая, оральная вакцина против полиомиелита).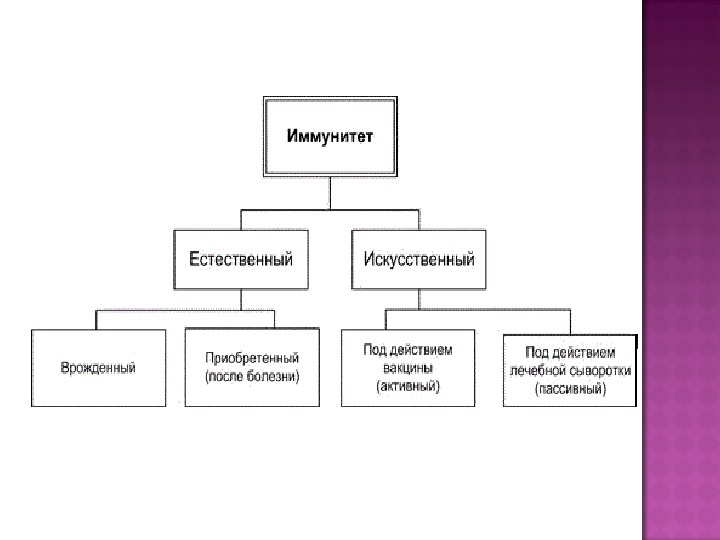
Ослабленные микроорганизмы обладают сниженной вирулентностью (заражающей способностью), но сохраняют антигенные свойства. После однократного введения в организм человека живые вакцины некоторое время размножаются, что создает как бы «легкую болезнь», благодаря чему стимулируют выработку напряженного и длительного защитного иммунитета до 10-15 лет. Поэтому живые вакцины не нужно вводить много раз, как неживые. Считают, что двукратное введение живых вакцин против кори, паротита, краснухи защищает практически на всю жизнь.
регистратура 905-899, 905-898 кабинет вакцинопрофилактики 905-897.
| < Предыдущая | Следующая > |
|---|
Что такое иммунитет
Основные клетки иммунной системы – фагоциты и лимфоциты (В- и Т-лимфоциты). Они циркулируют по кровеносной и лимфатической системе, некоторые из них могут проникать в ткани. Все клетки иммунной системы имеют определенные функции и работают в сложном взаимодействии, которое обеспечивается выработкой специальных биологически активных веществ – цитокинов.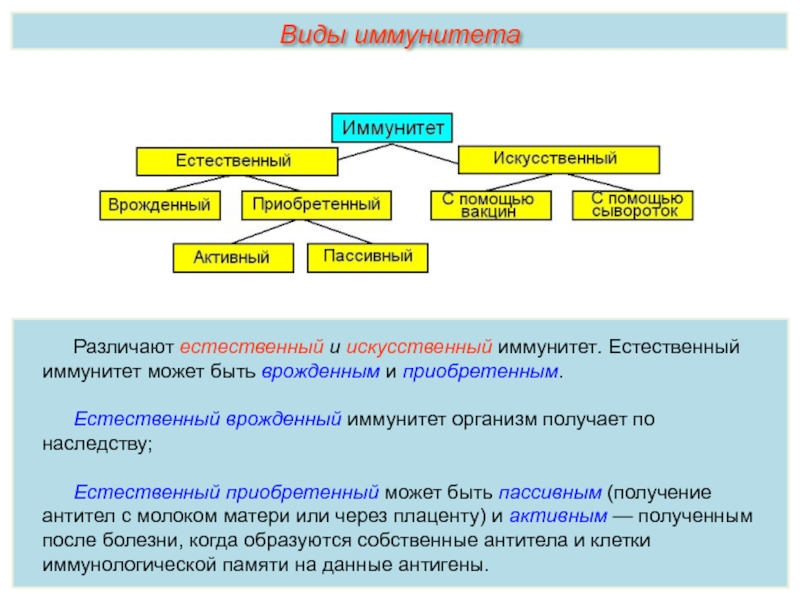
Фагоциты (в переводе на русский язык – «пожирающие») бросаются на пришельцев, поглощая и разрушая микробы, ядовитые вещества и другие чужеродные для организма клетки и ткани. При этом погибают и сами фагоциты, высвобождая вещества (медиаторы), вызывающие местную воспалительную реакцию и привлекающие новые группы фагоцитов на борьбу с антигенами.
Лимфоциты вырабатывают специфические белки (антитела) – иммуноглобулины, взаимодействующие с определенными антигенами и связывающие их. Антитела нейтрализуют активность ядов, микробов, делают их более доступными для фагоцитов.
Иммунная система «запоминает» те чужеродные вещества, с которыми она хоть раз встречалась и на которые реагировала. От этого зависит формирование невосприимчивости к «чужим» агентам, терпимости к собственным биологически активным веществам и повышенной чувствительности к аллергенам.
Нормально функционирующая иммунная система не реагирует на внутренние факторы и, в то же время, отторгает чужеродные воздействия на организм.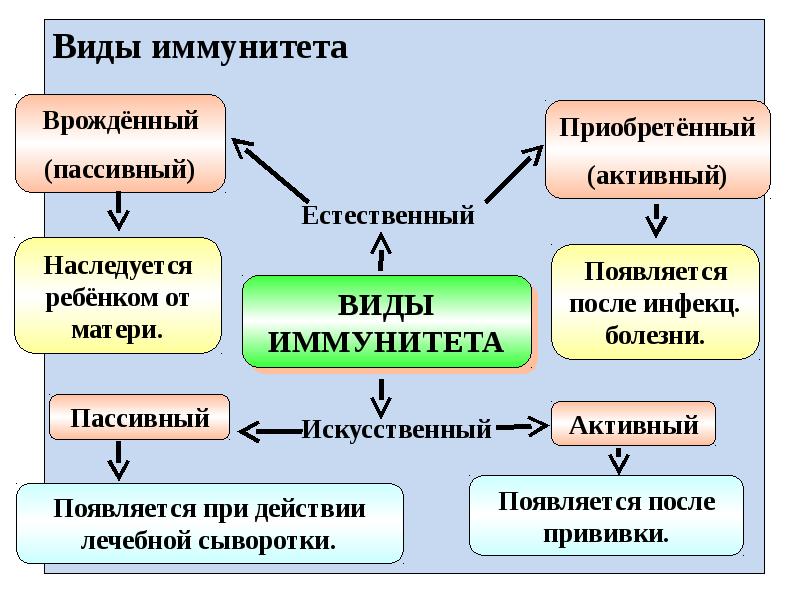 Она формирует иммунитет – противоинфекционный, трансплантационный, противоопухолевый.
Она формирует иммунитет – противоинфекционный, трансплантационный, противоопухолевый.
Иммунитет защищает организм от инфекционных болезней, освобождает его от погибших, переродившихся и ставших чужеродными клеток. Иммунные реакции являются причиной отторжения пересаженных органов и тканей. При врожденных или приобретенных дефектах иммунной системы возникают заболевания – иммунодефицитные, аутоиммунные или аллергические, вызванные повышенной чувствительностью организма к аллергенам.
Виды иммунитета. Различают естественный и искусственный иммунитет
Человек уже с рождения невосприимчив ко многим болезням. Такой иммунитет называют врожденным. Например, люди не болеют чумой животных, потому что у них в крови уже содержатся готовые антитела. Врожденный иммунитет передается по наследству от родителей. Организм получает антитела от матери через плаценту или с материнским молоком. Поэтому часто у детей, находящихся на искусственном вскармливании, ослаблен иммунитет. Они больше подвержены инфекционным заболеваниям и чаще страдают от диабета.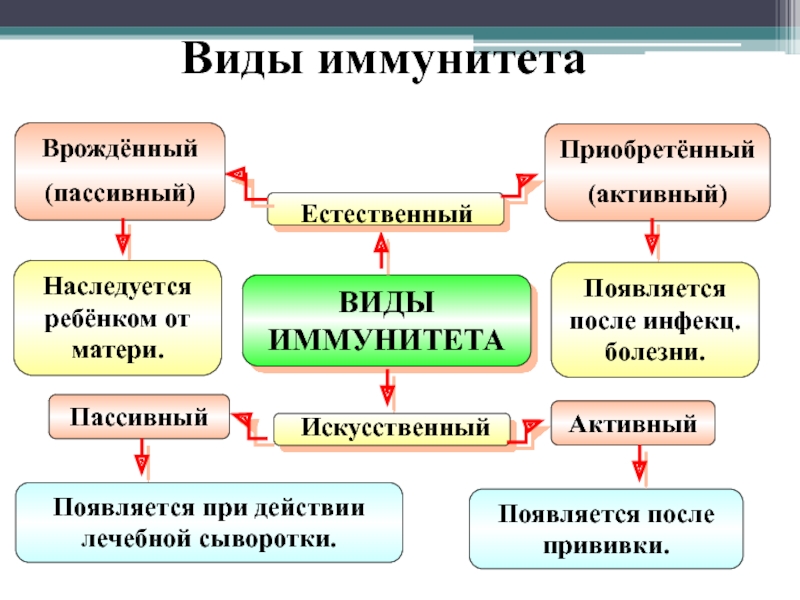 Врожденный иммунитет сохраняется всю жизнь, но он может быть преодолен, если дозы заражающего агента увеличатся или ослабеют защитные функции организма.
Врожденный иммунитет сохраняется всю жизнь, но он может быть преодолен, если дозы заражающего агента увеличатся или ослабеют защитные функции организма.
В некоторых случаях иммунитет возникает после перенесенных заболеваний. Это приобретенный иммунитет. Переболев один раз, люди приобретают невосприимчивость к возбудителю. Такой иммунитет может сохраняться десятки лет. Например, после кори остается пожизненный иммунитет. Но при других инфекциях, например, при гриппе, ангине, иммунитет сохраняется относительно недолго, и человек может перенести эти заболевания несколько раз в течение жизни. Врожденный и приобретенный иммунитет называют естественным. В частности, приобретённый иммунитет помогает справляться с различными инфекциями в будущем.
Инфекционный иммунитет всегда конкретен или, другими словами, специфичен. Он направлен только против определенного возбудителя и не распространяется на прочих.
Существует также искусственный иммунитет, который возникает в результате введения в организм готовых антител.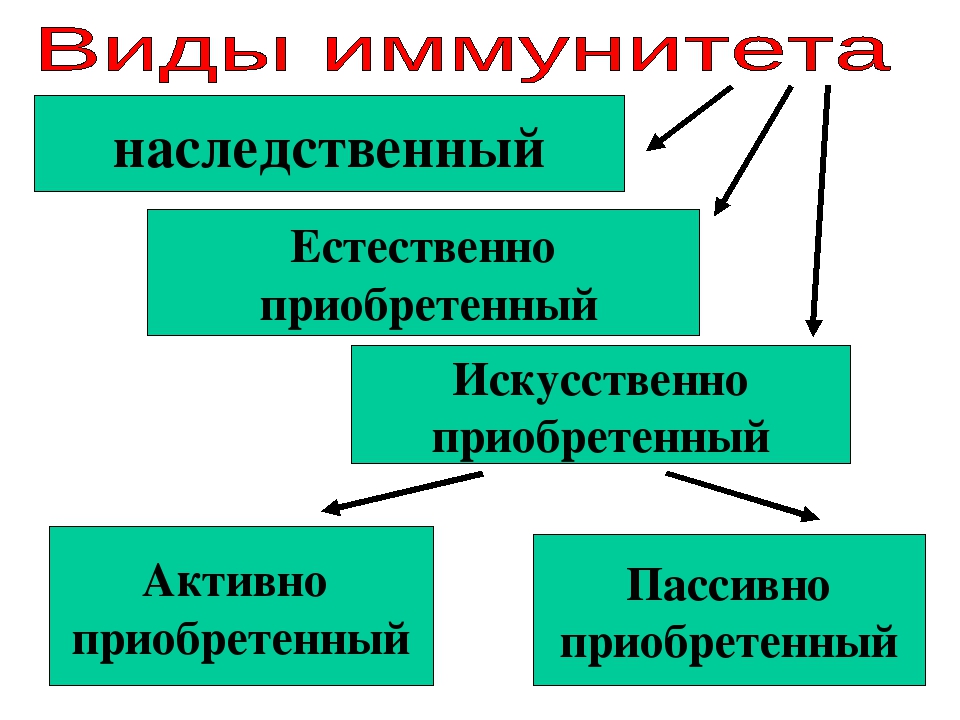 Это происходит, когда заболевшему человеку вводят сыворотку крови переболевших людей или животных, а также при введении ослабленных микробов – вакцины. В этом случае организм активно участвует в выработке собственных антител, и такой иммунитет остается на длительное время.
Это происходит, когда заболевшему человеку вводят сыворотку крови переболевших людей или животных, а также при введении ослабленных микробов – вакцины. В этом случае организм активно участвует в выработке собственных антител, и такой иммунитет остается на длительное время.
Признаки снижения иммунитета:
1. Быстрая утомляемость
2. Хроническая усталость
3. Сонливость, бессонница
4. Головные боли
5. Ломота в мышцах
6. Боли и ломота в суставах
7. Частая заболеваемость
8. Высыпания на коже вирусного характера (герпес и др.)
9. Длительное течение респираторных остро-вирусных заболеваний
10. Продолжительное повышение температуры 37.1-37.2, либо непродолжительное, но достаточно изматывающее
11. Общая слабость
12. Бледность кожных покровов
13. Снижение сопротивляемости
14. Неврозы и неврозоподобные состояния
15. Повышенная раздражительность, нарушение нормального сна
16. Рецидивирующие гнойно-септические инфекции (фурункулы, карбункулы, флегмоны, абсцессы и др. )
)
17. Грибковые поражения кожи, ногтей, слизистых оболочек
18. Стойкие к лечению и постоянно повторяющиеся болезни, например, дыхательных путей или носовых пазух, или мочевыделительной системы
В среднем, у 40-50% населения иммунитет снижен. Снижена способность организма соблюдать свою целостность и аутоидентичность. Поэтому методы, используемые в Клинике занимают особое место в профилактике заболеваний, коррекции иммунитета человека, от состояния которого зависит всё остальное в организме.
иммунитет к коронавирусу сохраняется даже после исчезновения антител
Иммунная система человека запоминает коронавирус SARS-CoV-2, чтобы противостоять ему при следующей атаке. Поэтому у пациентов появляется долговременный иммунитет. Он сохраняется даже после того, как антитела исчезают из крови переболевшего человека.
К таким выводам пришли авторы научной статьи, опубликованной в журнале Nature Medicine.
Запомнить врага в лицо
Иммунная система человека очень сложно устроена.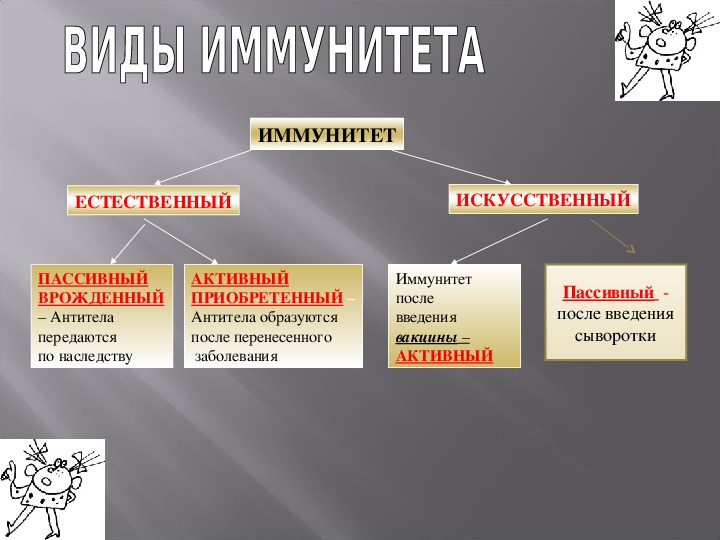 Но в самом упрощённом виде её реакция на инфекцию выглядит так.
Но в самом упрощённом виде её реакция на инфекцию выглядит так.
Первый рубеж нашей обороны – врождённый иммунитет. Как только в организм проникает патоген, он атакуется специальными клетками и химическими веществами. Этого хватает, чтобы уничтожить 99% незваных гостей.
Повезло людям, справившимся с инфекцией с помощью врождённого иммунитета, или нет? Это непростой вопрос. С одной стороны, большинство из них переносит инфекцию в лёгкой форме (раз уж организм останавливает возбудитель на первом «оборонительном рубеже»). Но с другой стороны, такие пациенты рискуют заболеть вновь.
Ведь у врождённого иммунитета нет памяти. Эта система организма не опознаёт патоген, с которым уже сталкивалась, и не заготавливает «оружия», направленного исключительно против него. По крайней мере, так считают практически все иммунологи. Хотя альтернативные мнения тоже есть.
Если же врождённый иммунитет не справляется, в бой вступает система приобретённого иммунитета. Его главное оружие – антитела.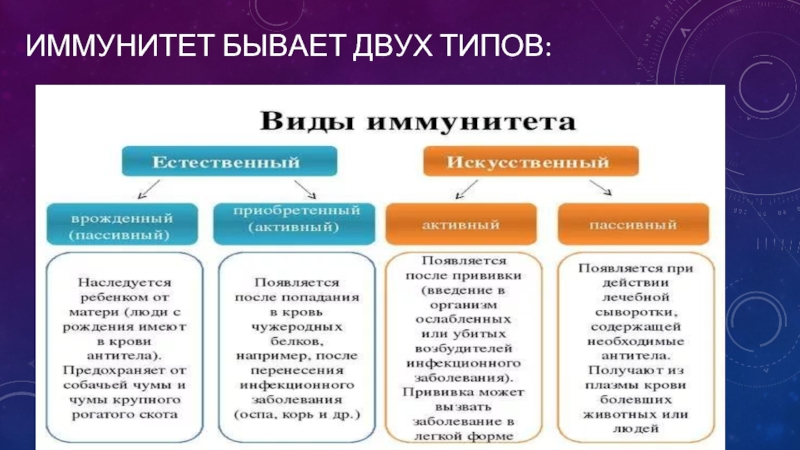 Это крупные молекулы белков, которые атакуют патоген и блокируют его.
Это крупные молекулы белков, которые атакуют патоген и блокируют его.
Но для борьбы с каждым видом вирусов или микробов необходимы свои собственные антитела. Если организм впервые сталкивается с этим патогеном, он ещё не знает, какое оружие против него работает эффективно. Тогда среди клеток, вырабатывающих антитела, начинается настоящий естественный отбор. В конце концов наше тело «выводит породу» клеток, продуцирующих нужные белки.
Организм вырабатывает антитела ещё некоторое время после победы над инфекцией, но в конце концов прекращает это делать. Нельзя же всё время стрелять в ту сторону, с которой однажды пришёл враг.
Однако наша иммунная система запоминает, какие антитела оказались эффективны против этого конкретного патогена. Для этого у неё есть специальные клетки, которые так и называются: Т-клетки памяти.
Когда организм столкнётся с этой же инфекцией ещё раз, иммунная система достанет из архивов информацию о том, каким оружием можно подавить нашествие захватчиков, и сразу же начнёт продуцировать нужные антитела.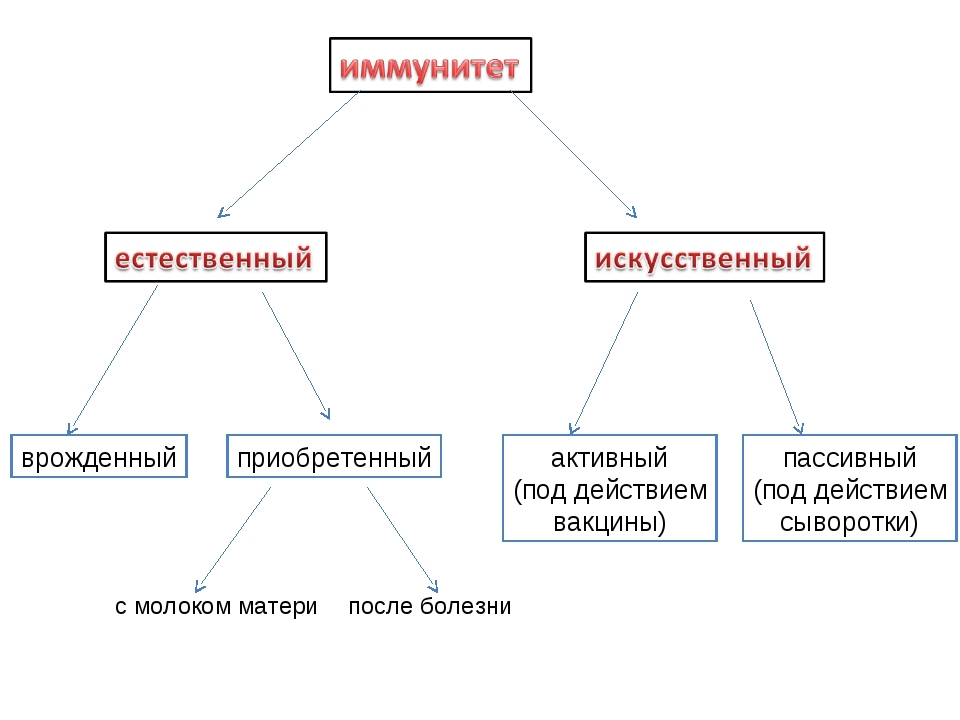 Поэтому человек, скорее всего, не заболеет или перенесёт болезнь в лёгкой форме. Так и работает приобретённый иммунитет.
Поэтому человек, скорее всего, не заболеет или перенесёт болезнь в лёгкой форме. Так и работает приобретённый иммунитет.
К слову, тот же самый механизм запускают и прививки, только вместо опасного патогена иммунная система тренируется на его безопасном «двойнике» – вакцине.
У человека вырабатывается долговременный иммунитет к коронавирусу, выяснили исследователи.
Коронавирус: правило или исключение?
Однако в этой сложной схеме не всегда всё срабатывает как надо. Иногда инфекция наносит организму непоправимые повреждения прежде, чем он успеет выработать эффективные антитела. Иногда патоген мутирует до неузнаваемости, и иммунной системе приходится заново учиться с ним бороться. Бывает и так, что Т-клетки памяти по каким-то причинам не сохраняют нужную информацию. Тогда организм не запоминает «рецепт» нужных антител. А значит, человек может заболеть снова.
Как обстоит дело с коронавирусом SARS-CoV-2 – виновником нынешней пандемии? Учёные уже убедились, что иногда он побеждается врождённым иммунитетом. Это значит, что у пациента не возникает приобретённый иммунитет, и он рискует заболеть вновь.
Это значит, что у пациента не возникает приобретённый иммунитет, и он рискует заболеть вновь.
У большинства переболевших всё-таки вырабатываются антитела. Но их содержание в крови постепенно уменьшается, и обычно сходит на нет уже через несколько месяцев (точные цифры зависят от конкретного пациента). В общем, это лишь временная защита.
А вот сохраняется ли информация о «рецепте» эффективных антител в Т-клетках памяти? И если да, то надолго ли?
Этим вопросом и задались авторы нового исследования. С помощью тонких методов они выявили Т-клетки, хранящие память именно о коронавирусе SARS-CoV-2, а не о других патогенах.
Учёные обследовали 20 выздоравливающих пациентов и почти у всех обнаружили такие клетки. Несколько человек были повторно обследованы через некоторое время. Анализ показал, что уровень одного вида антител упал ниже предела обнаружения через 29 дней после выздоровления, а другого – через 79 дней. Тем не менее «противоковидные» Т-клетки памяти по-прежнему присутствовали в крови испытуемых даже через 104 дня после выздоровления.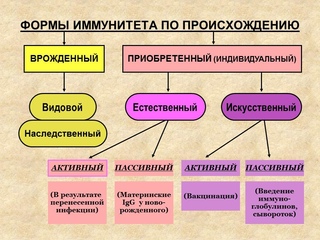 Скорее всего, они сохраняются и дольше.
Скорее всего, они сохраняются и дольше.
«Эти так называемые Т-клетки памяти, [образующиеся] после заражения [вирусом] SARS-CoV-2, похожи на клетки, [образующиеся] после обычного гриппа. Поэтому мы уверены, что большинство людей, переживших инфицирование SARS-CoV-2, имеют некоторую защиту от повторного заражения SARS-CoV-2», – утверждает соавтор статьи Майке Хофман (Maike Hofmann) из Фрайбургского университета.
Если результаты научной группы подтвердятся, это будет веским аргументом в пользу эффективности вакцин от коронавируса. Напомним, что Вести.Ru рассказывали о вакцинах, разработанных в России и за рубежом.
Искусственный и естественный иммунитеты. Факторы иммунитета.
Иммунитет человека – это единая, целостная система. Все ее клетки работают на один результат – здоровье организма. Тем не менее, условно ученые разделяют его на несколько видов для того, чтобы было проще изучать его и работать с ним. Современная наука выделяет врожденный и приобретенный виды иммунитета. Врожденный мы получаем от родителей, и на него в большой степени влияют генетические факторы. Он остается с нами на всю жизнь в неизменном виде. Другое дело – приобретенный иммунитет. На него можно и нужно воздействовать, развивать, укреплять, тренировать. Чтобы понять, каким образом это делать, нужно детально рассмотреть, как он классифицируется, и откуда берется.
Современная наука выделяет врожденный и приобретенный виды иммунитета. Врожденный мы получаем от родителей, и на него в большой степени влияют генетические факторы. Он остается с нами на всю жизнь в неизменном виде. Другое дело – приобретенный иммунитет. На него можно и нужно воздействовать, развивать, укреплять, тренировать. Чтобы понять, каким образом это делать, нужно детально рассмотреть, как он классифицируется, и откуда берется.
Приобретенный иммунитет делится на естественный и искусственный. Логично предположить, что естественный иммунитет приобретается благодаря определенным физиологическим процессам. Каждая болезнь, которую человек переносит, не проходит для организма бесследно. Антигены провоцируют выработку антител, клетки иммунитета, запоминают все, что им приходится делать, чтобы в следующий раз воспользоваться этой информацией. Таким образом, развивается естественный иммунитет. Он может быть активным или пассивным. После перенесенных болезней вырабатывается активный иммунитет. Пассивный естественный иммунитет вырабатывается вследствие передачи матерью иммунной информации новорожденному. Это происходит посредством грудного молока. Поэтому грудное вскармливание нельзя ничем заменить. Для ребенка это очень важная основа здоровья.
Пассивный естественный иммунитет вырабатывается вследствие передачи матерью иммунной информации новорожденному. Это происходит посредством грудного молока. Поэтому грудное вскармливание нельзя ничем заменить. Для ребенка это очень важная основа здоровья.
Искусственный иммунитет также может быть активным и пассивным. Когда человеку вводят вакцину, она активизирует выработку антител, как это происходит во время болезни. Это происходит благодаря тому, что в состав вакцин входят мертвые или ослабленные антигены, которые не могут вызвать болезнь, но могут вызвать иммунный ответ. Следствием всего этого является активный искусственный иммунитет. Бывает и обратная ситуация, когда человеку вводят сыворотку. Сыворотки – это вещества, которые содержит антигены против возбудителей определенных болезней. То есть, при проникновении определенного одноклеточного микроорганизма, иммунным клеткам не нужно формировать антигены, поскольку они уже есть в крови человека. Так формируется пассивный искусственный иммунитет.
Факторы иммунитета
Факторы иммунитета – это те «инструменты», которые обеспечивают защиту организма. Они делятся на клеточные, гуморальные и факторы саморегуляции.
Клеточные факторы иммунитета – это кожа и слизистые оболочки, процесс фагоцитоза, клетки-убийцы и видовая реактивность клеток. Все это создает механический барьер для вражеских микроорганизмов, а также поглощает и уничтожает их.
Гуморальные факторы иммунитета – это разнообразные ферменты и другие вещества, которые вырабатываются Т-лимфоцитами и макрофагами. Они содержатся в крови и других биологических жидкостях организма.
Факторы саморегуляции – это способность организма запускать некоторые процессы, которые способствуют излечению от болезни. Это, например, повышение температуры теля, изменение pH поврежденных тканей, выделение слизи, мокроты и другое.
Повышение иммунитета народными средствами
Многие люди испытывают дефицит иммунитета, но прибегать к фармацевтическим препаратам не хотят, объясняя это тем, что лишняя «химия» организму ни к чему. Это мудрое решение, поэтому повышение иммунитета народными средствами не теряет своей актуальности. Надо сказать, что такой метод подходит не всем, и тут большую роль играет внушаемость человека, а также глубина проблемы. Конечно, если речь идет о непродолжительных сезонных простудах, которые не слишком часты, не вызывают осложнений и быстро проходят, то в этом случае повышение иммунитета народными средствами будет эффективным. Если же проблема в серьезном иммунодефиците, который характеризуется частыми инфекционными заболеваниями, непроходящими вялотекущими простудами, слабостью, сонливостью – то нужны более радикальные методы и серьезное обследование.
Это мудрое решение, поэтому повышение иммунитета народными средствами не теряет своей актуальности. Надо сказать, что такой метод подходит не всем, и тут большую роль играет внушаемость человека, а также глубина проблемы. Конечно, если речь идет о непродолжительных сезонных простудах, которые не слишком часты, не вызывают осложнений и быстро проходят, то в этом случае повышение иммунитета народными средствами будет эффективным. Если же проблема в серьезном иммунодефиците, который характеризуется частыми инфекционными заболеваниями, непроходящими вялотекущими простудами, слабостью, сонливостью – то нужны более радикальные методы и серьезное обследование.
Если вам интересно повышение иммунитета народными средствами, мы приведем несколько простых и действенных рецептов, проверенных временем.
2 столовых ложки хвои нужно прокипятить в 500 граммах воды полчаса. Дать настояться и добавить 2 столовые ложки меда, разделить на 2 приема в день.
Витаминное варенье для иммунитета можно приготовить из 500 граммов клюквы, 4 средних яблок и стакана грецких орехов.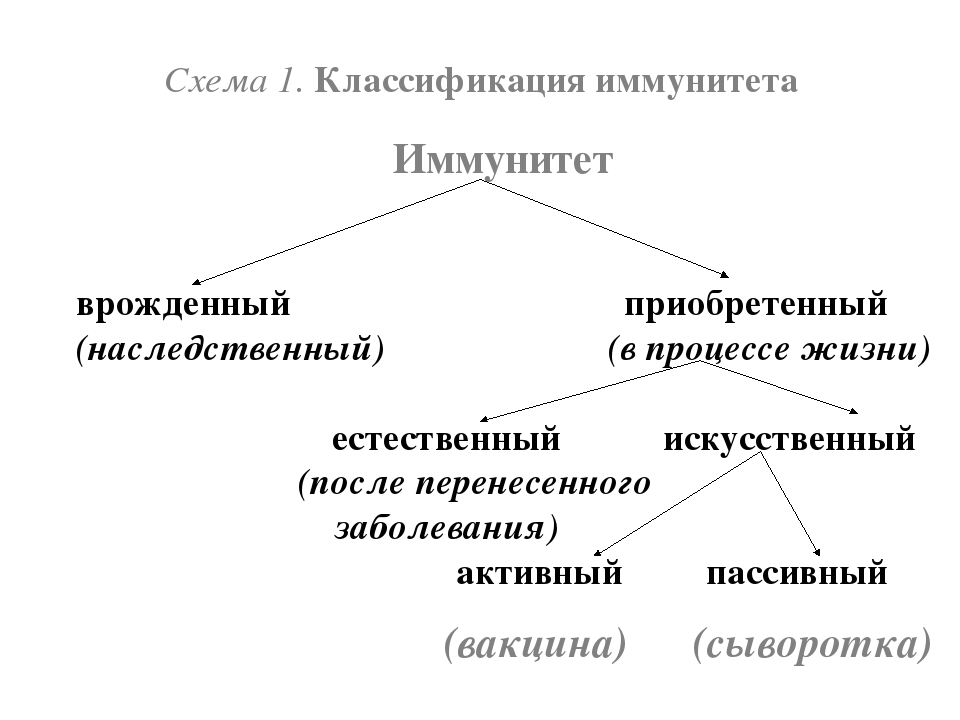 Все нужно измельчить, добавить 2 стакана сахара и полстакана воды. Варить все на медленном огне, чтобы прокипело. Потом разложить в банки и принимать по столовой ложке с чаем 2-3 раза в день.
Все нужно измельчить, добавить 2 стакана сахара и полстакана воды. Варить все на медленном огне, чтобы прокипело. Потом разложить в банки и принимать по столовой ложке с чаем 2-3 раза в день.
3 части сока алоэ, 5 частей меда и 7 частей кагора смешать и настоять в темном месте в течение недели. Принимать смесь по столовой ложке перед каждым основным приемом пищи.
Мы упомянули в этой статье, что иммунитет можно тренировать. Это действительно так, и сегодня для этого не обязательно переносить болезни или вводить дорогостоящие сыворотки и вакцины. Конечно, плановое вакцинирование согласно государственному календарю прививок – это необходимое мероприятие. Каждый обязан привиться и привить детей.
Говоря о тренировке иммунитета, мы имеем в виду снабжение его иммунной информацией, на основе которой работают клетки иммунной системы. Эта информация содержится на особых носителях, трансфер факторах, которые присущи всем млекопитающим. Носители эти состоят из 44 аминокислот – это длинные цепочки, которые способны вместить огромное количество информации. Это иммунная память млекопитающих, в которой сосредоточены знания иммунных клеток обо всех вредоносных микроорганизмах и методах борьбы с ними. Когда иммунитет обладает этими знаниями, он просто не подпускает одноклеточные на пушечный выстрел, сразу уничтожая их. Это самое совершенное оружие против болезней.
Это иммунная память млекопитающих, в которой сосредоточены знания иммунных клеток обо всех вредоносных микроорганизмах и методах борьбы с ними. Когда иммунитет обладает этими знаниями, он просто не подпускает одноклеточные на пушечный выстрел, сразу уничтожая их. Это самое совершенное оружие против болезней.
Трансфер факторы содержатся во многих биологических жидкостях, но основной их источник это молозиво любого млекопитающего. С молозивом матери передают детям иммунную память клеток, таким образом, закладывая прочный фундамент для их здоровья. Именно на этом и основано действие иммуномодулятора Трансфер фактор. Передавая иммунную память, он тренирует иммунитет человека. Это не стимуляция иммунитета, не повышение активности клеток – это разъяснение им их функций. Благодаря тому, что Трансфер фактор действует таким путем, он не представляет никакой опасности, поскольку побочных действий или привыкания вызвать не может. Кроме того, он изготавливается на основе натурального сырья – коровьего молозива, которое издавна использовалось нашими предками для укрепления здоровья.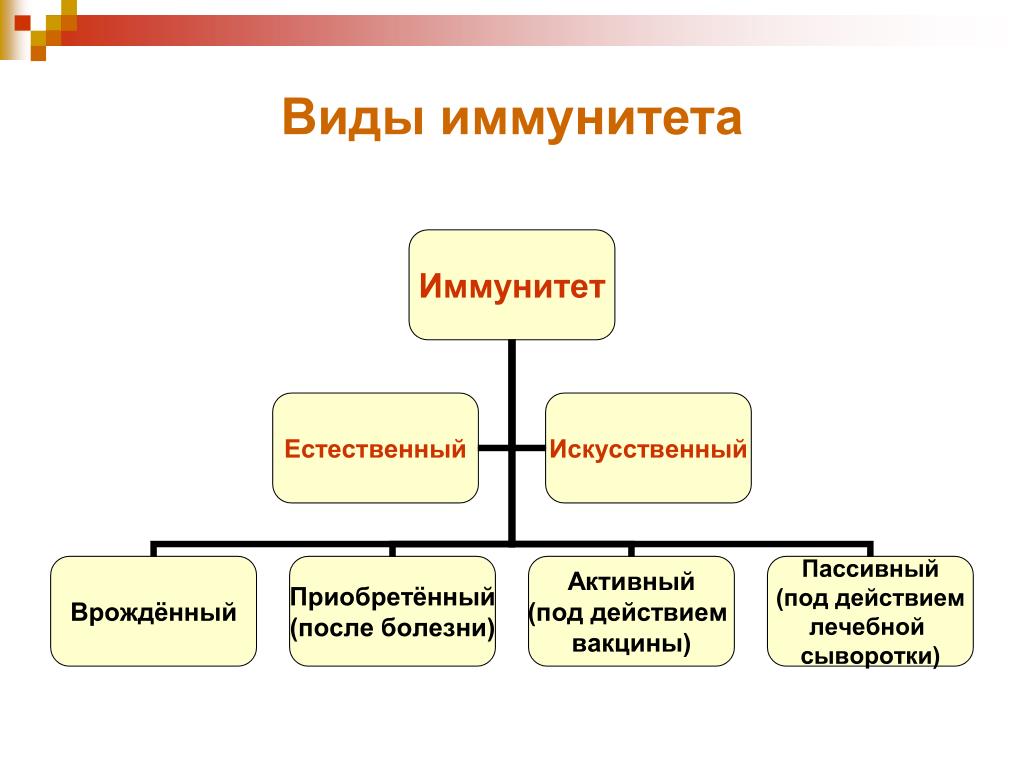 Трансфер факторы добываются из молозива благодаря запатентованной технологии ультрафильтрации.
Трансфер факторы добываются из молозива благодаря запатентованной технологии ультрафильтрации.
Безопасность Трансфер фактора подтверждена Минздравом России, который рекомендует использовать его вне зависимости от возраста, цели и диагноза. Он эффективен как профилактическое средство, и как дополнение к традиционному лечению. Трансфер фактор назначают даже младенцам и будущим мамам, что является лучшим подтверждением его безопасности.
Классифицирующий иммунитет | Безграничная микробиология
Естественный активный иммунитет
Естественно приобретенный активный иммунитет возникает, когда человек подвергается воздействию живого патогена, у него развивается болезнь, а затем развивается иммунитет.
Цели обучения
Сравните и противопоставьте: активный естественный и активный искусственный иммунитет
Основные выводы
Ключевые моменты
- Как только микроб проникает через кожу, слизистые оболочки или другие первичные защитные механизмы организма, он взаимодействует с иммунной системой.

- Активная иммунизация влечет за собой введение в организм чужеродной молекулы, которая вызывает развитие иммунного ответа через активацию Т-клеток и В-клеток.
- Принцип иммунизации заключается во введении антигена, полученного из болезнетворного организма, который стимулирует иммунную систему к выработке защитного иммунитета против этого организма, но который сам по себе не вызывает патогенных эффектов этого организма.
Ключевые термины
- иммунитет : состояние невосприимчивости к определенной вещи.
- вакцинация : прививка вакциной для защиты определенного заболевания или штамма заболевания.
Иммунитет — это состояние защиты от инфекционного заболевания, обеспечиваемое иммунным ответом, вызванным иммунизацией или предыдущей инфекцией, или другими неиммунологическими факторами. Есть два способа обрести активную сопротивляемость вторжению микробов: активный естественный и активный искусственный.
Вакцинация против брюшного тифа : Иммунизация (обычно называемая вакцинацией) — это преднамеренная индукция иммунного ответа и представляет собой единственную наиболее эффективную манипуляцию с иммунной системой, разработанную учеными.
Естественно приобретенный активный иммунитет возникает, когда человек подвергается воздействию живого патогена, у него развивается болезнь и становится иммунным в результате первичного иммунного ответа. Как только микроб проникает через кожу, слизистые оболочки или другие первичные защитные механизмы организма, он взаимодействует с иммунной системой. В-клетки в организме вырабатывают антитела, которые помогают бороться с вторгающимися микробами. Для развития адаптивного иммунного ответа, генерируемого против патогена, требуются дни или недели, но он может быть длительным или даже пожизненным.Дикие инфекции, например, вирусом гепатита A (HAV), и последующее выздоровление вызывают естественный активный иммунный ответ, обычно ведущий к пожизненной защите.
Аналогичным образом введение двух доз вакцины против гепатита А вызывает приобретенный активный иммунный ответ, ведущий к длительной (возможно, пожизненной) защите. Иммунизация (обычно называемая вакцинацией) — это преднамеренная индукция иммунного ответа и представляет собой единственное наиболее эффективное средство манипулирования иммунной системой, разработанное учеными.Иммунизация успешна, потому что использует естественную специфичность иммунной системы, а также ее индуцируемость. Принцип иммунизации заключается во введении антигена, полученного из болезнетворного организма, который стимулирует иммунную систему к выработке защитного иммунитета против этого организма, но который сам по себе не вызывает патогенных эффектов этого организма.
Естественный пассивный иммунитет
Естественно приобретенный пассивный иммунитет возникает во время беременности, когда антитела переходят из материнской крови в кровоток плода.
Цели обучения
Обрисуйте различные способы получения пассивной невосприимчивости
Основные выводы
Ключевые моменты
- Иммунитет передается через плаценту в виде антител, в основном IgG и IgA.

- Естественный пассивный иммунитет также может передаваться через грудное молоко.
- Естественный пассивный иммунитет недолговечен после рождения ребенка.
Ключевые термины
- IgG : иммуноглобулин G представляет собой изотип антитела.
- IgA : иммуноглобулин А представляет собой изотип антитела.
- пассивный иммунитет : передача активного гуморального иммунитета от одного человека к другому в форме специально созданных антител.
Иммунитет — это состояние защиты от инфекционного заболевания, обеспечиваемое иммунным ответом, вызванным иммунизацией или предыдущей инфекцией, или другими неиммунологическими факторами. Есть два способа обрести пассивную сопротивляемость болезням: пассивный естественный и пассивный искусственный.Естественно приобретенный пассивный иммунитет возникает во время беременности, при которой определенные антитела переходят из материнской крови в кровоток плода в виде IgG.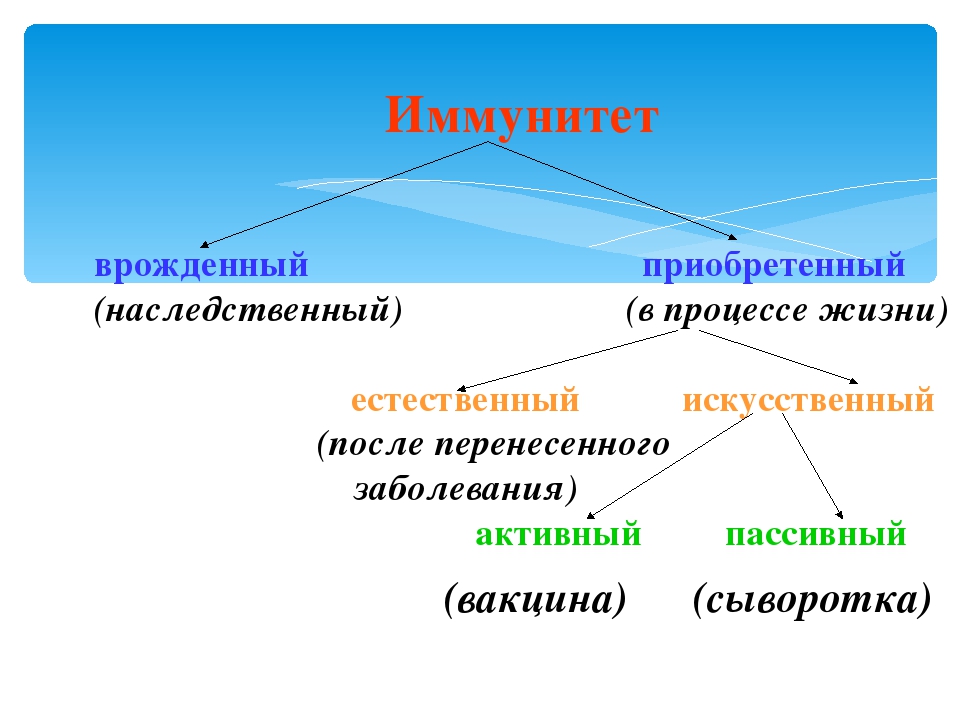 Антитела передаются от одного человека к другому естественным путем, например, в пренатальных и послеродовых отношениях между матерью и ребенком. Некоторые антитела могут проникать через плаценту и попадать в кровь плода. Это обеспечивает некоторую защиту ребенка на короткое время после рождения, но в конечном итоге она ухудшается, и младенец должен полагаться на свою собственную иммунную систему.Антитела также могут передаваться через грудное молоко. Перенос IgG от матери к плоду во время беременности обычно длится от 4 до 6 месяцев после рождения. Иммунные ответы достигают полной силы примерно в 5 лет.
Антитела передаются от одного человека к другому естественным путем, например, в пренатальных и послеродовых отношениях между матерью и ребенком. Некоторые антитела могут проникать через плаценту и попадать в кровь плода. Это обеспечивает некоторую защиту ребенка на короткое время после рождения, но в конечном итоге она ухудшается, и младенец должен полагаться на свою собственную иммунную систему.Антитела также могут передаваться через грудное молоко. Перенос IgG от матери к плоду во время беременности обычно длится от 4 до 6 месяцев после рождения. Иммунные ответы достигают полной силы примерно в 5 лет.
антитело IgA : димерная молекула IgA.1 H-цепь2 L-цепь3 J-цепь4 секреторный компонент. Антитела IgA передаются от матери к ребенку с молозивом и молоком и обеспечивают пассивный иммунитет.
Пассивный иммунитет также может быть в форме IgA и IgG, обнаруженных в человеческом молозиве и молоке грудных детей.Помимо IgA и IgG, грудное молоко также содержит: олигосахариды и муцины, которые прикрепляются к бактериям и вирусам, препятствуя их прикреплению к клеткам-хозяевам; лактоферрин связывает железо и делает его недоступным для большинства бактерий; B 12 связывающий белок, лишающий бактерии необходимого витамина B 12; бифид-фактор, который способствует росту Lactobacillus bifidus, нормальной микрофлоры желудочно-кишечного тракта младенцев, вытесняющей вредные бактерии; фибронектин, который увеличивает антимикробную активность макрофагов и помогает восстанавливать поврежденные ткани в результате инфекции в желудочно-кишечном тракте; гамма-интерферон, цитокин, усиливающий активность определенных иммунных клеток; гормоны и факторы роста, которые стимулируют желудочно-кишечный тракт ребенка быстрее созреть и стать менее восприимчивым к инфекциям; и лизоцим для расщепления пептидогликана в стенках бактериальных клеток.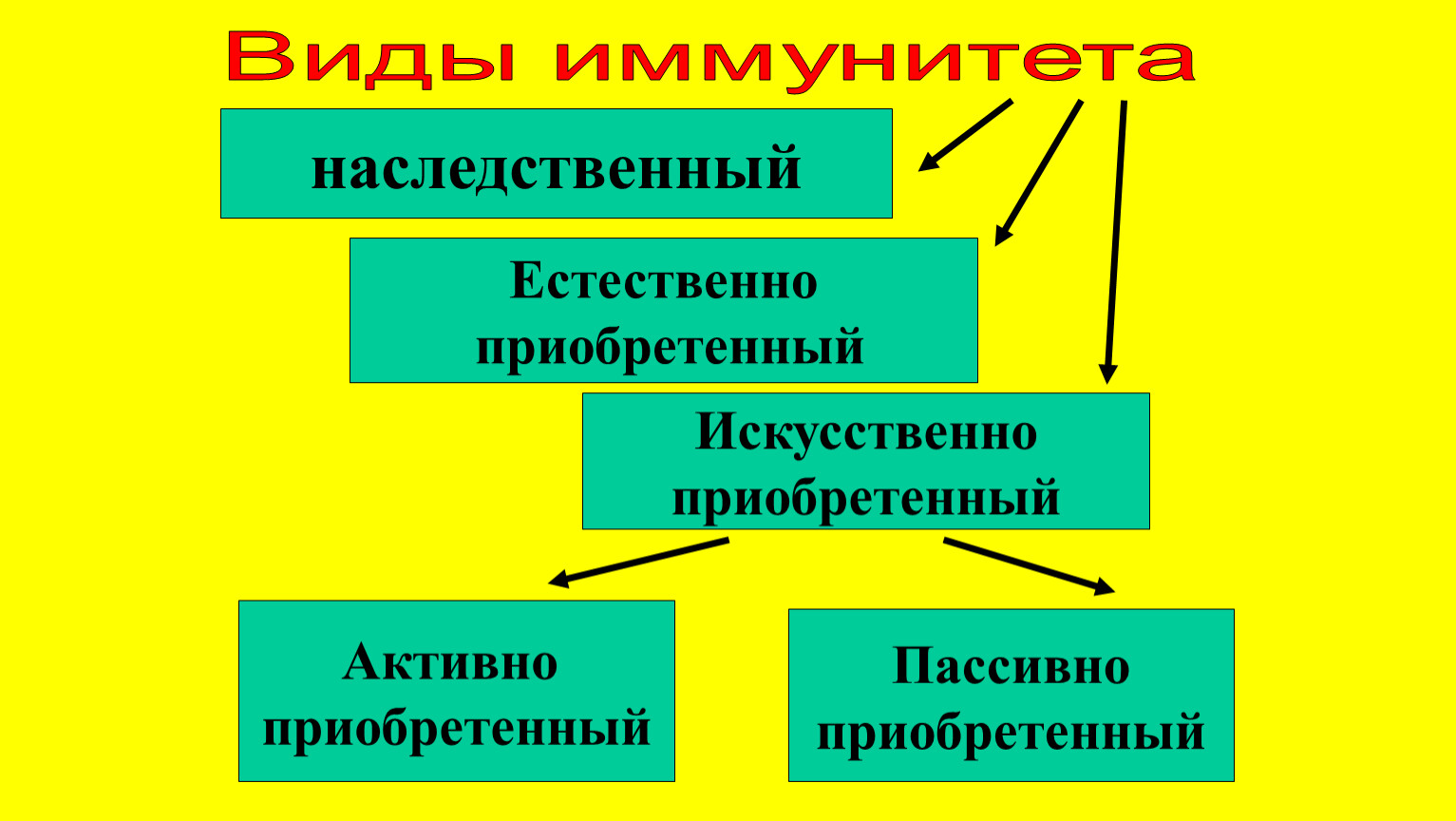
Искусственный иммунитет
Искусственный иммунитет — это средство, с помощью которого организм получает иммунитет к болезни путем преднамеренного воздействия на нее небольших количеств.
Цели обучения
Опишите искусственно приобретенный иммунитет и способы его получения
Основные выводы
Ключевые моменты
- Самая распространенная форма искусственного иммунитета классифицируется как активная и представляет собой прививки, которые обычно делаются детям и молодым людям.
- Пассивная форма искусственного иммунитета включает введение антитела в систему после того, как человек уже инфицирован болезнью, что в конечном итоге облегчает нынешние симптомы болезни и предотвращает ее повторное появление.
- После того, как организм успешно избавился от болезни, вызванной определенным патогеном, повторное заражение тем же патогеном окажется безвредным.
Ключевые термины
- гамма-глобулин : класс белков в крови, определяемый по их положению после электрофореза белков сыворотки, например антитела
- анафилактический шок : тяжелая и быстрая системная аллергическая реакция на аллерген, сужающая трахею и препятствующая дыханию.

- коллективный иммунитет : защита, предоставляемая сообществу от эпидемии заразного заболевания, когда достаточное количество населения иммунизировано или иным образом развивает иммунитет к нему
Иммунитет — это состояние защиты от инфекционного заболевания, обеспечиваемое иммунным ответом, вызванным иммунизацией, предыдущей инфекцией или другими неиммунологическими факторами.
Искусственный иммунитет может быть активным или пассивным.
Иммунитет : Естественный иммунитет возникает при контакте с возбудителем болезни, когда контакт не был преднамеренным, а искусственный иммунитет развивается только в результате преднамеренных воздействий.И естественный, и искусственный иммунитет можно подразделить дальше, в зависимости от продолжительности действия защиты. Пассивный иммунитет недолговечен и обычно длится всего несколько месяцев, тогда как защита с помощью активного иммунитета длится намного дольше, а иногда и пожизненно.
Искусственно приобретенный пассивный иммунитет — это немедленная, но краткосрочная иммунизация, обеспечиваемая инъекцией антител, таких как гамма-глобулин, которые не продуцируются клетками реципиента. Эти антитела вырабатываются у другого человека или животного, а затем вводятся другому человеку.Антисыворотка — это общий термин, используемый для препаратов, содержащих антитела.
Искусственная активная иммунизация — это когда микроб или его части вводятся человеку до того, как он сможет принять его естественным путем. Если используются целые микробы, это предварительно обработанные ослабленные вакцины. Эта вакцина стимулирует первичный ответ против антигена у реципиента, не вызывая симптомов болезни.
Искусственная пассивная иммунизация обычно проводится с помощью инъекций и используется в случае недавней вспышки определенного заболевания или в качестве неотложной помощи при токсичности, например столбняке.Антитела могут вырабатываться у животных, что называется «сывороточной терапией», хотя существует высокая вероятность анафилактического шока из-за иммунитета против самой сыворотки животных. Таким образом, вместо них используются гуманизированные антитела, продуцируемые культурой клеток in vitro, если они доступны.
Таким образом, вместо них используются гуманизированные антитела, продуцируемые культурой клеток in vitro, если они доступны.
Первое сообщение об искусственном иммунитете было связано с болезнью, известной как оспа. Люди подвергались воздействию незначительного штамма оспы в контролируемой среде. Как только их тела выработали естественный иммунитет или устойчивость к ослабленным штаммам оспы, у них стало гораздо меньше шансов заразиться более смертоносными штаммами болезни.По сути, пациенты получали болезнь, чтобы помочь бороться с ней в дальнейшей жизни. Хотя этот метод был эффективным, ученые того времени не знали, почему он работает.
Типы иммунитета к болезням
Иммунитет к заболеванию достигается за счет наличия антител к этому заболеванию в организме человека. Антитела — это белки, вырабатываемые организмом для нейтрализации или уничтожения токсинов или болезнетворных организмов. Антитела специфичны для болезни.Например, антитела к кори будут защищать человека, который переболел корью, но не окажет никакого эффекта, если он или она подвергнется воздействию эпидемического паротита.
Есть два типа иммунитета: активный и пассивный.
Активный иммунитет
Активный иммунитет возникает, когда воздействие болезнетворного организма заставляет иммунную систему вырабатывать антитела к этой болезни. Воздействие болезнетворного организма может происходить через инфицирование самим заболеванием (приводящее к естественному иммунитету) или введение убитой или ослабленной формы болезнетворного организма посредством вакцинации (иммунитет, индуцированный вакциной).В любом случае, если иммунный человек вступит в контакт с этим заболеванием в будущем, его иммунная система распознает его и немедленно произведет антитела, необходимые для борьбы с ним.
Активный иммунитет длительный, а иногда и пожизненный.
Пассивный иммунитет
Пассивный иммунитет предоставляется, когда человеку дают антител к болезни, а не вырабатывают их через свою собственную иммунную систему.
Новорожденный ребенок приобретает пассивный иммунитет от матери через плаценту.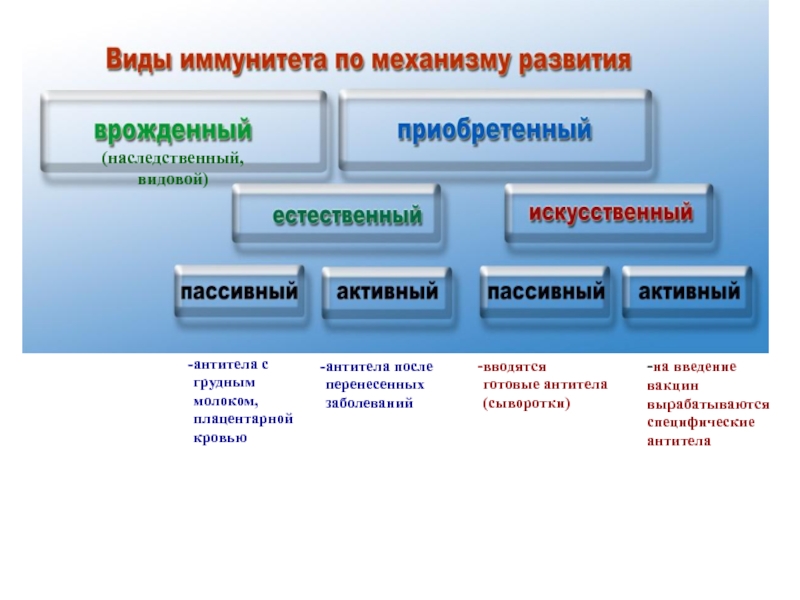 Человек также может получить пассивный иммунитет через продукты крови, содержащие антитела, такие как иммуноглобулин, который может быть назначен, когда необходима немедленная защита от определенного заболевания. Это главное преимущество пассивного иммунитета; защита возникает немедленно, тогда как для развития активного иммунитета требуется время (обычно несколько недель).
Человек также может получить пассивный иммунитет через продукты крови, содержащие антитела, такие как иммуноглобулин, который может быть назначен, когда необходима немедленная защита от определенного заболевания. Это главное преимущество пассивного иммунитета; защита возникает немедленно, тогда как для развития активного иммунитета требуется время (обычно несколько недель).
Однако пассивный иммунитет длится всего несколько недель или месяцев. Долговечен только активный иммунитет.
Журнальных статей по этой теме
- Fox JP, Elveback L, Scott W и др.Коллективный иммунитет: основная концепция и актуальность для практики иммунизации общественного здравоохранения. Am J Epidemiol 1971; 94: 179–89.
- Андерсон РМ, Май РМ. Вакцинация и коллективный иммунитет к инфекционным заболеваниям. Nature 1985; 318: 323–9.
- Мелкий ПЭМ. Коллективный иммунитет: история, теория, практика. Epidemiol Rev 1993; 15: 265–302.
- Fine PEM, Mulholland K. Иммунитет сообщества.
 В: Плоткин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. Глава 71. Филадельфия, Пенсильвания: Elsevier Inc., 2008: 1573–1592.
В: Плоткин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. Глава 71. Филадельфия, Пенсильвания: Elsevier Inc., 2008: 1573–1592. - Джон Т.Дж., Сэмюэл Р. Коллективный иммунитет и эффект стада: новые идеи и определения. Eur J Epidemiol 2000; 16: 601–6.
- Стивенс Д.С. Вакцины для непривитых: защита стада. J Inf Dis 2008; 197: 643–45.
- Хейманн Д., Эйлвард Б. Массовая вакцинация в общественном здравоохранении. В: Heymann D, ed. Пособие по борьбе с инфекционными заболеваниями. 19 изд. Вашингтон, округ Колумбия: Американская ассоциация общественного здравоохранения, 2008 г.
- Топли WWC, Уилсон GS. Распространение бактериальной инфекции: проблема коллективного иммунитета.J Hyg 1923; 21: 243–9.
Естественный иммунитет против иммунитета, полученного с помощью вакцин: что лучше?
Что лучше — получить иммунитет через инфекцию или вакцинацию?
Иммунная система человека вырабатывает одни и те же антитела в ответ, скажем, на инфекцию ветряной оспы и вакцинацию против ветряной оспы.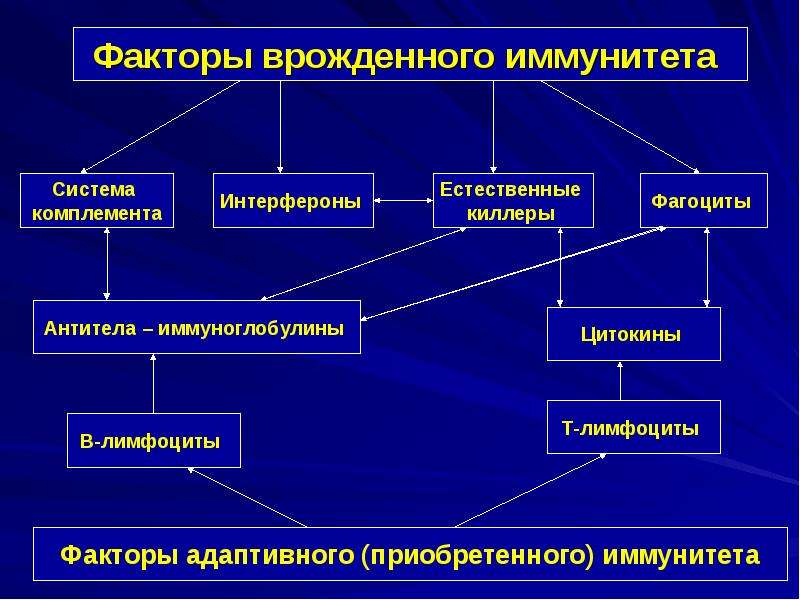 Люди, переболевшие ветряной оспой, и люди, получившие вакцину от ветряной оспы, хорошо защищены от заражения в будущем.В обоих случаях организм «запоминает» и может быстро сгенерировать иммунный ответ, чтобы атаковать вирус ветряной оспы, если он встретится снова.
Люди, переболевшие ветряной оспой, и люди, получившие вакцину от ветряной оспы, хорошо защищены от заражения в будущем.В обоих случаях организм «запоминает» и может быстро сгенерировать иммунный ответ, чтобы атаковать вирус ветряной оспы, если он встретится снова.
Некоторые люди думают, что естественный иммунитет, выработанный после заражения, предпочтительнее иммунитета, приобретенного вакциной. У обоих типов иммунитета (естественного и приобретенного) есть свои плюсы и минусы. Узнайте больше о естественном и приобретенном иммунитете, в том числе о том, что известно о естественном иммунитете и иммунитете от вакцины против COVID-19.
Естественный иммунитет В отношении некоторых инфекционных болезней, от которых существуют вакцины, естественная инфекция вызывает более сильный иммунитет, чем иммунитет, приобретенный с помощью вакцины.По данным Детской больницы Филадельфии (CHOP), «иммунитет от болезни часто возникает после одной естественной инфекции, [но] иммунитет от вакцин обычно возникает только после нескольких доз». Так обстоит дело с ветряной оспой: иммунитет обычно наступает только после одного приступа ветряной оспы, но людям требуется две дозы вакцины против ветряной оспы, чтобы развить эффективный и длительный иммунитет.
Так обстоит дело с ветряной оспой: иммунитет обычно наступает только после одного приступа ветряной оспы, но людям требуется две дозы вакцины против ветряной оспы, чтобы развить эффективный и длительный иммунитет.
Одна из причин, по которой естественный иммунитет настолько силен, заключается в том, что люди обычно не заболевают в ответ на заражение микробами, если только они не подвергаются воздействию большого количества вирусов или бактерий.Иммунная система вырабатывает сильный ответ на эту высокую «дозу» микробов. Эта мощная реакция также отвечает за многие неприятные симптомы, которые вы испытываете во время болезни, такие как усталость, жар и озноб.
С другой стороны, бесчисленные микробы, такие как вирус папилломы человека (ВПЧ), эволюционируют, чтобы избежать обнаружения иммунной системой. Здоровая иммунная система в конце концов избавляется от ВПЧ в 90% случаев, но люди с ослабленным иммунитетом особенно уязвимы для долгосрочной инфекции, а также повторного заражения.
Самый большой недостаток естественного заражения заключается в том, что невозможно заранее узнать, насколько серьезным будет заражение. У большинства людей ветряная оспа доставляет дискомфорт. Но у некоторых людей также развивается инфекция легких, отек мозга или опасная для жизни инфекция крови. До того, как вакцинация против ветряной оспы стала широко доступной, около 10 000 человек в Соединенных Штатах ежегодно госпитализировались с осложнениями ветряной оспы, и около 100 человек ежегодно умирали от ветряной оспы.
Иммунитет, приобретенный вакцинами Вакцины стимулируют организм вырабатывать антитела и клетки памяти, необходимые для борьбы с конкретными инфекциями. Вакцина против ветряной оспы содержит крошечные количества ослабленного (аттенуированного) вируса ветряной оспы — достаточно, чтобы заставить иммунную систему начать вырабатывать антитела, но недостаточно для того, чтобы в организме образовались волдыри от ветряной оспы. Вакцины против полиомиелита и гриппа содержат мертвые (инактивированные или «убитые») вирусы; они не могут вызвать болезнь, но они заставляют иммунную систему действовать.Вакцины с мРНК COVID-19 учат клетки вырабатывать спайковые белки, подобные тем, которые есть у коронавируса, а затем организм вырабатывает антитела против этих белков.
Вакцины против полиомиелита и гриппа содержат мертвые (инактивированные или «убитые») вирусы; они не могут вызвать болезнь, но они заставляют иммунную систему действовать.Вакцины с мРНК COVID-19 учат клетки вырабатывать спайковые белки, подобные тем, которые есть у коронавируса, а затем организм вырабатывает антитела против этих белков.
Хотя побочные эффекты, такие как болезненность и жар, являются обычным явлением после вакцинации, большинство людей после вакцинации не чувствуют себя так плохо, как при заражении.
В некоторых случаях иммунитет, полученный с помощью вакцины, сильнее естественного иммунитета. Согласно CHOP, вакцины против ВПЧ, столбняка, Haemophilus influenzae типа b (Hib) и пневмококковой вакцины вызывают лучший иммунный ответ, чем естественная инфекция.
Естественный иммунитет против вакцины против COVID-19 Исследователи все еще изучают естественный и индуцированный вакцинами иммунитет к COVID-19. В настоящее время медицинские работники считают, что и инфекция COVID-19, и вакцинация COVID-19 вызывают иммунитет, который, вероятно, сохраняется не менее восьми месяцев. Этот иммунитет неполный; можно заразиться COVID-19 после вакцинации против COVID-19 или после более раннего приступа инфекции, хотя эти случаи обычно не являются тяжелыми.
В настоящее время медицинские работники считают, что и инфекция COVID-19, и вакцинация COVID-19 вызывают иммунитет, который, вероятно, сохраняется не менее восьми месяцев. Этот иммунитет неполный; можно заразиться COVID-19 после вакцинации против COVID-19 или после более раннего приступа инфекции, хотя эти случаи обычно не являются тяжелыми.
Некоторые данные свидетельствуют о том, что вакцинация против COVID-19 после заражения может «обострить иммунитет». Согласно нескольким исследованиям, вакцинация после выздоровления от COVID-19 увеличивает выработку антител и снижает частоту повторного заражения.
Что эксперты в области здравоохранения говорят о естественном иммунитете по сравнению с приобретенным иммунитетом Приобретенный иммунитет безопаснее естественного иммунитета. Для всех болезней, которые можно предотвратить с помощью вакцин, риск развития серьезных побочных эффектов, связанных с вакцинацией, намного меньше, чем риск серьезных осложнений в случае инфицирования.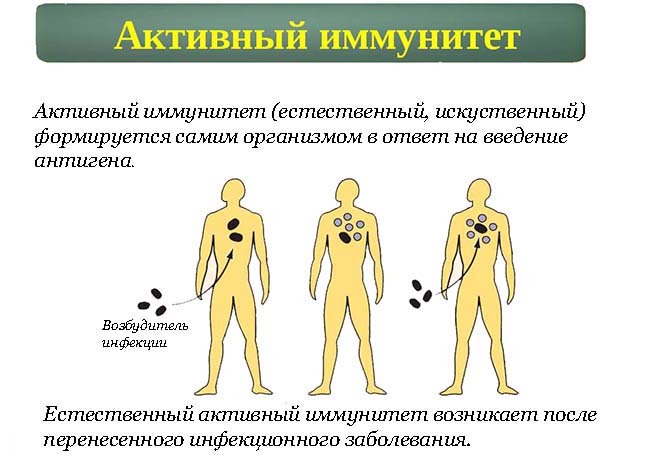 Человек, который заразился COVID-19, подвержен риску госпитализации и долгосрочным побочным эффектам, включая пост-COVID-19 синдром (или «COVID на длительный срок»). Существуют известные факторы риска тяжелой формы COVID-19, такие как болезни сердца, но у тысяч людей, не имеющих ни одного из этих факторов риска, развился тяжелый COVID-19. Человек, получивший вакцину от COVID-19, вряд ли потребует госпитализации или у него разовьется пост-COVID-19 синдром.
Человек, который заразился COVID-19, подвержен риску госпитализации и долгосрочным побочным эффектам, включая пост-COVID-19 синдром (или «COVID на длительный срок»). Существуют известные факторы риска тяжелой формы COVID-19, такие как болезни сердца, но у тысяч людей, не имеющих ни одного из этих факторов риска, развился тяжелый COVID-19. Человек, получивший вакцину от COVID-19, вряд ли потребует госпитализации или у него разовьется пост-COVID-19 синдром.
В большинстве случаев эксперты в области здравоохранения рекомендуют вакцинацию вместо естественной инфекции, если таковая имеется.Если у вас есть вопросы о естественном и приобретенном иммунитете, поговорите со своим врачом.
границ | Естественно приобретенный гуморальный иммунитет против малярии, вызванной Plasmodium falciparum
Введение
Малярия — смертельное заболевание, вызываемое преимущественно паразитом Plasmodium falciparum . По оценкам, в 2018 году во всем мире произошло около 228 миллионов случаев заболевания, в результате которых погибло 405 000 человек, в основном дети (1). Благодаря распространению надкроватных сеток, обработанных инсектицидами длительного пользования, более активному опрыскиванию инсектицидами, а также более ранней диагностике и лечению, с 2010 года был достигнут значительный прогресс в снижении заболеваемости и смертности.Однако малярия по-прежнему является серьезной проблемой глобального общественного здравоохранения и оказывает разрушительное социально-экономическое воздействие, в основном в странах Африки к югу от Сахары. Из-за распространения устойчивых к лекарствам паразитов и устойчивых к инсектицидам комаров, а также отсутствия доступа к лечению разработка вакцины остается наиболее многообещающим направлением искоренения малярии.
Благодаря распространению надкроватных сеток, обработанных инсектицидами длительного пользования, более активному опрыскиванию инсектицидами, а также более ранней диагностике и лечению, с 2010 года был достигнут значительный прогресс в снижении заболеваемости и смертности.Однако малярия по-прежнему является серьезной проблемой глобального общественного здравоохранения и оказывает разрушительное социально-экономическое воздействие, в основном в странах Африки к югу от Сахары. Из-за распространения устойчивых к лекарствам паразитов и устойчивых к инсектицидам комаров, а также отсутствия доступа к лечению разработка вакцины остается наиболее многообещающим направлением искоренения малярии.
Усилия по разработке вакцины были сосредоточены на нескольких стадиях жизненного цикла паразита, включая преэритроцитарную стадию и стадию бесполой крови (рис. 1).В то время как разработка вакцин со спорозоитом находится на более продвинутой стадии, чем вакцины на стадии крови [обзор в (2, 3)], стратегии против обеих стадий все еще сталкиваются с множеством препятствий. Следовательно, окончательная вакцина против малярии может потребовать воздействия на обе стадии жизненного цикла для достижения достаточной эффективности вакцины. Стадия бесполой крови Plasmodium ответственна за симптоматическое заболевание и может вызывать устойчивый иммунный ответ [см. Обзор (4)]. В ходе множественных инфекций ответные реакции антител против паразитов на стадии крови расширяются и достигают уровня, обеспечивающего защиту от малярии (5–7).Однако получение длительного защитного ответа антител путем вакцинации оказалось сложной задачей. Среди многих причин неудач вакцины-кандидатов на стадии исторической стадии крови: i) вариация последовательности в мишенях вакцины, которая привела к паразитоспецифическим ответам (8, 9), ii) неспособность вакцины вызывать достаточно высокие титры антител, необходимые для защиты. (10, 11) и iii) быстрое ослабление вызванных иммунных ответов (6, 12–15). Параллельно с этими препятствиями для разработки вакцины остается много вопросов о природе естественного иммунитета.
Следовательно, окончательная вакцина против малярии может потребовать воздействия на обе стадии жизненного цикла для достижения достаточной эффективности вакцины. Стадия бесполой крови Plasmodium ответственна за симптоматическое заболевание и может вызывать устойчивый иммунный ответ [см. Обзор (4)]. В ходе множественных инфекций ответные реакции антител против паразитов на стадии крови расширяются и достигают уровня, обеспечивающего защиту от малярии (5–7).Однако получение длительного защитного ответа антител путем вакцинации оказалось сложной задачей. Среди многих причин неудач вакцины-кандидатов на стадии исторической стадии крови: i) вариация последовательности в мишенях вакцины, которая привела к паразитоспецифическим ответам (8, 9), ii) неспособность вакцины вызывать достаточно высокие титры антител, необходимые для защиты. (10, 11) и iii) быстрое ослабление вызванных иммунных ответов (6, 12–15). Параллельно с этими препятствиями для разработки вакцины остается много вопросов о природе естественного иммунитета. Например, не до конца понятно, почему иммунитет против малярии развивается относительно медленно, как долго естественные ответы антител сохраняются в отсутствие повторного воздействия, являются ли ответы антител трансцендентными по отношению к штамму или являются комбинацией штамм-специфических ответов и какие (комбинации) антигена (ов) должны быть приоритетными при разработке вакцины.
Например, не до конца понятно, почему иммунитет против малярии развивается относительно медленно, как долго естественные ответы антител сохраняются в отсутствие повторного воздействия, являются ли ответы антител трансцендентными по отношению к штамму или являются комбинацией штамм-специфических ответов и какие (комбинации) антигена (ов) должны быть приоритетными при разработке вакцины.
Рис. 1 Plasmodium falciparum Стадии жизненного цикла человека-хозяина. Кровяная стадия P.falciparum — единственный этап жизненного цикла, ответственный за заболевание человека-хозяина. Во время цикла интраэритроцитарного развития (IDC) мерозоиты проникают в эритроциты с последующим развитием и репликацией паразита через стадии кольца, трофозоита и шизонта, пока не выйдут новые мерозоиты и цикл не повторится. Ответы антител, защищающие от малярии, направлены против двух классов антигенов, экспрессируемых во время IDC. Антигены мерозоитов, такие как MSP1 и AMA1, являются обычными мишенями для антител, генерируемых естественным путем P. falciparum инфекция. Антитела против этих антигенов предотвращают инвазию мерозоитов в эритроциты посредством различных эффекторных механизмов, включая нейтрализацию, опсонический фагоцитоз и активацию комплемента. Вариантные поверхностные антигены (VSA) экспрессируются на поверхности инфицированных эритроцитов. Антитела против VSA, включая PfEMP1, RIFIN и STEVOR, предотвращают цитоадгезию инфицированных эритроцитов к эндотелию сосудов и розетку, тем самым способствуя удалению инфицированных паразитами эритроцитов селезенкой.
falciparum инфекция. Антитела против этих антигенов предотвращают инвазию мерозоитов в эритроциты посредством различных эффекторных механизмов, включая нейтрализацию, опсонический фагоцитоз и активацию комплемента. Вариантные поверхностные антигены (VSA) экспрессируются на поверхности инфицированных эритроцитов. Антитела против VSA, включая PfEMP1, RIFIN и STEVOR, предотвращают цитоадгезию инфицированных эритроцитов к эндотелию сосудов и розетку, тем самым способствуя удалению инфицированных паразитами эритроцитов селезенкой.
Основные антигенные мишени паразитов на стадии крови можно разделить на две категории: i) поверхностные антигены вариантов паразита на клеточной мембране инфицированных эритроцитов и ii) белки, которые расположены на поверхности мерозоитов или секретируются мерозоитами во время инвазии эритроцитов (рис. 1). Недавние исследования, посвященные изучению естественного иммунитета, выявили важную информацию об ответах антител против этих двух групп антигенов P. falciparum , включая их развитие и поддержание, ключевые молекулярные и иммунологические механизмы ингибирования паразитов и потенциальную роль иммуноглобулина M (IgM). в защитном ответе.В этом обзоре представлен обзор этих открытий и подчеркивается их важность для разработки вакцин.
falciparum , включая их развитие и поддержание, ключевые молекулярные и иммунологические механизмы ингибирования паразитов и потенциальную роль иммуноглобулина M (IgM). в защитном ответе.В этом обзоре представлен обзор этих открытий и подчеркивается их важность для разработки вакцин.
На зрелых стадиях стадии бесполой крови P. falciparum экспрессирует вариантные поверхностные антигены (VSA) на клеточной мембране инфицированного эритроцита. Эти белки играют решающую роль как в патогенезе малярии, так и в уклонении от иммунитета. VSA принадлежат к мультигенным семействам, в первую очередь P.falciparum мембранный белок 1 эритроцитов (PfEMP1), повторяющиеся вкрапленные повторы (RIFIN) и субтеломерный вариант открытой рамки считывания (STEVOR). PfEMP1 может связываться со специфическими рецепторами хозяина, выстилающими эндотелий сосудов, что приводит к секвестрации инфицированных эритроцитов в капиллярах, тем самым предотвращая выведение паразитов селезенкой (16-18) (Рисунок 2). Кроме того, члены всех трех семейств VSA опосредуют розетку, образование кластера неинфицированных эритроцитов вокруг инфицированного эритроцита, что усиливает обструкцию микрососудов (19–22).Розетение и секвестрация инфицированных эритроцитов могут способствовать заболеванию, уменьшая перфузию капилляров и способствуя выживанию паразитов за счет предотвращения клиренса селезенки [обзор в (23)]. Антитела против VSA могут действовать, противодействуя этим стратегиям иммунного уклонения паразита (24–26). Кроме того, антитела против VSA могут способствовать прямому уничтожению инфицированных эритроцитов за счет индукции опсонического фагоцитоза (27) или антителозависимой клеточной цитотоксичности естественными киллерами (NK) клетками (28).
Кроме того, члены всех трех семейств VSA опосредуют розетку, образование кластера неинфицированных эритроцитов вокруг инфицированного эритроцита, что усиливает обструкцию микрососудов (19–22).Розетение и секвестрация инфицированных эритроцитов могут способствовать заболеванию, уменьшая перфузию капилляров и способствуя выживанию паразитов за счет предотвращения клиренса селезенки [обзор в (23)]. Антитела против VSA могут действовать, противодействуя этим стратегиям иммунного уклонения паразита (24–26). Кроме того, антитела против VSA могут способствовать прямому уничтожению инфицированных эритроцитов за счет индукции опсонического фагоцитоза (27) или антителозависимой клеточной цитотоксичности естественными киллерами (NK) клетками (28).
Рисунок 2 Антитела против вариантов поверхностных антигенов. (A) PfEMP1 на поверхности инфицированного эритроцита облегчает связывание с рецепторами эндотелия сосудов человека. (B) Гуморальные иммунные ответы против PfEMP1 ингибируют прикрепление инфицированных эритроцитов к эндотелию хозяина и вызывают опсонический фагоцитоз инфицированных эритроцитов. (C) Иммунное уклонение инфицированных эритроцитов опосредуется RIFIN, экспрессируемыми на поверхности эритроцита.Связывание RIFIN с LAIR1 на В-клетках и естественных киллерах (NK) приводит к подавлению иммунных ответов. (D) Антитела против RIFIN могут предотвращать связывание инфицированных эритроцитов с LAIR1 на лейкоцитах. Было обнаружено, что широко реактивные антитела к RIFIN содержат вставку фрагмента LAIR1 в плечо тяжелой цепи антитела. (E) STEVORs опосредуют образование розетки и могут играть роль в инвазии мерозоитов, прикрепляясь к гликофорину C на поверхности эритроцитов. (F) Антитела, нацеленные на STEVOR, могут предотвращать розетку и ингибировать прикрепление мерозоитов к эритроцитам, тем самым потенциально ограничивая репликацию и выживаемость паразитов.
(C) Иммунное уклонение инфицированных эритроцитов опосредуется RIFIN, экспрессируемыми на поверхности эритроцита.Связывание RIFIN с LAIR1 на В-клетках и естественных киллерах (NK) приводит к подавлению иммунных ответов. (D) Антитела против RIFIN могут предотвращать связывание инфицированных эритроцитов с LAIR1 на лейкоцитах. Было обнаружено, что широко реактивные антитела к RIFIN содержат вставку фрагмента LAIR1 в плечо тяжелой цепи антитела. (E) STEVORs опосредуют образование розетки и могут играть роль в инвазии мерозоитов, прикрепляясь к гликофорину C на поверхности эритроцитов. (F) Антитела, нацеленные на STEVOR, могут предотвращать розетку и ингибировать прикрепление мерозоитов к эритроцитам, тем самым потенциально ограничивая репликацию и выживаемость паразитов.
Ответы антител против PfEMP1
Каждый паразит из P. falciparum кодирует разнообразный набор из примерно 60 белков PfEMP1, но только один из этих антигенов будет экспрессироваться у одного паразита [обзор в (29)].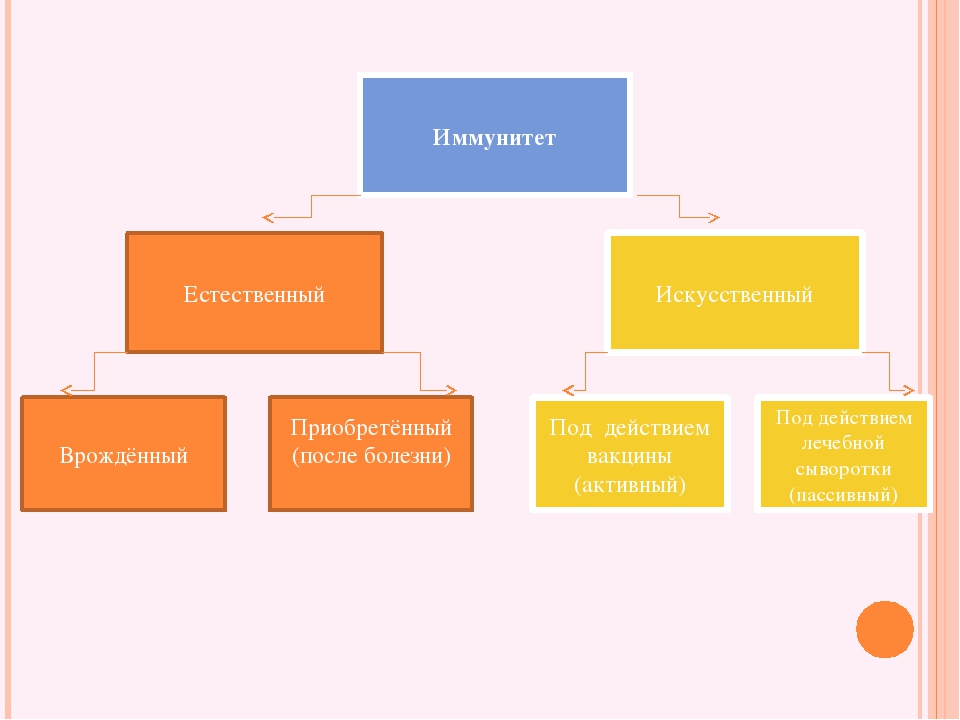 Белки PfEMP1 демонстрируют высокую степень вариабельности последовательностей как среди различных вариантов, кодируемых одним паразитом, так и среди тех, которые экспрессируются разными штаммами паразита.Таким образом, переключение экспрессии варианта PfEMP1 способствует быстрому и эффективному уклонению паразита от гуморальных иммунных ответов хозяина (18). К сожалению, чрезвычайное разнообразие последовательностей среди вариантов PfEMP1 препятствует нашей способности изучать естественный иммунитет против этих антигенов, а также разработке вакцины на основе PfEMP1.
Белки PfEMP1 демонстрируют высокую степень вариабельности последовательностей как среди различных вариантов, кодируемых одним паразитом, так и среди тех, которые экспрессируются разными штаммами паразита.Таким образом, переключение экспрессии варианта PfEMP1 способствует быстрому и эффективному уклонению паразита от гуморальных иммунных ответов хозяина (18). К сожалению, чрезвычайное разнообразие последовательностей среди вариантов PfEMP1 препятствует нашей способности изучать естественный иммунитет против этих антигенов, а также разработке вакцины на основе PfEMP1.
Белки PfEMP1 состоят из двух-десяти богатых цистеином междоменных областей (CIDRα, β, γ и δ) и доменов, подобных связыванию Даффи (DBLα, β, γ, δ, ϵ, ζ и x), которые могут быть далее разделены на 147 подтипов (30–32).Эти разные домены могут связываться с разными рецепторами хозяина, включая рецептор эндотелиального протеина C (EPCR), молекулу межклеточной адгезии 1 (ICAM1) и CD36. Эти эндотелиальные рецепторы хозяина не экспрессируются на одинаковом уровне во всех органах (33, 34).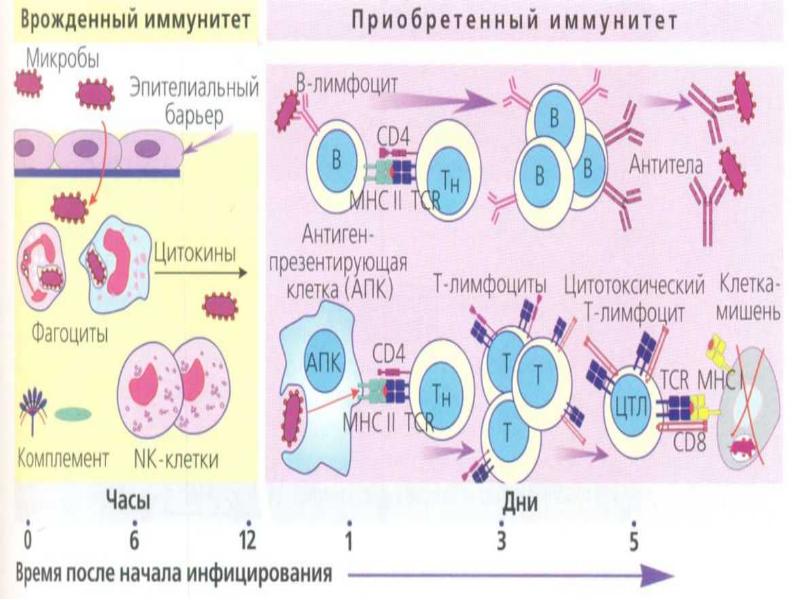 Например, экспрессия CD36 в эндотелии сосудов головного мозга низкая, тогда как экспрессия EPCR высока, а экспрессия ICAM1 повышается в условиях воспаления (33, 34). Патогенез, симптомы заболевания и развитие тяжелой малярии частично зависят от того, какой вариант PfEMP1 экспрессируется паразитом.
Например, экспрессия CD36 в эндотелии сосудов головного мозга низкая, тогда как экспрессия EPCR высока, а экспрессия ICAM1 повышается в условиях воспаления (33, 34). Патогенез, симптомы заболевания и развитие тяжелой малярии частично зависят от того, какой вариант PfEMP1 экспрессируется паразитом.
Тяжелая форма малярии в основном встречается у детей в возрасте до 5 лет и включает опасные для жизни осложнения, такие как церебральная малярия и тяжелая анемия. Эти тяжелые проявления заболевания были связаны с экспрессией определенных подтипов доменов CIDR и DBL, включая CIDRα1, DBLα1, DBLα2 и DBLβ (35, 36). Защита от тяжелой малярии достигается в раннем возрасте после небольшого числа инфекций (37). В последние несколько лет многочисленные независимые когортные исследования выявили роль антител IgG к PfEMP1 в этом защитном ответе и пролили свет на то, какие домены PfEMP1 являются основными мишенями для защитных антител.Хотя все домены PfEMP1 кажутся иммуногенными (38), субъекты с неосложненной малярией показали более высокие титры анти-PfEMP1 IgG и содержали IgG, которые нацелены на варианты PfEMP1, связанные с тяжелой малярией (27, 39–42). В когорте из 448 детей младшего возраста (29–56 месяцев) в Папуа-Новой Гвинее у детей с неосложненной малярией были более высокие уровни IgG к PfEMP1, чем у детей с тяжелой формой малярии (27). Способность этих антител вызывать опсонический фагоцитоз предполагает, что прямое уничтожение инфицированных эритроцитов может способствовать защите.Однако еще предстоит окончательно установить, являются ли клеточные иммунные механизмы или предотвращение цитоадгезии основным механизмом действия этих антител. Подобно этим результатам, анализ реактивности сыворотки на 170 фрагментов PfEMP1 с помощью белкового микрочипа показал, что у детей в Мали с тяжелой формой малярии уровни антител к PfEMP1 были ниже, и эти антитела распознавали меньше вариантов PfEMP1, чем антитела у контрольных субъектов (41). В этом исследовании участники подбирались по возрасту и месту жительства, чтобы минимизировать различия в воздействии паразитов между группами.Это сходство уровней воздействия было экспериментально подтверждено наблюдением, что дети с церебральной малярией и здоровые люди из контрольной группы показали лишь незначительные различия в иммунных ответах против внутриклеточных доменов PfEMP1 и мерозоитных антигенов.
В когорте из 448 детей младшего возраста (29–56 месяцев) в Папуа-Новой Гвинее у детей с неосложненной малярией были более высокие уровни IgG к PfEMP1, чем у детей с тяжелой формой малярии (27). Способность этих антител вызывать опсонический фагоцитоз предполагает, что прямое уничтожение инфицированных эритроцитов может способствовать защите.Однако еще предстоит окончательно установить, являются ли клеточные иммунные механизмы или предотвращение цитоадгезии основным механизмом действия этих антител. Подобно этим результатам, анализ реактивности сыворотки на 170 фрагментов PfEMP1 с помощью белкового микрочипа показал, что у детей в Мали с тяжелой формой малярии уровни антител к PfEMP1 были ниже, и эти антитела распознавали меньше вариантов PfEMP1, чем антитела у контрольных субъектов (41). В этом исследовании участники подбирались по возрасту и месту жительства, чтобы минимизировать различия в воздействии паразитов между группами.Это сходство уровней воздействия было экспериментально подтверждено наблюдением, что дети с церебральной малярией и здоровые люди из контрольной группы показали лишь незначительные различия в иммунных ответах против внутриклеточных доменов PfEMP1 и мерозоитных антигенов. Однако ограничение этого исследования состоит в том, что использовались только домены PfEMP1 из эталонного штамма P. falciparum 3D7, который не включает несколько известных доменов PfEMP1, которые связаны с тяжелой малярией и не обязательно соответствуют штаммам паразитов, которые эти дети подвергались воздействию.Обширное исследование ответа антител против 456 вариантов домена DBLα из местных изолятов паразитов среди 232 детей (0,9–3,2 года) в Папуа-Новой Гвинее показало, что IgG против 85 вариантов DBLα1 и DBLα2 были связаны с 70–100% снижением заболеваемости тяжелой малярией ( 40). В этом исследовании защита от тяжелой малярии может быть дополнительно сужена до антител против 17 вариантов DBLα, многие из которых были физически связаны с EPCR-связывающими доменами CIDRα1 (см. Ниже). Эти результаты предполагают, что иммунитет против тяжелой малярии является результатом антител, нацеленных на относительно небольшую панель консервативных доменов PfEMP1 (менее 5% от полного репертуара PfEMP1), обеспечивая поддержку для разработки вакцины на основе этих патогенных доменов PfEMP1.
Однако ограничение этого исследования состоит в том, что использовались только домены PfEMP1 из эталонного штамма P. falciparum 3D7, который не включает несколько известных доменов PfEMP1, которые связаны с тяжелой малярией и не обязательно соответствуют штаммам паразитов, которые эти дети подвергались воздействию.Обширное исследование ответа антител против 456 вариантов домена DBLα из местных изолятов паразитов среди 232 детей (0,9–3,2 года) в Папуа-Новой Гвинее показало, что IgG против 85 вариантов DBLα1 и DBLα2 были связаны с 70–100% снижением заболеваемости тяжелой малярией ( 40). В этом исследовании защита от тяжелой малярии может быть дополнительно сужена до антител против 17 вариантов DBLα, многие из которых были физически связаны с EPCR-связывающими доменами CIDRα1 (см. Ниже). Эти результаты предполагают, что иммунитет против тяжелой малярии является результатом антител, нацеленных на относительно небольшую панель консервативных доменов PfEMP1 (менее 5% от полного репертуара PfEMP1), обеспечивая поддержку для разработки вакцины на основе этих патогенных доменов PfEMP1.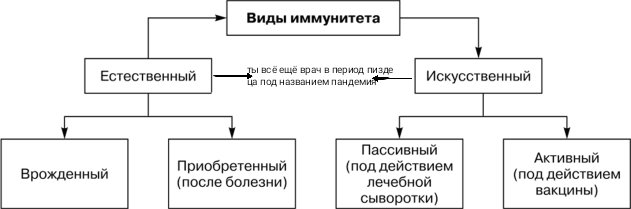 Аналогичным образом Tuju et al. сообщили, что дети в Кении с легким или тяжелым заболеванием (n = 36) показали различные серологические профили IgG против вариантов домена DBLα и аналогичное, но более слабое качественное различие для IgM (42). Механизмы, лежащие в основе этих различных серологических исходов, еще предстоит изучить, и они будут полезны при разработке вакцины.
Аналогичным образом Tuju et al. сообщили, что дети в Кении с легким или тяжелым заболеванием (n = 36) показали различные серологические профили IgG против вариантов домена DBLα и аналогичное, но более слабое качественное различие для IgM (42). Механизмы, лежащие в основе этих различных серологических исходов, еще предстоит изучить, и они будут полезны при разработке вакцины.
CIDRα1 — это домен типа PfEMP1, который может играть доминирующую роль в развитии защиты от тяжелой малярии.Было показано, что домены CIDRα1 связываются с EPCR, и результаты нескольких исследований показывают, что это взаимодействие играет важную роль в развитии тяжелой малярии, в частности церебральной малярии (43–45). В поперечных исследованиях в двух независимых когортах было обнаружено, что ответы IgG против EPCR-связывающих доменов CIDRα1 развиваются раньше в жизни, чем антитела против других доменов CIDR PfEMP1 (46, 47), что подчеркивает их потенциальную роль в защите от клинических заболеваний. Кроме того, продольный анализ в малийской когорте показал упорядоченное приобретение IgG против различных доменов CIDRα1, начиная с IgG против CIDRα1.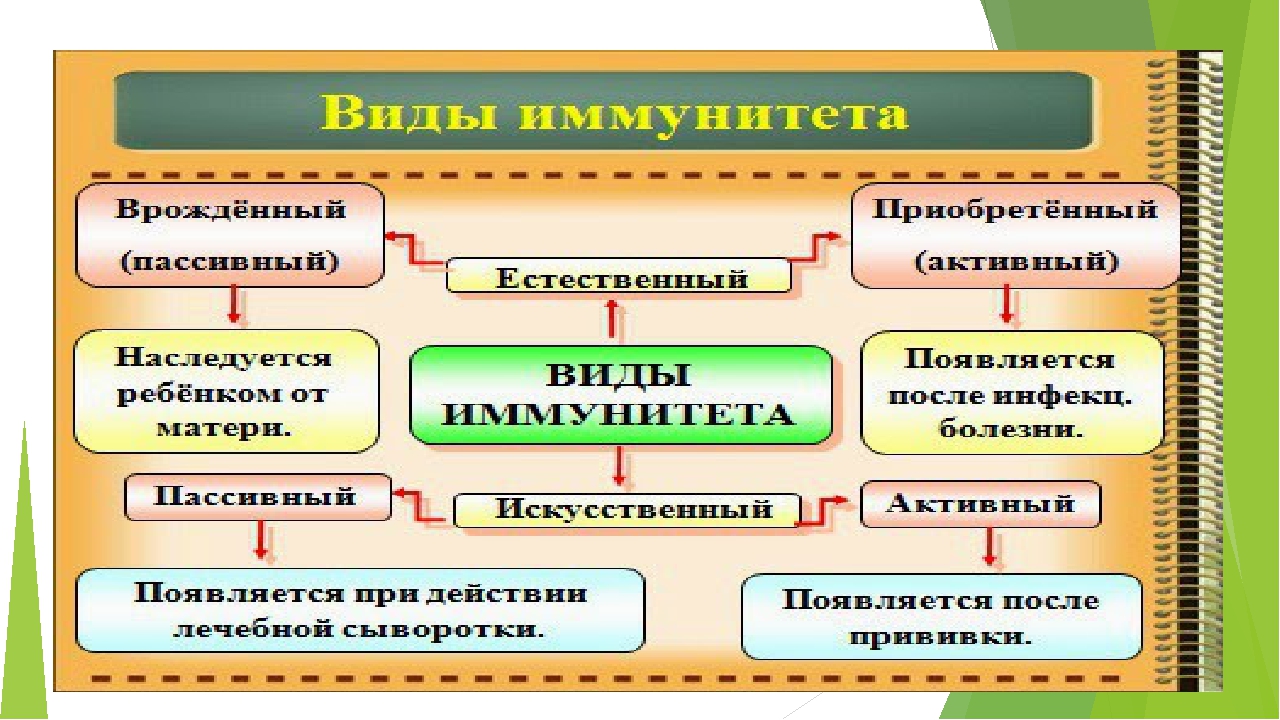 7 и CIDRα1.8 (46). Это могло означать упорядоченную экспрессию вариантов PfEMP1 P. falciparum , потенциально в ответ на иммунный статус хозяина. В качестве альтернативы, это может отражать различия в приспособленности паразитов и их трансмиссивности, что приводит к ранним инфекциям, преимущественно вызванным паразитами, циркулирующими с более высокой распространенностью (46).
7 и CIDRα1.8 (46). Это могло означать упорядоченную экспрессию вариантов PfEMP1 P. falciparum , потенциально в ответ на иммунный статус хозяина. В качестве альтернативы, это может отражать различия в приспособленности паразитов и их трансмиссивности, что приводит к ранним инфекциям, преимущественно вызванным паразитами, циркулирующими с более высокой распространенностью (46).
Учитывая высокую степень вариабельности последовательностей среди вариантов PfEMP1, можно было бы ожидать, что многие антитела к PfEMP1 являются штамм-специфичными.Однако было показано, что домены CIDRα1 обладают консервативными структурными особенностями, которые позволяют множеству различных вариантов PfEMP1 связываться с одним и тем же рецептором хозяина (48). Эта структурная консервация сайта связывания EPCR может позволить иммунной системе продуцировать антитела, которые обладают перекрестной реактивностью против многих различных доменов CIDRα1. Действительно, IgG, выделенные из сыворотки путем аффинной очистки с использованием пептида, содержащего сайт связывания EPCR одного домена CIDRα1, были способны связываться с другими доменами CIDRα1 и предотвращать взаимодействие домена с EPCR (48). Эти результаты предполагают, что структурная консервация доменов CIDRα1 может предоставить возможность для разработки вакцины, обеспечивающей защиту от тяжелой малярии.
Эти результаты предполагают, что структурная консервация доменов CIDRα1 может предоставить возможность для разработки вакцины, обеспечивающей защиту от тяжелой малярии.
Ответы антител против RIFIN
RIFIN кодируются набором от 150 до 200 генов и сильно различаются по антигенам (49). Следуя паттерну семейства PfEMP1 в P. falciparum , каждый паразит экспрессирует один RIFIN (19). Члены семейства RIFIN предпочтительно связываются с эритроцитами группы крови A с образованием больших розеток и индуцируют цитоадгезию, тем самым потенциально способствуя тяжелому заболеванию (19).Кроме того, недавно было показано, что RIFIN могут связываться с ингибирующими рецепторами, экспрессируемыми на B-клетках, T-клетках и NK-клетках, включая лейкоцитарный иммуноглобулиноподобный рецептор B1 (LILRB1) и лейкоцит-ассоциированный иммуноглобулиноподобный рецептор 1 (LAIR1) ( 50) (Рисунок 2). Связывание этих рецепторов с их естественными лигандами приводит к подавлению иммунных ответов (51–53). RIFINs связываются с той же областью LILRB1, что и MHC-I, его природный лиганд, и имитируют функцию MHC-I, совместно локализуясь с LILRB1 в иммунологическом синапсе и ингибируя активацию NK-клеток (54).Кроме того, было продемонстрировано, что связывание RIFIN с LILRB1 ингибирует продукцию IgM в первичных В-клетках человека и снижает NK-опосредованное уничтожение клеток-мишеней (55). Прямой эффект связывания RIFIN с репортерными клетками гибридомы Т-клеток мыши, экспрессирующими LAIR1, не наблюдался, но эффект взаимодействия между RIFIN и LAIR1 еще предстоит протестировать в более подходящих экспериментальных условиях, таких как использование первичных лейкоцитов человека ( 55). На основании этих наблюдений была выдвинута гипотеза, что одна из функций RIFIN заключается в подавлении иммунных ответов против P.falciparum через связывание с этими ингибирующими рецепторами.
RIFINs связываются с той же областью LILRB1, что и MHC-I, его природный лиганд, и имитируют функцию MHC-I, совместно локализуясь с LILRB1 в иммунологическом синапсе и ингибируя активацию NK-клеток (54).Кроме того, было продемонстрировано, что связывание RIFIN с LILRB1 ингибирует продукцию IgM в первичных В-клетках человека и снижает NK-опосредованное уничтожение клеток-мишеней (55). Прямой эффект связывания RIFIN с репортерными клетками гибридомы Т-клеток мыши, экспрессирующими LAIR1, не наблюдался, но эффект взаимодействия между RIFIN и LAIR1 еще предстоит протестировать в более подходящих экспериментальных условиях, таких как использование первичных лейкоцитов человека ( 55). На основании этих наблюдений была выдвинута гипотеза, что одна из функций RIFIN заключается в подавлении иммунных ответов против P.falciparum через связывание с этими ингибирующими рецепторами.
Интересно, что было обнаружено, что иммунная система человека использует способность RIFIN связывать LAIR1 для генерации широко реактивных антител IgM и IgG к RIFIN (56, 57). Эти антитела имеют весьма необычные структуры, вызванные вставкой экзона LAIR1 человека в CDR3 вариабельной области тяжелой цепи антитела или в переключающую область (рис. 2). Вставки генов в переключаемые области показали более высокую распространенность в В-клетках памяти с переключением классов по сравнению с наивными В-клетками, что указывает на роль индуцированной активацией цитидиндезаминазы в облегчении таких вставок (56, 57).В результате соматической гипермутации эти домены LAIR1 утратили способность связываться со своим естественным лигандом, коллагеном, тем самым предотвращая образование аутоантител, но сохранили высокое сродство к RIFIN. Эти антитела к LAIR1 были обнаружены у 5–10% лиц, переживших малярию, в то время как только 0,3% европейских доноров имели IgG, содержащие LAIR1 (56, 57). Однако наличие антител к LAIR1 не коррелировало с защитой от малярии. Таким образом, в то время как антитела к LAIR1 свидетельствуют об исключительно сильном давлении отбора P.falciparum об иммунном ответе инфицированных людей, остается вопрос, вносят ли антитела против RIFIN в защиту.
Эти антитела имеют весьма необычные структуры, вызванные вставкой экзона LAIR1 человека в CDR3 вариабельной области тяжелой цепи антитела или в переключающую область (рис. 2). Вставки генов в переключаемые области показали более высокую распространенность в В-клетках памяти с переключением классов по сравнению с наивными В-клетками, что указывает на роль индуцированной активацией цитидиндезаминазы в облегчении таких вставок (56, 57).В результате соматической гипермутации эти домены LAIR1 утратили способность связываться со своим естественным лигандом, коллагеном, тем самым предотвращая образование аутоантител, но сохранили высокое сродство к RIFIN. Эти антитела к LAIR1 были обнаружены у 5–10% лиц, переживших малярию, в то время как только 0,3% европейских доноров имели IgG, содержащие LAIR1 (56, 57). Однако наличие антител к LAIR1 не коррелировало с защитой от малярии. Таким образом, в то время как антитела к LAIR1 свидетельствуют об исключительно сильном давлении отбора P.falciparum об иммунном ответе инфицированных людей, остается вопрос, вносят ли антитела против RIFIN в защиту.
IgG-антитела против RIFIN (независимо от вставки LAIR1) были обнаружены у детей в Танзании уже через 1 год после рождения, но уровни не увеличивались с возрастом (19). Не наблюдалось различий в реактивности сывороточного IgG против трех RIFIN на белковом микрочипе между детьми (1–6 лет) и взрослыми (18–55 лет) в Мали (58).IgG в сыворотках взрослых в этой когорте связывались с большим количеством пептидов RIFIN как в полуконсервативных, так и в гипервариабельных доменах, чем антитела в сыворотках детей (58). Однако не было различий в серореактивности между RIFIN A-типа, экспрессируемыми на поверхности инфицированного эритроцита, и RIFIN-ами B-типа, локализованными внутри паразита, что позволяет предположить, что повышенная реактивность антител у взрослых отражает более высокую совокупную подверженность малярии. паразит по сравнению с детьми, а не защита (58, 59).В соответствии с этим наблюдением у детей в Кении IgG против PfEMP1 были связаны с защитой от малярии, в то время как антитела против других VSA — нет (60), что позволяет предположить, что белки PfEMP1 являются основной мишенью защитных иммунных ответов против белков паразитов, экспрессируемых на поверхность эритроцитов.
Ответы антител против STEVOR
Из семейств VSA, обсуждаемых в этом обзоре, STEVOR были идентифицированы последними и остаются наименее охарактеризованными. STEVOR представляют собой семейство примерно из 40 полиморфных белков, кодируемых генами, обнаруженными в субтеломерных регионах P.falciparum (61). Анализ РНК-секвенирования штамма P. falciparum 3D7 выявил двухфазный профиль экспрессии STEVOR в пределах внутриэритроцитарного цикла с пиком в ранних трофозоитах и поздних шизонтах / мерозоитах (62). Кроме того, экспрессия STEVOR была идентифицирована на стадии спорозоитов и гаметоцитов паразита (63). Локализация STEVOR на всех трех стадиях различна, что предполагает разные функции в зависимости от стадии жизненного цикла. Как в трофозоитах, так и в гаметоцитах, STEVORs могут быть обнаружены на мембране инфицированных эритроцитов (63), где они, вероятно, играют роль в секвестрации паразитов [см. Обзор (64, 65)].Кроме того, STEVOR были обнаружены на апикальной поверхности мерозоитов (66). STEVORs могут связываться с гликофорином C на поверхности эритроцитов, что приводит к образованию розеток эритроцитов, инфицированных зрелыми паразитами (67), и прикреплению мерозоитов к мембране эритроцитов (20). Учитывая широкое распространение STEVOR на протяжении жизненного цикла P. falciparum , ответы антител против этих мишеней могут ингибировать репликацию паразитов на различных стадиях. Действительно, моноклональные антитела, нацеленные на STEVOR, показали уменьшение розеток (67) и ингибирование инвазии мерозоитов (20).
Хотя очевидно, что STEVOR участвуют во взаимодействиях хозяин-патоген, их роль в патогенезе заболевания до конца не изучена. В нескольких когортных исследованиях была предпринята попытка раскрыть эту роль путем анализа сывороточных ответов антител против STEVOR. В когорте лиц из Уганды в возрасте 6–22 лет распространенность серотипов антител против STEVOR была ниже по сравнению с антителами против RIFIN (68). Группирование участников на основе риска лихорадочной малярии выявило только один STEVOR, обычно нацеленный на гуморальную иммунную систему защищенных лиц (68).В этом исследовании серореактивность тестировалась с использованием библиотеки из 30 уникальных рекомбинантных белков STEVOR, каждый из которых экспрессировался в виде 1 или 2 усеченных фрагментов (68). В результате возможно, что реактивность антитела была упущена из-за неправильной укладки этих фрагментов белка. Поэтому в будущих исследованиях необходимо будет оценить иммунные ответы хозяина на полноразмерные белки STEVOR. В аналогичном исследовании более подробно изучена серореактивность у детей по сравнению со взрослыми в малийской когорте с использованием массива пептидов (58). Сыворотки детей и взрослых были способны связывать все три RIFIN, протестированных в этой панели.В то время как взрослые антитела также реагировали со всеми шестью STEVOR, дети проявляли реактивность только к четырем из шести (58). Пептидный массив этих шести STEVOR показал, что IgG от взрослых связывают значительно больше пептидов и обладают большей реактивностью с полуконсервативными и гипервариабельными областями по сравнению с IgG от детей (58). При сравнении сывороток, полученных от детей до и через 90 дней после единичного клинического эпизода малярии, антитела в сыворотке крови в постмалярийный момент времени распознали двойное количество пептидов STEVOR, что более близко соответствовало профилю эпитопов, нацеленному на взрослых (58 ).Это исследование ограничено репертуаром протестированных белков STEVOR и измеряет только ответы антител против линейных эпитопов, но оно подчеркивает, насколько быстро антитела к одному белку могут развиваться в течение одной инфекции. Эти результаты согласуются с быстрым приобретением антител, способствующих защите от тяжелого заболевания, всего после нескольких клинических эпизодов.
Потребуются дополнительные анализы, чтобы определить, вносят ли анти-STEVOR антитела вклад в защиту или просто коррелируют с воздействием антигена.В будущих исследованиях потребуется более обширный анализ экспрессии STEVOR в клинических изолятах, аналогичный тому, что было выполнено для PfEMP1. Использование антигенов на основе 3D7 для измерения ответов антител против STEVOR является ограничивающим фактором при попытке понять вклад ответа антител в защиту, поскольку анализ клинических изолятов выявил области внутри STEVOR с высокой вариабельностью последовательностей (69) и вариабельностью в Экспрессия STEVOR между свежими изолятами и лабораторно адаптированными штаммами (66).Использование последовательностей STEVOR из клинических изолятов вместе с когортами людей, которые находятся в группе риска или клинически защищены от малярии, обеспечит более глубокое понимание вариантов, участвующих в патогенезе заболевания, ответов антител против STEVOR, связанных с защитой, и потенциальных целей для разработки вакцины. .
Plasmodium falciparum Мерозоитные антигеныИнвазия мерозоитов в эритроциты — важный этап в бесполом цикле репликации паразитов Plasmodium , процесс, который может блокироваться антителами [обзор (70)].В результате мерозоитные антигены были предметом интенсивных исследований в течение последних десятилетий, которые, к сожалению, (пока) не были преобразованы в успешную вакцину для определения стадии крови [см. Обзор (71)]. Мерозоиты экспрессируют большой репертуар белков на своей поверхности и в специализированных секреторных органеллах, микронемах и рооптриях, которые высвобождаются во время процесса инвазии [rev. (70)]. Титры антител против членов семейства поверхностных белков мерозоитов (MSP) обычно являются одними из самых высоких, обнаруживаемых у людей, переживших малярию (72, 73), скорее всего, из-за их обилия и характера воздействия.Однако связь между специфичностью антител в сыворотке крови и защитой от малярии обычно слабее для поверхностных белков мерозоитов, чем для белков микронемы или роптри (74, 75). Из-за генетического полиморфизма и функциональной избыточности среди белков мерозоитов до сих пор неясно, какие антигены являются лучшими кандидатами для разработки вакцины (8, 9). Таким образом, определение ключевых мерозоитных антигенов и механизмов, с помощью которых антитела против этих антигенов обеспечивают защиту, остаются важными областями исследований для разработки вакцины на стадии крови.
Рассечение защитных реакций антител на мерозоитные антигены
Приоритезация антигенов для разработки вакцины затруднялась множеством проблем, в том числе нашим отсутствием понимания того, какие иммунологические меры коррелируют с защитой и какие механизмы опосредованного антителами подавления паразитов наиболее важны для иммунитета . Поэтому потребуются широкомасштабные усилия для систематического сравнения ответов антител в разных когортах с использованием нескольких считываний.Один из наиболее эффективных подходов заключался в сравнении специфичности антител у защищенных и восприимчивых людей с использованием белковых микрочипов. Эти анализы показали, что большая часть протеома P. falciparum является иммуногенным и что широта и устойчивость ответов IgG возрастают с кумулятивным воздействием (5-7). Кроме того, защищенные индивидуумы имеют более высокие уровни IgG к широкому спектру антигенов с уникальными серологическими профилями для каждого человека (5–7).Разницу между защитой от малярии и восприимчивостью к ней нельзя просто объяснить наличием или отсутствием одной или небольшого числа специфичностей антител. Чтобы лучше понять высокую сложность таких наборов данных и выйти за рамки анализа ответов IgG на отдельные антигены, в недавних исследованиях использовались подходы машинного обучения, которые позволяют оценивать комбинации ответов и их связь с защитой (76, 77). Анализ данных микроматрицы белков, включающий реактивность антител против более чем 1000 антигенов у детей (2-10 лет) и молодых людей (18-25 лет), показал, что защита была связана с качественным сдвигом в ответах антител с увеличением титры антител против VSA и снижение титров антител против антигенов, обогащенных консервативными белками с неизвестной функцией (77).Proietti et al. идентифицировали иммунную сигнатуру ответов IgG против 15 антигенов, которая предсказывала защиту от малярии в двух когортах (76). Интересно, что большинство этих белков были локализованы внутриклеточно и экспрессировались на разных стадиях жизненного цикла P. falciparum , что делает их маловероятными прямыми мишенями для антител, ингибирующих паразитов. Однако эти результаты могут подчеркивать важность других компонентов адаптивной иммунной системы, таких как Т-клеточные ответы, в управлении защитным В-клеточным иммунитетом.Кроме того, эту иммунную сигнатуру можно использовать для прогнозирования восприимчивости к болезням, отслеживания приобретения естественного иммунитета с течением времени и оценки воздействия вмешательств против малярии.
Одним из недостатков этих крупномасштабных исследований белковых микрочипов является то, что они оценивают только связывание антитела, а не эффекторные функции антитела, такие как опсонизация или фиксация комплемента. Антитела, которые связываются с антигенами мерозоитов, не обязательно подавляют инвазию эритроцитов. Например, было показано, что активность ингибирующего анти-MSP1 IgG может блокироваться неингибиторными антителами, которые конкурируют за связывание с перекрывающимися эпитопами или связываются с более дистальными областями и предположительно предотвращают связывание ингибирующих антител через стерические препятствия (78). .Поэтому анализы, которые оценивают различные эффекторные функции антител, необходимы для измерения способности антител ингибировать репликацию паразитов или индуцировать уничтожение паразитов иммунными клетками. В последние годы была продемонстрирована важность эффекторных функций антител в ингибировании паразитов, и в нескольких исследованиях началось определение вклада антител в отдельные антигены в этом процессе. В следующих разделах мы суммируем последние достижения в нашем понимании природы и механизмов опосредованной приобретенными антителами защиты от P.falciparum инвазия мерозоитов.
Ответы антител на комбинации мерозоитных антигенов
Недавние исследования естественного иммунитета дали важную информацию о том, что широта распознавания антигена более предсказуема для иммунитета, чем реактивность антител против любого отдельного антигена (74, 75, 79–82). Это предполагает, что вакцина на основе одного антигена может не вызывать полностью защитного ответа антител. Чтобы лучше понять, сколько различных антигенов должно быть нацелено для достижения защиты и работают ли ответы антител против определенных комбинаций антигенов лучше, чем другие, был проанализирован кумулятивный защитный эффект индивидуальных специфичностей антител.Как в африканских, так и в индийских популяциях к югу от Сахары комбинации IgG против четырех или пяти антигенов обеспечивали почти полную защиту от малярии с лишь ограниченным вкладом антител против дополнительных антигенов (80, 82). Сообщалось о наиболее эффективных комбинациях антигенов-мишеней, представленных на различных стадиях процесса инвазии, тем самым работая синергетически для подавления инвазии (79). В некоторых из этих комбинаторных анализов ответы IgG против нескольких не охарактеризованных белков, которые не имеют функциональной аннотации, но упоминаются их идентификаторами генов (например, PF3D7_1136200 и PF3D7_0606800), были связаны с наивысшими уровнями защиты.Эти результаты подтверждают подход к разработке мультиантигенной вакцины и побуждают к дальнейшей оценке нескольких новых защитных антигенов как потенциальных вакцин-кандидатов.
Штамм-трансцендентный иммунитет
Циркулирующие штаммов P. falciparum генетически разнообразны (8, 9). Одна из задач при разработке вакцины — вызвать иммунитет против этих генетически различных штаммов паразитов. Исследования пассивной иммунизации в 1960-х и 1990-х годах показали, что передача IgG от иммунных людей, живущих в Западной Африке, пациентам с малярией в Восточной Африке или Таиланде приводила к почти полному избавлению от паразитемии при отсутствии другого лечения (83, 84).Эти результаты предполагают, что IgG от иммунных людей могут ингибировать репликацию различных штаммов P. falciparum из разных географических регионов. Однако оставался вопрос, был ли этот защитный эффект результатом комбинации штамм-специфических антител, нацеленных на несколько генетически разнообразных антигенов, или это было связано с одним или несколькими антителами, нацеленными на консервативные эпитопы и тем самым обеспечивающими трансцендентный штамм иммунитет. Недавнее исследование Hill et al. попытались ответить на этот вопрос, измерив опсонический фагоцитоз мерозоитов 15 различных штаммов паразитов, индуцированный сывороточными антителами полуиммунных детей (5–14 лет), проживающих в Папуа-Новой Гвинее (85).У детей с сывороточными IgG, которые способствовали фагоцитозу мерозоитов всех протестированных штаммов, в течение 6 месяцев наблюдения было отмечено снижение риска развития малярии на 85% по сравнению с детьми с узкой активностью опсонического фагоцитоза в сыворотке. Истощение сывороточных антител, которые связывались с одним штаммом мерозоитов, резко снизило опсонизацию мерозоитов из других штаммов P. falciparum . Эти результаты предполагают, что активность опсонического фагоцитоза против мерозоитов из разных штаммов опосредуется одними и теми же антителами.Однако важно отметить, что уровни воздействия P. falciparum не совпадали между группами, и поэтому нельзя исключать, что различия в активности опсонического фагоцитоза между этими группами были обусловлены различиями в титрах антител. Потребуются дополнительные исследования, чтобы полностью понять динамику трансцендентного штамма иммунитета и идентифицировать консервативные эпитопы, на которые нацелен этот ответ.
Эффекторные функции антител, связанные с защитой
Одним из приоритетов при разработке вакцины против малярии является установление коррелятов защиты и стандартизация тестов in vitro для измерения этих иммунологических параметров.Поэтому важно лучше понять молекулярные и иммунологические механизмы, с помощью которых антитела ингибируют инвазию мерозоитов. В общем, антитела могут действовать, блокируя взаимодействия между молекулами (т.е. нейтрализацию) или способствуя Fc-опосредованным эффекторным функциям, включая активацию комплемента, опсонический фагоцитоз и антителозависимую клеточную цитотоксичность.
Было показано, что антитела против нескольких мерозоитных антигенов действуют путем нейтрализации. Например, связывание IgG с EBA-175 предотвращает прикрепление этого белка к гликофорину А на поверхности эритроцитов, тем самым подавляя инвазию (86).Точно так же IgG против PfRH5, сконструированный так, чтобы не участвовать в каких-либо Fc-опосредованных эффекторных функциях, был способен защищать от заражения P. falciparum , демонстрируя, что нейтрализация, вероятно, является основным механизмом действия (87). Хотя анализ ингибирования роста традиционно был золотым стандартом для оценки нейтрализации антител in vitro , он, как правило, плохо коррелирует с естественной защитой от малярии и поэтому может считаться менее ценным для оценки естественного иммунного ответа, чем другие, более недавние разработаны, пробы (74).Однако анализ ингибирования роста кажется хорошо подходящим для измерения активности антител, которые, как известно, опосредуют их действие посредством нейтрализации. Мы предполагаем, что эти антитела, скорее всего, нацелены на антигены, которых меньше на поверхности мерозоитов и которые участвуют в существенных взаимодействиях с лигандами на эритроцитах (рис. 3). Таким образом, анализ ингибирования роста может быть анализом выбора для оценки вызванных вакциной ответов антител против EBA-175, PfRH5 и, возможно, других антигенов.
Фиг. 3 Антитело-опосредованное ингибирование мерозоитов. Антитела могут действовать несколькими способами, опосредуя ингибирование инвазии мерозоитов в эритроциты. Здесь мы представляем модель различных эффекторных механизмов антител для двух разных классов антигенов: очень распространенных поверхностных белков мерозоитов и относительно мало белков микронем и роптри. (A) Иммуноглобулины G (IgG; показаны голубым), нацеленные на поверхностные белки, не являются эффективными медиаторами ингибирования через нейтрализацию , возможно потому, что для полного блокирования белковой оболочки на поверхности мерозоитов необходимы чрезвычайно высокие концентрации антител. (B) IgG могут эффективно нейтрализовать мерозоиты при нацеливании на относительно дефицитные микронемы и белки роптри на апикальной поверхности, такие как PfRH5 и EBA-175. (C) При нацеливании на многочисленные поверхностные белки опсонический фагоцитоз эффективно опосредуется через IgG1 и IgG3 путем связывания фагоцитарных клеток (зеленый) с их доменом Fc. (D) Многие микронемы и белки роптри высвобождаются на поверхность мерозоитов только после того, как они прикрепляются к эритроцитам и готовы начать процесс инвазии.В этот момент эритроцит будет (частично) защищать IgG, связанные с микронемами и белками rhoptry, от рецепторов Fc фагоцитов. Таким образом, опсонический фагоцитоз не может быть эффективной эффекторной функцией антител против этого класса белков. (E) И IgG, и IgM (оранжевый) эффективно инициируют классический каскад комплемента через C1q (темно-синий) при нацеливании на поверхностные белки для предотвращения инвазии мерозоитов. (F) IgG является эффективным медиатором каскада комплемента при нацеливании на микронемы и белки роптри.IgM может быть менее эффективным против этого класса белков, потому что большой пентамерный IgM не может проникать между поверхностями эритроцитов и мерозоитов.
Проведение новых функциональных анализов выявило роль опсонического фагоцитоза и фиксации комплемента в опосредованном антителами ингибировании и выявило эти эффекторные функции как корреляты естественной защиты. Как уже упоминалось, опсонический фагоцитоз естественными антителами, в основном IgG1 и IgG3, как сообщается, трансцендирует штамм (85) и хорошо коррелирует с защитой от болезней (81, 88).Опсонический фагоцитоз целых мерозоитов увеличивался с большей широтой ответов антител (81, 88), подтверждая, что нацеливание на множественные антигены полезно для антимерозоитного иммунитета. Различные антигены были идентифицированы как мишени для этих опсонизирующих антител, включая MSP1, MSP2 и MSP3 (86, 88, 89). Чтобы дополнительно обозначить роль специфичности отдельных антигенов, Kana et al. использовали шарики, покрытые рекомбинантными белками, для измерения способности антител IgG против отдельных мерозоитных антигенов вызывать опсонический фагоцитоз (90).Фагоцитоз, индуцированный антителами, в этом анализе показал связь с защитой от малярии в продольной когорте из 134 детей в Гане для MSP1-19, MSP2 (аллель 3D7), MSP3 (N-концевая область аллеля K1), GLURP (область 2). и PfRh3-2030 (фрагмент PfRh3, покрывающий аминокислотные остатки 2030–2528), но не против 21 другого антигена, которые были задействованы в качестве мишеней защитного иммунного ответа (90). Комбинации ответов антител против шести антигенов лучше коррелировали с защитой, чем ответы на любой отдельный антиген, предполагая, что антитела против нескольких антигенов могут быть необходимы для индукции оптимального фагоцитоза мерозоитов.
Фиксация комплемента и последующая активация классического пути комплемента также тесно связаны с защитой различных мерозоитных антигенов (74, 91). Этот каскад комплемента завершается формированием комплекса атаки на мембрану, который опосредует лизис мерозоитов. Рейлинг и др. определили, что фиксация C1q, первая стадия в каскаде комплемента, сильно коррелировала с образованием комплекса атаки на мембрану, и поэтому измерили способность сывороточных антител IgM и IgG к различным мерозоитным антигенам связывать C1q как показатель потенциала активации комплемента (74). .Распространенность C1q-фиксирующих антител была высокой для большинства изученных мерозоитных антигенов и сильно коррелировала с защитой от малярии. Наиболее сильные защитные ассоциации наблюдались для C1q-фиксирующих антител против EBA-140 (область III – V), MSP7, ассоциированного с rhoptry белка, подобного лейциновой молнии 1 (RALP1), GPI-заякоренного микронемного антигена (GAMA) и PfRh3-2030. (74). Опять же, комбинации антител против трех разных антигенов показали повышенный защитный эффект по сравнению с отдельными антигенами или комбинациями двух антигенов, причем RALP1 и MSP7 среди антигенов, наиболее часто встречающихся в защитных комбинациях.
Интересно, что сильная опсоническая фагоцитозная активность наблюдалась в основном для антител, направленных против антигенов, экспрессируемых на поверхности мерозоитов, в то время как сильная активность связывания комплемента наблюдалась преимущественно для антител, направленных против белков rhoptry и microneme (74, 90). Из антигенов, которые были протестированы в обоих анализах, антитела, которые проявляли сильную опсоническую фагоцитозную активность против трех из четырех антигенов в анализе на основе шариков, проведенном Kana et al. показали относительно слабую активность связывания комплемента или ее отсутствие, и обратное верно для антител IgG против EBA140RIII-V и RALP1 (74, 90).Вероятно, что несколько эффекторных механизмов антител действуют согласованно, обеспечивая иммунитет (92). Как фиксация комплемента, так и опсонический фагоцитоз индуцируются цитофильными антителами IgG1 и IgG3, что подчеркивает, что индуцированный вакциной ответ против мерозоитных антигенов должен быть направлен на эти изотипы. Результаты Reiling et al. и Кана и др. предполагают, что цитофильные антитела против разных антигенов преимущественно действуют через одну конкретную эффекторную функцию, и будет интересно понять, какие антигенные свойства влияют на этот ответ.Одним из объяснений преимущественной опсонической фагоцитозной активности антител против поверхностных белков мерозоитов может быть то, что многие антигены, расположенные в роттриях и микронемах, подвергаются воздействию только тогда, когда мерозоит находится в прямом контакте с эритроцитом (93) [обзор (70, 94)] и поэтому может быть плохо доступен для фагоцитов (рис. 3). Однако различия между результатами Reiling et al. и Кана и др. также могут влиять различия в титрах антител между людьми, исследуемые антигены, характеристики когорты, критерии включения участников, выбранных для исследования, а также другие переменные.Чтобы дополнительно оценить вклад специфичности антител и эффекторных механизмов в ингибирование инвазии мерозоитов, образцы от одних и тех же людей следует сравнивать бок о бок в анализах, которые измеряют эти различные эффекторные функции по сравнению с одной и той же панелью мерозоитных антигенов. Картирование эпитопов антител с различными уровнями ингибирующей активности против мерозоитов также предоставит важную информацию об иммунных механизмах. Например, связывание моноклональных IgG с ненейтрализующим эпитопом мерозоитного белка PfRH5 приводит к более медленной инвазии эритроцитов, тем самым увеличивая время воздействия нейтрализующих антител других эпитопов на PfRH5 (95).Это привело к синергическому эффекту между ненейтрализующими и нейтрализующими антителами (95). Для MSP1 картирование эпитопов неингибиторных и ингибирующих антител выявило сайты расщепления MSP1 как наиболее уязвимые сайты этого антигена (96). Было бы очень информативно провести такие исследования и для других антигенов, чтобы лучше понять, как действуют антитела и какие эпитопы должны быть нацелены на вакцинацию для достижения эффективного иммунного ответа.
Ответы иммуноглобулина M против белков мерозоитов
Хотя в центре внимания исследований естественного иммунитета был IgG, недавние исследования показывают, что IgM также может играть важную роль в защите (97–99).IgM является отличным медиатором активации комплемента и может таким образом обеспечивать иммунитет (98). Интересное наблюдение о роли IgM в защите от малярии было получено при сравнении людей фулани и догонов, двух генетически различных этнических групп, живущих в Западной Африке с разной восприимчивостью к малярии (100). Фулани более устойчивы к малярии, но несут более низкие частоты классических генов устойчивости к малярии (101), что побудило поиск иммунологических переменных, которые могут объяснить наблюдаемые различия в восприимчивости к малярии.Различия в частоте генетических вариантов в нескольких генах, связанных с иммунитетом, были выявлены между людьми фулани и догонами, но иммунологические последствия этих результатов неясны (102). Транскрипционное профилирование показало, что у фулани есть сильная сигнатура воспалительного гена в популяции моноцитов во время инфекции P. falciparum , что привело к гипотезе о том, что моноциты у людей фулани существуют в «примированном» состоянии, которое вызовет более сильный иммунный ответ при заражении ( 103).У Fulani также были более высокие частоты активированных В-клеток памяти в отсутствие инфекции и более высокий процент плазматических клеток во время инфекции P. falciparum (104). Эти усиленные клеточные иммунные ответы, скорее всего, объясняют повышенные уровни IgM и IgG против многих белков P. falciparum у фулани по сравнению с догонами (97). Интересно, что ответы Fulani IgM распознавали более широкий репертуар белков P. falciparum , чем ответы IgG, включая набор антигенов, уровни антител к которым коррелировали с защитой (97).Эти результаты предполагают, что IgM могут играть недооцененную роль в защите от малярии.
В модели на мышах было показано, что B-клетки памяти IgM + являются первыми ответчиками на вторичные инфекции Plasmodium , давая начало клеткам, секретирующим антитела IgM и IgG (99). IgM + В-клетки памяти содержали соматические гипермутации и распознавали целевые антигены с высокой аффинностью, что указывает на зависимое от Т-клеток созревание аффинности в зародышевом центре.IgM + В-клетки памяти со специфичностью к мерозоитным антигенам также были обнаружены у людей, переживших малярию (99). Наконец, Boyle et al. недавно показали, что IgM против мерозоитных антигенов быстро появляется при инфицировании P. falciparum и достигает высоких уровней у лиц, подвергшихся воздействию в течение всей жизни (98). Уровни IgM были более стабильными в условиях низкой передачи, чем уровни IgG, и были связаны с защитой (98). Однако у детей с высоким уровнем IgM также был высокий уровень IgG против мерозоитных антигенов, что также было связано с защитой.Следовательно, независимый вклад этих классов антител в иммунитет еще предстоит определить.
Получение и поддержание гуморальных иммунных ответов против
Plasmodium falciparumЕстественно приобретенные ответы антител против P. falciparum требуют многократного воздействия паразитов для достижения защиты, хотя, вероятно, никогда не достигают стерилизующего иммунитета. Скорость приобретения антител против белков P. falciparum зависит от различных факторов, включая возраст человека-хозяина, интенсивность передачи и тип антигена (72, 73, 105, 106).В целом уровни антител повышаются как с возрастом, так и с более высокой интенсивностью передачи (72, 73, 105). Антитела против различных антигенов накапливаются с разной скоростью, причем более сильные ответы обычно наблюдаются для антител, нацеленных на внеклеточные белки или белки плазматической мембраны, а также белки, которые в большом количестве, высокополиморфны или не имеют человеческого ортолога (106).
Было показано, что IgG против PfEMP1 приобретаются в течение первых лет жизни (47, 107), и их ширина увеличивается с возрастом и воздействием (38, 60).В когорте детей из Папуа-Новой Гвинеи уровни антител IgG к PfEMP1 положительно коррелировали с защитой как у детей младшего возраста (1–4 года), так и у детей старшего возраста (5–14 лет) (107). Интересно, что антитела против мерозоитных антигенов были связаны с защитой только у детей старшего возраста в этой когорте (107). Эти результаты предполагают, что антитела против PfEMP1 могут обеспечить первую линию защиты от тяжелого патогенеза малярии в раннем возрасте, в то время как антитела к другим антигенам паразитов могут способствовать защите от неосложненной малярии у детей старшего возраста.Это может показаться нелогичным, учитывая чрезвычайно высокое разнообразие вариантов PfEMP1 как на уровне аминокислотных последовательностей, так и на уровне состава доменов, в то время как полиморфизмы в мерозоитных антигенах обеспечивают относительно скромные вариации последовательностей по сравнению с ними. Однако, как подробно описано в разделе 2.1, только небольшая часть доменов PfEMP1 является патогенной, что дает особенно убедительные доказательства роли CIDRα1 в тяжелой малярии. Нацеливания на один или небольшую панель таких патогенных доменов PfEMP1 может быть достаточно для достижения защиты от тяжелого заболевания.Напротив, более широкий ответ антител с более высокими титрами антител может быть необходим для эффективного ингибирования инвазии мерозоитов в эритроциты. Действительно, сообщалось, что антитела против мерозоитных антигенов должны достигнуть порогового уровня, прежде чем связываться с защитой (10, 11). Хотя такой функциональный пороговый уровень также может существовать для антител против PfEMP1 и антигенов других патогенов, потребность в распознавании множественных мерозоитных антигенов при высоких концентрациях антител может быть исключительно высокой для инфекций Plasmodium .Это может объяснить, почему относительно низкие уровни антител против мерозоитов у маленьких детей недостаточны для обеспечения защиты от малярии у этих людей, в то время как аналогичные уровни антител против PfEMP1 обеспечивают защиту от тяжелого заболевания. Вклад иммунных ответов против этих двух основных групп антигенов в иммунитет еще предстоит полностью выяснить.
Дополнительным осложнением генерации защитного ответа антител против P. falciparum является способность паразита модулировать иммунные ответы через несколько механизмов . Инфекции Plasmodium вызывают провоспалительный иммунный ответ, который стимулирует дифференцировку Т-клеток CD4 + в Th-1 поляризованные Т-фолликулярные хелперы, что приводит к нарушению ответов зародышевого центра (ГЦ) (108, 109). Эта провоспалительная среда также вызывает рост субпопуляции B-клеток, известных как «атипичные B-клетки памяти» (110, 111) [обзор в (112, 113)]. Эти клетки экспрессируют ингибирующие рецепторы и были описаны как функционально нарушенные (114, 115), хотя в нескольких исследованиях сообщалось, что эти клетки на самом деле могут быть функциональными и могут вносить вклад в антипаразитарный иммунитет (116, 117).Было высказано предположение, что наивные В-клетки дифференцируются в атипичные В-клетки памяти в В-клеточных фолликулах при стимуляции гамма-интерфероном, продуцируемым Th-1 поляризованными Т-фолликулярными хелперами и агонистами Toll-подобных рецепторов (118). В этом процессе атипичные В-клетки памяти могут обходить зародышевый центр (ГЦ) или преждевременно выходить из ГЦ, тем самым ограничивая созревание аффинности и способность этих клеток продуцировать высокоаффинные антитела. Наконец, недавнее исследование показало, что при экспериментальной инфекции Plasmodium у человека и мыши большая часть активированных В-клеток дифференцировалась во экстрафолликулярные плазмобласты (119).Высокая потребность реплицирующихся плазмобластов в питательных веществах, в частности в аминокислоте L-глутамине, превосходила потребность GC B-клеток, тем самым ограничивая развитие B-клеток памяти и долгоживущих плазматических клеток. Нарушение образования GC во время инфекции Plasmodium , вероятно, препятствует развитию B-клеток с высоким сродством к антигенам паразитов. Однако возможно, что хроническая и повторяющаяся природа инфекций P. falciparum в конечном итоге позволит получить высокие уровни соматических гипермутаций путем последовательных циклов активации В-клеток памяти и созревания аффинности, как, например, при ВИЧ-инфекции. 1-инфицированные (120–122).В качестве альтернативы, плазматические клетки с высоким сродством могут быть получены из наивных предшественников B-клеток с присущей им высокой аффинностью связывания, что ограничит потребность в эффективных реакциях зародышевого центра (123). Продольные молекулярные исследования эволюции антител не проводились у индивидуумов, подвергшихся естественному воздействию P. falciparum , но были бы полезны для лучшего понимания того, как защитные реакции антител развиваются с течением времени.
Учитывая высокие уровни антител, необходимых для защиты от малярии, защитные реакции антител обычно не поддерживаются в течение длительных периодов времени без повторного воздействия.Уровни антител поддерживаются долгоживущими секретирующими антитела клетками в костном мозге. Хотя эти плазматические клетки нелегко доступны для изучения на людях, их период полураспада можно смоделировать на основе уровней антител в сыворотке. Используя этот подход, Yman et al. обнаружили, что уровни антител против мерозоитных антигенов, а также доля долгоживущих клеток, секретирующих антитела, после эпизода малярии у лиц, которые ранее подвергались облучению из-за проживания в эндемичной зоне (в среднем 14 лет назад), были выше по сравнению с предыдущими путешественники, не знающие малярии (12).Эти результаты предполагают, что повторные инфекции P. falciparum необходимы для стимулирования образования долгоживущих клеток, секретирующих антитела, что дает объяснение наблюдению, что иммунитет требует длительного воздействия. Кроме того, период полураспада долгоживущих плазматических клеток, специфичных к мерозоитным антигенам, составлял 2–4 года, что было короче, чем у долгоживущих клеток, секретирующих антитела против столбнячного анатоксина (7 лет), и объясняет, почему некоторая степень воздействия необходимо для поддержания иммунитета (12).Однако это исследование также продемонстрировало, что иммунологическая память не теряется полностью после более чем десятилетнего отсутствия воздействия. Эти результаты согласуются с более ранним отчетом, который показал, что у пяти жителей Швеции, которые ранее лечились от малярии после международных поездок, мерозоитных антиген-специфических В-клеток памяти P. falciparum были обнаружены вплоть до 16 лет спустя в отсутствие повторного заражения. -экспозиция (124). Результаты недавнего исследования в регионе с низким уровнем передачи инфекции в Замбии показывают, что уровень воздействия, необходимый для поддержания уровня антител, вероятно, очень низок (73).В этих условиях распространенность паразитов в популяции составляла примерно 2,5%, большинство инфекций протекало бессимптомно, и примерно у половины всех людей с паразитемией уровни паразитов не определялись с помощью быстрых диагностических тестов. В отсутствие значимой недавней передачи у взрослых наблюдался стабильный уровень антител в течение 2 лет, что позволяет предположить, что нечастых инфекций с паразитемией низкого уровня достаточно для поддержания гуморального иммунного ответа. Среди мишеней наиболее сильных ответов антител были варианты PfEMP1 и мерозоитные антигены.Ни одно из рассмотренных выше исследований не включало функциональную оценку ответов антител, и поэтому неясно, вносят ли антитела, измеренные в этих исследованиях, вклад в защиту. Однако, если предположить, что долгоживущие клетки, секретирующие антитела, и антитела, нацеленные на защитные эпитопы, имеют сходную кинетику, эти результаты предполагают, что долговременная защита с помощью вакцинации может быть возможна при частом усилении гуморального иммунного ответа.
Заключительные замечания
Основные мишени естественного иммунного ответа против P.falciparum — это вариантные поверхностные антигены на плазматической мембране инфицированных эритроцитов и антигены, экспрессируемые мерозоитами. Антительные ответы против вариантов PfEMP1 развиваются на раннем этапе жизни человека и, по-видимому, являются основным фактором защиты от тяжелой малярии у детей раннего возраста. Защита от малярии у детей старшего возраста достигается, когда антитела против мерозоитных антигенов достигают достаточно высокого уровня. Вакцина, основанная на комбинации этих двух классов антигенов, может вырабатывать антитела, которые обладают аддитивным эффектом или, возможно, даже действуют синергетически, в направлении предотвращения всех клинических проявлений малярии.
Основным препятствием для разработки вакцины, нацеленной на PfEMP1, является идентификация консервативных эпитопов, учитывая огромное разнообразие последовательностей среди этого семейства белков. Домен CIDRα1 имеет наибольший потенциал в качестве кандидата на вакцину против тяжелой малярии, учитывая его роль в патогенезе тяжелой малярии через связывание с EPCR и из-за структурной консервации сайта связывания EPCR.
Корреляция с защитой наблюдалась для ответов антител против многих различных мерозоитных антигенов.Более широкие ответы антител обеспечивают лучшую защиту с почти полной защитой ответов против комбинаций из трех-четырех антигенов. Что остается неясным, так это то, какие из этих (комбинаций) антигенов следует использовать при разработке вакцины. Поскольку многие из этих антигенов полиморфны, идентификация консервативных эпитопов имеет высокий приоритет. Кроме того, несколько кандидатов, которые были идентифицированы, имеют неизвестные функции, и дальнейшая характеристика этих белков предоставит более глубокое понимание процесса инвазии мерозоитов.
Наконец, недавние исследования выявили механизмы опосредованного антителами ингибирования паразитов. Понимание того, как антитела действуют против различных антигенов-мишеней, важно для возможности вызвать наиболее эффективный иммунный ответ путем вакцинации и установить корреляты защиты. Природа предоставила нам доказательство того, что защита от инфекции на стадии крови достижима. Таким образом, наше более глубокое понимание естественного иммунитета дает надежду на разработку вакцины против малярии на стадии крови.
Вклад авторов
Первый вариант рукописи был подготовлен SG и RR и отредактирован EB. AB, SB и GB дополнительно отредактировали рукопись и внесли интеллектуальный вклад в дизайн рисунков. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана Национальными институтами здравоохранения [номера грантов AI128466 и AI133274]. SG и AB поддерживаются грантом NIH T32 AI138944 по программе Graduate Research in Immunology Programme.RR поддерживается Национальным центром развития трансляционных наук Национальных институтов здравоохранения под номером награды TL1TR002647.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
2. Draper SJ, Sack BK, King CR, Nielsen CM, Rayner JC, Higgins MK, et al. Вакцины против малярии: последние достижения и новые горизонты. Клеточный микроб-хозяин (2018) 24: 43–56. doi: 10.1016 / j.chom.2018.06.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Кокберн И.А., Седер Р.А. Профилактика малярии: от иммунологических концепций до эффективных вакцин и защитных антител. Нат Иммунол (2018) 19: 1199–211. doi: 10.1038 / s41590-018-0228-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Кампоново Ф., Кампо Дж. Дж., Ле TQ, Обераи А., Хунг С., Пабло Дж. В. и др.Полнопротеомный анализ исследования вакцины против малярии показывает персонализированные гуморальные иммунные профили у взрослых жителей Танзании. Элиф (2020) 9: e53080. doi: 10.7554 / eLife.53080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Crompton PD, Kayala MA, Traore B, Kayentao K, Ongoiba A, Weiss GE, et al. Перспективный анализ ответа антител на Plasmodium falciparum до и после сезона малярии с помощью белкового микрочипа. Proc Natl Acad Sci USA (2010) 107: 6958–63.DOI: 10.1073 / pnas.1001323107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Дент А.Е., Накадзима Р., Лян Л., Баум Е., Мурманн А.М., Сумба П.О. и др. Plasmodium falciparum Профили антител на белковом микрочипе коррелируют с защитой от симптоматической малярии в Кении. J Infect Dis (2015) 212: 1429–38. doi: 10.1093 / infdis / jiv224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Му Дж, Авадалла П., Дуан Дж., МакГи К.М., Киблер Дж., Сейдел К. и др.Изменчивость по всему геному и идентификация мишеней вакцины в геноме Plasmodium falciparum . Нат Генет (2007) 39: 126–30. DOI: 10.1038 / ng1924
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Volkman SK, Sabeti PC, DeCaprio D, Neafsey DE, Schaffner SF, Milner DA Jr., et al. Полногеномная карта разнообразия у Plasmodium falciparum . Нат Генет (2007) 39: 113–9. DOI: 10.1038 / ng1930
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Мурунги Л.М., Камую Дж., Лоу Б., Беджон П., Тайсен М., Киньянджуй С.М. и др. Для защиты от клинических эпизодов малярии требуется пороговая концентрация антимерозоитных антител. Vaccine (2013) 31: 3936–42. doi: 10.1016 / j.vaccine.2013.06.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Станисич Д.И., Фаукс Ф.Дж., Койнари М., Джавати С., Лин Э., Киниборо Б. и др. Приобретение антител против мерозоитов Plasmodium falciparum и малярийный иммунитет у маленьких детей и влияние возраста, силы инфекции и степени реакции. Infect Immun (2015) 83: 646–60. doi: 10.1128 / IAI.02398-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Иман В., Уайт М. Т., Асгар М., Сандлинг С., Сонден К., Дрейпер С. Дж. И др. Ответы антител на мерозоитные антигены после естественной инфекции Plasmodium falciparum : кинетика и продолжительность жизни в отсутствие повторного воздействия. BMC Med (2019) 17:22. doi: 10.1186 / s12916-019-1255-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Kinyanjui SM, Conway DJ, Lanar DE, Marsh K. Ответы антител IgG на мерозоитные антигены Plasmodium falciparum у кенийских детей имеют короткий период полураспада. Малар J (2007) 6:82. doi: 10.1186 / 1475-2875-6-82
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Fowkes FJ, McGready R, Cross NJ, Hommel M, Simpson JA, Elliott SR, et al. Новые сведения о приобретении, повышении и продолжительности иммунитета к малярии у беременных женщин. J Infect Dis (2012) 206: 1612–21.doi: 10.1093 / infdis / jis566
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Белый М. Т., Гриффин Дж. Т., Акпогенета О., Конвей Д. Д., Корам К. А., Райли Е. М. и др. Динамика ответа антител на инфекцию Plasmodium falciparum у африканских детей. J Infect Dis (2014) 210: 1115–22. doi: 10.1093 / infdis / jiu219
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Барух Д.И., Паслоске Б.Л., Сингх HB, Би X, Ма XC, Фельдман М. и др.Клонирование P . falciparum ген, кодирующий PfEMP1, малярийный вариантный антиген и рецептор адгезии на поверхности паразитированных эритроцитов человека. Cell (1995) 82: 77–87. doi: 10.1016 / 0092-8674 (95)
-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Су XZ, Heatwole VM, Wertheimer SP, Guinet F, Herrfeldt JA, Peterson DS, et al. Большое разнообразие генов семейства var кодирует белки, участвующие в цитоадгезии и антигенной изменчивости эритроцитов, инфицированных Plasmodium falciparum . Cell (1995) 82: 89–100. doi: 10.1016 / 0092-8674 (95) -1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Smith JD, Chitnis CE, Craig AG, Roberts DJ, Hudson-Taylor DE, Peterson DS, et al. Переключение экспрессии генов Plasmodium falciparum var коррелирует с изменениями антигенного и цитоадгезионного фенотипа инфицированных эритроцитов. Cell (1995) 82: 101–10. doi: 10.1016 / 0092-8674 (95)
- -X
- -A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Wichers JS, Scholz JAM, Strauss J, Witt S, Lill A, Ehnold LI, et al. Анализ экспрессии генов, локализации, топологии мембран и функций семейства белков Plasmodium falciparum STEVOR. мБио (2019) 10: e01500-19. doi: 10.1128 / mBio.01500-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. МакРоберт Л., Прейзер П., Шарп С., Джарра В., Кавиратне М., Тейлор М.К. и др. Четкая доставка и локализация белков STEVOR на трех стадиях жизненного цикла Plasmodium falciparum . Infect Immun (2004) 72: 6597–602. doi: 10.1128 / IAI.72.11.6597-6602.2004
PubMed Реферат | CrossRef Полный текст | Google Scholar
66.Blythe JE, Yam XY, Kuss C, Bozdech Z, Holder AA, Marsh K, et al. Plasmodium falciparum Белки STEVOR высоко экспрессируются в изолятах пациентов и располагаются на поверхностных мембранах инфицированных эритроцитов и апикальных концах мерозоитов. Infect Immun (2008) 76: 3329–36. doi: 10.1128 / IAI.01460-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Сингх Х., Маднани К., Лим Й.Б., Цао Дж., Preiser PR, Lim CT. Динамика экспрессии и физиологически релевантное функциональное исследование STEVOR на бесполых стадиях инфекции Plasmodium falciparum . Cell Microbiol (2017) 19: e12715. doi: 10.1111 / cmi.12715
CrossRef Полный текст | Google Scholar
68. Каной Б.Н., Нагаока Х., Уайт М.Т., Морита М., Palacpac NMQ, Ntege EH и др. Глобальный репертуар человеческих антител против Plasmodium falciparum RIFINs, SURFINs и STEVORs в популяции, подвергшейся воздействию малярии. Фронт Иммунол (2020) 11: 893. doi: 10.3389 / fimmu.2020.00893
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Lavazec C, Sanyal S, Templeton TJ. Гипервариабельность внутри суперсемейств Rifin, Stevor и Pfmc-2TM в Plasmodium falciparum . Nucleic Acids Res (2006) 34: 6696–707. doi: 10.1093 / nar / gkl942
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Cowman AF, Tonkin CJ, Tham WH, Duraisingh MT. Молекулярные основы инвазии эритроцитов малярийными паразитами. Клеточный микроб-хозяин (2017) 22: 232–45. doi: 10.1016 / j.chom.2017.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Бисон Дж. Г., Куртович Л., Добано С., Опи Д. Х., Чан Дж. А., Фенг Дж. И др. Проблемы и стратегии разработки эффективных и долговечных вакцин против малярии. Sci Transl Med (2019) 11: eaau1458. doi: 10.1126 / scitranslmed.aau1458
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. King CL, Davies DH, Felgner P, Baum E, Jain A, Randall A, et al. Биосигнатуры воздействия / передачи и иммунитета. Am J Trop Med Hyg (2015) 93: 16–27. DOI: 10.4269 / ajtmh.15-0037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Кобаяши Т., Джайн А., Лян Л, Обиеро Дж. М., Хамапумбу Х., Стивенсон Дж. К. и др. Отчетливые сигнатуры антител, связанные с различной интенсивностью передачи малярии в Замбии и Зимбабве. мСфера (2019) 4: e00061-19. doi: 10.1128 / mSphereDirect.00061-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Рейлинг Л., Бойл М.Дж., Уайт М.Т., Уилсон Д.В., Фенг Дж., Уивер Р. и др.Мишени комплемент-фиксирующих антител в защитном иммунитете против малярии у детей. Нац Коммуна (2019) 10: 610. doi: 10.1038 / s41467-019-08528-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Ричардс Дж. С., Арумугам Т. У., Рейлинг Л., Целитель Дж., Ходдер А. Н., Фаукс Ф. Дж. И др. Идентификация и приоритизация мерозоитных антигенов как мишеней защитного иммунитета человека против малярии Plasmodium falciparum для разработки вакцин и биомаркеров. J Immunol (2013) 191: 795–809. doi: 10.4049 / jimmunol.1300778
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Proietti C, Krause L, Trieu A, Dodoo D, Gyan B, Koram KA, et al. Иммунная сигнатура против Plasmodium falciparum антигенов позволяет прогнозировать клинический иммунитет в отдельных эндемичных по малярии сообществах. Mol Cell Proteomics (2020) 19: 101–13. doi: 10.1074 / mcp.RA118.001256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78.Гевара Патино Дж. А., Держатель А. А., МакБрайд Дж. С., Блэкман М. Дж.. Антитела, которые ингибируют процессинг поверхностного белка-1 малярийного мерозоита и инвазию эритроцитов, блокируются естественными человеческими антителами. J Exp Med (1997) 186: 1689–99. doi: 10.1084 / jem.186.10.1689
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Bustamante LY, Powell GT, Lin YC, Macklin MD, Cross N, Kemp A, et al. Синергетические комбинации вакцин против малярии, выявленные с помощью систематического антигенного скрининга. Proc Natl Acad Sci USA (2017) 114: 12045–50. DOI: 10.1073 / pnas.1702944114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Гарсия-Сеносиан А., Кана И.Х., Сингх С.К., Чурасия Б.К., Дас М.К., Доду Д. и др. Поверхностные белки периферических мерозоитов являются мишенями естественного иммунитета против малярии как в Индии, так и в Гане. Infect Immun (2020) 88: e00778-19. doi: 10.1128 / IAI.00778-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81.Кана И.Х., Гарсия-Сеносиаин А., Сингх С.К., Тиендребеого Р.В., Чурасия Б.К., Малхотра П. и др. Цитофильные антитела против ключевых антигенов стадии крови Plasmodium falciparum способствуют защите от клинической малярии в регионе с высокой степенью передачи инфекции на востоке Индии. J Infect Dis (2018) 218: 956–65. doi: 10.1093 / infdis / jiy258
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Osier FH, Mackinnon MJ, Crosnier C, Fegan G, Kamuyu G, Wanaguru M, et al.Новые антигены для многокомпонентной вакцины против малярии на стадии крови. Sci Transl Med (2014) 6: 247ra102. doi: 10.1126 / scitranslmed.3008705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Sabchareon A, Burnouf T., Ouattara D, Attanath P, Bouharoun-Tayoun H, Chantavanich P, et al. Паразитологический и клинический ответ человека на введение иммуноглобулина при малярии falciparum . Am J Trop Med Hyg (1991) 45: 297–308. DOI: 10.4269 / ajtmh.1991.45.297
PubMed Реферат | CrossRef Полный текст | Google Scholar
85. Hill DL, Wilson DW, Sampaio NG, Eriksson EM, Ryg-Cornejo V, Harrison GLA и др. Мерозоитные антигены Plasmodium falciparum вызывают штаммовый опсонизирующий иммунитет. Infect Immun (2016) 84: 2175–84. doi: 10.1128 / IAI.00145-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Ирани В., Рамсленд П.А., Гай А.Дж., Сиба П.М., Мюллер И., Ричардс Дж.С. и др.Приобретение функциональных антител, которые блокируют связывание эритроцит-связывающего антигена 175 и защиту от малярии Plasmodium falciparum у детей. Clin Infect Dis (2015) 61: 1244–52. doi: 10.1093 / cid / civ525
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Дуглас А.Д., Бальдевиано Г.К., Джин Дж., Миура К., Диуф А., Зенонос З.А. и др. Определенный механистический коррелят защиты от малярии Plasmodium falciparum у нечеловеческих приматов. Нац Коммуна (2019) 10: 1953. doi: 10.1038 / s41467-019-09894-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Osier FH, Feng G, Boyle MJ, Langer C, Zhou J, Richards JS и др. Опсонический фагоцитоз мерозоитов Plasmodium falciparum : механизм иммунитета человека и коррелят защиты от малярии. BMC Med (2014) 12: 108. doi: 10.1186 / 1741-7015-12-108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89.Jaschke A, Coulibaly B, Remarque EJ, Bujard H, Epp C. Поверхностный белок 1 мерозоитов из Plasmodium falciparum является основной мишенью опсонизирующих антител у людей с приобретенным иммунитетом против малярии. Clin Vaccine Immunol (2017) 24: e00155-17. doi: 10.1128 / CVI.00155-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Кана И.Х., Сингх С.К., Гарсия-Сеносиан А., Доду Д., Сингх С., Аду Б. и др. Широкий спектр функциональных антител связан с фагоцитозом мерозоитов Plasmodium falciparum и защитой от лихорадочной малярии. J Infect Dis (2019) 220: 275–84. doi: 10.1093 / infdis / jiz088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Boyle MJ, Reiling L, Feng G, Langer C, Osier FH, Aspeling-Jones H, et al. Человеческие антитела фиксируют комплемент для подавления инвазии Plasmodium falciparum в эритроциты и связаны с защитой от малярии. Иммунитет (2015) 42: 580–90. doi: 10.1016 / j.immuni.2015.02.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92.Мурунги Л.М., Сонден К., Ллевеллин Д., Роно Дж., Гулейд Ф., Уильямс А.Р. и др. Цели и механизмы, связанные с защитой от тяжелой малярии Plasmodium falciparum у кенийских детей. Infect Immun (2016) 84: 950–63. doi: 10.1128 / IAI.01120-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Zuccala ES, Gout AM, Dekiwadia C, Marapana DS, Angrisano F, Turnbull L, et al. Субкомпартментализация белков в rhoptries коррелирует с упорядоченными событиями инвазии эритроцитов паразитом малярии на стадии крови. PloS One (2012) 7: e46160. doi: 10.1371 / journal.pone.0046160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Alanine DGW, Quinkert D, Kumarasingha R, Mehmood S, Donnellan FR, Minkah NK, et al. Человеческие антитела, замедляющие инвазию эритроцитов, усиливают нейтрализующие малярию антитела. Cell (2019) 178: 216–228 e21. doi: 10.1016 / j.cell.2019.05.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Blank A, Furle K, Jaschke A, Mikus G, Lehmann M, Husing J, et al.Иммунизация полноразмерным поверхностным белком мерозоитов Plasmodium falciparum 1 является безопасным и выявляет функциональные цитофильные антитела в рандомизированном испытании с участием людей. Вакцины NPJ (2020) 5:10. DOI: 10.1038 / s41541-020-0160-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Арама С., Скиннер Дж., Думтабэ Д., Португалия С., Тран Т.М., Джайн А. и др. Генетическая устойчивость к малярии связана с большим усилением иммуноглобулина (Ig) M, чем ответы IgG на широкий спектр антигенов Plasmodium falciparum . Открытый форум Infect Dis (2015) 2: ofv118. doi: 10.1093 / ofid / ofv118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Boyle MJ, Chan JA, Handayuni I., Reiling L, Feng G, Hilton A, et al. IgM в иммунитете человека к малярии Plasmodium falciparum . Научный прогресс (2019) 5: eaax4489. doi: 10.1126 / sciadv.aax4489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Krishnamurty AT, Thouvenel CD, Portugal S, Keitany GJ, Kim KS, Holder A, et al.Соматически гипермутированные Plasmodium -специфические IgM (+) В-клетки памяти являются быстрыми, пластичными, ранними ответчиками на повторное заражение малярией. Иммунитет (2016) 45: 402–14. doi: 10.1016 / j.immuni.2016.06.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Доло А, Модиано Д., Майга Б., Дау М., Доло Дж., Гиндо Х. и др. Разница в восприимчивости к малярии между двумя симпатрическими этническими группами в Мали. Am J Trop Med Hyg (2005) 72: 243–8. DOI: 10.4269 / ajtmh.2005.72.243
PubMed Реферат | CrossRef Полный текст | Google Scholar
101. Модиано Д., Луони Дж., Сирима Б.С., Ланфранкотти А., Петрарка В., Кручиани Ф. и др. Более низкая восприимчивость к малярии Plasmodium falciparum фулани из Буркина-Фасо (западная Африка) связана с низкими частотами генов устойчивости к классической малярии. Trans R Soc Trop Med Hyg (2001) 95: 149–52. doi: 10.1016 / S0035-9203 (01)
-5PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Майга Б., Доло А., Туре О, Дара В., Тапили А., Кампино С. и др. Полиморфизмы кандидатов-кандидатов в симпатрических этнических группах, различающихся по восприимчивости к малярии, в Мали. PloS One (2013) 8: e75675. doi: 10.1371 / journal.pone.0075675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Quin JE, Bujila I, Cherif M, Sanou GS, Qu Y, Vafa Homann M, et al. Основные изменения транскрипции наблюдаются у фулани, этнической группы, менее подверженной малярии. Элиф (2017) 6: e29156.doi: 10.7554 / eLife.29156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Portugal S, Doumtabe D, Traore B, Miller LH, Troye-Blomberg M, Doumbo OK, et al. Анализ B-клеток этнических групп в Мали с дифференциальной восприимчивостью к малярии. Малар Дж. (2012) 11: 162. DOI: 10.1186 / 1475-2875-11-162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. McCallum FJ, Persson KE, Fowkes FJ, Reiling L, Mugyenyi CK, Richards JS, et al.Различная скорость приобретения антител к мерозоитным антигенам при малярии: последствия для иммунитета и эпиднадзора. J Leukoc Biol (2017) 101: 913–25. doi: 10.1189 / jlb.5MA0716-294R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Лю Э.В., Скиннер Дж., Тран Т.М., Кумар К., Нарум Д.Л., Джайн А. и др. Белковые особенности, связанные с вариабельностью человеческих антител к антигенам малярии Plasmodium falciparum . Am J Trop Med Hyg (2018) 98: 57–66.doi: 10.4269 / ajtmh.17-0437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Чан Дж. А., Станисич Д. И., Даффи М. Ф., Робинсон Л. Дж., Лин Е., Казура Дж. В. и др. Паттерны защитных ассоциаций различаются для антител к P . falciparum — инфицированные эритроцитами и мерозоитами иммунитет против малярии у детей. Eur J Immunol (2017) 47: 2124–36. doi: 10.1002 / eji.201747032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108.Обенг-Аджеи Н., Португалия С., Тран Т.М., Язев Т.Б., Скиннер Дж., Ли С. и др. Циркулирующие клетки Tfh типа Th2-клеток, которые проявляют нарушенную функцию B-клеток, предпочтительно активируются во время острой малярии у детей. Cell Rep (2015) 13: 425–39. doi: 10.1016 / j.celrep.2015.09.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Ryg-Cornejo V, Ioannidis LJ, Ly A, Chiu CY, Tellier J, Hill DL, et al. Тяжелые малярийные инфекции ухудшают реакцию зародышевых центров, подавляя дифференцировку Т-фолликулярных хелперных клеток. Cell Rep (2016) 14: 68–81. doi: 10.1016 / j.celrep.2015.12.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Weiss GE, Crompton PD, Li S, Walsh LA, Moir S, Traore B и др. Атипичные В-клетки памяти значительно увеличиваются у людей, живущих в эндемичных по малярии районах. J Immunol (2009) 183: 2176–82. doi: 10.4049 / jimmunol.0
7PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Обенг-Аджеи Н., Португалия С., Холла П., Ли С., Сон Х., Амбегаонкар А. и др.Вызванный малярией гамма-интерферон стимулирует рост атипичных В-клеток памяти Tbethi. PloS Pathog (2017) 13: e1006576. doi: 10.1371 / journal.ppat.1006576
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Portugal S, Obeng-Adjei N, Moir S, Crompton PD, Pierce SK. Атипичные В-клетки памяти при хронических инфекционных заболеваниях человека: промежуточный отчет. Cell Immunol (2017) 321: 18–25. doi: 10.1016 / j.cellimm.2017.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113.Брэддом А., Батугедара Г., Бол С., Бунник Э. Потенциальные функции атипичных В-клеток памяти у лиц, подвергшихся воздействию Plasmodium . Int J Parasitol (2020). (Под давлением). doi: 10.1016 / j.ijpara.2020.08.003
CrossRef Полный текст | Google Scholar
114. Portugal S, Tipton CM, Sohn H, Kone Y, Wang J, Li S и др. Связанные с малярией атипичные В-клетки памяти демонстрируют заметно сниженную передачу сигналов рецептора В-клеток и эффекторную функцию. Элиф (2015) 4: e07218.doi: 10.7554 / eLife.07218
CrossRef Полный текст | Google Scholar
115. Салливан Р. Т., Ким С. К., Фонтана М. Ф., Фини М. Е., Джаганнатан П., Бойл М. Дж. И др. FCRL5 определяет функционально нарушенные В-клетки памяти, связанные с воздействием Plasmodium falciparum . PloS Pathog (2015) 11: e1004894. doi: 10.1371 / journal.ppat.1004894
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Muellenbeck MF, Ueberheide B, Amulic B, Epp A, Fenyo D, Busse CE и др.Атипичные и классические В-клетки памяти продуцируют нейтрализующие антитела Plasmodium falciparum . J Exp Med (2013) 210: 389–99. doi: 10.1084 / jem.20121970
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Амбегаонкар А.А., Квак К., Сон Х., Манцелла-Лапейра Дж., Бжостовски Дж., Пирс С.К. Экспрессия ингибирующих рецепторов В-клетками при хронических инфекционных заболеваниях человека ограничивает ответы на мембранно-ассоциированные антигены. Научный руководитель (2020) 6: eaba6493.doi: 10.1126 / sciadv.aba6493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Холла П., Амбегаонкар А., Сон Х., Пирс С.К. Истощение может отсутствовать в словаре В-клеток человека, по крайней мере, при малярии. Immunol Rev (2019) 292: 139–48. doi: 10.1111 / imr.12809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Виджай Р., Гутмиллер Дж. Дж., Стурц А. Дж., Суретт Ф. А., Роджерс К. Дж., Сомпалла Р. Р. и др. Вызванные инфекцией плазмобласты являются стоком питательных веществ, нарушающим гуморальный иммунитет к малярии. Нат Иммунол (2020) 21: 790–801. doi: 10.1038 / s41590-020-0678-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Ву X, Чжоу Т., Чжу Дж., Чжан Б., Георгиев И., Ван С. и др. Сфокусированная эволюция нейтрализующих антител к ВИЧ-1, выявленная структурой и глубоким секвенированием. Наука (2011) 333: 1593–602. DOI: 10.1126 / science.1207532
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Klein F, Diskin R, Scheid JF, Gaebler C., Mouquet H, Georgiev IS, et al.Соматические мутации каркаса иммуноглобулина обычно требуются для широкой и сильной нейтрализации ВИЧ-1. Cell (2013) 153: 126–38. doi: 10.1016 / j.cell.2013.03.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Liao HX, Lynch R, Zhou T, Gao F, Alam SM, Boyd SD, et al. Совместная эволюция широко нейтрализующего антитела ВИЧ-1 и вируса-основателя. Nature (2013) 496: 469–76. DOI: 10.1038 / nature12053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123.Муруган Р., Бухауэр Л., Триллер Дж., Крешель С., Коста Дж., Пиделасерра Марти Дж. И др. Клональный отбор стимулирует защитные реакции В-клеток памяти при контролируемой малярийной инфекции у человека. Sci Immunol (2018) 3: eaap8029. doi: 10.1126 / sciimmunol.aap8029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Ндунгу Ф.М., Лундблом К., Роно Дж., Иллингворт Дж., Эрикссон С., Фарнерт А. Долгоживущие В-клетки специфической памяти Plasmodium falciparum у шведских путешественников, подвергшихся естественному воздействию. Eur J Immunol (2013) 43: 2919–29. doi: 10.1002 / eji.201343630
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пассивная иммунизация | История вакцин
В этой статье предполагается, что вы знакомы с терминами антитело, антиген, иммунитет, и патоген . См. Определения в Глоссарии.
Человек может стать невосприимчивым к определенному заболеванию несколькими способами. При некоторых заболеваниях, таких как корь и ветряная оспа, наличие болезни обычно приводит к пожизненному иммунитету к ней.Вакцинация — еще один способ стать невосприимчивым к болезни. Оба способа получения иммунитета — от болезни или вакцинации — являются примерами активного иммунитета . Активный иммунитет возникает, когда иммунная система человека вырабатывает антитела и активирует другие иммунные клетки против определенных патогенов. Если человек снова столкнется с этим патогеном, устойчивые иммунные клетки, специфичные для него, уже будут подготовлены к борьбе с ним.
Другой тип иммунитета, называемый пассивным иммунитетом, возникает, когда человеку вводят чужие антитела.Когда эти антитела вводятся в организм человека, «заимствованные» антитела помогают предотвратить определенные инфекционные заболевания или бороться с ними. Защита, обеспечиваемая пассивной иммунизацией, недолговечна, обычно длится всего несколько недель или месяцев. Но помогает сразу защитить.
Пассивный иммунитет: естественный против искусственногоNatural Младенцы пользуются пассивным иммунитетом, приобретаемым, когда антитела их матери и белые клетки, борющиеся с патогенами, проходят через плаценту и достигают развивающихся детей, особенно в третьем триместре.Вещество под названием молозиво, которое младенец получает во время кормления грудью в первые дни после рождения и до того, как мать начинает производить «настоящее» грудное молоко, богато антителами и обеспечивает защиту младенца. Грудное молоко, хотя и не так богато защитными компонентами, как молозиво, также содержит антитела, которые передаются грудному ребенку. Однако такая защита, обеспечиваемая матерью, недолговечна. В течение первых нескольких месяцев жизни уровни материнских антител у младенца падают, а защита ослабевает примерно к шести месяцам жизни.
Искусственный Пассивный иммунитет можно вызвать искусственно, когда антитела вводятся в качестве лекарства неиммунному человеку. Эти антитела могут происходить из объединенных и очищенных продуктов крови людей с иммунитетом или от животных, не относящихся к человеку с иммунитетом, таких как лошади. Фактически, самые первые содержащие антитела препараты, используемые против инфекционных заболеваний, были получены от лошадей, овец и кроликов.
История пассивной иммунизацииАнтитела были впервые использованы для лечения болезней в конце 19, и веках, когда только зарождалась область бактериологии.Первая история успеха связана с дифтерией, опасным заболеванием, которое поражает горло и дыхательные пути тех, кто им заразился.
В 1890 году Шибасабуро Китасато (1852-1931) и Эмиль фон Беринг (1854-1917) иммунизировали морских свинок против дифтерии с помощью термически обработанных продуктов крови от животных, которые выздоровели от болезни. Препараты содержали антитела к токсину дифтерии, которые защищали морских свинок, если вскоре после этого они подвергались смертельным дозам дифтерийных бактерий и их токсина.Затем ученые показали, что можно вылечить дифтерию у животного, введя ему продукты крови иммунизированного животного. Вскоре они перешли к тестированию подхода на людях и смогли показать, что продукты крови иммунизированных животных могут лечить дифтерию у людей. Вещество, содержащее антитела, полученное из крови, называлось дифтерийным антитоксином, и с 1895 года государственные советы здравоохранения и коммерческие предприятия начали его производство и распространение. Китасато, фон Беринг и другие ученые затем посвятили свое внимание лечению столбняка, оспы и бубонной чумы продуктами крови, содержащими антитела.
Использование антител к для лечения специфических заболеваний привело к попыткам разработать иммунизаций против заболеваний. Джозеф Стоукс-младший, доктор медицины, и Джон Ниф, доктор медицины, провели испытания в Университете Пенсильвании по контракту с ВМС США во время Второй мировой войны, чтобы исследовать использование препаратов антител для предотвращения инфекционного гепатита (то, что мы теперь называем гепатитом А). Их новаторская работа, наряду с достижениями в разделении компонентов крови, содержащих антитела, привела к многочисленным исследованиям эффективности препаратов антител для иммунизации против кори и инфекционного гепатита.
До того, как вакцина от полиомиелита была лицензирована, чиновники здравоохранения надеялись на использование гамма-глобулина (продукта крови, содержащего антитела) для предотвращения болезни. Уильям М. Хэммон, доктор медицины из Высшей школы общественного здравоохранения Университета Питтсбурга, опираясь на работу Стокса и Ниф, провел важные испытания для проверки этой идеи в 1951-52 гг. Он показал, что введение гамма-глобулина, содержащего известные антитела к полиовирусу, может предотвратить случаи паралитического полиомиелита. Однако ограниченная доступность гамма-глобулина и краткосрочная защита, которую он обеспечивает, означают, что лечение не может использоваться в широком масштабе.Лицензирование инактивированной вакцины против полиомиелита Солка в 1955 г. сделало ненужным использование гамма-глобулина для иммунизации против полиовируса.
Пассивная иммунизация сегодняСегодня пациентов можно лечить антителами, когда они болеют дифтерией или цитомегаловирусом. Или лечение антителами может использоваться в качестве профилактической меры после контакта с патогеном, чтобы попытаться остановить развитие болезни (например, респираторно-синцитиального вируса [RSV], кори, столбняка, гепатита A, гепатита B, бешенства или ветряной оспы).Лечение антителами нельзя использовать в обычных случаях этих заболеваний, но оно может быть полезным для людей с высоким риском, таких как люди с недостаточностью иммунной системы.
Преимущества и недостатки пассивной иммунизацииВакцинам обычно требуется время (недели или месяцы) для выработки защитного иммунитета у человека, и для достижения оптимальной защиты может потребоваться несколько доз в течение определенного периода времени. Однако пассивная иммунизация имеет преимущество в том, что она действует быстро, вызывая иммунный ответ в течение нескольких часов или дней, быстрее, чем вакцина.Кроме того, пассивная иммунизация может преодолеть недостаточную иммунную систему, что особенно полезно для тех, кто не реагирует на иммунизацию.
Однако антителаимеют определенные недостатки. Во-первых, производство антител может быть трудным и дорогостоящим. Хотя новые методы могут помочь производить антитела в лаборатории, в большинстве случаев антитела к инфекционным заболеваниям необходимо собирать из крови сотен или тысяч людей-доноров. Или они должны быть получены из крови животных с иммунитетом (например, с антителами, которые нейтрализуют змеиный яд).В случае антител, полученных от животных, у реципиента могут развиться серьезные аллергические реакции. Другой недостаток заключается в том, что многие виды лечения антителами необходимо вводить внутривенно, что является более трудоемкой и потенциально сложной процедурой, чем инъекция вакцины. Наконец, иммунитет, полученный при пассивной иммунизации, недолговечен: он не приводит к образованию долговременных иммунных клеток памяти.
В некоторых случаях пассивный и активный иммунитет могут использоваться вместе.Например, человек, укушенный бешеным животным, может получить антитела против бешенства (пассивная иммунизация для создания немедленного ответа) и вакцину против бешенства (активный иммунитет, вызывающий длительный ответ на этот медленно воспроизводящийся вирус).
Тенденции будущегоМоноклональные антитела Технологии все чаще используются для создания моноклональных антител (MAb) — «моно» означает, что они представляют собой чистые антитела одного типа, нацеленные на один сайт патогена, и «клональные», потому что они производятся из единственной родительской клетки.Эти антитела имеют широкое потенциальное применение при инфекционных заболеваниях и других типах заболеваний.
Моноклональные антитела были впервые созданы исследователями Цезаром Мильштейном, PhD (1927-2002), и Georges Kohler, PhD (1946-1995), которые объединили короткоживущие продуцирующие антитела клетки селезенки мыши (которые подвергались воздействию определенного антигена) с долгоживущими опухолевыми клетками мыши. Объединенные клетки продуцировали антитела к целевому антигену. Мильштейн и Колер получили Нобелевскую премию по физиологии и медицине за свое открытие в 1984 году.
На сегодняшний день коммерчески доступно только одно средство для лечения MAb для профилактики инфекционного заболевания. Это препарат MAb для профилактики тяжелого заболевания, вызываемого RSV, у младенцев из группы высокого риска. Врачи также все чаще используют МА для борьбы с неинфекционными заболеваниями, такими как определенные типы рака, рассеянный склероз, ревматоидный артрит, болезнь Крона и сердечно-сосудистые заболевания.
Ученые исследуют другие новые технологии производства антител в лаборатории, такие как рекомбинантные системы с использованием дрожжевых клеток или вирусов, а также системы, объединяющие человеческие клетки и мышиные клетки, или человеческую ДНК и мышиную ДНК.
Угрозы биотеррора В случае преднамеренного высвобождения инфекционного биологического агента эксперты по биобезопасности предположили, что пассивная иммунизация может сыграть роль в реагировании на чрезвычайные ситуации. Преимущество использования антител вместо вакцин для ответа на событие биотеррора состоит в том, что антитела обеспечивают немедленную защиту, тогда как защитный ответ, вызванный вакциной, не является мгновенным и в некоторых случаях может зависеть от бустерной дозы, введенной позже.
Кандидатами на возможное применение пассивной иммунизации являются ботулинический токсин, туляремия, сибирская язва и чума.Для большинства этих мишеней были проведены исследования только на животных, поэтому использование пассивной иммунизации в потенциальных биотеррористических событиях все еще находится на экспериментальной стадии.
СводкаАнтитела были одними из первых инструментов, используемых против конкретных инфекционных заболеваний. По мере того как стали широко использоваться антибиотики и были разработаны вакцины, пассивная иммунизация стала менее распространенной. Однако даже сегодня антитела играют роль против инфекционных заболеваний, когда врачи используют антитела для достижения пассивного иммунитета и лечения некоторых заболеваний у пациентов.Ученые исследуют новые области применения пассивной иммунизации и лечения антителами, а также новые и более эффективные методы создания антител.
ИсточникиCasadevall, A. Пассивное введение антител (немедленный иммунитет) как специфическая защита от биологического оружия. Emerg Infect Dis [серийный номер онлайн], август 2002 г .; 8. Дата обращения 10.01.2018.
Центры по контролю и профилактике заболеваний. Типы иммунитета. Дата обращения 10.01.2018.
Келлер М.А., Штием Э.Р.Пассивный иммунитет в профилактике и лечении инфекционных заболеваний. Обзоры клинической микробиологии. Октябрь 2000 г., стр. 602-614, т. 13, вып. 4.
Feign, R.D., Cherry, J.D., Demmler, G.J., Kaplan, S.L. Учебник детских инфекционных болезней. 5 -е изд., Т. 2. Филадельфия: Сондерс, 2004.
Kaempffert, W. Теперь обнаружена причина армейской желтухи и указаны средства борьбы с ней. New York Times, 21 января 1945 г.Дата обращения 10.01.2018.
Кемпфферт, В. Профилактика кори: Гамма-глобулин, выделенный из крови, уничтожает микроб. New York Times , 14 мая 1944 г. Дата обращения 10.01.2018.
Ринальдо младший, C.R. Пассивная иммунизация против полиомиелита. Полевые испытания гамма-глобулина Хаммона, 1951-1953 гг. Am J Pub Health. Май 2005 г .; 95 (5): 790-799. Дата обращения 10.01.2018.
Информационная страницаSynagis (Palivizumab). Дата обращения 10.01.2018.
Последнее обновление 10.01.2018
ИММУНОЛОГИЯ
ИММУНОЛОГИЯ ИММУНОЛОГИЯ .(Если дополнительные материалы требуется, я добавил несколько дополнительных чтение)· Генетически предопределенный человек устойчивость к определенным заболеваниям называется врожденной
сопротивления.
· Индивидуальное сопротивление нарушено по полу, возрасту, состоянию питания и общему состоянию здоровья.Иммунитет
· Иммунитет — это способность тело, чтобы специально противодействовать чужеродным организмам или веществам
названы антигенами.
· Иммунитет в результате производства специализированных лимфоцитов и антител.Типы приобретенного иммунитета
· Приобретенный иммунитет — специфическая резистентность к инфекции, развившейся при жизни
человека.
· Человек может развить или приобрести иммунитет после рождения.I. Естественный иммунитет
· Иммунитет в результате инфекции. называется естественным активным иммунитетом ; Этот тип
иммунитет может быть длительным.
· Антитела, переданные от матери плоду (трансплацентарный перенос) или новорожденному в
молозиво дает естественных приобретенных пассивный иммунитет у новорожденного; Этот тип
иммунитет может длиться до нескольких месяцев.II. Искусственно приобретенный иммунитет
· Иммунитет в результате вакцинации называется искусственно приобретенный активный иммунитет и может быть
долговечный.
· Вакцины можно приготовить из ослабленных, инактивированные или убитые микроорганизмы и анатоксины.
· Искусственно приобретенный пассив иммунитет относится к гуморальным антителам, полученным путем инъекции; это
иммунитет может длиться несколько недель.
· Антитела, произведенные человеком или другими млекопитающее может быть введено восприимчивому человеку.
· Сыворотка, содержащая антитела часто называют антисывороткой .
· Когда сыворотка разделена гелем электрофорезом антитела обнаружены в гамма-фракции
сыворотки и называются иммуноглобулином сыворотки, или гамма-глобулин .III. Двойственность иммунной системы
· Гуморальный иммунитет находится в жидкостях организма.
· Клеточный иммунитет обусловлен определенные типы лимфоцитов.Гуморальная (опосредованная антителами) иммунная система
· Гуморальная иммунная система включает антитела, продуцируемые В-клетками в ответ на специфический
антиген.
· Антитела в первую очередь защищают от бактерии, вирусы и токсины в плазме крови и лимфе.Клеточно-опосредованная иммунная система
· клеточно-опосредованная иммунная система зависит от Т-клеток и не включает антитела
производства.
· Клеточный иммунитет — это прежде всего реакция на внутриклеточные бактерии и вирусы, многоклеточные
паразитов, трансплантированная ткань и раковые клетки.IV. Антигены и антитела
Природа антигенов
· Антиген (или иммуноген) — это химическое вещество, которое заставляет организм производить специфические
антитела или сенсибилизированные Т-клетки.
· Как правило, антигены чужеродные. вещества; они не являются частью химии тела.
· Большинство антигенов входят в состав вторгающиеся микробы: белки, нуклеопротеины, липопротеины,
гликопротеинов или больших полисахаридов с молекулярной вес больше 6000.
· Антитела образуются против специфических области на поверхности антигена, называемые эпитопами , или
антигенные детерминанты .
· Большинство антигенов имеют много разных детерминанты.
· Гаптен — низкомолекулярный вещество, которое не может вызвать образование антител
, если не сочетается с молекулой-носителем.IV. Природа антител
· Антитело или иммуноглобулин, белок, продуцируемый В-клетками в ответ на присутствие
антигена и способны специфически сочетаться с этим антигеном.
· Антитело имеет не менее двух одинаковых антигенсвязывающие (валентные) сайты.В. Антитело Структура
· Единичная единица бивалентного антитела это мономер.
· Большинство мономеров антител состоят четырех полипептидных цепей. Два — тяжелых цепей , а два —
представляют собой легких цепей.
· В каждой цепочке есть переменная (V) область , где происходит связывание антигена, и константа (C)
регион , который служит основанием для различения классы антител.
· Мономер антитела имеет Y- или Т-образную форму; переменные области образуют наконечники, а постоянная
области образуют основание и область Fc (стебель).
· Fc-регион может присоединяться к хосту ячейка или комплемент.VI. Иммуноглобулин Классы
· Наиболее распространены антитела IgG. в сыворотке; они обеспечивают естественным образом приобретенные пассивные
иммунитет, нейтрализует бактериальные токсины, участвует в фиксации комплемента и усилить
фагоцитоз.
· антитела IgM состоят из пяти мономеры , удерживаемые соединительной цепью ; они участвуют в
агглютинация и фиксация комплемента.
· Сывороточные IgA-антитела — мономеров ; секреторные антитела IgA представляют собой димеры , которые защищают слизистую оболочку
поверхности от вторжения патогенов.
· Антитела IgD являются рецепторами антигенов. на В-клетки.
· IgE-антитела связываются с тучными клетками. и базофилы и участвуют в аллергических реакциях.VI. В-клетки и гуморальный иммунитет
· Гуморальный иммунитет включает антитела которые производятся В-клетками.
· Стволовые клетки костного мозга дают начало к В-клеткам.
· Зрелые В-клетки мигрируют в лимфоидные органы.
· Зрелая В-клетка распознает антиген с рецепторами антигенов.Апоптоз
· Ненужные лимфоциты подвергаются апоптозу или запрограммированной гибели клеток и
уничтожено фагоцитами.VII. Активация продуцирующих антитела клеток клональными Подборка
· По клональному отбору теории, ранее существовавшие B-клетки активируются, когда Антиген
реагирует с рецепторами антигена на своей поверхности.
· События рекомбинации в гене кодирование вариабельной области приводит к способности производить
огромное количество различных молекул антител.
· Активированная В-клетка производит клон плазматических клеток и клеток памяти .
· Плазматические клетки секретируют антитела. Клетки памяти распознают патогены из предыдущих встреч.
· Т-клетки и В-клетки, которые реагируют аутоантигены разрушаются в процессе внутриутробного развития плода; это
назвал клональной делецией.VIII. Связывание антиген-антитело и его результаты
· Антиген связывается с антигенсвязывающим сайт (вариабельная область) антитела с образованием антигена —
комплекс антител.
· антитела IgG инактивируют вирусов и нейтрализуют бактериальных токсинов.
· Агглютинация клеточных антигенов возникает, когда антитело IgG или IgM сочетается с двумя
ячеек.
· Комплексы антиген-антитело с участием антитела IgG и IgM могут фиксировать t комплемента, в результате чего
при лизисе бактериальной (антигенной) клетки.IX. Иммунологические Память
· Количество антител в сыворотке называется титром антител.
· Ответ тела на Первый контакт с антигеном называется первичным ответом . Это
характеризуется появлением IgM за ним следует IgG.
· Последующий контакт с тем же антиген приводит к очень высокому титру антител и называется
вторичный , анамнестический или память ответ . Антитела — это в первую очередь IgG.Х.Т-клетки и клеточно-опосредованный иммунитет
· Клеточный иммунитет включает специализированные лимфоциты, в первую очередь Т-клетки, которые реагируют на
внутриклеточных антигенов.
· Химические посланники иммунных клеток: Цитокины
· Клетки иммунной системы общаются друг с другом с помощью химикатов, называемых
цитокина.Интерлейкины (IL) — это цитокины, которые служат коммуникаторами между лейкоциты.
Хемокины заставляют лейкоциты перемещаться к месту инфекции.
Цитокины могут быть полезны при лечении опухолей.Клеточные компоненты иммунитета
· Т-клетки отвечают за клеточно-опосредованные иммунитет.
· После дифференцировки в тимусе железы, Т-клетки мигрируют в лимфоидную ткань.
· Т-клетки дифференцируются в эффекторные Т-клетки, когда они стимулируются антигеном.
· Некоторые эффекторные Т-клетки становятся памятью клетки.Типы Т-клеток
· Т-клетки классифицируются по к их функциям и рецепторам на клеточной поверхности, называемым CD.
· Антиген должен обрабатываться антигенпрезентирующая клетка (APC) и расположена на
поверхность БТР.
· Майор комплекс гистосовместимости (MHC) состоит из белков клеточной поверхности которые уникальны
каждому человеку и предоставить собственные молекулы.
· Т-клетка распознает антигены в связь с MHC на APC, в результате чего APC высвобождает
Ил-1.
· После привязки к APC, помощник Клетки T (TH) или CD4 секретируют IL-2 для активации других клеток TH
, специфичный для этого антигена.
· Цитотоксический Клетки T (TC) или CD8 выделяют перфорин для лизиса клеток, несущих мишень. антиген и
MHC.
· гиперчувствительность замедленного типа T (TD) клетки связаны с определенными типами аллергических реакций
и отторжение трансплантата.
· Появляются глушители T (TS). для регулирования иммунного ответа.Неспецифические клеточные компоненты
· Стимулируемые макрофаги активируя антиген или цитокины активируются к
обладают повышенной фагоцитарной способностью.
· Естественные киллеры (NK) клеток лизировать инфицированные вирусом и опухолевые клетки. Они не Т-лимфоциты и не являются
антигенно специфичен.Взаимосвязь клеточно-опосредованного и Гуморальный Иммунитет
· TH-клетки активируют В-клетки для производства антитела против Т-зависимых антигенов.
· Антигены, непосредственно активирующие В-клетки называются Т-независимыми антигенами.
· В антителозависимой клеточно-опосредованной цитотоксичность (ADCC), NK-клетки, макрофаги и другие
лейкоцитов лизируют клетки, покрытые антителами.
· ADCCИнфекционный иммунитет в сравнении с иммунитетом, приобретенным вакциной в модели SIRWS
Abstract
В некоторых системах болезни процесс ослабления иммунитета может быть незаметным, включая сложную взаимосвязь между продолжительностью иммунитета, приобретенного либо в результате естественной инфекции, либо вакцинация — и последующее повышение иммунитета за счет бессимптомного повторного заражения.Мы представляем и анализируем модель передачи инфекционных заболеваний, в которой различают первичные и вторичные инфекции, чтобы изучить взаимосвязь между инфекцией и иммунитетом. Кроме того, мы позволяем длительности иммунитета, приобретенного инфекцией, отличаться от иммунитета, приобретенного вакциной, чтобы изучить влияние на долгосрочные модели заболевания и распространенность инфекции в присутствии иммуностимулятора.
Наша модель демонстрирует, что вакцинация может вызывать циклическое поведение, а способность вакцинации снижать количество первичных инфекций может не приводить к снижению передачи.Там, где усиление иммунитета, полученного с помощью вакцины, задерживает первичную инфекцию, движущей силой передачи в основном остаются первичные инфекции. Напротив, если иммуностимуляция обходит первичную инфекцию, вторичные инфекции становятся основным фактором передачи при достаточно длительном иммунитете.
Наши результаты показывают, что эпидемиологические модели инфекционного заболевания могут значительно измениться, если продолжительность иммунитета, приобретенного с помощью вакцины, отличается от продолжительности иммунитета, приобретенного инфекцией.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Гоэль С., Палмквист М., Молл К., Джоаннин Н., Лара П., Ахури Р.Р. и др. RIFIN — это адгезины, вызывающие тяжелую малярию Plasmodium falciparum . Нат Мед (2015) 21: 314–7. DOI: 10,1038 / нм.3812
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Нианг М., Бей А.К., Маднани К.Г., Пелли С., Данква С., Канжи У. и др. STEVOR — это связывающий эритроциты белок Plasmodium falciparum , который опосредует инвазию и розетку мерозоитов. Клеточный микроб-хозяин (2014) 16: 81–93.doi: 10.1016 / j.chom.2014.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Роу Дж. А., Плесень Дж. М., Ньюболд К. И., Миллер Л. Х. П . falciparum розетение, опосредованное паразитарно-вариантным мембранным белком эритроцитов и рецептором комплемента 1. Nature (1997) 388: 292–5. doi: 10.1038 / 40888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Семблат Дж. П., Гумра А., Чайковский Д. М., Уоллис Р., Митчелл Д. А., Раза А. и др.Идентификация минимальной связывающей области Plasmodium falciparum IgM связывающего домена PfEMP1. Mol Biochem Parasitol (2015) 201: 76–82. doi: 10.1016 / j.molbiopara.2015.06.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Вальгрен М., Гоэль С., Ахури Р.Р. Варианты поверхностных антигенов Plasmodium falciparum и их роль в тяжелой форме малярии. Nat Rev Microbiol (2017) 15: 479–91. doi: 10.1038 / nrmicro.2017.47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Дэвид PH, Хоммель М., Миллер Л.Х., Удейня И.Дж., Олигино Л.Д. Секвестрация паразитов при малярии Plasmodium falciparum : селезенка и модуляция антител цитоадгезии инфицированных эритроцитов. Proc Natl Acad Sci USA (1983) 80: 5075–9. doi: 10.1073 / pnas.80.16.5075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Гумра А., Кхунра П., Атаиде Р., Раза А., Роджерсон С.Дж., Хиггинс М.К. и др. Иммунизация рекомбинантными доменами PfEMP1 выявляет функциональные антитела, ингибирующие розетку и индуцирующие фагоцитоз, к Plasmodium falciparum . PloS One (2011) 6: e16414. doi: 10.1371 / journal.pone.0016414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Гильотт М., Нато Ф., Жюльерат А., Хессель А., Маршан Ф., Левит-Бентли А. и др. Функциональный анализ моноклональных антител против адгезина Plasmodium falciparum PfEMP1-VarO. Малар Дж. (2016) 15:28. doi: 10.1186 / s12936-015-1016-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Чан Дж. А., Бойл М. Дж., Мур К. А., Рейлинг Л., Лин З, Хасанг В. и др. Антитела нацелены на поверхность эритроцитов, инфицированных Plasmodium falciparum , которые связаны с иммунитетом к тяжелой малярии у детей младшего возраста. J Infect Dis (2019) 219: 819–28. doi: 10.1093 / infdis / jiy580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Arora G, Hart GT, Manzella-Lapeira J, Doritchamou JY, Narum DL, Thomas LM, et al. NK-клетки подавляют рост Plasmodium falciparum в красных кровяных тельцах посредством антителозависимой клеточной цитотоксичности. Элиф (2018) 7: e53080. doi: 10.7554 / eLife.36806
CrossRef Полный текст | Google Scholar
30. Ларремор Д. Б., Сундарараман С. А., Лю В., Прото В. Р., пункт А, Лой Д. Е. и др. Происхождение обезьяньих паразитов генов вирулентности малярии человека. Нац Коммун (2015) 6: 8368. doi: 10.1038 / ncomms9368
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Olsen RW, Ecklu-Mensah G, Bengtsson A, Ofori MF, Kusi KA, Koram KA, et al. Приобретение IgG к ICAM-1-связывающим комаинам DBLbeta в семействе антигенов мембранного белка 1 эритроцитов Plasmodium falciparum варьирует между группами A, B и C. Infect Immun (2019) 87: e00224-19. doi: 10.1128 / IAI.00224-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Раск Т.С., Хансен Д.А., Теандер Т.Г., Горм Педерсен А., Лавстсен Т. Plasmodium falciparum разнообразие мембранного белка 1 эритроцитов в семи геномах — разделяй и властвуй. PloS Comput Biol (2010) 6: e1000933. doi: 10.1371 / journal.pcbi.1000933
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Аврил М., Бенджамин М., Долс М.М., Смит Дж. Д. Взаимодействие Plasmodium falciparum и тромбина в разрушении эндотелиального барьера головного мозга. Sci Rep (2019) 9: 13142. doi: 10.1038 / s41598-019-49530-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Тернер Г.Д., Моррисон Х., Джонс М., Дэвис Т.М., Луарисуван С., Були И.Д. и др. Иммуногистохимическое исследование патологии фатальной малярии. Доказательства широко распространенной активации эндотелия и потенциальной роли молекулы межклеточной адгезии-1 в церебральной секвестрации. Am J Pathol (1994) 145: 1057–69.
PubMed Аннотация | Google Scholar
35. Кесслер А., Данква С., Бернабеу М., Харава В., Данцигер С.А., Даффи Ф. и др. Связывание EPCR-связывающего PfEMP1 с набуханием мозга при детской церебральной малярии. Клеточный микроб-хозяин (2017) 22: 601–614 e5. doi: 10.1016 / j.chom.2017.09.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Lavstsen T, Turner L, Saguti F, Magistrado P, Rask TS, Jespersen JS, et al. Plasmodium falciparum Кассеты 8 и 13 домена мембранного белка 1 эритроцитов связаны с тяжелой формой малярии у детей. Proc Natl Acad Sci USA (2012) 109: E1791–800. DOI: 10.1073 / pnas.1120455109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Каной Б.Н., Нагаока Х., Морита М., Уайт М.Т., Palacpac NMQ, Ntege EH и др. Комплексный анализ ответов антител на Plasmodium falciparum доменов мембранного белка 1 эритроцитов. Vaccine (2018) 36: 6826–33. doi: 10.1016 / j.vaccine.2018.08.058
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Даффи М.Ф., Новиянти Р., Цубои Т., Фенг З.П., Трианти Л., Себаянг Б.Ф. и др. Различия в PfEMP1, распознаваемых антителами, от пациентов с неосложненной или тяжелой малярией. Малар Дж. (2016) 15: 258. doi: 10.1186 / s12936-016-1296-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Tessema SK, Nakajima R, Jasinskas A, Monk SL, Lekieffre L, Lin E, et al.Защитный иммунитет против тяжелой малярии у детей связан с ограниченным набором антител к консервативным вариантам PfEMP1. Клеточный микроб-хозяин (2019) 26: 579–590 e5. doi: 10.1016 / j.chom.2019.10.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Травассос М.А., Ниангали А., Бейли Дж. А., Уаттара А., Кулибали Д., Лайк К. Э. и др. У детей с церебральной малярией или тяжелой малярийной анемией отсутствует иммунитет к различным субпопуляциям поверхностных антигенов. Sci Rep (2018) 8: 6281. doi: 10.1038 / s41598-018-24462-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Tuju J, Mackinnon MJ, Abdi AI, Karanja H, Musyoki JN, Warimwe GM, et al. Антигенная картография иммунных ответов на мембранный белок 1 эритроцитов Plasmodium falciparum (PfEMP1). PloS Pathog (2019) 15: e1007870. doi: 10.1371 / journal.ppat.1007870
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Jespersen JS, Wang CW, Mkumbaye SI, Minja DT, Petersen B, Turner L и др. Гены Plasmodium falciparum var , экспрессируемые у детей с тяжелой формой малярии, кодируют домены CIDRalpha1. EMBO Mol Med (2016) 8: 839–50. doi: 10.15252 / emmm.201606188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Mkumbaye SI, Wang CW, Lyimo E, Jespersen JS, Manjurano A, Mosha J, et al. Тяжесть инфекции Plasmodium falciparum связана с уровнями транскрипта генов var , кодирующих связывание с рецептором эндотелиального протеина C P.falciparum мембранный белок эритроцитов 1. Infect Immun (2017) 85: e00841-16. doi: 10.1128 / IAI.00841-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Rambhatla JS, Turner L, Manning L, Laman M, Davis TME, Beeson JG, et al. Приобретение антител против эндотелиального белка С рецептор-связывающих доменов Plasmodium falciparum мембранного белка 1 эритроцитов у детей с тяжелой формой малярии. J Infect Dis (2019) 219: 808–18.doi: 10.1093 / infdis / jiy564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Обенг-Аджеи Н., Ларремор Д. Б., Тернер Л., Онгойба А., Ли С., Думбо С. и др. Продольный анализ естественно приобретенных антител к варианту домена CIDR PfEMP1 выявляет ассоциации с защитой от малярии. JCI Insight (2020) 5: e137262. doi: 10.1172 / jci.insight.137262
CrossRef Полный текст | Google Scholar
47. Turner L, Lavstsen T, Mmbando BP, Wang CW, Magistrado PA, Vestergaard LS, et al.Антитела IgG к эндотелиальному протеину С, связывающему рецептор богатых цистеином междоменных доменов мембранного белка 1 эритроцитов Plasmodium falciparum , приобретаются в раннем возрасте у людей, подвергшихся воздействию малярии. Infect Immun (2015) 83: 3096–103. doi: 10.1128 / IAI.00271-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Лау С.К., Тернер Л., Джесперсен Дж.С., Лоу Э.Д., Петерсен Б., Ван К.В. и др. Структурная консервация, несмотря на огромное разнообразие последовательностей, позволяет связывать EPCR семейством PfEMP1, участвующим в тяжелой детской малярии. Клеточный микроб-хозяин (2015) 17: 118–29. doi: 10.1016 / j.chom.2014.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Fernandez V, Hommel M, Chen Q, Hagblom P, Wahlgren M. Небольшие клонально вариантные антигены, экспрессируемые на поверхности эритроцита, инфицированного Plasmodium falciparum , кодируются семейством гена RIF и являются мишенью иммунных ответов человека. J Exp Med (1999) 190: 1393–404. doi: 10.1084 / jem.190.10.1393
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Сайто Ф., Хираясу К., Сато Т., Ван Ч. У., Лусингу Дж., Аримори Т. и др. Исправление: Иммунное уклонение от Plasmodium falciparum с помощью RIFIN через ингибирующие рецепторы. Природа (2018) 554: 554. DOI: 10.1038 / nature25498
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Meyaard L, Adema GJ, Chang C, Woollatt E, Sutherland GR, Lanier LL, et al. LAIR-1, новый рецептор-ингибитор, экспрессируемый на мононуклеарных лейкоцитах человека. Иммунитет (1997) 7: 283–90.DOI: 10.1016 / S1074-7613 (00) 80530-0
PubMed Реферат | CrossRef Полный текст | Google Scholar
52. Наджи А., Менье С., Моранди Ф., Агауг С., Маки Дж., Ферретти Е. и др. Связывание HLA-G с ITIM-несущим Ig-подобным рецептором транскрипта 2 подавляет В-клеточные ответы. J Immunol (2014) 192: 1536–46. doi: 10.4049 / jimmunol.1300438
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. van der Vuurst de Vries AR, Clevers H, Logtenberg T, Meyaard L.Связанный с лейкоцитами иммуноглобулиноподобный рецептор-1 (LAIR-1) дифференциально экспрессируется во время дифференцировки В-клеток человека и ингибирует передачу сигналов, опосредованную рецептором В-клеток. Eur J Immunol (1999) 29: 3160–7. doi: 10.1002 / (SICI) 1521-4141 (199910) 29:10 <3160 :: AID-IMMU3160> 3.0.CO; 2-S
PubMed Реферат | CrossRef Полный текст | Google Scholar
54. Харрисон Т.Э., Морч А.М., Фелс Дж. Х., Сакогучи А., Рид А. Дж., Аразе Н. и др. Структурная основа RIFIN-опосредованной активации LILRB1 при малярии. Природа (2020). doi: 10.1038 / s41586-020-2530-3
CrossRef Полный текст | Google Scholar
55. Сайто Ф., Хираясу К., Сато Т., Ван Ч.В., Лусингу Дж., Аримори Т. и др. Иммунное уклонение от Plasmodium falciparum под действием RIFIN через ингибирующие рецепторы. Nature (2017) 552: 101–5. DOI: 10.1038 / nature24994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Пипер К., Тан Дж., Пикколи Л., Фольерини М., Барбьери С., Чен Й и др.Общественные антитела к антигенам малярии, генерируемые двумя способами встраивания LAIR1. Nature (2017) 548: 597–601. DOI: 10.1038 / nature23670
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Тан Дж., Пипер К., Пикколи Л., Абди А., Перес М. Ф., Гейгер Р. и др. Вставка LAIR1 генерирует широко реактивные антитела против вариантных антигенов малярии. Nature (2016) 529: 105–9. doi: 10.1038 / nature16450
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Чжоу А.Е., Берри А.А., Бейли Дж.А., Пайк А., Дара А., Агравал С. и др. Антитела к пептидам в полуконсервированных доменах RIFIN и STEVOR коррелируют с воздействием малярии. мСфера (2019) 4: e00097-19. DOI: 10.1128 / mSphere.00097-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Петтер М., Хеггстром М., Хаттаб А., Фернандес В., Клинкерт М.К., Уолгрен М. Вариантные белки семейства Plasmodium falciparum RIFIN демонстрируют различные субклеточные локализации и паттерны экспрессии в процессе развития. Mol Biochem Parasitol (2007) 156: 51–61. doi: 10.1016 / j.molbiopara.2007.07.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Чан Дж. А., Хауэлл К. Б., Рейлинг Л., Атаиде Р., Макинтош К. Л., Фаукс Ф. Дж. И др. Мишени антител против эритроцитов, инфицированных Plasmodium falciparum , при иммунитете к малярии. Дж. Клин Инвест (2012) 122: 3227–38. doi: 10.1172 / JCI62182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61.Limpaiboon T, Shirley MW, Kemp DJ, Saul A. 7H8 / 6, многокопийный ДНК-зонд для различения изолятов Plasmodium falciparum . Mol Biochem Parasitol (1991) 47: 197–206. doi: 10.1016 / 0166-6851 (91)

 При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
 Основа такого разделения зависит от происхождения.
Основа такого разделения зависит от происхождения.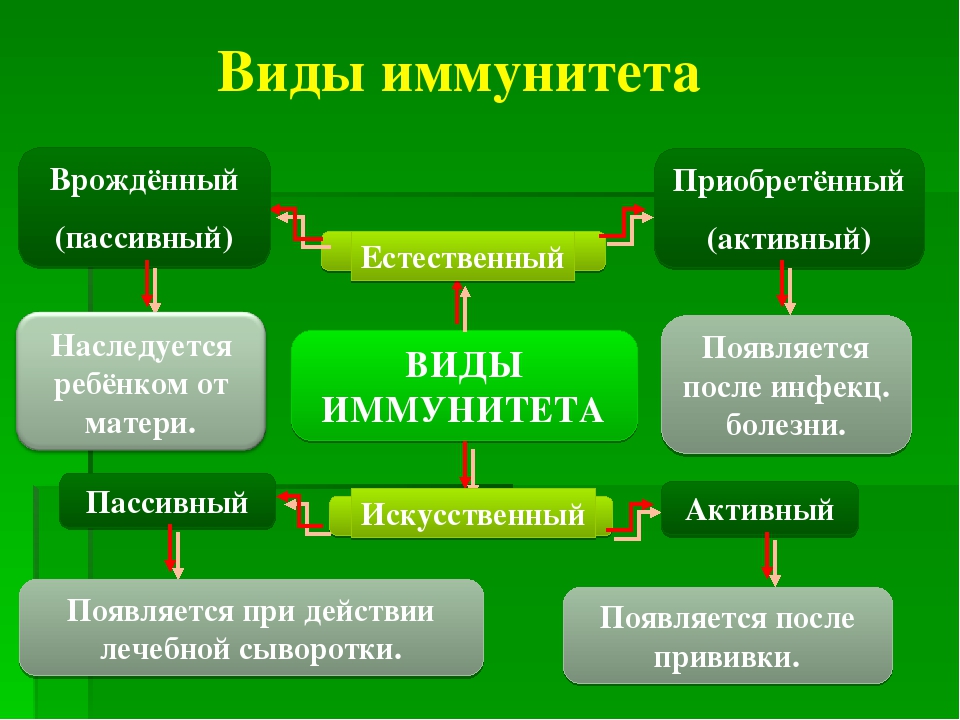



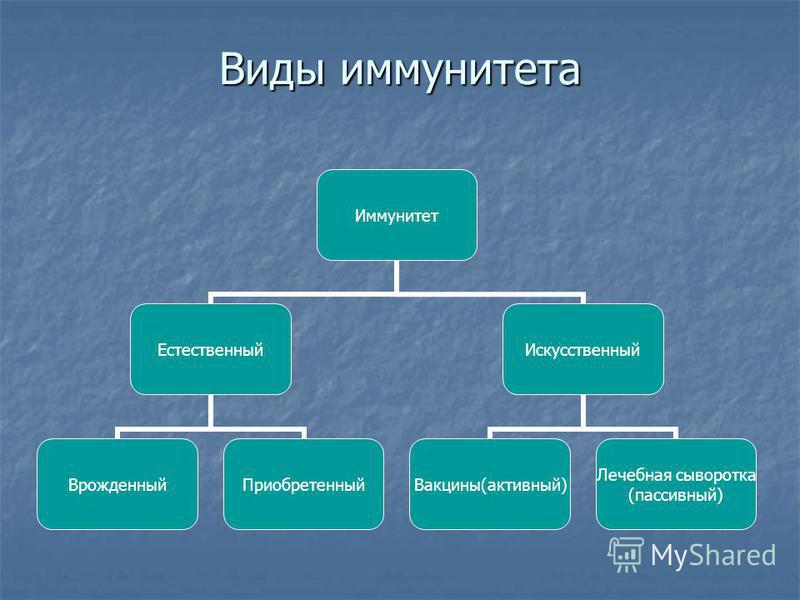 В: Плоткин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. Глава 71. Филадельфия, Пенсильвания: Elsevier Inc., 2008: 1573–1592.
В: Плоткин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. Глава 71. Филадельфия, Пенсильвания: Elsevier Inc., 2008: 1573–1592.