15 Основные понятия ядерной физики. Радиоактивность. Виды радиоактивного распада.
Ядерная физика — это раздел физики, в котором изучаются структура и свойства атомных ядер. Ядерная физика занимается также изучением взаимопревращения атомных ядер, совершающиеся как в результате радиоактивных распадов, так и в результате различных ядерных реакций. Основная ее задача связана с выяснением природы ядерных сил, воздействующих между нуклонами, и особенностей движения нуклонов в ядрах. Протоны и нейтроны — это основные элементарные частицы, из которых состоит ядро атома. Нуклон — это частица, обладающая двумя различными зарядовыми состояниями: протон и нейтрон. Заряд ядра — количество протонов в ядре, одинаковое с атомным номером элемента в периодической системе Менделеева. Изотопы — ядра, имеющие один и тот же заряд, если массовое число нуклонов различно.
Изобары — это ядра, обладающие одним и тем же числом нуклонов, при разных зарядах.
Нуклид — это конкретное ядро со значениями. Удельная энергия связи — это энергия связи, приходящаяся на один нуклон ядра. Ее определяют экспериментально. Основное состояние ядра — это состояние ядра, имеющего наименьшую возможную энергию, равную энергии связи. Возбужденное состояние ядра — это состояние ядра, имеющего энергию, большую энергии связи. Корпускулярно-волновой дуализм. Фотоэффект Свет имеет двойственную корпускулярно-волновую природу, т. е. корпускулярно-волновой дуализм: во-первых: он имеет волновые свойства; во-вторых: он выступает в роли потока частиц — фотонов. Электромагнитное излучение не только испускается квантами, но распространяется и поглощается в виде частиц (корпускул) электромагнитного поля — фотонов. Фотоны являются реально существующими частицами электромагнитного поля. Квантование — это метод отбора орбит электронов, соответствующих стационарным состояниям атома.
РАДИОАКТИВНОСТЬ
Радиоактивностью — называется способность атомного ядра самопроизвольно распадаться с испусканием частиц. Спонтанный распад изотопов ядер в условиях природной среды называют естественной радиоактивностью — это радиоактивность, которую можно наблюдать у существующих в природе неустойчивых изотопов. А в условиях лабораторий в результате деятельности человека – искусственной радиоактивностью — это радиоактивность изотопов, приобретенных в результате ядерных реакций. Радиоактивность сопровождается
превращением одного химического элемента в другой и всегда сопровождается выделением энергии. Для каждого радиоактивного элемента установлены количественные оценки. Так, вероятность распада одного атома в одну секунду характеризуется постоянной распада данного элемента, а время, за которое распадается половина радиоактивного образца, называется периодом полураспада.
Радиоактивный распад — это процесс, являющийся статическим, при котором ядра радиоактивного элемента распадаются независимо друг от друга. ВИДЫ РАДИОАКТИВНОГО РАСПАДА
Основными видами радиоактивного распада являются:
Альфа — распад
Альфа-частицы испускаются только тяжелыми ядрами, т.е. содержащими большое число протонов и нейтронов. Прочность тяжелых ядер мала. Для того, чтобы покинуть ядро, нуклон должен преодолеть ядерные силы, а для этого он должен обладать достаточной энергией. При объединении двух протонов и двух нейтронов в альфа-частицу ядерные силы в подобном сочетании являются наиболее крепкими, а связи с другими нуклонами слабее, поэтому альфа-частица способна «выйти» из ядра. Вылетевшая альфа-частица уносит положительный заряд в 2 единицы и массу в 4 единицы. В результате альфа-распада радиоактивный элемент превращается в другой элемент, порядковый номер которого на 2 единицы, а массовое число на 4 единицы, меньше.То ядро, которое распадается, называют материнским, а образовавшееся дочерним. Дочернее ядро оказывается обычно тоже радиоактивным и через некоторое время распадается. Процесс радиоактивного распада происходит до тех пор, пока не появится стабильное ядро, чаще всего ядро свинца или висмута.
Бета-распад
Явление бета-распада состоит в том, что ядра некоторых элементов самопроизвольно испускают электроны и элементарную частицу очень малой массы — антинейтрино. Так как электронов в ядрах нет, то появление бета-лучей из ядра атома можно объяснить способностью нейтронов ядра распадаться на протон, электрон и антинейтрино. Появившийся протон переходит во вновь образующееся ядро. Электрон, вылетающий из ядра, и является частицей бета-излучения. Такой процесс распада нейтронов характерен для ядер с большим количеством нейтронов. В результате бета-распада образуется новое ядро с таким же массовым числом, но с большим на единицу зарядом.
Гамма — распад — не существует. В процессе радиоактивного излучения ядра атомов могут испускать гамма-кванты. Испускание гамма-квантов не сопровождается распадом ядра атома. Гамма излучение зачастую сопровождает явления альфа- или бета-распада. При альфа- и бета-распаде новое возникшее ядро первоначально находится в возбужденном состоянии и , когда оно переходит в нормальное состояние, то испускает гамма-кванты. Так как радиоактивное излучение состоит из альфа-частиц, бета-частиц и гамма-квантов, то явление радиоактивности сопровождается потерей массы и энергии ядра, атома и вещества в целом.
γ-распад – испускание атомным ядром γ-квантов;
спонтанное деление – распад атомного ядра на два или три осколка сравнимой массы.
16 Химия —
это одна из отраслей естествознания, предметом изучения которой являются химические элементы (атомы), образуемые ими простые и сложные вещества (молекулы), их превращения и законы, которым подчиняются эти превращения.Химия — наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей в организме; почему раствор соли проводит электрический ток, а раствор сахара — нет; почему одни химические изменения происходят быстро, а другие — медленно.
Химия — Наука о составе, строении, изменениях и превращениях, а также об образовании новых простых и сложных веществ. Химию, говорит Энгельс, можно назвать наукой о качественных изменениях тел, происходящих под влиянием изменения количественного состава.
Химия.— греч. наука о разложении и составлении веществ, тел, об отыскании неразлагаемых стихий, основ.
Химию довольно произвольно делят на несколько разделов, которые нельзя четко отграничить ни от других областей химии, ни от других наук (физики, геологии, биологии). Неорганическая химия занимается изучением химической природы элементов и их соединений, за исключением большинства соединений углерода.
Органическая химия изучает соединения, состоящие в основном из углерода и водорода. Поскольку атомы углерода могут соединяться друг с другом с образованием колец и длинных цепочек, как линейных, так и разветвленных, таких соединений существует сотни тысяч. Из органических соединений состоят уголь и нефть, они составляют основу живых организмов. Химики-органики научились получать из угля, нефти, растительных материалов синтетические волокна, пестициды, красители, лекарства, пластики и множество других полезных вещей
Радиохимия — это наука о химическом воздействии высокоэнергетического излучения на вещества; она занимается также изучением поведения радиоактивных изотопов Физическая химия использует физические методы для изучения химических систем. Большое место в ней занимают вопросы энергетики химических процессов; соответствующий раздел химии называется химической термодинамикой. К важнейшим направлениям относятся химическая кинетика и строение молекул. Электрохимия изучает химические процессы, протекающие под действием электрического тока, а также способы получения электричества химическими методами. Среди других направлений следует отметить коллоидную химию (она занимается исследованием поведения дисперсных систем), химию поверхностных явлений, статистическую механику.
Аналитическая химия — старейшая область химии. Она занимается разложением сложных веществ на более простые, анализом самих веществ и их составляющих. Сегодня в ней широко используются сложное физическое оборудование и компьютеры, позволяющие автоматизировать рутинные процессы, сбор и обработку данных.
Биохимия изучает сложнейшие химические процессы, протекающие в живых организмах. Биохимик должен детально знать органическую химию, владеть многими химическими и физическими методами анализа. К биохимии примыкают биофизика и молекулярная биология.
Геохимия занимается исследованием химических процессов, протекающих в земной коре. Она изучает образование минералов, метаморфоз скальных пород, образование нефти, пересекается с органической химией и биохимией, а также физикой и физической химией.
Химический элемент – это простое вещество, состоящее из одинаковых атомов.
Природа разных химических элементов различна, так например, многие химические элементы содержатся в природе в чистом виде, некоторые из химических элементов можно вычленить из сложного вещества путем разложения, а можно и вовсе синтезировать новый химический элемент искусственным путем.
Атомы химических элементов – это своего рода строительный материал, из которого выстраиваются все окружающие нас с вами тела.
В природе существует около ста различных химических элементов. И именно эта сотня элементов является фундаментом всего, что нас окружает. Атомы могут соединяться в молекулы, совершенно разнообразными способами, которым нет числа.
Кроме всего прочего, каждый химический элемент имеет свое название. Все, наверное, слышали такие названия как: сера, водород, ртуть, мышьяк и другие. Это и есть названия химических элементов. Но помимо своих русскоязычных наименований химические элементы имеют еще и международные стандартные обозначения. Например, водород обозначается, как H, кислород – O и т.д.
Вещества чаще всего классифицируют по двум самым важным показателям — их строению и составу.
молекулярные и немолекулярные. Молекулярных веществ, т. е. веществ, состоящих из молекул, — подавляющее большинство. В немолекулярных веществах атомы сразу образуют макроскопические тела, не объединяясь перед этим в молекулы.
Для веществ немолекулярного строения характерны только эмпирические формулы, показывающие, какие атомы и в каком количестве содержатся в повторяющемся фрагменте. В нашем примере эмпирическая формула вещества — SiO2, и это ни что иное, как самый обыкновенный песок.
органические и неорганические. Слово органи́ческий происходит от слова организм, т. е. живой, живущий. И действительно, вся живая материя на Земле состоит из огромного разнообразия органических веществ. Несколько столетий назад считали, что органические вещества могут содержаться только в растениях и животных, однако сегодня мы встречаемся с ними и далеко за пределами живой природы: это пластмассы, пластики, клеи, краски, синтетические ткани и многие другие материалы.
Органические вещества обязаны своему существованию одному единственному элементу — углероду. В отличие от остальных элементов, именно углерод обладает удивительным свойством: его атомы способны соединяться непосредственно друг с другом, образуя всевозможные цепи и кольца.
углеродная цепьуглеродное кольцо
Вещества, основу которых составляют углеродные цепи и кольца, и называются органическими. Например, приведенная выше цепь может лечь в основу вот такой органической молекулы
Все остальные вещества, т. е. не содержащие углеродных цепей и колец, называются неорганическими. Однако, неправильно было бы думать, что они не могут входить в состав живых организмов. Так, вода — вещество, без которого жизнь вообще немыслима, является, очевидно, неорганическим. На схеме (рис. 2) видно, что неорганических веществ значительно меньше, чем органических: всего около 700 тысяч, при том, что они приходятся на долю всех остальных химических элементов. Неорганические вещества, в свою очередь, образуют две обширные группы: простые и сложные.
Простыми называются вещества, состоящие из атомов только одного элемента, например H2, O2, Fe, Au. Как правило, элемент и простое вещество, образованное им, имеют одно и то же название: водород, кислород, железо, золото. Простые вещества, а также соответствующие им химические элементы, делятся на два класса: металлы и неметаллы. Металлы отличаются от неметаллов хорошей тепло- и электропроводностью, ковкостью, характерным блеском (рис. 3) и рядом других свойств.
Сложными называются неорганические вещества, образованные атомами разных элементов. Сложные вещества, или, как их еще называют — химические соединения, — невероятно разнообразны по строению и свойствам. Они составляют основную часть неживой природы (рис. 4), хотя, как мы уже знаем, могут встречаться и в составе живых организмов.
studfiles.net
Радиоактивность и радиация
1. Что такое радиоактивность и радиация?
Явление радиоактивности было открыто в 1896 году французским ученым Анри Беккерелем. В настоящее время оно широко используется в науке, технике, медицине, промышленности. Радиактивные элементы естественного происхождения присутствуют повсюду в окружающей человека среде. В больших объемах образуются искусственные радионуклиды, главным образом в качестве побочного продукта на предприятиях оборонной промышленности и атомной энергетики. Попадая в окружающую среду, они оказывают воздействия на живые организмы, в чем и заключается их опасность. Для правильной оценки этой опасности необходимо четкое представление о масштабах загрязнения окружающей среды, о выгодах, которые приносят производства, основным или побочным продуктом которых являются радионуклиды, и потерях, связанных с отказом от этих производств, о реальных механизмах действия радиации, последствиях и существующих мерах защиты.
Радиоактивность — неустойчивость ядер некоторых атомов, проявляющаяся в их способности к самопроизвольным превращениям (распаду), сопровождающимся испусканием ионизирующего излучения или радиацией
2. Какая бывает радиация?
Различают несколько видов радиации.
Альфа-частицы
: относительно тяжелые, положительно заряженные частицы, представляющие собой ядра гелия.
Бета-частицы
— это просто электроны.
Гамма-излучение
имеет ту же электромагнитную природу, что и видимый свет, однако обладает гораздо большей проникающей способностью. 2 Нейтроны
— электрически нейтральные частицы, возникают главным образом непосредственно вблизи работающего атомного реактора, куда доступ, естественно, регламентирован.
Рентгеновское излучение
подобно гамма-излучению, но имеет меньшую энергию. Кстати, наше Солнце — один из естественных источников рентгеновского излучения, но земная атмосфера обеспечивает от него надежную защиту.
3. К чему может привести воздействие радиации на человека?
Воздействие радиации на человека называют облучением
. Основу этого воздействия составляет передача энергии радиации клеткам организма.
Облучение может вызвать нарушения обмена веществ, инфекционные осложнения, лейкоз и злокачественные опухоли, лучевое бесплодие, лучевую катаракту, лучевой ожог, лучевую болезнь.
Последствия облучения сильнее сказываются на делящихся клетках, и поэтому для детей облучение гораздо опаснее, чем для взрослых
Следует помнить, что гораздо больший РЕАЛЬНЫЙ ущерб здоровью людей приносят выбросы предприятий химической и сталелитейной промышленности, не говоря уже о том, что науке пока неизвестен механизм злокачественного перерождения тканей от внешних воздействий.
4. Как радиация может попасть в организм?
mirznanii.com
Ответы Mail.ru: что такое радиоактивность?
Радиоактивный элемент — химический элемент, все изотопы которого радиоактивны. На практике этим термином часто называют всякий элемент, в природной смеси которого присутствует хотя бы один радиоактивный изотоп, то есть если элемент проявляет радиоактивность в природе. Кроме того, радиоактивными оказываются все изотопы любого из синтезированных на сегодняшний день искусственных элементов.Радиоактивными элементами в строгом смысле являются все элементы, идущие в таблице Менделеева после свинца (включая висмут) , а также элементы технеций и прометий. Следующие элементы содержат в природных смесях хотя бы один радиоактивный изотоп: калий, кальций, ванадий, германий, селен, рубидий, цирконий, молибден, кадмий, индий, теллур, лантан, неодим, самарий, гадолиний, лютеций, гафний, вольфрам, рений, осмий, платина, висмут, торий, уран (в список не включены дочерние элементы из рядов урана и тория, такие как радий, радон и астат, а также образующиеся в атмосфере под действием космических лучей, такие как углерод-14).
Все элементы, идущие за ураном, называются трансурановыми элементами. Есть предположения, что некоторые далёкие трансурановые элементы могут быть не радиоактивными или, во всяком случае, иметь достаточно долгоживущие изотопы, чтобы присутствовать в природе.
Многие радиоактивные элементы имеют важное практическое значение. Уран и плутоний используют как делящийся материал в атомных реакторах и в ядерном оружии. Некоторые радиоактивные элементы применяют для изготовления атомных электрических батареек со сроком непрерывной работы до нескольких лет. Долгоживущие изотопы природных радиоактивных элементов используются в геохронологии.
Явление радиоактивности было открыто в 1896 году французским ученым Анри
Беккерелем. В настоящее время оно широко используется в науке, технике,
медицине, промышленности. Радиактивные элементы естественного происхождения
присутствуют повсюду в окружающей человека среде. В больших объемах
образуются искусственные радионуклиды, главным образом в качестве побочного
продукта на предприятиях оборонной промышленности и атомной энергетики.
Попадая в окружающую среду, они оказывают воздействия на живые организмы, в
чем и заключается их опасность. Для правильной оценки этой опасности
необходимо четкое представление о масштабах загрязнения окружающей среды, о
выгодах, которые приносят производства, основным или побочным продуктом
которых являются радионуклиды, и потерях, связанных с отказом от этих
производств, о реальных механизмах действия радиации, последствиях и
существующих мерах защиты.
Радиоактивность — неустойчивость ядер некоторых атомов, проявляющаяся в их
способности к самопроизвольным превращениям (распаду) , сопровождающимся
испусканием ионизирующего излучения или радиацией
|Радиация, или ионизирующее излучение — это частицы и гамма-кванты, |
|энергия которых достаточно велика, чтобы при воздействии на |
|вещество создавать ионы разных знаков. Радиацию нельзя вызвать с |
|помощью химических реакций. |
otvet.mail.ru
Радиоактивность
Содержание
Введение……………………………………………………………….….. 2
- Радиоактивность……………………………………………….…… 3
Типы радиоактивного распада и радиоактивного излучения…… 3
Закон радиоактивного распада……………………………………. 4
- Методики анализа, основанные на измерении радиоактивности .6
Использование естественной радиоактивности в анализе………. 6
Активационный анализ…………………………………………….. 6
Метод изотропного разбавления…………………………..………7
Радиометрическое титрование…………………………………….. 7
- Практическое использование радионуклидов…………………… 9
- Список использованных источников…………………………….10
ВВЕДЕНИЕ
Радиоактивный анализ открыл в конце XIX столетия (в 1895 г.) немецкий физик Вильгельм Конрад Рентген невидимые лучи способные беспрепятственно проходить через твёрдые тела и вызывать почернение фотоплёнки. Рентген назвал их X-лучами (теперь они называются рентгеновскими).
Самопроизвольное испускание атомами излучения получило название радиоактивности. Его открыл французский физик Антуан Анри Беккерель.
Новым явлением заинтересовались работавшие во Франции Пьер Кюри (1859-1906) и его супруга Мария Склодовская-Кюри (1867-1934), которая и ввела термин “радиоактивность”. Исследователи установили, что сильной радиоактивностью обладают присутствующие в урановой руде в очень малых концентрациях два новых химических элемента – полоний Ро (он открыт ими в июле 1898г.) и радий Ra (открыт в декабре того же года).
Достижения Беккереля и супругов Кюри были отмечены присуждением им Нобелевских премий.
Радиоактивный анализ – это физический метод анализа, который возник и развился после открытия атомной энергии и создания атомных реакторов.
Он основан на измерении радиоактивного излучения элементов. Анализ по радиоактивности был известен и ранее. Так, измеряя естественную радиоактивность урановых руд, определяли содержание в них урана. Аналогичный метод известен для определения калия по радиоактивному изотопу этого элемента. Активационный анализ отличается от этих методов тем, что в нём измеряют интенсивность излучения радиоизотопов элементов, образовавшихся вследствие бомбардировки анализируемой пробы потоком элементарных частиц. При такой бомбардировке происходят ядерные реакции и образуются радиоактивные изотопы элементов, входящих в состав анализируемой пробы.
1. Радиоактивность
1.1 Типы радиоактивного распада и радиоактивного излучения
Открытие радиоактивности относится к 1896г., когда А. Беккерель обнаружил, что уран самопроизвольно испускает излучение, названное им радиоактивным (от. radio – излучаю и activas – действенный).
Радиоактивное излучение возникает при самопроизвольном распаде атомного ядра. Известно несколько типов радиоактивного распада и радиоактивного излучения.
1) α-Распад. Распад ядра с выделением α-частиц, которые являются ядрами He2+. Например,
226 88Ra → 222 86Rn + 4 2He ;
238 92U → 234 90Th + 2 4α (He)
В соответствии с законом радиоактивного смещения, при α-распаде получается атом, порядковый номер которого на две единицы, а атомная масса на четыре единицы меньше, чем у исходного атома.
2) β-Распад. Различают несколько видов β-распада: электронном β-распаде, например,
90 88Sn → 90 89Y + β;
32 15P → 32 16S + β
Нейтрон внутри ядра превращается в протон. При испускании отрицательно заряженной β-частицы порядковый номер элемента возрастает на единицу, а атомная масса практически не меняется.
При позитронном β-распаде из атомного ядра выделяется позитрон (β-частица), а потом внутри ядра превращается в нейтрон. Например:
22 11Na → 22 10Ne + β
Продолжительность жизни позитрона невелика, так как при столкновении его с электроном происходит аннигиляция, сопровождающаяся испусканием γ-квантов.
3) При К-захвате ядро атома захватывает электрон из близлежащей электронной оболочки (из К-оболочки) и один из протонов ядра превращается в нейтрон. Например,
64 31Cu→64 30Ni+n
40 19K + e= 48 18Ar + hv
На свободное место в К-оболочке переходит один из электронов внешней оболочки, что сопровождается испусканием жёсткого рентгеновского излучения.
Спонтанное деление. Оно характерно для элементов периодической системы Д. И. Менделеева с Z>90. При спонтанном делении тяжёлые атомы делятся на осколки, которыми обычно являются элементы середины таблицы Л. И. Менделеева. Спонтанное деление и α-распад ограничивают получение новых трансурановых элементов.
Поток α и β-частиц называют соответственно α и β-излучением. Кроме того, известно γ-излучение. Это электромагнитные колебания с очень короткой длиной волны. В принципе, γ-излучение близко к жёсткому рентгеновскому и отличается от него своим внутриядерным происхождением. Рентгеновское излучение при переходах в электронной оболочке атома, а γ-излучение испускает возбуждённые атомы, получившиеся в результате радиоактивного распада (α и β).
В результате радиоактивного распада получаются элементы, которые по заряду ядер (порядковому номеру) должны быть помещены в уже занятые клетки периодической системы элементами с таким же порядковым номером, но другой атомной массой. Это так называемые изотопы. По химическим свойствам их принято считать неразличимыми, поэтому смесь изотопов обычно рассматривается как один элемент. Неизменность изотопного состава в подавляющем большинстве химических реакций иногда называют законом постоянства изотопного состава. Например, калий в природных соединениях представляет собой смесь изотопов, на 93,259% из 39 К, на 6,729% из 41 К и на 0,0119% из 40 К (К-захват и β-распад). Кальций насчитывает шесть стабильных изотопов с массовыми числами 40, 42,43,44,46 и 48. В химико-аналитических и очень многих других реакциях это соотношение сохраняется практически неизменным, поэтому для разделения изотопов химической реакции обычно не применяются. Чаще всего для этой цели используются различные физические процессы – диффузия, дистилляция или электролиз.
Единицей активности изотопа является беккерель (Бк), равный активности нуклида в радиоактивном источнике, в котором за время 1с происходит один акт распада.
1.2 Закон радиоактивного распада
Скорость радиоактивного распада — пропорциональна числу имеющихся ядер N:
где λ – постоянная распада.
-lnN = λt + const,
Если t = 0, то N = N0 и, следовательно, const = -lg N0 . Окончательно
N = N0 e—λt (1)
или
A = A0e—λt (2)
где А – активность в момент времени t; А0 – активность при t = 0.
Уравнения (1) и (2) характеризуют закон радиоактивного распада. В кинетике они известны как уравнения реакции первого порядка. В качестве характеристики скорости радиоактивного распада обычно указывают период полураспада T1/2, который так же, как и λ, является фундаментальной характеристикой процесса, не зависящей от количества вещества.
Периодом полураспада называют промежуток времени, в течение которого данное количество радиоактивного вещества уменьшается наполовину.
Период полураспада различных изотопов существенно различен. Он находится примерно от 1010 лет до ничтожных долей секунды. Конечно, вещества, имеющие период полураспада 10 – 15 мин. и меньше, использовать в лаборатории трудно. Изотопы с очень большим периодом полураспада также нежелательны в лаборатории, так как при случайном загрязнении этими веществами окружающих предметов потребуется специальная работа по дезактивации помещения и приборов.
2. Методики анализа, основанные на измерении радиоактивности
2.1. Использование естественной радиоактивности в анализе
Элементы, имеющие естественную радиоактивность, могут быть определены по этому свойству количественно. Это U, Th, Ra, Ac и др., всего более 20 элементов. Например, калий можно определить по его радиоактивности в растворе при концентрации 0,05 М. Определение различных элементов по их радиоактивности обычно проводят с помощью градуировочного графика, показывающего зависимость активности от содержания (%) определяемого элемента или методом добавок.
Большое значение имеют радиометрические методы в поисковой работе геологов, например при разведке месторождений урана.
2.2. Активационный анализ
При облучении нейтронами, протонами и другими частицами высокой энергии многие нерадиоактивные элементы становятся радиоактивными. Активационный анализ основан на измерении этой радиоактивности. Хотя в принципе для облучения могут быть использованы любые частицы, наибольшее практическое значение имеет процесс облучения нейтронами. Применение для этой цели заряженных частиц связано с преодолением более значительных технических трудностей, чем в случае нейтронов. Основными источниками нейтронов для проведения активационного анализа являются атомный реактор и так называемые портативные источники (радиевобериллиевый и др.). В последнем случае α-частицы, получившиеся при распаде какого-либо α-активного элемента (Ra, Rn, и т. д.), взаимодействуют с ядрами бериллия, выделяя нейтроны:
9Be + 4He →12C + n
Нейтроны вступают в ядерную реакцию с компонентами анализируемой пробы,
например 55Mn + n = 56Mn или Mn (n,γ) 56Mn
Радиоактивный 56Mn распадается с периодом полураспада 2,6 ч:
55Mn → 56Fe + e—
Для получения информации о составе образца некоторое время измеряют его радиоактивность и анализируют полученную кривую. При проведении такого анализа необходимо располагать надёжными данными о периодах полураспада различных изотопов, с тем чтобы провести расшифровку суммарной кривой.
Другим вариантом активационного анализа является метод γ-спектроскопии, основанный на измерении спектра γ-излучения образца. Энергия γ-излучения является качественной, а скорость счёта – количественной характеристикой изотопа. Измерения производят с помощью многоканальных γ-спектрометров со сцинтилляционными или полупроводниковыми счётчиками. Это значительно более быстрый и специфичный, хотя и несколько менее чувствительный метод анализа, чем радиохимический.
Важным достоинством активационного анализа является его низкий предел обнаружения. С его помощью может быть обнаружено при благоприятных условиях до 10-13 – 10-15 г вещества. В некоторых специальных случаях удавалось достигнуть ещё более низких пределов обнаружения. Например, с его помощью контролируют чистоту кремния и германия в промышленности полупроводников, обнаруживая содержание примесей до 10-8 – 10-9 %. Такие содержания никаким другим методом, кроме активационного анализа определить невозможно. При получении тяжёлых элементов периодической системы, таких, как менделевий и курчатовий, исследователям удавалось считать почти каждый атом полученного элемента.
Основным недостатком активационного анализа является громоздкость источника нейтронов, а также нередко длительность самого процесса получения результатов.
2.3 Метод изотропного разбавления
Метод изотопного разбавления целесообразно применять для количественного определения близких по свойствам компонентов трудно разделяемых смесей В этом методе необходимо выделять не всё определяемое вещество, а лишь часть его в возможно более чистом состоянии. Метод изотопного разбавления открывает новые возможности в анализе сложных смесей и элементов, близких по своим химико-аналитическим свойствам. Например, при анализе смесей цирконий – гафний или ниобий – тантал можно получить чистый осадок одного из компонентов, но осаждение не будет полным. Если добиться полного осаждения, то полученный осадок будет загрязнен элементом-аналогом. В методе изотопного разбавления проводят неполное осаждение и, используя измерения активности, находят содержание анализируемого элемента с достаточной точностью. Аналогичный приём используется также при анализе различных смесей органических веществ.
2.4 Радиометрическое титрование
При радиометрическом титровании индикатором являются радиоактивные изотопы элементов. Например, при титровании фосфата магнием в анализируемый раствор вводят небольшое количество фосфата, содержащего радиоактивный P*.
Реакции радиометрического титрования должны удовлетворять требованиям, обычно предъявляемым к реакциям титриметрического анализа (скорость и полнота протекания реакции, постоянство состава продукта реакции и т. д.). Очевидным условием применимости реакции в данном методе является также переход продукта реакции из анализируемого раствора в другую фазу, с тем, чтобы устранить помехи при определении активности раствора. Этой второй фазой часто является образующийся осадок. Известны методики, где продукт реакции экстрагируется органическим растворителем. Например, при титровании многих катионов дитизоном в качестве экстрагента применяют хлороформ или тетрахлорид углерода. Применение экстрагента позволяет более точно установить точку эквивалентности, так как в этом случае её определения можно измерять активность обеих фаз.
3. Практическое использование радионуклидов
В наши дни радионуклиды известны у большинства химических элементов. Они имеют много самых разных применений, особенно в химии и биохимии. Дело в том, что химическое поведение радионуклидов какого-либо элемента практически такое же, как и у его стабильных нуклидов. Но ядра радионуклидов в момент распада “посылают сигнал” о своём присутствии. Учёные разработали аппаратуру, позволяющую надёжно регистрировать сигналы от распада буквально единичных атомов. Благодаря этому становится возможным использовать радионуклиды в качестве атомов-меток, так называемых радиоактивных индикаторов.
Например, с помощью фосфора-32 можно установить, как кукуруза усваивает из почвы фосфорное удобрение. В удобрение добавляют очень малое количество радионуклида. Далее, анализируя радиоактивность различных частей растения, можно определить, быстро ли фосфат усваивает корни, с какой скоростью он поступает в листья, стебли или початки и как усвоение удобрения зависит от его химической формы ( в частности, от того, в виде какой именно соли – аммония, калия или кальция – взят фосфат), от способа введения в почву и других факторов. Полученная информация позволила существенно повысить эффективность применения минеральных удобрений.
Аналогичным образом на подопытных животных можно проследить действие лекарств, содержащих радиоактивные индикаторы. Использование радионуклидов позволяет наблюдать и за поведением различных микропримесей в технологических процессах.
Так как для установления природы радионуклидов достаточно буквально единичных атомов, по результатам исследования пряди волос Наполеона, сохранившейся до наших дней, удавалось выяснить, что в конце жизни его организм получал избыток мышьяка. Возможно, именно это и стало причинной болезни и смерти.
А вот чисто химическая проблема, которую помог решить радиоуглерод. При окислении пропионовой кислоты СН3СН2СООН в кислой среде образуются углекислый газ и шавелевая кислота НООС-СООН. Интересно было выяснить, какая именно из двух связей С-С в пропионовой кислоте разрушается при окислении. Для этого синтезировали пропионовую кислоту, содержащую метку 14С в карбоксильной группе. Затем провели окисление и определили активность выделившегося углекислого газа и активность шавеливой кислоты. Измерения показали, что эти значения относятся как 3:7. Следовательно, впропионовой кислоты рвутся обе связи, но с разной вероятностью.
И число подобных примеров очень велико. Однако только использованию меток углерода-14 и трития в органической химии посвящены многотомные издания.
Список использованных источников:
- Аналитическая химия. Физико-химические методы анализа. Под ред. Е. Н. Дорохова, Г. В. Прохорова, — М.: Высш. шк.., 1991. — 256с.
- Аналитическая химия. Книга 2. Физико-химические методы анализа. Под ред. В.П. Васильева, — М.: Дрофа, 2004. — 384с.
- Патяковский В. М. Гигиенические основы питания и экспертизы продовольственных товаров. — Новосибирск: Издательство Новосибирского Университета, 1999. -431с.
- Курс аналитической химии: Учеб. для с.-х. вузов. — 6-е изд., испр. и доп. — М .: Высш. шк. 1994. — 495с.
znakka4estva.ru
Реферат — Радиоактивность и радиация
1. Что такое радиоактивность и радиация?
Явление радиоактивности было открыто в 1896 году французским ученым Анри Беккерелем. В настоящее время оно широко используется в науке, технике, медицине, промышленности. Радиактивные элементы естественного происхождения присутствуют повсюду в окружающей человека среде. В больших объемах образуются искусственные радионуклиды, главным образом в качестве побочного продукта на предприятиях оборонной промышленности и атомной энергетики. Попадая в окружающую среду, они оказывают воздействия на живые организмы, в чем и заключается их опасность. Для правильной оценки этой опасности необходимо четкое представление о масштабах загрязнения окружающей среды, о выгодах, которые приносят производства, основным или побочным продуктом которых являются радионуклиды, и потерях, связанных с отказом от этих производств, о реальных механизмах действия радиации, последствиях и существующих мерах защиты.
Радиоактивность — неустойчивость ядер некоторых атомов, проявляющаяся в их способности к самопроизвольным превращениям (распаду), сопровождающимся испусканием ионизирующего излучения или радиацией
Радиация, или ионизирующее излучение — это частицы и гамма-кванты, энергия которых достаточно велика, чтобы при воздействии на вещество создавать ионы разных знаков. Радиацию нельзя вызвать с помощью химических реакций. |
2. Какая бывает радиация?
Различают несколько видов радиации.
Альфа-частицы: относительно тяжелые, положительно заряженные частицы, представляющие собой ядра гелия.
Бета-частицы — это просто электроны.
Гамма-излучение имеет ту же электромагнитную природу, что и видимый свет, однако обладает гораздо большей проникающей способностью. 2 Нейтроны — электрически нейтральные частицы, возникают главным образом непосредственно вблизи работающего атомного реактора, куда доступ, естественно, регламентирован.
Рентгеновское излучение подобно гамма-излучению, но имеет меньшую энергию. Кстати, наше Солнце — один из естественных источников рентгеновского излучения, но земная атмосфера обеспечивает от него надежную защиту.
Заряженные частицы очень сильно взаимодействуют с веществом, поэтому, с одной стороны, даже одна альфа-частица при попадании в живой организм может уничтожить или повредить очень много клеток, но, с другой стороны, по той же причине, достаточной защитой от альфа- и бета-излучения является любой, даже очень тонкий слой твердого или жидкого вещества — например, обычная одежда (если, конечно, источник излучения находится снаружи). Следует различать радиоактивность и радиацию. Источники радиации — радиоактивные вещества или ядерно-технические установки (реакторы, ускорители, рентгеновское оборудование и т.п.) – могут существовать значительное время, а радиация существует лишь до момента своего поглощения в каком-либо веществе. |
3. К чему может привести воздействие радиации на человека?
Воздействие радиации на человека называют облучением. Основу этого воздействия составляет передача энергии радиации клеткам организма.
Облучение может вызвать нарушения обмена веществ, инфекционные осложнения, лейкоз и злокачественные опухоли, лучевое бесплодие, лучевую катаракту, лучевой ожог, лучевую болезнь.
Последствия облучения сильнее сказываются на делящихся клетках, и поэтому для детей облучение гораздо опаснее, чем для взрослых
Следует помнить, что гораздо больший РЕАЛЬНЫЙ ущерб здоровью людей приносят выбросы предприятий химической и сталелитейной промышленности, не говоря уже о том, что науке пока неизвестен механизм злокачественного перерождения тканей от внешних воздействий.
4. Как радиация может попасть в организм?
Организм человека реагирует на радиацию, а не на ее источник. 3 5. Передается ли радиация как болезнь? Радиацию создают радиоактивные вещества или специально сконструированное оборудование. Сама же радиация, воздействуя на организм, не образует в нем радиоактивных веществ, и не превращает его в новый источник радиации. Таким образом, человек не становится радиоактивным после рентгеновского или флюорографического обследования. Кстати, и рентгеновский снимок (пленка) также не несет в себе радиоактивности. Исключением является ситуация, при которой в организм намеренно вводятся радиоактивные препараты (например, при радиоизотопном обследовании щитовидной железы), и человек на небольшое время становится источником радиации. Однако препараты такого рода специально выбираются так, чтобы быстро терять свою радиоактивность за счет распада, и интенсивность радиации быстро спадает. |
6. В каких единицах измеряется радиоактивность?
Мерой радиоактивности служит активность. Измеряется в Беккерелях (Бк), что соответствует 1 распаду в секунду. Содержание активности в веществе часто оценивают на единицу веса вещества (Бк/кг) или объема (Бк/куб.м).
Также встречается еще такая единица активности, как Кюри (Ки). Это — огромная величина: 1 Ки = 37000000000 Бк.
Активность радиоактивного источника характеризует его мощность. Так, в источнике активностью 1 Кюри происходит 37000000000 распадов в секунду.
4
Как было сказано выше, при этих распадах источник испускает ионизирующее излучения. Мерой ионизационного воздействия этого излучения на вещество является экспозиционная доза. Часто измеряется в Рентгенах (Р). Поскольку 1 Рентген — довольно большая величина, на практике удобнее пользоваться миллионной (мкР) или тысячной (мР) долями Рентгена.
Действие распространенных бытовых дозиметров основано на измерении ионизации за определенное время, то есть мощности экспозиционной дозы. Единица измерения мощности экспозиционной дозы — микроРентген/час.
Мощность дозы, умноженная на время, называется дозой. Мощность дозы и доза соотносятся так же как скорость автомобиля и пройденное этим автомобилем расстояние (путь).
Для оценки воздействия на организм человека используются понятия эквивалентная доза и мощность эквивалентной дозы. Измеряются, соответственно, в Зивертах (Зв) и Зивертах/час. В быту можно считать, что 1 Зиверт = 100 Рентген. Необходимо указывать на какой орган, часть или все тело пришлась данная доза.
Можно показать, что упомянутый выше точечный источник активностью 1 Кюри (для определенности рассматриваем источник цезий-137) на расстоянии 1 метр от себя создает мощность экспозиционной дозы приблизительно 0,3 Рентгена/час, а на расстоянии 10 метров — приблизительно 0,003 Рентгена/час. Уменьшение мощности дозы с увеличением расстояния от источника происходит всегда и обусловлено законами распространения излучения.
7. Что такое изотопы?
В таблице Менделеева более 100 химических элементов. Почти каждый из них представлен смесью стабильных и радиоактивных атомов, которые называют изотопами данного элемента. Известно около 2000 изотопов, из которых около 300 — стабильные.
Например, у первого элемента таблицы Менделеева — водорода — существуют следующие изотопы:
— водород Н-1 (стабильный),
— дейтерий Н-2 (стабильный),
— тритий Н-3 (радиоактивный, период полураспада 12 лет).
Радиоактивные изотопы обычно называют радионуклидами 5
8. Что такое период полураспада?
Число радиоактивных ядер одного типа постоянно уменьшается во времени благодаря их распаду.
Скорость распада принято характеризовать периодом полураспада: это время, за которое число радиоактивных ядер определенного типа уменьшится в 2 раза.
Абсолютно ошибочной является следующая трактовка понятия «период полураспада»: «если радиоактивное вещество имеет период полураспада 1 час, это значит, что через 1 час распадется его первая половина, а еще через 1 час — вторая половина, и это вещество полностью исчезнет (распадется)».
Для радионуклида с периодом полураспада 1 час это означает, что через 1 час его количество станет меньше первоначального в 2 раза, через 2 часа — в 4, через 3 часа — в 8 раз и т.д., но полностью не исчезнет никогда. В такой же пропорции будет уменьшается и радиация, излучаемая этим веществом. Поэтому можно прогнозировать радиационную обстановку на будущее, если знать, какие и в каком количестве радиоактивные вещества создают радиацию в данном месте в данный момент времени.
У каждого радионуклида — свой период полураспада, он может составлять как доли секунды, так и миллиарды лет. Важно, что период полураспада данного радионуклида постоянен, и изменить его невозможно.
Образующиеся при радиоактивном распаде ядра, в свою очередь, также могут быть радиоактивными. Так, например, радиоактивный радон-222 обязан своим происхождением радиоактивному урану-238.
Иногда встречаются утверждения, что радиоактивные отходы в хранилищах полностью распадутся за 300 лет. Это не так. Просто это время составит примерно 10 периодов полураспада цезия-137, одного из самых распространенных техногенных радионуклидов, и за 300 лет его радиоактивность в отходах снизится почти в 1000 раз, но, к сожалению, не исчезнет.
9. Что вокруг нас радиоактивно?
6
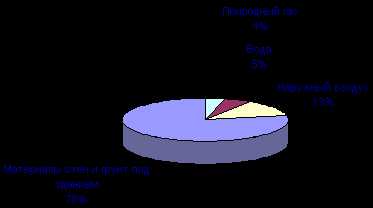
Воздействие на человека тех или иных источников радиации поможет оценить следующая диаграмма (по данным А.Г.Зеленкова, 1990).
10. Естественная радиоактивность Естественная радиоактивность существует миллиарды лет, она присутствует буквально повсюду. Ионизирующие излучения существовали на Земле задолго до зарождения на ней жизни и присутствовали в космосе до возникновения самой Земли. Радиоактивные материалы вошли в состав Земли с самого ее рождения. Любой человек слегка радиоактивен: в тканях человеческого тела одним из главных источников природной радиации являются калий-40 и рубидий-87, причем не существует способа от них избавиться. Учтем, что современный человек до 80% времени проводит в помещениях — дома или на работе, где и получает основную дозу радиации: хотя здания защищают от излучений извне, в стройматериалах, из которых они построены, содержится природная радиоактивность. Существенный вклад в облучение человека вносит радон и продукты его распада. |
11. Радон |
12. Техногенная радиоактивность Техногенная радиоактивность возникает вследствие человеческой деятельности. |
Такой вид транспорта, как гражданская авиация, подвергает своих пассажиров повышенному воздействию космического излучения.
И, конечно, свой вклад дают испытания ядерного оружия, предприятия атомной энергетики и промышленности.
8
Безусловно, возможно и случайное (неконтролируемое) распространение радиоактивных источников: аварии, потери, хищения, распыление и т.п. Таки ситуации, к счастью, ОЧЕНЬ РЕДКИ. Кроме того, их опасность не следует преувеличивать.
13. Как защититься от радиации?
От источника радиации защищаются временем, расстоянием и веществом.
Временем — вследствие того, что чем меньше время пребывания вблизи источника радиации, тем меньше полученная от него доза облучения.
Расстоянием — благодаря тому, что излучение уменьшается с удалением от компактного источника (пропорционально квадрату расстояния). Если на расстоянии 1 метр от источника радиации дозиметр фиксирует 1000 мкР/час, то уже на расстоянии 5 метров показания снизятся приблизительно до 40 мкР/час.
Веществом — необходимо стремиться, чтобы между Вами и источником радиации оказалось как можно больше вещества: чем его больше и чем оно плотнее, тем большую часть радиации оно поглотит.
Что касается главного источника облучения в помещениях — радона и продуктов его распада, то регулярное проветривание позволяет значительно уменьшить их вклад в дозовую нагрузку.
Кроме того, если речь идет о строительстве или отделке собственного жилья, которое, вероятно, прослужит не одному поколению, следует постараться купить радиационно безопасные стройматериалы — благо их ассортимент ныне чрезвычайно богат.
Заключение:
Делая этот реферат, я открыл для себя много нового. Я выбирал нужную информацию из многих источников. В ходе отбора информации я находил много интересного. Эта работа обьединяет в себе труды многих людей. В ней коротко изложен почти весь материал о главных аспектах радиоктивности, начиная от того, что такое радиоктивность и заканчивая методами защиты от неё.
Информация о радиоктивности получена из: 9
Интернет
Э. Резерфорд “Радиоктивность”
И. Белоусова, Ю. Штуккенберг “Естественная радиоктивность”
Энциклопедия по физике “Радиоктивные излучения”
10
ronl.org
13 Радиоактивность Открытие радиоактивности.
открытие радиоактивности
Радиоактивность—это самопроизвольное испускание излучения каким-либо элементом, обусловленное распадом атомных ядер. Явление радиоактивности обнаружил Антуан Анри Беккерель в 1896 г. Он установил, что урановые соли вызывают почернение фотографических пластинок даже завернутых в черную бумагу. Он обнаружил также, что эти соли способны ионизировать газы и таким образом разряжать электроскоп.
В 1898 г. Мария Склодовская-Кюри использовала этот способ ионизации для изучения радиоактивности руды, называемой смоляной обманкой. Смоляная обманка является урановой рудой и состоит главным образом из U3O8- М. Кюри обнаружила, что радиоактивность какой-либо массы урановой руды больше, чем у такой же массы чистой урановой соли. Пользуясь химическими методами разделения, она сумела выделить из руды два новых радиоактивных элемента и дала им названия полоний и радий. Радиоактивность радия оказалась приблизительно в миллион раз больше, чем урана. Вскоре после этого (1899 г.) сотрудник Кюри, Андре Дебьерн, открыл еще один радиоактивный элемент—актиний.
М. Склодовская-Кюри предположила, что радиоактивность радия обусловлена распадом его атомов. Она обнаружила излучение двух типов, названное а- и В-излу-чением. а-Излучение можно отклонять от первоначального направления с помощью электрически заряженной пластинки. В 1900 г. Пьер Кюри открыл излучение третьего типа, получившее название у-излучение.
Антуан Анри Беккерель (1852-1908). Открыл радиоактивность в 1896 г. Получил за эту работу Нобелевскую премию по физике в 1903 г.
Мария Склодовская-Кюри. Родилась в Варшаве в 1867 г. В 1903 г. вместе с мужем Пьером Кюри получила Нобелевскую премию по физике за исследование радиоактивного излучения. В 1911 г. получила Нобелевскую премию по химии за выделение радия. В 1934 г. умерла от лейкемии, которая, несомненно, была вызвана продолжительным облучением при работе с радиоактивными веществами.
В последующие несколько лет Эрнест Резерфорд и Фредерик Содди выполнили ряд экспериментов по изучению радия, радона и урана. Они показали, что а-излучение представляет собой поток заряженных частиц. Впоследствии было установлено, что эти частицы являются ядрами атомов гелия. Резерфорд и Содди продемонстрировали также, что радиоактивность приводит к образованию других элементов.
Оглавление:
www.himikatus.ru
Радиоактивность в химии — Справочник химика 21
ТЕХНЕЦИЙ (Te hnetium) Тс, радиоактивный хим. элем. VII гр. периодич. сист., ат. и. 43, ат. м. для Тс 98,9062. Первый искусственно полученный элемент. Известно ок. 20 радиоакт. иэотопов с мае. ч. 92—108 (о изомерами) наиб, долгоживущий «T (7 i/2 2,12-10 лет). Синтезирован К. Перье и Э. Сегре в 1937 бомбардировкой ядер Мо дейтронами. В ничтожных кол-вах обнаружен в урановых рудах. Серебристо-серый металл кристаллич. решетка гексагональная, в тонких слоях (менее 15-10 мкм) — гранецентрированная кубическая плотн. 11,487 г/см [c.575]БЕРКЛИЙ (от Беркли, Berkeley-город в США, где был открыт Б. лат. Berkelium) Вк, искусственный радиоактивный хим. элемент Ш гр. периодич. системы ат. н. 97 относится к актиноидам. Стабильных изотопов не имеет. Получены 10 изотопов с мае. ч. 240-251 (кроме 241). Наиб, долгоживущие Вк (7,,2 1380 лет а-излучатель) Вк (Т,/2 314 сут -излучатель). Конфигурация внеш. электронных оболочек атома 5/ 6s 6p d 7i степени окисления -f3 (наиб, устойчива), +4 энергия ионизации Вк — Вк 40,8 эВ электроотрицательность по Полингу 1,0-1,2 ионные радиусы Вк 0,0935 нм, Вк -» 0,0870 нм. [c.282]
ПРОМЕТИЙ (РготеС1ит) Рт, радиоактивный хим. элем. 111 гр. периодич. сист., ат. н. 61, ат. м. 145,0 относится к лантаноидам. И.чвеотно 14 изотопов с мае. ч. 141—154 и 2 ядерных изомера наиб, долгоживущий Рга (Т, ок. [c.480]
ТОРИЙ (Thorium) Th, радиоактивный хим. элем. П1 гр. периодич. сист., ат. п. 90, ат. м. 232,0381 относится к актиноидам. В природе в основном состоит из изотопа 232ТН (Ti 1,389-10 лет). Открыт Й. Берцелиусом в 1828. [c.585]
АМЕРИЦИЙ (от Америка, по месту открытия лат. Ameri ium) Am, искусств, радиоактивный хим. элемент [c.125]
КЮРИЙ (от имени П. Кюри и М. Склодовской-Кюри лат. urium) m, искусственный радиоактивный хим. элемент III гр. периодич. системы, ат. н. 96 относится к актиноидам. Стабильных изотопов ие имеет. Известно 15 изотопов с мае. ч. 237-251. Наиб. долгоживущие изотопы Ст (Т,,2 1,58-10 лет) и Ст(Тц2 3,4-10 лет)-а-излучатели. Первый из них обнаружен в земиой коре в иек-рых радиоактивных минералах родоначальник семейства Конфигурация внеш. электронных оболочек атома 5/ 6i 6p 6i/ 7j степень окисления -(-3 (нанб. устойчива), -t-4, -(-6 электроотрицательность по Полингу 1,2 ат. раднус 0,175 нм, ионные радиусы 0,0946 нм для m и 0,0886 нм для Сш [c.560]
РАДИЙ (Radium) Ra, радиоактивный хим. элем. II гр. периодич. сист., ат. н. 88, ат. м. для Ra 226,0254. Изотопы с мае. ч. 224, 226 и 228 входят в прир. радиоакт. ряды наиб, устойчив Ra (Tij ок. 1620 лет). Открыт в 1898 П. Кюри, М. Склодовской Кюри и Ж. Бемоном. Содержание в земиой коре 1 -10 % по массе. Серебристо-белый металл кристаллич. решетка объемноцентрированная плотн. [c.489]
АСТАТ (от греч. astatos-неустойчивый лат. Astatium) At, радиоактивный хим. элемент VII гр. периодич. системы, относится к галогенам, ат. н. 85. Стабильных изотопов не имеет. Известно более 20 изотопов с мае. ч. от 196 до 219 наиб. долгоживущие- °А1 (Т,,2 8,1 ч) и «At(T, 2 7,21 ч). [c.211]
КАЛИФОРНИЙ (от назв. штата Калифорния, США лат. alifornium) f, искусств, радиоактивный хим. элемент III гр. периодич. системы, ат. н. 98 относится к актиноидам. Стабильных изотопов не имеет. Известно 17 изотопов с мае. [c.286]
ФРАНЦИИ (1 гапс1ит) Рг, радиоактивный хим. элем. I гр. периодич. сист., ат. н. 87. Открыт (изотоп Рг) М. Пе-рей в 1939. Этот изотоп наиб, устойчив (Г] 21,8 мин) он [c.635]
КУРЧАТ0ВИЙ (Kur hatovium) Ки, искусств, радиоактивный ХИМ. элемент IV гр. периодич, системы, ат. н. 104 первый элемент третьей переходной серии. Стабильных изотопов не имеет. Известно 10 изотопов с мае. ч. 253-262. Наиб, лолгоживущий изотоп Ки (Г,, 1,1 мин, а-излучатель). Конфигурация внеш. электронных оболочек атома 5j 6.s 6p (>d-7s степень окисления -(- 4, [c.558]
НОБЕЛИЙ (Nobelium) N0, искусств, радиоактивный хим. элемент 1П гр. периодич. системы, ат. н. 102, относится к актиноидам. Стабильных изотопов не имеет. Известно девять изотопов с мае. ч. 251-259. Наиб. долгожив оций h40Ton- No (Т,,2 1,0 ч). Конфигурация (расчетная) внеш. электронных оболочек атома 5/ 7s . Степень окисления + 2, -1-3 по оценочным данным, ионный радиус No 0,11 нм. [c.287]
МЕНДЕЛЕВИЙ (Mendelevium) Md, искусств, радиоактивный хим. элемент III гр. периодич, системы, ат.н. 101 относится к актиноидам. Стабильных изотопов не имеет. Известно 13 изотопов с мас.ч. 247-252, 254-260. Наиб, долгоживущие Md (Т1/2 56 сут, а-излучатель), [c.33]
НЕПТУНИЙ (от назв. планеты Нептун лат. Neptunium) Np, искусственный радиоактивный хим. элемент III гр. периодич. системы, ат. н. 93, относится к актиноидам. Стабильных изотопов не имеет. Известно ]5 изотопов с мае. ч. 227-241. Наиб, долгоживущий изотоп- Np (Тц 2,14-10 лет, а-излучатель), являющийся родоначальником четвертого радиоактивного ряда. В природе встречается в ничтожных кол-вах в урановых рудах. Образуется из ядер урана под действием нейтронов космич. излучения и нейтронов спонтанного деления Конфигурация внеш. электронных оболочек атома 5f 6s 6p 6d 7s степеьш окисления -f-3, -1-4, + 5 (наиб, устойчива), -t-б, +7 электроотрицательность по Полингу 1,22 ат. радиус 0,155 нм, ионные радиусы Np 0.0986 нм, Np — 0,0913 нм, Np — -O.OS нм, Np 0,082 нм. [c.216]
ЛОУРЕНСИЙ (Lowren ium) Lr, искусств, радиоактивный хим. элемент 1П гр. периодич. системы, ат. н. 103 относится к актиноидам. Стабильных изотопов не имеет. Известно 8 радиоактивных изотопов Lr, [c.611]
РАД0Н (Radon) Rn, радиоактивный хим. элемент VIII гр. периодич. системы, ат. и. 86, ат. м. 222,0176 относится к благородным газам. Природный Р. состоит из смеси изотопов (и-излучатели) — Rn (Ti,2 3,8 сут), Rn (Т . 55,6 с, торон Тп), Rn 3,9 с), » Rn (Т,д 0,035 с), являющихся членами прир. радиоактивных рядов (дочерние продукты распада изотопов Ra). Поперечное сечение захвата [c.174]
НИЛЬСБОРИЙ (Nielsboniun) Ns, искусств, радиоактивный хим. элемент V гр. периодич. системы, ат.н. 105, аналог Та и Nb. Стабильных изотопов не имеет. Известно шесть изотопов с мае. ч. 255, 257, 259-262. Нанб. долгоживущий изотоп Ns (Ti/2 40 с). Конфигурация (расчетная) внеш. электронных оболочек атома 5f 6d 7s , степень окисления + 5. [c.248]
ТЕХНЕЦИЙ (от греч. te hnetos-искусственный лат. Te hnetimn) Тс, искусств, радиоактивный хим. элемент VII гр. периодич. системы, ат.н. 43. Стабильных изотопов не имеет. Известно 16 изотопов и 6 ядерных изомеров с мао. ч. 92-107. Наиб, долгоживущие изотопы Тс (Tj,, 2,6-10 лет, электронный захват), Тс (Тщ 1,5-10 лет, -распад) и Тс (Т 12 2,12- Ю лет, -распад). В природе встречается в ничтожных кол-вах в урановых рудах спектральные линии Т. обнаружены в спектрах Солнца и нек-рых звезд. [c.560]
ПЛУТбНИЙ (от назв. планеты Плутон лат. Plutonium) Pu, искусств, радиоактивный хим. элемент III гр. периодич. системы, ат. н. 94, ат. м. 244,0642 относится к актиноида. и Стабильных изотопов не имеет. Известны 15 изотопов с мае. [c.580]
ФЕРМИЙ (Fermium), Fm, искусственный радиоактивный хим. элемент Ш ф. периодич. системы, ат. н. 100 относится к актиноидам. Стабильных изотопов не имеет. Известно 17 радиоактивных изотопов с мае. ч. 243-259. Наиб, долгожищ -щий нуклид Fm (Tj 100,5 сут, а-излучатель). Вероятная конфигурщия внеш. электронных оболочек атома 5/ 6i 6p i степени окисления +2 и +3 (наиб, устойчивая) ионный радиус Fm 0,0922 нм, Fm + 0,194 нм. [c.84]
РАДИЙ (от лат. radius-луч лат. Radium) Ra, радиоактивный хим. элемент П гр. периодич. системы, ат. н. 88 относится к щелочноземельным элементам. Известны изотопы с мае. ч. 206-230. Наиб, долгоживущий — Ra [c.153]
ФРХнЦИЙ (Рк апаиш) Рг, радиоактивный хим. элемент I гр. периодич. системы, ат. н. 87 относится к щелочным металлам. Стабильных изотопов не имеет. Известно 27 радиоактивных изотопов с мае. ч. 202-229. Наиб, долгоживущие нуклчды [Т,д20 мин, оь-распад (44%), электронный захват (56%)] и мин, Р-распад (99,9%)], последний входит в
www.chem21.info