Как ученые пытаются создать искусственные человеческие органы
unsplash.com
Здоровье
И станет ли замена печени такой же привычной манипуляцией, как смена тормозных колодок в автомобиле.
Вадим Рощин
В начале XXI века наука только-только подступалась к идее создания искусственных человеческих органов, которые можно было бы использовать для трансплантации. Спустя 20 лет десятки лабораторий по всему миру проводят эксперименты в этой области, мыши с искусственно выращенными яичниками приносят потомство, а производители косметики тестируют новинки на выращенной в пробирке коже – потому что на мышах и кроликах это делать теперь запрещено (по крайней мере в Европе). GQ поговорил с экспертами из трех российских центров, в которых пытаются наладить производство «запчастей» для человека, и о совершенно фантастических разработках, которые вот-вот изменят медицину и мир.
Биопринтинг
Биопринтинг – это «печать» тканей живых существ. Принцип такой же, как и в обычном офисном устройстве для распечатки документов, только вместо чернил из картриджа подается биоматериал – клетки различных тканей организма. К слову, первый биопринтер, созданный в 2001 году, представлял собой как раз модернизированный офисный девайс Hewlett Packard.
Юсеф Хесуани
Соучредитель и управляющий партнер лаборатории 3D Bioprinting Solutions.
«Многие представляют себе 3D-принтинг как послойную печать объектов из пластика согласно заданной цифровой модели – и это действительно самая близкая аналогия биопринтинга, – рассказывает Юсеф Хесуани, глава лаборатории 3D Bioprinting Solutions. – Естественно, мы избегаем в работе высоких температур, чтобы не повредить «расходный материал», в основе которого – белки. Способы печати бывают разными – мы, например, придумали технологию управления клетками с помощью магнитных полей. Исходный материал «левитирует» в жидкой питательной среде, а когда он попадает в магнитную ловушку – клетки начинают взаимодействовать друг с другом, и формируется нужная нам ткань. Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
Еще одна технология – печать прямо в зоне дефекта, например, на месте повреждения кожи. Всю работу в этом случае выполняет роботический манипулятор, к которому мы приделали нашу форсунку с биоматериалами и для которого написали софт. Оператор выводит механическую руку в «точку ноль», а дальше робот сам начинает латать дефект».
В российской лаборатории с помощью такого манипулятора уже проводили эксперименты по устранению дефектов кожи у крыс и минипигов. (За границей пошли еще дальше: в прошлом году интернациональная команда ученых в ОАЭ впервые сделала «заплатку» на коже человека.) Кроме того, в 2015 году в России напечатали мышиную щитовидную железу, которую потом успешно трансплантировали. Эксперимент доказал: биопринтинг позволяет создавать и заменять целые органы не только в теории, но и на практике. Щитовидную железу выбрали для опыта по нескольким причинам. Во-первых, легко проверить ее работоспособность – просто измерив уровень гормонов в крови. Во-вторых, в структуре щитовидки нет сложных участков, которые не могли бы воспроизвести существующие на данный момент принтеры. Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Тем временем ученые из Чикаго поставили схожий эксперимент – пересадили мышке напечатанный яичник. Опыт также был удачным, мышь дала потомство.
Биопринтер Fabion
На таком устройстве был создан «тканеинженерный конструкт» щитовидной железы мыши. Искусственную щитовидку успешно пересадили, гормональный баланс у грызуна был в норме.
А вот печатать жизнеспособные человеческие органы пока что мешают два ограничения. Первое – большой размер этих самых органов и, как следствие, их сложная структура. Современные технологии не позволяют создать внутри искусственного органа систему сосудов, необходимых для его нормальной работы после пересадки, – клетки внутри напечатанного объекта не получают питания и погибают от нехватки кислорода. В случае с мышиной щитовидной железой ученые использовали эмбриональные клетки, в которых уже заложена необходимая информация о сосудах, то есть условия для их прорастания были созданы заранее. Да и тот факт, что мышиный орган в десятки раз меньше человеческого, тоже сыграл важную роль в успешном завершении эксперимента.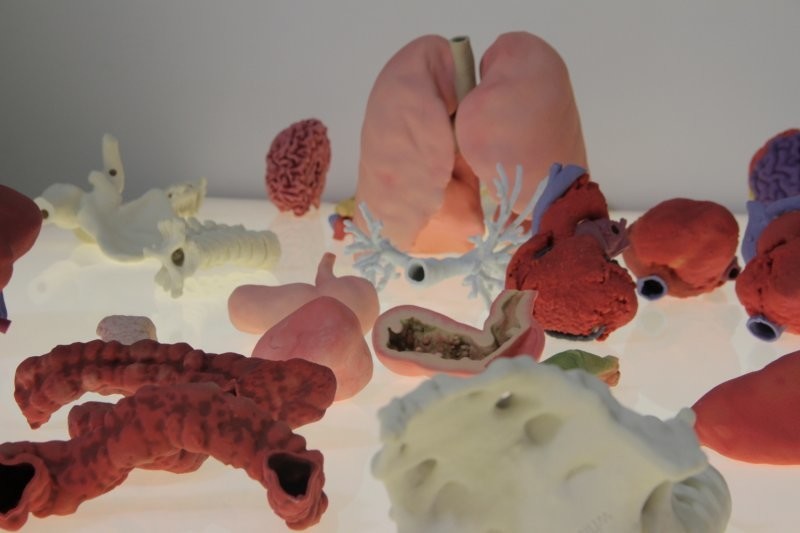
Вторая проблема – нехватка материала. Для биопечати нужны клетки, которые сначала необходимо вырастить, а для этого требуется время. В случае с кожей, например, на подготовку уходит порядка 4–6 недель, но в целом у каждого типа клеток свои скорость и возможность деления. Клетки кожи и крови, например, постоянно обновляются – у них высокий регенеративный потенциал. А клетки эндокринных органов делают это значительно реже и воспроизводятся намного медленнее. Для печати мышиной щитовидной железы экспериментаторы взяли эмбриональные клетки, которые, по словам ученых, «дают отличный прирост в сотни процентов». Использование эмбриональных клеток человека в России запрещено, а клетки той же щитовидной железы растут заметно хуже, их прирост – всего 5–10 процентов.
Биопринтеры уже умеют «печатать» работоспособные органы животных и фрагменты кожи человека.
Наука развивается скачкообразно, и прорыв в сфере биопринтинга может случиться в любой момент: «В 2014 году Общество биофабрикации, членом которого является наша лаборатория, выпустило прогноз развития отрасли. И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
И там говорилось, что искусственная кожа будет пересажена человеку примерно в 2030 году. А произошло это с опережением на десять лет, – говорит Юсеф Хесуани. – Поэтому вопрос о будущем – сложный. Биопринтинг – игра со множеством неизвестных. Когда мы открылись в 2013 году, мы были всего лишь шестой в мире коммерческой компанией, которая осваивала технологию трехмерной биопечати. А сейчас только производством биопринтеров занимаются больше 80 компаний в разных частях планеты, в том числе в Белоруссии и Армении».
В мире примерно половина компаний, экспериментирующих в области биопринтинга, существует с поддержкой государства, причем внимание этой технологии уделяют на самом высоком уровне. Так, весной президент США Джо Байден представил новый комитет по науке и объявил биопринтинг приоритетным направлением развития. Американцы уже готовят большую государственную программу, которая предусматривает солидные вложения в эту отрасль, поэтому можно предположить, что лучшие умы со всего мира будут переезжать поближе к этим деньгам.
По словам Юсефа Хесуани, заниматься наукой, запершись у себя в кабинете, сейчас крайне сложно, поэтому специалисты по биопринтингу из разных стран активно сотрудничают. Одновременно с этим развивается и конкуренция, ведь многие компании берут научные выкладки за основу бизнеса и уже могут похвастаться успешными кейсами их монетизации. Зарабатывать сегодня можно на производстве биопринтеров, расходных материалов к ним или же на печати образцов тканей – например, для исследования свойств лекарственных или косметических средств. Особенно это актуально в случае с клетками кожи: с 2012 года в Европе запрещены испытания косметики на животных, а тесты проводить нужно. Именно по этой причине гиганты уровня L’Oréal и BASF активно поддерживают компании, которые занимаются биопечатью кожи.
Биореакторы
Еще одно перспективное направление – выращивание органов в устройствах, именуемых биореакторами. В России этим занимаются в Национальном медицинском исследовательском центре трансплантологии и искусственных органов, а об особенностях технологии GQ рассказал глава центра Сергей Готье.
«Клетки не могут существовать в организме сами по себе – они закреплены на тонкой соединительнотканной основе, им там хорошо. В своих экспериментах мы в качестве такой основы используем специальные «подложки» – матриксы. У нас в институте разработаны и опробованы десятки матриксов и в итоге выбраны лучшие – те, которые могут обеспечить, например, жизнедеятельность хрящевых клеток и на основе которых можно вырастить новый хрящ. Но все-таки хрящ – это ткань, не орган. Основная задача, которую мы сейчас пытаемся решить, – обеспечить совместное существование большого количества клеток в одном конгломерате. Для этого нужно создать такую среду, которая могла бы не только питать клетки, но и выводить продукты распада, обмена веществ. Именно эту функцию и выполняют биореакторы, но в них пока что невозможно вырастить большой орган. Казалось бы, самая простая задача – создать миокардиоциты (мышечные клетки сердца. – Прим. GQ) и построить из них сердце. Мы делали такие попытки, и они были успешными, но пока только в случае с маленьким органом. С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
С сердцем мыши. Проблема в том, что сейчас у нас нет технологических возможностей для создания большого объема функционирующей ткани».
Сергей Готье
Директор НМИЦ трансплантологии и искусственных органов имени академика В. И. Шумакова Минздрава России.
Результаты экспериментов с биореактором помогают медикам и в других сферах – в том числе при восстановлении поврежденных донорских органов перед пересадкой. В российском Центре трансплантологии ежегодно проводят около 200 трансплантаций сердца (по мировым меркам это огромная цифра), а вот донорские легкие для пересадки используют намного реже. Причина в том, что легкие очень часто оказываются поврежденными при жизни человека и не годятся для операции. Что делать? Пытаться восстановить «некачественный» донорский орган вне организма. Выглядит это так: через кровеносную систему легких пропускают специально разработанный раствор, дыхательный аппарат имитирует вдохи и выдохи – создаются идеальные условия для регенерации клеток. Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
Таким образом можно восстановить до половины поврежденной ткани, а потом имплантировать «отремонтированный» орган пациенту.
«Пока мы с вами ведем эту беседу, кто-то может совершить открытие, которое изменит медицину».
В ответ на вопрос, когда же в биореакторе получится вырастить полноценный орган, Сергей Готье просит воздержаться от каких-либо предсказаний: «Пока мы с вами ведем эту беседу, где-нибудь в Гонконге, в США или в России кто-то может воскликнуть: «Эврика!» – и совершить открытие, которое изменит медицину».
«Призрачные органы»
Третья технология, которая в будущем может лечь в основу производства «запасных частей» для человечества, – децеллюляризация. Необходимый орган (или его часть) в этом случае создается не с нуля. В качестве «каркаса» берется донорский орган, причем не обязательно человеческий. Затем будущую основу «отмывают» от клеток прошлого хозяина и «высаживают» на нее биоматериал будущего владельца. Полученный орган после трансплантации с меньшей вероятностью вызовет отторжение, так как организм будет воспринимать его как что-то знакомое и даже родное.
«Поместив донорский орган в специальные растворы, мы можем добиться того, что все его клетки будут смыты – останется только сетчатый каркас из фибриллярных белков, его «архитектурная основа», – объясняет Елена Петерсен из Центра внедрения геномных технологий МФТИ. – Далее мы заселяем каркас клетками пациента и при дальнейшем выращивании можем получить искусственный орган, который будет максимально естественным для будущего хозяина. Фактически речь идет о воссоздании взрослого органа с использованием донорского каркаса и специальным образом обработанных и пересаженных клеток пациента».
Эпитет «призрачные» появился из‑за бледно-белого цвета, который органы приобретают после децеллюляризации. А получающийся в итоге каркас, по сути, тот же матрикс. И трудности, с которым сталкивается технология, – такие же, как и у двух предыдущих. Метод выращивания полноценных трансплантатов на основе «бесклеточных заготовок» не может преодолеть барьер, связанный с доставкой кислорода и питательных веществ внутрь органа – наладить этот процесс пока не получается.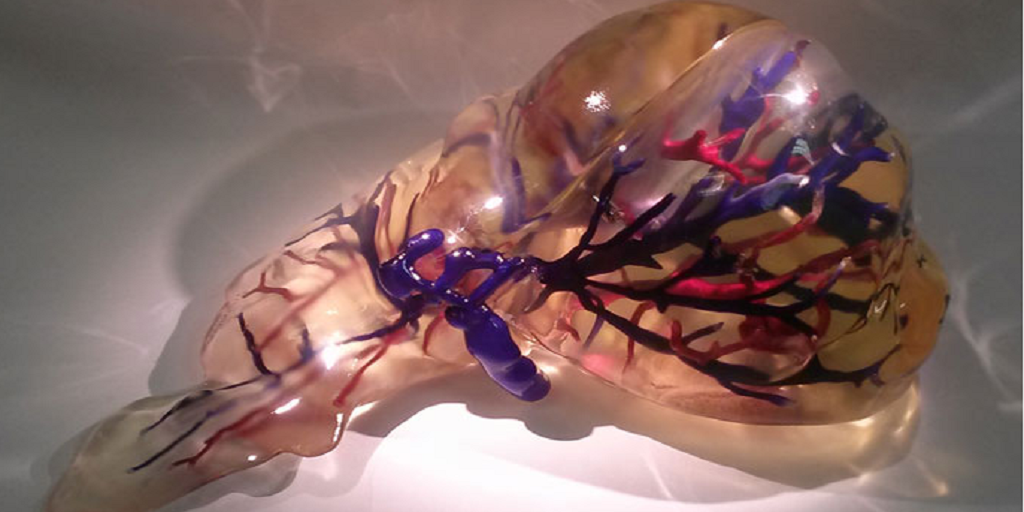 Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Да, к любому объекту, пересаженному человеку, все равно прорастают сосуды – организм таким образом пытается его опознать, подвести к нему иммунные клетки. Загвоздка в том, что естественное формирование сосудов происходит медленнее, чем процесс гибели клеток внутри «призрачного органа» от нехватки питания и кислорода.
Елена Петерсен
К. м. н., доцент департамента молекулярной и биологической физики МФТИ, заведующая лабораторией молекулярно-биологических и нейробиологических проблем и биоскрининга Центра внедрения геномных технологий МФТИ.
KUPRIANOFFOTO
Тем не менее эксперименты в этой области приносят все больше результатов. Так, наука уже дошла до пересадки человеку отдельных «отмытых» деталей – например, клапанов сердца. Раньше для этой операции использовались высушенные бычьи клапаны, которые сохраняли в себе клетки животного-донора. Сейчас человеку стараются трансплантировать «отмытые» части органов – иммунная реакция в этом случае менее выражена, риск отторжения ниже.
«Я думаю, что в ближайшие лет 10–15 произойдет большой скачок в этой области, – резюмирует Елена, – а технология, которая приведет к созданию искусственных органов, скорее всего, будет смешанной, на стыке биопринтинга, трехмерных клеточных структур и сегментированной пересадки органов.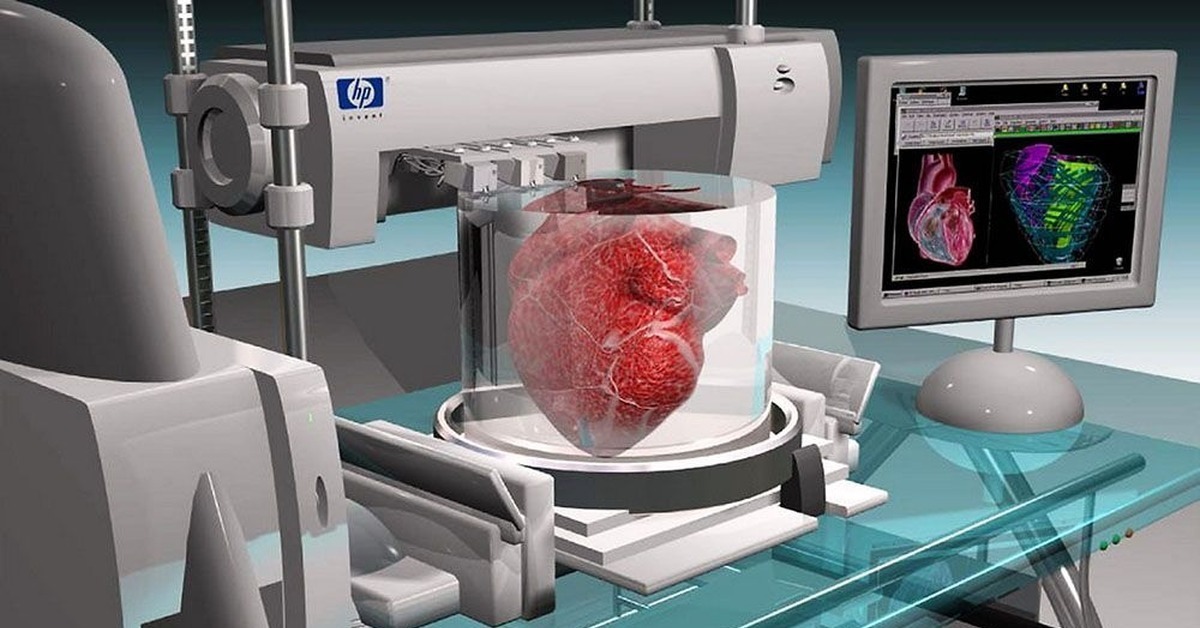
Вероятно, вам также будет интересно:
Печать зубов на принтере и роботизированный осмотр. Какой будет стоматология завтра?
Что получается, когда мода и медицина объединяются
Фото: Gettyimages.com; Shutterstock/Fotodom; Владимир Купринов; архив пресс-службы
ТегимедицинаТехнологиитехнологии будущего
российский химик — о создании и пересадке искусственных органов — РТ на русском
Короткая ссылка
Екатерина Кийко, Надежда Алексеева
Сегодня есть множество технологий по созданию искусственных органов, и они постоянно совершенствуются. Активно развивается направление создания имплантатов на основе умных материалов.
— Недавно биологи из Гарварда разработали технологию по созданию зачатков мочеточника из плюрипотентных стволовых клеток. По их словам, разработка является первым шагом на пути к выращиванию искусственных почек. Что представляют собой искусственные органы и из чего они создаются?
— Во всём мире активно развиваются технологии, связанные с умными материалами. Создание таких материалов позволяет выращивать и исследовать искусственные органы in vitro в лабораторных условиях.
Большой интерес представляет разработка имплантатов из умных материалов для культивирования (процесс, посредством которого in vitro отдельные клетки или единственная клетка выращиваются в контролируемых условиях. — RT) клеток, в том числе взятых у самого пациента. В дальнейшем такой имплантат вживляется в организм пациента.
При использовании биоразлагаемых материалов клетки пациента начнут прорастать в имплантат, по сути, выращивая новый орган внутри организма. По такому принципу в лабораторных условиях уже разрабатываются кардиоимплантаты, заплатки для сердца и т. д.
Однако надо понимать, что от лабораторных исследований до создания имплантатов, пригодных для вживления в организм человека, нужно проделать очень долгий и сложный путь.
Сначала мы на теоретическом уровне стараемся предсказать, как тот или иной материал будет вести себя в теле живого организма. Далее имплантат испытывается на лабораторных животных: мы смотрим, сбывается ли теоретический прогноз в реальных условиях. С учётом полученных данных имплантат дорабатывается.
С учётом полученных данных имплантат дорабатывается.
- © Smile111222/Wikimedia Commons/CC BY-SA 4.0
— Какие трудности бывают на разных этапах разработки и пересадки таких органов?
— Чтобы создать такую систему, которая прижилась бы в организме, нужна большая команда специалистов, в которую входят и химики, и биологи, и врачи. Трудности появляются уже на самых ранних стадиях разработки имплантатов. Очень важно найти баланс, при котором искусственный материал, биологически активная молекула, сможет взаимодействовать с клеточными структурами.
Есть примеры, когда недостаточное количество экспериментальных данных приводило к тяжёлым последствиям. Например, учёные нашли молекулу, которая может провоцировать быстрое дифференцирование костных тканей. Однако если не учитывать разные параметры ввода молекулы в организм, то возможны даже самые тяжёлые последствия — вплоть до превращения мышечных клеток в костные.
Важно понимать разные аспекты молекулярной терапии.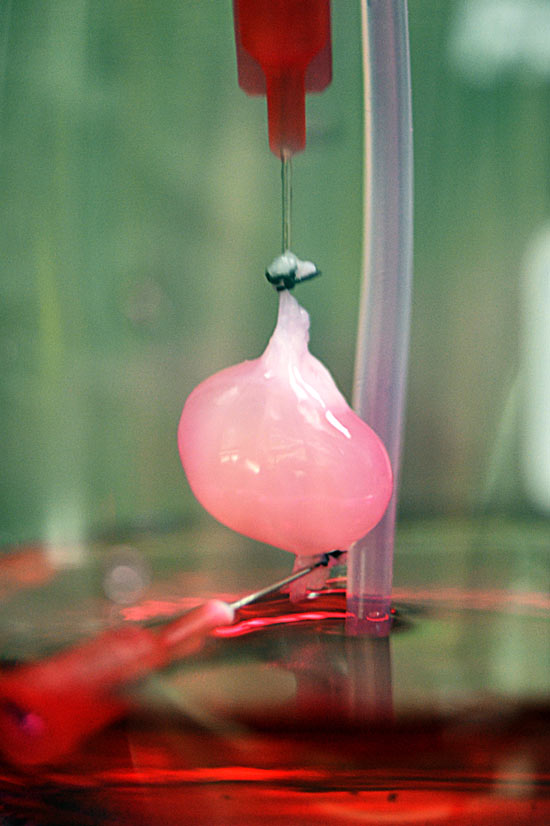
В целях безопасности перед применением какой-то технологии на людях она всегда исследуется in vitro и в опытах на животных.
- РИА Новости
- © Кирилл Брага
— Сейчас для создания искусственных органов всё больше стали применять 3D-печать. В разных странах печатают фрагменты черепа, уши, носы и другие части тела человека. Как выглядит процесс биопечати и насколько он развит? Есть ли примеры пересадки таких органов в нашей стране и как хорошо они приживаются?
— 3D-печать сейчас вызывает большой интерес научного сообщества. Например, один из видов такой биопечати — это печать органов из специальных гидрогелей. Отмечу, что одни из лучших принтеров для такой печати выпускаются в России, отечественные учёные владеют технологией создания таких органов.
Технологический процесс выглядит так: сначала подбирается специальный биоразлагаемый полимер, из которого будет состоять гидрогель. Далее на этот материал путём 3D-печати в определённом порядке накладываются слои из живых клеток. Гидрогели также могут быть покрыты каким-то активным веществом, которое будет способствовать имплантации искусственного органа в организм реципиента.
Далее на этот материал путём 3D-печати в определённом порядке накладываются слои из живых клеток. Гидрогели также могут быть покрыты каким-то активным веществом, которое будет способствовать имплантации искусственного органа в организм реципиента.
Такие органы хорошо приживаются, так как в технологии биопечати используются собственные клетки пациента. Важный фактор успеха — работа врачей на послеоперационном этапе. От медиков, которые отслеживают возможные осложнения, зависит очень многое.
Ранее в России уже проводились операции по пересадке напечатанных на 3D-принтере хрящей в гортань. Учёные пристально наблюдают за такими пациентами, поскольку собранные данные позволяют создавать специальные модели для совершенствования имплантатов и операций по их пересадке.
— В начале этого года врачи Мэрилендского университета провели первую операцию по трансплантации сердца генетически модифицированной свиньи человеку. Позже человек умер от вируса, свойственного этим животным.
— Это ещё одно перспективное направление выращивания искусственных органов. Очень много генных исследований такой направленности ведётся сегодня в России. Сейчас даже обсуждают формирование единой базы организаций, занимающихся такими разработками, для их поддержки создаются государственные программы. Важны государственные программы и по поддержке разработок материалов регенеративной медицины, чтобы собирать консорциумы химиков, биологов и медиков для возможности отдавать технологии из лаборатории в клинику.
Также по теме
«Не только мозг, но и бьющееся сердце»: британские биологи вырастили эмбрионы мышей из стволовых клеток
Британские учёные создали эмбрионы мышей из стволовых клеток. Технология отличается от клонирования, которое подразумевает…
Можно сказать, что генетические исследования и разработка специальных материалов для регенеративной медицины — это два основных направления работы в сфере создания искусственных органов. У каждого из этих направлений есть свои плюсы и минусы.
У каждого из этих направлений есть свои плюсы и минусы.
Понятно, что раз единожды такой опыт по вживлению генно-модифицированного органа удалось провести, значит, рано или поздно эти исследования увенчаются успехом. По сути, прорыв уже состоялся, а сейчас речь идёт о работе с возможными осложнениями, — нужно научиться их предотвращать.
Вообще, человеческий организм очень адаптивный — порой люди встают с постели и начинают ходить даже после самых тяжёлых заболеваний. Это свойство человеческого организма всегда вдохновляет учёных и даёт надежду на успех.
- AP
- © Molly Riley
— Какие ещё уникальные технологии, связанные с разработкой искусственных органов, есть в мире?
— Технологий множество, и все они продолжают совершенствоваться. Например, учёные хотят минимизировать эксперименты на животных и проводить внедрение и тестирование на лекарственных чипах в лаборатории. В этом случае они смотрят, какое лекарство лучше приживается в ткани.
В этом случае они смотрят, какое лекарство лучше приживается в ткани.
В своё время большой резонанс вызвало предложение исследования «лёгкого на чипе», когда была создана in vitro модельная система, где можно видеть, как развиваются несколько типов клеток и как они друг с другом взаимодействуют.
Что касается искусственного материала и клеточных структур, то в этом направлении тоже предложено множество уникальных методик. Например, касающихся организации такой сложной системы и контроля протекающего в ней каскада реакций.
Для успешного развития этой сферы нужно объединять в команды разноплановых специалистов: как я уже сказала, создание искусственных органов — междисциплинарная область. Так что очень важную роль играет взаимодействие между фундаментальной наукой и новыми технологиями, чтобы наработки активно внедрялись для лечения пациентов, а не оставались в лабораториях.
— В России сейчас дефицит донорских органов. Специалисты связывают это с неприятием в обществе идеи посмертного донорства. Смогут ли такую проблему решить искусственные органы?
Смогут ли такую проблему решить искусственные органы?
— Дефицит донорских органов — это огромная проблема во всём мире. Я думаю, что в ближайшем будущем сохранятся оба подхода: будет внедряться применение искусственных органов, но также сохранится и традиционная трансплантация. Но когда-нибудь обязательно получится полностью покрыть всю потребность в органах для имплантации. В частности, важную роль в спасении жизней продолжает играть посмертное донорство.
Производитель органов
Регистрация завершена За пределами лаборатории биомедицинская инженерия, Профессиональное развитиеСидя рядом с… Энтони Атала, директор Института регенеративной медицины Уэйк Форест, Уинстон-Салем, Северная Каролина, США.
Шарлотта Баркер |
Когда я был ребенком, в моей семье все еще был традиционный семейный врач. Он приходил на дом, когда кто-то из нас болел, и в то же время проверял остальных. Эти детские воспоминания о докторе, заботящемся не только о пациенте, но и о семье в целом, заставили меня сделать то же самое. Я по-прежнему принимаю пациентов и провожу операции параллельно с исследовательской деятельностью.
Эти детские воспоминания о докторе, заботящемся не только о пациенте, но и о семье в целом, заставили меня сделать то же самое. Я по-прежнему принимаю пациентов и провожу операции параллельно с исследовательской деятельностью.
Определенно. Это держит меня ближе к пациенту и его потребностям и вдохновляет меня работать еще усерднее, чтобы найти лучшие решения. Во время моего медицинского образования у меня фактически не было намерения заниматься исследованиями — я стал клиницистом-исследователем по счастливой случайности. Я подал заявку на участие в программе обучения в Детской больнице Гарвардской медицинской школы, где недавно добавили необязательный исследовательский компонент. Они дали мне выбор: следовать прямому клиническому пути или получить сочетание клинического и исследовательского опыта. Я просто хотел стать хирургом, но каким-то образом д-р Алан Ретик, председатель программы, убедил меня, что я должен попробовать себя в исследовательской сфере. Конечно, как только я начал заниматься исследованиями, мне это понравилось.
В то время исследовательская лаборатория только создавалась, так что у меня было больше свободы делать то, что я хотел, и это было попробовать вырастить человеческую ткань. Тканевая инженерия была в зачаточном состоянии, но в моей специальности определенно была клиническая потребность, и меня привлекал потенциал.
Это были ранние дни поля. Термин «регенеративная медицина» даже не был придуман. В то время было много проблем — прежде всего тот факт, что большинство нормальных человеческих клеток нельзя было выращивать вне тела. Потребовались годы, чтобы найти правильную комбинацию факторов для успешного культивирования клеток мочевыводящих путей.
Еще одной задачей была разработка биоматериалов, которые позволили бы использовать эти клетки у пациентов — каркасов, на которых клетки могут расти. Также сложной задачей было создание сосудистой сети в тканях, чтобы ткани выжили после имплантации. Это потребовало много работы, но к концу 1990-х годов мы впервые имплантировали выращенные в лаборатории мочевые пузыри пациентам.
Мы очень волновались, узнав, что подобная процедура не предпринималась ранее. Вы можете провести столько доклинических испытаний, сколько хотите, и вы должны показать в них безопасность и эффективность, но в конечном итоге вы должны испытать это на пациенте. Это был процесс обучения, поскольку мы продолжали имплантировать эти органы. Сейчас мы готовимся начать клинические испытания фазы III.
Начиная со сложного органа, такого как мочевой пузырь, полого нетрубчатого органа, мы могли быть более амбициозными в более поздних испытаниях — было относительно легко расширить его до более простых плоских или трубчатых структур, таких как кожа или кровеносные сосуды, как мы уже решили многие проблемы дизайна.
Шумиха никоим образом не уникальна для регенеративной медицины; когда делается какой-либо научный прорыв, люди склонны увлекаться и думать, что он будет доступен пациентам через год или два. Конечно, все мы знаем, что в любой области науки это не так, поэтому мы должны оставаться на земле. Научные открытия требуют времени, чтобы превратиться в терапию, а терапия требует времени, чтобы ее отрегулировать и протестировать. Как человек, который занимался переводом как в фундаментальной науке, так и в клинической части спектра, я считаю, что образование очень важно. Мы должны найти баланс; мы хотим быть достаточно энтузиазмом, чтобы иметь возможность продвигать разработку технологий, которые имеют потенциальную клиническую пользу, но умерить эти ожидания, когда дело доходит до их конечного успеха и сроков.
Научные открытия требуют времени, чтобы превратиться в терапию, а терапия требует времени, чтобы ее отрегулировать и протестировать. Как человек, который занимался переводом как в фундаментальной науке, так и в клинической части спектра, я считаю, что образование очень важно. Мы должны найти баланс; мы хотим быть достаточно энтузиазмом, чтобы иметь возможность продвигать разработку технологий, которые имеют потенциальную клиническую пользу, но умерить эти ожидания, когда дело доходит до их конечного успеха и сроков.
В наших клинических испытаниях мы всегда ждали, пока завершится пятилетнее наблюдение, и всегда на серии пациентов, а не на отчетах об отдельных случаях, прежде чем публиковать результаты. Это позволило нам узнать, что технология была надежной и эффективной в долгосрочной перспективе, прежде чем результаты были обнародованы.
Это потребовало много работы, но к концу 1990-х годов мы впервые имплантировали выращенные в лаборатории мочевые пузыри пациентам.
Абсолютно. За последние несколько десятилетий было сделано много достижений. В какой-то момент эта область считалась научной фантастикой. Люди действительно думали, что из культивируемых клеток невозможно создать ткани или органы. Теперь это научный факт — это не только возможно, но и воспроизводимо. Сконструированные ткани и органы используются в центрах по всему миру, и пациенты получают от этого пользу.
Здесь, в Уэйк Форест, мы сейчас работаем примерно с 30 различными тканями, 25 процентов из которых уже доставлены пациентам. Наша цель — увеличить этот процент и в конечном итоге помочь большему количеству пациентов с помощью этих технологий. Предстоит еще много работы, но я по-прежнему оптимистичен в отношении результатов для нашей области.
Электронная почта*
Выберите пароль
Я прочитал и понял Уведомление о конфиденциальности *
Когда вы нажмете «Подписаться», мы отправим вам по электронной почте ссылку, которую вы должны нажать, чтобы подтвердить адрес электронной почты, указанный выше, и активировать подписку.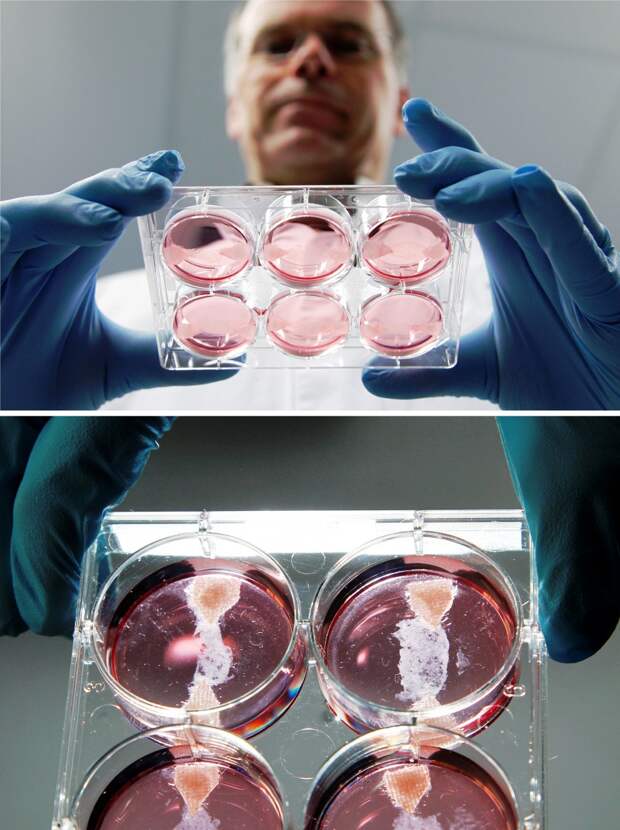 Если вы не получили это письмо, свяжитесь с нами по адресу
[электронная почта защищена].
Если вы не получили это письмо, свяжитесь с нами по адресу
[электронная почта защищена].
Если вы хотите отказаться от подписки, вы можете обновить свои настройки в любой момент.
«Как редактор The Translational Scientist, я тесно сотрудничаю с нашей аудиторией, чтобы создавать яркий, увлекательный контент, отражающий тяжелую работу и страсть, необходимые для вывода на рынок новых лекарств. Я начал заниматься биомедицинскими публикациями в качестве редактора медицинских журналов и посвятил свою карьеру всему, от исследований на ранних стадиях до клинической медицины, так что я хорошо разбираюсь в этом. И я не могу представить себе более интересную, сложную или важную область для работы».
Производители органов (Трилогия Макбрайда #2) Ричарда Ван Андерсона
Ричард Ван Андерсон
Оценить эту книгу
нравственное и гражданское право. Оставшись без подобия нормальной жизни — его семья, свобода и человечность лишены — он уходит в отставку, чтобы принять свою судьбу и столкнуться с любым грядущим наказанием. Но вскоре Дэвид Макбрайд оказывается в ловушке между противоборствующими силами — корпоративным шпионом, представляющим известную российскую биотехнологическую фирму, и человеком, пытающимся спасти жизнь своей дочери, — которые борются за контроль над технологиями изготовления органов, жизненно важными для роста человека. органов в лаборатории.
Но вскоре Дэвид Макбрайд оказывается в ловушке между противоборствующими силами — корпоративным шпионом, представляющим известную российскую биотехнологическую фирму, и человеком, пытающимся спасти жизнь своей дочери, — которые борются за контроль над технологиями изготовления органов, жизненно важными для роста человека. органов в лаборатории.
264 страницы, Kindle Edition
Опубликовано 14 декабря 2017 г.
Об авторе
Я бывший кардиохирург, ставший писателем-фантастом. Я пишу то, что можно назвать медицинскими детективами, медицинскими триллерами или медицинскими детективами, но я предпочитаю думать о них как о хирургических романах.
Что такое хирургическая приостановка? Хирурги, хирургические заболевания и операционная по своей сути драматичны. Как бывший хирург, я пережил эту драму на собственном опыте и подумал, что из нее получится хорошая фантастика. Моя хирургическая подготовка привела меня из «клуба ножей и оружия» Медицинского центра LSU в Шривпорте, штат Луизиана, в знаменитую больницу Белвью в Мидтауне Манхэттена. Мое писательское образование включает в себя степень магистра искусств в области творческого письма, где я был наставником Денниса Лихейна, автора бестселлеров New York Times, среди других опытных преподавателей.
Моя хирургическая подготовка привела меня из «клуба ножей и оружия» Медицинского центра LSU в Шривпорте, штат Луизиана, в знаменитую больницу Белвью в Мидтауне Манхэттена. Мое писательское образование включает в себя степень магистра искусств в области творческого письма, где я был наставником Денниса Лихейна, автора бестселлеров New York Times, среди других опытных преподавателей.
Я много знаю о медицине и хирургии, я много знаю о писательстве и рассказывании историй, и я считаю, что сочетание этого обширного и необычного опыта правого и левого полушарий сделает интересным чтение и обсуждение, поэтому, пожалуйста, заходите почаще.
Что ты думаешь?
Оценить книгу ⭐️⭐️⭐️.75(B+) Ричарда Ван Андерсона. Я решил просмотреть эту дилогию вместе, потому что я закончил слушать обе прежде, чем у меня появилась возможность просмотреть ее. Мне очень понравились эти книги и главный герой. Я и не подозревала, как часто я слушаю книги, в которых главный герой женского пола!! Эти оба следят за жизнью молодого доктора и этого бедолаги!!! В обеих этих книгах МНОГО медицинского жаргона, так что будьте готовы. Хорошо, что это не отвлекает от сюжета. Если вы этого не понимаете, это не повлияет на вашу способность понимать, что происходит в истории. Я медсестра, и это определенно выше моей зарплаты. Теперь нужно отдать должное рассказчику… отличная работа #joelrichards. Это первая его книга, которую я прослушала. Отличный рассказчик и 🙌🏼 с русским акцентом!! @playstermedia #richardvananderson #joelrichards #theorgangrowers #theorgantakers #playsteraudiobook
Хорошо, что это не отвлекает от сюжета. Если вы этого не понимаете, это не повлияет на вашу способность понимать, что происходит в истории. Я медсестра, и это определенно выше моей зарплаты. Теперь нужно отдать должное рассказчику… отличная работа #joelrichards. Это первая его книга, которую я прослушала. Отличный рассказчик и 🙌🏼 с русским акцентом!! @playstermedia #richardvananderson #joelrichards #theorgangrowers #theorgantakers #playsteraudiobook
19 апреля 2018 г.
Мне очень понравилось это продолжение The Organ Takers. Письмо так же хорошо, как и первая книга, и она была профессионально отредактирована. Я люблю цифровую книгу без грамматических ошибок! Одна из самых важных вещей для меня заключается в том, чтобы любая представленная наука была точной, и доктор Ван Андерсон, очевидно, сделал свою домашнюю работу. Область биоинженерии чрезвычайно сложна, но доктор Ван Андерсон ловко вплел ее в свою работу без мозгового разрушения научных кругов, которые могут убить хорошую историю. Персонажи хорошо проработаны, сюжет движется плавно. С нетерпением жду выхода третьего романа из этой серии 🙂
Персонажи хорошо проработаны, сюжет движется плавно. С нетерпением жду выхода третьего романа из этой серии 🙂
17 февраля 2018 г.
Книга вторая
Молодцы! Так часто вторая книга не всегда лучше последней в серии. Этот доставил. Много действий, оторваться невозможно! Дэвид Макбрайд начинает загладить свою вину. На этом книга могла бы закончиться, но что в этом было бы интересного? Отлично прочитано!! Не могу дождаться последней книги. Что будет дальше, какую жизнь он выберет? Что он будет делать?
24 февраля 2018 г.
Захватывающее дух действие
Эта книга захватила все мое внимание от корки до корки. Хотя многое из того, что делает Дэвид, можно интерпретировать как «плохое», в конце концов он поступает правильно, делясь знаниями с теми, кто может помочь другим, вместо того, чтобы позволять небольшой группе жадных людей играть в Бога и разбогатеть
Дебора
12 отзывов3 подписчика
Прочитано
20 апреля 2021Супер чтение!
Эта книга была очень захватывающей и стала отличным дополнением к первой. Там так много действия, и персонажи были и симпатичными, и правдоподобными. Даже плохие парни. Я бы порекомендовал эту книгу всем, кто интересуется медициной, особенно хирургией, и любит читать остросюжетные триллеры.
Там так много действия, и персонажи были и симпатичными, и правдоподобными. Даже плохие парни. Я бы порекомендовал эту книгу всем, кто интересуется медициной, особенно хирургией, и любит читать остросюжетные триллеры.
9 января 2018 г.
Медицинский Mayham!
Я был немного расстроен тем, что у первой книги не было концовки, но я хотел узнать, что произошло, поэтому я прочитал вторую книгу и не был разочарован. Это было действительно хорошее чтение. Я бы порекомендовал эту книгу всем, кто любит медицинские шестипенсовики.
19 декабря 2017 г.
Это действительно хороший сиквел, но он стоит особняком.
Цены для Kindle на обе книги очень выгодны на данный момент, поэтому, если вам нравится динамичный боевик, попробуйте их.
24 декабря 2017 г.
Увлекательный сюжет. Хорошее продолжение первой книги серии. Будьте готовы не сдаваться.
