Полный и частичный пузырный занос
Пузырный занос – патологическое состояние плодного яйца, при котором не происходит нормального развития эмбриона. Ворсины хориона преобразуются в пузырьки, содержащие жидкость, а хориальный эпителий начинает активно разрастаться.
Для того чтобы избежать опасных осложнений, очень важно своевременно диагностировать патологию и пройти курс лечения. Записаться на прием к врачу можно по телефону, указанному на сайте, или воспользовавшись кнопкой записи.
Размеры пузырьков постепенно увеличиваются, достигая 2,5 см. Внешне такие цисты, заполненные желтоватым содержимым, напоминают виноградные гроздья. В большинстве случаев сосуды в них атрофируются, хотя в редких случаях обнаруживаются капилляры в малом количестве. Синцитий – ткань, являющаяся оболочкой пузырьков, начинает разрастаться и с помощью ферментов понемногу расплавлять децидуальную оболочку (именно так называется претерпевший определенные изменения в связи с беременностью функциональный слой эндометрия).
Классификация пузырного заноса
Существует несколько классификаций пузырного заноса. В основе одной из них лежит степень гиперплазии (разрастания) и анаплазии (утраты клетками своих свойств и возвращения к недифференцированным формам, что является предвестником их злокачественного перерождения) хориального эпителия. Согласно этой классификации выделяют следующие виды пузырных заносов:
- Доброкачественный — в данном случае имеет место небольшая гиперплазия, анаплазия отсутствует
- Потенциально злокачественный – гиперплазия и анаплазия выражены в умеренной степени
- Злокачественный – гиперплазия и анаплазия выражены в значительной степени
Также выделяют полный и частичный пузырный занос.
Полный пузырный занос
Полный пузырный занос характеризуется тем, что все ворсины хориона трансформируются в пузырьки. Эта патология развивается в 1 триместре беременности, когда весь хорион покрыт ворсинами.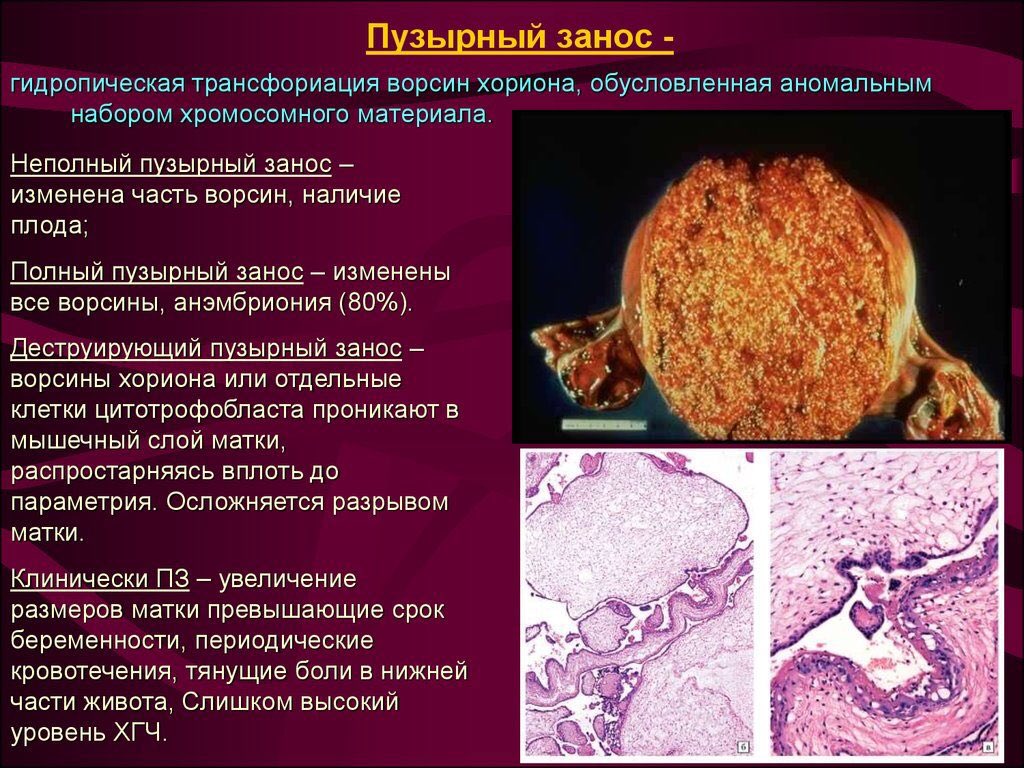 Происходит гибель эмбриона, который затем рассасывается.
Происходит гибель эмбриона, который затем рассасывается.
При исследовании полного пузырного заноса в большинстве случаев выявляется кариотип 46ХХ, при этом обе Х-хромосомы являются отцовскими. Такая ситуация возможна в том случае, если ооцит содержит поврежденное ядро или не имеет ядра вовсе. После оплодотворения происходит удвоение отцовского набора хромосом. Значительно реже (в среднем до 10% случаев) полный пузырный занос содержит хромосомный набор 46XY, все хромосомы также являются отцовскими.
При полном пузырном заносе матка увеличивается в большей степени, нежели это должно быть в норме на ранних соках беременности.
Частичный пузырный занос

При частичном пузырном заносе чаще всего выявляется триплоидный набор хромосом (69.XXY, 69.XXX, 69.XYY), где присутствует диплоидный набор хромосом отца и гаплоидный набор хромосом матери.
Размер матки обычно меньше или соответствует сроку гестации.
Если у Вас возникли какие-либо вопросы, связанные с полным и частичным пузырным заносом, вы можете задать их врачам Нова Клиник. Записаться на прием к врачу можно по телефону, указанному на сайте, или воспользовавшись кнопкой записи.
Причины
На сегодняшний день определить причины патологии ученым пока не удалось, однако можно выделить ряд факторов риска. Так, вероятность молярной беременности выше, если:
- в прошлом уже был диагностирован пузырный занос;
- возраст беременной менее 15 или более 40 лет;
- в анамнезе присутствуют случаи спонтанного или искусственного прерывания беременности.

Кроме того, следует отметить, что пузырный занос чаще всего выявляется в Латинской Америке и Азии.
Симптомы
Поскольку пузырный занос влечет за собой опасные последствия, женщине необходимо обратить самое пристальное внимание на такие симптомы, как:
- кровянистые выделения из половых путей. Маточные кровотечения имеют место в 9 из 10 случаев молярной беременности;
- значительное увеличение размеров живота, не соответствующее сроку беременности;
- болевые ощущения в нижней части живота;
- тошнота и эпизоды рвоты;
- усиленное слюноотделение;
- отеки;
- слабость.
Если вы отметили у себя эти признаки, незамедлительно запишитесь на прием к вашему акушеру-гинекологу, чтобы доктор провел обследование и своевременно принял необходимые меры.
Диагностика
Чтобы выявить пузырный занос, врач назначает:
- анализ крови на определение уровня β-ХГЧ (бета-субъединицы хорионического гонадотропина человека).
 При молярной беременности результаты заметно превышают нормы для определенного срока. Кроме того, в динамике наблюдается значительное ежедневное увеличение концентрации гормона. Поскольку аналогичная ситуация характерна для многоплодной беременности, назначается ультразвуковое исследование;
При молярной беременности результаты заметно превышают нормы для определенного срока. Кроме того, в динамике наблюдается значительное ежедневное увеличение концентрации гормона. Поскольку аналогичная ситуация характерна для многоплодной беременности, назначается ультразвуковое исследование; - УЗИ органов малого таза. На экране монитора доктор видит значительно разросшиеся ворсины хориона, которые визуально напоминают виноградные гроздья. При частичном пузырном заносе визуализируются отдельные очаги отекших ворсин хориона.
В некоторых случаях дополнительно могут быть назначены гистероскопия, лапароскопия, КТ или МРТ.
Лечение и возможные осложнения
Беременность прерывают в любом случае.
Очень важно правильно осуществить полную эвакуацию пузырного заноса. Обычно с этой целью проводится вакуум-аспирация содержимого полости матки с последующим контрольным выскабливанием.
Окончательный диагноз с указанием вида пузырного заноса ставят только на основании проведенного гистологического исследования материала.
После хирургического вмешательства женщине нужно будет несколько раз сдать анализ крови на определение уровня β-ХГЧ до получения трех отрицательных результатов подряд. Если пузырный занос не удален полностью, то оставшиеся в полости матки ворсины продолжают продуцировать гормон. В этом случае в динамике исследования будут демонстрировать повышенный уровень и дальнейшее увеличение концентрации хорионического гонадотропина.
Кроме того, женщина:
- сразу после оперативного вмешательства, а также спустя 1 и 2 месяца делает рентген легких;
- на протяжении полугода ежемесячно продолжает сдавать анализы на ХГЧ и делать УЗИ органов малого таза.
К осложнениям, которые могут развиваться вследствие пузырного заноса, относят:
- образование злокачественной опухоли трофобласта;
- полное прекращение менструаций;
- бесплодие;
- инфекционно-воспалительные процессы в полости матки.

Своевременное обращение к врачу и адекватное лечение позволяют сохранить репродуктивное здоровье женщины.
Беременность после пузырного заноса
На протяжении года после эвакуации пузырного заноса требуется применение средств контрацепции. При этом до момента получения отрицательных результатов ХГЧ нужно использовать презервативы. В дальнейшем женщина может перейти на КОК. Следует обратить внимание на то, что установка внутриматочной спирали запрещена.
При отсутствии осложнений начать планировать беременность под наблюдением опытного акушера-гинеколога можно через год.
|
!
Пузырный занос — состояние, сопровождающееся пролиферацией трофобласта (наружный слой клеток эмбриона, участвует в имплантации зародыша в стенку матки и образовании плаценты), заполняющего полость матки. Частота. В США 1 случай пузырного заноса приходится на 1200 беременностей, в странах Дальнего Востока — 1 случай на 120 беременностей. В России — 1 случай на 820-3000 родовЭтиология  Иногда (5%) полный пузырный занос вызван оплодотворением пустой (безъядерной) яйцеклетки двумя сперматозоидами, приводящим к кариотипу 46,XY или 46,XX. Эмбрион погибает на ранних стадиях развития, до установления плацентарного кровообращения Иногда (5%) полный пузырный занос вызван оплодотворением пустой (безъядерной) яйцеклетки двумя сперматозоидами, приводящим к кариотипу 46,XY или 46,XX. Эмбрион погибает на ранних стадиях развития, до установления плацентарного кровообращения Патоморфология 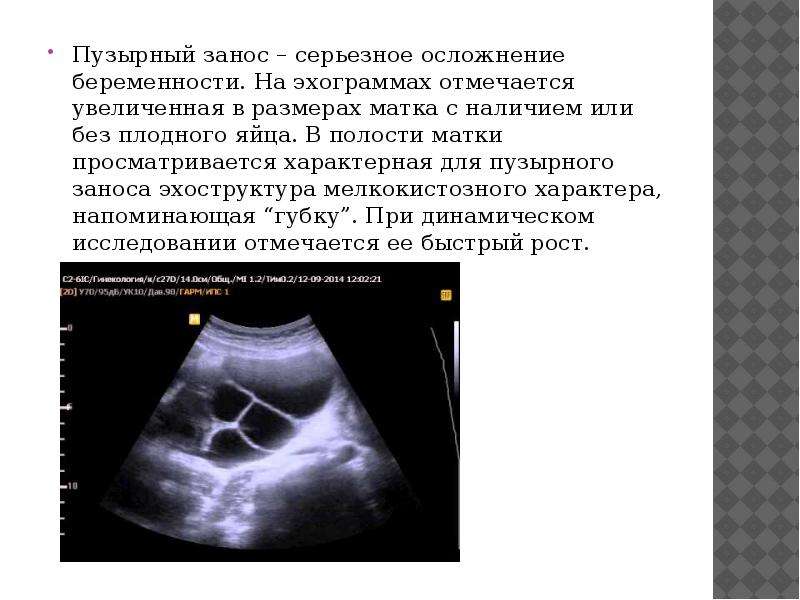 Клиническая картина Диагностика 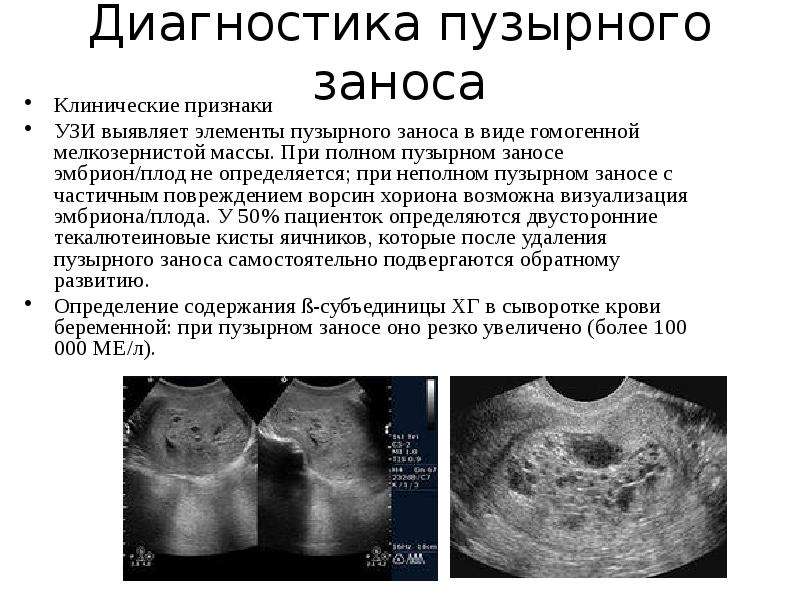 ЛЕЧЕНИЕ  Наблюдение. Время полной элиминации ХГТ (в среднем — 73 дня) зависит от исходной концентрации ХГТ, количества жизнеспособной ткани трофобласта, оставшейся после вакуум-аспирации, и периода полураспада ХГТ. Наблюдение за пациентками после удаления пузырного заноса включает ряд мероприятий Осложнения  Профилактика Синонимы
|
Осложнение беременности: пузырный занос | Passion.ru
Пузырный занос — это редкая разновидность осложнения беременности, которая происходит в процессе оплодотворения с отклонениями. Отклонения приводят к неправильному развитию клеток плаценты. Пузырный занос — это заболевание из области «трофобластичеких опухолей». Такие опухоли не являются раковыми, они доброкачественные и вполне поддаются лечению.
Отклонения приводят к неправильному развитию клеток плаценты. Пузырный занос — это заболевание из области «трофобластичеких опухолей». Такие опухоли не являются раковыми, они доброкачественные и вполне поддаются лечению.
При нормальной беременности оплодотворенная яйцеклетка содержит 23 отцовских и 23 материнских хромосомы. Для полного пузырного заноса характерна оплодотворенная яйцеклетка без материнских хромосом вообще, в то время как хромосомы отцовской спермы вдвое превышают допустимое количество, и в итоге яйцеклетка содержит два комплекта отцовских хромосом вместо двух разных: отцовских и материнских.
В этом случае эмбрион не развивается, нет плодного пузыря и нормальной ткани плаценты. Плацента продолжает формироваться, но в виде наростов, наподобие грозди. Такое отклонение в формировании отлично видно на мониторе УЗИ.
При неполной форме пузырного заноса в оплодотворенной яйцеклетке содержится стандартный набор материнских хромосом и два набора отцовских хромосом. В оплодотворенной яйцеклетке имеется 69 хромосом, а не 46, как положено при нормальном развитии событий. Это может случиться при дублировании хромосом спермы или же при оплодотворении яйцеклетки двумя сперматозоидами.
В оплодотворенной яйцеклетке имеется 69 хромосом, а не 46, как положено при нормальном развитии событий. Это может случиться при дублировании хромосом спермы или же при оплодотворении яйцеклетки двумя сперматозоидами.
Неполный пузырный занос формируется с частично нормальной тканью плаценты одновременно с кистообразной плацентарной структурой. Эмбрион с околоплодным мешком также продолжают развиваться. Несмотря на присутствие эмбриона, а также на его развитие, нужно иметь в виду то, что он генетически не соответствует плоду, не является ребенком.
Тяжело осознать потерю беременности при таких условиях, но если состоять на своевременном лечении и наблюдении у врача, развитие патологий, связанных с этим отклонением, в дальнейшем будет исключено.
Какова вероятность пузырного заноса при зачатии?
Одна на две тысячи беременностей может сопровождаться пузырным заносом.
Как определить наличие пузырного заноса?
Какое-то время беременность по всем признакам ничем не отличается от нормальной, но в какой-то момент начинаются небольшие кровянистые выделения или кровотечение. Кровянистые выделения нельзя однозначно считать патологией, они лишь в крайних случаях свидетельствуют о пузырном заносе, но в любом случае предпочтительнее проконсультироваться с врачом.
Кровянистые выделения нельзя однозначно считать патологией, они лишь в крайних случаях свидетельствуют о пузырном заносе, но в любом случае предпочтительнее проконсультироваться с врачом.
По характеру кровотечения ничего конкретно установить невозможно: кровь может быть и яркого, и темного оттенка, выделения могут быть и слабыми, и обильными, могут продолжаться постоянно или случаться время от времени. Кровотечение может дать о себе знать на шестой неделе беременности, а может произойти и на шестнадцатой.
Вы можете испытывать тошноту и рвоту, ваш живот вздувается, если это пузырный занос, матка растет в несколько раз быстрее, чем при обычной беременности. Хорионический гонадотропин в крови также возрастает значительно интенсивнее, чем во время нормальной беременности.
Полная форма пузырного заноса прекрасно отображается на УЗИ. Диагноз подтверждается анализом ХГЧ в крови, превышающим нормальные значения. Что касается неполной формы пузырного заноса, ее определить не так просто.
Ольга
Ольга
Мы встречались 4,5 года, и решение пожениться было взвешенное и обдуманное. У нас были общие цели, и мы мечтали стать родителями.
И после свадьбы началась наша борьба. Дорогие врачи, анализы, тесты, народные методы — ничего не получалось. Врачи говорили, что все хорошо, пробуйте! Это длилось 3 года. Усталость, недопонимание, разлад в семье, скандалы, в какой-то момент опустились руки, и, вдруг, вторая еле-еле заметная полоска на тесте. Мы разглядывали и не верили, что это происходит с нами!
Сдала кровь на ХГЧ. Он слишком мал, чтобы делать УЗИ. Ждала неделю, которая показалась вечностью. На мониторе я увидела маленькую горошенку! Счастье, смех и слезы, вот оно счастье! На 8 неделе на экране УЗИ я увидела ручки, ножки и, самое главное, как колышется крохотное сердечко! Очень странные чувства и счастья, и страха — все в перемешку, ведь скоро я стану МАМОЙ! Ну а дальше начались прелести. Сказать, что начался токсикоз — ничего не сказать. Я не могла доехать до работы, меня полоскало (уж простите за откровения), ничего не могла есть (гречку до сих пор не люблю). Я ходила зеленая и еле доползала до кровати. Теряла в весе.
Я не могла доехать до работы, меня полоскало (уж простите за откровения), ничего не могла есть (гречку до сих пор не люблю). Я ходила зеленая и еле доползала до кровати. Теряла в весе.
В 12 недель первый скрининг, т.к. у нас по направлению ждать результат месяц, то я по совету сестры (спасибо ей огромное) сделала в платной клинике, пожаловалась на токсикоз, выписали таблетки, которые не помогли вообще. Через неделю мне позвонили и сказали приезжать, так как анализ оказался плохим. У меня сердце сжалось, 2 дня в слезах, поехали в клинику, по анализу расчет скрининга невозможен в связи с запредельным значением ХГЧ. Направили к генетику. В голове туман, смутно помню, что она рассказывала про прокол, про риски, про толщину хориона, про пузыри вокруг эмбриона. Прошли УЗИ, и врач сразу сообщает: «Беременность замерла, подозрение на пузырный занос», смотреть не стала. Уже был поздний вечер, роддом был закрыт на мойку, ночью приехали в платный госпиталь, часа 3 меня осматривали: ЭКГ, МСКТ, анализы, УЗИ (сама попросила, решилась и увидела, что сердечко молчит). Всю ночь прорыдала, приходили врачи, анестезиолог, хирург. На момент поступления ХГЧ был 1221747 мМЕд/мл, врачи округляли глаза, а мне становилось все страшнее. По сроку было 13-14 недель, матка увеличена да 16 недель (потом я узнала, что на таком сроке при моем диагнозе делают кесарево, но мой гинеколог уговорила хирурга, и она рискнула на чистку).
Всю ночь прорыдала, приходили врачи, анестезиолог, хирург. На момент поступления ХГЧ был 1221747 мМЕд/мл, врачи округляли глаза, а мне становилось все страшнее. По сроку было 13-14 недель, матка увеличена да 16 недель (потом я узнала, что на таком сроке при моем диагнозе делают кесарево, но мой гинеколог уговорила хирурга, и она рискнула на чистку).
Пошла на операцию, до сих по в ушах звенят слова хирурга «с Богом», которые я услышала, «проваливаясь в сон». Восстановление было долгим, сначала раз в неделю, а потом и раз в месяц в течение года сдавала кровь на ХГЧ — падал медленно, но все обошлось. Гистология подтвердила диагноз «пузырный занос» — это доброкачественная опухоль, которую можно удалить без последствий. Долгое время мучал вопрос «Почему?», врачи в один голос отвечали «нет ответа, просто так карта легла, так звезды встали, изначально сбой произошёл».
Первым признаком был сильнейший токсикоз, и я похудела на 10 кг. Спустя год произошла задержка, ХГЧ 13, через день удвоился. УЗИ рано, и врач говорит, что, скорее всего, беременность. Приезжаю домой, у меня пошла кровь. Позвонила врачу, она назначила кровоостанавливающее — не помогло, сдала ХГЧ, упал до 5! Врач сказала, что это химическая беременность (оплодотворение произошло, а плодное яйцо не прикрепилось к матке, и она вытолкнула его с менструацией).
УЗИ рано, и врач говорит, что, скорее всего, беременность. Приезжаю домой, у меня пошла кровь. Позвонила врачу, она назначила кровоостанавливающее — не помогло, сдала ХГЧ, упал до 5! Врач сказала, что это химическая беременность (оплодотворение произошло, а плодное яйцо не прикрепилось к матке, и она вытолкнула его с менструацией).
Снова опустились руки, муж в растерянности. Через 2 месяца задержка, делаю тест: две полоски. Эмоций никаких, сдаю анализы: ХГЧ повышен, на УЗИ плодное яйцо только опустилось. Мы с мужем без эмоций и уже в ожидании провала. Каждое УЗИ на сильных нервах, и было потерянное состояние до 20 недель, пока не почувствовала свою малышку! Всю беременность на нервах, руки тряслись. В коридоре встретила хирурга, она потом звонила и спрашивала, как беременность проходит. А запомнила она меня по диагнозу, т.к. он очень редкий. Спасибо врачам, к которым я попала в руки: если бы не их решимость и знания, не стала бы я сейчас мамой!
Девочки, берегите себя, слушайте врачей, не жалейте денег! Главное все вовремя увидеть, ведь медицина развивается, и что-то уже могут исправлять! С дочкой о таком тестеPrenetix не слышала, но обязательно сделала бы, уж очень живы воспоминания о сынишке, которого всем сердцем люблю, хоть и не видела никогда.
Пузырный занос — это… Что такое Пузырный занос?
Пузырный занос — это продукт зачатия, при котором не происходит нормального развития эмбриона, а ворсины плаценты разрастаются в виде пузырей, наполненных жидкостью.
Механизм
Пузырный занос бывает полным, при котором отсутствуют ткани эмбриона, и неполным, при котором эмбрион или его отдельные элементы присутствуют. Полный пузырный занос наблюдается вследствие оплодотворения дефектной яйцеклетки, не имеющей хромосом. В процессе дальнейшего деления отцовские хромосомы удваиваются, однако такая зигота является нежизнеспособной, так как эмбриона не образуется, и происходит только рост ворсин. Неполный пузырный занос образуется в связи с оплодотворением яйцеклетки двумя сперматозоидами, поэтому клетки в этом случае содержат большое количество дополнительных хромосом, что также делает продукт зачатия нежизнеспособным. Ткань пузырного заноса вырабатывает большое количество хорионического гонадотропина, который приводит к образованию в яичниках лютеиновых кист.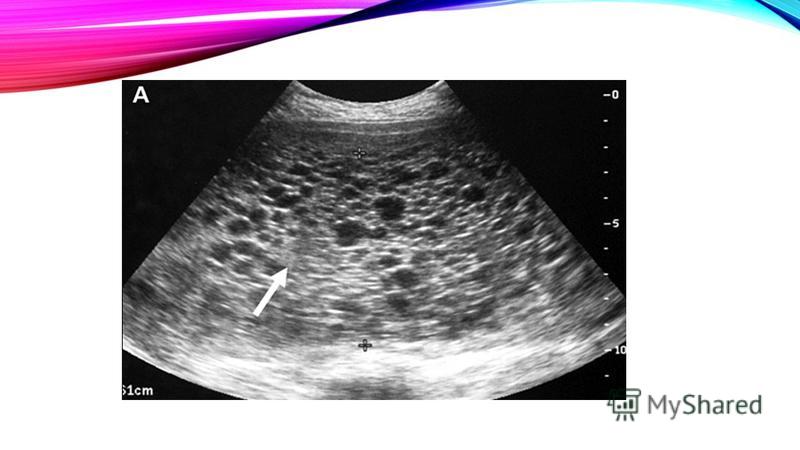 В 15-20 % случаев пузырный занос трансформируется в хорионэпителиому — злокачественная опухоль, то есть внедряется в здоровые ткани и дает метастазы.
В 15-20 % случаев пузырный занос трансформируется в хорионэпителиому — злокачественная опухоль, то есть внедряется в здоровые ткани и дает метастазы.
Частота встречаемости
Статистические показатели частоты пузырного заноса в разных странах варьируют от 1 случая на 100 беременностей до 1 на 5000. Около 80 % всех случаев составляет полный пузырный занос. У женщин после 35 лет пузырный занос встречается чаще.
Симптомы
Течение пузырного заноса на ранних стадиях мало чем отличается от обычной беременности. Могут быть более выражены тошнота и рвота. Увеличение размера матки наблюдается быстрее, чем при нормальной беременности. По мере прогрессирования пузырного заноса может развиться осложнение, сопровождающееся повышением артериального давления, отеками, протеинурией, мозговыми симптомами — преэклампсия. Маточное кровотечение может появиться на любом этапе развития пузырного заноса и иногда бывает обильным. Прорастание стенки матки может сопровождаться острыми болями в животе. При метастазировании в лёгкие появляется кашель, может быть кровохарканье. При метастазах в головной мозг развиваются головные боли и неврологические симптомы.
При метастазировании в лёгкие появляется кашель, может быть кровохарканье. При метастазах в головной мозг развиваются головные боли и неврологические симптомы.
Диагностика
Диагноз пузырного заноса устанавливается при ультразвуковом исследовании. Вместо нормальной структуры плодного яйца обнаруживается пестрая картина, получившая название «снежной бури». В яичниках определяются лютеиновые кисты. При исследовании ХГЧ отмечается высокий его уровень, иногда многократно превышающий уровень при нормальной беременности.
Лечение
Лечением пузырного заноса является его удаление. Эта процедура проводится путем расширения шейки матки, вакуум-аспирации содержимого матки и кюретажа. После удаления пузырного заноса рекомендуется еженедельное определение уровня ХГЧ до тех пор, пока он не снизится примерно до 100 мМЕ/мл, после чего продолжают определение ХГЧ каждый месяц в течение 6 месяцев. Если не происходит снижения ХГЧ или после периода снижения отмечается повышение его уровня, заболевание расценивают, как злокачественное, и назначают химиотерапию. Излечимость пузырного заноса составляет практически 100 %.
Излечимость пузырного заноса составляет практически 100 %.
См. также
Ссылки
| Патология беременности, родов и послеродового периода (МКБ-10 класс XV, О00-О99) | |
|---|---|
| Беременность | |
| Роды Патологический прелиминарный период • Первичная слабость родовой деятельности • Вторичная слабость родовой деятельности • Стремительные роды • Дискоординированная родовая деятельность | |
| Акушерские кровотечения • Преждевременная отслойка нормально расположенной плаценты (ПОНРП) • ДВС-синдром в акушерстве • Эмболия околоплодными водами • Матка Кювелера | |
| Материнский травматизм | Разрывы промежности • Гематомы • Разрывы шейки матки • Разрыв матки • Выворот матки |
и новорождённого
симптомы, причины, диагностика и лечение пузырного заноса
Пузырный занос (ПЗ) — это состояние, сопровождающееся пролиферацией трофобласта (наружный слой клеток эмбриона участвует в имплантации зародыша в стенку матки и образовании плаценты), заполняющего полость матки. Представляет собой гидропическое перерождение ворсин хориона, которые превращаются в гроздевидные образования, состоящие из прозрачных пузырьков, напоминающих кисти винограда. Диаметр пузырьков редко превышает 25 мм, они наполнены опалесцирующей или желтоватой жидкостью, в которой можно определить аминокислоты, альбумины и глобулины, хорионический гонадотропин.
ПЗ по степени распространенности может быть полным (классическим) или неполным (частичным). При полном ПЗ изменения захватывают весь хорион, при частичном — только его часть. Кроме того, выделяют злокачественную форму пузырного заноса — деструирующий ПЗ. При микроскопическом исследовании ПЗ выявляют пролиферацию клеток трофобласта и гидропическую дегенерацию стромы ворсин.
Пузырьки заноса покрыты хориальным эпителием, состоящим из клеток Лангганса и синцития. По мере разрастания пузырьков хориальный эпителий атрофируется, последовательность расположения слоев клеток нарушается. Отмечается гиперплазия хориального эпителия в виде скопления синтицитиальных клеток.
Представляет собой гидропическое перерождение ворсин хориона, которые превращаются в гроздевидные образования, состоящие из прозрачных пузырьков, напоминающих кисти винограда. Диаметр пузырьков редко превышает 25 мм, они наполнены опалесцирующей или желтоватой жидкостью, в которой можно определить аминокислоты, альбумины и глобулины, хорионический гонадотропин.
ПЗ по степени распространенности может быть полным (классическим) или неполным (частичным). При полном ПЗ изменения захватывают весь хорион, при частичном — только его часть. Кроме того, выделяют злокачественную форму пузырного заноса — деструирующий ПЗ. При микроскопическом исследовании ПЗ выявляют пролиферацию клеток трофобласта и гидропическую дегенерацию стромы ворсин.
Пузырьки заноса покрыты хориальным эпителием, состоящим из клеток Лангганса и синцития. По мере разрастания пузырьков хориальный эпителий атрофируется, последовательность расположения слоев клеток нарушается. Отмечается гиперплазия хориального эпителия в виде скопления синтицитиальных клеток. В ворсинках кровеносные сосуды отсутствуют. Строма ворсин представляет собой набухшие и разрушенные коллагеновые волокна. Деструирующий пузырный занос характеризуется интенсивной пролиферацией хориального эпителия, его анаплазией, отеком стромы ворсин. При этой форме заболевания ткани опухоли глубоко прорастают в миометрий, разрушая его и врастая в венозные сосуды. Опухоль может выходить за пределы матки, распространяясь в широкую связку матки, мочевой пузырь, брюшную полость. Наиболее частый вариант ПЗ — однородительская дисомия, когда по неизвестным причинам происходит потеря материнских генов и дублирование отцовского гаплоидного генома (46ХХ хромосомный набор, обе хромосомы — отцовские). В 3-13% встречается 46ХУ комбинация, все хромосомы — отцовские. Эмбрион погибает на ранних стадиях развития, до установления плацентарного кровообращения. Также ПЗ может быть вызван триплоидией в результате оплодотворения яйцеклетки двумя сперматозоидами (диспермия) с задержкой гаплоидного набора материнских хромосом.
В ворсинках кровеносные сосуды отсутствуют. Строма ворсин представляет собой набухшие и разрушенные коллагеновые волокна. Деструирующий пузырный занос характеризуется интенсивной пролиферацией хориального эпителия, его анаплазией, отеком стромы ворсин. При этой форме заболевания ткани опухоли глубоко прорастают в миометрий, разрушая его и врастая в венозные сосуды. Опухоль может выходить за пределы матки, распространяясь в широкую связку матки, мочевой пузырь, брюшную полость. Наиболее частый вариант ПЗ — однородительская дисомия, когда по неизвестным причинам происходит потеря материнских генов и дублирование отцовского гаплоидного генома (46ХХ хромосомный набор, обе хромосомы — отцовские). В 3-13% встречается 46ХУ комбинация, все хромосомы — отцовские. Эмбрион погибает на ранних стадиях развития, до установления плацентарного кровообращения. Также ПЗ может быть вызван триплоидией в результате оплодотворения яйцеклетки двумя сперматозоидами (диспермия) с задержкой гаплоидного набора материнских хромосом. Клетки концептуса содержат один гаплоидный набор материнских хромосом и диплоидный набор отцовских хромосом — кариотип может быть 69XXY, 69ХХХ или 69XYY.
Клетки концептуса содержат один гаплоидный набор материнских хромосом и диплоидный набор отцовских хромосом — кариотип может быть 69XXY, 69ХХХ или 69XYY.
Расскажите, какие возможные последствия для женщины имеет пузырный занос? Что делать женщине? Какие лечебные мероприятия применяются?
К счастью, сегодня возможности ультразвуковой диагностики возросли в разы. Диагноз пузырного заноса не представляет сложность для любого специалиста ультразвуковой диагностики. Если пациентка вдруг поняла, что она беременная, гормон гонадотропин позволяет это ощутить, все симптомы беременности имеют место быть: и тошнота, и наличие лёгкого токсикоза, задержка месячных или нарушение цикла. Конечно, пациентка первым делом думает, что она беременная и идёт гинекологу. Вторым этапом является УЗИ-диагностика после двуручного гинекологического обследования, обязательно выполняется УЗИ диагностика. Как правило, при ультразвуковой диагностике доктор может видеть полный пузырный занос – элементы плода отсутствуют, хорошо визуализируется пузырьковая масса, которая сразу дает возможность поставить диагноз.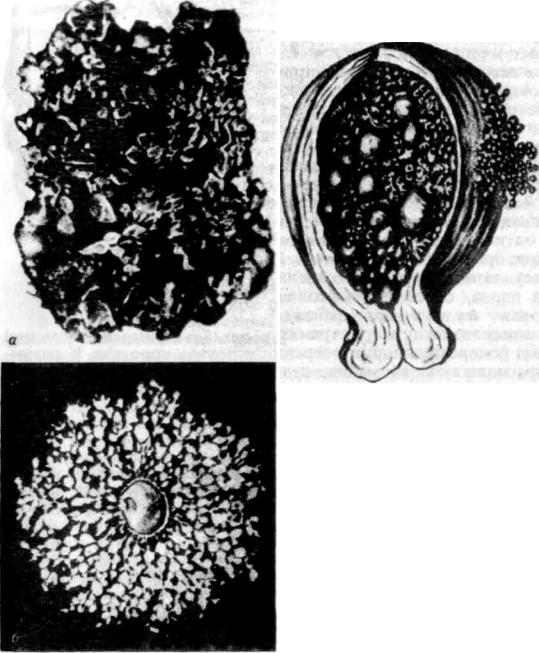
– То есть, не нужен какой-то суперспециалист по ультразвуку.
Немножко сложнее обстоит дело с частичными пузырными заносами. На малых сроках беременности они никак не выглядят, выглядят как замершая беременность. Поскольку все пациентки и с полными, и с частичными заносами, или просто с замершей беременностью, должны тактически в дальнейшем подвергаться выскабливанию полости матки, то следующим этапом диагноза является диагностическое выскабливание. Если доктор ставит диагноз пузырный занос, то, конечно, оптимальным вариантом является эвакуация пузырного заноса с помощью вакуумного эвакуатора с дальнейшим контрольным кюретажем, желательно под контролем ультразвукового аппарата или гистероскопии, чтобы не травмировать стенки полости матки. Это важно.
Что касается замершей беременности, не развивающейся беременности, то делается обычный аборт. Весь морфологический материал должен быть исследован. Если морфологически подтверждается, что у пациентки был пузырный занос, то пациенты в дальнейшем направляются к онкологу, где им рекомендуется осуществлять динамический контроль за уровнем ХГЧ, который должен показать положительную динамику, то есть, снижение маркера. Если уровень ХГЧ не снижается в какой-то момент, то пациентка, как правило, направляется в онкологический центр. У нас есть специальный кабинет в поликлинике, куда приезжают все пациенты, живущие в городе Москве и во всей России. У кого есть желание приехать на консультацию, приезжают сюда. Они привозят свои гистологические препараты, мы выполняем ультразвуковое исследование у наших высококлассных специалистов и даем рекомендации, что им делать дальше. Если ХГЧ достаточно высокий, мы обязательно выполняем рентген легких или компьютерную томографию, которая показывает наличие или отсутствие метастазов в легких, после уже мы даем рекомендации по лечению.
Если уровень ХГЧ не снижается в какой-то момент, то пациентка, как правило, направляется в онкологический центр. У нас есть специальный кабинет в поликлинике, куда приезжают все пациенты, живущие в городе Москве и во всей России. У кого есть желание приехать на консультацию, приезжают сюда. Они привозят свои гистологические препараты, мы выполняем ультразвуковое исследование у наших высококлассных специалистов и даем рекомендации, что им делать дальше. Если ХГЧ достаточно высокий, мы обязательно выполняем рентген легких или компьютерную томографию, которая показывает наличие или отсутствие метастазов в легких, после уже мы даем рекомендации по лечению.
– То есть, в принципе, лечение пузырного заноса не представляет сложностей для гинекологов, является обычной рутинной практикой.
В норме обычно 80% пациенток, перенесших полный пузырный занос, излечивается после выскабливания. У 20% больных, то есть, каждая пятая пациентка, потенциально имеет риск развития злокачественной формы опухоли. После частичного пузырного заноса риск такой существует у 7-10% больных. Если раньше считалось, что никогда не бывает злокачественных форм после частичного пузырного заноса, то сегодня уже давно доказанный факт, что тоже бывает. Поэтому у пациенток должен вестись активный мониторинг уровня ХГЧ еженедельно до нормы 5 единиц. При благоприятном течении он должен нормализоваться в течение, максимум, 2-х месяцев. Иногда допустимо несколько дольше наблюдать, если продолжается снижение уровня ХГЧ. Как только он прекратил снижаться или начал расти, это первые признаки появления малигнизации элементов пузырного заноса, больная нуждается в специализированном лечении.
После частичного пузырного заноса риск такой существует у 7-10% больных. Если раньше считалось, что никогда не бывает злокачественных форм после частичного пузырного заноса, то сегодня уже давно доказанный факт, что тоже бывает. Поэтому у пациенток должен вестись активный мониторинг уровня ХГЧ еженедельно до нормы 5 единиц. При благоприятном течении он должен нормализоваться в течение, максимум, 2-х месяцев. Иногда допустимо несколько дольше наблюдать, если продолжается снижение уровня ХГЧ. Как только он прекратил снижаться или начал расти, это первые признаки появления малигнизации элементов пузырного заноса, больная нуждается в специализированном лечении.
О муковисцидозе | CF Foundation
Муковисцидоз — это прогрессирующее генетическое заболевание, которое вызывает стойкие инфекции легких и со временем ограничивает способность дышать.
У людей с МВ мутации в гене трансмембранного регулятора проводимости муковисцидоза (CFTR) приводят к нарушению функции белка CFTR.Когда белок работает неправильно, он не может помочь переместить хлорид — компонент соли — на поверхность клетки. Без хлорида, притягивающего воду к поверхности клетки, слизь в различных органах становится густой и липкой.
В легких слизь закупоривает дыхательные пути и улавливает микробы, такие как бактерии, что приводит к инфекциям, воспалениям, дыхательной недостаточности и другим осложнениям. По этой причине сведение к минимуму контакта с микробами является главной заботой людей с МВ.
В поджелудочной железе накопление слизи предотвращает высвобождение пищеварительных ферментов, которые помогают организму усваивать
пища и основные питательные вещества, что приводит к недоеданию и плохому росту. В печени густая слизь может блокировать желчный проток, в результате чего печень
болезнь. У мужчин CF может повлиять на их способность иметь детей.
В печени густая слизь может блокировать желчный проток, в результате чего печень
болезнь. У мужчин CF может повлиять на их способность иметь детей.
Симптомы CF
Люди с CF могут иметь различные симптомы, в том числе:
- Кожа с очень соленым привкусом
- Постоянный кашель, иногда с мокротой
- Частые легочные инфекции, включая пневмонию или бронхит
- Свистящее дыхание или затрудненное дыхание
- Плохой рост или прибавка в весе, несмотря на хороший аппетит
- Частый жирный, объемный стул или затрудненное опорожнение кишечника
- Мужское бесплодие
Джей, 6 лет с CF
Послушайте объяснения клиницистов CF:
- Какие части тела поражены CF
- Общие симптомы МВ
- Как лечить CF
Муковисцидоз — это генетическое заболевание. Люди с CF унаследовали две копии дефектного гена CF — по одной от каждого родителя. У обоих родителей должна быть хотя бы одна копия дефектного гена.
Люди с CF унаследовали две копии дефектного гена CF — по одной от каждого родителя. У обоих родителей должна быть хотя бы одна копия дефектного гена.
Людей, у которых есть только одна копия дефектного гена CF, называют носителями, но они не болеют. Каждый раз, когда у двух носителей CF появляется ребенок, вероятность:
- 25 процентов (1 из 4) ребенка будет иметь CF
- 50 процентов (1 из 2) ребенок будет носителем, но не будет иметь CF
- 25 процентов (1 из 4) ребенок не будет носителем и не будет иметь CF
Дефектный ген CF содержит небольшую аномалию, называемую мутацией.Известно более 1700 мутаций этого заболевания. Большинство генетических тестов проверяют только самые
общие мутации МВ. Следовательно, результаты теста могут указывать на то, что человек, являющийся носителем гена CF, не является носителем.
Диагностика муковисцидоза — это многоэтапный процесс, который должен включать обследование новорожденных, тест пота, генетический тест или тест на носительство, а также клиническую оценку в аккредитованном CF Foundation центр заботы. Хотя у большинства людей муковисцидоз диагностируется к 2 годам, некоторым ставят диагноз уже взрослым.Специалист CF может заказать тест пота и порекомендовать дополнительное тестирование для подтверждения диагноз CF.
Ознакомьтесь с рекомендациями CF Foundation по клинической помощи для диагностики CF.
Согласно Реестру пациентов Фонда муковисцидоза в США:
- Более 30 000 человек живут с муковисцидозом (более 70 000 во всем мире).
- Ежегодно диагностируется около 1000 новых случаев CF.
- Более 75 процентов людей с МВ диагностируются к 2 годам.
- Более половины людей с МВ имеют возраст 18 лет и старше.
Знаете ли вы?
Более половина больных муковисцидозом — это человек старше 18 лет.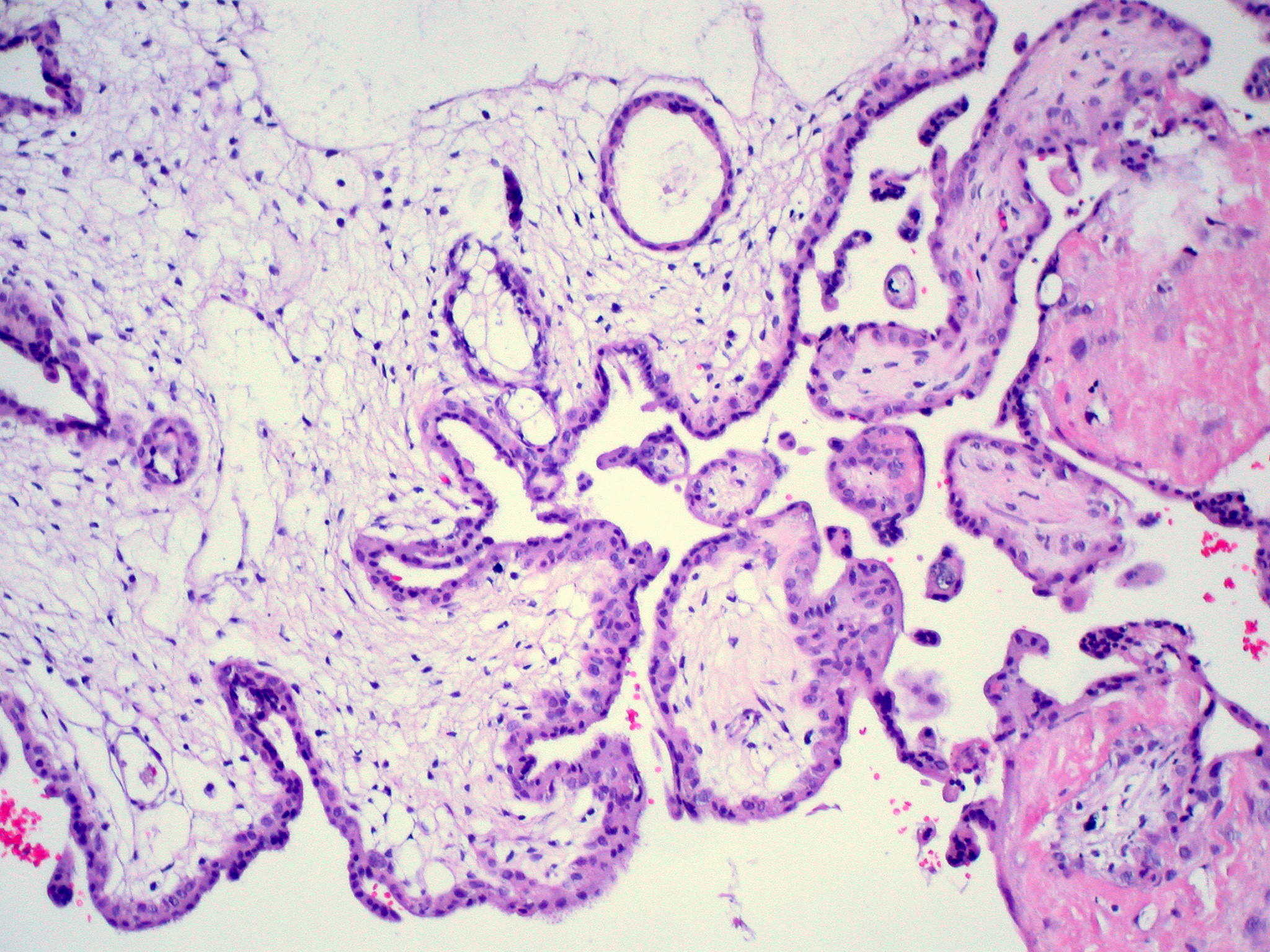
Муковисцидоз — сложное заболевание, и типы и тяжесть симптомов могут сильно различаться от человека к человеку.Многие факторы, такие как возраст постановки диагноза, могут повлиять на здоровье человека и течение болезни.
Посмотрите видео, которое дает представление о повседневной жизни Кейтлин Бродхерст, 25-летней женщины, страдающей муковисцидозом.
Огромные достижения в области специализированной помощи при МВ добавили годы и качество жизни людям с муковисцидозом.С 1950-х годов, когда ребенок с муковисцидозом редко дожил до сегодняшнего дня, произошли кардинальные улучшения, когда ребенок с муковисцидозом жил достаточно долго, чтобы реализовать свои мечты о поступлении в колледж, карьере, женитьбе и рождении детей.
Несмотря на значительный прогресс в лечении этой болезни, лекарства до сих пор нет, и слишком много жизней урезаются слишком быстро.
Тип и тяжесть симптомов МВ могут сильно различаться от человека к человеку.Поэтому, хотя планы лечения могут содержать многие из одних и тех же элементов, они адаптированы к уникальным обстоятельствам каждого человека.
Тре, 24 года с МВ, в жилете.
Люди с МВ и их семьи знают, как болезнь влияет на них и как условия их повседневной жизни влияют на их подход к лечению. Признавая соответствующие роли, люди с МВ, их семьи и медицинские бригады могут работать вместе над разработкой лечения. планы, которые согласовывают личные жизненные цели с целями в отношении здоровья.
«Мой врач и я решили придумать план, который подойдет мне. Мы смогли договориться о сделке, так что я лечил больше, чем раньше, но я не просто сидел дома, подключенный к аппаратам ». –– Бетси Салливан, подросток с CF, из блога сообщества CF
Фонд CF аккредитует более 130 медицинских центров, в которых работают преданные своему делу специалисты в области здравоохранения, которые предоставляют квалифицированную помощь при CF и специализированное лечение заболеваний.
Каждый день люди с CF проходят комбинацию из следующих терапий:
- Очистка дыхательных путей для разрыхления и избавления от густой слизи, которая может скапливаться в легких.
- Вдыхал лекарства, чтобы открыть дыхательные пути или разжижить слизь. Это жидкие лекарства, которые превращаются в туман или аэрозоль, а затем вдыхаются через небулайзер и включают антибиотики для борьбы с легочными инфекциями и терапию, чтобы помочь очистить дыхательные пути.
- Капсулы с добавками ферментов поджелудочной железы для улучшения усвоения жизненно важных питательных веществ. Эти добавки принимают каждый прием пищи и большинство перекусов. Люди с CF также обычно принимает поливитамины.
- Индивидуальный план фитнеса для улучшения энергии, функции легких и общего состояния здоровья
- Модуляторы CFTR для нацеливания на основной дефект в белке CFTR. Поскольку разные мутации вызывают разные дефекты в белке, разработанные до сих пор лекарства эффективны только для людей с определенными мутациями.
CF Foundation поддерживает исследования по открытию и разработке новых методов лечения CF и поддерживает ряд потенциальных методов лечения, направленных на болезнь со всех сторон.
Сегодня Фонд сосредоточен на разработке новых жизненно важных методов лечения для большего числа людей с МВ, в том числе с редкими и бессмысленными мутациями, и смелость, новые возможности однажды разработать лекарство на всю жизнь.
Когда в 1955 году группа родителей основала Фонд муковисцидоза, лечения муковисцидоза не существовало.Эти родители поставили перед собой высокие цели — углубить понимание этой малоизвестной болезни, создать новые методы лечения и специализированный уход для своих детей, а также найти лекарство.
В последующие годы сбор средств и приверженность сообщества CF позволили Фонду поддержать фундаментальные исследования в лаборатории, которые привели к революционным открытиям, включая идентификацию гена и белка, ответственных за муковисцидоз.Расширяя наши знания о биологии заболевания и его влиянии на организм, исследователи проложили путь к созданию новых методов лечения.
Непоколебимая приверженность Фонда развитию исследований МВ помогла разработать более десятка новых методов лечения этого заболевания. Мы добились невероятных успехов, включая одобрение Управлением по контролю за продуктами и лекарствами США (FDA) ивакафтора (Kalydeco ® ), люмакафтора / ивакафтора (Orkambi ® ), тезакафтора / ивакафтора ® ), элексакафтор / тезакафтор / ивакафтор (Trikafta ™), Cayston ® и тобрамицин (TOBI ® ).
Посмотрите это видео, чтобы увидеть, как клинические исследования повлияли на жизнь людей с МВ.
Исследования, проводимые преданными своему делу учеными и клиницистами из широкого круга дисциплин, ежедневно улучшают наше понимание муковисцидоза, помогая формировать клиническую практику лечения людей, живущих с этим заболеванием, на долгие годы. К ним относятся исследования, проведенные с использованием данных пациентов из реестра пациентов CF Foundation, которые помогают нам выявлять тенденции и отслеживать эффективность лечения.
От кабинета до постели Фонд поддерживает лучшие исследования здесь и за рубежом, чтобы улучшить качество жизни людей с МВ сегодня и ускорить инновационные исследования и разработку лекарств, чтобы добавить завтрашнего дня. Недавно были запущены две крупные инициативы, которые помогут нам в этой миссии.
В 2018 году Фонд объявил о выделении 100 миллионов долларов на Инициативу по исследованию инфекций — комплексный подход к улучшению результатов, связанных с инфекциями, за счет улучшения выявления, диагностики, профилактики и лечения.Фонд также активно разрабатывает и финансирует широкий спектр новых методов лечения других осложнений заболевания, таких как воспаление, чрезмерное выделение слизи, желудочно-кишечные проблемы и диабет, связанный с муковисцидозом.
Вторая крупная инициатива сосредоточена на людях с бессмысленными и редкими мутациями, которым не помогут только модуляторы CFTR, и которые нуждаются в эффективном лечении основной причины своего заболевания. К настоящему времени Фонд выделил более 72 миллионов долларов на Инициативу по исследованию бессмысленных и редких мутаций и терапии, многогранную инициативу, которая уже профинансировала более 60 проектов за последние несколько лет как в академических учреждениях, так и в фармацевтических компаниях.
Следуя этим и другим смелым стратегиям, CF Foundation продолжает создавать надежную линейку потенциальных новых методов лечения, которые борются с болезнью со всех сторон. Узнайте больше о ключевых исследовательских программах CF Foundation:
- Обзор исследования: Широкий взгляд на то, как Фонд поддерживает фундаментальную науку, клинические исследования и исследования в реальном мире, чтобы расширить наши знания о муковисцидозе и преобразовать открытия и идеи в жизненно важные новые методы лечения и клиническую практику для людей, живущих с МВ.
- Исследования, которые мы финансируем: См. Снимок того, как Фонд CF финансирует исследования кистозного фиброза.
- Лаборатория CF Foundation Therapeutics: Базирующаяся в Лексингтоне, штат Массачусетс, терапевтическая лаборатория CF Foundation выявляет и тестирует потенциальные новаторские методы лечения CF, готовя их к дальнейшей разработке.
- Сеть разработки терапевтических средств: Сеть разработки терапевтических средств является крупнейшей в мире сетью клинических исследований МВ.Он предоставляет ресурсы и поддержку исследованиям, ведущим к новым важным методам лечения и более совершенным методам лечения.
- Новые достижения в клинических исследованиях: Посмотрите интервью с ведущими исследователями МВ, чтобы узнать о последних передовых исследованиях по таким вопросам, как инфекции, нетуберкулезные микобактерии (НТМ), питание и здоровье желудочно-кишечного тракта.
- Разработка лекарств: Лабораторные открытия превращаются в потенциальные лекарства, которые атакуют как симптомы CF, так и причину — дефектный ген, который производит дефектный белок.
- Исследовательские центры: Эти «мозговые центры» CF расположены в ведущих университетах и медицинских школах по всей Северной Америке, где ученые из многих дисциплин собираются вместе, чтобы объединить свои знания, чтобы найти лекарство от CF.
Скрининг новорожденных на МВ | CF Foundation
Важность ранней диагностики CF
Скрининг новорожденных (NBS) на муковисцидоз проводится в первые несколько дней после рождения.Диагностируя CF на ранней стадии, поставщики медицинских услуг могут помочь родителям научиться поддерживать здоровье своего ребенка, насколько это возможно, и отсрочить или предотвратить серьезные пожизненные проблемы со здоровьем, связанные с CF.
Исследования показывают, что дети, получившие помощь при МВ в раннем возрасте, лучше питаются и более здоровы. чем те, кому поставлен диагноз позже. Ранняя диагностика и лечение могут:
- Улучшить рост
- Помогите сохранить легкие здоровыми
- Сократить пребывание в больнице
- Добавить годы к жизни
Как проводится скрининг новорожденных?
Несколько капель крови из укола пятки помещаются на специальную карту, называемую картой Гатри.Фото любезно предоставлено March of Dimes.
Обследование новорожденных проводится в течение первых нескольких дней жизни вашего ребенка — обычно врачом в больнице. Несколько капель крови из укола пятки помещаются на специальную карту, называемую картой Гатри.
Эта карточка с информацией о вашем ребенке отправляется по почте в специальную государственную лабораторию, которая проверяет образец крови на определенные состояния здоровья, включая CF. В некоторых штатах скрининг новорожденных включает два образца крови: один при рождении и один. несколько недель спустя.
CF Скрининг новорожденных может отличаться в зависимости от штата
Все 50 штатов и округ Колумбия проводят скрининг новорожденных на CF, но методы скрининга могут отличаться от штата к штату.
Программа скрининга новорожденных на МВ в каждом штате начинается с анализа крови ребенка, чтобы проверить уровни химического вещества, вырабатываемого поджелудочной железой, называемого иммунореактивным трипсиногеном (IRT).
Знаете ли вы?
Все 50 штатов проводят скрининг новорожденных на муковисцидоз.
IRT обычно находится в организме в небольших количествах. У людей, страдающих МВ, уровни IRT, как правило, высоки, но уровни IRT также могут быть высокими, если ребенок недоношен, у него были стрессовые роды или по другим причинам.
В некоторых штатах уровни IRT проверяются только при первом анализе крови. Такие состояния называются состояниями только для IRT. В других штатах проводится как IRT, так и ДНК-тест. Это называется состояниями IRT-ДНК. Узнайте больше об этих методах проверки.
Если у вас есть вопросы о скрининге новорожденных или генетическом тестировании на МВ, пожалуйста, обратитесь в центр обслуживания, аккредитованный CF Foundation, или поговорите со своим врачом.
На основании результатов скрининга новорожденного вас могут попросить отвезти ребенка в аккредитованный фондом CFF для анализа пота, чтобы либо исключить, либо подтвердить диагноз CF.
Чтобы узнать больше о методе обследования новорожденных, используемом в штате, где родился ваш ребенок, свяжитесь с [email protected].
Общие сведения о результатах скрининга новорожденных
Результаты скрининга новорожденных на CF могут занять более одной недели после взятия образца крови.Спросите основного лечащего врача вашего ребенка, когда вы можете ожидать результатов.
Скрининговый тест CF проверяет наличие IRT, которая обычно в небольших количествах обнаруживается в организме.
Когда поджелудочная железа подвергается стрессу перед рождением ребенка, в кровь ребенка попадает больше IRT. Уровень IRT может быть высоким по нескольким причинам, включая преждевременные или стрессовые роды, или по другим причинам. Уровни IRT также, как правило, высоки у людей, которые есть CF. Когда в крови обнаруживается высокий уровень IRT, результаты скрининга новорожденных считаются положительными.
Посмотрите видео «Скрининг новорожденных на кистозный фиброз» от Nemours, чтобы узнать, почему отклоненный от нормы результат теста не обязательно означает, что у вашего ребенка МВ.
Что делать, если результаты скрининга новорожденных положительны на CF
Положительный результат скрининга новорожденных говорит вам, что у вашего ребенка может быть CF и потовая проба необходима для того, чтобы исключить или диагностировать CF.
Тест на пот позволяет определить, сколько соли в поту вашего ребенка.Этот тест — единственный способ диагностировать CF, хотя другие формы тестирования могут помочь подтвердить или сообщить диагноз, если результаты теста пота неубедительны.
Тест на пот должен проводиться в центре по уходу, аккредитованном CF Foundation. Персонал постарается как можно скорее назначить тест на пот.
Если у вашего ребенка был положительный NBS или вы получили положительный пренатальный генетический тест, важно назначить тест на пот как можно скорее, как только ваш новорожденный достигнет 10-дневного возраста.Самое позднее, младенцы с положительным результатом NBS или пренатального генетического теста должны пройти тест на пот в возрасте до 4 недель, чтобы гарантировать, что любые проблемы со здоровьем или изменения могут быть обнаружены на ранней стадии и быстро вылечены. Для получения дополнительной информации о записи на прием для пробы пота обратитесь в ближайший к вам центр помощи при CF.
Послушайте других родителей, получивших положительные результаты скрининга новорожденных, в этом коротком видео от Nemours.
Когда пот-тест подтверждает диагноз CF
Прежде всего, помните, что вы не одиноки. Существует сильная и растущая сеть людей с МВ, других родителей и семей, специалистов здравоохранения и центров по уходу, которые помогут вам и вашему ребенку. Благодаря этой сети — и агрессивным исследованиям и новые методы лечения — люди с МВ живут дольше и здоровее.
Чтобы узнать больше о том, как другие семьи справились с положительным диагнозом CF, посмотрите наш видеоролик «Скрининг и диагностика CF новорожденных».
Как можно скорее вам следует обратиться в центр обслуживания, аккредитованный CF Foundation. Медицинские работники этих центров помогут вам узнать больше о CF и станут вашими партнерами в разработке плана по сохранению здоровья вашего ребенка.
Посмотрите веб-трансляцию «Партнерство в сфере ухода: центры обслуживания, аккредитованные Фондом CF», чтобы узнать больше о центрах обслуживания CF.
Что я могу сделать, чтобы мой ребенок оставался здоровым?
Самое важное — это работать в тесном контакте со специалистами по лечению МВ в вашем медицинском центре.Они будут работать с вами, чтобы разработать план для здоровья вашего ребенка, в том числе избегать микробов, разумно питаться и очищать легкие от слизи.
Вашему ребенку необходимо будет ежедневно соблюдать режим лечения, чтобы оставаться здоровым и поддерживать оптимальную функцию легких.
Послушайте, как другие родители детей с МВ рассказывают о том, как они заботились о своем ребенке в течение первого года жизни.
Благодаря сообществу людей, живущих с CF, и их семей, которые участвуют в исследованиях, поддерживаемых CF Foundation, и работают с группами по уходу в аккредитованных CF Foundation центрах по всей стране, существует больше возможностей для лечения CF чем когда-либо.К ним относятся препараты, которые помогают выводить слизь CF из дыхательных путей, уменьшают воспаление, борются с микробами и помогают вашему ребенку расти.
Существуют также новые лекарства, называемые модуляторами трансмембранного регулятора проводимости при муковисцидозе (CFTR), предназначенные для лечения основной причины МВ у людей с определенными мутациями гена МВ, и аналогичные методы лечения находятся в разработке для большего числа людей, живущих с МВ.
Диагноз CF может вызвать множество различных эмоций. Понимание того, как справиться с этими эмоциями, — первый шаг в обучении воспитанию счастливого и здорового ребенка.
Мой ребенок — носитель CF
Если результаты скрининга новорожденных выявили одну мутацию гена CF, а тест пота был отрицательным (нормальным), у вашего ребенка МВ нет. Результат теста на одну мутацию означает, что ваш ребенок является носителем муковисцидоза. Носитель CF здоров и не имеет болезнь.
Мы рекомендуем вам поговорить со своим ребенком, когда он или она достаточно взрослые, чтобы понимать генетику. Вашему ребенку будет важно знать, что он или она может передать мутацию гена CF своим будущим детям.Его или ее партнер может захотеть пройти тестирование на носительство CF, если они планируют иметь детей.
Мутации гена CF разделяются в семьях. По этой причине вам следует сообщить своим кровным родственникам, что они могут быть носителями мутации гена CF, чтобы они и их партнеры могли решить, хотят ли они пройти тестирование.
Вы и ваш ребенок можете обсудить вопрос о том, кто является носителем CF, с врачом вашего ребенка, генетическим консультантом или медсестрой-генетиком, когда ваша семья будет готова к такому разговору.
Исследователи быстро продвигаются в понимании генетики МВ. Гораздо больше будет известно о генетике МВ, когда ваш ребенок будет готов иметь детей.
Фертильность у мужчин с CF
Биология мужской репродукции и CF
Чтобы понять внутренние механизмы бесплодия у мужчин с муковисцидозом, полезно сначала понять биологию мужской репродуктивной системы. Он состоит из трех основных частей: яичек, придатка яичка и семявыносящего протока (см. Рисунок 1).
Сперма (репродуктивные клетки) развиваются в яичках. Эпидидимис представляет собой серию трубок, которые находятся за яичками, где хранятся сперматозоиды до тех пор, пока они не станут доступными при эякуляции. Семявыносящий проток — это длинная трубка, которая соединяет придаток яичка с семяпроводами и действует как канал, по которому зрелые сперматозоиды могут проходить через половой член во время эякуляции (см. Рисунок 2).
Большинство мужчин с МВ (97–98 процентов) бесплодны из-за отсутствия семявыносящего канала, известного как врожденное двустороннее отсутствие семявыносящего протока.Сперма никогда не попадает в сперму, что делает невозможным для них добраться до яйцеклетки и оплодотворить ее во время полового акта. Отсутствие сперматозоидов в сперме также может способствовать тому, что мужчины с МВ имеют более тонкий эякулят и меньший объем спермы.
Разница между бесплодием и бесплодием
Это различие между бесплодием и бесплодием является ключом к пониманию влияния CF на мужскую репродуктивную функцию. Хотя семявыносящий проток отсутствует, сперматозоидов нет. Фактически, производство спермы в яичках является нормальным у 90 процентов мужчин с CF и CBAVD, а это означает, что большинство мужчин с CF все еще могут иметь биологических детей с помощью вспомогательных репродуктивных технологий (ВРТ).Ваш врач должен быть в состоянии дать вам направление к урологу (или эксперту по репродуктивным заболеваниям), который сможет использовать медицинские тесты, чтобы подтвердить, что вы бесплодны.
Посмотрите, как родители с МВ и врач говорят о мужском бесплодии и процессах, связанных с рождением биологических детей.
Хотя причина CBAVD окончательно не известна, считается, что она связана с регулятором трансмембранной проводимости при муковисцидозе (CFTR). мутации генов, которые также вызывают проблемы в поджелудочной железе и легких.Поскольку считается, что CBAVD вызывается аналогичными генетическими паттернами, обнаруженными при CF, для мужчин, которым был поставлен диагноз CBAVD, невероятно важно также пройти тестирование на CF. Потому что CBAVD часто не имеет внешних признаков или симптомов и по-прежнему позволяет мужчинам иметь При полноценной сексуальной жизни некоторые мужчины могут даже не узнать, что у них CF или CBAVD, пока у них не возникнут проблемы с зачатием ребенка.
Несмотря на то, что большинство мужчин с МВ бесплодны, у некоторых все же есть сперма в эякуляте.Если ваше бесплодие не было подтверждено медицинскими тестами, обязательно используйте контрацепция для предотвращения возможности незапланированной беременности.
Еще одно заболевание, которое мужчины с МВ могут испытывать, хотя и редко, — это тип инфекции, известный как мужской. кандидоз. Могут проявляться такие симптомы, как язвы на половом члене, раздражение и зуд.
Посмотрите онлайн-трансляцию с участием уролога Томаса Дж.Walsh, M.D., M.S., и Moira Aitken, M.D., чтобы узнать:
- Как CF влияет на мужское бесплодие и CBAVD
- Как мужчины с МВ могут преодолеть бесплодие и иметь биологических детей
- Как определить фертильность мужчины
- Как работать с вашей командой по уходу за CF, чтобы получить оптимальную помощь и поддержку
Информация о фертильности для мужчин с МВ | Интернет-трансляция
Основы белка CFTR
Белок-регулятор трансмембранной проводимости при муковисцидозе (CFTR) помогает поддерживать баланс соли и воды на многих поверхностях тела, например, на поверхности легких.Когда белок не работает должным образом, хлорид — компонент соли — задерживается в клетках. Без правильного движения хлорида вода не может увлажнять клеточную поверхность. Это приводит к тому, что слизь, покрывающая клетки, становится густой и липкой, вызывая многие симптомы, связанные с муковисцидозом.
Чтобы понять, как мутации в гене CFTR приводят к нарушению функций белка, важно понимать, как этот белок обычно производится и как он помогает перемещать воду и хлориды на поверхность клетки.
Что такое белки?
Белки — это крошечные машины, которые выполняют определенную работу внутри клетки. Инструкции по созданию каждого белка закодированы в ДНК. Белки собираются из строительных блоков, называемых аминокислотами. Есть 20 различных аминокислот. Все белки состоят из цепочек этих аминокислот, соединенных вместе в разном порядке, как разные слова, написанные с использованием одних и тех же 26 букв алфавита. Инструкции ДНК сообщают клетке, какую аминокислоту использовать в каждой позиции цепи для создания определенного белка.
Белок CFTR состоит из 1480 аминокислот. После создания белковой цепи CFTR она складывается в определенную трехмерную форму. Белок CFTR имеет форму трубки, которая проходит через мембрану, окружающую клетку, как соломинка, проходящая через пластиковую крышку чашки.
Что делает белок CFTR?
Белок CFTR — это особый тип белка, называемый ионным каналом. Ионный канал перемещает атомы или молекулы, имеющие электрический заряд, изнутри клетки наружу или снаружи клетки внутрь.В легких ионный канал CFTR перемещает ионы хлора изнутри клетки за пределы клетки. Чтобы выйти из клетки, ионы хлора проходят через центр трубки, образованной белком CFTR.
Как только ионы хлора выходят за пределы клетки, они притягивают слой воды. Этот водный слой важен, потому что он позволяет крошечным волоскам на поверхности клеток легких, называемых ресничками, перемещаться взад и вперед. Это широкое движение перемещает слизь вверх и из дыхательных путей.
Как проблемы с белком CFTR вызывают МВ?
У людей с МВ мутации в гене CFTR могут вызывать следующие проблемы с белком CFTR:
- Он не работает хорошо
- Не производится в достаточном количестве
- Совершенно не производится
При возникновении любой из этих проблем ионы хлора задерживаются внутри ячейки, и вода больше не притягивается к пространству за пределами ячейки.Когда за пределами клеток становится меньше воды, слизь в дыхательных путях обезвоживается и сгущается, что приводит к сглаживанию ресничек. Реснички не могут подметать должным образом, когда их отягощает густая липкая слизь.
Поскольку реснички не могут двигаться должным образом, слизь застревает в дыхательных путях, затрудняя дыхание. Кроме того, микробы, попавшие в слизь, больше не выводятся из дыхательных путей, что позволяет им размножаться и вызывать инфекции. Густая слизь в легких и частые инфекции дыхательных путей — одни из наиболее распространенных проблем, с которыми сталкиваются люди с МВ.
Исследователи все еще изучают базовую структуру
Исследователи все еще пытаются узнать больше о структуре белка CFTR, чтобы они могли найти новые и более эффективные способы помочь улучшить функцию белка у людей с МВ.
На этом рисунке представлено недавнее изображение структуры полноразмерного белка CFTR (показано зеленым), созданного в лаборатории Джуэ Чена, доктора философии, профессора Уильяма Э. Форда в Университете Рокфеллера в Нью-Йорке.Он отражает наше текущее понимание того, как выглядит белок CFTR.
Поскольку трехмерная форма CFTR настолько сложна, первые изображения с высоким разрешением были получены только в начале 2017 года. Эти изображения дали исследователям важные подсказки о том, где лекарства связывают белок, как они влияют на его функцию и как разрабатывать новые методы лечения МВ. В будущем изображения, показывающие белок в «открытом» положении, через которое может проходить соль, будут еще более полезны для исследователей, разрабатывающих новые методы лечения МВ.
Выявление истоков муковисцидоза в древней Европе | Наука
Представьте себе волнение открытия, когда более 10 лет исследований происхождения распространенного генетического заболевания, кистозного фиброза (МВ), привели к тому, что его проследили до группы отдельных, но загадочных европейцев, живших около 5000 лет назад.
CF является наиболее распространенным и потенциально смертельным наследственным заболеванием среди европеоидов — примерно каждый 40 человек несет так называемую мутацию F508del.Обычно в популяции широко распространяются только полезные мутации, которые обеспечивают преимущество в выживании.
CF препятствует высвобождению пищеварительных ферментов из поджелудочной железы, что вызывает недоедание, вызывает заболевание легких, которое в конечном итоге приводит к летальному исходу и вызывает высокий уровень соли в поте, который может быть опасным для жизни.
В зависимости от мутации, переносимой пациентом, у него могут наблюдаться некоторые или все симптомы муковисцидоза.(Сотрудники Blausen.com (2014), CC BY-SA)В последние годы ученые выявили многие аспекты этого смертельного заболевания легких, которые привели к рутинной ранней диагностике у детей, прошедших скрининг, лучшему лечению и увеличению продолжительности жизни. С другой стороны, научное сообщество не могло понять, когда, где и почему мутация стала настолько распространенной. Сотрудничая с выдающейся командой европейских ученых, таких как Дэвид Бартон в Ирландии и Милан Мацек в Чешской Республике, в частности с группой блестящих генетиков в Бресте, Франция во главе с Эммануэль Женин и Клод Ферком, мы считаем, что теперь знаем, где и когда Первоначальная мутация возникла и в древнем племени людей.
Мы делимся этими выводами в статье в European Journal of Human Genetics, которая представляет собой кульминацию 20-летней работы с участием девяти стран.
Что такое муковисцидоз?
Мое стремление определить, как возникает МВ и почему оно так распространено, началось вскоре после того, как ученые обнаружили ген CFTR, вызывающий заболевание, в 1989 году. Самая распространенная мутация этого гена, вызывающего заболевание, получила название F508del. Две копии мутации — одна унаследованная от матери, а другая от отца — вызвали смертельную болезнь.Но наследование только одной копии не вызывало никаких симптомов и делало человека «носителем».
Я работал в Университете Висконсина с 1977 года в качестве врача-ученого, специализирующегося на ранней диагностике CF посредством скрининга новорожденных. До открытия гена мы идентифицировали детей с высоким риском CF с помощью анализа крови, в котором измеряли уровень белка, называемого иммунореактивным трипсиногеном (IRT). Высокий уровень IRT предполагал, что у ребенка МВ. Когда я узнал об открытии гена, я был убежден, что это изменит правила игры как для разработки скрининговых тестов, так и для эпидемиологических исследований.
Это потому, что с геном мы можем предложить родителям более информативный тест. Мы могли сказать им не только о том, есть ли у их ребенка CF, но и о том, есть ли у них две копии мутации CFTR, которая вызывает заболевание, или только одну копию, которая делает их носителями.
Родители, несущие одну хорошую копию гена CF (R) и одну плохую копию мутировавшего гена CF (r), называются носителями. Когда оба родителя передают своему потомству плохую копию гена CF, ребенок страдает муковисцидозом.Дети, унаследовавшие только одну плохую копию, будут носителями, как и их родители, и смогут передать ген своим детям. (Cburnett, CC BY-SA)Можно спросить, какова связь между изучением скрининга новорожденных CF и изучением происхождения заболевания. Ответ заключается в том, как наша исследовательская группа в Висконсине преобразовала биохимический скрининговый тест с использованием маркера IRT в двухуровневый метод, называемый IRT / ДНК.
Потому что около 90 процентов пациентов с МВ в США.В S. и Европе есть по крайней мере одна мутация F508del, мы начали анализировать кровь новорожденных на ее наличие всякий раз, когда уровень IRT был высоким. Но когда проводится этот двухэтапный IRT / ДНК-скрининг, выявляются не только пациенты с диагностированным заболеванием, но и в десять раз больше младенцев, которые являются генетическими носителями этого заболевания.
Поскольку до зачатия, пренатальный и неонатальный скрининг на МВ за последние два десятилетия увеличился, многие тысячи людей, которые обнаружили, что они являются носителями F508del, и их обеспокоенные родители часто задавали вопросы о происхождении и значении носителей этой мутации сами или в их дети.Пострадали бы они с одним экземпляром? Была ли польза для здоровья? Для педиатра, специализирующегося на МВ, очень неприятно, что у него нет ответа.
Проблема поиска происхождения мутации CF
Я хотел сосредоточиться на том, когда впервые появилась эта генетическая мутация. Выявление этого периода позволит нам понять, как он мог развиться, чтобы принести пользу — по крайней мере на начальном этапе — тем людям в Европе, у которых он был. Чтобы расширить свои исследования, я решил взять творческий отпуск и обучиться эпидемиологии во время прохождения курсов в Лондонской школе гигиены и тропической медицины в 1993 году.
Время было идеальным, потому что область исследований древней ДНК начала расцветать. Новые революционные методы, такие как полимеразная цепная реакция, позволили изучать ДНК мумий и других археологических образцов человека из доисторических захоронений. Например, ранние исследования проводились на ДНК 5000-летнего тирольского ледяного человека, который позже стал известен как Эци.
Типичное доисторическое захоронение в позе скрюченного плода.(Филип Фаррелл, CC BY-SA)Я решил, что мы сможем выяснить происхождение CF, проанализировав ДНК в зубах людей железного века, похороненных между 700-100 годами до нашей эры. на кладбищах по всей Европе.
Используя эту стратегию, я объединился с археологами и антропологами, такими как Мария Тешлер-Никола из Музея естественной истории в Вене, которая предоставила доступ к 32 скелетам, захороненным около 350 г. до н. Э. недалеко от Вены. Французские генетики собрали ДНК древних коренных зубов и проанализировали ее.К нашему удивлению, мы обнаружили присутствие мутации F508del в ДНК трех из 32 скелетов.
Это открытие F508del в захоронениях железного века в Центральной Европе, датированное радиоуглеродом 350 г. до н. Э. предположили, что исходная мутация CF могла возникнуть раньше. Но получение образцов бронзового века и неолита для таких прямых исследований оказалось трудным, потому что доступно меньше захоронений, скелеты не так хорошо сохранились, и каждое кладбище просто представляет собой племя или деревню.Поэтому вместо того, чтобы полагаться на древнюю ДНК, мы изменили нашу стратегию на изучение генов современного человека, чтобы выяснить, когда впервые возникла эта мутация.
Почему должна распространяться вредная мутация?
Мы знали, что для выяснения происхождения МВ у современных пациентов нам необходимо больше узнать о сигнатурной мутации — F508del — у людей, которые являются носителями или страдают этим заболеванием.
Эта крошечная мутация вызывает потерю одной аминокислоты из 1480 аминокислотной цепи и изменяет форму белка на поверхности клетки, который перемещает хлорид внутрь и из клетки.Когда этот белок мутирует, люди, несущие две его копии — одну от матери и одну от отца, страдают от густой липкой слизи в легких, поджелудочной железе и других органах. Слизь в их легких позволяет бактериям процветать, разрушая ткани и в конечном итоге вызывая отказ легких. В поджелудочной железе густые выделения не позволяют железе доставлять ферменты, необходимые организму для переваривания пищи.
Так почему же такая вредная мутация продолжает передаваться из поколения в поколение?
В Музее естественной истории в Вене, Австрия, хранится большая коллекция скелетов железного и бронзового веков, хранителем которых является доктор Др.Мария Тешлер-Никола. Эти коллекции были источником зубов и костей для исследования древней ДНК и исследований на тему «Древнее происхождение кистозного фиброза». (Филип Фаррелл, CC BY-ND)Такая опасная мутация, как F508del, никогда не выжила бы среди людей с двумя копиями мутировавшего гена CFTR, потому что они, вероятно, умерли вскоре после рождения. С другой стороны, люди с одной мутацией могут иметь преимущество в выживании, как и предсказывает теория Дарвина «выживание наиболее приспособленных».
Возможно, лучший пример мутации, способствующей выживанию в стрессовых условиях окружающей среды, можно найти в Африке, где смертельная малярия была эндемической на протяжении веков.Паразит, вызывающий малярию, поражает эритроциты, основным компонентом которых является переносящий кислород белок гемоглобин. Люди, несущие нормальный ген гемоглобина, уязвимы для этой болезни, переносимой комарами. Но те, кто являются носителями мутировавшего гена «гемоглобина S», имеющего только одну копию, защищены от тяжелой малярии. Однако две копии гена гемоглобина S вызывают серповидно-клеточную анемию, которая может быть фатальной.
В этом случае наличие одного мутантного гена дает явное преимущество — фактически, примерно каждый десятый африканец несет единственную копию.Таким образом, на протяжении многих веков фактор окружающей среды благоприятствовал выживанию людей, несущих единственную копию мутации серповидного гемоглобина.
Люди, несущие две копии гена серповидноклеточных клеток, страдают серповидно-клеточной анемией, при которой клетки крови приобретают жесткую серповидную форму и застревают в кровеносных сосудах, вызывая боль. Нормальные эритроциты — это гибкие диски, которые легко скользят по сосудам. (Designua / Shutterstock.com)Аналогичным образом мы задались вопросом, полезно ли для здоровья иметь одну копию этой специфической мутации CF во время воздействия стрессовых условий окружающей среды.Возможно, рассуждали мы, поэтому мутация F508del была распространена среди кавказских европейцев и популяций европейского происхождения.
Подсказки современной ДНК
Чтобы выяснить преимущества передачи одного мутировавшего гена F508del от поколения к поколению, нам сначала нужно было определить, когда и где возникла мутация, чтобы мы могли раскрыть пользу, которую принесла эта мутация.
Мы получили образцы ДНК от 190 пациентов с МВ, носящих F508del, и их родителей, проживающих в географически различных европейских популяциях от Ирландии до Греции, плюс немецкое население в США.S. Затем мы идентифицировали набор генетических маркеров — по сути, последовательности ДНК — внутри гена CF и фланкирующих участков на хромосоме. Определив, когда эти мутации появились в изученных нами популяциях, мы смогли оценить возраст самого недавнего общего предка.
Затем путем тщательного компьютерного анализа мы оценили возраст мутации CF в каждой популяции, проживающей в разных странах.
Болезнь вызывают две копии гена серповидных клеток.Но ношение одного экземпляра снижает риск малярии. Ген широко распространен среди людей, живущих в регионах мира (красный цвет), где малярия является эндемической. (ellepigrafica)Затем мы определили, что возраст самого старого общего предка составляет от 4600 до 4725 лет и он возник в юго-западной Европе, вероятно, в поселениях вдоль Атлантического океана и, возможно, в регионе Франции или Португалии. Мы полагаем, что мутация быстро распространилась оттуда в Великобританию и Ирландию, а затем позже в популяции центральной и юго-восточной Европы, такие как Греция, где F508del был введен всего около 1000 лет назад.
Кто распространил мутацию CF по Европе?
Таким образом, наши недавно опубликованные данные предполагают, что мутация F508del возникла в раннем бронзовом веке и распространилась с запада на юго-восток Европы во время древних миграций.
Более того, принимая во внимание археологические данные, наши результаты позволяют нам представить новую концепцию, предполагающую, что популяция, известная как народ Колокольных кубков, была вероятной мигрирующей популяцией, ответственной за раннее распространение F508del в доисторической Европе.Они появились при переходе от позднего неолита, около 4000 г. до н.э., к раннему бронзовому веку в третьем тысячелетии до н.э. где-то в Западной Европе. Они отличались своими керамическими мензурками, первопроходцами в металлургии меди и бронзы к северу от Альп и большой мобильностью. Фактически, все исследования показывают, что они были в большой миграции, путешествуя по всей Западной Европе.
Распространение сайтов Bell Beaker по всей Европе. (DieKraft через Wikimedia Commons)Примерно за 1000 лет сеть небольших семей и / или элитных племен распространила свою культуру с запада на восток в регионы, которые близко соответствуют нынешнему Европейскому Союзу, где наблюдается самый высокий уровень заболеваемости МВ. .Их миграция связана с появлением металлургии в Западной и Центральной Европе, поскольку они производили и торговали металлическими товарами, особенно оружием, путешествуя на большие расстояния. Также предполагается, что их путешествия были мотивированы установлением брачных связей. Наиболее актуальным для нашего исследования является свидетельство того, что они мигрировали в направлении и за период времени, которые хорошо согласуются с нашими результатами. Последние геномные данные предполагают, что и миграция, и культурная передача сыграли важную роль в распространении «комплекса мензурки» и привели к «глубокой демографической трансформации» Британии и других регионов после 2400 г.С.
Определение того, когда F508del был впервые представлен в Европе, и выяснение того, где он возник, должно дать новое представление о высокой распространенности носителей — и о том, дает ли мутация эволюционное преимущество. Например, европейцы бронзового века, активно мигрируя, по-видимому, были избавлены от воздействия эндемических инфекционных заболеваний или эпидемий; таким образом, защита от инфекционного заболевания, такого как серповидная мутация, посредством этой генетической мутации кажется маловероятной.
По мере того, как больше информации о людях бронзового века и их действиях во время миграций становится доступной благодаря археологическим и геномным исследованиям, должно появиться больше подсказок о факторах окружающей среды, которые благоприятствовали людям, у которых был этот вариант гена. Затем мы сможем ответить на вопросы пациентов и родителей о том, почему в их семье есть мутация CFTR и какие преимущества это дает.
Примеры инструментов и керамики, созданные людьми Bell Beaker.(Benutzer: Thomas Ihle через немецкую Википедию, CC BY-SA)Эта статья изначально была опубликована в The Conversation.
Филип Фаррелл, профессор педиатрии и наук о здоровье населения, Университет Висконсин-Мэдисон
Муковисцидоз: MedlinePlus Genetics
Муковисцидоз — это наследственное заболевание, характеризующееся накоплением густой липкой слизи, которая может повредить многие органы тела. Наиболее распространенные признаки и симптомы заболевания включают прогрессирующее поражение дыхательной системы и хронические проблемы с пищеварительной системой.Особенности заболевания и их тяжесть варьируются у разных людей.
Слизь — скользкое вещество, которое смазывает и защищает слизистую оболочку дыхательных путей, пищеварительной системы, репродуктивной системы и других органов и тканей. У людей с муковисцидозом в организме выделяется необычно густая и липкая слизь. Эта ненормальная слизь может закупоривать дыхательные пути, что приводит к серьезным проблемам с дыханием и бактериальным инфекциям в легких. Эти инфекции вызывают хронический кашель, хрипы и воспаления.Со временем накопление слизи и инфекции приводят к необратимому повреждению легких, включая образование рубцовой ткани (фиброз) и кист в легких.
У большинства людей с муковисцидозом также есть проблемы с пищеварением. У некоторых пораженных детей бывает кишечная непроходимость мекония, закупорка кишечника, которая возникает вскоре после рождения. Другие проблемы с пищеварением возникают в результате скопления густой липкой слизи в поджелудочной железе. Поджелудочная железа — это орган, вырабатывающий инсулин (гормон, который помогает контролировать уровень сахара в крови).Он также производит ферменты, которые помогают переваривать пищу. У людей с муковисцидозом слизь часто повреждает поджелудочную железу, нарушая ее способность вырабатывать инсулин и пищеварительные ферменты. Проблемы с пищеварением могут привести к диарее, недоеданию, плохому росту и потере веса. В подростковом или взрослом возрасте нехватка инсулина может вызвать форму диабета, известную как сахарный диабет, связанный с муковисцидозом (CFRDM).
Муковисцидоз считался смертельным заболеванием в детстве. Благодаря улучшенным методам лечения и лучшим способам борьбы с заболеванием многие люди с муковисцидозом теперь доживают до зрелого возраста.Взрослые с муковисцидозом испытывают проблемы со здоровьем, влияющие на дыхательную, пищеварительную и репродуктивную системы. Большинство мужчин с муковисцидозом имеют врожденное двустороннее отсутствие семявыносящего протока (CBAVD), состояние, при котором трубки, по которым проходит сперма (семявыносящий проток), заблокированы слизью и не развиваются должным образом. Мужчины с CBAVD не могут иметь детей (бесплодие), если они не проходят лечение бесплодия. У женщин с муковисцидозом могут возникнуть осложнения во время беременности.
Влияние ивакафтора на патологию придаточных пазух носа у пациентов с S1251N-опосредованным муковисцидозом
Аннотация
Важность
Синоназальные симптомы у пациентов, страдающих муковисцидозом, могут отрицательно влиять на качество жизни, а носовые пазухи могут быть нишей для патогенов, вызывающих инфекцию и воспаление, что приводит к снижению функции легких.Ивакафтор, усилитель белка трансмембранного регулятора проводимости при муковисцидозе, продемонстрировал улучшение функции легких у пациентов с муковисцидозом с различными формами воротных мутаций класса III. Однако влияние ивакафтора на патологию носовых пазух практически не изучено.
Цель
Определить влияние терапии ивакафтором на патологию носовых пазух у пациентов с муковисцидозом с мутацией S1251N.
Проект
Проспективное наблюдательное когортное исследование моноцентров, с июня 2015 г. по декабрь 2016 г.
Настройка
Специализированный специализированный центр в Утрехте, Нидерланды.
Участников
Обследованы восемь пациентов с муковисцидозом с мутацией S1251N, получавших потенциатор ивакафтор.
Открытий
Ивакафтор (Калидеко, VX-770) терапия. Компьютерная томография придаточных пазух носа. Измерение концентрации оксида азота в носу и носовая эндоскопия.
Основные результаты и меры
Первичный результат — помутнение придаточных пазух носа, исследованное с помощью анализа компьютерной томографии и оцененное по модифицированной шкале Лунда-Маккея до и через год после лечения.Вторичными результатами являются уровни концентрации оксида азота в носу, симптомы придаточных пазух носа и результаты назальной эндоскопии до и примерно через два месяца, а в некоторых случаях через год после лечения.
Результаты
Анализ компьютерной томографии показал значительное уменьшение помутнения большинства придаточных пазух носа при сравнении оценки помутнения околоносовых пазух до и после одного года лечения ивакафтором. Средний уровень оксида азота в носу значительно улучшился с 220.От 00 (IQR: 136,00–341,18) до 462,84 (IQR: 233,17–636,25) (p = 0,017) частей на миллиард. Аналогичным образом, большинство симптомов придаточных пазух носа и носовой эндоскопической патологии уменьшились или разрешились через два месяца после применения ивакафтора.
Заключение и актуальность
Ивакафтор, по-видимому, улучшает параметры исходов придаточных пазух носа и, следовательно, их здоровье у пациентов с муковисцидозом с мутацией S1251N.
Образец цитирования: Gostelie R, Stegeman I, Berkers G, Bittermann J, Ligtenberg-van der Drift I, Kipshagen P-Jv, et al.(2020) Влияние ивакафтора на патологию придаточных пазух носа у пациентов с муковисцидозом, опосредованным S1251N. PLoS ONE 15 (7): e0235638. https://doi.org/10.1371/journal.pone.0235638
Редактор: Клаудио Андалоро, Университет Катании, ИТАЛИЯ
Поступило: 31 марта 2020 г .; Одобрена: 19 июня 2020 г .; Опубликовано: 20 июля 2020 г.
Авторские права: © 2020 Gostelie et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Муковисцидоз (КФ) — одно из наиболее распространенных аутосомно-рецессивных генетических заболеваний в популяции европеоидной расы, с частотой примерно 1 на 4000–5500 живорождений в Нидерландах.[1,2] Это укорачивающее жизнь заболевание вызвано мутацией в гене регулятора трансмембранной проводимости при кистозном фиброзе (CFTR) , который кодирует белок CFTR, экспрессируемый как канал хлорид-иона на апикальных мембранах секреторного эпителия. Из-за потери транспорта хлоридов у пациентов с МВ выделяется густая вязкая слизь в различных органах. [3–5] Следовательно, заболевание носовых пазух является одним из системных проявлений и встречается почти у всех пациентов с МВ с такими симптомами, как инфекции верхних дыхательных путей, аносмия. , головные боли и заложенность носа с носовыми полипами или без них.[6–8] Признание и лечение проблем верхних дыхательных путей у пациентов с МВ важно, потому что это может привести к снижению качества жизни. [6,7,9] Кроме того, это может быть ниша для патогенов, которые могут привести к легочным заболеваниям. инфекции, что в конечном итоге приводит к снижению функции легких и прогрессированию CF. [7,9,10]
МутацииCFTR можно сгруппировать по шести различным классам болезней. Мутации класса I-III связаны практически с отсутствием функционального белка CFTR и, следовательно, с тяжелым фенотипом со значительно более высокой частотой гипоплазии или аплазии пазух и более сильным помутнением в области носовых пазух.[7,11] Мутации класса IV-VI связаны с пониженным количеством функционального CFTR и, как правило, имеют более мягкий фенотип МВ. [7]
На сегодняшний день отсутствуют убедительные доказательства лечения хронической патологии придаточных пазух носа у пациентов с МВ. Несмотря на отсутствие стандартизированных руководств, текущее лечение поражения придаточных пазух носа у пациентов с МВ начинается с консервативного, медикаментозного лечения, включая орошение носа физиологическим раствором, назальные стероиды, системные стероиды, а также местные или системные антибиотики.Когда консервативное вмешательство не дает результатов и симптомы носовых пазух сохраняются, показана функциональная эндоскопическая хирургия носовых пазух (FESS). [4–6,9]
Большинство методов лечения МВ нацелены на вторичные эффекты дисфункции белка CFTR. С момента открытия гена CFTR в 1989 году были разработаны инновационные методы лечения, направленные на основной дефект функции CFTR. [3,12–14] Один из этих методов лечения, ивакафтор (VX-770 или Kalydeco), представляет собой белок CFTR. потенциатор, который может увеличивать время открытия канала CFTR и, следовательно, способствовать увеличению транспорта хлоридов у пациентов с мутацией гейтирования класса III или мутацией класса IV Arg117H.[1,13,15–18]
Исследования, оценивающие использование ивакафтора, показывают значительное улучшение легочной функции. [19–22] Пациенты, у которых была по крайней мере одна мутация G551D CFTR, демонстрируют уменьшение легочных обострений, улучшение качества жизни и веса тела, а также уменьшение потоотделения. концентрация хлорида, без серьезных побочных эффектов. Ивакафтор одобрен для лечения МВ у пациентов в возрасте от 6 месяцев и старше с мутациями гейтинга, такими как мутация G551D класса III, мутация R117H и некоторые другие мутации сплайсинга.[4,6, 23–25] Большинство исследований было проведено на пациентах с муковисцидозом с мутацией G551D, хотя данные in vitro и vivo предполагают, что ивакафтор может иметь потенциальную пользу при других мутациях воротного типа III класса. [16,17,26] Что касается синуса. заболевания, несколько исследований показывают значительное улучшение симптомов придаточных пазух носа и разрешение помутнения придаточных пазух носа после лечения ивакафтором. [27–29] Для наблюдения улучшения симптомов носовых пазух в литературе приводятся различные измерения, в том числе анализ компьютерной томографии (КТ), Уровень оксида азота в носу (nNO), анкеты качества жизни придаточных пазух носа и эндоскопия носа являются наиболее важными.[5,9,30–32]
КТ синуса — широко используемый метод оценки степени и стадии хронического риносинусита. Наиболее часто используемая система оценки тяжести риносинусита — это шкала Лунда-Маккея (L-M) или модифицированная шкала L-M у пациентов с различной степенью развития пазух. [5,31,33,34]
Оксид азота (NO) — это газ свободных радикалов, образующийся в дыхательных путях путем превращения аминокислоты L-аргинина в L-цитруллин с помощью трех форм фермента NO-синтазы.NO встречается в высоких концентрациях в верхних дыхательных путях и может быть обнаружен орально в выдыхаемом воздухе или измерен непосредственно в полости носа и придаточных пазухах носа. [30,35] Предыдущие исследования показывают, что носовые уровни NO значительно ниже у пациентов с МВ по сравнению с здоровый контроль. [36–40]
На сегодняшний день имеется ограниченная литература о влиянии ивакафтора на пациентов с муковисцидозом III класса с синоназальными симптомами. Учитывая тот факт, что ивакафтор усиливает дефектные хлоридные каналы в различных тканях, дальнейшие исследования ивакафтора у пациентов, страдающих CF, могут, возможно, изучить уменьшение синоназальных проблем.[9,16]
В рамках этого исследования мы стремимся оценить влияние ивакафтора у пациентов с S125N-опосредованным МВ на здоровье придаточных пазух носа путем изучения компьютерной томографии придаточных пазух носа, уровней nNO, симптомов придаточных пазух носа и результатов назальной эндоскопии.
Методы
Характеристики пациентов
В период с июня 2015 года по декабрь 2016 года восемь пациентов с МВ с гейт-мутацией S1251N класса III проходили лечение в Университетском медицинском центре Утрехта (UMCU), Нидерланды. В это ретроспективное когортное исследование были включены пациенты, которым лечащий врач считал, что ивакафтор будет подходящим как часть их плана лечения, с ивакафтором по 150 мг два раза в день.Наличие мутации S1251N использовалось в качестве критерия для определения того, какие пациенты получали ивакафтор. Это решение было принято в рамках плановой клинической помощи. Протокол исследования был одобрен Медицинским этическим комитетом Утрехтского медицинского центра (METC Utrecht). Из историй болезни пациентов были собраны различные клинические и социально-демографические данные, такие как возраст, пол, дополнительные лекарства и история хирургии носовых пазух. Кроме того, были задокументированы образцы мазков из носоглотки и посевов мокроты или образцы мазков из ротоглотки.Этический комитет отказался от согласия родителей или опекунов детей, включенных в это исследование.
Компьютерная томография
Всем пациентам была выполнена компьютерная томография придаточных пазух носа до и через год после терапии ивакафтором. Модифицированная шкала L-M использовалась для анализа помутнения придаточных пазух носа из-за высокой распространенности неразвитых придаточных пазух носа у детей с МВ. 31 Эта утвержденная система оценок оценивает каждую часть носовых пазух в отдельности со следующей оценкой: 0: нормальное, 1: частичное помутнение и 2: полное помутнение.Более того, остиомеатальный комплекс (OMC) был оценен как 0: проходимость или 2: окклюзия. Четыре оториноларинголога независимо друг от друга оценили верхнечелюстную пазуху, переднюю решетчатую, заднюю решетчатую, клиновидную и лобную пазухи с обеих сторон. Они не учитывали характеристики пациентов и случайным образом оценивали результаты всех КТ-сканирований до и после введения ивакафтора. Используя этот метод, можно было сравнить оценку помутнения (L-M) околоносовых пазух до и после одного года лечения ивакафтором.В целом более низкий балл L-M часто означает менее тяжелое бремя заболевания носовых пазух. [34,41]
В случае разногласий в оценке отсутствия придаточных пазух носа пазухи не включались в анализ, если два или более из четырех оториноларингологов указали на отсутствие придаточных пазух носа.
Измерение оксида азота через нос
Уровни NO в носу измеряли до и через два месяца после применения ивакафтора с помощью хемилюминесцентного анализатора.Тефлоновая «назальная оливковая» трубка была вставлена в одну из ноздрей пациента, чтобы обеспечить воздухонепроницаемое уплотнение, гарантируя, что воздух может выходить из ноздри только через центральный канал трубки. Через носовую трубку выдыхаемый воздух собирался с постоянной скоростью, в то время как пациенты медленно выдыхали через рот, преодолевая сопротивление выдоху, со стандартизованным положительным давлением. Посредством этого процесса было достигнуто закрытие велума для измерения только концентраций nNO в верхних дыхательных путях, а не уровней NO в нижних дыхательных путях.Концентрации nNO регистрировались, когда значения выходили на плато концентрации NO. Измерения проводили в трех экземплярах, рассчитывали средние значения nNO.
Синоназальные симптомы и результаты назальной эндоскопии
Симптомы, связанные с хроническим риносинуситом, регистрировались по четырехбалльной шкале, чтобы указать тяжесть симптомов, затронувших пациента, с более высокими баллами, указывающими на более высокую степень тяжести. Информация о следующих симптомах: ринорея, заложенность носа, постназальный отек, лицевая боль, головная боль и аносмия или гипосмия ретроспективно регистрировалась на основании карт пациентов.Для каждого синоназального симптома было подсчитано, сколько из включенных пациентов имели этот симптом до и после двух месяцев применения ивакафтора, а также с какой степенью тяжести. Для оценки результатов эндоскопических исследований использовалась модифицированная шкала Лунда-Кеннеди. [42,43] Информация о носовых полипах, выделениях из носа и отеках была собрана для каждого пациента до и после двух месяцев терапии ивакафтором.
Данные и статистика
Статистический анализ данных был выполнен с использованием SPSS для Windows версии 25.Описательная статистика использовалась для клинических и социально-демографических данных участников. После оценки распределения результатов сравнение степени помутнения придаточных пазух носа с использованием или без использования ивакафтора было исследовано с помощью непараметрического критерия Вилкоксона. Оценка LM проводилась четырьмя оториноларингологами, поэтому мы решили провести анализ чувствительности, в котором мы проанализировали самую низкую оценку LM (лучший случай), а также самую высокую оценку LM (худший случай), данную оториноларингологами для придаточных пазух носа, до и после одного года использования ивакафтора.С помощью коэффициента конкордантности Кендалла мы рассчитали межэкспертную изменчивость между четырьмя оториноларингологами. Более высокое значение коэффициента Кендалла означает, что отоларингологи применили практически тот же стандарт при оценке помутнения носовых пазух. Различия в уровнях nNO проверяли с помощью теста Wilcoxon Signed Rank. P-значения <0,05 считались статистически значимыми. Из-за небольшого количества пациентов и отсутствия значений в сообщаемых симптомах и эндоскопических данных, мы не проводили статистический анализ симптомов или эндоскопического уменьшения.
Результаты
Пациенты
Пять из восьми пациентов были мужчинами (63%), а средний возраст начала применения ивакафтора составлял 16 лет (диапазон 9–26). Двум пациентам перед лечением ивакафтором были выполнены множественные операции на носовых пазухах (25%) (таблица 1). Ни одному из пациентов в период применения ивакафтора не проводились операции на носовых пазухах. Во время лечения ивакафтором двое пациентов получали системные стероиды. Один принимал стероиды примерно в течение недели из-за обострения МВ, вероятно, из-за аллергического бронхолегочного аспергиллеза (АБЛА).Другие использовали стероиды в течение более длительного периода времени из-за симптомов артрита. У трех пациентов Pseudomonas aeruginosa культивировали из верхних дыхательных путей (мазки из носоглотки) до применения ивакафтора. В двух из них не было культивирования микроорганизмов из верхних дыхательных путей после применения ивакафтора. У одного из этих пациентов после лечения ивакафтором был культивирован золотистый стафилококк. Staphylococcus aureus также культивировали из верхних дыхательных путей у одного пациента перед применением ивакафтора.После применения ивакафтора у этого пациента не было культивирования микроорганизмов. Aspergillus fumigatus культивировали из нижних дыхательных путей у пяти из восьми включенных пациентов до использования ивакафтора. После применения ивакафтора только у одного из этих пяти пациентов культивировали Aspergillus fumigatus (таблица S1). Один пациент скончался через несколько месяцев после начала приема ивакафтора из-за передозировки рекреационных наркотиков экстази (3,4-метилендиоксиметамфетамин). Таким образом, этот пациент не смог пройти обычную компьютерную томографию через год и был исключен из анализа оценок L-M.
Компьютерная томография
Для верхнечелюстной пазухи и передней решетчатой кости было статистически значимое уменьшение помутнения пазух с обеих сторон после одного года использования ивакафтора, см. Рис. 1 и Таблицу 2. Кроме того, лобная пазуха и OMC (Таблица 2) показали улучшение помутнения синуса. и проходимость комплекса после одного года терапии ивакафтором для правой стороны лобной пазухи и левой стороны ОМС. Другие части этих синоназальных компонентов не показали статистически значимого улучшения.Для задней решетчатой кости и клиновидной кости различия между помутнением до и после терапии ивакафтором были меньше. Статистически значимого улучшения помутнения этих околоносовых пазух не наблюдалось (таблицы 2 и S2 – S5). Различия между оценками помутнения у четырех отоларингологов до применения ивакафтора варьировались от 0,061 до 0,505, а после применения ивакафтора от 0,000 до 0,333 (таблица 2).
Оксид азота назальный
Медианные уровни nNO (IQR) значительно увеличились с 220,00 (136,00–341,18) до 462,84 (233,17–636,25) частей на миллиард (частей на миллиард) (p = 0,017) после двух месяцев применения. ивакафтора, см. Таблицу 3.У четырех из восьми пациентов уровни nNO были доступны после одного года терапии ивакафтором. У этих четырех пациентов в период от двух до двенадцати месяцев уровни nNO не увеличивались. (От 583,34 (299,42–781,75) до 521,00 (231,75–689,50) частей на миллиард (p = 0,465)) (Рис. 2 и Таблица 3).
Синоназальные симптомы и результаты назальной эндоскопии
После лечения ивакафтором ни у одного из восьми включенных пациентов не было симптомов заложенности носа, постназального подтекания и лицевой боли. Перед применением ивакафтора четыре пациента (50%) иногда сообщали о симптомах заложенности носа, а у одного пациента (13%) часто наблюдались симптомы заложенности носа.Перед применением ивакафтора иногда сообщалось о постназальном кровотечении у одного пациента (13%) и часто у другого пациента (13%). У одного пациента (13%) лицевая боль часто присутствовала до применения ивакафтора. (Таблица 4). У пяти пациентов (63%) не было головных болей после терапии ивакафтором, по сравнению с двумя пациентами (25%) до лечения ивакафтором. Один пациент (13%) заметил значительное улучшение симптомов аносмии или гипосмии после использования ивакафтора, поскольку у этого пациента восстановилось обоняние после трех недель использования ивакафтора.Два пациента (25%) сообщили о заметном усилении симптомов ринореи после начала приема ивакафтора. (Таблица 4 и S1, рис.) Кроме того, у трех пациентов (38%) носовые полипы и выделения из носа исчезли после лечения ивакафтором. Противоречиво то, что у двух пациентов (25%) сообщалось об усилении отека после применения ивакафтора. (Таблица 4 и рис. S2)
Обсуждение
Это исследование показывает, что ивакафтор играет важную роль в улучшении здоровья носовых пазух у пациентов с МВ с мутацией S1251N.Анализ компьютерной томографии показывает значительное уменьшение помутнения большинства придаточных пазух носа через год после лечения ивакафтором. Уровень оксида азота в носу значительно улучшается. Аналогичным образом, большинство симптомов придаточных пазух носа и носовой эндоскопической патологии уменьшаются или исчезают после двух месяцев применения ивакафтора.
Компьютерная томография показала значительное уменьшение помутнения всех придаточных пазух носа у всех пациентов после применения ивакафтора в течение одного года. Для гайморовой пазухи, передней решетчатой кости и отдельных частей лобной пазухи и остиомеатального комплекса мы замечаем статистически значимое снижение.Однако этого не произошло с небольшим улучшением помутнения задней части решетчатой кости и клиновидной кости. Эти результаты согласуются с исследованием Sheikh et al. 2015 г., который показывает значительное улучшение, измеренное с помощью компьютерной томографии (КТ), после лечения ивакафтором у двенадцати пациентов с муковисцидозом с мутацией G551D [27].
Значительное повышение уровня nNO после двух месяцев применения ивакафтора, возможно, можно объяснить уменьшением густой слизистой оболочки, носовых полипов или воспаления и, таким образом, уменьшением обструкции придаточных пазух носа и верхних дыхательных путей.То, что это открытие является обратимым после модуляции CFTR с помощью ивакафтора, является новинкой и следует подчеркнуть. К сожалению, из-за ретроспективного анализа, измерения nNO только у четырех из восьми включенных пациентов доступны после одного года использования ивакафтора. У трех пациентов уровень nNO ниже после одного года применения ивакафтора по сравнению с уровнем nNO после двух месяцев терапии ивакафтором. Возможная причина снижения уровня nNO заключается в том, что назальное лечение было прекращено из-за значительного улучшения, которое пациенты испытали в отношении своих синоназальных симптомов.В качестве альтернативы, это могло быть связано с различиями в измерениях у небольшой группы пациентов.
Кроме того, при лечении ивакафтором улучшились симптомы придаточных пазух носа. Все включенные пациенты положительно реагируют на симптомы придаточных пазух носа после введения ивакафтора. Примечательно, что вскоре после начала приема ивакафтора пациенты часто сообщают об увеличении выработки слизи, иногда сопровождающемся головными болями. Обычно эти жалобы исчезают через пару дней, и пациенты сообщают о значительном улучшении физической активности и отсутствии заложенности носа с отсутствием густой слизи.Некоторые пациенты даже прекращают прием назальных лекарств из-за этих значительных улучшений. Кроме головных болей, увеличения мокроты, болей в животе, тошноты и рвоты, серьезных побочных эффектов ивакафтора не сообщалось. Наши результаты согласуются с предыдущими отчетами. Например, Chang et al. 2015, описывает обращение симптомов придаточных пазух носа у пациента с мутацией G551D / P205S после применения ивакафтора. [28] Как и в 2015 году, отчет Vreede et al. который описывает улучшение патологии носовых пазух у пациента с муковисцидозом с мутацией S1251N, получавшего потенциатор ивакафтор.[29]
Сила этого исследования заключается в том, что КТ независимо оцениваются четырьмя отоларингологами. Если посмотреть на вариабельность между экспертами, надежность этой модифицированной системы оценки L-M для оценки компьютерной томографии, выполненной разными отоларингологами, кажется умеренной. Еще одной сильной стороной этого исследования является то, что это первое исследование, в котором изучается состояние придаточных пазух носа до и после применения ивакафтора с помощью четырех различных измерений параназальных исходов.
Необходимо упомянуть некоторые ограничения.Благодаря дизайну нашего исследования информация о синоназальных симптомах ретроспективно извлекается из медицинских записей. Следовательно, это приводит к неодинаково задокументированным симптомам для разных пациентов и большому количеству пропущенных значений. Никакие стандартизированные анкеты, такие как Sino-Nasal Outcome Test -20 (SNOT-20), не используются для документирования синоназальных симптомов включенных пациентов в фиксированном, структурированном виде. [32,44–47] Кроме того, поскольку предыдущие исследования были показали, что пациенты с МВ часто занижают свои хронические синоназальные симптомы, связанные с МВ, вполне возможно, что не все синоназальные симптомы у пациентов задокументированы правильно.[5,8,44,48]
Поскольку ожидаемая продолжительность жизни пациентов с МВ продолжает увеличиваться, число пациентов, обращающихся за лечением по поводу хронического заболевания носовых пазух, связанного с МВ, скорее всего, будет продолжать расти. [49] В будущем исследования должны измерять параметры исходов придаточных пазух носа, такие как помутнение носовых пазух, уровни nNO и анкеты для придаточных пазух носа, чтобы лучше понять роль модуляторов CFTR в лечении и последующем наблюдении патологии носовых пазух у пациентов с МВ. Поэтому мы рекомендуем измерять уровни концентрации nNO и использовать стандартизированные системы оценки для анализа компьютерной томографии носовых пазух, поскольку это может помочь документировать состояние носовых пазух у пациентов с МВ.
Перспективы для будущих исследований могут заключаться в объединении двух потенциаторов в S1251N, опосредующих пациентов, чтобы увидеть, есть ли увеличение опосредованной CFTR секреции хлоридов, и, таким образом, лучшее лечение пациентов с муковисцидозом. Или есть аналогичные эффекты с другими видами потенцирующих препаратов?
Заключение
Лечение ивакафтором значительно снижает помутнение носовых пазух, как это видно на КТ носовых пазух, увеличивает уровни концентрации nNO и улучшает симптомы придаточных пазух носа и эндоскопические данные, что указывает на положительное влияние на здоровье носовых пазух у пациентов с МВ с мутацией S1251N.
Список литературы
- 1. Сликер М.Г., Уитервал С.С., Синаасаппель М. и др. Распространенность рождений и выживаемость при муковисцидозе: национальное когортное исследование в Нидерландах. Сундук 2005; 128: 2309–15. pmid: 16236889
- 2. Всемирная организация здравоохранения (2019), Пациенты и общественность, Гены и болезни человека, Муковисцидоз. Доступно по адресу: https://www.who.int/genomics/public/geneticdiseases/en/index2.html#CF
- 3. Эльборн ЖС 1 .Кистозный фиброз. Ланцет. 2016 19 ноября; 388 (10059): 2519–2531.
- 4. О’Салливан Б.П. 1 , Фридман С.Д. Кистозный фиброз. Ланцет. 30 мая 2009 г .; 373 (9678): 1891–904.
- 5. Gysin C 1 , Alothman GA, Papsin BC. Синоназальная болезнь при муковисцидозе: клинические характеристики, диагностика и лечение. Педиатр Пульмонол. 2000 декабрь; 30 (6): 481–9. pmid: 11109061
- 6. Чаабан М.Р., Кейнер А., Роу С.М., Вудворт Б.А. Муковисцидоз, хронический риносинусит: всесторонний обзор Am J Rhinol Allergy, 27 (5) (сентябрь 2013 г.), стр.387–395. pmid: 24119602
- 7. Berkhout MC, ван Роден CJ, Rijntjes E, Fokkens WJ, El Bouazzaoui LH, Heijerman HG. Синоназальные проявления муковисцидоза: корреляция между генотипом и фенотипом? J Cyst Fibros, 13 (4) (июль 2014 г.), стр. 442–448. pmid: 24210900
- 8. Гамилос ДЛ 1 . Хронический риносинусит у больных муковисцидозом. J Allergy Clin Immunol Pract. Июль-август 2016 г .; 4 (4): 605–12. pmid: 27393775
- 9. Kang SH 1 , Dalcin Pde T 1 , Piltcher OB 2 , Migliavacca Rde O.Хронический риносинусит и полипоз носа при муковисцидозе: обновленная информация о диагностике и лечении. J Bras Pneumol. 2015, январь-февраль; 41 (1): 65–76. pmid: 25750676
- 10. Аанес К 1 . Бактериальный синусит может быть очагом начальной колонизации легких и хронической легочной инфекции у пациентов с муковисцидозом. J Cyst Fibros. 2013 сен; 12 Приложение 2: S1–20.
- 11. Феррил GR 1 , Ник Дж. А., Гетц А. Э. и др. Сравнение рентгенологических и клинических характеристик генотипов муковисцидоза низкого и высокого риска.Int Forum Allergy Rhinol. 2014 ноя; 4 (11): 915–20. pmid: 25224556
- 12. Белл СК 1 , Де Бок К 2 , Амарал MD 3 . Новые фармакологические подходы к лечению муковисцидоза: перспективы, успехи, подводные камни. Pharmacol Ther. 2015, январь; 145: 19–34. pmid: 24932877
- 13. Бойл М.П. 1 , Де Бок К 2 . Новая эра в лечении муковисцидоза: коррекция основного дефекта CFTR. Ланцет Респир Мед. 2013 Апрель; 1 (2): 158–63.pmid: 24429096
- 14. Риордан Дж. Р., Ромменс Дж. М., Керем Б. и др. Идентификация гена муковисцидоза: клонирование и характеристика комплементарной ДНК. Science, 245 (4922) (8 сентября 1989 г.), стр. 1066–1073 pmid: 2475911
- 15. Amaral MD, Kunzelmann K. Молекулярное нацеливание CFTR как терапевтический подход к муковисцидозу. Trends Pharmacol Sci, 28 (7) (июль 2007 г.), стр. 334–341. pmid: 17573123
- 16. Ю Х, Бертон Б., Хуанг С. Дж. И др.Потенцирование ивакафтора нескольких каналов CFTR с помощью стробирующих мутаций. J Cyst Fibros, 11 (3) (2012, май), стр. 237–245. pmid: 22293084
- 17. Ван Гур Ф., Хадида С., Гроотенхуис П.Д. и др. Восстановление функции эпителиальных клеток дыхательных путей при МВ in vitro с помощью потенциатора CFTR, VX-770. Proc. Natl. Акад. Sci. США 2009; 106: 18825–18830. pmid: 19846789
- 18. Мосс Р. Б., Флюм П. А., Элборн Дж. С. и др. Эффективность и безопасность ивакафтора у пациентов с муковисцидозом с мутацией Arg117His-CFTR: двойное слепое рандомизированное контролируемое исследование.Ланцет респираторной медицины, 3 (7), 524–533. (2015). pmid: 26070913
- 19. Accurso FJ 1 , Rowe SM, Clancy JP, et al. Эффект VX-770 у людей с муковисцидозом и мутацией G551D-CFTR. N Engl J Med. 2010 18 ноября; 363 (21): 1991–2003. pmid: 21083385
- 20. Hebestreit H 1 , Sauer-Heilborn A, Fischer R, Käding M, Mainz JG. Влияние ивакафтора на тяжелобольных пациентов с муковисцидозом, несущих мутацию G551D. J Cyst Fibros.2013 декабрь; 12 (6): 599–603. pmid: 23757359
- 21. Рэмси Б.В., Дэвис Дж., МакЭлвейни Н.Г. и др. Потенциатор CFTR у пациентов с муковисцидозом и мутацией G551D. N Engl J Med 2011; 365: 1663–72. pmid: 22047557
- 22. МакКоун Э.Ф., Боровиц Д., Древинек П. и др. Долгосрочная безопасность и эффективность ивакафтора у пациентов с муковисцидозом с мутацией G551d-CFTR: ответ через 144 недели лечения (96 недель PERSIST) Lancet Respir Med. 2014 ноя; 2 (11): 902–910.pmid: 25311995
- 23. Davies J 1 , Sheridan H 2 , Bell N 3 и др. Оценка клинического ответа на ивакафтор с индексом клиренса легких у пациентов с муковисцидозом с мутацией G551D-CFTR и сохраненной спирометрией: рандомизированное контролируемое исследование. Ланцет Респир Мед. 2013 Октябрь; 1 (8): 630–638. pmid: 24461666
- 24.
Davies JC 1 , Wainwright CE, Canny GJ, et al. VX08-770-103 (ENVISION) Исследовательская группа. Эффективность и безопасность ивакафтора у пациентов в возрасте от 6 до 11 лет с муковисцидозом с мутацией G551D.Am J Respir Crit Care Med. 2013 г., 1 июня; 187 (11): 1219–25. pmid: 235
- 25. Фонд кистозного фиброза. FDA одобряет Kalydeco для младенцев с CF. По состоянию на 30 апреля 2019 г. https://www.cff.org/Trials/Pipeline/details/49/Ivacaftor-Kalydeco
- 26. De Boeck K 1 , Munck A 2 , Walker S 3 и др. Эффективность и безопасность ивакафтора у пациентов с муковисцидозом и гейтирующей мутацией, не связанной с G551D. J Cyst Fibros. 2014 декабрь; 13 (6): 674–80.pmid: 25266159
- 27. Sheikh SI 1 , Long FR, McCoy KS, Johnson T., Ryan-Wenger NA, Hayes D. Jr. Ivacaftor улучшает проявление заболевания носовых пазух на компьютерной томографии у пациентов с муковисцидозом с мутацией G551D. Клин Отоларингол. 2015 фев; 40 (1): 16–21. pmid: 25145599
- 28. Чанг EH 1 , Тан XX, Шах В.С. и др. Медицинское лечение хронического синусита у пациента с муковисцидозом с помощью ивакафтора. Int Forum Allergy Rhinol. 2015 фев; 5 (2): 178–81.pmid: 25363320
- 29. Vreede CL, Berkhout MC, Sprij AJ, Fokkens WJ, Heijerman HG. Ивакафтор и патология придаточных пазух носа у пациента с муковисцидозом с генотипом deltaF508 / S1215N. Журнал муковисцидоза. 2015 Май; pmid: 25169789
- 30. de Winter-de Groot KM 1 , van der Ent CK. Оксид азота при муковисцидозе. J Cyst Fibros. 2005 авг; 4 Дополнение 2: 25–9. pmid: 15982933
- 31. Nishioka GJ 1 , Cook PR, McKinsey JP, Rodriguez FJ.Результаты компьютерной томографии околоносовых пазух у пациентов с муковисцидозом. Otolaryngol Head Neck Surg. 1996 Март, 114 (3): 394–9. pmid: 8649872
- 32. Morley AD 1 , Sharp HR. Обзор систем оценки исходов придаточных пазух носа — какая лучше? Клин Отоларингол. 2006 Апрель; 31 (2): 103–9. pmid: 16620328
- 33. Томас SR 1 , Харитонов С.А., Скотт С.Ф., Ходсон М.Э., Барнс П.Дж. Оксид азота в носу и выдыхаемом воздухе снижается у взрослых пациентов с кистозной болезнью fi8.Бальфур-Линн IM1, Лаверти А., Динвидди Р. Снижение содержания оксида азота в верхних дыхательных путях при муковисцидозе. Arch Dis Child. 1996 Октябрь; 75 (4): 319–22.
- 34. Лунд VJ, Mackay IS. Стадия при риносинусите. Ринология, 31 (1993), стр. 183–184 pmid: 8140385
- 35. Sheikh SI 1 , Handly B 2 , Ryan-Wenger NA 3 и др. Новая система компьютерной томографии для определения заболевания носовых пазух у взрослых с муковисцидозом. Анн Отол Ринол Ларингол. 2016 Октябрь; 125 (10): 838–43.pmid: 27357973
- 36. Eggesbø HB 1 , Søvik S, Dølvik S, Eiklid K, Kolmannskog F. КТ-характеристика вариаций развития придаточных пазух носа при муковисцидозе. Acta Radiol. 2001 сентябрь; 42 (5): 482–93. pmid: 11552886
- 37. Манна А 1 , Монтелла С., Манискалько М., Маглионе М., Сантамария Ф. Клиническое применение назального измерения оксида азота при заболеваниях дыхательных путей у детей. Педиатр Пульмонол. 2015, январь; 50 (1): 85–99. pmid: 25156952
- 38.de Winter-de Groot KM 1 , van Haren Noman S, Speleman L, Schilder AG, van der Ent CK. Уровни оксида азота в носу и полипоз носа у детей и подростков с муковисцидозом. JAMA Otolaryngol Head Neck Surg. 2013 сентябрь; 139 (9): 931–6. pmid: 24051748
- 39. Уокер WT 1 , Лью А., Харрис А., Коул Дж., Лукас Дж. С.. Уровни оксида азота в верхних и нижних дыхательных путях при первичной цилиарной дискинезии, муковисцидозе и астме. Respir Med. 2013 Март; 107 (3): 380–6.pmid: 232
- 40. Krantz C 1 , Janson C, Hollsing A, Alving K, Malinovschi A. Выдыхаемый и назальный оксид азота в зависимости от функции легких, количества клеток крови и характеристик заболевания при муковисцидозе. J Breath Res. 2017 20 марта; 11 (2): 026001. pmid: 28220034
- 41. Oluwole M 1 , Russell N, Tan L, Gardiner Q, White P. Сравнение компьютерных томографических систем определения стадии при хроническом синусите. Clin Otolaryngol Allied Sci.1996 Февраль; 21 (1): 91–5. pmid: 8674232
- 42. Лунд VJ, Кеннеди DW. Стадия хронического риносинусита. Отоларингол. Head Surg., 3 (1997), стр. 5–40.
- 43. Psaltis AJ 1 , Li G, Vaezeafshar R, Cho KS, Hwang PH. Модификация эндоскопической балльной системы Лунда-Кеннеди повышает ее надежность и корреляцию с показателями результатов, сообщаемыми пациентами. Ларингоскоп. 2014 Октябрь; 124 (10): 2216–23. pmid: 24615873
- 44. Чан Д.К., Макнамара С., Парк Дж.С., Вайда Дж., Гибсон Р.Л., Парих С.Р.Качество жизни носовых пазух у детей с муковисцидозом. JAMA Otolaryngology – Head Neck Surg., 142 (2016), pp. 743–749. pmid: 27228505
- 45. Се DX 1 , Ву J 2 , Келли K 1 , Браун RF 3 , Шеннон C 4 , Virgin FW 5 . Оценка качества жизни носовых пазух и носа в популяции пациентов с муковисцидозом у детей. Int J Pediatr Otorhinolaryngol. 2017 ноя; 102: 133–137. pmid: 29106860
- 46.Wentzel JL 1 , Virella-Lowell I, Schlosser RJ, Soler ZM. Количественная оценка синоназальных симптомов в неотобранной педиатрической популяции с муковисцидозом. Am J Rhinol Allergy. 2015 сентябрь-октябрь; 29 (5): 357–61. pmid: 26358346
- 47. Virgin FW. Клинические исходы хронического риносинусита у детей с муковисцидозом. Laryngoscope Investig. Отоларингол. (2017). pmid: 29094071
- 48. Nishioka GJ 1 , Повар PR. Заболевание околоносовых пазух у больных муковисцидозом.Otolaryngol Clin North Am. 1996 фев; 29 (1): 193–205 pmid: 8834282
- 49. Burgel PR 1 , Bellis G 2 , Olesen HV 3 , Viviani L 4 , Zolin A 4 , Blasi F 5 и др. Целевая группа ERS / ECFS по оказанию помощи взрослым с муковисцидозом в Европе.

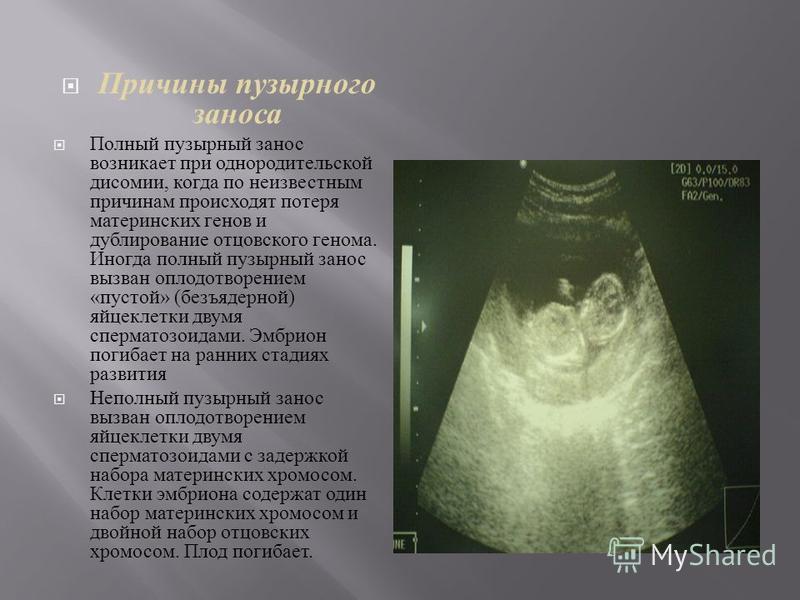 Клиническая картина пузырного заноса создаёт впечатление нормально прогрессирующей беременности. Пузырный занос может быть полным (классическим) или неполным (частичным). При полном пузырном заносе изменения захватывают весь хорион, при частичном — только его часть. К пузырному заносу относят также синцитиальный эндометрит.
Клиническая картина пузырного заноса создаёт впечатление нормально прогрессирующей беременности. Пузырный занос может быть полным (классическим) или неполным (частичным). При полном пузырном заносе изменения захватывают весь хорион, при частичном — только его часть. К пузырному заносу относят также синцитиальный эндометрит.