Витамин D — механизм действия и нужно ли принимать добавки / Хабр
В современной литературе про поддержание здорового образа жизни и ее продление часто упоминается витамин D. В некоторых работах рекомендуется регулярно проверять его уровень и пить поддерживающие дозы, а в других работах утверждается, что непонятно есть ли от этого польза.
В нашей статье мы разберемся что такое витамин D, как он работает, на что влияет и, если вы пришли к выводу, что хотите его принимать для улучшения здоровья и продления жизни, то как это правильно делать.
Немного истории и общее описание
Витамин D был открыт в 1922 году и изначально рассматривался как обычный витамин. Однако, сейчас его считают провитамином, то есть он должен пройти несколько стадий биохимических преобразований для активации.
Уникальность витамина D заключается в том, что он поступает в наш организм не только с пищей, но и вырабатывается телом при воздействии солнечных лучей. Это затрудняет разработку рекомендаций по его приему как добавки.
Однако, нам гикам, обычно, можно отбросить фактор солнца, такие уж у нас жизненные привычки.
Общее название витамин D (также кальциферол) включает в себя несколько секостероидов из которых самые важные формы D2 и D3.
D2 мы получаем только с пищей, а D3 вырабатывается при попадании на кожу ультрафиолета + с пищей. По своему воздействию они одинаковы, что можно увидеть на картинке выше. Однако, до сих пор ведутся исследования, что полезнее принимать в долговременной перспективе. Пока однозначного ответа нет и мы можем принять, что это не важно и покупать наиболее подходящую форму D2 или D3.
В некоторых странах, например США, Канаде, Индии, продают молоко и другие продукты обогащенные витамином D. В 2016 году FDA (государственное агентство по лекарствам США) одобрило увеличение норм витамина D в молоке и заменяющих его напитках (соевое молоко и т.п.), до 84 МЕ (или IU) на 100 грамм продукта. Это косвенно может сказать о том, что недостаток витамина D официально признан.
Для измерения растворимых витаминов дозы обычно измеряются в МЕ (Международные единицы) или IU (International Unit). У каждого витамина своё соответствие прямому весу. Один микрограмм (одна миллионная грамма) витамина D = 40IU (400IU = 10мкг или µg).
Почему витамин D важен для нашего здоровья
Для целей продления жизни и здорового мозга поддержание нормального уровня витамина D очень важно и поэтому мы начали серию статей про витамины именно с него.
Изначально, главной ролью этого витамина считалось поддержание гомеостаза кальция и костей. Иными словами, при его недостатке у может развиваться рахит у детей или остеопороз у взрослых. Именно при изучении рахита витамин D и был открыт.
Для более полного перечня возможных болезней от недостатка витамина (к примеру слабость, боль в костях, боль в мышцах и т.п.) и для полного изучения доказательной базы по нему можно посмотреть на Pubmed очень полный системный обзор с рекомендацией ввести скрининг в США + второй обзор про дефицит этого витамина у взрослых.
И хотя только проблем с костями и мышцами достаточно для того, чтобы начать поддерживать уровень этого витамина в норме, но, плюс к этому, в последние десятилетия было выяснено, что витамин D участвует еще в очень многих важных процессах организма:
(ниже ссылки на канал Telegram, в котором переведены выдержки из исследований Пабмед, название статьи — ссылка на оригинал на Pubmed)
(картинка из журнала Nature про участие в работе иммунной системы)
Тут мы приводим только важные для нас пункты, если набрать поиск по витамину D на https://scholar.google.ru, то только за последний год мы получим 53000 результатов. В общем и целом понятно, что если у нас есть недостаток этого витамина, то желательно принимать добавку, для поддержания его на нормальном уровне.
Конечно, вся эта информация не к тому, что найдена какая-то панацея и мы теперь будем жить вечно. Но этот витамин, согласно множеству современных исследований, довольно важно поддерживать на нормальном уровне для долговременного здоровья. Тем более цена вопроса совсем не высока.
Тем более цена вопроса совсем не высока.
Еще для информации.
Также в книгах и статьях часто пишут о том, что витамин D предотвращает рак и сердечно-сосудистые заболевания. Однако, есть вероятность, что он не предотвращает их, а сопровождает. Иначе говоря, приемом добавок и повышением его уровня в крови мы не сможем предотвратить эти заболевания. Для выяснения этого вопроса было проведено огромное контролируемое плацебо исследование в Новой Зеландии.
Оно шло 4 года и в нем приняло участие 5100 человек, около половины принимали плацебо, другие принимали 100 000 IU витамина D ежемесячно.
По результатам этого исследования было выяснено, что это не снизило вероятность этих болезней. ОДНАКО! Сами исследователи отметили, что в Новой Зеландии у большей части проходящих исследование уровень в крови был 32.8 ng/mL (у плацебо тоже), а примерно у 75% населения США имеет уровень ниже 30 ng/mL, и около 30% ниже 20 ng/mL. (Примечание Lifext — а в России, где еще меньше солнца чем в США и где молоко не обогащают витамином D — можно предположить, что еще ниже)
Поэтому, как отмечают авторы, требуются дополнительные исследования. (исследование 1, исследование 2)
(исследование 1, исследование 2)
Какие уровни нормальные и какие дозы пить?
Для витамина D мы можем определить свою норму, сдав анализ крови на его содержание. Измеряется показатель 25(OH)D (основной метаболит витамина D, присутствующий в крови) и считается, что уровень 30-100нг/мл является нормальным (см. источник)
В некоторых книгах про продление жизни и здоровья мозга указываются следующие параметры к которым авторы рекомендуют стремиться
- “Норма – между 30 и 100 нг/мл, но это не значит, что можно остановиться на показателе 31. Оптимальный уровень витамина D составляет около 80 нг/мл. Это середина так называемой нормальной зоны. Попросите своего терапевта помочь вам скорректировать дозировку для достижения оптимального уровня. После этого, как правило, достаточно приема 2000 МЕ, чтобы поддерживать здоровый уровень. И все же обязательно проконсультируйтесь с врачом.” (Кристин Лоберг Дэвид Перлмуттер Еда и мозг.)
- “ваш уровень должен быть как минимум 50 нг/мл” (Рэй Курцвейл, Терри Гроссман Transcend: девять шагов на пути к вечной жизни)
Условие выбора вашей дозы
- уровень 25(OH)D < 20 нг/мл — принимать по 5000 МЕ витамина D в день (см.
 источник)
источник) - 21 < уровень 25(OH)D < 30 — ежедневно 2000 МЕ
- 31 < уровень 25(OH)D < 80 — ежедневно 1000 МЕ
(все рекомендации только для взрослых людей)
ВАЖНО! Если вы пьете дозу 2000МЕ в день и более, то уровень витамина обязательно замерять один раз в три месяца.
Дозу 1000МЕ вполне безопасно пить ежедневно, при этом, замеряя уровень витамина 1 раз в год и, если он ниже 30нг/мл, то увеличивать ее по схеме выше и делать новый замер через три месяца.
Итак, если вам лень замерять уровень и вы не работаете на солнце по часу и более в день (что кстати, скорее вредно, чем полезно), то можно смело начинать пить витамин D в дозировке 1000МЕ (IU) в день.
Через пару месяцев мы придем к полному набору анализов для долгой жизни тела и мозга гика и к тому, куда с ними идти и попробуем выбить нам скидки на это, а пока вы можете подождать или сделать его в любой лаборатории.
Рекомендации по покупке
Ниже я привожу ссылки на покупку трех витаминов, которые рекомендуется пить всем, особенно в начале весны.
На данный момент вы прочитали полное исследование только витамина D.
Пить ежедневно за завтраком или в другой прием пищи, это позволяет меньше нагружать вашу пищеварительную систему. Все принимаем по 1 шт., кроме рыбьего жира — их по 2 шт.
- Витамин D3 1000 IU
- Если замерили уровень, то один из двух вариантов
дозировка 5000 IU или 2000 IU - Рыбий жир — 2 капсулы за завтраком
В заключение хочу напомнить, что смысл не столько в добавках и витаминах, сколько во внимании к своему образу жизни и направлении мизерной части умственных сил на то, как мы будем жить например в 60, 80, 90 лет (если доживем конечно). Если мы не будем улучшать образ жизни и всякие возникающие нюансы, то добавки мало помогут.
Рекомендуемый комплекс для ежедневного приема
Рыбий жир и витамин D очень важны и для мозга и для тела, минералы и белок важны для долговременного здоровья тела. Желательно принимать тем, кому больше 30 лет.
После 35-40 лет также можно начать принимать пару добавок для молодости кожи и тканей и здоровья суставов:
Витамин механизм действия — Справочник химика 21
Следует подчеркнуть, что главной и отличительной особенностью молекулярных механизмов действия двух основных классов гормонов является то, что действие пептидных гормонов реализуется в основном путем посттрансляционных (постсинтетических) модификаций белков в клетках, в то время как стероидные гормоны (а также тиреоидные гормоны, ретиноиды, витамин Dj-ropMOHbi) выступают в качестве регуляторов экспрессии генов. Это обобщение, однако, не является абсолютным, и здесь возможны модификации, рассмотренные при описании отдельных гормонов. [c.297]Как видно из разд. 7.1, суть большинства химических реакций, протекающих в биологических системах, заключается в окислении или восстановлении одного или более реагентов.
 Однако особенно важный тип реакций, к которому, очевидно, относятся многие ферментативные реакции, не связанные с окислением — восстановлением,— это реакции, включающие перенос протона и сопровождающиеся общим основным или кислотным катализом. Естественно, многие из этих ферментативных превращений осуществляются с помощью небелковых кофакторов или коферментов. К таким коферментам относятся некоторые серосодержащие коферменты, среди которых тиаминпирофосфат (часто называемый витамином В1) имеет наибольшее значение. Сейчас уже очевидно, что механизм действия тиаминпирофосфата включает участие карбаниона в качестве промежуточного соединения. Правда, некоторые особенности этого процесса еще недостаточно изучены. [c.458]
Однако особенно важный тип реакций, к которому, очевидно, относятся многие ферментативные реакции, не связанные с окислением — восстановлением,— это реакции, включающие перенос протона и сопровождающиеся общим основным или кислотным катализом. Естественно, многие из этих ферментативных превращений осуществляются с помощью небелковых кофакторов или коферментов. К таким коферментам относятся некоторые серосодержащие коферменты, среди которых тиаминпирофосфат (часто называемый витамином В1) имеет наибольшее значение. Сейчас уже очевидно, что механизм действия тиаминпирофосфата включает участие карбаниона в качестве промежуточного соединения. Правда, некоторые особенности этого процесса еще недостаточно изучены. [c.458] Механизм действия витамина К в регулировании процессов свертывания крови, вероятно, состоит в том, что он, обладая окислительно-восстанови-
МЕХАНИЗМ ДЕЙСТВИЯ ВИТАМИНОВ, ИХ КЛАССИФИКАЦИЯ И ТЕХНИЧЕСКАЯ ХАРАКТЕРИСТИКА [c. 6]
6]
Витамин Bi принадлежит к числу сравнительно немногих витаминов, механизм действия которых достаточно ясен. [c.156]
По-видимому, уже из этого суждения следует вывод о необходимости изучения законов химической эволюции и законов биогенеза для решения проблемы освоения каталитического опыта живой природы. Небезынтересно в связи с этим напомнить, что даже наиболее оптимистически настроенные химики, которые с успехом моделируют биокатализаторы, все же считают, что они проявили бы легкомыслие, если бы утверждали, что изолированное изучение биокатализаторов— ферментов достаточно для получения исчерпывающей информации о том, что такое биокатализ [ 9, с. 13 . Да, конечно, фермент можно выделить из биосистемы можно точно определить его структуру, во всяком случае не менее точно, чем, например, структуру витамина А или какого-либо стероида. Фермент можно ввести в реакцию и заставить осуществлять каталитические функции. Но, получая фермент в чистом виде и с облегчением выбрасывая остатки исходных материалов, мы жертвуем новым ради привычного — разрушенная клетка со всем ее ферментным аппаратом более интересный объект, чем одна, грубо удаленная деталь (там же).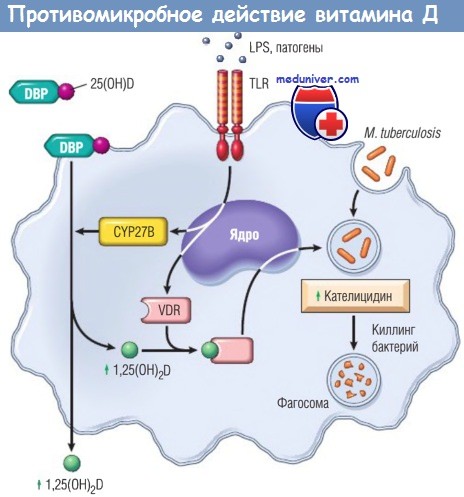
Теория, положенная в основу механизма действия сульфаниламидных препаратов, привела к открытию новых антагонистов для других классов соединений, например витаминов. [c.248]
VJ,Ha современном этапе развития витаминологии ученых стали интересовать вопросы механизма действия витаминов. Установлено, что для выполнения биокаталитических функций значительная часть витаминов должна превращаться в клетках организма в активную форму — кофермент. Это открывает путь для искусственного создания коферментов вне организма с целью использования их в медицине взамен витаминов. Это особенно важно при заболеваниях, связанных с нарушением процесса внутриклеточного биосинтеза коферментов из витаминов. Примером искусственного создания кофермента является синтетическая кокарбоксилаза (эфир тиамина и пирофосфорной кислоты).
[c.379]
Установлено, что для выполнения биокаталитических функций значительная часть витаминов должна превращаться в клетках организма в активную форму — кофермент. Это открывает путь для искусственного создания коферментов вне организма с целью использования их в медицине взамен витаминов. Это особенно важно при заболеваниях, связанных с нарушением процесса внутриклеточного биосинтеза коферментов из витаминов. Примером искусственного создания кофермента является синтетическая кокарбоксилаза (эфир тиамина и пирофосфорной кислоты).
[c.379]
Новейшее учение о функциях и механизме действия витаминов, гормонов, стеринов и других биологически активных веществ, о биофизической связи между ними, о роли и всасывающей способности кожи, о влиянии микродоз различных химических веществ на состояние организма, а также успехи, достиг- Нутые благодаря возможности проникновения в биологический микромир — в мельчайшие клетки живого организма, дали воз- [c.3]
Научные достижения биохимии в последние годы приоткрыли завесу над тайной механизма действия витаминов [c. 6]
6]
Механизм действия витаминов, их классификация и техническая
Дополнительные разделы, завершающие каждую главу, посвящены отдельным достижениям органической химии последних лет. Особое внимание в них уделено роли органической химии в решении проблем в смежных областях науки и технологии, и прежде всего в области биохимии. Читатель, в частности, узнает, каким образом современные достижения органической химии и биохимии позволяют трактовать механизмы действия лекарств, ферментов и витаминов. Он познакомится с механизмом зрения, природой цвета, механизмами вкусовых ощущений, с процессами обмена энергии и веществ в живых организмах. Сведения, обсуждаемые в дополнительных разделах, не являются обязательными для изучения основного [c.8]
ВИТАМИН B,j (кобаламины), группа соед.-производных коррина (ф-ла I), предотвращающих развитие злокачеств анемии и дегенеративные изменения нервной ткани Механизм действия таких соед. (витамеров) связан с участием их коферментных форм (кобамидных коферментов) в ферментативных р-циях. [c.383]
(витамеров) связан с участием их коферментных форм (кобамидных коферментов) в ферментативных р-циях. [c.383]
В 1948 г. было опубликовано сообщение о том, что удалось выделить и охарактеризовать витамин В12 — ингредиент пищи, предотвращающий заболевание лейкозом. Рентгеноструктурный анализ данного соединения, выполненный в 1956 г., и химические исследования показали, что это самый сложный из всех витаминов. Его синтез, осуществленный в 1976 г., явился эпохальным событием в органической химии. Были достигнуты большие успехи в понимании функций и механизма действия коферментных форм витамина В12. [c.109]
Механизм действия витамина А на обмен веществ до настоящего времени не выяснен. Наличие большого количества двойных связей в структуре этого витамина позволяет предполагать его активное участие в различных химических превращениях, в частности в окислительно-восстановительных процессах в тканях. Известным подтверждением этого являются эксперименты, в которых было показано активирование окисления ненасыщенных жирных кислот, а также усиление дыхания ткани печени после прибавления витамина А. Интересно также, что даже местное применение витамина А, например нри обработке ран, приводит к увеличению содержания пуринов в ткани, регенерации эпителия и к быстрому заживлению ран. [c.143]
Интересно также, что даже местное применение витамина А, например нри обработке ран, приводит к увеличению содержания пуринов в ткани, регенерации эпителия и к быстрому заживлению ран. [c.143]
Витамин Bi2 является наиболее активным противоанемическим средством. Механизм действия его недостаточно выяснен, однако доказано, что он участвует в синтезе лабильных метильных групп и в образовании холина, метионина, креатина, нуклеиновых кислот. Он оказывает активное влияние на накопление в эритроцитах соединений, содержащих сульфгидрильные группы участвует в обмене жиров и углеводов. Оказывает благоприятное влияние на функцию печени и нервной системы. Благодаря исследованиям Кастля (1929) стало известно, что для излечения пернициозной анемии, которая ранее протекала со смертельным исходом, необходимы два фактора. Первый получил название внутреннего фактора и содержится в желудочном соке, второй — внешнего фактора, содержится в пищевых продуктах. В 1948 г. Фолкерсу (США) и Смиту (Англия) удалось выделить из печени внешний фактор, оказавшийся витамином и названный витамином или цианокобаламином.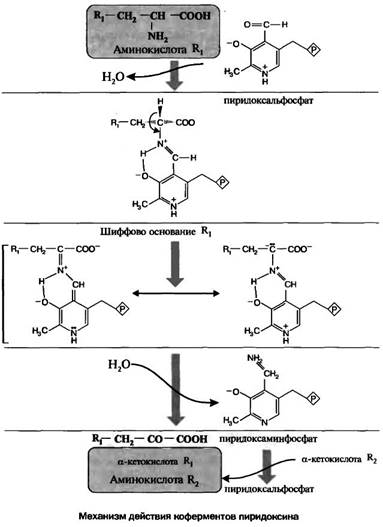 [c.680]
[c.680]
Опишите вероятный механизм действия больших количеств витамина пи-ридоксина, применяемого при лечении генетической болезни цистатионину-рии. [c.427]
В учебнике нашли отражение современные представления о структуре и функциях молекул белков, нуклеиновых кислот, углеводов и липидов. Разделы по химии биополимеров, как и ферментов, витаминов и гормонов, объединены по просьбе большинства рецензентов в первой части учебника. В главах, посвященных витаминам, гормонам и ферментам, представлены новые сведения о биологической роли и механизме действия этих соединений. Опущены данные о первичной структуре ряда пептидных и белковых гормонов, зато приведены новейшие результаты по биогенезу простаглан-динов и родственных соединений простациклинов, тромбоксанов и лейко-триенов. В главе Ферменты подробно рассмотрены проблемы медицинской энзимологии, включая некоторые вопросы инженерной энзимологии. [c.11]
Характер влияния гормонов на обмен веществ отличен от механизма действия ферментов и витаминов.
 Они не вхо 1Лт в состав молекул биологических катализаторов, ферментоп, отличаясь этим от питаминов. [c.241]
Они не вхо 1Лт в состав молекул биологических катализаторов, ферментоп, отличаясь этим от питаминов. [c.241]Помимо воды и некоторых минеральных веществ (фосфора, калия, иода, серы, кальция, железа и т. д.), которые здесь не будут рассматриваться, существуют еще два типа веществ, жизненно необходимых для организма. Речь идет о витаминах и гормонах — биохимически активных веществах, которые, присутствуя в организме в мальк количествах, регулируют многие важные функции. При недостатке в организме того или иного витамина возможно развитие тяжелых болезней примером может служить бери-бери. Хотя биохимические механизмы действия этих веществ очень сложны и точно не выяснены, строение их удалось установить. Рассмотрим ряд подобных примеров. [c.487]
Химический механизм действия витамина А остается нерасшифрованным. Можно предположить, что ретиналь образует шиффовы основания с аминогруппами белков, как это происходит в зрительных пигментах. Нельзя исключить возможного участия ретиналя в окислительно восстановительных реакциях. В присутствии H l протекает неферментативное превращение ретинола в ангидроретинол путем отщепления молекулы воды при этом остается система сопряженных связей. Ангидроретинол встречается в природе, но биологической активностью, по-видимому, не обладает [c.577]
В присутствии H l протекает неферментативное превращение ретинола в ангидроретинол путем отщепления молекулы воды при этом остается система сопряженных связей. Ангидроретинол встречается в природе, но биологической активностью, по-видимому, не обладает [c.577]
Витамин У (от лат. ul us — язва), называемый также противоязвенным фактором и метилметионином, открыт в 1952 г. на основании наблюдений врачей, отметивших лечебное действие капустного сока при язвах желудка и двенадцатиперстной кишки. Большие количества витамина содержатся, кроме того, в спарже, петрушке, шпинате, сельдерее, томатах и молоке. В дозах 250— 300 мг/сут он оказывает болеутоляющее действие и способствует эпителизацин оболочки желудка и кишечника у язвенных больных. Механизм действия этого витамина, являющегося биохимическим донором метильных групп, связан, вероятно, с детоксикацией гистамина и усилением обмена тиамина и холина. [c.692]
Существуют природные соединения, содержащие связь углерод —металл. Хотя большинство металлоорганических соединений нестабильно в водной среде, исследование механизма действия витамина В12 6.86 (см. разд. 6.12.4) выявило, что живые организмы могут использовать реакции металлоорганической химии для решения своих метаболических проблем при функционировании кобольтосодержащих ферментов в качестве промежуточных соединений образуются кобальтоорганические вещества. Что же касается более стабильных метаболитов со связями углерод — металл, то в природе встречаются только простейшие. В последнее время выяснилось, что процесс биометилирования, показанный выше для мышьяка, имеет более широкое распространение. [c.624]
Хотя большинство металлоорганических соединений нестабильно в водной среде, исследование механизма действия витамина В12 6.86 (см. разд. 6.12.4) выявило, что живые организмы могут использовать реакции металлоорганической химии для решения своих метаболических проблем при функционировании кобольтосодержащих ферментов в качестве промежуточных соединений образуются кобальтоорганические вещества. Что же касается более стабильных метаболитов со связями углерод — металл, то в природе встречаются только простейшие. В последнее время выяснилось, что процесс биометилирования, показанный выше для мышьяка, имеет более широкое распространение. [c.624]
Несмотря на то что механизм действия витаминов в организме известен лили, в немногих случаях, можно утверждать, что они не служат источниками энергии, подобно углеводам и жирам, или материалом для построения клеток и скелета, как белки они представляют собой регуляторы жизнедеятельных функций клеток и в этом отношении похожи скорее на ферменты и гормоны. В дальнейшем мы увидим, что некоторые витамины служат организму для синтеза целого ряда ферментов, а именно витамин В является компонентом кокарбоксилазы, витамин Ва —компонентом диафоразы, никотинамид —компонентом кодегидраз I и II, витамин В, — кодекарбоксилазы аминокислот, пантотеновая кислота — компонентом кофермента А и га-аминобензойная кислота — компонентом фолиевой кислоты. [c.272]
В дальнейшем мы увидим, что некоторые витамины служат организму для синтеза целого ряда ферментов, а именно витамин В является компонентом кокарбоксилазы, витамин Ва —компонентом диафоразы, никотинамид —компонентом кодегидраз I и II, витамин В, — кодекарбоксилазы аминокислот, пантотеновая кислота — компонентом кофермента А и га-аминобензойная кислота — компонентом фолиевой кислоты. [c.272]
Некоторые бактерии не нуждаются в экзогенной фолиевой кислоте как факторе роста, так как они сами могут ее синтезировать из п-аминобензойной кислоты-одного из компонентов фолиевой кислоты. Следовательно, н-аминобензой-ная кислота играет роль витамина для таких бактерий. Это открытие оказалось очень ценным, потому что оно позволило понять механизм действия сульфаниламид а-важного лекарственного препарата, ингибирующего рост патогенных бактерий, нуждающихся в и-аминобензойной кислоте. На рис. 10-14 показано, что л-аминобензойная кислота и сульфаниламид очень сходны по своей структуре. Благодаря такому сходству сульфаниламид может конкурировать с -амйно-бензоатом в процессе ферментативного синтеза фолиевой кислоты. [c.286]
Благодаря такому сходству сульфаниламид может конкурировать с -амйно-бензоатом в процессе ферментативного синтеза фолиевой кислоты. [c.286]
В пользу такого механизма действия витамина В1 свидетельствуют два факта. Во-первых, было синтезировано одно из приведенных выше промежуточных соединений — оксиэтилтиамин, которое по биологической активности почти не отличается от самого витамина В1 [c.179]
инструкция по применению, показания, побочные действия
Аскорбиновая кислота (витамин С) обладает выраженными восстановительными свойствами. Относится к группе водорастворимых витаминов. Участвует в окислительно- восстановительных реакциях, регуляции углеводного обмена, влияет на обмен аминокислот ароматического ряда, метаболизм тироксина, биосинтез катехоламинов, стероидных гормонов и инсулина, необходима для свертывания крови, синтеза коллагена и проколлагена, регенерации соединительной и костной ткани. Улучшает проницаемость капилляров. Способствует абсорбции железа в кишечнике и принимает участие в синтезе гемоглобина. Повышает неспецифическую резистентность организма, оказывает неспецифическое общестимулирующее влияние на организм. Дефицит витамина С в пище приводит к развитию гипо- и авитаминоза С, поскольку в организме этот витамин не синтезируется.
Участвует в окислительно- восстановительных реакциях, регуляции углеводного обмена, влияет на обмен аминокислот ароматического ряда, метаболизм тироксина, биосинтез катехоламинов, стероидных гормонов и инсулина, необходима для свертывания крови, синтеза коллагена и проколлагена, регенерации соединительной и костной ткани. Улучшает проницаемость капилляров. Способствует абсорбции железа в кишечнике и принимает участие в синтезе гемоглобина. Повышает неспецифическую резистентность организма, оказывает неспецифическое общестимулирующее влияние на организм. Дефицит витамина С в пище приводит к развитию гипо- и авитаминоза С, поскольку в организме этот витамин не синтезируется.
Со стороны центральной нервной системы: при длительном применении больших доз (более 1 000 мг) – головная боль, повышение возбудимости центральной нервной системы, бессонница.
Со стороны мочевыделительной системы: умеренная поллакиурия (при приеме дозы более 600 мг/сутки), при длительном применении больших доз – гипероксалурия, нефролитиаз (из кальция оксалата), повреждение гломерулярного аппарата почек.
Со стороны пищеварительной системы: при приеме внутрь – раздражение слизистой оболочки желудочно-кишечного тракта, при длительном применении больших доз – тошнота, рвота, диарея, гиперацидный гастрит, ульцерация слизистой оболочки ЖКТ.
Со стороны сердечно-сосудистой системы: при длительном применении больших доз – снижение проницаемости капилляров (возможно ухудшение трофики тканей, повышение артериального давления, гиперкоагуляция, развитие микроангиопатий).
Аллергические реакции: кожная сыпь, гиперемия кожи.
Лабораторные показатели: тромбоцитоз, гиперпротромбинемия, эритропения, нейтрофильный лейкоцитоз, гипокалиемия, глюкозурия.
Прочие: угнетение функции инсулярного аппарата поджелудочной железы
(гипергликемия, глюкозурия). При длительном приеме возможно нарушение обмена цинка, меди.
При длительном приеме возможно нарушение обмена цинка, меди.
В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, необходимо обратиться к врачу.
Симптомы: при длительном применении больших доз (более 1000 мг аскорбиновой кислоты) – головная боль, повышение возбудимости центральной нервной системы, бессонница, снижение проницаемости капилляров (возможно ухудшение трофики тканей, повышение артериального давления, гиперкоагуляция, развитие микроангиопатий), угнетение функции инсулярного аппарата поджелудочной железы (гипергликемия, глюкозурия), гипероксалурия, нефролитиаз, повреждение гломерулярного аппарата почек.
Лечение: отмена лекарственного средства. Показана симптоматическая терапия.
Следует соблюдать осторожность при назначении аскорбиновой кислоты пациентам с повышенной свертываемостью крови, гемохроматозом, сидеробластной анемией, серповидно-клеточной анемией, талассемией, гипероксалурией, почечнокаменной болезнью, полицитемией, лейкемией.
При приеме больших доз и длительном применении лекарственного средства следует контролировать функцию почек и уровень артериального давления, а также функцию поджелудочной железы.
С осторожностью применяют у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы (может вызвать гемолиз эритроцитов).
У пациентов с повышенным содержанием железа в организме следует применять аскорбиновую кислоту в минимальных дозах. Одновременное применение аскорбиновой кислоты с дефероксамином усиливает экскрецию железа. У пациентов с идиопатическим гемохроматозом и талассемией, получавших дефероксамин, после приема аскорбиновой кислоты зафиксированы случаи развития кардиомиопатии и застойной сердечной недостаточности. В данных ситуациях аскорбиновую кислоту следует назначать с осторожностью, необходим мониторинг сердечной функции.
Одновременное применение аскорбиновой кислоты с дефероксамином усиливает экскрецию железа. У пациентов с идиопатическим гемохроматозом и талассемией, получавших дефероксамин, после приема аскорбиновой кислоты зафиксированы случаи развития кардиомиопатии и застойной сердечной недостаточности. В данных ситуациях аскорбиновую кислоту следует назначать с осторожностью, необходим мониторинг сердечной функции.
Всасывание аскорбиновой кислоты может нарушаться при кишечных дискинезиях, энтеритах и ахилии.
Применение аскорбиновой кислоты у пациентов с быстро прогрессирующими и интенсивно метастазирующими злокачественными новообразованиями может усугубить течение процесса.
Одновременное применение витамина С с антацидами, содержащими алюминий, может увеличивать выведение алюминия с мочой. Одновременный прием антацидов и аскорбиновой кислоты не рекомендуется у пациентов с почечной недостаточностью.
Повышенное потребление аскорбиновой кислоты в течение длительного периода может привести к увеличению почечного клиренса и дефициту аскорбиновой кислоты при резкой отмене препарата.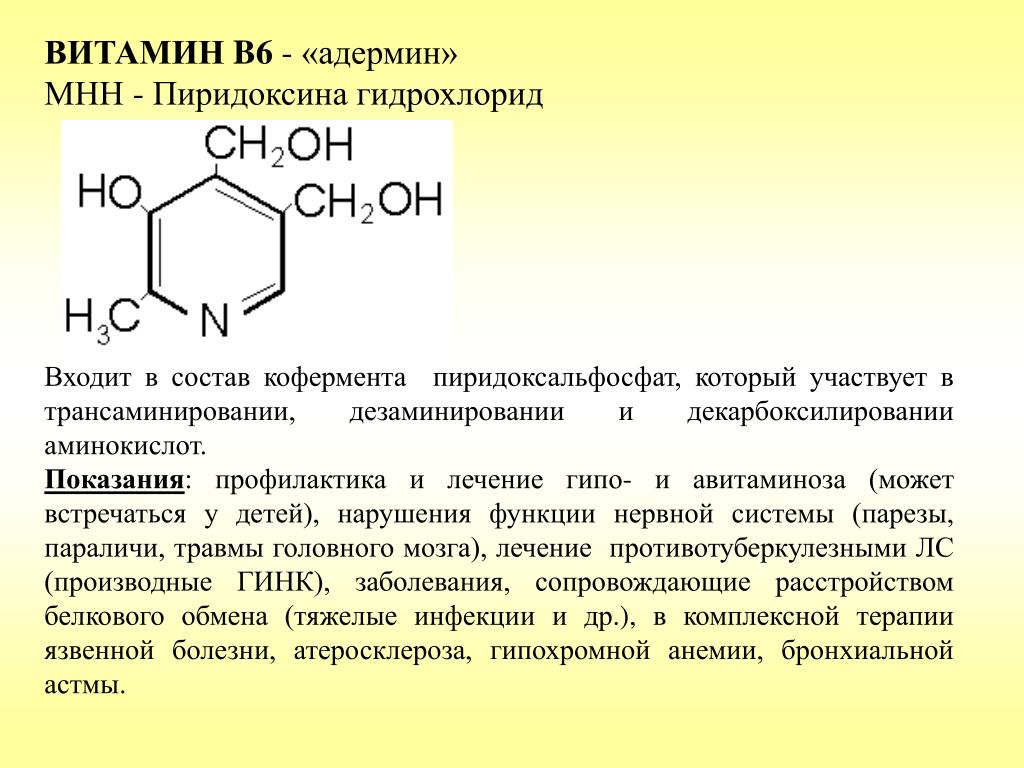
Большие дозы аскорбиновой кислоты связаны с образованием камней оксалата кальция в почках.
Применение аскорбиновой кислоты в терапевтических дозах может искажать результаты тестов для определения глюкозурии.
Витамин С может искажать результаты оценки концентрации мочевой кислоты методом с фосфовольфраматом или уриказой с восстановлением меди и креатинина в недепротеинезированной сыворотке.
Аскорбиновая кислота, как восстановитель, может искажать результаты различных лабораторных тестов (содержание в крови глюкозы, билирубина, активности трансаминаз, лактатдегидрогеназы).
Лекарственное средство не рекомендуется применять одновременно с другими лекарственными средствами, содержащими аскорбиновую кислоту.
Повышает концентрацию в крови бензилпенициллина и тетрациклинов; в дозе 1 г/сутки повышает биодоступность этинилэстрадиола.
Улучшает всасывание в кишечнике препаратов железа (переводит трехвалентное железо в двухвалентное).
Может повышать экскрецию железа при одновременном применении с дефероксамином. Совместный прием витамина С и дефероксамина повышает тканевую токсичность железа, особенно в сердечной мышце, что может привести к декомпенсации системы кровообращения. Витамин С можно принимать через 2 часа после инъекции дефероксамина.
Ацетилсалициловая кислота (АСК), пероральные контрацептивы, свежие соки и щёлочное питье снижают всасывание и усвоение аскорбиновой кислоты. При одновременном применении с АСК повышается выделение с мочой аскорбиновой кислоты и снижается экскреция АСК. АСК снижает абсорбцию аскорбиновой кислоты примерно на 30%. Увеличивает риск развития кристаллурии при лечении салицилатами и сульфаниламидами короткого действия, замедляет выделение почками кислот, увеличивает выведение препаратов, имеющих щелочную реакцию (в т.ч. алкалоидов), снижает концентрацию в крови пероральных контрацептивов.
Препараты хинолинового ряда (фторхинолоны и др.), кальция хлорид, салицилаты, глюкокортикостероиды при длительном применении истощают запасы аскорбиновой кислоты.
При одновременном применении уменьшает хронотропное действие изопреналина. Повышает общий клиренс этанола, который, в свою очередь, снижает концентрацию аскорбиновой кислоты в организме.
Длительный прием больших доз лицами, которые лечатся дисульфирамином, тормозит реакцию дисульфирам-алкоголь.
В высоких дозах повышает почечную экскрецию мексилетина.
Барбитураты и примидон повышают выведение аскорбиновой кислоты с мочой. Уменьшает терапевтическое действие антипсихотических средств (производных фенотиазина), канальцевую реабсорбцию амфетамина и трициклических антидепрессантов.
Витамины группы В в клинической практике
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Т. Е. Морозова, д.м.н., профессор, О.С. Дурнецова, к.м.н., Первый Московский государственный медицинский университет им. И.М. Сеченова
Е. Морозова, д.м.н., профессор, О.С. Дурнецова, к.м.н., Первый Московский государственный медицинский университет им. И.М. Сеченова
В статье обсуждается роль витаминов группы В в терапии неврологических заболеваний. Освещаются результаты исследований и опыт применения комбинированного препарата Нейромультивит.
Важную роль в нормальном функционировании организма, а также в патогенезе некоторых заболеваний играют витамины, многие из которых являются незаменимыми участниками различных обменных процессов. Они необходимы для нормального клеточного метаболизма и трофики тканей, нормальной работоспособности и поддержания жизненно важных функций организма. К дефициту витаминов приводят самые разные причины, такие как заболевания желудочно-кишечного тракта, приводящие к нарушению всасывания, недостаточное питание, алкоголизм, нарушения метаболизма и пр. В настоящее время известно более 30 витаминов и витаминоподобных веществ. Большинство из них являются коферментами различных энзимов и участвуют в регуляции углеводного, белкового, жирового и минерального обмена, в поддержании клеточной структуры, устойчивости организма к неблагоприятным факторам внешней среды [1].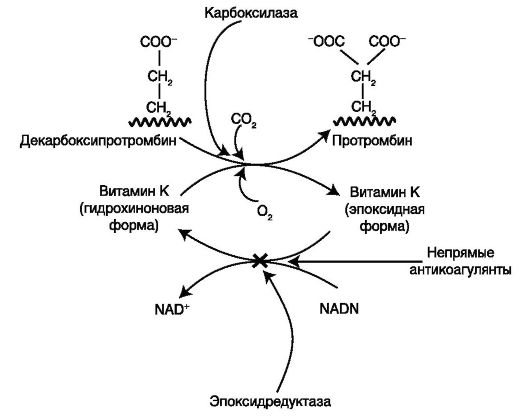
Витамины разделяют на жирорастворимые (витамины A, D, E и K) и водорастворимые (витамины группы B и витамин C). Отсутствие какого-либо из них ведет к недостаточному образованию в организме определенных жизненно важных ферментов и, как следствие, к специфическому нарушению обмена веществ. Так, хорошо известно, что ретинол (витамин А) играет важную роль в процессах роста, репродукции, а также зрительной функции; витамин К необходим для синтеза II, VII, IX и X факторов свертывания в печени и обладает антигеморрагическим свойством; витамин D регулирует минерализацию костной ткани, повышает проницаемость эпителия кишечника для кальция и фосфатов, витамины группы В являются нейротропными и применяются при заболеваниях нервной системы и пр. [2].
Клинические симптомы и проявления гиповитаминозов многообразны и могут затрагивать различные органы и системы (табл. 1). Поскольку большинство витаминов в организме не синтезируется, а восполнить их недостаток, используя только продукты питания, невозможно, большое значение имеют витаминные лекарственные препараты.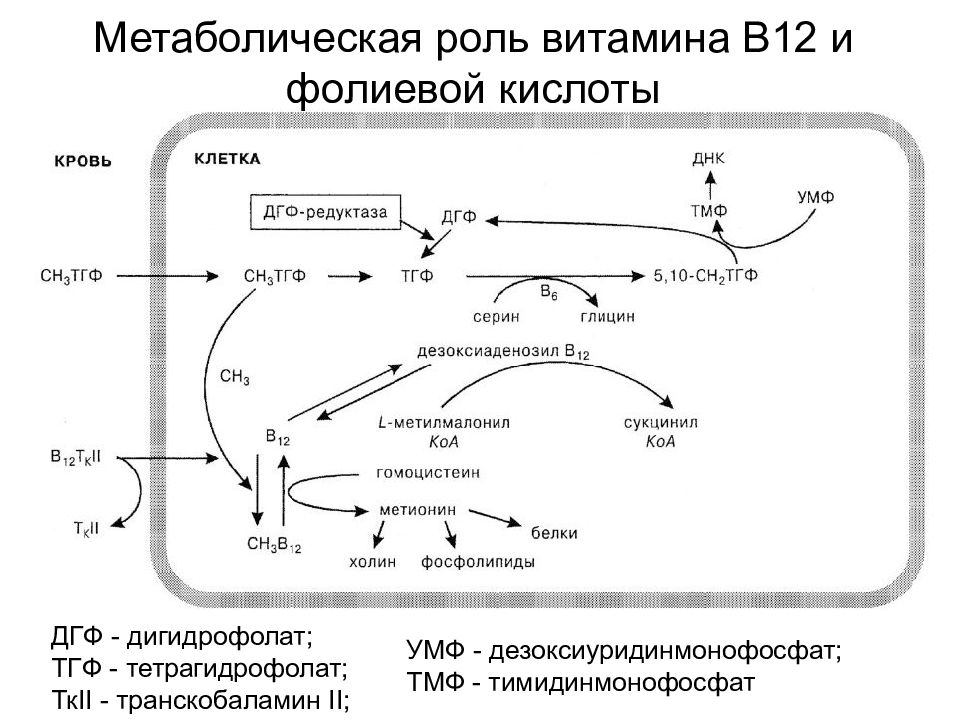 Они широко применяются для профилактики и в составе комплексной терапии заболеваний различных органов и систем человека [1]. В настоящее время все более широкое применение находят витаминные комплексы для коррекции функциональных состояний и повышения резервных возможностей человека при различных клинических ситуациях [3].
Они широко применяются для профилактики и в составе комплексной терапии заболеваний различных органов и систем человека [1]. В настоящее время все более широкое применение находят витаминные комплексы для коррекции функциональных состояний и повышения резервных возможностей человека при различных клинических ситуациях [3].
Таблица 1. Клинические проявления и симптомы гиповитаминозов
| Недостаток витамина | Клинические проявления и симптомы |
|---|---|
| А (ретинол) |
|
| B1 (тиамин) |
|
| В2 (рибофлавин) |
|
| В6 (пиридоксин) |
|
| В12 (цианокобаламин) |
|
| С (аскорбиновая кислота) |
|
| Е (токоферол) |
|
| D |
|
| K |
|
| Недостаток витамина РР (никотиновая кислота) |
|
В настоящем обзоре мы более подробно остановимся на фармакологических аспектах и клинических возможностях использования витаминов группы В.
 Витамины группы В
Витамины группы В занимают важное место в клинической практике. Они используются в самых разных областях медицины у различных категорий больных, однако наибольшее применение получили в лечении заболеваний периферической и центральной нервной системы. Витамины группы В считаются нейротропными, т. к. они необходимы для нормального функционирования центральной и периферической нервной системы.
Витамины группы В
Витамины группы В занимают важное место в клинической практике. Они используются в самых разных областях медицины у различных категорий больных, однако наибольшее применение получили в лечении заболеваний периферической и центральной нервной системы. Витамины группы В считаются нейротропными, т. к. они необходимы для нормального функционирования центральной и периферической нервной системы.Витамины группы В оказывают метаболическое влияние на аксональный транспорт и процессы миелинизации в периферических нервных волокнах. Среди всех витаминов группы В в наибольшей степени эти свойства присущи трем из них — тиамину (В1), пиридоксину (В6) и цианокобаламину (В12). Воздействие витаминов группы В, в первую очередь тиамина, на центральную нервную систему опосредовано через метаболизм гамма-аминомасляой кислоты (ГАМК) и серотонина, что обеспечивает и анальгетический эффект, проявляющийся при их использовании в высоких дозах. Основные физиологические эффекты суммированы в таблице 2 [4—6].
Таблица 2. Физиологические эффекты витаминов группы В
| Витамин В1 (тиамин) | Витамин В6 (пиридоксин) | Витамин В12 (цианокобаламин) |
|---|---|---|
|
Является коферментом многих реакций Участвует в: — дигидрогеназных комплексах цикла Кребса — регуляции активности пентозофосфатного цикла утилизации углеводов — проведении нервного импульса — обеспечении аксонального транспорта, определяющего регенерацию нервной ткани — модуляции нервно-мышечной передачи в Н-холинорецепторах (синтез норадреналина) — регуляции «болевой» активности нерва |
Является кофактором более 100 ферментов Участвует в: — дезаминировании, переаминировании, декарбоксилировании аминокислот — фосфорилировании гликогена — обмене фолиевой кислоты — биосинтезе нейромедиаторов (дофамина, норадреналина, адреналина, гистамина) — обеспечении процессов торможения в центральной нервной системе – ЦНС (синтез гамма-аминомасляной кислоты) — регуляции энергетических процессов нервной ткани Cпособствует накоплению магния в клетках |
Активирует фолиевую кислоту Участвует в: — гемопоэзе и эритропоэзе (предупреждение нейроанемического синдрома) — стимуляции обмена нуклеиновых кислот — синтезе/восстановлении миелиновой оболочки — процессах репликации роста клеток — активации свертывающей системы крови — регуляции функции ЖКТ Оказывает анальгетический эффект Уменьшает нейрогенные боли (снижает синтез глутамата в ЦНС) |
Следует подчеркнуть, что витамин B1 (тиамин) необходим для окислительного декарбоксилирования кетокислот, (пировиноградной и молочной), синтеза ацетилхолина, он участвует в углеводном обмене и связанных с ним энергетическом, жировом, белковом, водно-солевом обмене, оказывает регулирующее воздействие на трофику и деятельность нервной системы. При недостаточном поступлении тиамина пировиноградная и молочная кислоты накапливаются в тканях, нарушается синтез ацетилхолина, вследствие чего ухудшаются функции ряда систем, в первую очередь нервной, сердечно-сосудистой и пищеварительной. Тиамин оптимизирует познавательную активность и функции мозга. Он оказывает положительное действие на уровень энергии, рост, нормальный аппетит, способность к обучению и необходим для тонуса мышц пищеварительного тракта, желудка и сердца. Тиамин выступает как антиоксидант, защищая организм от разрушительного воздействия старения, алкоголя и табака.
Витамин В6 (пиридоксин) участвует в синтезе ряда нейромедиаторов. В фосфорилированной форме обеспечивает процессы декарбоксилирования, переаминирования, дезаминирования аминокислот, участвует в синтезе белка, ферментов, гемоглобина, простагландинов, обмене серотонина, катехоламинов, глутаминовой кислоты, ГАМК, гистамина, улучшает использование ненасыщеных жирных кислот, снижает уровень холестерина и липидов в крови, улучшает сократимость миокарда, способствует превращению фолиевой кислоты в ее активную форму, стимулирует гемопоэз.
Важнейшим свойством витамина В12 (цианокобаламин) является его участие в гемопоэзе и эритропоэзе (предупреждение нейроанемического синдрома) и активация свертывающей системы крови. Помимо этого, как и два других витамина из группы В, он участвует в синтезе/восстановлении миелиновой оболочки и оказывает анальгетический эффект при нейрогенном болевом синдроме (снижает синтез глутамата в ЦНС).
Каждый из перечисленных витаминов можно использовать в качестве монотерапии, однако комбинация витаминов группы В (В1, В6, В12) оказывает более выраженное воздействие, поскольку витамины группы В могут дополнять эффекты друг друга в биохимических процессах нервной ткани [7, 8].
Обширная область применения препаратов, содержащих витамины группы В, — это различные болевые синдромы. Имеется большой опыт применения их в случаях как ноциоцептивной, так и смешанной боли средней и низкой интенсивности, в лечении нейропатической боли, в качестве профилактического лечения после купирования обострения хронической боли, при полинейропатиях различного генеза. Высокие дозы витаминов группы В оказывают положительное влияние на регенерацию нервов, что оправдывает их применение в купировании острого болевого синдрома и для профилактики обострений хронического [7, 9].
Оптимальным путем введения витаминов группы В является пероральный. Применение парентеральных форм может осложняться развитием инфильтратов, воспалительных реакций в месте введения лекарственного препарата.
Одним из препаратов для перорального приема, содержащих комбинацию 3 перечисленных выше витаминов группы В в высоких дозах, является Нейромультивит (Lannacher, Австрия), который получил широкое распространение в практике неврологов и эндокринологов. В его состав входят 3 витамина группы В в терапевтических дозах (100 мг тиамина гидрохлорида, 200 мг пиридоксина гидрохлорида и 200 мкг цианокобаламина (витамин В12). Отсутствие нежелательных взаимодействий между компонентами определяют в целом хорошую биодоступность препарата.
Компоненты препарата Нейромультивит — водорастворимые витамины, что исключает возможность их кумуляции в организме. Тиамин и пиридоксин абсорбируются в верхнем отделе кишечника, степень абсорбции зависит от их дозы. Абсорбция цианокобаламина в большой степени определяется присутствием внутреннего фактора в желудке и верхнем отделе кишечника, в дальнейшем доставка цианокобаламина в ткани осуществляется транспортным белком транскобаламином II. Тиамин, пиридоксин и цианокобаламин метаболизируются в печени. Тиамин и пиридоксин выводятся почками (около 8—10% в неизмененном виде). При передозировке значительно увеличивается выведение тиамина и пиридоксина через кишечник. Цианокобаламин выводится в основном с желчью, степень выведения почками вариабельна — от 6 до 30% [1, 3].
Применение витаминов группы В в неврологической практике
Как уже было отмечено, витамины группы В являются нейротропными веществами. Благодаря их активному участию в биохимических процессах, обеспечивающих нормальное функционирование структур нервной системы, их используют при диабетической полинейропатии, лечении болевых синдромов. Комбинированные препараты витаминов группы В применяются и для комплексной терапии болевых синдромов [10].В практике врача практически любой специальности достаточно часто встречаются пациенты с дорсалгиями или, другими словами, с болевым синдромом (БС) в области спины, удельный вес которых растет. Частота встречаемости БС довольно высока. Эпидемиологические исследования показали, что в среднем 60—70% населения хотя бы раз в жизни испытали острую боль в спине, а у трети характер боли изменяется и переходит в хроническую форму. Зачастую болевой синдром возникает в молодом возрасте и в дальнейшем сопровождает пациента на протяжении всей его жизни. При этом среди болевых неврологических синдромов ноцицептивного генеза, обусловленных поражением мышечной системы, на одно из первых мест в последние годы выходят миофасциальные боли [11].
Качество жизни этих больных во многом зависит от своевременной, правильно подобранной и адекватной фармакотерапии. Неполноценное же лечение часто приводит к хронизации болевого синдрома. Не секрет, что большое число пациентов занимается и самолечением, пытаясь уменьшить выраженность болевого синдрома приемом обезболивающих лекарственных средств, нестероидных противовоспалительных препаратов (НПВП).
Еще одна возможная причина болевого синдрома — это различные полинейропатии. Среди всех видов нейропатий, диабетическая полинейропатия прочно занимает первое место, значительно опережая другие виды нейропатий (алкогольная, смешанного генеза, воспалительная, токсическая и т. д.), и доля таких пациентов весьма велика в общеклинической практике [12].
Тактика ведения больных с болевым синдромом предполагает использование немедикаментозных и медикаментозных методов лечения, главной целью которых является купирование болевого синдрома или, как минимум, уменьшение степени его выраженности. Также терапия направлена на лечение основного патологического процесса, приведшего к формированию болевого синдрома, на повышение качества жизни пациента.
В период обострения необходимо соблюдение щадящего режима физической активности, ограничение нагрузок. Используются физиотерапия, мануальная терапия, иглорефлексотерапия, физическая нагрузка, направленная на укрепление мышечного корсета, на растяжение определенных мышц или групп мышц. К немедикаментозным относятся и рекомендации по изменению привычек пациента, формирование у него «правильных» навыков, обучение методикам миорелаксации, коррекция осанки, обучение приемам поднятия тяжестей, выполнения определенных видов физической нагрузки.
Для фармакотерапии острого и хронического болевого синдрома возможно использование различных классов ЛС, в число которых входят и витамины группы В, как в монотерапии, так и в комбинации их между собой (табл. 3):
— НПВП,
— витамины группы В,
— миорелаксанты,
— хондропротекторы,
— антидепрессанты,
— антиконвульсанты,
— селективные ингибиторы обратного захвата серотонина (СИОЗС),
— блокады местными анестетиками (в тяжелых случаях),
— наркотические анальгетики [11].
Таблица 3. Дифференцированный подход к терапии боли
| Ноцицептивная боль | Невропатическая боль |
|---|---|
| НПВП | |
|
ненаркотические анальгетики |
|
| Наркотические анальгетики (при сильных болях) | |
| Витамины группы В | |
| Миорелаксанты | |
| хондропротекторы | |
| антидепрессанты | |
| антиконвульсанты | |
| СИОЗС | |
| Новокаиновые блокады | |
Патогенетические основы выбора ЛС для лечения болевого синдрома основываются на знании, с одной стороны — основных патофизиологических механизмов его формирования, с другой — механизмов действия ЛС.
Поскольку боли в спине часто носят смешанный характер с участием ноцицептивного и нейропатического компонентов, целесообразно назначение и НПВС, в большей степени влияющих на ноцицептивный компонент, и витаминов группы В, оказывающих воздействие на нейропатический компонент.
Известно, что при различных болевых синдромах для его купирования нередко используют витамины группы В, которые могут оказывать собственный анальгетический эффект, а также усиливают обезболивающее действие НПВС. Многочисленными исследованиями доказано, что под влиянием витаминов группы В у пациентов с острой болью в спине наступает клиническое улучшение.
Анальгетический эффект витаминов группы В в медицине известен уже давно. Как показывает многолетний клинический опыт, внутримышечное введение комбинации тиамина, пиридоксина и цианокобаламина способствует купированию боли, нормализует рефлекторные реакции, уменьшает нарушение чувствительности. Механизм этого действия заключается прежде всего в том, что происходит ингибирование ноцицептивных ответов. Антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен угнетением синтеза и/или блокированием действия воспалительных медиаторов. Клинически и на экспериментальных моделях было показано, что совместное назначение с витаминами группы В усиливает анальгетический эффект нестероидных противовоспалительных препаратов, антиаллодинический эффект габапентина, дексаметазона и вальпроатов при невропатиях [10].
Учитывая эти свойства витаминов группы В, основными показаниями к назначению Нейромультивита являются различные заболевания и поражения нервной системы с болевыми синдромами:
— полинейропатия;
— неврит; невралгия; невралгия тройничного нерва;
— корешковый синдром, вызванный дегенеративными изменениями позвоночника; ишиас; люмбаго;
— плексит; межреберная невралгия;
— парез лицевого нерва.
Опыт применения комбинированного препарата Нейромультивит
Клиническая эффективность и хороший профиль безопасности препарата Нейромультивит при различных заболеваниях имеют большую доказательную базу, в т. ч. и метаанализы [5, 13—16]. В работах последних лет есть достаточно большое количество работ, отражающих опыт применения комплексного препарата Нейромультивит у разных категорий больных. Преимущественно это больные с нейропатиями различного генеза (диабетической, алкогольной) и болевыми синдромами в области спины (дорсалгиями).У больных с СД и эндокринной нейропатией позитивная динамика на фоне применения Нейромультивита выражается в виде улучшения вибрационной и тактильной чувствительности, уменьшении боли и повышении качества жизни пациентов с ДПН [14—16].
Результаты большого числа исследований препарата Нейромультивит свидетельствуют о хорошем профиле безопасности и хорошей переносимости препарата большинством пациентов. Кохрановский систематический обзор, включивший в себя результаты 30 исследований с участием 741 пациента с нейропатией алкогольного и эндокринного генеза, убедительно продемонстрировал хорошую переносимость витаминов группы В в клинических исследованиях [17—19].
В единичных случаях могут появиться побочные эффекты, чаще связанные с передозировкой компонентов препарата, проявляющиеся тошнотой, сердцебиением, иногда развиваются кожные реакции в виде зуда и крапивницы. Передозировка возможна только в случае приема исключительно высоких доз в течение очень длительного времени.
Имеются ограничения применения препарата в период беременности и лактации.
Поскольку Нейромультивит содержит терапевтические дозы витаминов, не рекомендуется сочетать его с другими витаминами группы В. Клинические симптомы передозировки витаминов, содержащихся в препарате Нейромультивит, возможны только при значительном превышении рекомендуемых доз, в основном за счет витамина В6 (если его доза более 2 г в сутки). В этом случае существует риск развития нейропатии с атаксией и нарушениями чувствительности, судорогами с изменением ЭЭГ, в отдельных случаях гипохромная анемия и себорейный дерматит. Лечение симптоматическое.
Важное значение в практике любого врача имеют вопросы противопоказаний к назначению тех или иных препаратов. В полной мере это относится и к витаминным препаратам. Практикующий врач должен обладать подробной информацией о том, кому можно, а кому нельзя назначать витаминные препараты. Очень часто этот вопрос касается пациентов с опухолевыми процессами как доброкачественного, так и злокачественного характера. Результаты исследований демонстрируют слабую антиканцерогенную активность или отсутствие какого-либо влияния на опухолевый рост витаминов в физиологических дозах [20—24]. Ряд исследований продемонстрировал безопасность приема витаминов, в т. ч. витаминов группы В у онкологических больных [25—27]. Также витамины группы В могут входить в состав комплексной поддерживающей терапии в период проведения химиотерапии или после нее [28].
Таким образом, комплексный препарат Нейромультивит может быть рекомендован к применению в составе комплексной терапии болевого синдрома различного генеза, при проявлениях полинейропатии различного генеза (включая алкогольную и диабетическую полинейропатию) и даже в ряде случаев в составе поддерживающей терапии онкологических больных. Он также широко применяется в неврологической практике в комплексной терапии пациентов, страдающих невритом, невралгией, ишиасом, люмбаго, а также корешковым синдромом, который вызван дегенеративными изменениями позвоночника, плекситом, межреберной невралгией, парезом лицевого нерва и невралгией тройничного нерва.
Нейромультивит может назначаться как в комплексной терапии в сочетании с НПВС, миорелаксантами, различными немедикаментозными методами терапии, усиливая их анальгетический эффект. Также препарат можно использовать в качестве поддерживающей терапии после отмены НПВС для снижения риска рецидива и хронизации боли.
Литература
1. Клиническая фармакология: национальное руководство. Под ред. Ю.Б. Белоусова, В.К. Лепахина, В.И. Петрова. М.: ГЭОТАР-Медиа, 2008. (Серия «Национальные руководства», гл. 37).2. Fauci AS, Braunwald E, Isselbacher KJ. Harrison’s principles of internal medicine14th edition, 1998. Chapter 79: Vitamin deficiency and excess. P. 480-7.
3. Ших Е.В. Клинико–фармакологические аспекты применения витамин-
ных препаратов в клинике внутренних болезней. МЗ РФ. Ведомости Науч-
ного центра экспертизы и государственного контроля лекарственных
средств. 2001, 1 (5): 46-52.
4. Ленинджер А.Л. Основы биохимии. Пер. с англ. Т. 1, 2, 3. М.: Мир, 1985.
5. Козелкин А.А., Кузнецов А.А., Медведкова С.А. Применение нейромультивита в неврологической практике. Therapia, 2008, 11(31): 1-5.
6. Ахмеджанова Л.Т., Солоха О.А., Строков И.А. Витамины группы В в лечении неврологических заболеваний. РМЖ, 2009, 17(11): 776-83.
7. Строков И.А. Применение высоких доз витаминов группы В в неврологии. И.А. Строков, Л.Т. Ахмеджанова, О.А. Солоха. Трудный пациент, 2009, 10: 17-22.
8. Becker KW, Kienecker EW, Dick P. A contribution to the scientific assessment of degenerative and regenerative processes of peripheral nerve fibers following axonotmesis under the systemic administration of vitamins B1, B6 and B12 – light and electron microscopy findings of the saphenous nerve in the rabbit. Neurochirurgia (Stuttg.), 1990, 33(4): 113-121.
9. Луцкий И.С., Лютикова Л.В., Луцкий Е.И. Витамины группы В в неврологической практике. Междунар неврол журн, 2008, 2: 89-93.
10. .Данилов А.Б. Применение витаминов группы В при болях в спине: новые анальгетики? РМЖ, 2008, 16: 35-9.
11. Вялов С.С. Пациенты с поясничной невралгией: особенности терапии поясничного синдрома. Справочник поликлинического врача, 2013, 12: 16-22.
12. Доскина Е.В. Диабетическая полиневропатия и В12-дефицитные состояния: основы патогенеза, пути лечения и профилактики. Е.В. Румянцева. Фарматека, 2011, 20: 1-6.
13. Жиров И.В. Опыт применения препарата Нейромультивит при алкогольной полинейропатии. И.В. Жиров, М.А. Федина, А.Б. Покровский. Новые лекарственные препараты, 2002, 12: 10-18.
14. Гуревич К.Г. Нейромультивит: применение в современной практике. Фарматека, 2004, 9-10: 48-51.
15. Токмакова А.Ю. Возможности использования Нейромультивита в комплексной терапии полинейропатии у больных сахарным диабетом. А.Ю. Токмакова, М.Б. Анциферов. Сахарный диабет, 2001, 11(2): 33-35.
16. Бреговский В.Б. Применение Нейромультивита у больных с хронической формой диабетической сенсомоторной полинейропатией нижних конечностей. В.Б. Бреговский, Е.В. Белогурова, В.А. Кузьмина. Новые лекарственные препараты, 2002, 6: 7-10.
17. Ang CD, Alviar MJ, Dans AL et al. Vitamin B for treating peripheral neuropathy. Cochrane Database Syst Rev., 2008, 16(3).
18. Peters TJ, Kotowicz J, Nyka W et al. Treatment of alcoholic polyneuropathy with vitamin complex: a randomized controlled trial. Alcohol & Alcoholism, 2006, 41(4): 636-642.
19. Головачева В.А. Лечение диабетической и алкогольной полинейропатии: возможности и перспективы фармакотерапии. В.А. Головачева, И.А. Строков. РМЖ, 2014, 16: 1193-1197.
20. Den Heijer M. Are B. Vitamins a risk factor for VTE? Perhaps. J Thromb Haemost., 2006, Feb., 4(2): 309-11.
21. Krishnan AV, Moreno J, Nonn L et al. Novel pathways that contribute to the anti–proliferative and chemopreventive activities of calcitriol in prostate cancer. J Steroid Biochem Mol Biol., 2007, Jan. 15.
22. Lajous M, Lazcano-Ponce E, Hernandez-Avila M et al Folate, vitamin B(6), and vitamin B(12) intake and the risk of breast cancer among Mexican women. Cancer Epidemiol Biomarkers Prev., 2006, Mar.15(3): 443-448.
23. Lajous M, Romieu I, Sabia S et al. Folate, vitamin B12 and postmenopausal breast cancer in a prospective study of French women. Cancer Causes Control, 2006, Nov., 17(9): 1209-1213.
24. Xu WH, Dai Q, Xiang YB, Zhao GM et al. Nutritional factors in relation to endometrial cancer: A report from a population–based case–control study in Shanghai, China. Int J Cancer, 2007, Jan. 17.
25. Nascimento MM, Suliman ME, Murayama Y et al. Effect of high-dose thiamine and pyridoxine on advanced glycation end products and other oxidative stress markers in hemodialysis patients: a randomized placebo-controlled study. J Ren Nutr., 2006, Apr., 16(2): 119-124.
26. Bjelakovic G, Nikolova D, Simonetti RG, Gluud C. Antioxidant supplements for preventing gastrointestinal cancers. Cochrane Database Syst Rev., 2004, Oct., 18(4): CD004183. Evid Based Nurs., 2005, Apr., 8(2): 48.
27. Reynolds E. Vitamin B12, folic acid, and the nervous system. Lancet Neurol., 2006, Nov., 5(11): 949-960.
28. Громова О.А. Клиническая фармакология витамина В12. Доказательные исследования. Практика педиатра, 2006, 3: 20-24.
Ниацинамид (Витамин В3)
Витамин В3 представляет собой группу веществ сходного строения в которую входит ниацинамид, также называемый никотинамидом (старое название – витамин РР (профилактика пеллагры)). Ниацинамид – водорастворимое стабильное низкомолекулярное вещество, легко проникающее в роговой слой кожи.
Ниацинамид (амид никотиновой кислоты) широко распространен в растительных и животных продуктах. Содержится в почках, печени, мясе, молоке, дрожжах, а также в бобовых культурах. При его недостатке кожа утрачивает эластичность, появляется шелушение, ухудшается ее цвет. Лучше всего витамин В3 усваивается организмом из продуктов животного происхождения. Способствует заживлению ран и язв на коже, применяется для лечения фотодерматитов. Ниацинамид вводят в средства, предназначенные для ухода за волосами и кожей лица.
Местное применение ниацинамида позволяет предотвратить фотоповреждение кожи, уменьшает выраженность угревой сыпи, улучшает течение буллезного пемфигоида, розацеа и атопии. Кроме того, ниацинамид является предшественником НАДФ (окисленный никотинамидаденин-динуклеотидфосфат) его восстановленной формы НАДФН (восстановленный никотинамидаденин-динуклеотидфосфат) – кофакторов, играющих важную роль во многих клеточных метаболических ферментативных реакциях, что влияет на функцию многих тканей. К тому же восстановленные формы этих кофакторов мощные антиоксиданты, участвующие в реакциях восстановления.
Применение ниацинамида снижает трансэпидермальную потерю воды, что оказывает влияние на улучшение барьерной функции кожи. После обработки она становится значительно устойчивее к повреждению барьерно-деструктивными средствами, такими как натрия лаурилсульфат (поверхностно-активное вещество) и транс-ретиноевая кислота. Это выражалось в уменьшении раздражения и красных пятен на лице.
Длительное местное применение ниацинамида уменьшает количество гиперпигментированных пятен на коже лица у представителей белой и азиатской рас. Механизм действия: ингибирование переноса меланосом от меланоцитов к кератиноцитам с прекращением синтеза меланина.
Витамин C (аскорбиновая кислота) — StatPearls
Непрерывное обучение
Витамин C — водорастворимый витамин, антиоксидант и важный кофактор для биосинтеза коллагена, метаболизма карнитина и катехоламинов и всасывания железа с пищей. Люди не могут синтезировать витамин С, поэтому он получается строго через диетическое потребление фруктов и овощей. Цитрусовые, ягоды, помидоры, картофель и зеленые листовые овощи — отличные источники витамина С.Хотя большая часть витамина C полностью всасывается в тонком кишечнике, процент всасываемого витамина C уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена. Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровоизлиянием, гиперкератозом и гематологическими аномалиями.В этом упражнении излагаются показания, механизм действия, методы введения, значительные побочные эффекты, противопоказания и мониторинг витамина С, чтобы медицинские работники могли направлять терапию пациента на лечение или добавку, если это указано в рамках межпрофессиональной группы.
Целей:
-
Объясните роль и фармакологию витамина С в физиологии человека.
-
Обобщите диетические источники витамина С.
-
Определите дефицит витамина С по имени и укажите характерные признаки и симптомы такой недостаточности.
-
Рассмотрите важность сотрудничества и координации между межпрофессиональной командой и то, как это может улучшить уход за пациентами с помощью витамина А для улучшения результатов лечения пациентов, когда показан прием витамина С.
Показания
Витамин C — водорастворимый витамин, антиоксидант и важный кофактор для биосинтеза коллагена, метаболизма карнитина и катехоламинов и всасывания железа с пищей.Люди не могут синтезировать витамин С, поэтому они могут получить его только при употреблении фруктов и овощей с пищей. Цитрусовые, ягоды, томаты, картофель и зеленые листовые овощи являются отличными источниками витамина С. Хотя большая часть витамина С полностью всасывается в тонком кишечнике, процент поглощенного витамина С уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена.Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровотечением, гиперкератозом и гематологическими аномалиями. [1] [2] [3] [4] [5]
Дефицит витамина С обычно возникает в условиях пониженного потребления или повышенных потребностей или потерь. К лицам, подверженным риску недостаточного потребления витамина, относятся пациенты следующих групп:
-
Пожилые
-
Люди с алкогольным расстройством, анорексией или раком
-
Пристрастия к еде
-
Те, у кого есть предполагаемые пищевая аллергия
-
Получение парентерального питания без добавок
-
Лица, соблюдающие ограниченную диету, вызванную воспалительным заболеванием кишечника, желудочно-кишечным рефлюксом или болезнью Уиппла
-
Те, кто курит табачные изделия
-
, оральные контрацептивы, тетрациклины и кортикостероиды.
-
Пациенты с почечной недостаточностью из-за фильтрации водорастворимого витамина С во время диализа
-
Пациенты с осложнением лечения метастатической почечно-клеточной карциномы интерлейкином-2
-
Получение трансплантатов печени
Показания
Цинга
Витамин C показан для профилактики и лечения цинги. Цинга развивается через 1–3 месяца после перехода на диету с дефицитом витамина С.Люди могут жаловаться на вялость, утомляемость, недомогание, эмоциональную лабильность, артралгии, потерю веса, анорексию и диарею. У них также могут наблюдаться легкие кровотечения, синяки и плохое заживление ран. Кожные проявления цинги включают фринодермию, волоски типа «штопор», перифолликулярное кровоизлияние и пурпуру, отек нижних конечностей и осколочные кровоизлияния. Фринодермия, или увеличенные гиперкератотические волосяные фолликулы, изначально присутствуют на заднебоковых участках. Впоследствии это представление распространяется на ягодицы, заднюю часть бедер, икры, голени и спину.Волосы штопора представляют собой сломанные и свернутые в спираль волосы из-за нарушения сшивки кератина дисульфидными связями. Со временем возникает значительная закупорка сосудов, особенно в нижних конечностях, что приводит к перифолликулярному кровоизлиянию и отеку. Эта пурпура иногда пальпируется, имитируя кожный васкулит. Хрупкость стенки кровеносных сосудов также приводит к осколочным кровоизлияниям в ногтевое ложе. Заболевания полости рта распространены среди тех, у кого уже есть плохие зубы. У людей может развиться геморрагический гингивит, при котором десна сначала красная, опухшая и блестящая, а затем становится пурпурной, некротической и склонной к кровотечению.Кроме того, плохо сформированные мягкие зубы подвержены инфицированию. Заболевания опорно-двигательного аппарата часто проявляются у детей. Кровоизлияние может быть внутримышечным, внутрисуставным или поднадкостничным, приводя к боли и псевдопарализу. При физикальном обследовании выявляются искривления длинных костей, депрессия грудины и припухлость реберно-хрящевых соединений. Рентгенологические находки включают поперечную метафизарную рентгенопрозрачную полосу (линия цинги или зона Труммерфельда), расширение в зоне кальцификации (белая линия Франкеля), кольцо повышенной плотности вокруг эпифиза (кольцо Вимбергера) и метафизарные шпоры с краевыми переломами (Пелкан шпоры).Имеются сообщения о конъюнктивальных, внутриглазных, внутримозговых и желудочно-кишечных кровотечениях.
Другие показания
Ежедневная потребность увеличивается у пациентов с такими состояниями, как гингивит, астма, глаукома, нарушения коллагена, тепловой удар, артрит, инфекции (пневмония, синусит, ревматическая лихорадка) и хронические заболевания. Нарушения со стороны системы кровообращения, ожоги и замедленное заживление ран являются причинами увеличения суточного потребления.
Механизм действия
Поглощение происходит через энергозависимый процесс, который имеет два механизма: простая диффузия и активный перенос.Участвуют два транспортера: SVCT (натрийзависимые транспортеры витамина C) и транспортеры гексозы. Участком всасывания является дистальный отдел тонкого кишечника, который регулируется почечной экскрецией. Обычные диетические дозы до 100 мг / день почти полностью всасываются. Самые высокие концентрации аскорбиновой кислоты в гипофизе, надпочечниках, головном мозге, лейкоцитах и глазах.
Аскорбиновая кислота действует как кофактор, ферментный комплемент, вспомогательный субстрат и мощный антиоксидант в различных реакциях и метаболических процессах.Он также стабилизирует витамин Е и фолиевую кислоту и улучшает всасывание железа. Он нейтрализует свободные радикалы и токсины, а также ослабляет воспалительную реакцию, включая синдром сепсиса.
Администрация
Обычно перорально, препарат можно вводить внутримышечно, внутривенно (IV) или подкожно при подозрении на мальабсорбцию. Для внутривенной инъекции минимизируйте побочные реакции, разбавив препарат физиологическим раствором или глюкозой.
Средняя защитная доза витамина С для взрослых составляет от 70 до 150 мг в день.Увеличьте дозу от 300 мг до 1 г в день, когда присутствует цинга.
Побочные эффекты
Побочные эффекты включают головные боли, приливы, тошноту или рвоту и головокружение (внутривенное введение). Имеются сообщения о мигрени при суточной дозе 6 г.
Значительное количество витамина С может увеличить риск образования камней в почках и повысить уровень мочевой кислоты и оксалата, поскольку он подкисляет мочу.
Противопоказания
Добавки витамина С противопоказаны при заболеваниях крови, таких как талассемия, дефицит G6PD, серповидно-клеточная анемия и гемохроматоз.Избегайте приема добавок непосредственно перед или после ангиопластики. Пациентам с диабетом следует с осторожностью принимать добавки витамина С, поскольку они повышают уровень сахара в крови.
Витамин С следует с осторожностью применять при оксалатной нефропатии или нефролитиазе, поскольку подкисление аскорбиновой кислотой увеличивает вероятность выпадения в осадок цистеиновых, уратных и оксалатных камней.
Мониторинг
Цинга — это в основном клинический диагноз. Уровень аскорбиновой кислоты в сыворотке может быть измерен (более 11 микромоль / л), но это обычно отражает недавнее потребление с пищей.Измерение уровня аскорбиновой кислоты в лейкоцитах обычно бывает более точным, но тестирование широко не доступно. Нормохромная нормоцитарная анемия часто возникает из-за кровопотери, дефицита фолиевой кислоты и дефицита железа. [6] [7] [8]
Тест на дихлорфенолиндофенол для измерения уровня витамина С в моче и сыворотке / плазме и высокоэффективная жидкостная хроматография (ВЭЖХ) для измерения уровня накопления в лимфоцитах и тканях.
Рекомендуемая суточная доза витамина С составляет от 40 до 120 мг, в зависимости от возраста и пола.
Цингу лечат аскорбиновой кислотой в дозе 100–300 мг в день до исчезновения симптомов. Клиническое улучшение отмечается в течение первых 1-2 недель с исчезновением усталости, отека суставов, экхимозов и заживления десен. Полное выздоровление часто наступает в течение трех месяцев.
Токсичность
Витамин С (в граммах) может давать ложноотрицательные результаты по гваяковой кислоте и редко вызывает фатальную сердечную аритмию у пациентов с перегрузкой железом.
Улучшение результатов команды здравоохранения
Практически любой врач, включая практикующую медсестру, может прописать витамин С.Однако, если нет дефицита, упор следует делать на здоровую диету, состоящую из фруктов и овощей. Добавки витамина С относительно безопасны, но в долгосрочной перспективе могут быть дорогими. Кроме того, из-за отсутствия контроля над добавками качество продукции может стать проблемой. Существует очень мало убедительных доказательств в пользу использования витамина С для предотвращения большинства хронических заболеваний, таких как болезни сердца, инсульт, диабет или рак. [4]
Независимо от того, прописан ли он врачом или принимается в виде безрецептурной добавки, вся межпрофессиональная медицинская бригада, включая всех врачей, медперсонал и фармацевта, должна знать, что пациент принимает витамин С, и быть в состоянии дать совет, выявить признаки дефицита и / или чрезмерное потребление, и посоветуйте, как оптимизировать использование этого витамина для достижения оптимальных результатов.[Уровень5]
Ссылки
- 1.
- Фенек М., Амайя I, Валпуэста В., Ботелла Массачусетс. Содержание витамина С в фруктах: биосинтез и регуляция. Фронтальный завод им. 2018; 9: 2006. [Бесплатная статья PMC: PMC6353827] [PubMed: 30733729]
- 2.
- Халиф Р., Грико А., Хамиса К., Тинмоу А., Мак-Кадден К., Сайденберг Э. Цинга, старая история в новое время: опыт гематолога. Blood Cells Mol Dis. 2019 Май; 76: 40-44. [PubMed: 30704850]
- 3.
- Blaszczak W, Barczak W, Masternak J, Kopczyński P, Zhitkovich A, Rubiś B.Витамин С как модулятор ответа на терапию рака. Молекулы. 2019 28 января; 24 (3) [Бесплатная статья PMC: PMC6384696] [PubMed: 30695991]
- 4.
- Ашор А.В., Браун Р., Кинан П.Д., Уиллис Н.Д., Сьерво М., Мазерс Дж.С. Ограниченные данные о положительном влиянии добавок витамина С на биомаркеры сердечно-сосудистых заболеваний: общий обзор систематических обзоров и метаанализов. Nutr Res. 2019 Янв; 61: 1-12. [PubMed: 30683434]
- 5.
- де Карвальо Мело-Кавальканте А.А., да Роша Соуза Л., Аленкар МВОБ, де Оливейра Сантос СП, да Мата АМО, Пас MFCJ, де Карвалью Р.М., Нуньес NMF, Islam MT, Mendes AN , Gonçalves JCR, da Silva FCC, Ferreira PMP, de Castro E Sousaa JM.Ретинол, пальмитат и аскорбиновая кислота: роль в онкологической профилактике и терапии. Biomed Pharmacother. 2019 Янв; 109: 1394-1405. [PubMed: 30551390]
- 6.
- Чжан X, Чжу З., Сунь DW. Влияние предварительной обработки на качественные характеристики длительного хранения овощей в глубокой заморозке: обзор. Crit Rev Food Sci Nutr. 2019; 59 (5): 743-757. [PubMed: 30595028]
- 7.
- Langlois PL, Manzanares W, Adhikari NKJ, Lamontagne F, Stoppe C, Hill A, Heyland DK. Администрация витамина С для критически больных: систематический обзор и метаанализ.JPEN J Parenter Enteral Nutr. 2019 Март; 43 (3): 335-346. [PubMed: 30452091]
- 8.
- Гонсалес-Фуэнтес Дж., Сельва Дж., Мойя К., Кастро-Васкес Л., Лосано М. В., Маркос П., Плаза-Оливер М., Родригес-Робледо В., Сантандер-Ортега М. Дж., Вилласека- Гонсалес Н, Арройо-Хименес ММ. Нейрозащитные природные молекулы, от пищи до мозга. Front Neurosci. 2018; 12: 721. [Бесплатная статья PMC: PMC6206709] [PubMed: 30405328]
Витамин C (аскорбиновая кислота) — StatPearls
Непрерывное обучение
Витамин C — водорастворимый витамин, антиоксидант и важный сопутствующий фактор для биосинтеза коллагена. метаболизм карнитина и катехоламинов и всасывание железа с пищей.Люди не могут синтезировать витамин С, поэтому он получается строго через диетическое потребление фруктов и овощей. Цитрусовые, ягоды, томаты, картофель и зеленые листовые овощи являются отличными источниками витамина С. Хотя большая часть витамина С полностью всасывается в тонком кишечнике, процент поглощенного витамина С уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена.Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровоизлиянием, гиперкератозом и гематологическими аномалиями. В этом упражнении излагаются показания, механизм действия, методы введения, значительные побочные эффекты, противопоказания и мониторинг витамина С, чтобы медицинские работники могли направлять терапию пациента на лечение или добавку, если это указано в рамках межпрофессиональной группы.
Целей:
-
Объясните роль и фармакологию витамина С в физиологии человека.
-
Обобщите диетические источники витамина C.
-
Определите дефицит витамина C по имени и укажите характерные признаки и симптомы такого дефицита.
-
Рассмотрите важность сотрудничества и координации между межпрофессиональной командой и то, как это может улучшить уход за пациентами с помощью витамина А для улучшения результатов лечения пациентов, когда показан прием витамина С.
Показания
Витамин C — водорастворимый витамин, антиоксидант и важный кофактор для биосинтеза коллагена, метаболизма карнитина и катехоламинов и всасывания железа с пищей. Люди не могут синтезировать витамин С, поэтому они могут получить его только при употреблении фруктов и овощей с пищей. Цитрусовые, ягоды, помидоры, картофель и зеленые листовые овощи — отличные источники витамина С.Хотя большая часть витамина C полностью всасывается в тонком кишечнике, процент всасываемого витамина C уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена. Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровоизлиянием, гиперкератозом и гематологическими аномалиями.[1] [2] [3] [4] [5]
Дефицит витамина С обычно возникает в условиях пониженного потребления или повышенных потребностей или потерь. К лицам, подверженным риску недостаточного потребления витамина, относятся пациенты следующих групп:
-
Пожилые
-
Люди с алкогольным расстройством, анорексией или раком
-
Пристрастия к еде
-
Те, у кого есть предполагаемые пищевая аллергия
-
Получение парентерального питания без добавок
-
Лица, соблюдающие ограниченную диету, вызванную воспалительным заболеванием кишечника, желудочно-кишечным рефлюксом или болезнью Уиппла
-
Те, кто курит табачные изделия
-
, оральные контрацептивы, тетрациклины и кортикостероиды.
-
Пациенты с почечной недостаточностью из-за фильтрации водорастворимого витамина С во время диализа
-
Пациенты с осложнением лечения метастатической почечно-клеточной карциномы интерлейкином-2
-
Получение трансплантатов печени
Показания
Цинга
Витамин C показан для профилактики и лечения цинги. Цинга развивается через 1–3 месяца после перехода на диету с дефицитом витамина С.Люди могут жаловаться на вялость, утомляемость, недомогание, эмоциональную лабильность, артралгии, потерю веса, анорексию и диарею. У них также могут наблюдаться легкие кровотечения, синяки и плохое заживление ран. Кожные проявления цинги включают фринодермию, волоски типа «штопор», перифолликулярное кровоизлияние и пурпуру, отек нижних конечностей и осколочные кровоизлияния. Фринодермия, или увеличенные гиперкератотические волосяные фолликулы, изначально присутствуют на заднебоковых участках. Впоследствии это представление распространяется на ягодицы, заднюю часть бедер, икры, голени и спину.Волосы штопора представляют собой сломанные и свернутые в спираль волосы из-за нарушения сшивки кератина дисульфидными связями. Со временем возникает значительная закупорка сосудов, особенно в нижних конечностях, что приводит к перифолликулярному кровоизлиянию и отеку. Эта пурпура иногда пальпируется, имитируя кожный васкулит. Хрупкость стенки кровеносных сосудов также приводит к осколочным кровоизлияниям в ногтевое ложе. Заболевания полости рта распространены среди тех, у кого уже есть плохие зубы. У людей может развиться геморрагический гингивит, при котором десна сначала красная, опухшая и блестящая, а затем становится пурпурной, некротической и склонной к кровотечению.Кроме того, плохо сформированные мягкие зубы подвержены инфицированию. Заболевания опорно-двигательного аппарата часто проявляются у детей. Кровоизлияние может быть внутримышечным, внутрисуставным или поднадкостничным, приводя к боли и псевдопарализу. При физикальном обследовании выявляются искривления длинных костей, депрессия грудины и припухлость реберно-хрящевых соединений. Рентгенологические находки включают поперечную метафизарную рентгенопрозрачную полосу (линия цинги или зона Труммерфельда), расширение в зоне кальцификации (белая линия Франкеля), кольцо повышенной плотности вокруг эпифиза (кольцо Вимбергера) и метафизарные шпоры с краевыми переломами (Пелкан шпоры).Имеются сообщения о конъюнктивальных, внутриглазных, внутримозговых и желудочно-кишечных кровотечениях.
Другие показания
Ежедневная потребность увеличивается у пациентов с такими состояниями, как гингивит, астма, глаукома, нарушения коллагена, тепловой удар, артрит, инфекции (пневмония, синусит, ревматическая лихорадка) и хронические заболевания. Нарушения со стороны системы кровообращения, ожоги и замедленное заживление ран являются причинами увеличения суточного потребления.
Механизм действия
Поглощение происходит через энергозависимый процесс, который имеет два механизма: простая диффузия и активный перенос.Участвуют два транспортера: SVCT (натрийзависимые транспортеры витамина C) и транспортеры гексозы. Участком всасывания является дистальный отдел тонкого кишечника, который регулируется почечной экскрецией. Обычные диетические дозы до 100 мг / день почти полностью всасываются. Самые высокие концентрации аскорбиновой кислоты в гипофизе, надпочечниках, головном мозге, лейкоцитах и глазах.
Аскорбиновая кислота действует как кофактор, ферментный комплемент, вспомогательный субстрат и мощный антиоксидант в различных реакциях и метаболических процессах.Он также стабилизирует витамин Е и фолиевую кислоту и улучшает всасывание железа. Он нейтрализует свободные радикалы и токсины, а также ослабляет воспалительную реакцию, включая синдром сепсиса.
Администрация
Обычно перорально, препарат можно вводить внутримышечно, внутривенно (IV) или подкожно при подозрении на мальабсорбцию. Для внутривенной инъекции минимизируйте побочные реакции, разбавив препарат физиологическим раствором или глюкозой.
Средняя защитная доза витамина С для взрослых составляет от 70 до 150 мг в день.Увеличьте дозу от 300 мг до 1 г в день, когда присутствует цинга.
Побочные эффекты
Побочные эффекты включают головные боли, приливы, тошноту или рвоту и головокружение (внутривенное введение). Имеются сообщения о мигрени при суточной дозе 6 г.
Значительное количество витамина С может увеличить риск образования камней в почках и повысить уровень мочевой кислоты и оксалата, поскольку он подкисляет мочу.
Противопоказания
Добавки витамина С противопоказаны при заболеваниях крови, таких как талассемия, дефицит G6PD, серповидно-клеточная анемия и гемохроматоз.Избегайте приема добавок непосредственно перед или после ангиопластики. Пациентам с диабетом следует с осторожностью принимать добавки витамина С, поскольку они повышают уровень сахара в крови.
Витамин С следует с осторожностью применять при оксалатной нефропатии или нефролитиазе, поскольку подкисление аскорбиновой кислотой увеличивает вероятность выпадения в осадок цистеиновых, уратных и оксалатных камней.
Мониторинг
Цинга — это в основном клинический диагноз. Уровень аскорбиновой кислоты в сыворотке может быть измерен (более 11 микромоль / л), но это обычно отражает недавнее потребление с пищей.Измерение уровня аскорбиновой кислоты в лейкоцитах обычно бывает более точным, но тестирование широко не доступно. Нормохромная нормоцитарная анемия часто возникает из-за кровопотери, дефицита фолиевой кислоты и дефицита железа. [6] [7] [8]
Тест на дихлорфенолиндофенол для измерения уровня витамина С в моче и сыворотке / плазме и высокоэффективная жидкостная хроматография (ВЭЖХ) для измерения уровня накопления в лимфоцитах и тканях.
Рекомендуемая суточная доза витамина С составляет от 40 до 120 мг, в зависимости от возраста и пола.
Цингу лечат аскорбиновой кислотой в дозе 100–300 мг в день до исчезновения симптомов. Клиническое улучшение отмечается в течение первых 1-2 недель с исчезновением усталости, отека суставов, экхимозов и заживления десен. Полное выздоровление часто наступает в течение трех месяцев.
Токсичность
Витамин С (в граммах) может давать ложноотрицательные результаты по гваяковой кислоте и редко вызывает фатальную сердечную аритмию у пациентов с перегрузкой железом.
Улучшение результатов команды здравоохранения
Практически любой врач, включая практикующую медсестру, может прописать витамин С.Однако, если нет дефицита, упор следует делать на здоровую диету, состоящую из фруктов и овощей. Добавки витамина С относительно безопасны, но в долгосрочной перспективе могут быть дорогими. Кроме того, из-за отсутствия контроля над добавками качество продукции может стать проблемой. Существует очень мало убедительных доказательств в пользу использования витамина С для предотвращения большинства хронических заболеваний, таких как болезни сердца, инсульт, диабет или рак. [4]
Независимо от того, прописан ли он врачом или принимается в виде безрецептурной добавки, вся межпрофессиональная медицинская бригада, включая всех врачей, медперсонал и фармацевта, должна знать, что пациент принимает витамин С, и быть в состоянии дать совет, выявить признаки дефицита и / или чрезмерное потребление, и посоветуйте, как оптимизировать использование этого витамина для достижения оптимальных результатов.[Уровень5]
Ссылки
- 1.
- Фенек М., Амайя I, Валпуэста В., Ботелла Массачусетс. Содержание витамина С в фруктах: биосинтез и регуляция. Фронтальный завод им. 2018; 9: 2006. [Бесплатная статья PMC: PMC6353827] [PubMed: 30733729]
- 2.
- Халиф Р., Грико А., Хамиса К., Тинмоу А., Мак-Кадден К., Сайденберг Э. Цинга, старая история в новое время: опыт гематолога. Blood Cells Mol Dis. 2019 Май; 76: 40-44. [PubMed: 30704850]
- 3.
- Blaszczak W, Barczak W, Masternak J, Kopczyński P, Zhitkovich A, Rubiś B.Витамин С как модулятор ответа на терапию рака. Молекулы. 2019 28 января; 24 (3) [Бесплатная статья PMC: PMC6384696] [PubMed: 30695991]
- 4.
- Ашор А.В., Браун Р., Кинан П.Д., Уиллис Н.Д., Сьерво М., Мазерс Дж.С. Ограниченные данные о положительном влиянии добавок витамина С на биомаркеры сердечно-сосудистых заболеваний: общий обзор систематических обзоров и метаанализов. Nutr Res. 2019 Янв; 61: 1-12. [PubMed: 30683434]
- 5.
- де Карвальо Мело-Кавальканте А.А., да Роша Соуза Л., Аленкар МВОБ, де Оливейра Сантос СП, да Мата АМО, Пас MFCJ, де Карвалью Р.М., Нуньес NMF, Islam MT, Mendes AN , Gonçalves JCR, da Silva FCC, Ferreira PMP, de Castro E Sousaa JM.Ретинол, пальмитат и аскорбиновая кислота: роль в онкологической профилактике и терапии. Biomed Pharmacother. 2019 Янв; 109: 1394-1405. [PubMed: 30551390]
- 6.
- Чжан X, Чжу З., Сунь DW. Влияние предварительной обработки на качественные характеристики длительного хранения овощей в глубокой заморозке: обзор. Crit Rev Food Sci Nutr. 2019; 59 (5): 743-757. [PubMed: 30595028]
- 7.
- Langlois PL, Manzanares W, Adhikari NKJ, Lamontagne F, Stoppe C, Hill A, Heyland DK. Администрация витамина С для критически больных: систематический обзор и метаанализ.JPEN J Parenter Enteral Nutr. 2019 Март; 43 (3): 335-346. [PubMed: 30452091]
- 8.
- Гонсалес-Фуэнтес Дж., Сельва Дж., Мойя К., Кастро-Васкес Л., Лосано М. В., Маркос П., Плаза-Оливер М., Родригес-Робледо В., Сантандер-Ортега М. Дж., Вилласека- Гонсалес Н, Арройо-Хименес ММ. Нейрозащитные природные молекулы, от пищи до мозга. Front Neurosci. 2018; 12: 721. [Бесплатная статья PMC: PMC6206709] [PubMed: 30405328]
Витамин C (аскорбиновая кислота) — StatPearls
Непрерывное обучение
Витамин C — водорастворимый витамин, антиоксидант и важный сопутствующий фактор для биосинтеза коллагена. метаболизм карнитина и катехоламинов и всасывание железа с пищей.Люди не могут синтезировать витамин С, поэтому он получается строго через диетическое потребление фруктов и овощей. Цитрусовые, ягоды, томаты, картофель и зеленые листовые овощи являются отличными источниками витамина С. Хотя большая часть витамина С полностью всасывается в тонком кишечнике, процент поглощенного витамина С уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена.Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровоизлиянием, гиперкератозом и гематологическими аномалиями. В этом упражнении излагаются показания, механизм действия, методы введения, значительные побочные эффекты, противопоказания и мониторинг витамина С, чтобы медицинские работники могли направлять терапию пациента на лечение или добавку, если это указано в рамках межпрофессиональной группы.
Целей:
-
Объясните роль и фармакологию витамина С в физиологии человека.
-
Обобщите диетические источники витамина C.
-
Определите дефицит витамина C по имени и укажите характерные признаки и симптомы такого дефицита.
-
Рассмотрите важность сотрудничества и координации между межпрофессиональной командой и то, как это может улучшить уход за пациентами с помощью витамина А для улучшения результатов лечения пациентов, когда показан прием витамина С.
Показания
Витамин C — водорастворимый витамин, антиоксидант и важный кофактор для биосинтеза коллагена, метаболизма карнитина и катехоламинов и всасывания железа с пищей. Люди не могут синтезировать витамин С, поэтому они могут получить его только при употреблении фруктов и овощей с пищей. Цитрусовые, ягоды, помидоры, картофель и зеленые листовые овощи — отличные источники витамина С.Хотя большая часть витамина C полностью всасывается в тонком кишечнике, процент всасываемого витамина C уменьшается по мере увеличения внутрипросветной концентрации. Остаткам пролина на проколлагене необходим витамин С для гидроксилирования, что делает его необходимым для образования тройной спирали зрелого коллагена. Отсутствие стабильной трехспиральной структуры ставит под угрозу целостность кожи, слизистых оболочек, кровеносных сосудов и костей. Следовательно, дефицит витамина С приводит к цинге, которая проявляется кровоизлиянием, гиперкератозом и гематологическими аномалиями.[1] [2] [3] [4] [5]
Дефицит витамина С обычно возникает в условиях пониженного потребления или повышенных потребностей или потерь. К лицам, подверженным риску недостаточного потребления витамина, относятся пациенты следующих групп:
-
Пожилые
-
Люди с алкогольным расстройством, анорексией или раком
-
Пристрастия к еде
-
Те, у кого есть предполагаемые пищевая аллергия
-
Получение парентерального питания без добавок
-
Лица, соблюдающие ограниченную диету, вызванную воспалительным заболеванием кишечника, желудочно-кишечным рефлюксом или болезнью Уиппла
-
Те, кто курит табачные изделия
-
, оральные контрацептивы, тетрациклины и кортикостероиды.
-
Пациенты с почечной недостаточностью из-за фильтрации водорастворимого витамина С во время диализа
-
Пациенты с осложнением лечения метастатической почечно-клеточной карциномы интерлейкином-2
-
Получение трансплантатов печени
Показания
Цинга
Витамин C показан для профилактики и лечения цинги. Цинга развивается через 1–3 месяца после перехода на диету с дефицитом витамина С.Люди могут жаловаться на вялость, утомляемость, недомогание, эмоциональную лабильность, артралгии, потерю веса, анорексию и диарею. У них также могут наблюдаться легкие кровотечения, синяки и плохое заживление ран. Кожные проявления цинги включают фринодермию, волоски типа «штопор», перифолликулярное кровоизлияние и пурпуру, отек нижних конечностей и осколочные кровоизлияния. Фринодермия, или увеличенные гиперкератотические волосяные фолликулы, изначально присутствуют на заднебоковых участках. Впоследствии это представление распространяется на ягодицы, заднюю часть бедер, икры, голени и спину.Волосы штопора представляют собой сломанные и свернутые в спираль волосы из-за нарушения сшивки кератина дисульфидными связями. Со временем возникает значительная закупорка сосудов, особенно в нижних конечностях, что приводит к перифолликулярному кровоизлиянию и отеку. Эта пурпура иногда пальпируется, имитируя кожный васкулит. Хрупкость стенки кровеносных сосудов также приводит к осколочным кровоизлияниям в ногтевое ложе. Заболевания полости рта распространены среди тех, у кого уже есть плохие зубы. У людей может развиться геморрагический гингивит, при котором десна сначала красная, опухшая и блестящая, а затем становится пурпурной, некротической и склонной к кровотечению.Кроме того, плохо сформированные мягкие зубы подвержены инфицированию. Заболевания опорно-двигательного аппарата часто проявляются у детей. Кровоизлияние может быть внутримышечным, внутрисуставным или поднадкостничным, приводя к боли и псевдопарализу. При физикальном обследовании выявляются искривления длинных костей, депрессия грудины и припухлость реберно-хрящевых соединений. Рентгенологические находки включают поперечную метафизарную рентгенопрозрачную полосу (линия цинги или зона Труммерфельда), расширение в зоне кальцификации (белая линия Франкеля), кольцо повышенной плотности вокруг эпифиза (кольцо Вимбергера) и метафизарные шпоры с краевыми переломами (Пелкан шпоры).Имеются сообщения о конъюнктивальных, внутриглазных, внутримозговых и желудочно-кишечных кровотечениях.
Другие показания
Ежедневная потребность увеличивается у пациентов с такими состояниями, как гингивит, астма, глаукома, нарушения коллагена, тепловой удар, артрит, инфекции (пневмония, синусит, ревматическая лихорадка) и хронические заболевания. Нарушения со стороны системы кровообращения, ожоги и замедленное заживление ран являются причинами увеличения суточного потребления.
Механизм действия
Поглощение происходит через энергозависимый процесс, который имеет два механизма: простая диффузия и активный перенос.Участвуют два транспортера: SVCT (натрийзависимые транспортеры витамина C) и транспортеры гексозы. Участком всасывания является дистальный отдел тонкого кишечника, который регулируется почечной экскрецией. Обычные диетические дозы до 100 мг / день почти полностью всасываются. Самые высокие концентрации аскорбиновой кислоты в гипофизе, надпочечниках, головном мозге, лейкоцитах и глазах.
Аскорбиновая кислота действует как кофактор, ферментный комплемент, вспомогательный субстрат и мощный антиоксидант в различных реакциях и метаболических процессах.Он также стабилизирует витамин Е и фолиевую кислоту и улучшает всасывание железа. Он нейтрализует свободные радикалы и токсины, а также ослабляет воспалительную реакцию, включая синдром сепсиса.
Администрация
Обычно перорально, препарат можно вводить внутримышечно, внутривенно (IV) или подкожно при подозрении на мальабсорбцию. Для внутривенной инъекции минимизируйте побочные реакции, разбавив препарат физиологическим раствором или глюкозой.
Средняя защитная доза витамина С для взрослых составляет от 70 до 150 мг в день.Увеличьте дозу от 300 мг до 1 г в день, когда присутствует цинга.
Побочные эффекты
Побочные эффекты включают головные боли, приливы, тошноту или рвоту и головокружение (внутривенное введение). Имеются сообщения о мигрени при суточной дозе 6 г.
Значительное количество витамина С может увеличить риск образования камней в почках и повысить уровень мочевой кислоты и оксалата, поскольку он подкисляет мочу.
Противопоказания
Добавки витамина С противопоказаны при заболеваниях крови, таких как талассемия, дефицит G6PD, серповидно-клеточная анемия и гемохроматоз.Избегайте приема добавок непосредственно перед или после ангиопластики. Пациентам с диабетом следует с осторожностью принимать добавки витамина С, поскольку они повышают уровень сахара в крови.
Витамин С следует с осторожностью применять при оксалатной нефропатии или нефролитиазе, поскольку подкисление аскорбиновой кислотой увеличивает вероятность выпадения в осадок цистеиновых, уратных и оксалатных камней.
Мониторинг
Цинга — это в основном клинический диагноз. Уровень аскорбиновой кислоты в сыворотке может быть измерен (более 11 микромоль / л), но это обычно отражает недавнее потребление с пищей.Измерение уровня аскорбиновой кислоты в лейкоцитах обычно бывает более точным, но тестирование широко не доступно. Нормохромная нормоцитарная анемия часто возникает из-за кровопотери, дефицита фолиевой кислоты и дефицита железа. [6] [7] [8]
Тест на дихлорфенолиндофенол для измерения уровня витамина С в моче и сыворотке / плазме и высокоэффективная жидкостная хроматография (ВЭЖХ) для измерения уровня накопления в лимфоцитах и тканях.
Рекомендуемая суточная доза витамина С составляет от 40 до 120 мг, в зависимости от возраста и пола.
Цингу лечат аскорбиновой кислотой в дозе 100–300 мг в день до исчезновения симптомов. Клиническое улучшение отмечается в течение первых 1-2 недель с исчезновением усталости, отека суставов, экхимозов и заживления десен. Полное выздоровление часто наступает в течение трех месяцев.
Токсичность
Витамин С (в граммах) может давать ложноотрицательные результаты по гваяковой кислоте и редко вызывает фатальную сердечную аритмию у пациентов с перегрузкой железом.
Улучшение результатов команды здравоохранения
Практически любой врач, включая практикующую медсестру, может прописать витамин С.Однако, если нет дефицита, упор следует делать на здоровую диету, состоящую из фруктов и овощей. Добавки витамина С относительно безопасны, но в долгосрочной перспективе могут быть дорогими. Кроме того, из-за отсутствия контроля над добавками качество продукции может стать проблемой. Существует очень мало убедительных доказательств в пользу использования витамина С для предотвращения большинства хронических заболеваний, таких как болезни сердца, инсульт, диабет или рак. [4]
Независимо от того, прописан ли он врачом или принимается в виде безрецептурной добавки, вся межпрофессиональная медицинская бригада, включая всех врачей, медперсонал и фармацевта, должна знать, что пациент принимает витамин С, и быть в состоянии дать совет, выявить признаки дефицита и / или чрезмерное потребление, и посоветуйте, как оптимизировать использование этого витамина для достижения оптимальных результатов.[Уровень5]
Ссылки
- 1.
- Фенек М., Амайя I, Валпуэста В., Ботелла Массачусетс. Содержание витамина С в фруктах: биосинтез и регуляция. Фронтальный завод им. 2018; 9: 2006. [Бесплатная статья PMC: PMC6353827] [PubMed: 30733729]
- 2.
- Халиф Р., Грико А., Хамиса К., Тинмоу А., Мак-Кадден К., Сайденберг Э. Цинга, старая история в новое время: опыт гематолога. Blood Cells Mol Dis. 2019 Май; 76: 40-44. [PubMed: 30704850]
- 3.
- Blaszczak W, Barczak W, Masternak J, Kopczyński P, Zhitkovich A, Rubiś B.Витамин С как модулятор ответа на терапию рака. Молекулы. 2019 28 января; 24 (3) [Бесплатная статья PMC: PMC6384696] [PubMed: 30695991]
- 4.
- Ашор А.В., Браун Р., Кинан П.Д., Уиллис Н.Д., Сьерво М., Мазерс Дж.С. Ограниченные данные о положительном влиянии добавок витамина С на биомаркеры сердечно-сосудистых заболеваний: общий обзор систематических обзоров и метаанализов. Nutr Res. 2019 Янв; 61: 1-12. [PubMed: 30683434]
- 5.
- де Карвальо Мело-Кавальканте А.А., да Роша Соуза Л., Аленкар МВОБ, де Оливейра Сантос СП, да Мата АМО, Пас MFCJ, де Карвалью Р.М., Нуньес NMF, Islam MT, Mendes AN , Gonçalves JCR, da Silva FCC, Ferreira PMP, de Castro E Sousaa JM.Ретинол, пальмитат и аскорбиновая кислота: роль в онкологической профилактике и терапии. Biomed Pharmacother. 2019 Янв; 109: 1394-1405. [PubMed: 30551390]
- 6.
- Чжан X, Чжу З., Сунь DW. Влияние предварительной обработки на качественные характеристики длительного хранения овощей в глубокой заморозке: обзор. Crit Rev Food Sci Nutr. 2019; 59 (5): 743-757. [PubMed: 30595028]
- 7.
- Langlois PL, Manzanares W, Adhikari NKJ, Lamontagne F, Stoppe C, Hill A, Heyland DK. Администрация витамина С для критически больных: систематический обзор и метаанализ.JPEN J Parenter Enteral Nutr. 2019 Март; 43 (3): 335-346. [PubMed: 30452091]
- 8.
- Гонсалес-Фуэнтес Дж., Сельва Дж., Мойя К., Кастро-Васкес Л., Лосано М. В., Маркос П., Плаза-Оливер М., Родригес-Робледо В., Сантандер-Ортега М. Дж., Вилласека- Гонсалес Н, Арройо-Хименес ММ. Нейрозащитные природные молекулы, от пищи до мозга. Front Neurosci. 2018; 12: 721. [Бесплатная статья PMC: PMC6206709] [PubMed: 30405328]
Аскорбат модулирует окислительно-восстановительную передачу сигналов в эндотелии
Биофакторы.Авторская рукопись; доступно в PMC 2009 26 октября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2767105
NIHMSID: NIHMS151756
Департамент физических упражнений и питания, Университет в Буффало, Буффало, штат Нью-Йорк, США *
905 905 Адрес для корреспонденции: Джон X. Уилсон, доктор философии, факультет физических упражнений и диетологии, Университет в Буффало, 3435 Main Street, Buffalo, NY, 14214-8028, USA Тел .: +716 829 2941; Факс: +716 829 2428.ude.olaffub@nosliwxj. Окончательная отредактированная версия этой статьи издателем доступна на Biofactors. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Уровни циркулирующего витамина С (аскорбата) низкие у пациентов с сепсисом. Парентеральное введение аскорбата повышает концентрацию витамина в плазме и тканях и может снизить заболеваемость. В моделях сепсиса на животных внутривенная инъекция аскорбата увеличивает выживаемость и защищает несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам.Воздействие парентерального аскорбата на функцию микрососудов быстрое и стойкое. Аскорбат быстро накапливается в эндотелиальных клетках микрососудов, поглощает активные формы кислорода и действует через тетрагидробиоптерин, стимулируя выработку оксида азота эндотелиальной синтазой оксида азота. Основная причина длительного улучшения функции микрососудов заключается в том, что клетки сохраняют высокий уровень аскорбата, который изменяет чувствительные к окислению-восстановлению сигнальные пути, чтобы уменьшить септическую индукцию НАДФН-оксидазы и индуцибельной синтазы оксида азота.Эти наблюдения согласуются с гипотезой о том, что функция микрососудов при сепсисе может быть улучшена парентеральным введением аскорбата в качестве адъювантной терапии.
Ключевые слова: Артериола, аскорбиновая кислота, кровоток, капилляр, воспаление, проницаемость микрососудов, оксид азота, пероксинитрит, тетрагидробиоптерин
1. Введение
Витамин С (аскорбиновая кислота) диссоциирует при физиологическом pH с образованием окислительно-восстановительного аскорбата. состояние витамина, наиболее часто встречающегося в клетках [1].Хорошо известно, что аскорбат физиологически действует как восстановитель и кофактор фермента. Целью настоящего обзора является изучение недавних доказательств того, что аскорбат модулирует внутриклеточные механизмы, которые вызывают дисфункцию микрососудов при критических заболеваниях, таких как сепсис.
Клинический синдром сепсиса — это не единичный гомогенный болезненный процесс, а общий термин для большой группы заболеваний [2]. Сепсис может развиться в результате хирургического вмешательства, пневмонии, инфекции мягких тканей, связанной со злокачественными новообразованиями или заболеванием периферических сосудов, или многих других событий.Синдромы сепсиса варьируются от синдрома системного воспалительного ответа до тяжелого сепсиса (острая органная дисфункция, вызванная инфекцией) и септического шока (тяжелый сепсис плюс гипотензия, не купируемая с помощью жидкостной реанимации) [2,3]. Эти синдромы являются основными причинами смерти в отделениях интенсивной терапии во всем мире. Основы лечения включают жидкостную реанимацию для восстановления среднего давления наполнения крови, терапию антибиотиками и контроль источника для устранения инсульта, вызывающего сепсис, вазопрессорную или комбинированную инотропно-вазопрессорную терапию для предотвращения шока, установление гликемического контроля, профилактику тромбоза глубоких вен и профилактика стрессовых язв для предотвращения кровотечений из верхних отделов желудочно-кишечного тракта [3].Тем не менее, несмотря на лучшее медицинское и хирургическое лечение, смертность остается высокой.
При сепсисе пациенты реагируют на целые бактерии, бактериальные продукты, такие как эндотоксин [например, липополисахарид Escherichia coli (LPS)] и внутриклеточные продукты, выделяемые из поврежденных тканей [2]. Ответы включают изменения в функции микрососудов, которые включают: (i) снижение плотности перфузированных капилляров и увеличение доли неперфузированных капилляров; (ii) повышенная проницаемость микрососудов (i.е. потеря барьерной функции), что приводит к образованию отека и гипердемии; и (iii) гипореактивность артериол к вазоконстрикторам и вазодилататорам [4–16]. Если эти изменения произошли только в небольших локализованных областях поврежденной ткани, они могут принести пользу пациенту за счет уменьшения кровотечения из поврежденных кровеносных сосудов, доставки антимикробных медиаторов и фагоцитарных клеток к месту повреждения или предотвращения распространения токсичных веществ [2]. Но широко распространенное системное возникновение этих изменений при сепсисе считается дисфункцией микрососудов, потому что оно приводит к гипоксии тканей, митохондриальной дисфункции и истощению АТФ, что провоцирует органную недостаточность, даже у реанимационных пациентов с адекватным оксигенацией артериальной крови и сердечным выбросом [17]. ].Действительно, микрососудистая дисфункция является важным предиктором смерти, и одна треть пациентов с тяжелым сепсисом умирает от органной недостаточности [10]. Терапевтическая эффективность антибиотиков осложняется увеличением числа инфекций, вызываемых бактериями с множественной лекарственной устойчивостью. Кроме того, патогены, которые уничтожаются антибиотиками, могут выделять большое количество токсичных продуктов (например, ЛПС), которые продолжают травмировать пациента [18]. Таким образом, пациенты с сепсисом могут получить пользу от адъювантной терапии, направленной на микрососудистую дисфункцию.
2. Уровни витамина С у пациентов в критическом состоянии и соответствующие экспериментальные модели
Снижение концентрации аскорбата в плазме и лейкоцитах — обычное явление для тяжелобольных в целом и пациентов с сепсисом в частности [19–25]. Кроме того, аскорбат в плазме обратно коррелирует с полиорганной недостаточностью [19] и напрямую с выживаемостью [21].
Одной из причин истощения аскорбата у госпитализированных критически больных пациентов может быть низкий уровень витамина в растворах для парентерального питания из-за разложения аскорбата и дегидроаскорбиновой кислоты (DHA), которое происходит во время приготовления и хранения [26,27].Другой причиной истощения запасов витамина С является повышенная потребность в аскорбате [22,28]. Количество витамина С, содержащееся в стандартных поливитаминных препаратах для парентерального питания (номинально 200 мг / день), недостаточно для нормализации уровня витамина С в плазме у тяжелобольных пациентов, даже при приеме в течение 7 дней [29]. Основанием для повышенной потребности может быть окисление аскорбата избытком активных форм кислорода (АФК). Действуя как поглотитель ROS и кофактор фермента, аскорбат окисляется до свободного радикала аскорбата, который затем дисмутируется с образованием DHA.
Как показано на фигуре, аскорбат транспортируется в эндотелиальные клетки с помощью специфического натрийзависимого транспортера витамина C 2 (SVCT2), в то время как DHA поглощается посредством вспомогательных транспортеров глюкозы (GLUT) и затем восстанавливается до аскорбата. Отток аскорбата из эндотелиальных клеток может стимулироваться кальций-зависимыми механизмами, но эти клетки обычно сохраняют внутриклеточные концентрации аскорбата, которые намного превышают внеклеточные уровни [1,30–33]. В целом, эти транспортные системы заставляют эндотелиальные клетки быстро накапливать миллимолярные уровни аскорбата, который либо изменяет внутриклеточную функцию, либо регулируемым образом выделяется во внеклеточную жидкость.
Внутриклеточный аскорбат модулирует эффекты септического инсульта на функцию эндотелиальных клеток микрососудов. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Септический инсульт увеличивает активность НАДФН-оксидазы (Nox) и индуцибельной синтазы оксида азота (iNOS), которые повышают уровни активных форм кислорода (АФК) и пероксинитрита (ONOO —). ROS и ONOO — ухудшают капиллярный кровоток, функцию капиллярного барьера и чувствительность артериол к вазоконстрикторам и вазодилататорам.Аскорбат (Asc) и дегидроаскорбиновая кислота (DHA) проникают в клетку через натрийзависимый транспортер витамина C 2 (SVCT2) и транспортер глюкозы 1 (GLUT1), соответственно, и DHA восстанавливается до Asc. Внутриклеточная Asc быстро улавливает ROS и ONOO —, одновременно стимулируя тетрагидробиоптерин (Bh5) -зависимую эндотелиальную синтазу оксида азота (eNOS), увеличивая локальную концентрацию оксида азота (NO). Asc также снижает активность Nox, предотвращает индукцию субъединицы фермента p47phox и блокирует индукцию iNOS.
Воспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-1бета) ингибируют захват аскорбата в культурах эндотелиальных клеток, которые спонтанно экспрессируют SVCT2 [34]. Это действие может истощить внутриклеточный аскорбат из эндотелия во время сепсиса. Вторая причина, по которой внутриклеточный аскорбат может истощаться, — это плохой контроль уровня глюкозы в плазме, что приводит к эпизодам гипергликемии у пациентов с сепсисом [3]. Острая гипергликемия вызывает дефицит аскорбата в эндотелиальных клетках и нарушает эндотелий-зависимую вазодилатацию у здоровых людей [35].Эти эффекты являются следствием конкурентного ингибирования глюкозой захвата ДГК эндотелиальными клетками, поскольку нарушение вазодилатации может быть отменено внутривенным введением аскорбата (2 г болюса [ссылка 36]; инфузия 3 мг / мин [ссылка 37]). Третьей потенциальной причиной внутриклеточного истощения аскорбата является то, что чрезмерное количество АФК может окислять аскорбат до DHA, а затем необратимо окислять последний.
ЛПС повышает концентрацию аскорбата в надпочечниках, сердце, почках и печени [38]. Этот феномен, по-видимому, не требует SVCT2, потому что нет взаимодействия между эффектами LPS и дефицита SVCT2 (SVCT2 +/– гетерозиготные мыши) на концентрацию аскорбата в этих органах [38].В большинстве типов клеток, которые были изучены, поглощение и восстановление внеклеточной DHA до аскорбата не нарушается LPS. Напротив, доноры LPS и оксида азота повышают экспрессию GLUT1 в культурах эндотелиальных клеток [39,40]. Септические инсульты ускоряют скорость поглощения внеклеточной DHA и восстановления ее до аскорбата во многих типах клеток [38,41] (хотя и не во всех, поскольку септический инсульт подавляет поглощение DHA в культивируемых астроцитах [42]).
Эндотелиальные клетки отвечают на ЛПС повышенной экспрессией глюкозо-6-фосфатдегидрогеназы, ключевого фермента пентозного цикла (гексозо-монофосфатный шунт), продуцирующего НАДФН [43].Индукция LPS глюкозо-6-фосфатдегидрогеназы может увеличить поступление восстанавливающих эквивалентов НАДФН для превращения DHA в аскорбат.
В областях тканей с неперфузированными капиллярами гипоксия может подавлять пролилгидроксилазу (PHD) индуцируемого гипоксией фактора (HIF) и, следовательно, увеличивать экспрессию HIF (). HIF-1 увеличивает экспрессию транспортеров GLUT1 и GLUT3, гликолитических ферментов и нескольких генов, участвующих в воспалении [44,45]. Гипоксия стимулирует поглощение DHA через GLUT1 [46].Повышенная восстанавливающая способность, связанная с гипоксией, может затем увеличить способность восстановления DHA к аскорбату внутри клеток.
Внутриклеточный аскорбат (Asc) модулирует окислительно-восстановительные сигнальные пути в эндотелиальных клетках микрососудов во время сепсиса. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Липополисахарид (LPS) и цитокины, такие как интерферон-гамма (IFNgamma), стимулируют сигнальные пути, которые запускают экспрессию субъединицы p47phox НАДФН-оксидазы (Nox), индуцибельной синтазы оксида азота (iNOS) и других медиаторов воспаления.Гипоксия увеличивает индуцируемый гипоксией фактор 1 (HIF-1) за счет ингибирования пролилгидроксилазы HIF-1 (PHD) и тем самым индуцирует экспрессию генов, связанных с сепсисом. Asc ингибирует активацию пути Jak2-Stat1-IRF1 и увеличивает активность PHD. Asc дополнительно регулирует локальную концентрацию оксида азота (NO), поглощая супероксид (O2⋅–) и пероксинитрит (ONOO — ). ИКК; NFκB. Аскорбат не влияет на киназу IKB (IKK) и ядерный фактор-κB, которые также опосредуют индукцию iNos в эндотелиальных клетках микрососудов, подвергнутых воздействию LPS и IFN гамма.
3. Клинические испытания витамина С у пациентов в критическом состоянии
Как подробно описано ниже, сепсис связан с повышенным образованием АФК и пероксинитрита, которые истощают молекулы антиоксидантов и окисляют белки и липиды. АФК также изменяют окислительно-восстановительную активацию и экспрессию белков, которые изменяют распределение капиллярного кровотока, проницаемость капилляров (то есть функцию капиллярного барьера) и чувствительность артериол к вазоконстрикторам и вазодилататорам (и). Следовательно, пациентам с сепсисом может быть полезна адъювантная терапия, которая предотвращает повышение ROS, особенно на участках внутриклеточной передачи сигналов.Парентеральное введение аскорбата может быть вмешательством, которое дает это преимущество.
Парентеральное, а не пероральное введение аскорбата увеличивает его влияние на концентрацию аскорбата в плазме и функцию микрососудов [1]. Например, при сравнении перорального и внутривенного пути введения аскорбата (500 мг / день в течение 30 дней) у мужчин, ведущих малоподвижный образ жизни, только внутривенное введение аскорбата улучшает эндотелий-зависимую функцию артериол, на что указывает вазодилатация, опосредованная потоком [47].
Парентеральное введение аскорбата может снизить заболеваемость и смертность у тяжелобольных пациентов с сепсисом или с риском сепсиса.В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 216 пациентов в критическом состоянии 28-дневная смертность была снижена у пациентов, получавших комбинацию аскорбата и витамина Е внутривенно, по сравнению с теми, кто этого не делал [48]. Второе рандомизированное исследование с 595 тяжелобольными хирургическими пациентами показало, что комбинация аскорбата (1000 мг каждые 8 часов путем внутривенной инъекции) и витамина E (1000 МЕ каждые 8 часов через назо- или орогастральный зонд), начавшаяся в течение 24 часов после травмы или серьезного хирургического вмешательства, снижение относительного риска отека легких и полиорганной недостаточности [49].Эти два испытания не были разработаны для того, чтобы различать действие аскорбата и витамина Е. Однако третье рандомизированное испытание выявило снижение заболеваемости у пациентов с тяжелыми ожогами, получавших очень высокую дозу аскорбата (1584 мг / кг / день) парентерально [50] . Лечение аскорбатом, имеющее особое значение для барьерной функции микрососудов, было связано со значительным снижением образования отеков, объема жидкой реанимации и респираторной дисфункции [50].
4. Влияние витамина С на выживаемость при экспериментальном сепсисе
Животные модели синдромов сепсиса предоставляют фундаментальную информацию о потенциальной пользе и механизме действия аскорбата.Предыдущее истощение запасов аскорбата снижает выживаемость мышей, которым вводили патогенные бактерии [51]. Соответственно, парентеральное введение аскорбата предотвращает гипотонию и отек у животных, которым вводили ЛПС [5,6,11], и улучшает капиллярный кровоток, чувствительность артериол, артериальное кровяное давление, функцию печени и выживаемость при экспериментальном сепсисе [4,12–15] , 52].
Среди наиболее клинически значимых моделей полимикробного сепсиса — перевязка и пункция слепой кишки (CLP) и инъекция фекалий в брюшину (FIP).Подобно изменениям, наблюдаемым у пациентов с сепсисом, CLP у животных увеличивает маркеры окислительного стресса и снижает концентрацию аскорбата в плазме и тканях [4,12,14]. Введение аскорбата (200 мг / кг, в / в) увеличивает выживаемость мышей CLP [15]. Показатели выживаемости через 24 часа после CLP составляют 9% и 65% у мышей, которым вводили носитель и вводили аскорбат, соответственно. Защитный эффект не связан с ингибированием репликации бактерий в инфекционном очаге, поскольку количество бактериальных колониеобразующих единиц в жидкости перитонеального лаважа после CLP не различается у мышей, которым вводили носитель и аскорбат [15].У мышей с FIP 24-часовая выживаемость составляет 19% после инъекции физиологического раствора носителя, но 50% после внутривенной инъекции аскорбата (10 мг / кг, в / в) [13].
5. Дефицит капиллярной перфузии
5.1. Быстрый ответ на аскорбат
Внутривенная инъекция аскорбата может защитить несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Внутривенная инъекция аскорбата предотвращает и обращает вспять неравномерное распределение кровотока в капиллярах септических моделей.Эффект парентерального аскорбата быстрый и стойкий. В этом разделе обсуждаются механизмы, лежащие в основе реакции на аскорбат.
Системное воспаление вызывает остановку кровотока в некоторых капиллярах. При клиническом сепсисе характер распределения капиллярного кровотока улучшается у выживших, но не улучшается у тех, кто не выжил [10]. Улучшение капиллярного кровотока во время жидкостной реанимации связано с предотвращением органной недостаточности независимо от изменений общей гемодинамики [53].Подобно клиническому сепсису, CLP и FIP уменьшают плотность перфузируемых капилляров и увеличивают долю неперфузированных капилляров в скелетных мышцах мышей и крыс, несмотря на введение жидкости для объемной реанимации, чтобы предотвратить шок [4,12,13].
У тяжелобольных пациентов вазодилататоры временно увеличивают долю перфузируемых капилляров [54]. Неизвестно, происходит ли расширение сосудов под действием аскорбата и является ли оно прямой причиной восстановления капиллярного кровотока при клиническом сепсисе.Однако увеличения скорости потока (измеряемой как скорость эритроцитов) в капиллярах не обнаруживается после инъекции аскорбата, который восстанавливает количество перфузируемых капилляров до нормального в скелетных мышцах мышей с сепсисом [13]. Таким образом, экспериментальные исследования сепсиса свидетельствуют о том, что восстановление капиллярного кровотока не достигается за счет сосудорасширяющего действия аскорбата. Вместо этого причиной остановки кровотока в некоторых капиллярах может быть дефицит оксида азота в эндотелиальных клетках и тромбоцитах.Действительно, оксид азота, по-видимому, необходим для сохранения проходимости микрососудов, а местное применение донора оксида азота восстанавливает капиллярный кровоток до нормального у мышей с сепсисом (6 часов после FIP) [13].
Снижение доступности оксида азота внутри септических эндотелиальных клеток и тромбоцитов может быть связано с АФК. Септический инсульт увеличивает активность НАДФН-оксидаз, которые синтезируют АФК в кровеносных сосудах и культурах эндотелиальных клеток микрососудов [16,33,55]. Действительно, активность НАДФН-оксидазы является основным источником стимулирования продукции супероксида в эндотелиальных клетках микрососудов, инкубированных с септическим инсультом (комбинация ЛПС и гамма-интерферона [ИФН-гамма]; ЛПС + ИФН-гамма) [33,55].Ускоренное производство супероксида выявляется в течение 2 часов после первоначального воздействия на клетки LPS + IFNgamma [33]. АФК, производные НАДФН-оксидазы, нарушают капиллярный кровоток во время сепсиса, поскольку либо нокаутации субъединицы gp91phox (Nox2) НАДФН-оксидазы, либо фармакологического ингибирования фермента достаточно для коррекции неправильного распределения кровотока, вызванного FIP у мышей [13]. АФК окисляют тетрагидробиоптерин, который в восстановленной форме является кофактором ферментативного синтеза оксида азота.Потеря тетрагидробиоптерина (из-за его окисления) разъединяет эндотелиальную синтазу оксида азота (eNOS) в эндотелиальных клетках и тромбоцитах, так что этот фермент синтезирует супероксид, а не оксид азота [56]. Местное применение тетрагидробиоптерина восстанавливает капиллярный кровоток во время сепсиса у мышей дикого типа, но не у мышей eNOS — / — [13]. Эти наблюдения подтверждают гипотезу о том, что тетрагидробиоптерин стимулирует активность eNOS для увеличения продукции оксида азота и, таким образом, меняет неравномерное распределение капиллярного кровотока при сепсисе.
По сравнению с инъекцией носителя, болюсное внутривенное введение аскорбата через 0, 1, 6 или 24 ч после начала септического инсульта улучшает распределение капиллярного кровотока в скелетных мышцах крыс CLP [4,12]. Например, инъекция аскорбата (10 мг / кг) через 6 часов после начала септического инсульта устраняет неравномерное распределение кровотока в течение 10 минут [13]. Быстрое улучшение распределения кровотока аскорбатом во время сепсиса зависит от eNOS, потому что это происходит у мышей с нокаутом нейрональной синтазы оксида азота дикого типа (nNOS — / — ) и индуцибельной синтазы оксида азота (iNOS — / — ), но отсутствует у мышей eNOS — / — [13].Стимулирующее действие аскорбата на уровни оксида азота в эндотелиальных клетках связано с несколькими механизмами. Во-первых, как показано на фиг.4, аскорбат предотвращает и обращает вспять окисление тетрагидробиоптерина, увеличивает содержание тетрагидробиоптерина и повышает тетрагидробиоптерин-зависимый синтез оксида азота с помощью eNOS, что является действиями, которые N -ацетилцистеин не может выполнять [7,57,58]. Во-вторых, аскорбат улавливает супероксид и другие АФК, которые в противном случае реагируют с оксидом азота [55] ().
Остановка кровотока в септических капиллярах может быть результатом взаимодействия между лейкоцитами, тромбоцитами и эндотелиальными клетками капилляров.АФК активируют внутриклеточные окислительно-восстановительные сигнальные пути для увеличения адгезии лейкоцитов и тромбоцитов к эндотелию [59]. В соответствии с этим фактом адгезия тромбоцитов стимулируется и ингибируется, соответственно, локально генерируемым супероксидом и оксидом азота во время экспериментального сепсиса [59]. АФК, происходящие из эндотелия и тромбоцитов, также усиливают агрегацию тромбоцитов [60]. Возможно, что образование тромбов в микрососудах после адгезии и агрегации тромбоцитов может способствовать остановке кровотока во время системного воспаления.Внутривенное введение 2 г аскорбата усиливает ингибирование агрегации тромбоцитов донором оксида азота у пациентов, протромботических из-за хронической сердечной недостаточности [61]. Механизм, лежащий в основе этого эффекта на клеточную адгезию, может включать ингибирование аскорбатом экспрессии и активации НАДФН-оксидазы, тем самым предотвращая локальный дефицит оксида азота [13,33]. Кажется вероятным, что аскорбат оказывает аналогичное антиагрегационное действие у пациентов с протромботическими заболеваниями из-за сепсиса.
5.2. Устойчивый ответ на аскорбат
Дефицит капиллярной перфузии при экспериментальном сепсисе можно уменьшить в течение как минимум 12 и 47 часов с помощью доз аскорбата 10 и 76 мг / кг соответственно [4,12,13]. Таким образом, микрососудистые эффекты парентерального аскорбата сохраняются в течение многих часов после того, как аскорбат в плазме возвращается к исходному уровню [13]. Одна из причин большой продолжительности этого эффекта заключается в том, что клетки сохраняют высокие концентрации внутриклеточного аскорбата, которые сохраняются дольше, чем внеклеточный аскорбат [33].Вторая причина того, что микрососудистая реакция на аскорбат сохраняется, заключается в том, что витамин изменяет экспрессию генов, как будет обсуждаться позже.
Клетки, поддерживаемые в стандартных условиях культивирования, часто не содержат аскорбата, потому что аскорбат и DHA либо не попадают в среду, либо случайно разрушаются во время приготовления и хранения культуральных сред и сывороток. В эндотелиальных клетках микрососудов, не содержащих аскорбат, ЛПС + ИНФ-гамма быстро увеличивает активность НАДФН-оксидазы [33,55]. Эндотелиальная НАДФН-оксидаза синтезирует внутриклеточный супероксид, который реагирует с образованием других АФК (например,g., дисмутация супероксида производит перекись водорода), которая затем вызывает пролонгированные окислительно-восстановительные сигнальные эффекты [62]. Либо LPS + INF-gamma, либо экзогенная перекись водорода стимулирует передачу сигналов Jak2 / Stat1 / IRF1 и увеличивает экспрессию белков субъединицы NADPH-оксидазы [33,55]. Таким образом, септический инсульт запускает механизм прямой связи для увеличения продукции АФК, производных НАДФН-оксидазы. Инкубация эндотелиальных клеток микрососудов с аскорбатом повышает внутриклеточную концентрацию аскорбата и предотвращает индукцию LPS + IFN-гамма или перекисью водорода активности эндотелиальной НАДФН-оксидазы [33].Аскорбат также подавляет индукцию субъединицы фермента p47phox [33]. Последний эффект опосредуется сигнальным путем Jak2 / Stat1 / IRF1, поскольку аскорбат предотвращает активацию этого пути LPS + IFNgamma или перекисью водорода [33] (). Селективность демонстрируется тем фактом, что аскорбат подавляет синтез супероксида НАДФН-оксидазой в эндотелиальных клетках [33], но не в лейкоцитах нейтрофилов [63–66].
Продолжительный эффект аскорбата на функцию микрососудов может также включать подавление экспрессии генов, которая зависит от HIF-1 ().Аскорбат действует через кофактор PHD, железо, увеличивая активность фермента и тем самым подавляя индукцию и стабилизацию HIF-1альфа при гипоксии [44]. Кроме того, ингибирование аскорбатом эндотелиальной НАДФН-оксидазы [33] и поглощение окислителей аскорбатом может сохранять активность PHD. Это связано с тем, что оксиданты, такие как производные НАДФН-оксидазы АФК, ингибируют активность PHD [67]. Снижение уровней HIF-1 аскорбатом подавляет экспрессию чувствительных к HIF-1 генов, таких как GLUT1 и iNOS [14,15,45,55].
Активация коагуляции во время сепсиса — еще одна потенциальная причина нарушения капиллярного кровотока, которое может постепенно модулироваться аскорбатом. АФК способствуют экспрессии молекул адгезии и тканевых факторов на поверхности тромбоцитов и эндотелиальных клеток [60]. Последующее образование тканевых факторов и комплекса фактора VII приводит к образованию тромбина, который активирует НАДФН-оксидазу. Этот механизм положительной обратной связи может стимулировать образование микротромбов [60], и его отмена может быть важным механизмом, с помощью которого улучшение распределения кровотока аскорбатом сохраняется достаточно долго для увеличения выживаемости.Инъекция ингибитора пути тканевого фактора увеличивает выживаемость в модели сепсиса CLP [68], что является эффектом, аналогичным эффекту, достигаемому при инъекции аскорбата [15].
Другая потенциальная роль аскорбата предполагает наблюдение, что супероксид стимулирует экспрессию молекулы 1 межклеточной адгезии на клеточной поверхности (ICAM-1) в эндотелиальных клетках микрососудов [62]. ICAM-1 опосредует адгезию лейкоцитов к эндотелию и может тем самым нарушать микроциркуляцию. Поскольку аскорбат подавляет выработку супероксида в эндотелиальных клетках микрососудов, подвергшихся септическому инсульту [33], необходимы дальнейшие исследования, чтобы определить, предотвращает ли витамин закупорку микрососудов лейкоцитами.
6. Витамин С и увеличение проницаемости эндотелия при сепсисе
Повышенная проницаемость эндотелия во многих органах происходит во время сепсиса, что приводит к экстравазации плазмы и образованию отеков. Это вызывает респираторную дисфункцию, уменьшение объема крови и прогрессирование заболевания до септического шока. Парентеральное введение аскорбата снижает образование отеков у пациентов с тяжелой ожоговой травмой [50], а также у получивших ожоговую травму или животных, которым вводили ЛПС [5,69,70]. Аскорбат также ослабляет увеличение проницаемости эндотелия, вызванное LPS in vitro [71].
Одной из причин потери барьерной функции при сепсисе может быть апоптоз эндотелиальных клеток [2]. Следовательно, роль аскорбата как в предотвращении апоптоза в эндотелиальных клетках, так и в стимуляции их пролиферации может быть полезной [72–75].
Другое действие аскорбата на проницаемость эндотелия может включать оксид азота, супероксид и пероксинитрит. Производство базального оксида азота с помощью eNOS необходимо для поддержания функции эндотелиального барьера (т.е. для поддержания параклеточной проницаемости эндотелия на низком уровне для белков плазмы) [76].Защитный эффект оксида азота снижается во время воспалительной реакции из-за одновременного образования супероксида. Оксид азота реагирует с супероксидом с образованием пероксинитрита, который вызывает перекисное окисление липидов, окисление сульфгидрильных групп и нитрование остатков тирозина в белках. В частности, нитрование протеинфосфатазы типа 2 и белков цитоскелета пероксинитритом, по-видимому, является ключевым этапом в развитии дисфункции микрососудистого барьера [77,78]. Основными источниками супероксида, вероятно, являются эндотелиальная НАДФН-оксидаза и несвязанные eNOS и iNOS.Доказательством роли iNOS является то, что генетические или фармакологические вмешательства, которые ингибируют этот фермент, также уменьшают утечку микрососудов при экспериментальном сепсисе [79]. Улавливая супероксид, подавляя экспрессию белка p47phox и iNOS и предотвращая синтез супероксида несвязанными eNOS и iNOS, аскорбат снижает образование пероксинитрита. Кроме того, аскорбат восстанавливает продукты окисления, образующиеся при реакции пероксинитрита с клеточными белками [80]. Эти действия аскорбата могут объяснить его эффективность в предотвращении отеков у тяжелобольных пациентов и экспериментальных моделей [5,50,69,71].
Выяснен механизм, лежащий в основе септической индукции iNOS и его отмены аскорбатом. Окислители, которые возникают из-за активности НАДФН-оксидазы (например, перекись водорода, образующаяся при дисмутации супероксида), усиливают индукцию iNOS в септических кровеносных сосудах и эндотелиальных клетках [15,33,77]. iNOS синтезирует большое количество оксида азота, который, в свою очередь, вступает в реакцию с супероксидом, что приводит к чрезмерному производству пероксинитрита. Аскорбат предотвращает индукцию iNOS при септических поражениях кровеносных сосудов in vivo и эндотелиальных клеток в культуре [14,15,81].Подавление аскорбатом НАДФН-оксидазы опосредует, по крайней мере частично, это подавление экспрессии iNOS [55]. При стимуляции LPS + IFNgamma НАДФН-оксидаза продуцирует АФК, которые активируют сигнальные пути JNK-AP1 и Jak2-IRF1 индукции iNOS, а аскорбат предотвращает эту активацию [55].
7. Гипореактивность артериол к вазоконстрикторам
Гипотензия у пациентов с сепсисом может быть вызвана нарушением функции миокарда и потерей чувствительности артериол к вазоконстрикторам.Парентеральное введение аскорбата может решить последнюю проблему, поскольку инфузия аскорбата меняет гипореактивность артериол к вазоконстрикторам (норэпинефрин, ангиотензин, вазопрессин) у людей, страдающих воспалительным заболеванием или получавших инъекции ЛПС [9,82].
Сопоставимые результаты были получены на животных моделях сепсиса. Например, повышенная неоднородность капиллярного кровотока сопровождается развитием артериальной гипотензии у крыс CLP [12]. Вазоконстрикция артериол и реакции артериального давления на норэпинефрин и ангиотензин II подавляются у мышей через 6 часов после CLP [14,15].Внутривенное введение аскорбата и дефицит гена iNOS (мыши iNOS — / — ) одинаково эффективны для предотвращения CLP-индуцированного нарушения реактивности артериол [13-15]. Чувствительность артериол и артериальное кровяное давление выше у крыс CLP, которым внутривенно вводили аскорбат, по сравнению с крысами, которым вводили носитель, когда эти параметры измеряли через 18–24 ч после инъекции [4,12].
8. Гипореактивность артериол к вазодилататорам
Эндотелиальные клетки регулируют чувствительность артериол к вазодилататорам посредством оксида азота, производного от eNOS, и простациклина, производного от эндопероксида h3-синтазы-1 (PGHS) [83].Оксид азота проникает в гладкомышечные клетки артериол и активирует растворимую гуанилилциклазу, тем самым повышая внутриклеточный цГМФ. Простациклин стимулирует аденилатциклазу к повышению внутриклеточного цАМФ. И цГМФ, и цАМФ затем опосредуют расслабление гладких мышц. Однако септический инсульт увеличивает выработку супероксида, который реагирует с оксидом азота с образованием пероксинитрита, который инактивирует эндотелиальный PGHS, который больше не может синтезировать простациклин. Супероксид и другие окислители, производные НАДФН-оксидазы (т.например, перекись водорода и пероксинитрит) также могут снижать эффективный клеточный уровень оксида азота ниже уровня, необходимого для активации гуанилилциклазы [83]. Таким образом, чувствительность артериол к вазодилататорам подавляется инфузией LPS у людей и CLP-индуцированным сепсисом у животных [7,8,16].
Инфузия аскорбата или тетрагидробиоптерина предотвращает ингибирование LPS зависимых от эндотелия вазодилатационных реакций (оцениваемых как изменения кровотока в предплечьях) на ацетилхолин у здоровых людей [7,8].Этот эффект аскорбата связан с резким увеличением концентрации тетрагидробиоптерина в плазме [7]. Аскорбат может поддерживать нормальные уровни оксида азота, полученного из eNOS, и простациклина, производного PGHS, путем подавления экспрессии НАДФН-оксидазы, удаления ROS и повышения уровней тетрагидробиоптерина в эндотелиальных клетках артериол.
Парентеральный аскорбат заметно увеличивает чувствительность артериол к вазодилататорам при некоторых заболеваниях. Например, при внутриартериальном введении N -ацетилцистеина (48 мг / мин) или аскорбата (18 мг / мин) людям с эссенциальной гипертензией только лечение аскорбатом усиливает вазодилатацию ацетилхолином [58].В последнее время тема реакции на вазодилататоры при клиническом сепсисе стала дискуссионной. Kienbaum et al. [84] сообщили, что вызванное ацетилхолином снижение сосудистого сопротивления предплечья (кровоток в предплечье / среднее артериальное давление) не различается между пациентами с сепсисом и контрольной группой. Однако, поскольку пациенты с сепсисом изначально имели более низкое сосудистое сопротивление, снижение сосудистого сопротивления, вызванное инфузией ацетилхолина, могло быть меньше у этих пациентов. При исследовании здоровых людей до и во время экспериментальной эндотоксемии гипореактивность артериол к ацетилхолину была обнаружена через 4-6 часов после введения ЛПС, в то время, когда циркулирующие цитокины находятся на самом высоком уровне [8].Следовательно, гипореактивность артериол, чувствительных к аскорбатам, к вазодилататорам может варьироваться в зависимости от времени или тяжести заболевания во время прогрессирования синдрома сепсиса.
9. Нерешенные вопросы, заслуживающие дальнейшего изучения
Нет исследований, сравнивающих эффективность аскорбата и DHA при лечении сепсиса. Максимальные скорости поглощения DHA выше, чем аскорбата, в большинстве типов клеток млекопитающих при исследовании в условиях отсутствия глюкозы [1]. Но глюкоза подавляет поглощение DHA большинством клеток, включая эндотелиальные клетки [35], а гипергликемия, которая часто возникает при сепсисе [3], может снизить клеточное поглощение и терапевтическую эффективность вводимой DHA.
Безопасность парентерального аскорбата требует дальнейшего изучения. Исследование внутривенного введения аскорбата у пациентов с запущенными злокачественными новообразованиями показало, что инъекции 1,5 г аскорбата на кг массы тела три раза в неделю хорошо переносятся [85]. Однако аскорбат метаболизируется до оксалата, который накапливается в виде нефротоксичных кристаллов оксалата кальция (нефролитиаз) в почках восприимчивых людей, как сообщается в недавнем исследовании [86]. Другая проблема заключается в том, что аскорбат отдает электроны переходным металлам (например,ж., железо), которые затем катализируют синтез перекиси водорода. Повторные внутривенные инъекции аскорбата 750–7 500 мг / сут в течение 6 дней не вызывают прооксидантных изменений в плазме у здоровых добровольцев [87]. Но у хирургических пациентов внутривенная инъекция 2 г аскорбата за 2 часа до серьезной операции увеличивает окислительную модификацию липидов плазмы в образцах венозной крови, полученных во время ишемической фазы операции [88].
10. Заключение
Для окончательного определения безопасности и эффективности аскорбата у пациентов с сепсисом необходимы дальнейшие исследования.Тем не менее, имеющиеся данные подтверждают гипотезу о том, что функция микрососудов может быть улучшена при сепсисе парентеральным введением аскорбата в качестве адъювантной терапии.
Благодарность
Эта работа финансировалась грантом 1R01AT003643-01A2 Национальных институтов здравоохранения.
Ссылки
1. Wilson JX. Регулирование транспорта витамина С. Анну. Rev. Nutr. 2005. 25: 105–125. [PubMed] [Google Scholar] 2. Маршалл Дж. Сепсис: переосмысление подхода к клиническим исследованиям.J. Leukoc. Биол. 2008; 83: 471–482. [PubMed] [Google Scholar] 3. Деллинджер Р.П., Леви М.М., Карлет Дж. М., Бион Дж., Паркер М. М., Яешке Р., Рейнхарт К., Ангус Д. К., Брун-Бюиссон С., Бил Р., Каландра Т., Дайно Дж. Ф., Герлах Х., Харви М., Марини Дж. Дж., Маршалл Дж., Раньери М., Рамзи Дж., Севрански Дж., Томпсон Б.Т., Таунсенд С., Вендер Дж. С., Циммерман Дж. Л., Винсент Дж. Л., Международный комитет по руководящим принципам кампании против сепсиса. Американская ассоциация медсестер интенсивной терапии. Американский колледж грудных врачей. Американский колледж врачей скорой помощи.Канадское общество интенсивной терапии. Европейское общество клинической микробиологии и инфекционных болезней. Европейское общество интенсивной терапии. Европейское респираторное общество. Международный форум по сепсису. Японская ассоциация острой медицины. Японское общество интенсивной медицины. Общество интенсивной терапии. Общество госпитальной медицины. Общество хирургической инфекции. Кампания Всемирной федерации обществ интенсивной терапии и реанимации по переживанию сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2008 г.Крит. Care Med. 2008. 36: 296–327. [PubMed] [Google Scholar] 4. Броня Дж, Таймл К, Лидингтон Д., Уилсон Дж. Аскорбат предотвращает дисфункцию микрососудов в скелетных мышцах крысы с сепсисом. J. Appl. Physiol. 2001; 90: 795–803. [PubMed] [Google Scholar] 5. Dwenger A, Pape HC, Bantel C, Schweitzer G, Krumm K, Grotz M, Lueken B, Funck M, Regel G. Аскорбиновая кислота снижает повреждение легких, вызванное эндотоксином, у бодрствующих овец. Евро. J. Clin. Инвестировать. 1994; 24: 229–235. [PubMed] [Google Scholar] 6. Фэн Н.Х., Чу С.Дж., Ван Д, Сюй К., Линь СН, Линь Х.И.Влияние различных антиоксидантов на вызванное эндотоксином повреждение легких и экспрессию генов: экспрессия мРНК MnSOD, интерлейкина-1бета и iNOS. Подбородок. J. Physiol. 2004. 47: 111–120. [PubMed] [Google Scholar] 7. Mittermayer F, Pleiner J, Schaller G, Zorn S, Namiranian K, Kapiotis S, Bartel G, Wolfrum M, Brugel M, Thiery J, Macallister RJ, Wolzt M. Тетрагидробиоптерин корректирует эндотоксиновую дисфункцию, вызванную Escherichia coli. Являюсь. J. Physiol. Heart Circ. Physiol. 2005; 289: h2752 – h2757. [PubMed] [Google Scholar] 8.Плейнер Дж., Миттермайер Ф., Шаллер Дж., Макаллистер Р. Дж., Вольц М. Высокие дозы витамина С обращают Escherichia coli эндотоксин-индуцированную гипореактивность к ацетилхолину в предплечье человека. Тираж. 2002; 106: 1460–1464. [PubMed] [Google Scholar] 9. Плейнер Дж., Миттермайер Ф., Шаллер Дж., Марсик С., МакАллистер Р. Дж., Вольц М. Вызванная воспалением гипореактивность сосудосуживающих средств вызвана окислительным стрессом. Варенье. Coll. Кардиол. 2003. 42: 1656–1662. [PubMed] [Google Scholar] 10. Сакр Й., Дюбуа М.Дж., Де Бакер Д., Кретер Дж., Винсент Дж.Л.Стойкие нарушения микроциркуляции связаны с органной недостаточностью и смертью пациентов с септическим шоком. Крит. Care Med. 2004. 32: 1825–1831. [PubMed] [Google Scholar] 11. Шен КП, Ло Ю.К., Ян Р.С., Лю Х.В., Чен И.Дж., Ву Б.Н. Антиоксидант эвгеноседин-A защищает от липополисахаридной гипотензии, гипергликемии и иммунореактивности цитокинов у крыс и мышей. J. Pharm. Pharmacol. 2005. 57: 117–125. [PubMed] [Google Scholar] 12. Тимл К., Ли Ф, Уилсон Дж. Отсроченный болюс аскорбата защищает от неправильного распределения микрососудистого кровотока в септических скелетных мышцах крыс.Крит. Care Med. 2005; 33: 1823–1828. [PubMed] [Google Scholar] 13. Тимл К., Ли Ф, Уилсон Дж. Септическое нарушение капиллярного кровотока требует никотинамидадениндинуклеотидфосфатоксидазы, но не синтазы оксида азота, и быстро устраняется аскорбатом через эндотелиальный механизм, зависимый от синтазы оксида азота. Крит. Care Med. 2008. 36: 2355–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Wu F, Wilson JX, Tyml K. Аскорбат подавляет экспрессию iNOS и сохраняет сосудосуживающую способность в скелетных мышцах мышей с сепсисом.Являюсь. J. Physiol. Regul. Интегр. Комп. Physiol. 2003; 285: R50 – R56. [PubMed] [Google Scholar] 15. Wu F, Wilson JX, Tyml K. Аскорбат защищает от нарушения сужения артериол при сепсисе, ингибируя экспрессию индуцибельной синтазы оксида азота. Свободный Радич. Биол. Med. 2004. 37: 1282–1289. [PubMed] [Google Scholar] 16. Ю ХП, Луи П.В., Хван Т.Л., Йен Ч., Лау Ю.Т. Пропофол улучшает эндотелиальную дисфункцию и снижает выработку супероксида в сосудах у крыс с сепсисом. Крит. Care Med. 2006; 34: 453–460. [PubMed] [Google Scholar] 17.Карре Дж. Э., Сингер М. Энергетический метаболизм клеток при сепсисе: необходимость системного подхода. Биохим. Биофиз. Acta. 2008; 1777: 763–771. [PubMed] [Google Scholar] 18. Holzheimer RG. Высвобождение эндотоксина, индуцированное антибиотиками, и клинический сепсис: обзор. J. Chemother. 2001; 13: 159–172. [PubMed] [Google Scholar] 19. Боррелли Э., Ру-Ломбард П., Грау Дж. Э., Жирардин Э., Рику Б., Дайер Дж., Сутер П. М.. Концентрация цитокинов, их растворимых рецепторов и витаминов-антиоксидантов в плазме может предсказать развитие полиорганной недостаточности у пациентов из группы риска.Крит. Care Med. 1996; 24: 392–397. [PubMed] [Google Scholar] 20. Doise JM, Aho LS, Quenot JP, Guilland JC, Zeller M, Vergely C, Aube H, Blettery B, Rochette L. Антиоксидантный статус плазмы у пациентов с сепсисом в критическом состоянии: снижение с течением времени. Fundam. Clin. Pharmacol. 2008; 22: 203–209. [PubMed] [Google Scholar] 21. Галлей Х.Ф., Дэвис М.Дж., Вебстер Н.Р. Образование аскорбильных радикалов у пациентов с сепсисом: эффект нагрузки аскорбатом. Свободный Радич. Биол. Med. 1996. 20: 139–143. [PubMed] [Google Scholar] 22. Лонг CL, Молл К.И., Кришнан Р.С., Лоус Х.Л., Гейгер Дж. У., Боргези Л., Фрэнкс В., Лоусон Т.С., Зауберлих Х.Динамика аскорбиновой кислоты у тяжелобольных и раненых. J. Surg. Res. 2003. 109: 144–148. [PubMed] [Google Scholar] 23. Метниц П.Г., Бартенс С., Фишер М., Фридрих П., Стельцер Н., Драмл В. Антиоксидантный статус у пациентов с острым респираторным дистресс-синдромом. Intensive Care Med. 1999. 25: 180–185. [PubMed] [Google Scholar] 24. Rumelin A, Humbert T, Luhker O, Drescher A, Fauth U. Метаболический клиренс антиоксидантной аскорбиновой кислоты у хирургических пациентов. J. Surg. Res. 2005. 129: 46–51. [PubMed] [Google Scholar] 25.Schorah CJ, Downing C, Piripitsi A, Gallivan L, Al-Hazaa AH, Sanderson MJ, Bodenham A. Концентрации общего витамина C, аскорбиновой кислоты и дегидроаскорбиновой кислоты в плазме критически больных пациентов. Являюсь. J. Clin. Nutr. 1996. 63: 760–765. [PubMed] [Google Scholar] 26. Dupertuis YM, Ramseyer S, Fathi M, Pichard C. Оценка стабильности аскорбиновой кислоты в различных многослойных пакетах для парентерального питания: критическое влияние материала стенки пакета. JPEN J. Parenter. Энтерально. Nutr. 2005; 29: 125–130. [PubMed] [Google Scholar] 27.Knafo L, Chessex P, Rouleau T, Lavoie JC. Связь между зависимыми от перекиси водорода побочными продуктами аскорбиновой кислоты и повышенной активностью ацетил-КоА-карбоксилазы печени. Clin. Chem. 2005; 51: 1462–1471. [PubMed] [Google Scholar] 28. Бейнс М., Шенкин А. Недостаточная эффективность кратковременного внутривенного микронутриентного питания в восстановлении антиоксидантного статуса плазмы после операции. Clin. Nutr. 2002; 21: 145–150. [PubMed] [Google Scholar] 29. Луо М., Фернандес-Эстиварис К., Джонс Д.П., Аккарди С.Р., Алтехельд Б., Базарган Н., Хао Л., Гриффит Д.П., Блумберг Дж. Б., Галлоуэй Дж. Р., Зиглер Т. Р..Истощение антиоксидантов плазмы у пациентов хирургического отделения интенсивной терапии, нуждающихся в парентеральном питании: эффекты парентерального питания с добавлением дипептида аланил-глутамина или без него. Питание. 2008; 24: 37–44. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Best KA, Holmes ME, Samson SE, Mwanjewe J, Wilson JX, Dixon SJ, Grover AK. Поглощение аскорбата эндотелиальными клетками коронарных артерий свиней. Мол. Cell Biochem. 2005. 271: 43–49. [PubMed] [Google Scholar] 31. Дэвис К.А., Самсон С.Е., Бест К., Малхи К.К., Шевчик М., Уилсон Дж. Х., Кван С. Ю., Гровер А. К..Ca 2+ -опосредованное высвобождение аскорбата из эндотелиальных клеток коронарных артерий. Br. J. Pharmacol. 2006a; 147: 131–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Дэвис К.А., Самсон С.Е., Уилсон Дж. Х., Гровер А. К.. Гипотонический шок стимулирует высвобождение аскорбата из эндотелиальных клеток коронарных артерий по Ca 2+ -независимому пути. Евро. J. Pharmacol. 2006b; 548: 36–44. [PubMed] [Google Scholar] 33. Ву Ф, Шустер Д.П., Тимл К., Уилсон Дж. Аскорбат подавляет экспрессию субъединицы НАДФН-оксидазы p47phox в эндотелиальных клетках микрососудов.Свободный Радич. Биол. Med. 2007. 42: 124–131. [PubMed] [Google Scholar] 34. Сено Т., Иноуэ Н., Мацуи К., Эджири Дж., Хирата К.И., Кавашима С., Йокояма М. Функциональная экспрессия натрий-зависимого транспортера витамина С 2 в эндотелиальных клетках человека. J. Vasc. Res. 2004. 41: 345–351. [PubMed] [Google Scholar] 35. Цена KD, Цена CSC, Reynolds RD. Дефицит аскорбиновой кислоты, вызванный гипергликемией, способствует дисфункции эндотелия и развитию атеросклероза. Атеросклероз 2001. 2001; 158: 1–12. [PubMed] [Google Scholar] 36.Муллан Б.А., Эннис К.Н., Фи Х.Дж., Янг И.С., Маккэнс Д.Р. Предварительное введение аскорбиновой кислоты внутривенно сохраняет функцию эндотелия во время острой гипергликемии (R1). Clin. Exp. Pharmacol. Physiol. 2005. 32: 340–345. [PubMed] [Google Scholar] 37. Ceriello A, Esposito K, Piconi L, Ihnat MA, Thorpe JE, Testa R, Boemi M, Giugliano D. Колеблющаяся глюкоза более вредна для эндотелиальной функции и окислительного стресса, чем средний уровень глюкозы у нормальных пациентов и пациентов с диабетом 2 типа. Диабет. 2008. 57: 1349–1354. [PubMed] [Google Scholar] 38.Куо С.М., Тан СН, Драган М., Уилсон Дж. Эндотоксин увеличивает рециркуляцию аскорбата и его концентрацию в печени мышей. J. Nutr. 2005; 135: 2411–2416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Paik JY, Lee KH, Ko BH, Choe YS, Choi YY, Kim BT. Оксид азота стимулирует захват 18F-FDG в эндотелиальных клетках человека за счет повышенной активности гексокиназы и экспрессии GLUT1. J. Nucl. Med. 2005. 46: 365–370. [PubMed] [Google Scholar] 40. Spolarics Z, Stein DS, Garcia ZC. Эндотоксин стимулирует детоксицирующую активность перекиси водорода в эндотелиальных клетках печени крыс.Гепатология. 1996. 24: 691–696. [PubMed] [Google Scholar] 41. Мэй Дж.М., Хуанг Дж., Цюй З.С. Поглощение макрофагами и рециркуляция аскорбиновой кислоты: ответ на активацию липополисахаридом. Свободный Радич. Биол. Med. 2005; 39: 1449–1459. [PubMed] [Google Scholar] 42. Wilson JX, Dragan M. Сепсис подавляет рециркуляцию и стимулированный глутаматом экспорт аскорбата астроцитами. Свободный Радич. Биол. Med. 2005; 39: 990–998. [PubMed] [Google Scholar] 43. Spolarics Z. Эндотоксемия, пентозный цикл и оксидант / антиоксидантный баланс в синусоиде печени.J. Leukoc. Биол. 1998; 63: 534–541. [PubMed] [Google Scholar] 44. Штольце И.П., Крот Д.Р., Рэтклифф П.Дж. Регулирование HIF: пролилгидроксилазы. Новартис найден. Symp. 2006; 272: 15–25. [PubMed] [Google Scholar] 45. Vissers MC, Gunningham SP, Моррисон MJ, Dachs GU, Currie MJ. Модуляция индуцируемого гипоксией фактора-1 альфа в культивируемых первичных клетках с помощью внутриклеточного аскорбата. Свободный Радич. Биол. Med. 2007. 42: 765–772. [PubMed] [Google Scholar] 46. МакНалти А.Л., Стейблер ТВ, Вейл Т.П., МакДэниел Г.Е., Краус В.Б. Транспорт дегидроаскорбат в хондроцитах человека регулируется гипоксией и является физиологически значимым источником аскорбиновой кислоты в суставе.Ревматоидный артрит. 2005. 52: 2676–2685. [PubMed] [Google Scholar] 47. Eskurza I, Monahan KD, Robinson JA, Seals DR. Влияние аскорбиновой кислоты в острой и хронической формах на расширение опосредованного потока при малоподвижном и физически активном старении человека. J. Physiol. 2004; 556: 315–324. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Crimi E, Liguori A, Condorelli M, Cioffi M, Astuto M, Bontempo P, Pignalosa O, Vietri MT, Molinari AM, Sica V, Della Corte F, Napoli C. Благоприятные эффекты приема антиоксидантных добавок при энтеральном питании у тяжелобольных пациентов : проспективное рандомизированное двойное слепое плацебо-контролируемое исследование.Анест. Анальг. 2004. 99: 857–863. [PubMed] [Google Scholar] 49. Натенс А.Б., Нефф М.Дж., Юркович Г.Дж., Клотц П., Фарвер К., Рузински Д.Т., Раделла Ф., Гарсия И., Майер Р.В. Рандомизированное проспективное исследование антиоксидантных добавок у тяжелобольных хирургических пациентов. Анна. Surg. 2002; 236: 814–822. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Танака Х., Мацуда Т., Миягантани Ю., Юкиока Т., Мацуда Х., Шимазаки С. Уменьшение объемов реанимационной жидкости у пациентов с тяжелыми ожогами с помощью введения аскорбиновой кислоты: рандомизированное проспективное исследование.Arch. Surg. 2000; 135: 326–331. [PubMed] [Google Scholar] 51. Гаут Дж. П., Белаауадж А., Бьюн Дж., Робертс Л. Дж., II, Маеда Н., Фрей Б., Хайнеке Дж. У. Витамин С не защищает аминокислоты и липиды от окисления во время острого воспаления. Свободный Радич. Биол. Med. 2006; 40: 1494–1501. [PubMed] [Google Scholar] 52. Ким Дж.Й., Ли С.М. Витамины C и E защищают дисфункцию печеночного цитохрома P450, вызванную полимикробным сепсисом. Евро. J. Pharmacol. 2006; 534: 202–209. [PubMed] [Google Scholar] 53. Trzeciak S, McCoy JV, Dellinger RP, Arnold RC, Rizzuto M, Abate NL, Shapiro NI, Parrillo JE, Hollenberg SM, от имени исследователей Microcirculatory Alterations in Resuscitation and Shock (MARS). Реанимационные мероприятия связаны со снижением полиорганной недостаточности через 24 ч у пациентов с сепсисом.Intensive Care Med. 2008; 34: 2210–2217. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Spronk PE, Ince C, Gardien MJ, Mathura KR, Oudemans-van Straaten HM, Zandstra DR. Нитроглицерин при септическом шоке после реанимации внутрисосудистого объема. Ланцет. 2002; 360: 1395–1396. [PubMed] [Google Scholar] 55. Ву Ф, Таймл К., Уилсон Дж. Экспрессия iNOS требует НАДФН-оксидазозависимой окислительно-восстановительной передачи сигналов в эндотелиальных клетках микрососудов. J. Cell. Physiol. 2008; 217: 207–214. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56.Ландмессер У., Дикалов С., Прайс С.Р., Макканн Л., Фукаи Т., Холланд С.М., Митч В.Е., Харрисон Д.Г. Окисление тетрагидробиоптерина приводит к разъединению синтазы оксида азота эндотелиальных клеток при гипертонии. J. Clin. Инвестировать. 2003; 111: 1201–1209. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Ким Х.Дж., Ли С.И., Ли Д.Х., Смит Д., Джо Х., Шеллхорн Х.Э., Бу YC. Синтез аскорбиновой кислоты за счет экспрессии L-гулоно-1,4-лактоноксидазы увеличивает выработку NO в эндотелиальных клетках. Биохим. Биофиз. Res. Commun. 2006; 345: 1657–1662.[PubMed] [Google Scholar] 58. Schneider MP, Delles C, Schmidt BM, Oehmer S, Schwarz TK, Schmieder RE, John S. Эффекты N-ацетилцистеина и витамина C по улавливанию супероксида у субъектов с гипертонической болезнью. Являюсь. J. Hypertens. 2005; 18: 1111–1117. [PubMed] [Google Scholar] 59. Портной А, Купер Д., Грейнджер Д.Н. Взаимодействие стенки тромбоцитов и сосудов в микроциркуляции. Микроциркуляция. 2005; 12: 275–285. [PubMed] [Google Scholar] 60. Херкерт О., Джорджевич Т., БелАиба Р.С., Горлач А. Понимание окислительно-восстановительного контроля свертывания крови: роль сосудистых активных форм кислорода, производных НАДФН-оксидазы, в тромбогенном цикле.Антиоксид. Редокс-сигнал. 2004. 6: 765–776. [PubMed] [Google Scholar] 61. Эллис Г.Р., Андерсон Р.А., Чирков Ю.Ю., Моррис-Тургуд Дж., Джексон С.К., Льюис М.Дж., Горовиц Д.Д., Френно М.П. Острые эффекты витамина С на чувствительность тромбоцитов к донорам оксида азота и эндотелиальную функцию у пациентов с хронической сердечной недостаточностью. J. Cardiovasc. Pharmacol. 2001; 37: 564–570. [PubMed] [Google Scholar] 62. Ли Дж. М., Фан Л. М., Кристи М. Р., Шах А. М.. Передача сигналов альфа фактора острого некроза опухоли через НАДФН-оксидазу в эндотелиальных клетках микрососудов: роль фосфорилирования p47phox и связывание с TRAF4.Мол. Клетка. Биол. 2005; 25: 2320–2330. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Carr AC, Frei B. Человеческие нейтрофилы окисляют липопротеины низкой плотности по механизму, зависящему от хлорноватистой кислоты: роль витамина C. J. Biol. Chem. 2002; 383: 627–636. [PubMed] [Google Scholar] 64. Чаттерджи М., Салуджа Р., Кумар В., Джоти А., Джайн Г.К., Бартвал М.К., Дикшит М. Аскорбат поддерживает экспрессию нейтрофилов NOS, катализ и окислительный взрыв. Свободный Радич. Биол. Med. 2008. 45: 1084–1093. [PubMed] [Google Scholar] 65.Эллис Г.Р., Андерсон Р.А., Ланг Д., Блэкман Д.Д., Моррис Р.Х., Моррис-Тургуд Дж., Макдауэлл И.Ф., Джексон С.К., Льюис М.Дж., Френно МП. Способность нейтрофилов генерировать супероксид-анион, функция эндотелия и окислительный стресс при хронической сердечной недостаточности: эффекты краткосрочной и долгосрочной терапии витамином С. Варенье. Coll. Кардиол. 2000; 36: 1474–1482. [PubMed] [Google Scholar] 66. Шарма П., Рагхаван С.А., Сайни Р., Дикшит М. Опосредованное аскорбатом усиление генерации активных форм кислорода из полиморфно-ядерных лейкоцитов: модулирующий эффект оксида азота.J. Leukoc. Биол. 2004; 75: 1070–1078. [PubMed] [Google Scholar] 67. Goyal P, Weissmann N, Grimminger F, Hegel C, Bader L, Rose F, Fink L, Ghofrani HA, Schermuly RT, Schmidt HH, Seeger W., Hanze J. Повышенная регуляция NAD (P) H оксидазы 1 при гипоксии активирует гипоксию. индуцируемый фактор 1 за счет увеличения количества активных форм кислорода. Свободный Радич. Биол. Med. 2004; 36: 1279–1288. [PubMed] [Google Scholar] 68. Опал С. М., Паларди Дж. Э., Парехо Н. А., Кризи А. А.. Активность ингибитора пути тканевого фактора в экспериментальных моделях суперантиген-индуцированного шока и полимикробного интраабдоминального сепсиса.Крит. Care Med. 2001; 29: 13–17. [PubMed] [Google Scholar] 69. Дубик М.А., Уильямс К., Эльджо Г.И., Крамер Г.К. Настой витамина С в высоких дозах снижает потребность в жидкости при реанимации овец, получивших ожоговые травмы. Шок. 2005. 24: 139–144. [PubMed] [Google Scholar] 70. Сакураи М., Танака Х., Мацуда Т., Гойя Т., Шимазаки С., Мацуда Х. Уменьшение объема реанимационной жидкости при экспериментальных ожогах второй степени с отсроченным началом терапии витамином С (начало через 6 часов после травмы). J. Surg. Res. 1997. 73: 24–27. [PubMed] [Google Scholar] 71.Диммелер С., Бринкманн С., Нойгебауэр Э. Эндотоксин-индуцированные изменения жизнеспособности и проницаемости эндотелиальных клеток: защитный эффект 21-аминостероида. Евро. J. Pharmacol. 1995; 287: 257–261. [PubMed] [Google Scholar] 72. Recchioni R, Marcheselli F, Moroni F, Pieri C. Апоптоз эндотелиальных клеток аорты человека, индуцированный гипергликемическим состоянием, включает митохондриальную деполяризацию и предотвращается N-ацетил-L-цистеином. Обмен веществ. 2002. 51: 1384–1388. [PubMed] [Google Scholar] 73. Rössig L, Hoffmann J, Hugel B, Mallat Z, Haase A, Freyssinet JM, Tedgui A, Aicher A, Zeiher AM, Dimmeler S.Витамин С подавляет апоптоз эндотелиальных клеток при застойной сердечной недостаточности. Тираж. 2001; 104: 2182–2187. [PubMed] [Google Scholar] 74. Саид Р.У., Пэн Т., Мец, CN. Аскорбиновая кислота блокирует рост ингибирующего действия фактора некроза опухоли альфа на эндотелиальные клетки. Exp. Cell Biol. (Maywood) 2003; 228: 855–865. [PubMed] [Google Scholar] 75. Шор AM, Шор SL, Аллен Т.Д. Влияние условий культивирования на пролиферацию, морфологию и миграцию эндотелиальных клеток аорты крупного рогатого скота. J. Cell Sci. 1983; 62: 267–285.[PubMed] [Google Scholar] 76. Чирино Дж., Фиоруччи С., Сесса WC. Эндотелиальная синтаза оксида азота: Золушка воспаления? Trends Pharmacol. Sci. 2003. 24: 91–95. [PubMed] [Google Scholar] 77. Neumann P, Gertzberg N, Vaughan E, Weisbrot J, Woodburn R, Lambert W., Johnson A. Пероксинитрит опосредует TNF-альфа-индуцированную дисфункцию эндотелиального барьера и нитрование актина. Являюсь. J. Physiol. Легочная клетка. Мол. Physiol. 2006; 290: L674 – L684. [PubMed] [Google Scholar] 78. Ву Ф, Уилсон Дж. Пероксинитрат-зависимая активация протеинфосфатазы типа 2A опосредует дисфункцию эндотелиального барьера микрососудов.Кардиоваск. Res. 2009; 81: 38–45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Холленберг С.М., Гульельми М., Паррилло Дж. Э. Несоответствие между проницаемостью микрососудов и динамикой лейкоцитов у мышей с септическим iNOS-дефицитом. Крит. Забота. 2007; 11: R125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Кирш М., де Гроот Х. Аскорбат — мощный антиоксидант против реакций окисления, вызванных пероксинитритом. Доказательства того, что аскорбат действует путем повторного восстановления радикалов субстрата, продуцируемых пероксинитритом. J. Biol.Chem. 2000; 275: 16702–16708. [PubMed] [Google Scholar] 81. Шен КП, Лиу С.Ф., Се С.Л., Чен И.Дж., Ву Б.Н. Эугеноседин-А — усиление индуцированной липополисахаридом активации p38 MAPK, индуцибельной синтазы оксида азота и циклооксигеназы-2. J. Pharm. Pharmacol. 2007; 59: 879–889. [PubMed] [Google Scholar] 82. Ферлитч А., Плейнер Дж., Миттермайер Ф., Шаллер Дж., Хомончик М., Пек-Радосавлевич М., Вольцт М. Сосудосуживающая гипореактивность может быть отменена антиоксидантами у пациентов с запущенным алкогольным циррозом печени и асцитом.Крит. Care Med. 2005; 33: 2028–2033. [PubMed] [Google Scholar] 83. Frein D, Schildknecht S, Bachschmid M, Ullrich V. Редокс-регулирование: новая проблема для фармакологии. Биохим. Pharmacol. 2005; 70: 811–823. [PubMed] [Google Scholar] 84. Киенбаум П., Пранте С., Леманн Н., Сандер А., Ялови А., Петерс Дж. Изменения реактивности сосудов предплечья у пациентов с септическим шоком. Анестезия. 2008. 63: 121–128. [PubMed] [Google Scholar] 85. Хоффер Л.Дж., Левин М., Ассулин С., Мельничук Д., Падаятти С.Дж., Росадюк К., Руссо К., Робитайл Л., Миллер У., Jr. Фаза I клинических испытаний i.v. аскорбиновая кислота при запущенных злокачественных новообразованиях. Анна. Онкол. 2008 в печати. [PubMed] [Google Scholar] 86. Наср Ш., Каштанова Ю., Левчук В., Марковиц Г.С. Вторичный оксалоз из-за избыточного потребления витамина С. Kidney Int. 2006; 70: 1672. [PubMed] [Google Scholar] 87. Мюльхофер А., Мрозек С., Шлегель Б., Троммер В., Розарио Ф., Бёлес Н., Шреммер Д., Золлер В. Г., Бисальски Н. К.. Внутривенное введение высоких доз витамина С не связано с увеличением прооксидантных биомаркеров. Евро. J. Clin. Nutr.2004. 58: 1151–1158. [PubMed] [Google Scholar] 88. Бейли Д.М., Раман С., Макинени Дж., Янг И.С., Пархэм К.Л., Халлин Д.А., Дэвис Б., МакКиман Дж., МакКорд Дж. М., Льюис М. Х. Профилактика витамином С способствует окислительному повреждению липидов во время хирургической ишемии-реперфузии. Свободный Радич. Биол. Med. 2006; 40: 591–600. [PubMed] [Google Scholar]Аскорбат модулирует окислительно-восстановительную передачу сигналов в эндотелии
биофакторов. Авторская рукопись; доступно в PMC 2009 26 октября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2767105
NIHMSID: NIHMS151756
Департамент физических упражнений и питания, Университет в Буффало, Буффало, штат Нью-Йорк, США *
905 905 Адрес для переписки: John X.Уилсон, доктор философии, факультет наук о физических упражнениях и питании, Университет в Буффало, 3435 Main Street, Buffalo, NY, 14214-8028, США Тел .: +716 829 2941; Факс: +716 829 2428. ude.olaffub@nosliwxj. Окончательная отредактированная версия этой статьи издателем доступна на сайте Biofactors. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Уровни циркулирующего витамина С (аскорбата) низкие у пациентов с сепсисом. Парентеральное введение аскорбата повышает концентрацию витамина в плазме и тканях и может снизить заболеваемость.В моделях сепсиса на животных внутривенная инъекция аскорбата увеличивает выживаемость и защищает несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Воздействие парентерального аскорбата на функцию микрососудов быстрое и стойкое. Аскорбат быстро накапливается в эндотелиальных клетках микрососудов, поглощает активные формы кислорода и действует через тетрагидробиоптерин, стимулируя выработку оксида азота эндотелиальной синтазой оксида азота.Основная причина длительного улучшения функции микрососудов заключается в том, что клетки сохраняют высокий уровень аскорбата, который изменяет чувствительные к окислению-восстановлению сигнальные пути, чтобы уменьшить септическую индукцию НАДФН-оксидазы и индуцибельной синтазы оксида азота. Эти наблюдения согласуются с гипотезой о том, что функция микрососудов при сепсисе может быть улучшена парентеральным введением аскорбата в качестве адъювантной терапии.
Ключевые слова: Артериола, аскорбиновая кислота, кровоток, капилляр, воспаление, проницаемость микрососудов, оксид азота, пероксинитрит, тетрагидробиоптерин
1.Введение
Витамин С (аскорбиновая кислота) диссоциирует при физиологическом pH с образованием аскорбата, окислительно-восстановительного состояния витамина, который наиболее часто встречается в клетках [1]. Хорошо известно, что аскорбат физиологически действует как восстановитель и кофактор фермента. Целью настоящего обзора является изучение недавних доказательств того, что аскорбат модулирует внутриклеточные механизмы, которые вызывают дисфункцию микрососудов при критических заболеваниях, таких как сепсис.
Клинический синдром сепсиса — это не единичный гомогенный болезненный процесс, а общий термин для большой группы заболеваний [2].Сепсис может развиться в результате хирургического вмешательства, пневмонии, инфекции мягких тканей, связанной со злокачественными новообразованиями или заболеванием периферических сосудов, или многих других событий. Синдромы сепсиса варьируются от синдрома системного воспалительного ответа до тяжелого сепсиса (острая органная дисфункция, вызванная инфекцией) и септического шока (тяжелый сепсис плюс гипотензия, не купируемая с помощью жидкостной реанимации) [2,3]. Эти синдромы являются основными причинами смерти в отделениях интенсивной терапии во всем мире. Основы лечения включают жидкостную реанимацию для восстановления среднего давления наполнения крови, терапию антибиотиками и контроль источника для устранения инсульта, вызывающего сепсис, вазопрессорную или комбинированную инотропно-вазопрессорную терапию для предотвращения шока, установление гликемического контроля, профилактику тромбоза глубоких вен и профилактика стрессовых язв для предотвращения кровотечений из верхних отделов желудочно-кишечного тракта [3].Тем не менее, несмотря на лучшее медицинское и хирургическое лечение, смертность остается высокой.
При сепсисе пациенты реагируют на целые бактерии, бактериальные продукты, такие как эндотоксин [например, липополисахарид Escherichia coli (LPS)] и внутриклеточные продукты, выделяемые из поврежденных тканей [2]. Ответы включают изменения в функции микрососудов, которые включают: (i) снижение плотности перфузированных капилляров и увеличение доли неперфузированных капилляров; (ii) повышенная проницаемость микрососудов (i.е. потеря барьерной функции), что приводит к образованию отека и гипердемии; и (iii) гипореактивность артериол к вазоконстрикторам и вазодилататорам [4–16]. Если эти изменения произошли только в небольших локализованных областях поврежденной ткани, они могут принести пользу пациенту за счет уменьшения кровотечения из поврежденных кровеносных сосудов, доставки антимикробных медиаторов и фагоцитарных клеток к месту повреждения или предотвращения распространения токсичных веществ [2]. Но широко распространенное системное возникновение этих изменений при сепсисе считается дисфункцией микрососудов, потому что оно приводит к гипоксии тканей, митохондриальной дисфункции и истощению АТФ, что провоцирует органную недостаточность, даже у реанимационных пациентов с адекватным оксигенацией артериальной крови и сердечным выбросом [17]. ].Действительно, микрососудистая дисфункция является важным предиктором смерти, и одна треть пациентов с тяжелым сепсисом умирает от органной недостаточности [10]. Терапевтическая эффективность антибиотиков осложняется увеличением числа инфекций, вызываемых бактериями с множественной лекарственной устойчивостью. Кроме того, патогены, которые уничтожаются антибиотиками, могут выделять большое количество токсичных продуктов (например, ЛПС), которые продолжают травмировать пациента [18]. Таким образом, пациенты с сепсисом могут получить пользу от адъювантной терапии, направленной на микрососудистую дисфункцию.
2. Уровни витамина С у пациентов в критическом состоянии и соответствующие экспериментальные модели
Снижение концентрации аскорбата в плазме и лейкоцитах — обычное явление для тяжелобольных в целом и пациентов с сепсисом в частности [19–25]. Кроме того, аскорбат в плазме обратно коррелирует с полиорганной недостаточностью [19] и напрямую с выживаемостью [21].
Одной из причин истощения аскорбата у госпитализированных критически больных пациентов может быть низкий уровень витамина в растворах для парентерального питания из-за разложения аскорбата и дегидроаскорбиновой кислоты (DHA), которое происходит во время приготовления и хранения [26,27].Другой причиной истощения запасов витамина С является повышенная потребность в аскорбате [22,28]. Количество витамина С, содержащееся в стандартных поливитаминных препаратах для парентерального питания (номинально 200 мг / день), недостаточно для нормализации уровня витамина С в плазме у тяжелобольных пациентов, даже при приеме в течение 7 дней [29]. Основанием для повышенной потребности может быть окисление аскорбата избытком активных форм кислорода (АФК). Действуя как поглотитель ROS и кофактор фермента, аскорбат окисляется до свободного радикала аскорбата, который затем дисмутируется с образованием DHA.
Как показано на фигуре, аскорбат транспортируется в эндотелиальные клетки с помощью специфического натрийзависимого транспортера витамина C 2 (SVCT2), в то время как DHA поглощается посредством вспомогательных транспортеров глюкозы (GLUT) и затем восстанавливается до аскорбата. Отток аскорбата из эндотелиальных клеток может стимулироваться кальций-зависимыми механизмами, но эти клетки обычно сохраняют внутриклеточные концентрации аскорбата, которые намного превышают внеклеточные уровни [1,30–33]. В целом, эти транспортные системы заставляют эндотелиальные клетки быстро накапливать миллимолярные уровни аскорбата, который либо изменяет внутриклеточную функцию, либо регулируемым образом выделяется во внеклеточную жидкость.
Внутриклеточный аскорбат модулирует эффекты септического инсульта на функцию эндотелиальных клеток микрососудов. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Септический инсульт увеличивает активность НАДФН-оксидазы (Nox) и индуцибельной синтазы оксида азота (iNOS), которые повышают уровни активных форм кислорода (АФК) и пероксинитрита (ONOO —). ROS и ONOO — ухудшают капиллярный кровоток, функцию капиллярного барьера и чувствительность артериол к вазоконстрикторам и вазодилататорам.Аскорбат (Asc) и дегидроаскорбиновая кислота (DHA) проникают в клетку через натрийзависимый транспортер витамина C 2 (SVCT2) и транспортер глюкозы 1 (GLUT1), соответственно, и DHA восстанавливается до Asc. Внутриклеточная Asc быстро улавливает ROS и ONOO —, одновременно стимулируя тетрагидробиоптерин (Bh5) -зависимую эндотелиальную синтазу оксида азота (eNOS), увеличивая локальную концентрацию оксида азота (NO). Asc также снижает активность Nox, предотвращает индукцию субъединицы фермента p47phox и блокирует индукцию iNOS.
Воспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-1бета) ингибируют захват аскорбата в культурах эндотелиальных клеток, которые спонтанно экспрессируют SVCT2 [34]. Это действие может истощить внутриклеточный аскорбат из эндотелия во время сепсиса. Вторая причина, по которой внутриклеточный аскорбат может истощаться, — это плохой контроль уровня глюкозы в плазме, что приводит к эпизодам гипергликемии у пациентов с сепсисом [3]. Острая гипергликемия вызывает дефицит аскорбата в эндотелиальных клетках и нарушает эндотелий-зависимую вазодилатацию у здоровых людей [35].Эти эффекты являются следствием конкурентного ингибирования глюкозой захвата ДГК эндотелиальными клетками, поскольку нарушение вазодилатации может быть отменено внутривенным введением аскорбата (2 г болюса [ссылка 36]; инфузия 3 мг / мин [ссылка 37]). Третьей потенциальной причиной внутриклеточного истощения аскорбата является то, что чрезмерное количество АФК может окислять аскорбат до DHA, а затем необратимо окислять последний.
ЛПС повышает концентрацию аскорбата в надпочечниках, сердце, почках и печени [38]. Этот феномен, по-видимому, не требует SVCT2, потому что нет взаимодействия между эффектами LPS и дефицита SVCT2 (SVCT2 +/– гетерозиготные мыши) на концентрацию аскорбата в этих органах [38].В большинстве типов клеток, которые были изучены, поглощение и восстановление внеклеточной DHA до аскорбата не нарушается LPS. Напротив, доноры LPS и оксида азота повышают экспрессию GLUT1 в культурах эндотелиальных клеток [39,40]. Септические инсульты ускоряют скорость поглощения внеклеточной DHA и восстановления ее до аскорбата во многих типах клеток [38,41] (хотя и не во всех, поскольку септический инсульт подавляет поглощение DHA в культивируемых астроцитах [42]).
Эндотелиальные клетки отвечают на ЛПС повышенной экспрессией глюкозо-6-фосфатдегидрогеназы, ключевого фермента пентозного цикла (гексозо-монофосфатный шунт), продуцирующего НАДФН [43].Индукция LPS глюкозо-6-фосфатдегидрогеназы может увеличить поступление восстанавливающих эквивалентов НАДФН для превращения DHA в аскорбат.
В областях тканей с неперфузированными капиллярами гипоксия может подавлять пролилгидроксилазу (PHD) индуцируемого гипоксией фактора (HIF) и, следовательно, увеличивать экспрессию HIF (). HIF-1 увеличивает экспрессию транспортеров GLUT1 и GLUT3, гликолитических ферментов и нескольких генов, участвующих в воспалении [44,45]. Гипоксия стимулирует поглощение DHA через GLUT1 [46].Повышенная восстанавливающая способность, связанная с гипоксией, может затем увеличить способность восстановления DHA к аскорбату внутри клеток.
Внутриклеточный аскорбат (Asc) модулирует окислительно-восстановительные сигнальные пути в эндотелиальных клетках микрососудов во время сепсиса. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Липополисахарид (LPS) и цитокины, такие как интерферон-гамма (IFNgamma), стимулируют сигнальные пути, которые запускают экспрессию субъединицы p47phox НАДФН-оксидазы (Nox), индуцибельной синтазы оксида азота (iNOS) и других медиаторов воспаления.Гипоксия увеличивает индуцируемый гипоксией фактор 1 (HIF-1) за счет ингибирования пролилгидроксилазы HIF-1 (PHD) и тем самым индуцирует экспрессию генов, связанных с сепсисом. Asc ингибирует активацию пути Jak2-Stat1-IRF1 и увеличивает активность PHD. Asc дополнительно регулирует локальную концентрацию оксида азота (NO), поглощая супероксид (O2⋅–) и пероксинитрит (ONOO — ). ИКК; NFκB. Аскорбат не влияет на киназу IKB (IKK) и ядерный фактор-κB, которые также опосредуют индукцию iNos в эндотелиальных клетках микрососудов, подвергнутых воздействию LPS и IFN гамма.
3. Клинические испытания витамина С у пациентов в критическом состоянии
Как подробно описано ниже, сепсис связан с повышенным образованием АФК и пероксинитрита, которые истощают молекулы антиоксидантов и окисляют белки и липиды. АФК также изменяют окислительно-восстановительную активацию и экспрессию белков, которые изменяют распределение капиллярного кровотока, проницаемость капилляров (то есть функцию капиллярного барьера) и чувствительность артериол к вазоконстрикторам и вазодилататорам (и). Следовательно, пациентам с сепсисом может быть полезна адъювантная терапия, которая предотвращает повышение ROS, особенно на участках внутриклеточной передачи сигналов.Парентеральное введение аскорбата может быть вмешательством, которое дает это преимущество.
Парентеральное, а не пероральное введение аскорбата увеличивает его влияние на концентрацию аскорбата в плазме и функцию микрососудов [1]. Например, при сравнении перорального и внутривенного пути введения аскорбата (500 мг / день в течение 30 дней) у мужчин, ведущих малоподвижный образ жизни, только внутривенное введение аскорбата улучшает эндотелий-зависимую функцию артериол, на что указывает вазодилатация, опосредованная потоком [47].
Парентеральное введение аскорбата может снизить заболеваемость и смертность у тяжелобольных пациентов с сепсисом или с риском сепсиса.В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 216 пациентов в критическом состоянии 28-дневная смертность была снижена у пациентов, получавших комбинацию аскорбата и витамина Е внутривенно, по сравнению с теми, кто этого не делал [48]. Второе рандомизированное исследование с 595 тяжелобольными хирургическими пациентами показало, что комбинация аскорбата (1000 мг каждые 8 часов путем внутривенной инъекции) и витамина E (1000 МЕ каждые 8 часов через назо- или орогастральный зонд), начавшаяся в течение 24 часов после травмы или серьезного хирургического вмешательства, снижение относительного риска отека легких и полиорганной недостаточности [49].Эти два испытания не были разработаны для того, чтобы различать действие аскорбата и витамина Е. Однако третье рандомизированное испытание выявило снижение заболеваемости у пациентов с тяжелыми ожогами, получавших очень высокую дозу аскорбата (1584 мг / кг / день) парентерально [50] . Лечение аскорбатом, имеющее особое значение для барьерной функции микрососудов, было связано со значительным снижением образования отеков, объема жидкой реанимации и респираторной дисфункции [50].
4. Влияние витамина С на выживаемость при экспериментальном сепсисе
Животные модели синдромов сепсиса предоставляют фундаментальную информацию о потенциальной пользе и механизме действия аскорбата.Предыдущее истощение запасов аскорбата снижает выживаемость мышей, которым вводили патогенные бактерии [51]. Соответственно, парентеральное введение аскорбата предотвращает гипотонию и отек у животных, которым вводили ЛПС [5,6,11], и улучшает капиллярный кровоток, чувствительность артериол, артериальное кровяное давление, функцию печени и выживаемость при экспериментальном сепсисе [4,12–15] , 52].
Среди наиболее клинически значимых моделей полимикробного сепсиса — перевязка и пункция слепой кишки (CLP) и инъекция фекалий в брюшину (FIP).Подобно изменениям, наблюдаемым у пациентов с сепсисом, CLP у животных увеличивает маркеры окислительного стресса и снижает концентрацию аскорбата в плазме и тканях [4,12,14]. Введение аскорбата (200 мг / кг, в / в) увеличивает выживаемость мышей CLP [15]. Показатели выживаемости через 24 часа после CLP составляют 9% и 65% у мышей, которым вводили носитель и вводили аскорбат, соответственно. Защитный эффект не связан с ингибированием репликации бактерий в инфекционном очаге, поскольку количество бактериальных колониеобразующих единиц в жидкости перитонеального лаважа после CLP не различается у мышей, которым вводили носитель и аскорбат [15].У мышей с FIP 24-часовая выживаемость составляет 19% после инъекции физиологического раствора носителя, но 50% после внутривенной инъекции аскорбата (10 мг / кг, в / в) [13].
5. Дефицит капиллярной перфузии
5.1. Быстрый ответ на аскорбат
Внутривенная инъекция аскорбата может защитить несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Внутривенная инъекция аскорбата предотвращает и обращает вспять неравномерное распределение кровотока в капиллярах септических моделей.Эффект парентерального аскорбата быстрый и стойкий. В этом разделе обсуждаются механизмы, лежащие в основе реакции на аскорбат.
Системное воспаление вызывает остановку кровотока в некоторых капиллярах. При клиническом сепсисе характер распределения капиллярного кровотока улучшается у выживших, но не улучшается у тех, кто не выжил [10]. Улучшение капиллярного кровотока во время жидкостной реанимации связано с предотвращением органной недостаточности независимо от изменений общей гемодинамики [53].Подобно клиническому сепсису, CLP и FIP уменьшают плотность перфузируемых капилляров и увеличивают долю неперфузированных капилляров в скелетных мышцах мышей и крыс, несмотря на введение жидкости для объемной реанимации, чтобы предотвратить шок [4,12,13].
У тяжелобольных пациентов вазодилататоры временно увеличивают долю перфузируемых капилляров [54]. Неизвестно, происходит ли расширение сосудов под действием аскорбата и является ли оно прямой причиной восстановления капиллярного кровотока при клиническом сепсисе.Однако увеличения скорости потока (измеряемой как скорость эритроцитов) в капиллярах не обнаруживается после инъекции аскорбата, который восстанавливает количество перфузируемых капилляров до нормального в скелетных мышцах мышей с сепсисом [13]. Таким образом, экспериментальные исследования сепсиса свидетельствуют о том, что восстановление капиллярного кровотока не достигается за счет сосудорасширяющего действия аскорбата. Вместо этого причиной остановки кровотока в некоторых капиллярах может быть дефицит оксида азота в эндотелиальных клетках и тромбоцитах.Действительно, оксид азота, по-видимому, необходим для сохранения проходимости микрососудов, а местное применение донора оксида азота восстанавливает капиллярный кровоток до нормального у мышей с сепсисом (6 часов после FIP) [13].
Снижение доступности оксида азота внутри септических эндотелиальных клеток и тромбоцитов может быть связано с АФК. Септический инсульт увеличивает активность НАДФН-оксидаз, которые синтезируют АФК в кровеносных сосудах и культурах эндотелиальных клеток микрососудов [16,33,55]. Действительно, активность НАДФН-оксидазы является основным источником стимулирования продукции супероксида в эндотелиальных клетках микрососудов, инкубированных с септическим инсультом (комбинация ЛПС и гамма-интерферона [ИФН-гамма]; ЛПС + ИФН-гамма) [33,55].Ускоренное производство супероксида выявляется в течение 2 часов после первоначального воздействия на клетки LPS + IFNgamma [33]. АФК, производные НАДФН-оксидазы, нарушают капиллярный кровоток во время сепсиса, поскольку либо нокаутации субъединицы gp91phox (Nox2) НАДФН-оксидазы, либо фармакологического ингибирования фермента достаточно для коррекции неправильного распределения кровотока, вызванного FIP у мышей [13]. АФК окисляют тетрагидробиоптерин, который в восстановленной форме является кофактором ферментативного синтеза оксида азота.Потеря тетрагидробиоптерина (из-за его окисления) разъединяет эндотелиальную синтазу оксида азота (eNOS) в эндотелиальных клетках и тромбоцитах, так что этот фермент синтезирует супероксид, а не оксид азота [56]. Местное применение тетрагидробиоптерина восстанавливает капиллярный кровоток во время сепсиса у мышей дикого типа, но не у мышей eNOS — / — [13]. Эти наблюдения подтверждают гипотезу о том, что тетрагидробиоптерин стимулирует активность eNOS для увеличения продукции оксида азота и, таким образом, меняет неравномерное распределение капиллярного кровотока при сепсисе.
По сравнению с инъекцией носителя, болюсное внутривенное введение аскорбата через 0, 1, 6 или 24 ч после начала септического инсульта улучшает распределение капиллярного кровотока в скелетных мышцах крыс CLP [4,12]. Например, инъекция аскорбата (10 мг / кг) через 6 часов после начала септического инсульта устраняет неравномерное распределение кровотока в течение 10 минут [13]. Быстрое улучшение распределения кровотока аскорбатом во время сепсиса зависит от eNOS, потому что это происходит у мышей с нокаутом нейрональной синтазы оксида азота дикого типа (nNOS — / — ) и индуцибельной синтазы оксида азота (iNOS — / — ), но отсутствует у мышей eNOS — / — [13].Стимулирующее действие аскорбата на уровни оксида азота в эндотелиальных клетках связано с несколькими механизмами. Во-первых, как показано на фиг.4, аскорбат предотвращает и обращает вспять окисление тетрагидробиоптерина, увеличивает содержание тетрагидробиоптерина и повышает тетрагидробиоптерин-зависимый синтез оксида азота с помощью eNOS, что является действиями, которые N -ацетилцистеин не может выполнять [7,57,58]. Во-вторых, аскорбат улавливает супероксид и другие АФК, которые в противном случае реагируют с оксидом азота [55] ().
Остановка кровотока в септических капиллярах может быть результатом взаимодействия между лейкоцитами, тромбоцитами и эндотелиальными клетками капилляров.АФК активируют внутриклеточные окислительно-восстановительные сигнальные пути для увеличения адгезии лейкоцитов и тромбоцитов к эндотелию [59]. В соответствии с этим фактом адгезия тромбоцитов стимулируется и ингибируется, соответственно, локально генерируемым супероксидом и оксидом азота во время экспериментального сепсиса [59]. АФК, происходящие из эндотелия и тромбоцитов, также усиливают агрегацию тромбоцитов [60]. Возможно, что образование тромбов в микрососудах после адгезии и агрегации тромбоцитов может способствовать остановке кровотока во время системного воспаления.Внутривенное введение 2 г аскорбата усиливает ингибирование агрегации тромбоцитов донором оксида азота у пациентов, протромботических из-за хронической сердечной недостаточности [61]. Механизм, лежащий в основе этого эффекта на клеточную адгезию, может включать ингибирование аскорбатом экспрессии и активации НАДФН-оксидазы, тем самым предотвращая локальный дефицит оксида азота [13,33]. Кажется вероятным, что аскорбат оказывает аналогичное антиагрегационное действие у пациентов с протромботическими заболеваниями из-за сепсиса.
5.2. Устойчивый ответ на аскорбат
Дефицит капиллярной перфузии при экспериментальном сепсисе можно уменьшить в течение как минимум 12 и 47 часов с помощью доз аскорбата 10 и 76 мг / кг соответственно [4,12,13]. Таким образом, микрососудистые эффекты парентерального аскорбата сохраняются в течение многих часов после того, как аскорбат в плазме возвращается к исходному уровню [13]. Одна из причин большой продолжительности этого эффекта заключается в том, что клетки сохраняют высокие концентрации внутриклеточного аскорбата, которые сохраняются дольше, чем внеклеточный аскорбат [33].Вторая причина того, что микрососудистая реакция на аскорбат сохраняется, заключается в том, что витамин изменяет экспрессию генов, как будет обсуждаться позже.
Клетки, поддерживаемые в стандартных условиях культивирования, часто не содержат аскорбата, потому что аскорбат и DHA либо не попадают в среду, либо случайно разрушаются во время приготовления и хранения культуральных сред и сывороток. В эндотелиальных клетках микрососудов, не содержащих аскорбат, ЛПС + ИНФ-гамма быстро увеличивает активность НАДФН-оксидазы [33,55]. Эндотелиальная НАДФН-оксидаза синтезирует внутриклеточный супероксид, который реагирует с образованием других АФК (например,g., дисмутация супероксида производит перекись водорода), которая затем вызывает пролонгированные окислительно-восстановительные сигнальные эффекты [62]. Либо LPS + INF-gamma, либо экзогенная перекись водорода стимулирует передачу сигналов Jak2 / Stat1 / IRF1 и увеличивает экспрессию белков субъединицы NADPH-оксидазы [33,55]. Таким образом, септический инсульт запускает механизм прямой связи для увеличения продукции АФК, производных НАДФН-оксидазы. Инкубация эндотелиальных клеток микрососудов с аскорбатом повышает внутриклеточную концентрацию аскорбата и предотвращает индукцию LPS + IFN-гамма или перекисью водорода активности эндотелиальной НАДФН-оксидазы [33].Аскорбат также подавляет индукцию субъединицы фермента p47phox [33]. Последний эффект опосредуется сигнальным путем Jak2 / Stat1 / IRF1, поскольку аскорбат предотвращает активацию этого пути LPS + IFNgamma или перекисью водорода [33] (). Селективность демонстрируется тем фактом, что аскорбат подавляет синтез супероксида НАДФН-оксидазой в эндотелиальных клетках [33], но не в лейкоцитах нейтрофилов [63–66].
Продолжительный эффект аскорбата на функцию микрососудов может также включать подавление экспрессии генов, которая зависит от HIF-1 ().Аскорбат действует через кофактор PHD, железо, увеличивая активность фермента и тем самым подавляя индукцию и стабилизацию HIF-1альфа при гипоксии [44]. Кроме того, ингибирование аскорбатом эндотелиальной НАДФН-оксидазы [33] и поглощение окислителей аскорбатом может сохранять активность PHD. Это связано с тем, что оксиданты, такие как производные НАДФН-оксидазы АФК, ингибируют активность PHD [67]. Снижение уровней HIF-1 аскорбатом подавляет экспрессию чувствительных к HIF-1 генов, таких как GLUT1 и iNOS [14,15,45,55].
Активация коагуляции во время сепсиса — еще одна потенциальная причина нарушения капиллярного кровотока, которое может постепенно модулироваться аскорбатом. АФК способствуют экспрессии молекул адгезии и тканевых факторов на поверхности тромбоцитов и эндотелиальных клеток [60]. Последующее образование тканевых факторов и комплекса фактора VII приводит к образованию тромбина, который активирует НАДФН-оксидазу. Этот механизм положительной обратной связи может стимулировать образование микротромбов [60], и его отмена может быть важным механизмом, с помощью которого улучшение распределения кровотока аскорбатом сохраняется достаточно долго для увеличения выживаемости.Инъекция ингибитора пути тканевого фактора увеличивает выживаемость в модели сепсиса CLP [68], что является эффектом, аналогичным эффекту, достигаемому при инъекции аскорбата [15].
Другая потенциальная роль аскорбата предполагает наблюдение, что супероксид стимулирует экспрессию молекулы 1 межклеточной адгезии на клеточной поверхности (ICAM-1) в эндотелиальных клетках микрососудов [62]. ICAM-1 опосредует адгезию лейкоцитов к эндотелию и может тем самым нарушать микроциркуляцию. Поскольку аскорбат подавляет выработку супероксида в эндотелиальных клетках микрососудов, подвергшихся септическому инсульту [33], необходимы дальнейшие исследования, чтобы определить, предотвращает ли витамин закупорку микрососудов лейкоцитами.
6. Витамин С и увеличение проницаемости эндотелия при сепсисе
Повышенная проницаемость эндотелия во многих органах происходит во время сепсиса, что приводит к экстравазации плазмы и образованию отеков. Это вызывает респираторную дисфункцию, уменьшение объема крови и прогрессирование заболевания до септического шока. Парентеральное введение аскорбата снижает образование отеков у пациентов с тяжелой ожоговой травмой [50], а также у получивших ожоговую травму или животных, которым вводили ЛПС [5,69,70]. Аскорбат также ослабляет увеличение проницаемости эндотелия, вызванное LPS in vitro [71].
Одной из причин потери барьерной функции при сепсисе может быть апоптоз эндотелиальных клеток [2]. Следовательно, роль аскорбата как в предотвращении апоптоза в эндотелиальных клетках, так и в стимуляции их пролиферации может быть полезной [72–75].
Другое действие аскорбата на проницаемость эндотелия может включать оксид азота, супероксид и пероксинитрит. Производство базального оксида азота с помощью eNOS необходимо для поддержания функции эндотелиального барьера (т.е. для поддержания параклеточной проницаемости эндотелия на низком уровне для белков плазмы) [76].Защитный эффект оксида азота снижается во время воспалительной реакции из-за одновременного образования супероксида. Оксид азота реагирует с супероксидом с образованием пероксинитрита, который вызывает перекисное окисление липидов, окисление сульфгидрильных групп и нитрование остатков тирозина в белках. В частности, нитрование протеинфосфатазы типа 2 и белков цитоскелета пероксинитритом, по-видимому, является ключевым этапом в развитии дисфункции микрососудистого барьера [77,78]. Основными источниками супероксида, вероятно, являются эндотелиальная НАДФН-оксидаза и несвязанные eNOS и iNOS.Доказательством роли iNOS является то, что генетические или фармакологические вмешательства, которые ингибируют этот фермент, также уменьшают утечку микрососудов при экспериментальном сепсисе [79]. Улавливая супероксид, подавляя экспрессию белка p47phox и iNOS и предотвращая синтез супероксида несвязанными eNOS и iNOS, аскорбат снижает образование пероксинитрита. Кроме того, аскорбат восстанавливает продукты окисления, образующиеся при реакции пероксинитрита с клеточными белками [80]. Эти действия аскорбата могут объяснить его эффективность в предотвращении отеков у тяжелобольных пациентов и экспериментальных моделей [5,50,69,71].
Выяснен механизм, лежащий в основе септической индукции iNOS и его отмены аскорбатом. Окислители, которые возникают из-за активности НАДФН-оксидазы (например, перекись водорода, образующаяся при дисмутации супероксида), усиливают индукцию iNOS в септических кровеносных сосудах и эндотелиальных клетках [15,33,77]. iNOS синтезирует большое количество оксида азота, который, в свою очередь, вступает в реакцию с супероксидом, что приводит к чрезмерному производству пероксинитрита. Аскорбат предотвращает индукцию iNOS при септических поражениях кровеносных сосудов in vivo и эндотелиальных клеток в культуре [14,15,81].Подавление аскорбатом НАДФН-оксидазы опосредует, по крайней мере частично, это подавление экспрессии iNOS [55]. При стимуляции LPS + IFNgamma НАДФН-оксидаза продуцирует АФК, которые активируют сигнальные пути JNK-AP1 и Jak2-IRF1 индукции iNOS, а аскорбат предотвращает эту активацию [55].
7. Гипореактивность артериол к вазоконстрикторам
Гипотензия у пациентов с сепсисом может быть вызвана нарушением функции миокарда и потерей чувствительности артериол к вазоконстрикторам.Парентеральное введение аскорбата может решить последнюю проблему, поскольку инфузия аскорбата меняет гипореактивность артериол к вазоконстрикторам (норэпинефрин, ангиотензин, вазопрессин) у людей, страдающих воспалительным заболеванием или получавших инъекции ЛПС [9,82].
Сопоставимые результаты были получены на животных моделях сепсиса. Например, повышенная неоднородность капиллярного кровотока сопровождается развитием артериальной гипотензии у крыс CLP [12]. Вазоконстрикция артериол и реакции артериального давления на норэпинефрин и ангиотензин II подавляются у мышей через 6 часов после CLP [14,15].Внутривенное введение аскорбата и дефицит гена iNOS (мыши iNOS — / — ) одинаково эффективны для предотвращения CLP-индуцированного нарушения реактивности артериол [13-15]. Чувствительность артериол и артериальное кровяное давление выше у крыс CLP, которым внутривенно вводили аскорбат, по сравнению с крысами, которым вводили носитель, когда эти параметры измеряли через 18–24 ч после инъекции [4,12].
8. Гипореактивность артериол к вазодилататорам
Эндотелиальные клетки регулируют чувствительность артериол к вазодилататорам посредством оксида азота, производного от eNOS, и простациклина, производного от эндопероксида h3-синтазы-1 (PGHS) [83].Оксид азота проникает в гладкомышечные клетки артериол и активирует растворимую гуанилилциклазу, тем самым повышая внутриклеточный цГМФ. Простациклин стимулирует аденилатциклазу к повышению внутриклеточного цАМФ. И цГМФ, и цАМФ затем опосредуют расслабление гладких мышц. Однако септический инсульт увеличивает выработку супероксида, который реагирует с оксидом азота с образованием пероксинитрита, который инактивирует эндотелиальный PGHS, который больше не может синтезировать простациклин. Супероксид и другие окислители, производные НАДФН-оксидазы (т.например, перекись водорода и пероксинитрит) также могут снижать эффективный клеточный уровень оксида азота ниже уровня, необходимого для активации гуанилилциклазы [83]. Таким образом, чувствительность артериол к вазодилататорам подавляется инфузией LPS у людей и CLP-индуцированным сепсисом у животных [7,8,16].
Инфузия аскорбата или тетрагидробиоптерина предотвращает ингибирование LPS зависимых от эндотелия вазодилатационных реакций (оцениваемых как изменения кровотока в предплечьях) на ацетилхолин у здоровых людей [7,8].Этот эффект аскорбата связан с резким увеличением концентрации тетрагидробиоптерина в плазме [7]. Аскорбат может поддерживать нормальные уровни оксида азота, полученного из eNOS, и простациклина, производного PGHS, путем подавления экспрессии НАДФН-оксидазы, удаления ROS и повышения уровней тетрагидробиоптерина в эндотелиальных клетках артериол.
Парентеральный аскорбат заметно увеличивает чувствительность артериол к вазодилататорам при некоторых заболеваниях. Например, при внутриартериальном введении N -ацетилцистеина (48 мг / мин) или аскорбата (18 мг / мин) людям с эссенциальной гипертензией только лечение аскорбатом усиливает вазодилатацию ацетилхолином [58].В последнее время тема реакции на вазодилататоры при клиническом сепсисе стала дискуссионной. Kienbaum et al. [84] сообщили, что вызванное ацетилхолином снижение сосудистого сопротивления предплечья (кровоток в предплечье / среднее артериальное давление) не различается между пациентами с сепсисом и контрольной группой. Однако, поскольку пациенты с сепсисом изначально имели более низкое сосудистое сопротивление, снижение сосудистого сопротивления, вызванное инфузией ацетилхолина, могло быть меньше у этих пациентов. При исследовании здоровых людей до и во время экспериментальной эндотоксемии гипореактивность артериол к ацетилхолину была обнаружена через 4-6 часов после введения ЛПС, в то время, когда циркулирующие цитокины находятся на самом высоком уровне [8].Следовательно, гипореактивность артериол, чувствительных к аскорбатам, к вазодилататорам может варьироваться в зависимости от времени или тяжести заболевания во время прогрессирования синдрома сепсиса.
9. Нерешенные вопросы, заслуживающие дальнейшего изучения
Нет исследований, сравнивающих эффективность аскорбата и DHA при лечении сепсиса. Максимальные скорости поглощения DHA выше, чем аскорбата, в большинстве типов клеток млекопитающих при исследовании в условиях отсутствия глюкозы [1]. Но глюкоза подавляет поглощение DHA большинством клеток, включая эндотелиальные клетки [35], а гипергликемия, которая часто возникает при сепсисе [3], может снизить клеточное поглощение и терапевтическую эффективность вводимой DHA.
Безопасность парентерального аскорбата требует дальнейшего изучения. Исследование внутривенного введения аскорбата у пациентов с запущенными злокачественными новообразованиями показало, что инъекции 1,5 г аскорбата на кг массы тела три раза в неделю хорошо переносятся [85]. Однако аскорбат метаболизируется до оксалата, который накапливается в виде нефротоксичных кристаллов оксалата кальция (нефролитиаз) в почках восприимчивых людей, как сообщается в недавнем исследовании [86]. Другая проблема заключается в том, что аскорбат отдает электроны переходным металлам (например,ж., железо), которые затем катализируют синтез перекиси водорода. Повторные внутривенные инъекции аскорбата 750–7 500 мг / сут в течение 6 дней не вызывают прооксидантных изменений в плазме у здоровых добровольцев [87]. Но у хирургических пациентов внутривенная инъекция 2 г аскорбата за 2 часа до серьезной операции увеличивает окислительную модификацию липидов плазмы в образцах венозной крови, полученных во время ишемической фазы операции [88].
10. Заключение
Для окончательного определения безопасности и эффективности аскорбата у пациентов с сепсисом необходимы дальнейшие исследования.Тем не менее, имеющиеся данные подтверждают гипотезу о том, что функция микрососудов может быть улучшена при сепсисе парентеральным введением аскорбата в качестве адъювантной терапии.
Благодарность
Эта работа финансировалась грантом 1R01AT003643-01A2 Национальных институтов здравоохранения.
Ссылки
1. Wilson JX. Регулирование транспорта витамина С. Анну. Rev. Nutr. 2005. 25: 105–125. [PubMed] [Google Scholar] 2. Маршалл Дж. Сепсис: переосмысление подхода к клиническим исследованиям.J. Leukoc. Биол. 2008; 83: 471–482. [PubMed] [Google Scholar] 3. Деллинджер Р.П., Леви М.М., Карлет Дж. М., Бион Дж., Паркер М. М., Яешке Р., Рейнхарт К., Ангус Д. К., Брун-Бюиссон С., Бил Р., Каландра Т., Дайно Дж. Ф., Герлах Х., Харви М., Марини Дж. Дж., Маршалл Дж., Раньери М., Рамзи Дж., Севрански Дж., Томпсон Б.Т., Таунсенд С., Вендер Дж. С., Циммерман Дж. Л., Винсент Дж. Л., Международный комитет по руководящим принципам кампании против сепсиса. Американская ассоциация медсестер интенсивной терапии. Американский колледж грудных врачей. Американский колледж врачей скорой помощи.Канадское общество интенсивной терапии. Европейское общество клинической микробиологии и инфекционных болезней. Европейское общество интенсивной терапии. Европейское респираторное общество. Международный форум по сепсису. Японская ассоциация острой медицины. Японское общество интенсивной медицины. Общество интенсивной терапии. Общество госпитальной медицины. Общество хирургической инфекции. Кампания Всемирной федерации обществ интенсивной терапии и реанимации по переживанию сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2008 г.Крит. Care Med. 2008. 36: 296–327. [PubMed] [Google Scholar] 4. Броня Дж, Таймл К, Лидингтон Д., Уилсон Дж. Аскорбат предотвращает дисфункцию микрососудов в скелетных мышцах крысы с сепсисом. J. Appl. Physiol. 2001; 90: 795–803. [PubMed] [Google Scholar] 5. Dwenger A, Pape HC, Bantel C, Schweitzer G, Krumm K, Grotz M, Lueken B, Funck M, Regel G. Аскорбиновая кислота снижает повреждение легких, вызванное эндотоксином, у бодрствующих овец. Евро. J. Clin. Инвестировать. 1994; 24: 229–235. [PubMed] [Google Scholar] 6. Фэн Н.Х., Чу С.Дж., Ван Д, Сюй К., Линь СН, Линь Х.И.Влияние различных антиоксидантов на вызванное эндотоксином повреждение легких и экспрессию генов: экспрессия мРНК MnSOD, интерлейкина-1бета и iNOS. Подбородок. J. Physiol. 2004. 47: 111–120. [PubMed] [Google Scholar] 7. Mittermayer F, Pleiner J, Schaller G, Zorn S, Namiranian K, Kapiotis S, Bartel G, Wolfrum M, Brugel M, Thiery J, Macallister RJ, Wolzt M. Тетрагидробиоптерин корректирует эндотоксиновую дисфункцию, вызванную Escherichia coli. Являюсь. J. Physiol. Heart Circ. Physiol. 2005; 289: h2752 – h2757. [PubMed] [Google Scholar] 8.Плейнер Дж., Миттермайер Ф., Шаллер Дж., Макаллистер Р. Дж., Вольц М. Высокие дозы витамина С обращают Escherichia coli эндотоксин-индуцированную гипореактивность к ацетилхолину в предплечье человека. Тираж. 2002; 106: 1460–1464. [PubMed] [Google Scholar] 9. Плейнер Дж., Миттермайер Ф., Шаллер Дж., Марсик С., МакАллистер Р. Дж., Вольц М. Вызванная воспалением гипореактивность сосудосуживающих средств вызвана окислительным стрессом. Варенье. Coll. Кардиол. 2003. 42: 1656–1662. [PubMed] [Google Scholar] 10. Сакр Й., Дюбуа М.Дж., Де Бакер Д., Кретер Дж., Винсент Дж.Л.Стойкие нарушения микроциркуляции связаны с органной недостаточностью и смертью пациентов с септическим шоком. Крит. Care Med. 2004. 32: 1825–1831. [PubMed] [Google Scholar] 11. Шен КП, Ло Ю.К., Ян Р.С., Лю Х.В., Чен И.Дж., Ву Б.Н. Антиоксидант эвгеноседин-A защищает от липополисахаридной гипотензии, гипергликемии и иммунореактивности цитокинов у крыс и мышей. J. Pharm. Pharmacol. 2005. 57: 117–125. [PubMed] [Google Scholar] 12. Тимл К., Ли Ф, Уилсон Дж. Отсроченный болюс аскорбата защищает от неправильного распределения микрососудистого кровотока в септических скелетных мышцах крыс.Крит. Care Med. 2005; 33: 1823–1828. [PubMed] [Google Scholar] 13. Тимл К., Ли Ф, Уилсон Дж. Септическое нарушение капиллярного кровотока требует никотинамидадениндинуклеотидфосфатоксидазы, но не синтазы оксида азота, и быстро устраняется аскорбатом через эндотелиальный механизм, зависимый от синтазы оксида азота. Крит. Care Med. 2008. 36: 2355–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Wu F, Wilson JX, Tyml K. Аскорбат подавляет экспрессию iNOS и сохраняет сосудосуживающую способность в скелетных мышцах мышей с сепсисом.Являюсь. J. Physiol. Regul. Интегр. Комп. Physiol. 2003; 285: R50 – R56. [PubMed] [Google Scholar] 15. Wu F, Wilson JX, Tyml K. Аскорбат защищает от нарушения сужения артериол при сепсисе, ингибируя экспрессию индуцибельной синтазы оксида азота. Свободный Радич. Биол. Med. 2004. 37: 1282–1289. [PubMed] [Google Scholar] 16. Ю ХП, Луи П.В., Хван Т.Л., Йен Ч., Лау Ю.Т. Пропофол улучшает эндотелиальную дисфункцию и снижает выработку супероксида в сосудах у крыс с сепсисом. Крит. Care Med. 2006; 34: 453–460. [PubMed] [Google Scholar] 17.Карре Дж. Э., Сингер М. Энергетический метаболизм клеток при сепсисе: необходимость системного подхода. Биохим. Биофиз. Acta. 2008; 1777: 763–771. [PubMed] [Google Scholar] 18. Holzheimer RG. Высвобождение эндотоксина, индуцированное антибиотиками, и клинический сепсис: обзор. J. Chemother. 2001; 13: 159–172. [PubMed] [Google Scholar] 19. Боррелли Э., Ру-Ломбард П., Грау Дж. Э., Жирардин Э., Рику Б., Дайер Дж., Сутер П. М.. Концентрация цитокинов, их растворимых рецепторов и витаминов-антиоксидантов в плазме может предсказать развитие полиорганной недостаточности у пациентов из группы риска.Крит. Care Med. 1996; 24: 392–397. [PubMed] [Google Scholar] 20. Doise JM, Aho LS, Quenot JP, Guilland JC, Zeller M, Vergely C, Aube H, Blettery B, Rochette L. Антиоксидантный статус плазмы у пациентов с сепсисом в критическом состоянии: снижение с течением времени. Fundam. Clin. Pharmacol. 2008; 22: 203–209. [PubMed] [Google Scholar] 21. Галлей Х.Ф., Дэвис М.Дж., Вебстер Н.Р. Образование аскорбильных радикалов у пациентов с сепсисом: эффект нагрузки аскорбатом. Свободный Радич. Биол. Med. 1996. 20: 139–143. [PubMed] [Google Scholar] 22. Лонг CL, Молл К.И., Кришнан Р.С., Лоус Х.Л., Гейгер Дж. У., Боргези Л., Фрэнкс В., Лоусон Т.С., Зауберлих Х.Динамика аскорбиновой кислоты у тяжелобольных и раненых. J. Surg. Res. 2003. 109: 144–148. [PubMed] [Google Scholar] 23. Метниц П.Г., Бартенс С., Фишер М., Фридрих П., Стельцер Н., Драмл В. Антиоксидантный статус у пациентов с острым респираторным дистресс-синдромом. Intensive Care Med. 1999. 25: 180–185. [PubMed] [Google Scholar] 24. Rumelin A, Humbert T, Luhker O, Drescher A, Fauth U. Метаболический клиренс антиоксидантной аскорбиновой кислоты у хирургических пациентов. J. Surg. Res. 2005. 129: 46–51. [PubMed] [Google Scholar] 25.Schorah CJ, Downing C, Piripitsi A, Gallivan L, Al-Hazaa AH, Sanderson MJ, Bodenham A. Концентрации общего витамина C, аскорбиновой кислоты и дегидроаскорбиновой кислоты в плазме критически больных пациентов. Являюсь. J. Clin. Nutr. 1996. 63: 760–765. [PubMed] [Google Scholar] 26. Dupertuis YM, Ramseyer S, Fathi M, Pichard C. Оценка стабильности аскорбиновой кислоты в различных многослойных пакетах для парентерального питания: критическое влияние материала стенки пакета. JPEN J. Parenter. Энтерально. Nutr. 2005; 29: 125–130. [PubMed] [Google Scholar] 27.Knafo L, Chessex P, Rouleau T, Lavoie JC. Связь между зависимыми от перекиси водорода побочными продуктами аскорбиновой кислоты и повышенной активностью ацетил-КоА-карбоксилазы печени. Clin. Chem. 2005; 51: 1462–1471. [PubMed] [Google Scholar] 28. Бейнс М., Шенкин А. Недостаточная эффективность кратковременного внутривенного микронутриентного питания в восстановлении антиоксидантного статуса плазмы после операции. Clin. Nutr. 2002; 21: 145–150. [PubMed] [Google Scholar] 29. Луо М., Фернандес-Эстиварис К., Джонс Д.П., Аккарди С.Р., Алтехельд Б., Базарган Н., Хао Л., Гриффит Д.П., Блумберг Дж. Б., Галлоуэй Дж. Р., Зиглер Т. Р..Истощение антиоксидантов плазмы у пациентов хирургического отделения интенсивной терапии, нуждающихся в парентеральном питании: эффекты парентерального питания с добавлением дипептида аланил-глутамина или без него. Питание. 2008; 24: 37–44. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Best KA, Holmes ME, Samson SE, Mwanjewe J, Wilson JX, Dixon SJ, Grover AK. Поглощение аскорбата эндотелиальными клетками коронарных артерий свиней. Мол. Cell Biochem. 2005. 271: 43–49. [PubMed] [Google Scholar] 31. Дэвис К.А., Самсон С.Е., Бест К., Малхи К.К., Шевчик М., Уилсон Дж. Х., Кван С. Ю., Гровер А. К..Ca 2+ -опосредованное высвобождение аскорбата из эндотелиальных клеток коронарных артерий. Br. J. Pharmacol. 2006a; 147: 131–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Дэвис К.А., Самсон С.Е., Уилсон Дж. Х., Гровер А. К.. Гипотонический шок стимулирует высвобождение аскорбата из эндотелиальных клеток коронарных артерий по Ca 2+ -независимому пути. Евро. J. Pharmacol. 2006b; 548: 36–44. [PubMed] [Google Scholar] 33. Ву Ф, Шустер Д.П., Тимл К., Уилсон Дж. Аскорбат подавляет экспрессию субъединицы НАДФН-оксидазы p47phox в эндотелиальных клетках микрососудов.Свободный Радич. Биол. Med. 2007. 42: 124–131. [PubMed] [Google Scholar] 34. Сено Т., Иноуэ Н., Мацуи К., Эджири Дж., Хирата К.И., Кавашима С., Йокояма М. Функциональная экспрессия натрий-зависимого транспортера витамина С 2 в эндотелиальных клетках человека. J. Vasc. Res. 2004. 41: 345–351. [PubMed] [Google Scholar] 35. Цена KD, Цена CSC, Reynolds RD. Дефицит аскорбиновой кислоты, вызванный гипергликемией, способствует дисфункции эндотелия и развитию атеросклероза. Атеросклероз 2001. 2001; 158: 1–12. [PubMed] [Google Scholar] 36.Муллан Б.А., Эннис К.Н., Фи Х.Дж., Янг И.С., Маккэнс Д.Р. Предварительное введение аскорбиновой кислоты внутривенно сохраняет функцию эндотелия во время острой гипергликемии (R1). Clin. Exp. Pharmacol. Physiol. 2005. 32: 340–345. [PubMed] [Google Scholar] 37. Ceriello A, Esposito K, Piconi L, Ihnat MA, Thorpe JE, Testa R, Boemi M, Giugliano D. Колеблющаяся глюкоза более вредна для эндотелиальной функции и окислительного стресса, чем средний уровень глюкозы у нормальных пациентов и пациентов с диабетом 2 типа. Диабет. 2008. 57: 1349–1354. [PubMed] [Google Scholar] 38.Куо С.М., Тан СН, Драган М., Уилсон Дж. Эндотоксин увеличивает рециркуляцию аскорбата и его концентрацию в печени мышей. J. Nutr. 2005; 135: 2411–2416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Paik JY, Lee KH, Ko BH, Choe YS, Choi YY, Kim BT. Оксид азота стимулирует захват 18F-FDG в эндотелиальных клетках человека за счет повышенной активности гексокиназы и экспрессии GLUT1. J. Nucl. Med. 2005. 46: 365–370. [PubMed] [Google Scholar] 40. Spolarics Z, Stein DS, Garcia ZC. Эндотоксин стимулирует детоксицирующую активность перекиси водорода в эндотелиальных клетках печени крыс.Гепатология. 1996. 24: 691–696. [PubMed] [Google Scholar] 41. Мэй Дж.М., Хуанг Дж., Цюй З.С. Поглощение макрофагами и рециркуляция аскорбиновой кислоты: ответ на активацию липополисахаридом. Свободный Радич. Биол. Med. 2005; 39: 1449–1459. [PubMed] [Google Scholar] 42. Wilson JX, Dragan M. Сепсис подавляет рециркуляцию и стимулированный глутаматом экспорт аскорбата астроцитами. Свободный Радич. Биол. Med. 2005; 39: 990–998. [PubMed] [Google Scholar] 43. Spolarics Z. Эндотоксемия, пентозный цикл и оксидант / антиоксидантный баланс в синусоиде печени.J. Leukoc. Биол. 1998; 63: 534–541. [PubMed] [Google Scholar] 44. Штольце И.П., Крот Д.Р., Рэтклифф П.Дж. Регулирование HIF: пролилгидроксилазы. Новартис найден. Symp. 2006; 272: 15–25. [PubMed] [Google Scholar] 45. Vissers MC, Gunningham SP, Моррисон MJ, Dachs GU, Currie MJ. Модуляция индуцируемого гипоксией фактора-1 альфа в культивируемых первичных клетках с помощью внутриклеточного аскорбата. Свободный Радич. Биол. Med. 2007. 42: 765–772. [PubMed] [Google Scholar] 46. МакНалти А.Л., Стейблер ТВ, Вейл Т.П., МакДэниел Г.Е., Краус В.Б. Транспорт дегидроаскорбат в хондроцитах человека регулируется гипоксией и является физиологически значимым источником аскорбиновой кислоты в суставе.Ревматоидный артрит. 2005. 52: 2676–2685. [PubMed] [Google Scholar] 47. Eskurza I, Monahan KD, Robinson JA, Seals DR. Влияние аскорбиновой кислоты в острой и хронической формах на расширение опосредованного потока при малоподвижном и физически активном старении человека. J. Physiol. 2004; 556: 315–324. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Crimi E, Liguori A, Condorelli M, Cioffi M, Astuto M, Bontempo P, Pignalosa O, Vietri MT, Molinari AM, Sica V, Della Corte F, Napoli C. Благоприятные эффекты приема антиоксидантных добавок при энтеральном питании у тяжелобольных пациентов : проспективное рандомизированное двойное слепое плацебо-контролируемое исследование.Анест. Анальг. 2004. 99: 857–863. [PubMed] [Google Scholar] 49. Натенс А.Б., Нефф М.Дж., Юркович Г.Дж., Клотц П., Фарвер К., Рузински Д.Т., Раделла Ф., Гарсия И., Майер Р.В. Рандомизированное проспективное исследование антиоксидантных добавок у тяжелобольных хирургических пациентов. Анна. Surg. 2002; 236: 814–822. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Танака Х., Мацуда Т., Миягантани Ю., Юкиока Т., Мацуда Х., Шимазаки С. Уменьшение объемов реанимационной жидкости у пациентов с тяжелыми ожогами с помощью введения аскорбиновой кислоты: рандомизированное проспективное исследование.Arch. Surg. 2000; 135: 326–331. [PubMed] [Google Scholar] 51. Гаут Дж. П., Белаауадж А., Бьюн Дж., Робертс Л. Дж., II, Маеда Н., Фрей Б., Хайнеке Дж. У. Витамин С не защищает аминокислоты и липиды от окисления во время острого воспаления. Свободный Радич. Биол. Med. 2006; 40: 1494–1501. [PubMed] [Google Scholar] 52. Ким Дж.Й., Ли С.М. Витамины C и E защищают дисфункцию печеночного цитохрома P450, вызванную полимикробным сепсисом. Евро. J. Pharmacol. 2006; 534: 202–209. [PubMed] [Google Scholar] 53. Trzeciak S, McCoy JV, Dellinger RP, Arnold RC, Rizzuto M, Abate NL, Shapiro NI, Parrillo JE, Hollenberg SM, от имени исследователей Microcirculatory Alterations in Resuscitation and Shock (MARS). Реанимационные мероприятия связаны со снижением полиорганной недостаточности через 24 ч у пациентов с сепсисом.Intensive Care Med. 2008; 34: 2210–2217. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Spronk PE, Ince C, Gardien MJ, Mathura KR, Oudemans-van Straaten HM, Zandstra DR. Нитроглицерин при септическом шоке после реанимации внутрисосудистого объема. Ланцет. 2002; 360: 1395–1396. [PubMed] [Google Scholar] 55. Ву Ф, Таймл К., Уилсон Дж. Экспрессия iNOS требует НАДФН-оксидазозависимой окислительно-восстановительной передачи сигналов в эндотелиальных клетках микрососудов. J. Cell. Physiol. 2008; 217: 207–214. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56.Ландмессер У., Дикалов С., Прайс С.Р., Макканн Л., Фукаи Т., Холланд С.М., Митч В.Е., Харрисон Д.Г. Окисление тетрагидробиоптерина приводит к разъединению синтазы оксида азота эндотелиальных клеток при гипертонии. J. Clin. Инвестировать. 2003; 111: 1201–1209. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Ким Х.Дж., Ли С.И., Ли Д.Х., Смит Д., Джо Х., Шеллхорн Х.Э., Бу YC. Синтез аскорбиновой кислоты за счет экспрессии L-гулоно-1,4-лактоноксидазы увеличивает выработку NO в эндотелиальных клетках. Биохим. Биофиз. Res. Commun. 2006; 345: 1657–1662.[PubMed] [Google Scholar] 58. Schneider MP, Delles C, Schmidt BM, Oehmer S, Schwarz TK, Schmieder RE, John S. Эффекты N-ацетилцистеина и витамина C по улавливанию супероксида у субъектов с гипертонической болезнью. Являюсь. J. Hypertens. 2005; 18: 1111–1117. [PubMed] [Google Scholar] 59. Портной А, Купер Д., Грейнджер Д.Н. Взаимодействие стенки тромбоцитов и сосудов в микроциркуляции. Микроциркуляция. 2005; 12: 275–285. [PubMed] [Google Scholar] 60. Херкерт О., Джорджевич Т., БелАиба Р.С., Горлач А. Понимание окислительно-восстановительного контроля свертывания крови: роль сосудистых активных форм кислорода, производных НАДФН-оксидазы, в тромбогенном цикле.Антиоксид. Редокс-сигнал. 2004. 6: 765–776. [PubMed] [Google Scholar] 61. Эллис Г.Р., Андерсон Р.А., Чирков Ю.Ю., Моррис-Тургуд Дж., Джексон С.К., Льюис М.Дж., Горовиц Д.Д., Френно М.П. Острые эффекты витамина С на чувствительность тромбоцитов к донорам оксида азота и эндотелиальную функцию у пациентов с хронической сердечной недостаточностью. J. Cardiovasc. Pharmacol. 2001; 37: 564–570. [PubMed] [Google Scholar] 62. Ли Дж. М., Фан Л. М., Кристи М. Р., Шах А. М.. Передача сигналов альфа фактора острого некроза опухоли через НАДФН-оксидазу в эндотелиальных клетках микрососудов: роль фосфорилирования p47phox и связывание с TRAF4.Мол. Клетка. Биол. 2005; 25: 2320–2330. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Carr AC, Frei B. Человеческие нейтрофилы окисляют липопротеины низкой плотности по механизму, зависящему от хлорноватистой кислоты: роль витамина C. J. Biol. Chem. 2002; 383: 627–636. [PubMed] [Google Scholar] 64. Чаттерджи М., Салуджа Р., Кумар В., Джоти А., Джайн Г.К., Бартвал М.К., Дикшит М. Аскорбат поддерживает экспрессию нейтрофилов NOS, катализ и окислительный взрыв. Свободный Радич. Биол. Med. 2008. 45: 1084–1093. [PubMed] [Google Scholar] 65.Эллис Г.Р., Андерсон Р.А., Ланг Д., Блэкман Д.Д., Моррис Р.Х., Моррис-Тургуд Дж., Макдауэлл И.Ф., Джексон С.К., Льюис М.Дж., Френно МП. Способность нейтрофилов генерировать супероксид-анион, функция эндотелия и окислительный стресс при хронической сердечной недостаточности: эффекты краткосрочной и долгосрочной терапии витамином С. Варенье. Coll. Кардиол. 2000; 36: 1474–1482. [PubMed] [Google Scholar] 66. Шарма П., Рагхаван С.А., Сайни Р., Дикшит М. Опосредованное аскорбатом усиление генерации активных форм кислорода из полиморфно-ядерных лейкоцитов: модулирующий эффект оксида азота.J. Leukoc. Биол. 2004; 75: 1070–1078. [PubMed] [Google Scholar] 67. Goyal P, Weissmann N, Grimminger F, Hegel C, Bader L, Rose F, Fink L, Ghofrani HA, Schermuly RT, Schmidt HH, Seeger W., Hanze J. Повышенная регуляция NAD (P) H оксидазы 1 при гипоксии активирует гипоксию. индуцируемый фактор 1 за счет увеличения количества активных форм кислорода. Свободный Радич. Биол. Med. 2004; 36: 1279–1288. [PubMed] [Google Scholar] 68. Опал С. М., Паларди Дж. Э., Парехо Н. А., Кризи А. А.. Активность ингибитора пути тканевого фактора в экспериментальных моделях суперантиген-индуцированного шока и полимикробного интраабдоминального сепсиса.Крит. Care Med. 2001; 29: 13–17. [PubMed] [Google Scholar] 69. Дубик М.А., Уильямс К., Эльджо Г.И., Крамер Г.К. Настой витамина С в высоких дозах снижает потребность в жидкости при реанимации овец, получивших ожоговые травмы. Шок. 2005. 24: 139–144. [PubMed] [Google Scholar] 70. Сакураи М., Танака Х., Мацуда Т., Гойя Т., Шимазаки С., Мацуда Х. Уменьшение объема реанимационной жидкости при экспериментальных ожогах второй степени с отсроченным началом терапии витамином С (начало через 6 часов после травмы). J. Surg. Res. 1997. 73: 24–27. [PubMed] [Google Scholar] 71.Диммелер С., Бринкманн С., Нойгебауэр Э. Эндотоксин-индуцированные изменения жизнеспособности и проницаемости эндотелиальных клеток: защитный эффект 21-аминостероида. Евро. J. Pharmacol. 1995; 287: 257–261. [PubMed] [Google Scholar] 72. Recchioni R, Marcheselli F, Moroni F, Pieri C. Апоптоз эндотелиальных клеток аорты человека, индуцированный гипергликемическим состоянием, включает митохондриальную деполяризацию и предотвращается N-ацетил-L-цистеином. Обмен веществ. 2002. 51: 1384–1388. [PubMed] [Google Scholar] 73. Rössig L, Hoffmann J, Hugel B, Mallat Z, Haase A, Freyssinet JM, Tedgui A, Aicher A, Zeiher AM, Dimmeler S.Витамин С подавляет апоптоз эндотелиальных клеток при застойной сердечной недостаточности. Тираж. 2001; 104: 2182–2187. [PubMed] [Google Scholar] 74. Саид Р.У., Пэн Т., Мец, CN. Аскорбиновая кислота блокирует рост ингибирующего действия фактора некроза опухоли альфа на эндотелиальные клетки. Exp. Cell Biol. (Maywood) 2003; 228: 855–865. [PubMed] [Google Scholar] 75. Шор AM, Шор SL, Аллен Т.Д. Влияние условий культивирования на пролиферацию, морфологию и миграцию эндотелиальных клеток аорты крупного рогатого скота. J. Cell Sci. 1983; 62: 267–285.[PubMed] [Google Scholar] 76. Чирино Дж., Фиоруччи С., Сесса WC. Эндотелиальная синтаза оксида азота: Золушка воспаления? Trends Pharmacol. Sci. 2003. 24: 91–95. [PubMed] [Google Scholar] 77. Neumann P, Gertzberg N, Vaughan E, Weisbrot J, Woodburn R, Lambert W., Johnson A. Пероксинитрит опосредует TNF-альфа-индуцированную дисфункцию эндотелиального барьера и нитрование актина. Являюсь. J. Physiol. Легочная клетка. Мол. Physiol. 2006; 290: L674 – L684. [PubMed] [Google Scholar] 78. Ву Ф, Уилсон Дж. Пероксинитрат-зависимая активация протеинфосфатазы типа 2A опосредует дисфункцию эндотелиального барьера микрососудов.Кардиоваск. Res. 2009; 81: 38–45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Холленберг С.М., Гульельми М., Паррилло Дж. Э. Несоответствие между проницаемостью микрососудов и динамикой лейкоцитов у мышей с септическим iNOS-дефицитом. Крит. Забота. 2007; 11: R125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Кирш М., де Гроот Х. Аскорбат — мощный антиоксидант против реакций окисления, вызванных пероксинитритом. Доказательства того, что аскорбат действует путем повторного восстановления радикалов субстрата, продуцируемых пероксинитритом. J. Biol.Chem. 2000; 275: 16702–16708. [PubMed] [Google Scholar] 81. Шен КП, Лиу С.Ф., Се С.Л., Чен И.Дж., Ву Б.Н. Эугеноседин-А — усиление индуцированной липополисахаридом активации p38 MAPK, индуцибельной синтазы оксида азота и циклооксигеназы-2. J. Pharm. Pharmacol. 2007; 59: 879–889. [PubMed] [Google Scholar] 82. Ферлитч А., Плейнер Дж., Миттермайер Ф., Шаллер Дж., Хомончик М., Пек-Радосавлевич М., Вольцт М. Сосудосуживающая гипореактивность может быть отменена антиоксидантами у пациентов с запущенным алкогольным циррозом печени и асцитом.Крит. Care Med. 2005; 33: 2028–2033. [PubMed] [Google Scholar] 83. Frein D, Schildknecht S, Bachschmid M, Ullrich V. Редокс-регулирование: новая проблема для фармакологии. Биохим. Pharmacol. 2005; 70: 811–823. [PubMed] [Google Scholar] 84. Киенбаум П., Пранте С., Леманн Н., Сандер А., Ялови А., Петерс Дж. Изменения реактивности сосудов предплечья у пациентов с септическим шоком. Анестезия. 2008. 63: 121–128. [PubMed] [Google Scholar] 85. Хоффер Л.Дж., Левин М., Ассулин С., Мельничук Д., Падаятти С.Дж., Росадюк К., Руссо К., Робитайл Л., Миллер У., Jr. Фаза I клинических испытаний i.v. аскорбиновая кислота при запущенных злокачественных новообразованиях. Анна. Онкол. 2008 в печати. [PubMed] [Google Scholar] 86. Наср Ш., Каштанова Ю., Левчук В., Марковиц Г.С. Вторичный оксалоз из-за избыточного потребления витамина С. Kidney Int. 2006; 70: 1672. [PubMed] [Google Scholar] 87. Мюльхофер А., Мрозек С., Шлегель Б., Троммер В., Розарио Ф., Бёлес Н., Шреммер Д., Золлер В. Г., Бисальски Н. К.. Внутривенное введение высоких доз витамина С не связано с увеличением прооксидантных биомаркеров. Евро. J. Clin. Nutr.2004. 58: 1151–1158. [PubMed] [Google Scholar] 88. Бейли Д.М., Раман С., Макинени Дж., Янг И.С., Пархэм К.Л., Халлин Д.А., Дэвис Б., МакКиман Дж., МакКорд Дж. М., Льюис М. Х. Профилактика витамином С способствует окислительному повреждению липидов во время хирургической ишемии-реперфузии. Свободный Радич. Биол. Med. 2006; 40: 591–600. [PubMed] [Google Scholar]Аскорбат модулирует окислительно-восстановительную передачу сигналов в эндотелии
биофакторов. Авторская рукопись; доступно в PMC 2009 26 октября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2767105
NIHMSID: NIHMS151756
Департамент физических упражнений и питания, Университет в Буффало, Буффало, штат Нью-Йорк, США *
905 905 Адрес для переписки: John X.Уилсон, доктор философии, факультет наук о физических упражнениях и питании, Университет в Буффало, 3435 Main Street, Buffalo, NY, 14214-8028, США Тел .: +716 829 2941; Факс: +716 829 2428. ude.olaffub@nosliwxj. Окончательная отредактированная версия этой статьи издателем доступна на сайте Biofactors. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Уровни циркулирующего витамина С (аскорбата) низкие у пациентов с сепсисом. Парентеральное введение аскорбата повышает концентрацию витамина в плазме и тканях и может снизить заболеваемость.В моделях сепсиса на животных внутривенная инъекция аскорбата увеличивает выживаемость и защищает несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Воздействие парентерального аскорбата на функцию микрососудов быстрое и стойкое. Аскорбат быстро накапливается в эндотелиальных клетках микрососудов, поглощает активные формы кислорода и действует через тетрагидробиоптерин, стимулируя выработку оксида азота эндотелиальной синтазой оксида азота.Основная причина длительного улучшения функции микрососудов заключается в том, что клетки сохраняют высокий уровень аскорбата, который изменяет чувствительные к окислению-восстановлению сигнальные пути, чтобы уменьшить септическую индукцию НАДФН-оксидазы и индуцибельной синтазы оксида азота. Эти наблюдения согласуются с гипотезой о том, что функция микрососудов при сепсисе может быть улучшена парентеральным введением аскорбата в качестве адъювантной терапии.
Ключевые слова: Артериола, аскорбиновая кислота, кровоток, капилляр, воспаление, проницаемость микрососудов, оксид азота, пероксинитрит, тетрагидробиоптерин
1.Введение
Витамин С (аскорбиновая кислота) диссоциирует при физиологическом pH с образованием аскорбата, окислительно-восстановительного состояния витамина, который наиболее часто встречается в клетках [1]. Хорошо известно, что аскорбат физиологически действует как восстановитель и кофактор фермента. Целью настоящего обзора является изучение недавних доказательств того, что аскорбат модулирует внутриклеточные механизмы, которые вызывают дисфункцию микрососудов при критических заболеваниях, таких как сепсис.
Клинический синдром сепсиса — это не единичный гомогенный болезненный процесс, а общий термин для большой группы заболеваний [2].Сепсис может развиться в результате хирургического вмешательства, пневмонии, инфекции мягких тканей, связанной со злокачественными новообразованиями или заболеванием периферических сосудов, или многих других событий. Синдромы сепсиса варьируются от синдрома системного воспалительного ответа до тяжелого сепсиса (острая органная дисфункция, вызванная инфекцией) и септического шока (тяжелый сепсис плюс гипотензия, не купируемая с помощью жидкостной реанимации) [2,3]. Эти синдромы являются основными причинами смерти в отделениях интенсивной терапии во всем мире. Основы лечения включают жидкостную реанимацию для восстановления среднего давления наполнения крови, терапию антибиотиками и контроль источника для устранения инсульта, вызывающего сепсис, вазопрессорную или комбинированную инотропно-вазопрессорную терапию для предотвращения шока, установление гликемического контроля, профилактику тромбоза глубоких вен и профилактика стрессовых язв для предотвращения кровотечений из верхних отделов желудочно-кишечного тракта [3].Тем не менее, несмотря на лучшее медицинское и хирургическое лечение, смертность остается высокой.
При сепсисе пациенты реагируют на целые бактерии, бактериальные продукты, такие как эндотоксин [например, липополисахарид Escherichia coli (LPS)] и внутриклеточные продукты, выделяемые из поврежденных тканей [2]. Ответы включают изменения в функции микрососудов, которые включают: (i) снижение плотности перфузированных капилляров и увеличение доли неперфузированных капилляров; (ii) повышенная проницаемость микрососудов (i.е. потеря барьерной функции), что приводит к образованию отека и гипердемии; и (iii) гипореактивность артериол к вазоконстрикторам и вазодилататорам [4–16]. Если эти изменения произошли только в небольших локализованных областях поврежденной ткани, они могут принести пользу пациенту за счет уменьшения кровотечения из поврежденных кровеносных сосудов, доставки антимикробных медиаторов и фагоцитарных клеток к месту повреждения или предотвращения распространения токсичных веществ [2]. Но широко распространенное системное возникновение этих изменений при сепсисе считается дисфункцией микрососудов, потому что оно приводит к гипоксии тканей, митохондриальной дисфункции и истощению АТФ, что провоцирует органную недостаточность, даже у реанимационных пациентов с адекватным оксигенацией артериальной крови и сердечным выбросом [17]. ].Действительно, микрососудистая дисфункция является важным предиктором смерти, и одна треть пациентов с тяжелым сепсисом умирает от органной недостаточности [10]. Терапевтическая эффективность антибиотиков осложняется увеличением числа инфекций, вызываемых бактериями с множественной лекарственной устойчивостью. Кроме того, патогены, которые уничтожаются антибиотиками, могут выделять большое количество токсичных продуктов (например, ЛПС), которые продолжают травмировать пациента [18]. Таким образом, пациенты с сепсисом могут получить пользу от адъювантной терапии, направленной на микрососудистую дисфункцию.
2. Уровни витамина С у пациентов в критическом состоянии и соответствующие экспериментальные модели
Снижение концентрации аскорбата в плазме и лейкоцитах — обычное явление для тяжелобольных в целом и пациентов с сепсисом в частности [19–25]. Кроме того, аскорбат в плазме обратно коррелирует с полиорганной недостаточностью [19] и напрямую с выживаемостью [21].
Одной из причин истощения аскорбата у госпитализированных критически больных пациентов может быть низкий уровень витамина в растворах для парентерального питания из-за разложения аскорбата и дегидроаскорбиновой кислоты (DHA), которое происходит во время приготовления и хранения [26,27].Другой причиной истощения запасов витамина С является повышенная потребность в аскорбате [22,28]. Количество витамина С, содержащееся в стандартных поливитаминных препаратах для парентерального питания (номинально 200 мг / день), недостаточно для нормализации уровня витамина С в плазме у тяжелобольных пациентов, даже при приеме в течение 7 дней [29]. Основанием для повышенной потребности может быть окисление аскорбата избытком активных форм кислорода (АФК). Действуя как поглотитель ROS и кофактор фермента, аскорбат окисляется до свободного радикала аскорбата, который затем дисмутируется с образованием DHA.
Как показано на фигуре, аскорбат транспортируется в эндотелиальные клетки с помощью специфического натрийзависимого транспортера витамина C 2 (SVCT2), в то время как DHA поглощается посредством вспомогательных транспортеров глюкозы (GLUT) и затем восстанавливается до аскорбата. Отток аскорбата из эндотелиальных клеток может стимулироваться кальций-зависимыми механизмами, но эти клетки обычно сохраняют внутриклеточные концентрации аскорбата, которые намного превышают внеклеточные уровни [1,30–33]. В целом, эти транспортные системы заставляют эндотелиальные клетки быстро накапливать миллимолярные уровни аскорбата, который либо изменяет внутриклеточную функцию, либо регулируемым образом выделяется во внеклеточную жидкость.
Внутриклеточный аскорбат модулирует эффекты септического инсульта на функцию эндотелиальных клеток микрососудов. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Септический инсульт увеличивает активность НАДФН-оксидазы (Nox) и индуцибельной синтазы оксида азота (iNOS), которые повышают уровни активных форм кислорода (АФК) и пероксинитрита (ONOO —). ROS и ONOO — ухудшают капиллярный кровоток, функцию капиллярного барьера и чувствительность артериол к вазоконстрикторам и вазодилататорам.Аскорбат (Asc) и дегидроаскорбиновая кислота (DHA) проникают в клетку через натрийзависимый транспортер витамина C 2 (SVCT2) и транспортер глюкозы 1 (GLUT1), соответственно, и DHA восстанавливается до Asc. Внутриклеточная Asc быстро улавливает ROS и ONOO —, одновременно стимулируя тетрагидробиоптерин (Bh5) -зависимую эндотелиальную синтазу оксида азота (eNOS), увеличивая локальную концентрацию оксида азота (NO). Asc также снижает активность Nox, предотвращает индукцию субъединицы фермента p47phox и блокирует индукцию iNOS.
Воспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-1бета) ингибируют захват аскорбата в культурах эндотелиальных клеток, которые спонтанно экспрессируют SVCT2 [34]. Это действие может истощить внутриклеточный аскорбат из эндотелия во время сепсиса. Вторая причина, по которой внутриклеточный аскорбат может истощаться, — это плохой контроль уровня глюкозы в плазме, что приводит к эпизодам гипергликемии у пациентов с сепсисом [3]. Острая гипергликемия вызывает дефицит аскорбата в эндотелиальных клетках и нарушает эндотелий-зависимую вазодилатацию у здоровых людей [35].Эти эффекты являются следствием конкурентного ингибирования глюкозой захвата ДГК эндотелиальными клетками, поскольку нарушение вазодилатации может быть отменено внутривенным введением аскорбата (2 г болюса [ссылка 36]; инфузия 3 мг / мин [ссылка 37]). Третьей потенциальной причиной внутриклеточного истощения аскорбата является то, что чрезмерное количество АФК может окислять аскорбат до DHA, а затем необратимо окислять последний.
ЛПС повышает концентрацию аскорбата в надпочечниках, сердце, почках и печени [38]. Этот феномен, по-видимому, не требует SVCT2, потому что нет взаимодействия между эффектами LPS и дефицита SVCT2 (SVCT2 +/– гетерозиготные мыши) на концентрацию аскорбата в этих органах [38].В большинстве типов клеток, которые были изучены, поглощение и восстановление внеклеточной DHA до аскорбата не нарушается LPS. Напротив, доноры LPS и оксида азота повышают экспрессию GLUT1 в культурах эндотелиальных клеток [39,40]. Септические инсульты ускоряют скорость поглощения внеклеточной DHA и восстановления ее до аскорбата во многих типах клеток [38,41] (хотя и не во всех, поскольку септический инсульт подавляет поглощение DHA в культивируемых астроцитах [42]).
Эндотелиальные клетки отвечают на ЛПС повышенной экспрессией глюкозо-6-фосфатдегидрогеназы, ключевого фермента пентозного цикла (гексозо-монофосфатный шунт), продуцирующего НАДФН [43].Индукция LPS глюкозо-6-фосфатдегидрогеназы может увеличить поступление восстанавливающих эквивалентов НАДФН для превращения DHA в аскорбат.
В областях тканей с неперфузированными капиллярами гипоксия может подавлять пролилгидроксилазу (PHD) индуцируемого гипоксией фактора (HIF) и, следовательно, увеличивать экспрессию HIF (). HIF-1 увеличивает экспрессию транспортеров GLUT1 и GLUT3, гликолитических ферментов и нескольких генов, участвующих в воспалении [44,45]. Гипоксия стимулирует поглощение DHA через GLUT1 [46].Повышенная восстанавливающая способность, связанная с гипоксией, может затем увеличить способность восстановления DHA к аскорбату внутри клеток.
Внутриклеточный аскорбат (Asc) модулирует окислительно-восстановительные сигнальные пути в эндотелиальных клетках микрососудов во время сепсиса. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Липополисахарид (LPS) и цитокины, такие как интерферон-гамма (IFNgamma), стимулируют сигнальные пути, которые запускают экспрессию субъединицы p47phox НАДФН-оксидазы (Nox), индуцибельной синтазы оксида азота (iNOS) и других медиаторов воспаления.Гипоксия увеличивает индуцируемый гипоксией фактор 1 (HIF-1) за счет ингибирования пролилгидроксилазы HIF-1 (PHD) и тем самым индуцирует экспрессию генов, связанных с сепсисом. Asc ингибирует активацию пути Jak2-Stat1-IRF1 и увеличивает активность PHD. Asc дополнительно регулирует локальную концентрацию оксида азота (NO), поглощая супероксид (O2⋅–) и пероксинитрит (ONOO — ). ИКК; NFκB. Аскорбат не влияет на киназу IKB (IKK) и ядерный фактор-κB, которые также опосредуют индукцию iNos в эндотелиальных клетках микрососудов, подвергнутых воздействию LPS и IFN гамма.
3. Клинические испытания витамина С у пациентов в критическом состоянии
Как подробно описано ниже, сепсис связан с повышенным образованием АФК и пероксинитрита, которые истощают молекулы антиоксидантов и окисляют белки и липиды. АФК также изменяют окислительно-восстановительную активацию и экспрессию белков, которые изменяют распределение капиллярного кровотока, проницаемость капилляров (то есть функцию капиллярного барьера) и чувствительность артериол к вазоконстрикторам и вазодилататорам (и). Следовательно, пациентам с сепсисом может быть полезна адъювантная терапия, которая предотвращает повышение ROS, особенно на участках внутриклеточной передачи сигналов.Парентеральное введение аскорбата может быть вмешательством, которое дает это преимущество.
Парентеральное, а не пероральное введение аскорбата увеличивает его влияние на концентрацию аскорбата в плазме и функцию микрососудов [1]. Например, при сравнении перорального и внутривенного пути введения аскорбата (500 мг / день в течение 30 дней) у мужчин, ведущих малоподвижный образ жизни, только внутривенное введение аскорбата улучшает эндотелий-зависимую функцию артериол, на что указывает вазодилатация, опосредованная потоком [47].
Парентеральное введение аскорбата может снизить заболеваемость и смертность у тяжелобольных пациентов с сепсисом или с риском сепсиса.В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 216 пациентов в критическом состоянии 28-дневная смертность была снижена у пациентов, получавших комбинацию аскорбата и витамина Е внутривенно, по сравнению с теми, кто этого не делал [48]. Второе рандомизированное исследование с 595 тяжелобольными хирургическими пациентами показало, что комбинация аскорбата (1000 мг каждые 8 часов путем внутривенной инъекции) и витамина E (1000 МЕ каждые 8 часов через назо- или орогастральный зонд), начавшаяся в течение 24 часов после травмы или серьезного хирургического вмешательства, снижение относительного риска отека легких и полиорганной недостаточности [49].Эти два испытания не были разработаны для того, чтобы различать действие аскорбата и витамина Е. Однако третье рандомизированное испытание выявило снижение заболеваемости у пациентов с тяжелыми ожогами, получавших очень высокую дозу аскорбата (1584 мг / кг / день) парентерально [50] . Лечение аскорбатом, имеющее особое значение для барьерной функции микрососудов, было связано со значительным снижением образования отеков, объема жидкой реанимации и респираторной дисфункции [50].
4. Влияние витамина С на выживаемость при экспериментальном сепсисе
Животные модели синдромов сепсиса предоставляют фундаментальную информацию о потенциальной пользе и механизме действия аскорбата.Предыдущее истощение запасов аскорбата снижает выживаемость мышей, которым вводили патогенные бактерии [51]. Соответственно, парентеральное введение аскорбата предотвращает гипотонию и отек у животных, которым вводили ЛПС [5,6,11], и улучшает капиллярный кровоток, чувствительность артериол, артериальное кровяное давление, функцию печени и выживаемость при экспериментальном сепсисе [4,12–15] , 52].
Среди наиболее клинически значимых моделей полимикробного сепсиса — перевязка и пункция слепой кишки (CLP) и инъекция фекалий в брюшину (FIP).Подобно изменениям, наблюдаемым у пациентов с сепсисом, CLP у животных увеличивает маркеры окислительного стресса и снижает концентрацию аскорбата в плазме и тканях [4,12,14]. Введение аскорбата (200 мг / кг, в / в) увеличивает выживаемость мышей CLP [15]. Показатели выживаемости через 24 часа после CLP составляют 9% и 65% у мышей, которым вводили носитель и вводили аскорбат, соответственно. Защитный эффект не связан с ингибированием репликации бактерий в инфекционном очаге, поскольку количество бактериальных колониеобразующих единиц в жидкости перитонеального лаважа после CLP не различается у мышей, которым вводили носитель и аскорбат [15].У мышей с FIP 24-часовая выживаемость составляет 19% после инъекции физиологического раствора носителя, но 50% после внутривенной инъекции аскорбата (10 мг / кг, в / в) [13].
5. Дефицит капиллярной перфузии
5.1. Быстрый ответ на аскорбат
Внутривенная инъекция аскорбата может защитить несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Внутривенная инъекция аскорбата предотвращает и обращает вспять неравномерное распределение кровотока в капиллярах септических моделей.Эффект парентерального аскорбата быстрый и стойкий. В этом разделе обсуждаются механизмы, лежащие в основе реакции на аскорбат.
Системное воспаление вызывает остановку кровотока в некоторых капиллярах. При клиническом сепсисе характер распределения капиллярного кровотока улучшается у выживших, но не улучшается у тех, кто не выжил [10]. Улучшение капиллярного кровотока во время жидкостной реанимации связано с предотвращением органной недостаточности независимо от изменений общей гемодинамики [53].Подобно клиническому сепсису, CLP и FIP уменьшают плотность перфузируемых капилляров и увеличивают долю неперфузированных капилляров в скелетных мышцах мышей и крыс, несмотря на введение жидкости для объемной реанимации, чтобы предотвратить шок [4,12,13].
У тяжелобольных пациентов вазодилататоры временно увеличивают долю перфузируемых капилляров [54]. Неизвестно, происходит ли расширение сосудов под действием аскорбата и является ли оно прямой причиной восстановления капиллярного кровотока при клиническом сепсисе.Однако увеличения скорости потока (измеряемой как скорость эритроцитов) в капиллярах не обнаруживается после инъекции аскорбата, который восстанавливает количество перфузируемых капилляров до нормального в скелетных мышцах мышей с сепсисом [13]. Таким образом, экспериментальные исследования сепсиса свидетельствуют о том, что восстановление капиллярного кровотока не достигается за счет сосудорасширяющего действия аскорбата. Вместо этого причиной остановки кровотока в некоторых капиллярах может быть дефицит оксида азота в эндотелиальных клетках и тромбоцитах.Действительно, оксид азота, по-видимому, необходим для сохранения проходимости микрососудов, а местное применение донора оксида азота восстанавливает капиллярный кровоток до нормального у мышей с сепсисом (6 часов после FIP) [13].
Снижение доступности оксида азота внутри септических эндотелиальных клеток и тромбоцитов может быть связано с АФК. Септический инсульт увеличивает активность НАДФН-оксидаз, которые синтезируют АФК в кровеносных сосудах и культурах эндотелиальных клеток микрососудов [16,33,55]. Действительно, активность НАДФН-оксидазы является основным источником стимулирования продукции супероксида в эндотелиальных клетках микрососудов, инкубированных с септическим инсультом (комбинация ЛПС и гамма-интерферона [ИФН-гамма]; ЛПС + ИФН-гамма) [33,55].Ускоренное производство супероксида выявляется в течение 2 часов после первоначального воздействия на клетки LPS + IFNgamma [33]. АФК, производные НАДФН-оксидазы, нарушают капиллярный кровоток во время сепсиса, поскольку либо нокаутации субъединицы gp91phox (Nox2) НАДФН-оксидазы, либо фармакологического ингибирования фермента достаточно для коррекции неправильного распределения кровотока, вызванного FIP у мышей [13]. АФК окисляют тетрагидробиоптерин, который в восстановленной форме является кофактором ферментативного синтеза оксида азота.Потеря тетрагидробиоптерина (из-за его окисления) разъединяет эндотелиальную синтазу оксида азота (eNOS) в эндотелиальных клетках и тромбоцитах, так что этот фермент синтезирует супероксид, а не оксид азота [56]. Местное применение тетрагидробиоптерина восстанавливает капиллярный кровоток во время сепсиса у мышей дикого типа, но не у мышей eNOS — / — [13]. Эти наблюдения подтверждают гипотезу о том, что тетрагидробиоптерин стимулирует активность eNOS для увеличения продукции оксида азота и, таким образом, меняет неравномерное распределение капиллярного кровотока при сепсисе.
По сравнению с инъекцией носителя, болюсное внутривенное введение аскорбата через 0, 1, 6 или 24 ч после начала септического инсульта улучшает распределение капиллярного кровотока в скелетных мышцах крыс CLP [4,12]. Например, инъекция аскорбата (10 мг / кг) через 6 часов после начала септического инсульта устраняет неравномерное распределение кровотока в течение 10 минут [13]. Быстрое улучшение распределения кровотока аскорбатом во время сепсиса зависит от eNOS, потому что это происходит у мышей с нокаутом нейрональной синтазы оксида азота дикого типа (nNOS — / — ) и индуцибельной синтазы оксида азота (iNOS — / — ), но отсутствует у мышей eNOS — / — [13].Стимулирующее действие аскорбата на уровни оксида азота в эндотелиальных клетках связано с несколькими механизмами. Во-первых, как показано на фиг.4, аскорбат предотвращает и обращает вспять окисление тетрагидробиоптерина, увеличивает содержание тетрагидробиоптерина и повышает тетрагидробиоптерин-зависимый синтез оксида азота с помощью eNOS, что является действиями, которые N -ацетилцистеин не может выполнять [7,57,58]. Во-вторых, аскорбат улавливает супероксид и другие АФК, которые в противном случае реагируют с оксидом азота [55] ().
Остановка кровотока в септических капиллярах может быть результатом взаимодействия между лейкоцитами, тромбоцитами и эндотелиальными клетками капилляров.АФК активируют внутриклеточные окислительно-восстановительные сигнальные пути для увеличения адгезии лейкоцитов и тромбоцитов к эндотелию [59]. В соответствии с этим фактом адгезия тромбоцитов стимулируется и ингибируется, соответственно, локально генерируемым супероксидом и оксидом азота во время экспериментального сепсиса [59]. АФК, происходящие из эндотелия и тромбоцитов, также усиливают агрегацию тромбоцитов [60]. Возможно, что образование тромбов в микрососудах после адгезии и агрегации тромбоцитов может способствовать остановке кровотока во время системного воспаления.Внутривенное введение 2 г аскорбата усиливает ингибирование агрегации тромбоцитов донором оксида азота у пациентов, протромботических из-за хронической сердечной недостаточности [61]. Механизм, лежащий в основе этого эффекта на клеточную адгезию, может включать ингибирование аскорбатом экспрессии и активации НАДФН-оксидазы, тем самым предотвращая локальный дефицит оксида азота [13,33]. Кажется вероятным, что аскорбат оказывает аналогичное антиагрегационное действие у пациентов с протромботическими заболеваниями из-за сепсиса.
5.2. Устойчивый ответ на аскорбат
Дефицит капиллярной перфузии при экспериментальном сепсисе можно уменьшить в течение как минимум 12 и 47 часов с помощью доз аскорбата 10 и 76 мг / кг соответственно [4,12,13]. Таким образом, микрососудистые эффекты парентерального аскорбата сохраняются в течение многих часов после того, как аскорбат в плазме возвращается к исходному уровню [13]. Одна из причин большой продолжительности этого эффекта заключается в том, что клетки сохраняют высокие концентрации внутриклеточного аскорбата, которые сохраняются дольше, чем внеклеточный аскорбат [33].Вторая причина того, что микрососудистая реакция на аскорбат сохраняется, заключается в том, что витамин изменяет экспрессию генов, как будет обсуждаться позже.
Клетки, поддерживаемые в стандартных условиях культивирования, часто не содержат аскорбата, потому что аскорбат и DHA либо не попадают в среду, либо случайно разрушаются во время приготовления и хранения культуральных сред и сывороток. В эндотелиальных клетках микрососудов, не содержащих аскорбат, ЛПС + ИНФ-гамма быстро увеличивает активность НАДФН-оксидазы [33,55]. Эндотелиальная НАДФН-оксидаза синтезирует внутриклеточный супероксид, который реагирует с образованием других АФК (например,g., дисмутация супероксида производит перекись водорода), которая затем вызывает пролонгированные окислительно-восстановительные сигнальные эффекты [62]. Либо LPS + INF-gamma, либо экзогенная перекись водорода стимулирует передачу сигналов Jak2 / Stat1 / IRF1 и увеличивает экспрессию белков субъединицы NADPH-оксидазы [33,55]. Таким образом, септический инсульт запускает механизм прямой связи для увеличения продукции АФК, производных НАДФН-оксидазы. Инкубация эндотелиальных клеток микрососудов с аскорбатом повышает внутриклеточную концентрацию аскорбата и предотвращает индукцию LPS + IFN-гамма или перекисью водорода активности эндотелиальной НАДФН-оксидазы [33].Аскорбат также подавляет индукцию субъединицы фермента p47phox [33]. Последний эффект опосредуется сигнальным путем Jak2 / Stat1 / IRF1, поскольку аскорбат предотвращает активацию этого пути LPS + IFNgamma или перекисью водорода [33] (). Селективность демонстрируется тем фактом, что аскорбат подавляет синтез супероксида НАДФН-оксидазой в эндотелиальных клетках [33], но не в лейкоцитах нейтрофилов [63–66].
Продолжительный эффект аскорбата на функцию микрососудов может также включать подавление экспрессии генов, которая зависит от HIF-1 ().Аскорбат действует через кофактор PHD, железо, увеличивая активность фермента и тем самым подавляя индукцию и стабилизацию HIF-1альфа при гипоксии [44]. Кроме того, ингибирование аскорбатом эндотелиальной НАДФН-оксидазы [33] и поглощение окислителей аскорбатом может сохранять активность PHD. Это связано с тем, что оксиданты, такие как производные НАДФН-оксидазы АФК, ингибируют активность PHD [67]. Снижение уровней HIF-1 аскорбатом подавляет экспрессию чувствительных к HIF-1 генов, таких как GLUT1 и iNOS [14,15,45,55].
Активация коагуляции во время сепсиса — еще одна потенциальная причина нарушения капиллярного кровотока, которое может постепенно модулироваться аскорбатом. АФК способствуют экспрессии молекул адгезии и тканевых факторов на поверхности тромбоцитов и эндотелиальных клеток [60]. Последующее образование тканевых факторов и комплекса фактора VII приводит к образованию тромбина, который активирует НАДФН-оксидазу. Этот механизм положительной обратной связи может стимулировать образование микротромбов [60], и его отмена может быть важным механизмом, с помощью которого улучшение распределения кровотока аскорбатом сохраняется достаточно долго для увеличения выживаемости.Инъекция ингибитора пути тканевого фактора увеличивает выживаемость в модели сепсиса CLP [68], что является эффектом, аналогичным эффекту, достигаемому при инъекции аскорбата [15].
Другая потенциальная роль аскорбата предполагает наблюдение, что супероксид стимулирует экспрессию молекулы 1 межклеточной адгезии на клеточной поверхности (ICAM-1) в эндотелиальных клетках микрососудов [62]. ICAM-1 опосредует адгезию лейкоцитов к эндотелию и может тем самым нарушать микроциркуляцию. Поскольку аскорбат подавляет выработку супероксида в эндотелиальных клетках микрососудов, подвергшихся септическому инсульту [33], необходимы дальнейшие исследования, чтобы определить, предотвращает ли витамин закупорку микрососудов лейкоцитами.
6. Витамин С и увеличение проницаемости эндотелия при сепсисе
Повышенная проницаемость эндотелия во многих органах происходит во время сепсиса, что приводит к экстравазации плазмы и образованию отеков. Это вызывает респираторную дисфункцию, уменьшение объема крови и прогрессирование заболевания до септического шока. Парентеральное введение аскорбата снижает образование отеков у пациентов с тяжелой ожоговой травмой [50], а также у получивших ожоговую травму или животных, которым вводили ЛПС [5,69,70]. Аскорбат также ослабляет увеличение проницаемости эндотелия, вызванное LPS in vitro [71].
Одной из причин потери барьерной функции при сепсисе может быть апоптоз эндотелиальных клеток [2]. Следовательно, роль аскорбата как в предотвращении апоптоза в эндотелиальных клетках, так и в стимуляции их пролиферации может быть полезной [72–75].
Другое действие аскорбата на проницаемость эндотелия может включать оксид азота, супероксид и пероксинитрит. Производство базального оксида азота с помощью eNOS необходимо для поддержания функции эндотелиального барьера (т.е. для поддержания параклеточной проницаемости эндотелия на низком уровне для белков плазмы) [76].Защитный эффект оксида азота снижается во время воспалительной реакции из-за одновременного образования супероксида. Оксид азота реагирует с супероксидом с образованием пероксинитрита, который вызывает перекисное окисление липидов, окисление сульфгидрильных групп и нитрование остатков тирозина в белках. В частности, нитрование протеинфосфатазы типа 2 и белков цитоскелета пероксинитритом, по-видимому, является ключевым этапом в развитии дисфункции микрососудистого барьера [77,78]. Основными источниками супероксида, вероятно, являются эндотелиальная НАДФН-оксидаза и несвязанные eNOS и iNOS.Доказательством роли iNOS является то, что генетические или фармакологические вмешательства, которые ингибируют этот фермент, также уменьшают утечку микрососудов при экспериментальном сепсисе [79]. Улавливая супероксид, подавляя экспрессию белка p47phox и iNOS и предотвращая синтез супероксида несвязанными eNOS и iNOS, аскорбат снижает образование пероксинитрита. Кроме того, аскорбат восстанавливает продукты окисления, образующиеся при реакции пероксинитрита с клеточными белками [80]. Эти действия аскорбата могут объяснить его эффективность в предотвращении отеков у тяжелобольных пациентов и экспериментальных моделей [5,50,69,71].
Выяснен механизм, лежащий в основе септической индукции iNOS и его отмены аскорбатом. Окислители, которые возникают из-за активности НАДФН-оксидазы (например, перекись водорода, образующаяся при дисмутации супероксида), усиливают индукцию iNOS в септических кровеносных сосудах и эндотелиальных клетках [15,33,77]. iNOS синтезирует большое количество оксида азота, который, в свою очередь, вступает в реакцию с супероксидом, что приводит к чрезмерному производству пероксинитрита. Аскорбат предотвращает индукцию iNOS при септических поражениях кровеносных сосудов in vivo и эндотелиальных клеток в культуре [14,15,81].Подавление аскорбатом НАДФН-оксидазы опосредует, по крайней мере частично, это подавление экспрессии iNOS [55]. При стимуляции LPS + IFNgamma НАДФН-оксидаза продуцирует АФК, которые активируют сигнальные пути JNK-AP1 и Jak2-IRF1 индукции iNOS, а аскорбат предотвращает эту активацию [55].
7. Гипореактивность артериол к вазоконстрикторам
Гипотензия у пациентов с сепсисом может быть вызвана нарушением функции миокарда и потерей чувствительности артериол к вазоконстрикторам.Парентеральное введение аскорбата может решить последнюю проблему, поскольку инфузия аскорбата меняет гипореактивность артериол к вазоконстрикторам (норэпинефрин, ангиотензин, вазопрессин) у людей, страдающих воспалительным заболеванием или получавших инъекции ЛПС [9,82].
Сопоставимые результаты были получены на животных моделях сепсиса. Например, повышенная неоднородность капиллярного кровотока сопровождается развитием артериальной гипотензии у крыс CLP [12]. Вазоконстрикция артериол и реакции артериального давления на норэпинефрин и ангиотензин II подавляются у мышей через 6 часов после CLP [14,15].Внутривенное введение аскорбата и дефицит гена iNOS (мыши iNOS — / — ) одинаково эффективны для предотвращения CLP-индуцированного нарушения реактивности артериол [13-15]. Чувствительность артериол и артериальное кровяное давление выше у крыс CLP, которым внутривенно вводили аскорбат, по сравнению с крысами, которым вводили носитель, когда эти параметры измеряли через 18–24 ч после инъекции [4,12].
8. Гипореактивность артериол к вазодилататорам
Эндотелиальные клетки регулируют чувствительность артериол к вазодилататорам посредством оксида азота, производного от eNOS, и простациклина, производного от эндопероксида h3-синтазы-1 (PGHS) [83].Оксид азота проникает в гладкомышечные клетки артериол и активирует растворимую гуанилилциклазу, тем самым повышая внутриклеточный цГМФ. Простациклин стимулирует аденилатциклазу к повышению внутриклеточного цАМФ. И цГМФ, и цАМФ затем опосредуют расслабление гладких мышц. Однако септический инсульт увеличивает выработку супероксида, который реагирует с оксидом азота с образованием пероксинитрита, который инактивирует эндотелиальный PGHS, который больше не может синтезировать простациклин. Супероксид и другие окислители, производные НАДФН-оксидазы (т.например, перекись водорода и пероксинитрит) также могут снижать эффективный клеточный уровень оксида азота ниже уровня, необходимого для активации гуанилилциклазы [83]. Таким образом, чувствительность артериол к вазодилататорам подавляется инфузией LPS у людей и CLP-индуцированным сепсисом у животных [7,8,16].
Инфузия аскорбата или тетрагидробиоптерина предотвращает ингибирование LPS зависимых от эндотелия вазодилатационных реакций (оцениваемых как изменения кровотока в предплечьях) на ацетилхолин у здоровых людей [7,8].Этот эффект аскорбата связан с резким увеличением концентрации тетрагидробиоптерина в плазме [7]. Аскорбат может поддерживать нормальные уровни оксида азота, полученного из eNOS, и простациклина, производного PGHS, путем подавления экспрессии НАДФН-оксидазы, удаления ROS и повышения уровней тетрагидробиоптерина в эндотелиальных клетках артериол.
Парентеральный аскорбат заметно увеличивает чувствительность артериол к вазодилататорам при некоторых заболеваниях. Например, при внутриартериальном введении N -ацетилцистеина (48 мг / мин) или аскорбата (18 мг / мин) людям с эссенциальной гипертензией только лечение аскорбатом усиливает вазодилатацию ацетилхолином [58].В последнее время тема реакции на вазодилататоры при клиническом сепсисе стала дискуссионной. Kienbaum et al. [84] сообщили, что вызванное ацетилхолином снижение сосудистого сопротивления предплечья (кровоток в предплечье / среднее артериальное давление) не различается между пациентами с сепсисом и контрольной группой. Однако, поскольку пациенты с сепсисом изначально имели более низкое сосудистое сопротивление, снижение сосудистого сопротивления, вызванное инфузией ацетилхолина, могло быть меньше у этих пациентов. При исследовании здоровых людей до и во время экспериментальной эндотоксемии гипореактивность артериол к ацетилхолину была обнаружена через 4-6 часов после введения ЛПС, в то время, когда циркулирующие цитокины находятся на самом высоком уровне [8].Следовательно, гипореактивность артериол, чувствительных к аскорбатам, к вазодилататорам может варьироваться в зависимости от времени или тяжести заболевания во время прогрессирования синдрома сепсиса.
9. Нерешенные вопросы, заслуживающие дальнейшего изучения
Нет исследований, сравнивающих эффективность аскорбата и DHA при лечении сепсиса. Максимальные скорости поглощения DHA выше, чем аскорбата, в большинстве типов клеток млекопитающих при исследовании в условиях отсутствия глюкозы [1]. Но глюкоза подавляет поглощение DHA большинством клеток, включая эндотелиальные клетки [35], а гипергликемия, которая часто возникает при сепсисе [3], может снизить клеточное поглощение и терапевтическую эффективность вводимой DHA.
Безопасность парентерального аскорбата требует дальнейшего изучения. Исследование внутривенного введения аскорбата у пациентов с запущенными злокачественными новообразованиями показало, что инъекции 1,5 г аскорбата на кг массы тела три раза в неделю хорошо переносятся [85]. Однако аскорбат метаболизируется до оксалата, который накапливается в виде нефротоксичных кристаллов оксалата кальция (нефролитиаз) в почках восприимчивых людей, как сообщается в недавнем исследовании [86]. Другая проблема заключается в том, что аскорбат отдает электроны переходным металлам (например,ж., железо), которые затем катализируют синтез перекиси водорода. Повторные внутривенные инъекции аскорбата 750–7 500 мг / сут в течение 6 дней не вызывают прооксидантных изменений в плазме у здоровых добровольцев [87]. Но у хирургических пациентов внутривенная инъекция 2 г аскорбата за 2 часа до серьезной операции увеличивает окислительную модификацию липидов плазмы в образцах венозной крови, полученных во время ишемической фазы операции [88].
10. Заключение
Для окончательного определения безопасности и эффективности аскорбата у пациентов с сепсисом необходимы дальнейшие исследования.Тем не менее, имеющиеся данные подтверждают гипотезу о том, что функция микрососудов может быть улучшена при сепсисе парентеральным введением аскорбата в качестве адъювантной терапии.
Благодарность
Эта работа финансировалась грантом 1R01AT003643-01A2 Национальных институтов здравоохранения.
Ссылки
1. Wilson JX. Регулирование транспорта витамина С. Анну. Rev. Nutr. 2005. 25: 105–125. [PubMed] [Google Scholar] 2. Маршалл Дж. Сепсис: переосмысление подхода к клиническим исследованиям.J. Leukoc. Биол. 2008; 83: 471–482. [PubMed] [Google Scholar] 3. Деллинджер Р.П., Леви М.М., Карлет Дж. М., Бион Дж., Паркер М. М., Яешке Р., Рейнхарт К., Ангус Д. К., Брун-Бюиссон С., Бил Р., Каландра Т., Дайно Дж. Ф., Герлах Х., Харви М., Марини Дж. Дж., Маршалл Дж., Раньери М., Рамзи Дж., Севрански Дж., Томпсон Б.Т., Таунсенд С., Вендер Дж. С., Циммерман Дж. Л., Винсент Дж. Л., Международный комитет по руководящим принципам кампании против сепсиса. Американская ассоциация медсестер интенсивной терапии. Американский колледж грудных врачей. Американский колледж врачей скорой помощи.Канадское общество интенсивной терапии. Европейское общество клинической микробиологии и инфекционных болезней. Европейское общество интенсивной терапии. Европейское респираторное общество. Международный форум по сепсису. Японская ассоциация острой медицины. Японское общество интенсивной медицины. Общество интенсивной терапии. Общество госпитальной медицины. Общество хирургической инфекции. Кампания Всемирной федерации обществ интенсивной терапии и реанимации по переживанию сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2008 г.Крит. Care Med. 2008. 36: 296–327. [PubMed] [Google Scholar] 4. Броня Дж, Таймл К, Лидингтон Д., Уилсон Дж. Аскорбат предотвращает дисфункцию микрососудов в скелетных мышцах крысы с сепсисом. J. Appl. Physiol. 2001; 90: 795–803. [PubMed] [Google Scholar] 5. Dwenger A, Pape HC, Bantel C, Schweitzer G, Krumm K, Grotz M, Lueken B, Funck M, Regel G. Аскорбиновая кислота снижает повреждение легких, вызванное эндотоксином, у бодрствующих овец. Евро. J. Clin. Инвестировать. 1994; 24: 229–235. [PubMed] [Google Scholar] 6. Фэн Н.Х., Чу С.Дж., Ван Д, Сюй К., Линь СН, Линь Х.И.Влияние различных антиоксидантов на вызванное эндотоксином повреждение легких и экспрессию генов: экспрессия мРНК MnSOD, интерлейкина-1бета и iNOS. Подбородок. J. Physiol. 2004. 47: 111–120. [PubMed] [Google Scholar] 7. Mittermayer F, Pleiner J, Schaller G, Zorn S, Namiranian K, Kapiotis S, Bartel G, Wolfrum M, Brugel M, Thiery J, Macallister RJ, Wolzt M. Тетрагидробиоптерин корректирует эндотоксиновую дисфункцию, вызванную Escherichia coli. Являюсь. J. Physiol. Heart Circ. Physiol. 2005; 289: h2752 – h2757. [PubMed] [Google Scholar] 8.Плейнер Дж., Миттермайер Ф., Шаллер Дж., Макаллистер Р. Дж., Вольц М. Высокие дозы витамина С обращают Escherichia coli эндотоксин-индуцированную гипореактивность к ацетилхолину в предплечье человека. Тираж. 2002; 106: 1460–1464. [PubMed] [Google Scholar] 9. Плейнер Дж., Миттермайер Ф., Шаллер Дж., Марсик С., МакАллистер Р. Дж., Вольц М. Вызванная воспалением гипореактивность сосудосуживающих средств вызвана окислительным стрессом. Варенье. Coll. Кардиол. 2003. 42: 1656–1662. [PubMed] [Google Scholar] 10. Сакр Й., Дюбуа М.Дж., Де Бакер Д., Кретер Дж., Винсент Дж.Л.Стойкие нарушения микроциркуляции связаны с органной недостаточностью и смертью пациентов с септическим шоком. Крит. Care Med. 2004. 32: 1825–1831. [PubMed] [Google Scholar] 11. Шен КП, Ло Ю.К., Ян Р.С., Лю Х.В., Чен И.Дж., Ву Б.Н. Антиоксидант эвгеноседин-A защищает от липополисахаридной гипотензии, гипергликемии и иммунореактивности цитокинов у крыс и мышей. J. Pharm. Pharmacol. 2005. 57: 117–125. [PubMed] [Google Scholar] 12. Тимл К., Ли Ф, Уилсон Дж. Отсроченный болюс аскорбата защищает от неправильного распределения микрососудистого кровотока в септических скелетных мышцах крыс.Крит. Care Med. 2005; 33: 1823–1828. [PubMed] [Google Scholar] 13. Тимл К., Ли Ф, Уилсон Дж. Септическое нарушение капиллярного кровотока требует никотинамидадениндинуклеотидфосфатоксидазы, но не синтазы оксида азота, и быстро устраняется аскорбатом через эндотелиальный механизм, зависимый от синтазы оксида азота. Крит. Care Med. 2008. 36: 2355–2362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Wu F, Wilson JX, Tyml K. Аскорбат подавляет экспрессию iNOS и сохраняет сосудосуживающую способность в скелетных мышцах мышей с сепсисом.Являюсь. J. Physiol. Regul. Интегр. Комп. Physiol. 2003; 285: R50 – R56. [PubMed] [Google Scholar] 15. Wu F, Wilson JX, Tyml K. Аскорбат защищает от нарушения сужения артериол при сепсисе, ингибируя экспрессию индуцибельной синтазы оксида азота. Свободный Радич. Биол. Med. 2004. 37: 1282–1289. [PubMed] [Google Scholar] 16. Ю ХП, Луи П.В., Хван Т.Л., Йен Ч., Лау Ю.Т. Пропофол улучшает эндотелиальную дисфункцию и снижает выработку супероксида в сосудах у крыс с сепсисом. Крит. Care Med. 2006; 34: 453–460. [PubMed] [Google Scholar] 17.Карре Дж. Э., Сингер М. Энергетический метаболизм клеток при сепсисе: необходимость системного подхода. Биохим. Биофиз. Acta. 2008; 1777: 763–771. [PubMed] [Google Scholar] 18. Holzheimer RG. Высвобождение эндотоксина, индуцированное антибиотиками, и клинический сепсис: обзор. J. Chemother. 2001; 13: 159–172. [PubMed] [Google Scholar] 19. Боррелли Э., Ру-Ломбард П., Грау Дж. Э., Жирардин Э., Рику Б., Дайер Дж., Сутер П. М.. Концентрация цитокинов, их растворимых рецепторов и витаминов-антиоксидантов в плазме может предсказать развитие полиорганной недостаточности у пациентов из группы риска.Крит. Care Med. 1996; 24: 392–397. [PubMed] [Google Scholar] 20. Doise JM, Aho LS, Quenot JP, Guilland JC, Zeller M, Vergely C, Aube H, Blettery B, Rochette L. Антиоксидантный статус плазмы у пациентов с сепсисом в критическом состоянии: снижение с течением времени. Fundam. Clin. Pharmacol. 2008; 22: 203–209. [PubMed] [Google Scholar] 21. Галлей Х.Ф., Дэвис М.Дж., Вебстер Н.Р. Образование аскорбильных радикалов у пациентов с сепсисом: эффект нагрузки аскорбатом. Свободный Радич. Биол. Med. 1996. 20: 139–143. [PubMed] [Google Scholar] 22. Лонг CL, Молл К.И., Кришнан Р.С., Лоус Х.Л., Гейгер Дж. У., Боргези Л., Фрэнкс В., Лоусон Т.С., Зауберлих Х.Динамика аскорбиновой кислоты у тяжелобольных и раненых. J. Surg. Res. 2003. 109: 144–148. [PubMed] [Google Scholar] 23. Метниц П.Г., Бартенс С., Фишер М., Фридрих П., Стельцер Н., Драмл В. Антиоксидантный статус у пациентов с острым респираторным дистресс-синдромом. Intensive Care Med. 1999. 25: 180–185. [PubMed] [Google Scholar] 24. Rumelin A, Humbert T, Luhker O, Drescher A, Fauth U. Метаболический клиренс антиоксидантной аскорбиновой кислоты у хирургических пациентов. J. Surg. Res. 2005. 129: 46–51. [PubMed] [Google Scholar] 25.Schorah CJ, Downing C, Piripitsi A, Gallivan L, Al-Hazaa AH, Sanderson MJ, Bodenham A. Концентрации общего витамина C, аскорбиновой кислоты и дегидроаскорбиновой кислоты в плазме критически больных пациентов. Являюсь. J. Clin. Nutr. 1996. 63: 760–765. [PubMed] [Google Scholar] 26. Dupertuis YM, Ramseyer S, Fathi M, Pichard C. Оценка стабильности аскорбиновой кислоты в различных многослойных пакетах для парентерального питания: критическое влияние материала стенки пакета. JPEN J. Parenter. Энтерально. Nutr. 2005; 29: 125–130. [PubMed] [Google Scholar] 27.Knafo L, Chessex P, Rouleau T, Lavoie JC. Связь между зависимыми от перекиси водорода побочными продуктами аскорбиновой кислоты и повышенной активностью ацетил-КоА-карбоксилазы печени. Clin. Chem. 2005; 51: 1462–1471. [PubMed] [Google Scholar] 28. Бейнс М., Шенкин А. Недостаточная эффективность кратковременного внутривенного микронутриентного питания в восстановлении антиоксидантного статуса плазмы после операции. Clin. Nutr. 2002; 21: 145–150. [PubMed] [Google Scholar] 29. Луо М., Фернандес-Эстиварис К., Джонс Д.П., Аккарди С.Р., Алтехельд Б., Базарган Н., Хао Л., Гриффит Д.П., Блумберг Дж. Б., Галлоуэй Дж. Р., Зиглер Т. Р..Истощение антиоксидантов плазмы у пациентов хирургического отделения интенсивной терапии, нуждающихся в парентеральном питании: эффекты парентерального питания с добавлением дипептида аланил-глутамина или без него. Питание. 2008; 24: 37–44. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Best KA, Holmes ME, Samson SE, Mwanjewe J, Wilson JX, Dixon SJ, Grover AK. Поглощение аскорбата эндотелиальными клетками коронарных артерий свиней. Мол. Cell Biochem. 2005. 271: 43–49. [PubMed] [Google Scholar] 31. Дэвис К.А., Самсон С.Е., Бест К., Малхи К.К., Шевчик М., Уилсон Дж. Х., Кван С. Ю., Гровер А. К..Ca 2+ -опосредованное высвобождение аскорбата из эндотелиальных клеток коронарных артерий. Br. J. Pharmacol. 2006a; 147: 131–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Дэвис К.А., Самсон С.Е., Уилсон Дж. Х., Гровер А. К.. Гипотонический шок стимулирует высвобождение аскорбата из эндотелиальных клеток коронарных артерий по Ca 2+ -независимому пути. Евро. J. Pharmacol. 2006b; 548: 36–44. [PubMed] [Google Scholar] 33. Ву Ф, Шустер Д.П., Тимл К., Уилсон Дж. Аскорбат подавляет экспрессию субъединицы НАДФН-оксидазы p47phox в эндотелиальных клетках микрососудов.Свободный Радич. Биол. Med. 2007. 42: 124–131. [PubMed] [Google Scholar] 34. Сено Т., Иноуэ Н., Мацуи К., Эджири Дж., Хирата К.И., Кавашима С., Йокояма М. Функциональная экспрессия натрий-зависимого транспортера витамина С 2 в эндотелиальных клетках человека. J. Vasc. Res. 2004. 41: 345–351. [PubMed] [Google Scholar] 35. Цена KD, Цена CSC, Reynolds RD. Дефицит аскорбиновой кислоты, вызванный гипергликемией, способствует дисфункции эндотелия и развитию атеросклероза. Атеросклероз 2001. 2001; 158: 1–12. [PubMed] [Google Scholar] 36.Муллан Б.А., Эннис К.Н., Фи Х.Дж., Янг И.С., Маккэнс Д.Р. Предварительное введение аскорбиновой кислоты внутривенно сохраняет функцию эндотелия во время острой гипергликемии (R1). Clin. Exp. Pharmacol. Physiol. 2005. 32: 340–345. [PubMed] [Google Scholar] 37. Ceriello A, Esposito K, Piconi L, Ihnat MA, Thorpe JE, Testa R, Boemi M, Giugliano D. Колеблющаяся глюкоза более вредна для эндотелиальной функции и окислительного стресса, чем средний уровень глюкозы у нормальных пациентов и пациентов с диабетом 2 типа. Диабет. 2008. 57: 1349–1354. [PubMed] [Google Scholar] 38.Куо С.М., Тан СН, Драган М., Уилсон Дж. Эндотоксин увеличивает рециркуляцию аскорбата и его концентрацию в печени мышей. J. Nutr. 2005; 135: 2411–2416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Paik JY, Lee KH, Ko BH, Choe YS, Choi YY, Kim BT. Оксид азота стимулирует захват 18F-FDG в эндотелиальных клетках человека за счет повышенной активности гексокиназы и экспрессии GLUT1. J. Nucl. Med. 2005. 46: 365–370. [PubMed] [Google Scholar] 40. Spolarics Z, Stein DS, Garcia ZC. Эндотоксин стимулирует детоксицирующую активность перекиси водорода в эндотелиальных клетках печени крыс.Гепатология. 1996. 24: 691–696. [PubMed] [Google Scholar] 41. Мэй Дж.М., Хуанг Дж., Цюй З.С. Поглощение макрофагами и рециркуляция аскорбиновой кислоты: ответ на активацию липополисахаридом. Свободный Радич. Биол. Med. 2005; 39: 1449–1459. [PubMed] [Google Scholar] 42. Wilson JX, Dragan M. Сепсис подавляет рециркуляцию и стимулированный глутаматом экспорт аскорбата астроцитами. Свободный Радич. Биол. Med. 2005; 39: 990–998. [PubMed] [Google Scholar] 43. Spolarics Z. Эндотоксемия, пентозный цикл и оксидант / антиоксидантный баланс в синусоиде печени.J. Leukoc. Биол. 1998; 63: 534–541. [PubMed] [Google Scholar] 44. Штольце И.П., Крот Д.Р., Рэтклифф П.Дж. Регулирование HIF: пролилгидроксилазы. Новартис найден. Symp. 2006; 272: 15–25. [PubMed] [Google Scholar] 45. Vissers MC, Gunningham SP, Моррисон MJ, Dachs GU, Currie MJ. Модуляция индуцируемого гипоксией фактора-1 альфа в культивируемых первичных клетках с помощью внутриклеточного аскорбата. Свободный Радич. Биол. Med. 2007. 42: 765–772. [PubMed] [Google Scholar] 46. МакНалти А.Л., Стейблер ТВ, Вейл Т.П., МакДэниел Г.Е., Краус В.Б. Транспорт дегидроаскорбат в хондроцитах человека регулируется гипоксией и является физиологически значимым источником аскорбиновой кислоты в суставе.Ревматоидный артрит. 2005. 52: 2676–2685. [PubMed] [Google Scholar] 47. Eskurza I, Monahan KD, Robinson JA, Seals DR. Влияние аскорбиновой кислоты в острой и хронической формах на расширение опосредованного потока при малоподвижном и физически активном старении человека. J. Physiol. 2004; 556: 315–324. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Crimi E, Liguori A, Condorelli M, Cioffi M, Astuto M, Bontempo P, Pignalosa O, Vietri MT, Molinari AM, Sica V, Della Corte F, Napoli C. Благоприятные эффекты приема антиоксидантных добавок при энтеральном питании у тяжелобольных пациентов : проспективное рандомизированное двойное слепое плацебо-контролируемое исследование.Анест. Анальг. 2004. 99: 857–863. [PubMed] [Google Scholar] 49. Натенс А.Б., Нефф М.Дж., Юркович Г.Дж., Клотц П., Фарвер К., Рузински Д.Т., Раделла Ф., Гарсия И., Майер Р.В. Рандомизированное проспективное исследование антиоксидантных добавок у тяжелобольных хирургических пациентов. Анна. Surg. 2002; 236: 814–822. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Танака Х., Мацуда Т., Миягантани Ю., Юкиока Т., Мацуда Х., Шимазаки С. Уменьшение объемов реанимационной жидкости у пациентов с тяжелыми ожогами с помощью введения аскорбиновой кислоты: рандомизированное проспективное исследование.Arch. Surg. 2000; 135: 326–331. [PubMed] [Google Scholar] 51. Гаут Дж. П., Белаауадж А., Бьюн Дж., Робертс Л. Дж., II, Маеда Н., Фрей Б., Хайнеке Дж. У. Витамин С не защищает аминокислоты и липиды от окисления во время острого воспаления. Свободный Радич. Биол. Med. 2006; 40: 1494–1501. [PubMed] [Google Scholar] 52. Ким Дж.Й., Ли С.М. Витамины C и E защищают дисфункцию печеночного цитохрома P450, вызванную полимикробным сепсисом. Евро. J. Pharmacol. 2006; 534: 202–209. [PubMed] [Google Scholar] 53. Trzeciak S, McCoy JV, Dellinger RP, Arnold RC, Rizzuto M, Abate NL, Shapiro NI, Parrillo JE, Hollenberg SM, от имени исследователей Microcirculatory Alterations in Resuscitation and Shock (MARS). Реанимационные мероприятия связаны со снижением полиорганной недостаточности через 24 ч у пациентов с сепсисом.Intensive Care Med. 2008; 34: 2210–2217. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Spronk PE, Ince C, Gardien MJ, Mathura KR, Oudemans-van Straaten HM, Zandstra DR. Нитроглицерин при септическом шоке после реанимации внутрисосудистого объема. Ланцет. 2002; 360: 1395–1396. [PubMed] [Google Scholar] 55. Ву Ф, Таймл К., Уилсон Дж. Экспрессия iNOS требует НАДФН-оксидазозависимой окислительно-восстановительной передачи сигналов в эндотелиальных клетках микрососудов. J. Cell. Physiol. 2008; 217: 207–214. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56.Ландмессер У., Дикалов С., Прайс С.Р., Макканн Л., Фукаи Т., Холланд С.М., Митч В.Е., Харрисон Д.Г. Окисление тетрагидробиоптерина приводит к разъединению синтазы оксида азота эндотелиальных клеток при гипертонии. J. Clin. Инвестировать. 2003; 111: 1201–1209. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Ким Х.Дж., Ли С.И., Ли Д.Х., Смит Д., Джо Х., Шеллхорн Х.Э., Бу YC. Синтез аскорбиновой кислоты за счет экспрессии L-гулоно-1,4-лактоноксидазы увеличивает выработку NO в эндотелиальных клетках. Биохим. Биофиз. Res. Commun. 2006; 345: 1657–1662.[PubMed] [Google Scholar] 58. Schneider MP, Delles C, Schmidt BM, Oehmer S, Schwarz TK, Schmieder RE, John S. Эффекты N-ацетилцистеина и витамина C по улавливанию супероксида у субъектов с гипертонической болезнью. Являюсь. J. Hypertens. 2005; 18: 1111–1117. [PubMed] [Google Scholar] 59. Портной А, Купер Д., Грейнджер Д.Н. Взаимодействие стенки тромбоцитов и сосудов в микроциркуляции. Микроциркуляция. 2005; 12: 275–285. [PubMed] [Google Scholar] 60. Херкерт О., Джорджевич Т., БелАиба Р.С., Горлач А. Понимание окислительно-восстановительного контроля свертывания крови: роль сосудистых активных форм кислорода, производных НАДФН-оксидазы, в тромбогенном цикле.Антиоксид. Редокс-сигнал. 2004. 6: 765–776. [PubMed] [Google Scholar] 61. Эллис Г.Р., Андерсон Р.А., Чирков Ю.Ю., Моррис-Тургуд Дж., Джексон С.К., Льюис М.Дж., Горовиц Д.Д., Френно М.П. Острые эффекты витамина С на чувствительность тромбоцитов к донорам оксида азота и эндотелиальную функцию у пациентов с хронической сердечной недостаточностью. J. Cardiovasc. Pharmacol. 2001; 37: 564–570. [PubMed] [Google Scholar] 62. Ли Дж. М., Фан Л. М., Кристи М. Р., Шах А. М.. Передача сигналов альфа фактора острого некроза опухоли через НАДФН-оксидазу в эндотелиальных клетках микрососудов: роль фосфорилирования p47phox и связывание с TRAF4.Мол. Клетка. Биол. 2005; 25: 2320–2330. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Carr AC, Frei B. Человеческие нейтрофилы окисляют липопротеины низкой плотности по механизму, зависящему от хлорноватистой кислоты: роль витамина C. J. Biol. Chem. 2002; 383: 627–636. [PubMed] [Google Scholar] 64. Чаттерджи М., Салуджа Р., Кумар В., Джоти А., Джайн Г.К., Бартвал М.К., Дикшит М. Аскорбат поддерживает экспрессию нейтрофилов NOS, катализ и окислительный взрыв. Свободный Радич. Биол. Med. 2008. 45: 1084–1093. [PubMed] [Google Scholar] 65.Эллис Г.Р., Андерсон Р.А., Ланг Д., Блэкман Д.Д., Моррис Р.Х., Моррис-Тургуд Дж., Макдауэлл И.Ф., Джексон С.К., Льюис М.Дж., Френно МП. Способность нейтрофилов генерировать супероксид-анион, функция эндотелия и окислительный стресс при хронической сердечной недостаточности: эффекты краткосрочной и долгосрочной терапии витамином С. Варенье. Coll. Кардиол. 2000; 36: 1474–1482. [PubMed] [Google Scholar] 66. Шарма П., Рагхаван С.А., Сайни Р., Дикшит М. Опосредованное аскорбатом усиление генерации активных форм кислорода из полиморфно-ядерных лейкоцитов: модулирующий эффект оксида азота.J. Leukoc. Биол. 2004; 75: 1070–1078. [PubMed] [Google Scholar] 67. Goyal P, Weissmann N, Grimminger F, Hegel C, Bader L, Rose F, Fink L, Ghofrani HA, Schermuly RT, Schmidt HH, Seeger W., Hanze J. Повышенная регуляция NAD (P) H оксидазы 1 при гипоксии активирует гипоксию. индуцируемый фактор 1 за счет увеличения количества активных форм кислорода. Свободный Радич. Биол. Med. 2004; 36: 1279–1288. [PubMed] [Google Scholar] 68. Опал С. М., Паларди Дж. Э., Парехо Н. А., Кризи А. А.. Активность ингибитора пути тканевого фактора в экспериментальных моделях суперантиген-индуцированного шока и полимикробного интраабдоминального сепсиса.Крит. Care Med. 2001; 29: 13–17. [PubMed] [Google Scholar] 69. Дубик М.А., Уильямс К., Эльджо Г.И., Крамер Г.К. Настой витамина С в высоких дозах снижает потребность в жидкости при реанимации овец, получивших ожоговые травмы. Шок. 2005. 24: 139–144. [PubMed] [Google Scholar] 70. Сакураи М., Танака Х., Мацуда Т., Гойя Т., Шимазаки С., Мацуда Х. Уменьшение объема реанимационной жидкости при экспериментальных ожогах второй степени с отсроченным началом терапии витамином С (начало через 6 часов после травмы). J. Surg. Res. 1997. 73: 24–27. [PubMed] [Google Scholar] 71.Диммелер С., Бринкманн С., Нойгебауэр Э. Эндотоксин-индуцированные изменения жизнеспособности и проницаемости эндотелиальных клеток: защитный эффект 21-аминостероида. Евро. J. Pharmacol. 1995; 287: 257–261. [PubMed] [Google Scholar] 72. Recchioni R, Marcheselli F, Moroni F, Pieri C. Апоптоз эндотелиальных клеток аорты человека, индуцированный гипергликемическим состоянием, включает митохондриальную деполяризацию и предотвращается N-ацетил-L-цистеином. Обмен веществ. 2002. 51: 1384–1388. [PubMed] [Google Scholar] 73. Rössig L, Hoffmann J, Hugel B, Mallat Z, Haase A, Freyssinet JM, Tedgui A, Aicher A, Zeiher AM, Dimmeler S.Витамин С подавляет апоптоз эндотелиальных клеток при застойной сердечной недостаточности. Тираж. 2001; 104: 2182–2187. [PubMed] [Google Scholar] 74. Саид Р.У., Пэн Т., Мец, CN. Аскорбиновая кислота блокирует рост ингибирующего действия фактора некроза опухоли альфа на эндотелиальные клетки. Exp. Cell Biol. (Maywood) 2003; 228: 855–865. [PubMed] [Google Scholar] 75. Шор AM, Шор SL, Аллен Т.Д. Влияние условий культивирования на пролиферацию, морфологию и миграцию эндотелиальных клеток аорты крупного рогатого скота. J. Cell Sci. 1983; 62: 267–285.[PubMed] [Google Scholar] 76. Чирино Дж., Фиоруччи С., Сесса WC. Эндотелиальная синтаза оксида азота: Золушка воспаления? Trends Pharmacol. Sci. 2003. 24: 91–95. [PubMed] [Google Scholar] 77. Neumann P, Gertzberg N, Vaughan E, Weisbrot J, Woodburn R, Lambert W., Johnson A. Пероксинитрит опосредует TNF-альфа-индуцированную дисфункцию эндотелиального барьера и нитрование актина. Являюсь. J. Physiol. Легочная клетка. Мол. Physiol. 2006; 290: L674 – L684. [PubMed] [Google Scholar] 78. Ву Ф, Уилсон Дж. Пероксинитрат-зависимая активация протеинфосфатазы типа 2A опосредует дисфункцию эндотелиального барьера микрососудов.Кардиоваск. Res. 2009; 81: 38–45. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Холленберг С.М., Гульельми М., Паррилло Дж. Э. Несоответствие между проницаемостью микрососудов и динамикой лейкоцитов у мышей с септическим iNOS-дефицитом. Крит. Забота. 2007; 11: R125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Кирш М., де Гроот Х. Аскорбат — мощный антиоксидант против реакций окисления, вызванных пероксинитритом. Доказательства того, что аскорбат действует путем повторного восстановления радикалов субстрата, продуцируемых пероксинитритом. J. Biol.Chem. 2000; 275: 16702–16708. [PubMed] [Google Scholar] 81. Шен КП, Лиу С.Ф., Се С.Л., Чен И.Дж., Ву Б.Н. Эугеноседин-А — усиление индуцированной липополисахаридом активации p38 MAPK, индуцибельной синтазы оксида азота и циклооксигеназы-2. J. Pharm. Pharmacol. 2007; 59: 879–889. [PubMed] [Google Scholar] 82. Ферлитч А., Плейнер Дж., Миттермайер Ф., Шаллер Дж., Хомончик М., Пек-Радосавлевич М., Вольцт М. Сосудосуживающая гипореактивность может быть отменена антиоксидантами у пациентов с запущенным алкогольным циррозом печени и асцитом.Крит. Care Med. 2005; 33: 2028–2033. [PubMed] [Google Scholar] 83. Frein D, Schildknecht S, Bachschmid M, Ullrich V. Редокс-регулирование: новая проблема для фармакологии. Биохим. Pharmacol. 2005; 70: 811–823. [PubMed] [Google Scholar] 84. Киенбаум П., Пранте С., Леманн Н., Сандер А., Ялови А., Петерс Дж. Изменения реактивности сосудов предплечья у пациентов с септическим шоком. Анестезия. 2008. 63: 121–128. [PubMed] [Google Scholar] 85. Хоффер Л.Дж., Левин М., Ассулин С., Мельничук Д., Падаятти С.Дж., Росадюк К., Руссо К., Робитайл Л., Миллер У., Jr. Фаза I клинических испытаний i.v. аскорбиновая кислота при запущенных злокачественных новообразованиях. Анна. Онкол. 2008 в печати. [PubMed] [Google Scholar] 86. Наср Ш., Каштанова Ю., Левчук В., Марковиц Г.С. Вторичный оксалоз из-за избыточного потребления витамина С. Kidney Int. 2006; 70: 1672. [PubMed] [Google Scholar] 87. Мюльхофер А., Мрозек С., Шлегель Б., Троммер В., Розарио Ф., Бёлес Н., Шреммер Д., Золлер В. Г., Бисальски Н. К.. Внутривенное введение высоких доз витамина С не связано с увеличением прооксидантных биомаркеров. Евро. J. Clin. Nutr.2004. 58: 1151–1158. [PubMed] [Google Scholar] 88. Бейли Д.М., Раман С., Макинени Дж., Янг И.С., Пархэм К.Л., Халлин Д.А., Дэвис Б., МакКиман Дж., МакКорд Дж. М., Льюис М. Х. Профилактика витамином С способствует окислительному повреждению липидов во время хирургической ишемии-реперфузии. Свободный Радич. Биол. Med. 2006; 40: 591–600. [PubMed] [Google Scholar]Аскорбат модулирует окислительно-восстановительную передачу сигналов в эндотелии
биофакторов. Авторская рукопись; доступно в PMC 2009 26 октября.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC2767105
NIHMSID: NIHMS151756
Департамент физических упражнений и питания, Университет в Буффало, Буффало, штат Нью-Йорк, США *
905 905 Адрес для переписки: John X.Уилсон, доктор философии, факультет наук о физических упражнениях и питании, Университет в Буффало, 3435 Main Street, Buffalo, NY, 14214-8028, США Тел .: +716 829 2941; Факс: +716 829 2428. ude.olaffub@nosliwxj. Окончательная отредактированная версия этой статьи издателем доступна на сайте Biofactors. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Уровни циркулирующего витамина С (аскорбата) низкие у пациентов с сепсисом. Парентеральное введение аскорбата повышает концентрацию витамина в плазме и тканях и может снизить заболеваемость.В моделях сепсиса на животных внутривенная инъекция аскорбата увеличивает выживаемость и защищает несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Воздействие парентерального аскорбата на функцию микрососудов быстрое и стойкое. Аскорбат быстро накапливается в эндотелиальных клетках микрососудов, поглощает активные формы кислорода и действует через тетрагидробиоптерин, стимулируя выработку оксида азота эндотелиальной синтазой оксида азота.Основная причина длительного улучшения функции микрососудов заключается в том, что клетки сохраняют высокий уровень аскорбата, который изменяет чувствительные к окислению-восстановлению сигнальные пути, чтобы уменьшить септическую индукцию НАДФН-оксидазы и индуцибельной синтазы оксида азота. Эти наблюдения согласуются с гипотезой о том, что функция микрососудов при сепсисе может быть улучшена парентеральным введением аскорбата в качестве адъювантной терапии.
Ключевые слова: Артериола, аскорбиновая кислота, кровоток, капилляр, воспаление, проницаемость микрососудов, оксид азота, пероксинитрит, тетрагидробиоптерин
1.Введение
Витамин С (аскорбиновая кислота) диссоциирует при физиологическом pH с образованием аскорбата, окислительно-восстановительного состояния витамина, который наиболее часто встречается в клетках [1]. Хорошо известно, что аскорбат физиологически действует как восстановитель и кофактор фермента. Целью настоящего обзора является изучение недавних доказательств того, что аскорбат модулирует внутриклеточные механизмы, которые вызывают дисфункцию микрососудов при критических заболеваниях, таких как сепсис.
Клинический синдром сепсиса — это не единичный гомогенный болезненный процесс, а общий термин для большой группы заболеваний [2].Сепсис может развиться в результате хирургического вмешательства, пневмонии, инфекции мягких тканей, связанной со злокачественными новообразованиями или заболеванием периферических сосудов, или многих других событий. Синдромы сепсиса варьируются от синдрома системного воспалительного ответа до тяжелого сепсиса (острая органная дисфункция, вызванная инфекцией) и септического шока (тяжелый сепсис плюс гипотензия, не купируемая с помощью жидкостной реанимации) [2,3]. Эти синдромы являются основными причинами смерти в отделениях интенсивной терапии во всем мире. Основы лечения включают жидкостную реанимацию для восстановления среднего давления наполнения крови, терапию антибиотиками и контроль источника для устранения инсульта, вызывающего сепсис, вазопрессорную или комбинированную инотропно-вазопрессорную терапию для предотвращения шока, установление гликемического контроля, профилактику тромбоза глубоких вен и профилактика стрессовых язв для предотвращения кровотечений из верхних отделов желудочно-кишечного тракта [3].Тем не менее, несмотря на лучшее медицинское и хирургическое лечение, смертность остается высокой.
При сепсисе пациенты реагируют на целые бактерии, бактериальные продукты, такие как эндотоксин [например, липополисахарид Escherichia coli (LPS)] и внутриклеточные продукты, выделяемые из поврежденных тканей [2]. Ответы включают изменения в функции микрососудов, которые включают: (i) снижение плотности перфузированных капилляров и увеличение доли неперфузированных капилляров; (ii) повышенная проницаемость микрососудов (i.е. потеря барьерной функции), что приводит к образованию отека и гипердемии; и (iii) гипореактивность артериол к вазоконстрикторам и вазодилататорам [4–16]. Если эти изменения произошли только в небольших локализованных областях поврежденной ткани, они могут принести пользу пациенту за счет уменьшения кровотечения из поврежденных кровеносных сосудов, доставки антимикробных медиаторов и фагоцитарных клеток к месту повреждения или предотвращения распространения токсичных веществ [2]. Но широко распространенное системное возникновение этих изменений при сепсисе считается дисфункцией микрососудов, потому что оно приводит к гипоксии тканей, митохондриальной дисфункции и истощению АТФ, что провоцирует органную недостаточность, даже у реанимационных пациентов с адекватным оксигенацией артериальной крови и сердечным выбросом [17]. ].Действительно, микрососудистая дисфункция является важным предиктором смерти, и одна треть пациентов с тяжелым сепсисом умирает от органной недостаточности [10]. Терапевтическая эффективность антибиотиков осложняется увеличением числа инфекций, вызываемых бактериями с множественной лекарственной устойчивостью. Кроме того, патогены, которые уничтожаются антибиотиками, могут выделять большое количество токсичных продуктов (например, ЛПС), которые продолжают травмировать пациента [18]. Таким образом, пациенты с сепсисом могут получить пользу от адъювантной терапии, направленной на микрососудистую дисфункцию.
2. Уровни витамина С у пациентов в критическом состоянии и соответствующие экспериментальные модели
Снижение концентрации аскорбата в плазме и лейкоцитах — обычное явление для тяжелобольных в целом и пациентов с сепсисом в частности [19–25]. Кроме того, аскорбат в плазме обратно коррелирует с полиорганной недостаточностью [19] и напрямую с выживаемостью [21].
Одной из причин истощения аскорбата у госпитализированных критически больных пациентов может быть низкий уровень витамина в растворах для парентерального питания из-за разложения аскорбата и дегидроаскорбиновой кислоты (DHA), которое происходит во время приготовления и хранения [26,27].Другой причиной истощения запасов витамина С является повышенная потребность в аскорбате [22,28]. Количество витамина С, содержащееся в стандартных поливитаминных препаратах для парентерального питания (номинально 200 мг / день), недостаточно для нормализации уровня витамина С в плазме у тяжелобольных пациентов, даже при приеме в течение 7 дней [29]. Основанием для повышенной потребности может быть окисление аскорбата избытком активных форм кислорода (АФК). Действуя как поглотитель ROS и кофактор фермента, аскорбат окисляется до свободного радикала аскорбата, который затем дисмутируется с образованием DHA.
Как показано на фигуре, аскорбат транспортируется в эндотелиальные клетки с помощью специфического натрийзависимого транспортера витамина C 2 (SVCT2), в то время как DHA поглощается посредством вспомогательных транспортеров глюкозы (GLUT) и затем восстанавливается до аскорбата. Отток аскорбата из эндотелиальных клеток может стимулироваться кальций-зависимыми механизмами, но эти клетки обычно сохраняют внутриклеточные концентрации аскорбата, которые намного превышают внеклеточные уровни [1,30–33]. В целом, эти транспортные системы заставляют эндотелиальные клетки быстро накапливать миллимолярные уровни аскорбата, который либо изменяет внутриклеточную функцию, либо регулируемым образом выделяется во внеклеточную жидкость.
Внутриклеточный аскорбат модулирует эффекты септического инсульта на функцию эндотелиальных клеток микрососудов. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Септический инсульт увеличивает активность НАДФН-оксидазы (Nox) и индуцибельной синтазы оксида азота (iNOS), которые повышают уровни активных форм кислорода (АФК) и пероксинитрита (ONOO —). ROS и ONOO — ухудшают капиллярный кровоток, функцию капиллярного барьера и чувствительность артериол к вазоконстрикторам и вазодилататорам.Аскорбат (Asc) и дегидроаскорбиновая кислота (DHA) проникают в клетку через натрийзависимый транспортер витамина C 2 (SVCT2) и транспортер глюкозы 1 (GLUT1), соответственно, и DHA восстанавливается до Asc. Внутриклеточная Asc быстро улавливает ROS и ONOO —, одновременно стимулируя тетрагидробиоптерин (Bh5) -зависимую эндотелиальную синтазу оксида азота (eNOS), увеличивая локальную концентрацию оксида азота (NO). Asc также снижает активность Nox, предотвращает индукцию субъединицы фермента p47phox и блокирует индукцию iNOS.
Воспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-1бета) ингибируют захват аскорбата в культурах эндотелиальных клеток, которые спонтанно экспрессируют SVCT2 [34]. Это действие может истощить внутриклеточный аскорбат из эндотелия во время сепсиса. Вторая причина, по которой внутриклеточный аскорбат может истощаться, — это плохой контроль уровня глюкозы в плазме, что приводит к эпизодам гипергликемии у пациентов с сепсисом [3]. Острая гипергликемия вызывает дефицит аскорбата в эндотелиальных клетках и нарушает эндотелий-зависимую вазодилатацию у здоровых людей [35].Эти эффекты являются следствием конкурентного ингибирования глюкозой захвата ДГК эндотелиальными клетками, поскольку нарушение вазодилатации может быть отменено внутривенным введением аскорбата (2 г болюса [ссылка 36]; инфузия 3 мг / мин [ссылка 37]). Третьей потенциальной причиной внутриклеточного истощения аскорбата является то, что чрезмерное количество АФК может окислять аскорбат до DHA, а затем необратимо окислять последний.
ЛПС повышает концентрацию аскорбата в надпочечниках, сердце, почках и печени [38]. Этот феномен, по-видимому, не требует SVCT2, потому что нет взаимодействия между эффектами LPS и дефицита SVCT2 (SVCT2 +/– гетерозиготные мыши) на концентрацию аскорбата в этих органах [38].В большинстве типов клеток, которые были изучены, поглощение и восстановление внеклеточной DHA до аскорбата не нарушается LPS. Напротив, доноры LPS и оксида азота повышают экспрессию GLUT1 в культурах эндотелиальных клеток [39,40]. Септические инсульты ускоряют скорость поглощения внеклеточной DHA и восстановления ее до аскорбата во многих типах клеток [38,41] (хотя и не во всех, поскольку септический инсульт подавляет поглощение DHA в культивируемых астроцитах [42]).
Эндотелиальные клетки отвечают на ЛПС повышенной экспрессией глюкозо-6-фосфатдегидрогеназы, ключевого фермента пентозного цикла (гексозо-монофосфатный шунт), продуцирующего НАДФН [43].Индукция LPS глюкозо-6-фосфатдегидрогеназы может увеличить поступление восстанавливающих эквивалентов НАДФН для превращения DHA в аскорбат.
В областях тканей с неперфузированными капиллярами гипоксия может подавлять пролилгидроксилазу (PHD) индуцируемого гипоксией фактора (HIF) и, следовательно, увеличивать экспрессию HIF (). HIF-1 увеличивает экспрессию транспортеров GLUT1 и GLUT3, гликолитических ферментов и нескольких генов, участвующих в воспалении [44,45]. Гипоксия стимулирует поглощение DHA через GLUT1 [46].Повышенная восстанавливающая способность, связанная с гипоксией, может затем увеличить способность восстановления DHA к аскорбату внутри клеток.
Внутриклеточный аскорбат (Asc) модулирует окислительно-восстановительные сигнальные пути в эндотелиальных клетках микрососудов во время сепсиса. Самый большой прямоугольник представляет собой эндотелиальную клетку микрососудов, в которой стрелки со сплошными линиями указывают на стимуляцию, а стрелки с пунктирными линиями указывают на ингибирование. Липополисахарид (LPS) и цитокины, такие как интерферон-гамма (IFNgamma), стимулируют сигнальные пути, которые запускают экспрессию субъединицы p47phox НАДФН-оксидазы (Nox), индуцибельной синтазы оксида азота (iNOS) и других медиаторов воспаления.Гипоксия увеличивает индуцируемый гипоксией фактор 1 (HIF-1) за счет ингибирования пролилгидроксилазы HIF-1 (PHD) и тем самым индуцирует экспрессию генов, связанных с сепсисом. Asc ингибирует активацию пути Jak2-Stat1-IRF1 и увеличивает активность PHD. Asc дополнительно регулирует локальную концентрацию оксида азота (NO), поглощая супероксид (O2⋅–) и пероксинитрит (ONOO — ). ИКК; NFκB. Аскорбат не влияет на киназу IKB (IKK) и ядерный фактор-κB, которые также опосредуют индукцию iNos в эндотелиальных клетках микрососудов, подвергнутых воздействию LPS и IFN гамма.
3. Клинические испытания витамина С у пациентов в критическом состоянии
Как подробно описано ниже, сепсис связан с повышенным образованием АФК и пероксинитрита, которые истощают молекулы антиоксидантов и окисляют белки и липиды. АФК также изменяют окислительно-восстановительную активацию и экспрессию белков, которые изменяют распределение капиллярного кровотока, проницаемость капилляров (то есть функцию капиллярного барьера) и чувствительность артериол к вазоконстрикторам и вазодилататорам (и). Следовательно, пациентам с сепсисом может быть полезна адъювантная терапия, которая предотвращает повышение ROS, особенно на участках внутриклеточной передачи сигналов.Парентеральное введение аскорбата может быть вмешательством, которое дает это преимущество.
Парентеральное, а не пероральное введение аскорбата увеличивает его влияние на концентрацию аскорбата в плазме и функцию микрососудов [1]. Например, при сравнении перорального и внутривенного пути введения аскорбата (500 мг / день в течение 30 дней) у мужчин, ведущих малоподвижный образ жизни, только внутривенное введение аскорбата улучшает эндотелий-зависимую функцию артериол, на что указывает вазодилатация, опосредованная потоком [47].
Парентеральное введение аскорбата может снизить заболеваемость и смертность у тяжелобольных пациентов с сепсисом или с риском сепсиса.В рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 216 пациентов в критическом состоянии 28-дневная смертность была снижена у пациентов, получавших комбинацию аскорбата и витамина Е внутривенно, по сравнению с теми, кто этого не делал [48]. Второе рандомизированное исследование с 595 тяжелобольными хирургическими пациентами показало, что комбинация аскорбата (1000 мг каждые 8 часов путем внутривенной инъекции) и витамина E (1000 МЕ каждые 8 часов через назо- или орогастральный зонд), начавшаяся в течение 24 часов после травмы или серьезного хирургического вмешательства, снижение относительного риска отека легких и полиорганной недостаточности [49].Эти два испытания не были разработаны для того, чтобы различать действие аскорбата и витамина Е. Однако третье рандомизированное испытание выявило снижение заболеваемости у пациентов с тяжелыми ожогами, получавших очень высокую дозу аскорбата (1584 мг / кг / день) парентерально [50] . Лечение аскорбатом, имеющее особое значение для барьерной функции микрососудов, было связано со значительным снижением образования отеков, объема жидкой реанимации и респираторной дисфункции [50].
4. Влияние витамина С на выживаемость при экспериментальном сепсисе
Животные модели синдромов сепсиса предоставляют фундаментальную информацию о потенциальной пользе и механизме действия аскорбата.Предыдущее истощение запасов аскорбата снижает выживаемость мышей, которым вводили патогенные бактерии [51]. Соответственно, парентеральное введение аскорбата предотвращает гипотонию и отек у животных, которым вводили ЛПС [5,6,11], и улучшает капиллярный кровоток, чувствительность артериол, артериальное кровяное давление, функцию печени и выживаемость при экспериментальном сепсисе [4,12–15] , 52].
Среди наиболее клинически значимых моделей полимикробного сепсиса — перевязка и пункция слепой кишки (CLP) и инъекция фекалий в брюшину (FIP).Подобно изменениям, наблюдаемым у пациентов с сепсисом, CLP у животных увеличивает маркеры окислительного стресса и снижает концентрацию аскорбата в плазме и тканях [4,12,14]. Введение аскорбата (200 мг / кг, в / в) увеличивает выживаемость мышей CLP [15]. Показатели выживаемости через 24 часа после CLP составляют 9% и 65% у мышей, которым вводили носитель и вводили аскорбат, соответственно. Защитный эффект не связан с ингибированием репликации бактерий в инфекционном очаге, поскольку количество бактериальных колониеобразующих единиц в жидкости перитонеального лаважа после CLP не различается у мышей, которым вводили носитель и аскорбат [15].У мышей с FIP 24-часовая выживаемость составляет 19% после инъекции физиологического раствора носителя, но 50% после внутривенной инъекции аскорбата (10 мг / кг, в / в) [13].
5. Дефицит капиллярной перфузии
5.1. Быстрый ответ на аскорбат
Внутривенная инъекция аскорбата может защитить несколько микрососудистых функций, а именно капиллярный кровоток, барьер проницаемости микрососудов и чувствительность артериол к вазоконстрикторам и вазодилататорам. Внутривенная инъекция аскорбата предотвращает и обращает вспять неравномерное распределение кровотока в капиллярах септических моделей.Эффект парентерального аскорбата быстрый и стойкий. В этом разделе обсуждаются механизмы, лежащие в основе реакции на аскорбат.
Системное воспаление вызывает остановку кровотока в некоторых капиллярах. При клиническом сепсисе характер распределения капиллярного кровотока улучшается у выживших, но не улучшается у тех, кто не выжил [10]. Улучшение капиллярного кровотока во время жидкостной реанимации связано с предотвращением органной недостаточности независимо от изменений общей гемодинамики [53].Подобно клиническому сепсису, CLP и FIP уменьшают плотность перфузируемых капилляров и увеличивают долю неперфузированных капилляров в скелетных мышцах мышей и крыс, несмотря на введение жидкости для объемной реанимации, чтобы предотвратить шок [4,12,13].
У тяжелобольных пациентов вазодилататоры временно увеличивают долю перфузируемых капилляров [54]. Неизвестно, происходит ли расширение сосудов под действием аскорбата и является ли оно прямой причиной восстановления капиллярного кровотока при клиническом сепсисе.Однако увеличения скорости потока (измеряемой как скорость эритроцитов) в капиллярах не обнаруживается после инъекции аскорбата, который восстанавливает количество перфузируемых капилляров до нормального в скелетных мышцах мышей с сепсисом [13]. Таким образом, экспериментальные исследования сепсиса свидетельствуют о том, что восстановление капиллярного кровотока не достигается за счет сосудорасширяющего действия аскорбата. Вместо этого причиной остановки кровотока в некоторых капиллярах может быть дефицит оксида азота в эндотелиальных клетках и тромбоцитах.Действительно, оксид азота, по-видимому, необходим для сохранения проходимости микрососудов, а местное применение донора оксида азота восстанавливает капиллярный кровоток до нормального у мышей с сепсисом (6 часов после FIP) [13].
Снижение доступности оксида азота внутри септических эндотелиальных клеток и тромбоцитов может быть связано с АФК. Септический инсульт увеличивает активность НАДФН-оксидаз, которые синтезируют АФК в кровеносных сосудах и культурах эндотелиальных клеток микрососудов [16,33,55]. Действительно, активность НАДФН-оксидазы является основным источником стимулирования продукции супероксида в эндотелиальных клетках микрососудов, инкубированных с септическим инсультом (комбинация ЛПС и гамма-интерферона [ИФН-гамма]; ЛПС + ИФН-гамма) [33,55].Ускоренное производство супероксида выявляется в течение 2 часов после первоначального воздействия на клетки LPS + IFNgamma [33]. АФК, производные НАДФН-оксидазы, нарушают капиллярный кровоток во время сепсиса, поскольку либо нокаутации субъединицы gp91phox (Nox2) НАДФН-оксидазы, либо фармакологического ингибирования фермента достаточно для коррекции неправильного распределения кровотока, вызванного FIP у мышей [13]. АФК окисляют тетрагидробиоптерин, который в восстановленной форме является кофактором ферментативного синтеза оксида азота.Потеря тетрагидробиоптерина (из-за его окисления) разъединяет эндотелиальную синтазу оксида азота (eNOS) в эндотелиальных клетках и тромбоцитах, так что этот фермент синтезирует супероксид, а не оксид азота [56]. Местное применение тетрагидробиоптерина восстанавливает капиллярный кровоток во время сепсиса у мышей дикого типа, но не у мышей eNOS — / — [13]. Эти наблюдения подтверждают гипотезу о том, что тетрагидробиоптерин стимулирует активность eNOS для увеличения продукции оксида азота и, таким образом, меняет неравномерное распределение капиллярного кровотока при сепсисе.
По сравнению с инъекцией носителя, болюсное внутривенное введение аскорбата через 0, 1, 6 или 24 ч после начала септического инсульта улучшает распределение капиллярного кровотока в скелетных мышцах крыс CLP [4,12]. Например, инъекция аскорбата (10 мг / кг) через 6 часов после начала септического инсульта устраняет неравномерное распределение кровотока в течение 10 минут [13]. Быстрое улучшение распределения кровотока аскорбатом во время сепсиса зависит от eNOS, потому что это происходит у мышей с нокаутом нейрональной синтазы оксида азота дикого типа (nNOS — / — ) и индуцибельной синтазы оксида азота (iNOS — / — ), но отсутствует у мышей eNOS — / — [13].Стимулирующее действие аскорбата на уровни оксида азота в эндотелиальных клетках связано с несколькими механизмами. Во-первых, как показано на фиг.4, аскорбат предотвращает и обращает вспять окисление тетрагидробиоптерина, увеличивает содержание тетрагидробиоптерина и повышает тетрагидробиоптерин-зависимый синтез оксида азота с помощью eNOS, что является действиями, которые N -ацетилцистеин не может выполнять [7,57,58]. Во-вторых, аскорбат улавливает супероксид и другие АФК, которые в противном случае реагируют с оксидом азота [55] ().
Остановка кровотока в септических капиллярах может быть результатом взаимодействия между лейкоцитами, тромбоцитами и эндотелиальными клетками капилляров.АФК активируют внутриклеточные окислительно-восстановительные сигнальные пути для увеличения адгезии лейкоцитов и тромбоцитов к эндотелию [59]. В соответствии с этим фактом адгезия тромбоцитов стимулируется и ингибируется, соответственно, локально генерируемым супероксидом и оксидом азота во время экспериментального сепсиса [59]. АФК, происходящие из эндотелия и тромбоцитов, также усиливают агрегацию тромбоцитов [60]. Возможно, что образование тромбов в микрососудах после адгезии и агрегации тромбоцитов может способствовать остановке кровотока во время системного воспаления.Внутривенное введение 2 г аскорбата усиливает ингибирование агрегации тромбоцитов донором оксида азота у пациентов, протромботических из-за хронической сердечной недостаточности [61]. Механизм, лежащий в основе этого эффекта на клеточную адгезию, может включать ингибирование аскорбатом экспрессии и активации НАДФН-оксидазы, тем самым предотвращая локальный дефицит оксида азота [13,33]. Кажется вероятным, что аскорбат оказывает аналогичное антиагрегационное действие у пациентов с протромботическими заболеваниями из-за сепсиса.
5.2. Устойчивый ответ на аскорбат
Дефицит капиллярной перфузии при экспериментальном сепсисе можно уменьшить в течение как минимум 12 и 47 часов с помощью доз аскорбата 10 и 76 мг / кг соответственно [4,12,13]. Таким образом, микрососудистые эффекты парентерального аскорбата сохраняются в течение многих часов после того, как аскорбат в плазме возвращается к исходному уровню [13]. Одна из причин большой продолжительности этого эффекта заключается в том, что клетки сохраняют высокие концентрации внутриклеточного аскорбата, которые сохраняются дольше, чем внеклеточный аскорбат [33].Вторая причина того, что микрососудистая реакция на аскорбат сохраняется, заключается в том, что витамин изменяет экспрессию генов, как будет обсуждаться позже.
Клетки, поддерживаемые в стандартных условиях культивирования, часто не содержат аскорбата, потому что аскорбат и DHA либо не попадают в среду, либо случайно разрушаются во время приготовления и хранения культуральных сред и сывороток. В эндотелиальных клетках микрососудов, не содержащих аскорбат, ЛПС + ИНФ-гамма быстро увеличивает активность НАДФН-оксидазы [33,55]. Эндотелиальная НАДФН-оксидаза синтезирует внутриклеточный супероксид, который реагирует с образованием других АФК (например,g., дисмутация супероксида производит перекись водорода), которая затем вызывает пролонгированные окислительно-восстановительные сигнальные эффекты [62]. Либо LPS + INF-gamma, либо экзогенная перекись водорода стимулирует передачу сигналов Jak2 / Stat1 / IRF1 и увеличивает экспрессию белков субъединицы NADPH-оксидазы [33,55]. Таким образом, септический инсульт запускает механизм прямой связи для увеличения продукции АФК, производных НАДФН-оксидазы. Инкубация эндотелиальных клеток микрососудов с аскорбатом повышает внутриклеточную концентрацию аскорбата и предотвращает индукцию LPS + IFN-гамма или перекисью водорода активности эндотелиальной НАДФН-оксидазы [33].Аскорбат также подавляет индукцию субъединицы фермента p47phox [33]. Последний эффект опосредуется сигнальным путем Jak2 / Stat1 / IRF1, поскольку аскорбат предотвращает активацию этого пути LPS + IFNgamma или перекисью водорода [33] (). Селективность демонстрируется тем фактом, что аскорбат подавляет синтез супероксида НАДФН-оксидазой в эндотелиальных клетках [33], но не в лейкоцитах нейтрофилов [63–66].
Продолжительный эффект аскорбата на функцию микрососудов может также включать подавление экспрессии генов, которая зависит от HIF-1 ().Аскорбат действует через кофактор PHD, железо, увеличивая активность фермента и тем самым подавляя индукцию и стабилизацию HIF-1альфа при гипоксии [44]. Кроме того, ингибирование аскорбатом эндотелиальной НАДФН-оксидазы [33] и поглощение окислителей аскорбатом может сохранять активность PHD. Это связано с тем, что оксиданты, такие как производные НАДФН-оксидазы АФК, ингибируют активность PHD [67]. Снижение уровней HIF-1 аскорбатом подавляет экспрессию чувствительных к HIF-1 генов, таких как GLUT1 и iNOS [14,15,45,55].
Активация коагуляции во время сепсиса — еще одна потенциальная причина нарушения капиллярного кровотока, которое может постепенно модулироваться аскорбатом. АФК способствуют экспрессии молекул адгезии и тканевых факторов на поверхности тромбоцитов и эндотелиальных клеток [60]. Последующее образование тканевых факторов и комплекса фактора VII приводит к образованию тромбина, который активирует НАДФН-оксидазу. Этот механизм положительной обратной связи может стимулировать образование микротромбов [60], и его отмена может быть важным механизмом, с помощью которого улучшение распределения кровотока аскорбатом сохраняется достаточно долго для увеличения выживаемости.Инъекция ингибитора пути тканевого фактора увеличивает выживаемость в модели сепсиса CLP [68], что является эффектом, аналогичным эффекту, достигаемому при инъекции аскорбата [15].
Другая потенциальная роль аскорбата предполагает наблюдение, что супероксид стимулирует экспрессию молекулы 1 межклеточной адгезии на клеточной поверхности (ICAM-1) в эндотелиальных клетках микрососудов [62]. ICAM-1 опосредует адгезию лейкоцитов к эндотелию и может тем самым нарушать микроциркуляцию. Поскольку аскорбат подавляет выработку супероксида в эндотелиальных клетках микрососудов, подвергшихся септическому инсульту [33], необходимы дальнейшие исследования, чтобы определить, предотвращает ли витамин закупорку микрососудов лейкоцитами.
6. Витамин С и увеличение проницаемости эндотелия при сепсисе
Повышенная проницаемость эндотелия во многих органах происходит во время сепсиса, что приводит к экстравазации плазмы и образованию отеков. Это вызывает респираторную дисфункцию, уменьшение объема крови и прогрессирование заболевания до септического шока. Парентеральное введение аскорбата снижает образование отеков у пациентов с тяжелой ожоговой травмой [50], а также у получивших ожоговую травму или животных, которым вводили ЛПС [5,69,70]. Аскорбат также ослабляет увеличение проницаемости эндотелия, вызванное LPS in vitro [71].
Одной из причин потери барьерной функции при сепсисе может быть апоптоз эндотелиальных клеток [2]. Следовательно, роль аскорбата как в предотвращении апоптоза в эндотелиальных клетках, так и в стимуляции их пролиферации может быть полезной [72–75].
Другое действие аскорбата на проницаемость эндотелия может включать оксид азота, супероксид и пероксинитрит. Производство базального оксида азота с помощью eNOS необходимо для поддержания функции эндотелиального барьера (т.е. для поддержания параклеточной проницаемости эндотелия на низком уровне для белков плазмы) [76].Защитный эффект оксида азота снижается во время воспалительной реакции из-за одновременного образования супероксида. Оксид азота реагирует с супероксидом с образованием пероксинитрита, который вызывает перекисное окисление липидов, окисление сульфгидрильных групп и нитрование остатков тирозина в белках. В частности, нитрование протеинфосфатазы типа 2 и белков цитоскелета пероксинитритом, по-видимому, является ключевым этапом в развитии дисфункции микрососудистого барьера [77,78]. Основными источниками супероксида, вероятно, являются эндотелиальная НАДФН-оксидаза и несвязанные eNOS и iNOS.Доказательством роли iNOS является то, что генетические или фармакологические вмешательства, которые ингибируют этот фермент, также уменьшают утечку микрососудов при экспериментальном сепсисе [79]. Улавливая супероксид, подавляя экспрессию белка p47phox и iNOS и предотвращая синтез супероксида несвязанными eNOS и iNOS, аскорбат снижает образование пероксинитрита. Кроме того, аскорбат восстанавливает продукты окисления, образующиеся при реакции пероксинитрита с клеточными белками [80]. Эти действия аскорбата могут объяснить его эффективность в предотвращении отеков у тяжелобольных пациентов и экспериментальных моделей [5,50,69,71].
Выяснен механизм, лежащий в основе септической индукции iNOS и его отмены аскорбатом. Окислители, которые возникают из-за активности НАДФН-оксидазы (например, перекись водорода, образующаяся при дисмутации супероксида), усиливают индукцию iNOS в септических кровеносных сосудах и эндотелиальных клетках [15,33,77]. iNOS синтезирует большое количество оксида азота, который, в свою очередь, вступает в реакцию с супероксидом, что приводит к чрезмерному производству пероксинитрита. Аскорбат предотвращает индукцию iNOS при септических поражениях кровеносных сосудов in vivo и эндотелиальных клеток в культуре [14,15,81].Подавление аскорбатом НАДФН-оксидазы опосредует, по крайней мере частично, это подавление экспрессии iNOS [55]. При стимуляции LPS + IFNgamma НАДФН-оксидаза продуцирует АФК, которые активируют сигнальные пути JNK-AP1 и Jak2-IRF1 индукции iNOS, а аскорбат предотвращает эту активацию [55].
7. Гипореактивность артериол к вазоконстрикторам
Гипотензия у пациентов с сепсисом может быть вызвана нарушением функции миокарда и потерей чувствительности артериол к вазоконстрикторам.Парентеральное введение аскорбата может решить последнюю проблему, поскольку инфузия аскорбата меняет гипореактивность артериол к вазоконстрикторам (норэпинефрин, ангиотензин, вазопрессин) у людей, страдающих воспалительным заболеванием или получавших инъекции ЛПС [9,82].
Сопоставимые результаты были получены на животных моделях сепсиса. Например, повышенная неоднородность капиллярного кровотока сопровождается развитием артериальной гипотензии у крыс CLP [12]. Вазоконстрикция артериол и реакции артериального давления на норэпинефрин и ангиотензин II подавляются у мышей через 6 часов после CLP [14,15].Внутривенное введение аскорбата и дефицит гена iNOS (мыши iNOS — / — ) одинаково эффективны для предотвращения CLP-индуцированного нарушения реактивности артериол [13-15]. Чувствительность артериол и артериальное кровяное давление выше у крыс CLP, которым внутривенно вводили аскорбат, по сравнению с крысами, которым вводили носитель, когда эти параметры измеряли через 18–24 ч после инъекции [4,12].
8. Гипореактивность артериол к вазодилататорам
Эндотелиальные клетки регулируют чувствительность артериол к вазодилататорам посредством оксида азота, производного от eNOS, и простациклина, производного от эндопероксида h3-синтазы-1 (PGHS) [83].Оксид азота проникает в гладкомышечные клетки артериол и активирует растворимую гуанилилциклазу, тем самым повышая внутриклеточный цГМФ. Простациклин стимулирует аденилатциклазу к повышению внутриклеточного цАМФ. И цГМФ, и цАМФ затем опосредуют расслабление гладких мышц. Однако септический инсульт увеличивает выработку супероксида, который реагирует с оксидом азота с образованием пероксинитрита, который инактивирует эндотелиальный PGHS, который больше не может синтезировать простациклин. Супероксид и другие окислители, производные НАДФН-оксидазы (т.например, перекись водорода и пероксинитрит) также могут снижать эффективный клеточный уровень оксида азота ниже уровня, необходимого для активации гуанилилциклазы [83]. Таким образом, чувствительность артериол к вазодилататорам подавляется инфузией LPS у людей и CLP-индуцированным сепсисом у животных [7,8,16].
Инфузия аскорбата или тетрагидробиоптерина предотвращает ингибирование LPS зависимых от эндотелия вазодилатационных реакций (оцениваемых как изменения кровотока в предплечьях) на ацетилхолин у здоровых людей [7,8].Этот эффект аскорбата связан с резким увеличением концентрации тетрагидробиоптерина в плазме [7]. Аскорбат может поддерживать нормальные уровни оксида азота, полученного из eNOS, и простациклина, производного PGHS, путем подавления экспрессии НАДФН-оксидазы, удаления ROS и повышения уровней тетрагидробиоптерина в эндотелиальных клетках артериол.
Парентеральный аскорбат заметно увеличивает чувствительность артериол к вазодилататорам при некоторых заболеваниях. Например, при внутриартериальном введении N -ацетилцистеина (48 мг / мин) или аскорбата (18 мг / мин) людям с эссенциальной гипертензией только лечение аскорбатом усиливает вазодилатацию ацетилхолином [58].В последнее время тема реакции на вазодилататоры при клиническом сепсисе стала дискуссионной. Kienbaum et al. [84] сообщили, что вызванное ацетилхолином снижение сосудистого сопротивления предплечья (кровоток в предплечье / среднее артериальное давление) не различается между пациентами с сепсисом и контрольной группой. Однако, поскольку пациенты с сепсисом изначально имели более низкое сосудистое сопротивление, снижение сосудистого сопротивления, вызванное инфузией ацетилхолина, могло быть меньше у этих пациентов. При исследовании здоровых людей до и во время экспериментальной эндотоксемии гипореактивность артериол к ацетилхолину была обнаружена через 4-6 часов после введения ЛПС, в то время, когда циркулирующие цитокины находятся на самом высоком уровне [8].Следовательно, гипореактивность артериол, чувствительных к аскорбатам, к вазодилататорам может варьироваться в зависимости от времени или тяжести заболевания во время прогрессирования синдрома сепсиса.
9. Нерешенные вопросы, заслуживающие дальнейшего изучения
Нет исследований, сравнивающих эффективность аскорбата и DHA при лечении сепсиса. Максимальные скорости поглощения DHA выше, чем аскорбата, в большинстве типов клеток млекопитающих при исследовании в условиях отсутствия глюкозы [1]. Но глюкоза подавляет поглощение DHA большинством клеток, включая эндотелиальные клетки [35], а гипергликемия, которая часто возникает при сепсисе [3], может снизить клеточное поглощение и терапевтическую эффективность вводимой DHA.
Безопасность парентерального аскорбата требует дальнейшего изучения. Исследование внутривенного введения аскорбата у пациентов с запущенными злокачественными новообразованиями показало, что инъекции 1,5 г аскорбата на кг массы тела три раза в неделю хорошо переносятся [85]. Однако аскорбат метаболизируется до оксалата, который накапливается в виде нефротоксичных кристаллов оксалата кальция (нефролитиаз) в почках восприимчивых людей, как сообщается в недавнем исследовании [86]. Другая проблема заключается в том, что аскорбат отдает электроны переходным металлам (например,ж., железо), которые затем катализируют синтез перекиси водорода. Повторные внутривенные инъекции аскорбата 750–7 500 мг / сут в течение 6 дней не вызывают прооксидантных изменений в плазме у здоровых добровольцев [87]. Но у хирургических пациентов внутривенная инъекция 2 г аскорбата за 2 часа до серьезной операции увеличивает окислительную модификацию липидов плазмы в образцах венозной крови, полученных во время ишемической фазы операции [88].
10. Заключение
Для окончательного определения безопасности и эффективности аскорбата у пациентов с сепсисом необходимы дальнейшие исследования.Тем не менее, имеющиеся данные подтверждают гипотезу о том, что функция микрососудов может быть улучшена при сепсисе парентеральным введением аскорбата в качестве адъювантной терапии.
Благодарность
Эта работа финансировалась грантом 1R01AT003643-01A2 Национальных институтов здравоохранения.
