Синдром Миллера Фишера, развившийся после перенесенной инфекции COVID-19 (клинический случай) | Малько
1. Abu-Rumeileh S., Abdelhak A., Foschi M. et al. Guillain–Barré syndrome spectrum associated with COVID-19: an up-to-date systematic review of 73 cases. J Neurol 2020;25:1–38. PMID: 32840686. DOI: 10.1007/s00415-020-10124-x.
2. Gomez A., Diaz A., Carrionn-Penagos J. et al. Clinical and electrophysiological characteristics of Guillain–Barré syndrome in Colombia. J Peripher Nerv Syst 2019;24(3):268–71. PMID: 31386254. DOI: 10.1111/jns.12340.
3. Hsueh H., Chang K., Chao C. et al. A pilot study on serial nerve ultrasound in Miller Fisher syndrome. Front Neurol 2020;11:865. PMID: 32922359. DOI: 10.3389/fneur.2020.00865.
4. Guarino M., Casmiro M., D’Alessandro R. Campylobacter jejuni infection and Guillain–Barré syndrome: a case-control study. Neuroepidemiology 1998;17(6):296–302. PMID: 9890808. DOI: 10.1159/000026183.
5. Bukhari S., Taboada J. A case of Miller Fisher syndrome and literature review. Cureus 2017;9(2):1048. PMID: 28367386. DOI: 10.7759/cureus.1048.
Cureus 2017;9(2):1048. PMID: 28367386. DOI: 10.7759/cureus.1048.
6. Lo Y.L. Clinical and immunological spectrum of the Miller Fisher syndrome. Muscle Nerve 2007;36(5):615–27. PMID: 17657801. DOI: 10.1002/mus.20835.
7. Leung J., Sejvar J.J., Soares J. et al. Guillain–Barré syndrome and antecedent cytomegalovirus infection, USA 2009–2015. Neurol Sci 2020;41(4):885–91. PMID: 31828680. DOI: 10.1007/s10072-019-04156-z.
8. Wijdicks E.F., Klein C.J. Guillain–Barré syndrome. Mayo Clin Proc 2017;92(3):467–79. PMID: 28259232. DOI: 10.1016/j.mayocp.2016.12.002.
9. Gutiérrez-Ortiz C., Méndez-Guerrero A., Rodrigo-Rey S. et al. Miller Fisher syndrome and polyneuritis cranialis in COVID-19. Neurology 2020;95(5):601–5. PMID: 32303650. DOI: 10.1212/WNL.0000000000009619.
10. Inoue A., Koh C., Iwahashi T. Detection of serum anticerebellar antibodies in patients with Miller Fisher syndrome. Eur Neurol 1999;42(4):230–4. PMID: 10567821. DOI: 10.1159/000008113.
11. Chiba A. , Kusunoki S., Shimizu T. et al. IgG antibody to ganglioside GQ1b is a possible marker of Miller Fisher syndrome. Ann Neurol 1992;31(6):677–9. PMID: 1514781. DOI: 10.1002/ana.410310619.
, Kusunoki S., Shimizu T. et al. IgG antibody to ganglioside GQ1b is a possible marker of Miller Fisher syndrome. Ann Neurol 1992;31(6):677–9. PMID: 1514781. DOI: 10.1002/ana.410310619.
12. Супонева Н.А. Клиническая и диагностическая роль аутоантител к ганглиозидам периферических нервов: обзор литературы и собственные данные. Нервно-мышечные болезни 2013;(1):26–34.
13. Koga M., Yuki N., Takahashi M. et al. Close association of IgA anti-ganglioside antibodies with antecedent Campylobacter jejuni infection in Guillain–Barré and Fisher’s syndromes. J Neuroimmunol 1998;81(1–2):138–43. PMID: 9521615. DOI: 10.1016/s0165-5728(97)00168-9.
14. Nishimoto Y., Odaka M., Hirata K. et al. Usefulness of anti-GQ1b IgG antibody testing in Fisher syndrome compared with cerebrospinal fluid examination. J Neuroimmunol 2004;148(1–2):200–5. PMID: 14975602. DOI: 10.1016/j.jneuroim.2003.11.017.
15. Lantos J.E., Strauss S.B., Lin E. COVID-19-associated Miller Fisher syndrome: MRI findings. AJNR Am J Neuroradiol 2020;41(7):1184–6. PMID: 32467190. DOI: 10.3174/ajnr.A6609.
AJNR Am J Neuroradiol 2020;41(7):1184–6. PMID: 32467190. DOI: 10.3174/ajnr.A6609.
16. Kiphuth I.C., Saake M., Lunkenheimer J. et al. Bilateral enhancement of the cranial nerves III–XII in severe Miller Fisher syndrome. Eur Neurol 2009;62(4):252–3. PMID: 19672080. DOI: 10.1159/000232929.
17. Mao L., Jin H., Wang M. et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol 2020;77(6):683–90. DOI: 10.1001/jamaneurol.2020.1127.PMID: 32275288.
18. Acharya A., Kevadiya B.D., Gendelman H.E. et al. SARS-CoV-2 infection leads to neurological dysfunction. J Neuroimmune Pharmacol 2020;15(2):167–73. PMID: 32447746. DOI: 10.1007/s11481-020-09924-9.
19. Lahiri D., Ardila A. COVID-19 pandemic: a neurological perspective. Cureus 2020;12(4):78–89. PMID: 32489743. DOI: 10.7759/cureus.7889.
20. Desforges M., LeCoupanec A., Dubeau P. et al. Human coronaviruses and other respiratory viruses: underestimated opportunistic pathogens of the central nervous system. Viruses 2020:12–4. DOI: 10.3390/v12010014
Viruses 2020:12–4. DOI: 10.3390/v12010014
21. Bohmwald K., Galvez N., Ríos M. et al. Neurologic alterations due to respiratory virus infections. Front Cell Neurosci 2018; 12:386. DOI: 10.3389/fncel.2018.00386.
22. Gutiérrez-Ortiz C., Méndez-Guerrero A., Rodrigo-Rey S. et al. Miller Fisher syndrome and polyneuritis cranialis in COVID-19. Neurology 2020;95(5):601–5. PMID: 32303650. DOI: 10.1212/WNL.0000000000009619.
23. Reyes-Bueno J.A., García-Trujillo L., Urbaneja P. et al. Miller Fisher syndrome after SARS-CoV-2 infection. Eur J Neurol 2020;27(9):1759–61. PMID: 32503084. DOI: 10.1111/ene.14383.
24. Senel M., Abu-Rumeileh S., Michel D. et al. Miller Fisher syndrome after COVID-19: neurochemical markers as an early sign of nervous system involvement. Eur J Neurol 2020;27(11):2378–80. PMID: 32781484. DOI: 10.1111/ene.14473.
25. Ray A. Miller Fisher syndrome and COVID-19: is there a link? BMJ Case Rep. 2020 Aug 11;13(8):e236419. PMID: 32784241. DOI: 10.1136/bcr-2020-236419.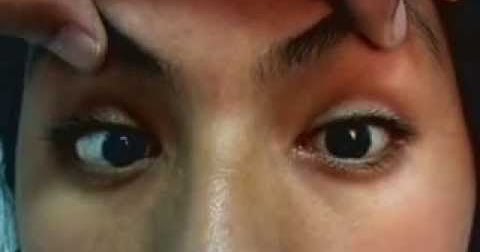
26. Manganotti P, Pesavento V, Buoite Stella A, et al. Miller Fisher syndrome diagnosis and treatment in a patient with SARS-CoV-2. J Neurovirol 2020;26(4):605, 606. PMID: 32529516. DOI: 10.1007/s13365-020-00858-9.
27. Fernández-Domínguez J., AmeijideSanluis E., García-Cabo C. et al. Miller Fisher-like syndrome related to SARSCoV-2 infection (COVID 19). J Neurol 2020;267(9):2495, 2496. PMID: 32458195. DOI: 10.1007/s00415-020-09912-2.
28. Li Z., Li X., Shen J. et al. Miller Fisher syndrome associated with COVID-19: an up-to-date systematic review. Environ Sci Pollut Res Int 2021. PMID: 33677662. DOI: 10.1007/s11356-021-13233-w.
29. Wakerley B.R., Uncini A., Yuki N., et al. Guillain–Barré and Miller Fisher syndromes-new diagnostic classification. Nat Rev Neurol 2014;10(9):537–44. PMID: 25072194. DOI: 10.1038/nrneurol.2014.138.
30. Jung J.H., Oh E.H., Shin J.H. et al. Atypical clinical manifestations of Miller Fisher syndrome. Neurol Sci 2019;40(1):67–73. PMID: 30232672. DOI: 10.1007/s10072-018-3580-2.
DOI: 10.1007/s10072-018-3580-2.
31. Friedman D.I., Potts E. Headache associated with miller fisher syndrome. Headache 2007;47(9):1347–8. PMID: 17927654. DOI: 10.1111/j.1526-4610.2007.00935.x.
Синдром Миллера Фишера как проявление острой воспалительной демиелинизирующей полиневропатии
Поражение периферической нервной системы в виде острой воспалительной демиелинизирующей полиневропатии (ОВДП), именуемое синдромом Гийена — Барре, встречается в неврологической практике с частотой 1–2 случая на 100 тыс. населения, чаще у мужчин, и имеет два пика заболеваемости: в 20–24 и 70–74 года. Синдром Гийена — Барре широко известен неврологам, имеет четко очерченную клиническую картину и подтверждается лабораторными критериями спинномозговой жидкости [1, 2].
Кроме классического типа течения ОВДП, встречается синдром Миллера Фишера (описанный американским невропатологом М. Fisher в 1956 г.), проявляющийся арефлексией, атаксией (мозжечкового характера) и офтальмоплегией (с вовлечением наружных, реже внутренних мышц глаз). В тяжелых случаях могут присоединиться тетрапарез, паралич дыхательных мышц, но чаще болезнь имеет доброкачественное течение, завершаясь спонтанным выздоровлением в течение нескольких недель или месяцев. У 90 % больных выявляются антитела к ганглиозиду GQlb, что может объяснить исключительную избирательность поражения нервных структур. В немногочисленных случаях, когда имеются признаки поражения периферической и центральной нервной систем, заболевание расценивают как энцефалополирадикулопатию. Выздоровление можно ускорить с помощью плазмафереза [3, 4].
В тяжелых случаях могут присоединиться тетрапарез, паралич дыхательных мышц, но чаще болезнь имеет доброкачественное течение, завершаясь спонтанным выздоровлением в течение нескольких недель или месяцев. У 90 % больных выявляются антитела к ганглиозиду GQlb, что может объяснить исключительную избирательность поражения нервных структур. В немногочисленных случаях, когда имеются признаки поражения периферической и центральной нервной систем, заболевание расценивают как энцефалополирадикулопатию. Выздоровление можно ускорить с помощью плазмафереза [3, 4].
Приводим клинический пример синдрома Миллера Фишера у больного, который находился в отделении реконструктивной ангионеврологии и нейрореабилитации ИНВХ им. В.К. Гусака АМН Украины. Больной Г., 57 лет, направлен на консультацию к неврологу ИНВХ из промышленного города Донецкой области. Ведущие жалобы, которые предъявлял больной (слабость, затруднение речи и жевания, нарушение ходьбы и самообслуживания), сочетались с онемением, болью кистей и стоп. Болезнь развивалась около 3 недель, после инфицирования незначительной ранки волосистой части головы в околоушной области слева. После чего появилась гиперемия волосистой части головы, обратился к дерматологу, заподозрено рожистое воспаление, принимал антибактериальную терапию, состояние не улучшалось. В течение 2 недель развилась слабость мимических и жевательных мышц, затем слабость, онемение появились в кистях, стопах. Осматривался неврологом по месту жительства, заподозрена нейроинфекция, при исследовании крови получена воспалительная реакция в виде повышенной СОЭ, повышенного содержания лейкоцитов. Была продолжена антибактериальная терапия, назначены стероидные средства. Эффективности от проводимой терапии не было, нарастала слабость, степень тетрапареза достигла умеренной выраженности. Больной был направлен на консультацию к неврологу ИНВХ им. В.К. Гусака АМН Украины, после осмотра ургентно направлен в отделение.
Болезнь развивалась около 3 недель, после инфицирования незначительной ранки волосистой части головы в околоушной области слева. После чего появилась гиперемия волосистой части головы, обратился к дерматологу, заподозрено рожистое воспаление, принимал антибактериальную терапию, состояние не улучшалось. В течение 2 недель развилась слабость мимических и жевательных мышц, затем слабость, онемение появились в кистях, стопах. Осматривался неврологом по месту жительства, заподозрена нейроинфекция, при исследовании крови получена воспалительная реакция в виде повышенной СОЭ, повышенного содержания лейкоцитов. Была продолжена антибактериальная терапия, назначены стероидные средства. Эффективности от проводимой терапии не было, нарастала слабость, степень тетрапареза достигла умеренной выраженности. Больной был направлен на консультацию к неврологу ИНВХ им. В.К. Гусака АМН Украины, после осмотра ургентно направлен в отделение.
При первичном осмотре общее состояние средней тяжести по неврологическому статусу. Кожа и видимые слизистые чистые. В легких везикулярное дыхание, хрипов нет. Деятельность сердца ритмична, тоны приглушены. АД 160/80 мм рт.ст.
Кожа и видимые слизистые чистые. В легких везикулярное дыхание, хрипов нет. Деятельность сердца ритмична, тоны приглушены. АД 160/80 мм рт.ст.
В неврологическом статусе выявлен умеренный дипарез лицевого нерва преимущественно слева, симптом Белла I ст. с 2 сторон, горизонтальный нистагм с 2 сторон при крайних отведениях глазных яблок, парез взора вверх и конвергенции, умеренное ограничение отведения глазных яблок в стороны. Дизартрия, снижение глоточных, небных рефлексов, мягкое небо свисает и ограничена его подвижность при фонации, глотает с легким поперхиванием, сухожильные рефлексы с рук низкие D = S, коленные, ахилловы рефлексы не вызываются, брюшные рефлексы отсутствуют. Умеренная болезненность при пальпации мышц рук и ног и по ходу нервных стволов, положительный симптом Ласега под углом 50° с 2 сторон. Сила в конечностях снижена до легкого пареза в руках (4 балла), выраженного (2 балла) в ногах, встает с кровати на ноги и передвигается с посторонней помощью. Полиневритический тип расстройств чувствительности, в виде высоких «перчаток» и «носков». Проведение координаторных проб выявило умеренную атаксию. Вибрационная чувствительность, исследуемая камертоном (С128), снижена на стопах до 3–5 секунд, на руках — до 7–8 секунд.
Проведение координаторных проб выявило умеренную атаксию. Вибрационная чувствительность, исследуемая камертоном (С128), снижена на стопах до 3–5 секунд, на руках — до 7–8 секунд.
Приведенные клинико-анамнестические данные делали необходимым проведение дифференциальной диагностики между миастеническим и миопатическим синдромами, стволовым энцефалитом, полимиозитом, острой воспалительной демиелинизирующей полиневропатией в виде синдрома Гийена — Барре и синдрома Миллера Фишера.
Приводим результаты проведенных исследований: произведена люмбальная пункция, спинномозговая жидкость бесцветная, прозрачная, белок 1,33 г/л, цитоз — 1 в мкл, реакция Панди 4+ с коагуляцией, атипичные клетки в данном материале не обнаружены, хлориды 132, глюкоза 3,05 ммоль/л.
Клинический анализ крови: Нb — 171, Эр. — 5,0 Т/л, ц.п. — 1,0, Л. — 3,8 Г/л, СОЭ — 15, палочкоядерные нейтрофилы — 1, сегментоядерные нейтрофилы — 61, эозинофилы — 1, моноциты — 3, лимфоциты — 34. Биохимические показатели крови были в пределах нормальных. Циркулирующие иммунные комплексы в крови — 90 (№ 40–70).
Циркулирующие иммунные комплексы в крови — 90 (№ 40–70).
Проведение ЭНМГ, получены данные, характерные для невропатии.
С учетом клинической картины развития заболевания, данных лабораторных исследований ликвора и нейрофизиологического исследования больному выставлен диагноз: острая воспалительная демиелинизирующая полиневропатия, вариант Миллера Фишера с умеренным вялым тетрапарезом, легким в руках, выраженным в ногах, глазодвигательными нарушениями, умеренным атактическим синдромом, легким бульбарным синдромом, умеренным нарушением функции ходьбы и самообслуживания.
Больному проведено лечение с применением плазмафереза в объеме 800 мл № 3 и введением внутривенно препарата биовен из расчета 7 мл на 1 кг массы тела № 3. Также больной получал ацелизин 1,0 внутримышечно № 10, лирику 75 мг 2 раза в сутки, актовегин 10,0 внутривенно № 10, тиогамму 50,0 внутривенно № 10 с последующим переходом на пероральный прием
600 мг в сутки, реосорбилакт 200,0 внутривенно № 3, дексалгин 2,0 внутримышечно № 5, нейромидин 1,5% 2,0 внутримышечно № 10, с последующим пероральным приемом 20 мг 3 раза в сутки. Комплексная терапия включала массаж, ЛФК, кинезитерапию, иглорефлексотерапию, БОС.
Комплексная терапия включала массаж, ЛФК, кинезитерапию, иглорефлексотерапию, БОС.
На 30-й день госпитализации больной выписан из стационара в удовлетворительном состоянии, значительно наросла сила в мимических и жевательных мышцах. Сохранялся легкий парез левого лицевого нерва, регрессировали бульбарный и атактический синдромы. Значительно уменьшились глазодвигательные нарушения. Сила в руках восстановилась, в ногах парез регрессировал до степени легкого (4 балла), сохранялось отсутствие сухожильных рефлексов, легких периферических чувствительных расстройств. После выписки больному рекомендовано продолжение реабилитационного восстановительного лечения.
При контрольном осмотре через 2 месяца у больного полностью регрессировал парез конечностей и восстановилась чувствительность. Сохраняется легкий парез нижней половины мимических мышц слева. Началось восстановление сухожильных рефлексов.
Таким образом, данный клинический пример показывает важность правильной и своевременной диагностики острой воспалительной демиелинизирующей полиневропатии и ее варианта Миллера Фишера для проведения патогенетически обоснованной терапии.
Bibliography
1. Пирадов М.А., Супонева Н.А. Синдром Гийена — Барре: современное состояние проблемы // Российский медицинский форум-2007. Сб. тезисов. — М., 2007. — С. 1-11.
2. Пономарев В.В. Полиневропатии: современный взгляд на старую проблему // Медицинские новости. — 2006. — № 1. — С. 15-17.
3. Ющук Н.Д., Тимченко О.Л., Морозова Е.А., Балмасова И.П., Гультяев М.М., Говорун В.М., Зиганшин Р.Х., Икрянникова Л.Н., Ильина Е.Н., Климова Е.А., Манжеева С.В., Пирадов М.А., Супонева М.А., Федькина Ю.А. Совершенствование алгоритма диагностики демиелинизирующих полиневропатий // Лечащий врач. — 2009. — № 10. — С. 27-29.
4. Hadden R.D., Karch H., Hartung H.P. et al. Preceding infection, immune factors, and outcome in Guillain — Barre syndrome // Neurology. — 2001. — Vol. 56. — P. 758-765.
Синдром Миллера: MedlinePlus Genetics
Описание
Синдром Миллера — редкое заболевание, поражающее главным образом развитие лица и конечностей. Тяжесть этого расстройства варьируется среди пострадавших людей.
Тяжесть этого расстройства варьируется среди пострадавших людей.
Дети с синдромом Миллера рождаются с недоразвитыми скуловыми костями (гипоплазия скул) и очень маленькой нижней челюстью (микрогнатия). У них часто имеется отверстие в нёбе (волчья пасть) и/или расщепление верхней губы (заячья губа). Эти аномалии часто вызывают проблемы с кормлением у младенцев с синдромом Миллера. Дыхательные пути обычно ограничены из-за микрогнатии, что может привести к опасным для жизни проблемам с дыханием.
Люди с синдромом Миллера часто имеют глаза, которые наклонены вниз, веки выворачиваются так, что открывается внутренняя поверхность (эктропион), и выемка на нижних веках, называемая колобомой века. Многие больные имеют маленькие чашеобразные уши, а у некоторых наблюдается потеря слуха, вызванная дефектами среднего уха (кондуктивная тугоухость). Еще одной особенностью этого состояния является наличие дополнительных сосков. Синдром Миллера не влияет на интеллект человека, хотя речевое развитие может задерживаться из-за нарушения слуха.
Люди с синдромом Миллера имеют различные аномалии костей рук и ног. Самая распространенная проблема — отсутствие пятых (мизинцев) пальцев рук и ног. У больных также могут быть перепончатые или сросшиеся пальцы рук или ног (синдактилия) и аномально сформированные кости предплечий и голеней. У людей с синдромом Миллера иногда бывают дефекты других костей, например ребер или позвоночника.
Реже у пораженных лиц наблюдаются аномалии сердца, почек, гениталий или желудочно-кишечного тракта.
Частота
Синдром Миллера — редкое заболевание; по оценкам, он поражает менее 1 из 1 миллиона новорожденных. В медицинской литературе описано не менее 30 случаев.
Причины
Мутации в гене DHODH вызывают синдром Миллера. Этот ген обеспечивает инструкции по созданию фермента, называемого дигидрооротатдегидрогеназой. Этот фермент участвует в производстве пиримидинов, которые являются строительными блоками ДНК, его химического родственника РНК и таких молекул, как АТФ и ГТФ, которые служат источниками энергии в клетке. В частности, дигидрооротатдегидрогеназа превращает молекулу, называемую дигидрооротатом, в молекулу, называемую оротовой кислотой. На последующих этапах другие ферменты модифицируют оротовую кислоту с образованием пиримидинов.
В частности, дигидрооротатдегидрогеназа превращает молекулу, называемую дигидрооротатом, в молекулу, называемую оротовой кислотой. На последующих этапах другие ферменты модифицируют оротовую кислоту с образованием пиримидинов.
Синдром Миллера нарушает развитие структур, называемых первой и второй глоточными дугами. Глоточные дуги представляют собой пять парных структур, которые формируются на каждой стороне головы и шеи во время эмбрионального развития. Эти структуры развиваются в кости, кожу, нервы и мышцы головы и шеи. В частности, первая и вторая глоточные дуги развиваются в челюсть, нервы и мышцы, отвечающие за жевание и выражение лица, кости среднего и наружного уха. Остается неясным, как именно 9Мутации гена 0021 DHODH
Синдром Миллера также влияет на развитие рук и ног. Каждая конечность начинается с небольшого холмика ткани, называемого зачатком конечности, который растет наружу. Многие различные белки участвуют в нормальном формировании (структурировании) каждой конечности. После того, как общий рисунок конечности сформирован, можно приступать к детальному формированию. Например, чтобы создать отдельные пальцы рук и ног, определенные клетки самоуничтожаются (подвергаются апоптозу), чтобы удалить перепонку между каждым пальцем. Роль дигидрооротатдегидрогеназы в развитии конечностей неизвестна. Также неизвестно, как мутации в 9Ген 0021 DHODH
После того, как общий рисунок конечности сформирован, можно приступать к детальному формированию. Например, чтобы создать отдельные пальцы рук и ног, определенные клетки самоуничтожаются (подвергаются апоптозу), чтобы удалить перепонку между каждым пальцем. Роль дигидрооротатдегидрогеназы в развитии конечностей неизвестна. Также неизвестно, как мутации в 9Ген 0021 DHODH
Наследование
Это состояние наследуется по аутосомно-рецессивному типу, что означает, что обе копии гена в каждой клетке имеют мутации. Каждый из родителей человека с аутосомно-рецессивным заболеванием несет по одной копии мутировавшего гена, но обычно у них нет признаков и симптомов заболевания.
Другие названия для этого состояния
- Акрофациальный дизостоз Джини-Видеманна
- Синдром Джини-Видеманна
- Постаксиальный акрофациальный дизостоз (POADS)
Дополнительная информация и ресурсы
Информация о генетическом тестировании
- Реестр генетического тестирования: синдром Миллера
Информационный центр генетических и редких заболеваний
- Синдром Миллера
Ресурсы поддержки и защиты интересов пациентов
- Поиск информации о заболеваниях
- Национальная организация редких заболеваний (NORD)
Научные исследования от ClinicalTrials.
 gov
gov - ClinicalTrials.gov
Каталог генов и болезней от OMIM
- ПОСТАКСАЛЬНЫЙ АКРОФАЦИАЛЬНЫЙ ДИЗОСТОЗ
Научные статьи в PubMed
- PubMed
Каталожные номера
- Bisecker LG. Секвенирование экзома делает медицинскую геномику реальностью. Нат Жене. 2010 Январь; 42 (1): 13-4. doi: 10.1038/ng0110-13. Цитата на PubMed
- Броснан М.Э., Броснан Дж.Т. Экскреция оротовой кислоты и метаболизм аргинина. Дж Нутр. 2007 г., июнь; 137 (6 Дополнение 2): 1656S-1661S. дои: 10.1093/jn/137.6.1656S. Цитата в PubMed
- Gurrieri F, Kjaer KW, Sangiorgi E, Neri G. Аномалии конечностей: развитие и эволюционные аспекты. Am J Med Genet. 2002 г., 30 декабря; 115(4):231-44. дои: 10.1002/ajmg.10981. Цитата в PubMed
- Neumann L, Pelz J, Kunze J. Новое наблюдение двух случаев акрофациального
дизостоз типа Жене-Видеманна в семье — замечания о типе наследования:
отчет о двух братьях.
 Am J Med Genet. 1996 Сен 6; 64 (4): 556-62. дои:
10.1002/(SICI)1096-8628(19960906)64:43.0.CO;2-N. Цитата в PubMed
Am J Med Genet. 1996 Сен 6; 64 (4): 556-62. дои:
10.1002/(SICI)1096-8628(19960906)64:43.0.CO;2-N. Цитата в PubMed - Ng SB, Buckingham KJ, Lee C, Bigham AW, Tabor HK, Dent KM, Huff CD, Shannon П.Т., Джабс Э.В., Никерсон Д.А., Шендуре Дж., Бамшад М.Дж. Секвенирование экзома идентифицирует причиной менделевской аномалии. Нат Жене. 2010 Январь; 42 (1): 30-5. дои: 10.1038/нг.499. Epub 2009, 13 ноября. Цитирование в PubMed или бесплатная статья на PubMed Central
- Роуч Дж. К., Глусман Г., Смит А. Ф., Хафф К. Д., Хабли Р., Шеннон П. Т., Роуэн Л., Пант К. П., Гудман Н., Бамшад М., Шендуре Дж., Дрманак Р., Джорде Л.Б., Худ Л., Галас Д.Дж. Анализ генетического наследования в семейном квартете с помощью полногеномного секвенирования. Наука. 2010 30 апр;328(5978):636-9. doi: 10.1126/science.1186802. Epub 2010, 10 марта. Цитирование в PubMed или бесплатная статья на PubMed Central
Синдром Миллера-Фишера: симптомы и лечение.

Синдром Миллера-Фишера — очень редкое заболевание нервов, связанное с синдромом Гийена-Барре (СГБ).
Синдром Гийена-Барре поражает примерно одного из 100 000 человек. По оценкам, в США от 3000 до 6000 человек ежегодно заболевают синдромом Гийена-Барре.
Синдром Миллера-Фишера является вариантом синдрома Гийена-Барре. Встречается реже, чем синдром Гийена-Барре. В западных странах он составляет от 1% до 5% всех случаев синдрома Гийена-Барре. Эта доля выше в некоторых странах Восточной Азии. до 19% случаев СГБ на Тайване и до 25% случаев в Японии приходится на случаи синдрома Миллера-Фишера.
Каковы причины синдрома Миллера-Фишера?
Как синдром Миллера-Фишера, так и синдром Гийена-Барре развиваются в ответ на заболевание. Болезнь запускает антитела, чтобы атаковать ваши нервы. Эксперты не уверены, почему это происходит.
Синдром Миллера-Фишера обычно развивается через несколько дней или до 4 недель после заболевания, особенно диарейного заболевания или респираторной инфекции.
Campylobacter jejuni — распространенный вид бактерий, вызывающих синдром Миллера-Фишера и синдром Гийена-Барре. Эти бактерии могут вызывать диарею и боль в животе. Вирусы, вызывающие оба заболевания, включают:
- Зика
- Вирус иммунодефицита человека (ВИЧ)
- Эпштейн-Барр (мононуклеоз)
Каковы симптомы синдрома Миллера-Фишера?
Люди обычно обращаются за медицинской помощью, потому что их зрение быстро ухудшается в течение нескольких дней. У них также могут быть трудности при ходьбе.
Три основных симптома синдрома Миллера-Фишера:
- Слабость глазных мышц, которая приводит к двоению в глазах и затруднению контроля движений глаз (офтальмоплегия)
- Проблемы с координацией конечностей (атаксия)
- Потеря рефлексов в сухожилия (арефлексия)
У некоторых людей также могут быть:
- расширенные или расширенные зрачки
- слабость лицевых мышц
- сниженный рвотный рефлекс
Если у вас есть эти симптомы, а также появляется слабость в дыхательных мышцах и конечностях, у вас может быть перекрывающийся синдром GBS-MFS. Основным симптомом синдрома Гийена-Барре является слабость, которая начинается в ногах и распространяется на руки и тело. У некоторых людей эта слабость распространяется на лицо, горло и дыхательные мышцы.
Основным симптомом синдрома Гийена-Барре является слабость, которая начинается в ногах и распространяется на руки и тело. У некоторых людей эта слабость распространяется на лицо, горло и дыхательные мышцы.
Как диагностируется синдром Миллера-Фишера?
Этот синдром может быть трудно диагностировать, потому что он похож на некоторые другие неврологические заболевания, такие как:
- Базальный менингит
- Ботулизм
- Дифтерия
- Стволовой инсульт
- Стволовой энцефалит
- Миастения гравис
Ваш врач проведет медицинский осмотр и соберет историю болезни. Они могут сделать спинномозговую пункцию (люмбальную пункцию). Многие люди с синдромом Миллера-Фишера имеют высокое содержание белка в спинномозговой жидкости.
Вам также может потребоваться сдать анализ крови на наличие антител к GQ1b. Это антитело обнаружено примерно в 95% людей с синдромом Миллера-Фишера.
Ваш врач может также провести исследование нервной проводимости и электромиографию (ЭМГ). В этих тестах используются небольшие электрические разряды для проверки активности ваших мышц и чувствительных нервов. Если у вас синдром Миллера-Фишера, тесты могут показать аномалии сенсорных нервов.
В этих тестах используются небольшие электрические разряды для проверки активности ваших мышц и чувствительных нервов. Если у вас синдром Миллера-Фишера, тесты могут показать аномалии сенсорных нервов.
Магнитно-резонансная томография (МРТ) головного мозга может быть выполнена для исключения стволового энцефалита и синдрома Гийена-Барре. При синдроме Миллера-Фишера МРТ обычно в норме, но могут быть отклонения при других заболеваниях.
Как лечить синдром Миллера-Фишера?
Синдром Миллера-Фишера неизлечим. Но лечение может помочь вашим симптомам улучшиться быстрее.
Людей с синдромом Миллера-Фишера обычно лечат в больнице. Это позволит врачам исключить синдром Гийена-Барре, который может привести к летальному исходу.
Поскольку синдром Миллера-Фишера связан с синдромом Гийена-Барре, обычно назначают лечение синдрома Гийена-Барре. Эти методы лечения могут включать плазмаферез (плазмаферез) и внутривенное введение иммуноглобулина (ВВИГ).
Внутривенный иммуноглобулин обычно назначается в первую очередь, поскольку он более доступен и удобен, чем плазмаферез.
