Значение, роль и функции белков в клетке. Какую функцию в клетке выполняют белки?
Белки – это важнейшие органические вещества, количество которых преобладает над всеми другими макромолекулами, которые присутствуют в живой клетке. Они составляют больше половины веса сухого вещества как растительных, так и животных организмов. Функции белков в клетке разнообразные, некоторые из них до сих пор остаются неизвестными науке. Но все же основные направления их «работы» хорошо изучены. Одни нужны для того, чтобы стимулировать процессы, протекающие в клетках и тканях. Другие переносят важные минеральные соединения через клеточную мембрану и по кровеносным сосудам от одного органа к другому. Некоторые защищают организм от чужеродных часто патогенных агентов. Ясно одно — без белков не протекает ни один процесс в нашем организме.
Основные функции белков
Функции белков в организме многообразны. Каждая группа имеет определенное химическое строение, совершает одну специализированную «работу». В некоторых случаях несколько типов белков взаимосвязаны друг с другом. Они отвечают за разные этапы одного процесса. Или же влияют сразу на несколько. Например, регуляторная функция белков осуществляется ферментами и гормонами. Это явление можно представить, вспомнив о гормоне адреналине. Он вырабатывается мозговым слоем надпочечников. Поступая в кровеносные сосуды, он повышает количество кислорода в крови. Поднимается и артериальное давление, увеличивается содержание сахара. Это стимулирует обменные процессы. Также адреналин является медиатором нервной системы у рыб, амфибий и пресмыкающихся.
Ферментативная функция
Многочисленные протекающие в клетках живых организмов биохимические реакции осуществляются при высоких температурах и с нейтральным значением рН. В таких условиях скорость их прохождения слишком мала, поэтому нужны специализированные катализаторы, называемые ферментами. Все их разнообразие объединено в 6 классов, которые различаются по специфичности действия. Ферменты синтезируются на рибосомах в клетках. Их изучением занимается наука энзимология.
Несомненно, без ферментов невозможна регуляторная функция белков. Они обладают высокой избирательностью действия. Их активность может регулироваться ингибиторами и активаторами. Кроме того, ферменты обычно проявляют специфичность по отношению к субстратам. Также ферментативная активность зависит от условий в организме и в клетках в частности. На их протекание влияет давление, кислая рН, температура, ионная сила раствора, то есть концентрация солей в цитоплазме.
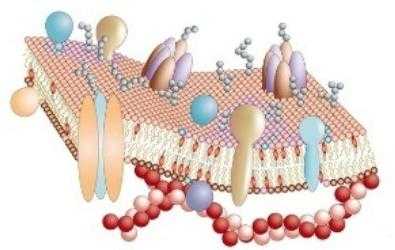
Транспортная функция белков
В клетку должны постоянно поступать необходимые организму минеральные и органические вещества. Они нужны как строительные материалы и источники энергии в клетках. Но механизм их поступления достаточно сложен. Клеточные оболочки состоят не только из белков. Биологические мембраны строятся по принципу двойного слоя липидов. Между ними встроены различные белки. Очень важно, что гидрофильные участки находятся на поверхности мембраны, а гидрофобные — в ее толще. Таким образом, такая структура делает оболочку непроницаемой. Через нее не могут самостоятельно, без «помощи», пройти такие важные компоненты, как сахара, ионы метолов и аминокислоты. Через цитоплазматическую мембрану в цитоплазму их транспортируют специализированные белки, которые вмонтированы в слои липидов.
Транспорт веществ от одних органов к другим
Но транспортная функция белков осуществляется не только между межклеточным веществом и клеткой. Некоторые важные для физиологических процессов вещества приходится доставлять из одних органов в другие. Например, транспортный белок крови – сывороточный альбумин. Он наделен уникальной способностью сформировывать соединения с жирными кислотами, которые появляются при переваривании жиров, с лекарственными препаратами, а также со стероидными гормонами. Важными белками-переносчиками являются и гемоглобин (доставляющий молекулы кислорода), трансферрин (соединяющийся с ионами железа) и церуплазмин (формирующий комплексы с медью).
Сигнальная функция белков
Огромное значение в протекании физиологических процессов в многоклеточных сложных организмах имеют белки-рецепторы. Они вмонтированы в плазматическую мембрану. Служат они для восприятия и расшифровки различного рода сигналов, которые непрерывным потоком поступают в клетки не только от соседних тканей, но и из внешней среды. В настоящее время, пожалуй, самым исследованным белком-рецептором является ацетилхолин. Он находится в ряде межнейронных контактов на мембране клетки.
Но сигнальная функция белков осуществляется не только внутри клеток. Многие гормоны связываются со специфическими рецепторами на их поверхности. Такое сформировавшееся соединение и является сигналом, который активирует физиологические процессы в клетках. Примером таких белков является инсулин, действующий в аденилатциклазной системе.
Защитная функция
Функции белков в клетке различны. Некоторые из них участвуют в иммунных ответах. Это защищает организм от инфекций. Иммунная система способна отвечать на выявленные чужеродные агенты синтезом огромного количества лимфоцитов. Эти вещества способны выборочно повреждать эти агенты, они могут быть чужеродными для организма, например бактерии, надмолекулярные частицы, или это могут быть раковые клетки.
Одна из групп — «бета»-лимфоциты — вырабатывает белки, которые попадают в русло крови. Они имеют очень интересную функцию. Эти белки должны распознавать чужеродные клетки и макромолекулы. Затем они соединяются с ними, формируя комплекс, который подлежит уничтожению. Белки эти называются иммуноглобулинами. Сами чужеродные компоненты – это антигены. А иммуноглобулины, которые им соответствуют – антитела.
Структурная функция
В организме, помимо высокоспециализированных, существуют еще и структурные белки. Они необходимы, чтобы обеспечивать механическую прочность. Эти функции белков в клетке важны для поддержания формы и сохранения молодости организма. Самым известным является коллаген. Это основной белок внеклеточного матрикса соединительных тканей. У высших млекопитающих он составляет до 1/4 общей массы белков. Синтезируется коллаген в фибробластах, которые являются основными клеточками соединительных тканей.
Такие функции белков в клетке имеют огромное значение. Помимо коллагена, известен еще один структурный белок – эластин. Он также является составляющей внеклеточного матрикса. Эластин способен наделять ткани возможностью растягиваться в определенных пределах и легко возвращаться в исходную форму. Еще один пример структурного белка – фиброин, который обнаружен у гусениц шелкопрядов. Это основной компонент шелковых нитей.
Двигательные белки
Роль белков в клетке переоценить невозможно. Они принимают участие и в работе мышц. Мышечное сокращение является важным физиологическим процессом. В результате происходит превращение запасенного в виде макромолекул АТФ в химическую энергию. Непосредственными участниками процесса являются два белка – актин и миозин.
Эти двигательные белки представляют собой нитевидные молекулы, которые функционируют в сократительной системе скелетных мышц. Также они обнаруживаются в немышечных тканях у эукариотических клеток. Еще один пример двигательных белков – тубулин. Из него построены микротрубочки, являющиеся важным элементом жгутиков и ресничек. Также микротрубочки, содержащие тубулин, обнаруживают в клетках нервной ткани животных.
Антибиотики
Огромна защитная роль белков в клетке. Частично ее возлагают на группу, которую принято называть антибиотиками. Это вещества природного происхождения, которые синтезируются, как правило, в бактериях, микроскопических грибах и прочих микроорганизмах. Они нацелены на подавление физиологических процессов других конкурирующих организмов. Открыты антибиотики белкового происхождения были в 40-х годах. Они произвели революцию в медицине, дав ей мощный толчок к развитию.
По своей химической природе антибиотики — весьма разнообразная группа. Они различаются и по механизму действия. Одни препятствуют синтезу белка внутри клеток, вторые блокируют выработку важных ферментов, третьи подавляют рост, четвертые — размножение. Например, хорошо известный стрептомицин взаимодействуют с рибосомами бактериальных клеток. Таким образом, в них резко замедляется синтез белков. При этом данные антибиотики не взаимодействуют с эукариотическими рибосомами организма человека. Это значит, что для высших млекопитающих данные вещества не токсичны.
Это далеко не все функции белков в клетке. Таблица антибиотических веществ позволяет определить и другие узкоспециализированные действия, которые эти специфические природные соединения способны оказывать на бактерии и не только. В настоящее время ведутся изучения антибиотиков белкового происхождения, которые при взаимодействии с ДНК нарушают процессы, связанные с воплощением наследственной информации. Но пока такие вещества используют только при химиотерапии онкологических заболеваний. Примером такого антибиотического вещества является дактиномицин, синтезируемый актиномицетами.
Токсины
Белки в клетке выполняют функцию весьма специфическую и даже неординарную. У ряда живых организмов вырабатываются ядовитые вещества – токсины. По своей природе это белки и сложные низкомолекулярные органические соединения. В качестве примера можно привести ядовитую мякоть гриба бледная поганка.
Запасные и пищевые белки
Некоторые белки выполняют функцию по обеспечению питанием зародышей животных и растений. Таких примеров много. Значение белка в клетке семян злаковых заключено именно в этом. Они будут питать формирующийся зачаток растения на первых стадиях его развития. У животных пищевыми белками являются яичный альбумин и молочный казеин.
Неизученные свойства белков

Приведенные выше примеры — лишь та часть, что уже достаточно изучена. Но в природе остается много загадок. Белки в клетке многих биологических видов уникальны, и в настоящее время даже классифицировать их затруднительно. Например, монеллин — белок, обнаруженный и выделенный из африканского растения. На вкус он сладкий, но при этом не вызывает ожирения и не токсичен. В будущем это может быть превосходная замена сахару. Еще один пример — белок, обнаруженный у некоторых арктических рыб, он препятствует замерзанию крови, действуя как антифриз в буквальном смысле этого сравнения. У ряда насекомых в соединениях крыльев выявлен белок резилин, обладающий уникальной, практически идеальной эластичностью. И это далеко не все примеры веществ, которые только предстоит изучить и классифицировать.
fb.ru
Строение и функции белков
Строение белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка. Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т.п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
spravochnick.ru
|
Строительная: Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
|
Транспортная: |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная: Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
|
Защитная: В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
|
Двигательная: Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
|
Сигнальная: В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
|
Запасающая: В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
|
Энергетическая: При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов - воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
|
Каталитическая: Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Copyright © BioFile 2007-2016 |
biofile.ru
Сайт учителей биологии МБОУ Лицей № 2 города Воронежа
Основные свойства и функции белков
Аминогруппа позволяет аминокислотам выступать в роли оснований и реагировать с кислотами.
Благодаря этому аминокислоты и белки служат буферами, т. е. противодействуют изменениям кислотности и щёлочности, защищая протоплазму клетки.
Для белковой молекулы характерны ещё два свойства: денатурация и ренатурация.
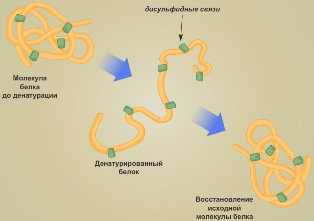 Денатурация — это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. Сначала разрушается четвертичная структура (самая слабая), затем третичная, вторичная и при наиболее жёстких условиях первичная.
Денатурация — это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. Сначала разрушается четвертичная структура (самая слабая), затем третичная, вторичная и при наиболее жёстких условиях первичная.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздаётся структура белка. Такой процесс носит название ренатурации.
Явление денатурации белка знакомо всем: каждый наблюдал, как прозрачное жидкое содержимое яйца после нагревания становится плотным и непрозрачным.
Свойство ренатурации широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например антибиотиков, для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Функции белков в клетке
| Функция | Пояснение |
|---|---|
| Каталитическая | Самый многообразный и наиболее специализированный класс белков — это ферменты. Они отвечают за работу точно и гибко согласованной системы взаимозависимых химических реакций, в результате совместного протекания которых возможна жизнь |
| Структурная | Белки участвуют в формировании клеточных и внеклеточных структур, например, входят в состав клеточных мембран (липопротеиды и гликопротеиды), волос (кератин), сухожилий (коллаген) и др. |
| Двигательная | Сократительные белки — актин и миозин — обеспечивают сокращение мышц у многоклеточных животных |
| Транспортная | В клеточных мембранах присутствуют особые транспортные белки, способные связывать некоторые вещества, например, глюкозу, аминокислоты и переносить их внутрь клеток. Гемоглобин транспортирует кислород и частично углекислый газ |
| Регуляторная | Некоторые гормоны имеют белковую природу. Например, инсулин, регулирующий уровень глюкозы в крови |
| Защитная | Иммуноглобулины (или антитела) обладают способностью распознавать проникшие в организм чужеродные белки или микроогранизмы и обезвреживать их. Фибриноген и протромбин участвуют в процессе свертывания крови и предохрняют организм от кровопотерь. Токсины также можно отнести к белкам, выполняющим защитную функцию |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. |
| Запасающая | Альбумин яиц и казеин молока — резервные белки животных |
| Сигнальная | В мембраны клеток встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды и передавать, таким образом, сигналы в клетку |
Белки-ферменты
Ферменты (лат. fermentum — закваска) — специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме, катализируются соответствующими ферментами.
Вещество, на которое оказывает действие фермент, называется субстратом. Вещества, получающиеся в результате ферментативной реакции, называются продуктами реакции.
Направляя и регулируя обмен веществ, ферменты играют важнейшую роль во всех процессах жизнедеятельности.
Классификация ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя к названию субстрата суффикс -аза (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФ-аза).
По типу катализируемых реакций ферменты подразделяются на 6 классов:
- Оксидоредуктазы катализируют окисление или восстановление (например, каталаза, алкогольдегидрогеназа).
- Трансферазы катализируют перенос химических групп с одной молекулы субстрата на другую (например, киназы, переносящие фосфатную группу с молекулы АТФ).
- Гидролазы катализируют гидролиз химических связей (к этому классу относится большинство пищеварительных ферментов, например, пепсин, трипсин, амилаза, липаза).
- Лиазы катализируют разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
- Изомеразы катализируют структурные или геометрические изменения в молекуле субстрата.
- Лигазы катализируют образование химических связей между субстратами за счет гидролиза АТФ (например, ДНК-полимераза).
Строение и механизм действия ферментов
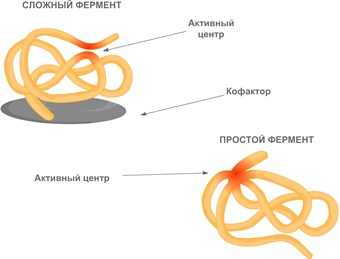 По химической природе ферменты — это глобулярные белки, состоящие либо только из аминокислот, либо в их состав входит небелковый компонент, называемый кофактором.
По химической природе ферменты — это глобулярные белки, состоящие либо только из аминокислот, либо в их состав входит небелковый компонент, называемый кофактором.
Кофакторы могут быть как неорганическими молекулами (например, ионы металлов), так и органическими (например, гем гемоглобина). Кофакторы органической природы, способные отделяться от фермента, называют еще коферментами. Роль коферментов часто играют витамины.
В молекуле фермента выделяют особую часть — активный центр. Это небольшой участок молекулы (от 3 до 12 аминокислотных остатков), где происходит связывание субстрата (или субстратов) и образуется фермент-субстратный комплекс.
Свойства реакций ферментативного катализа
1. Строгая специфичность. Ферменты проявляют строгую специфичность, то есть один фермент катализирует только одну реакцию.
2. Высокая скорость. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз выше скорости реакций, идущих с участием неорганических катализаторов.
Факторы, влияющие на скорость ферментативных реакций
Скорость ферментативных реакций зависит от ряда факторов.
1. Температура. Большинство ферментов может работать при температуре от 0оС до 40оС. При более низкой температуре ферменты неактивны, при более высокой подвергаются денатурации. Поскольку белки в сухом состоянии денатурируют значительно медленнее, чем белки в растворенном виде, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до более высоких температур, чем те же споры или семена в увлажненном состоянии.
2. Концентрация субстрата. При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента. Скорость реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При этом происходит насыщение всех активных центров молекул фермента.
3. Концентрация фермента. Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
4. рН. Для каждого фермента существует оптимальное значение рН, при котором проявляется максимальная каталитическая активность (например, для пепсина оптимум рН=2,0, а для липазы поджелудочной железы рН=9,0).
5. Активаторы и ингибиторы. Скорость работы некоторых ферментов регулируется особыми веществами — активаторами (ускоряют реакцию) и ингибиторами (замедляют реакцию). Эти вещества способны присоединяться к молекулам фермента и либо облегчать связывание активного центра молекулы фермента с субстратом, либо делать невозможным образование фермент-субстратного комплекса.
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность. Существует два типа модификации: присоединение химических групп к боковым остаткам полипептидной цепи и расщепление полипептидной цепи.
< Предыдущая страница «Органические вещества клетки. Белки»
Следующая страница «Органические вещества клетки. Нуклеиновые кислоты» >
biolicey2vrn.ru
ФУНКЦИИ БЕЛКОВ В КЛЕТКЕ — Мегаобучалка
1) Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
2) Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34. Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
3) Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
4) Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
5) Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.
6) Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, NH3. Аммиак NH3 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
7) Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей. Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
— восстановления;
— этерификации;
-алкилирования;
-нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Одним из важнейших свойств белка является гидролиз – разрушение первичной структуры, который протекает ступенчато:
(сложный белок) + Н2О полипептид олигопептид
дипептид α-АК
Белки по составу делятся на:
Простые — протеины (яичный белок – альбумин)
Сложные — протеиды, которые содержат небелковую часть – простетическую группу:
— фосфорную кислоту – фосфопротеины
— углевод – гликопротеины
— нуклеотиды – нуклеопротеины
— липид – липопротеины
— металл – металлопротеины.
megaobuchalka.ru
Виды белков, их функции и структура
По теории Опарина-Холдейна жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения — основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
Белки: общее понятие
С точки зрения химического строения, молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
- карбоксильную -СООН;
- амино-группу -NH2.
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы — ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в сыром виде. Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток — это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.
Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды структур белка определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой — глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей — это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур — альбумин, фиброин, белок шелка и прочие.
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.

Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся «белок» — это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.
Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство — гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения — гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример — глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними «в бой», выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные — те, что содержат все необходимые для организма аминокислоты;
- неполноценные — те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- соя;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.
Белки в клетке
Внутри самой маленькой структурной единицы всего живого — клетки — также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных видов протеинов, которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.
- Глобулярные белки. Это такие, которые представлены третичной структурой, то есть плотно упакованной глобулой. Примеры таких структур следующие: иммуноглобулины, значительная часть ферментов, многие гормоны.
- Фибриллярные белки. Представляют собой строго упорядоченные нити, имеющие правильную пространственную симметрию. К данной группе относятся протеины с первичной и вторичной структурой. Например, кератин, коллаген, тропомиозин, фибриноген.
Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен веществ просто невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы — это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.
fb.ru
Основные биологические функции белков
Белки входят в состав каждой клетки и составляют около 50% ее сухой массы. Они играют ключевую роль в обмене веществ, реализуют важнейшие биологические функции, лежащие в основе жизнедеятельности всех организмов.
Среди большого разнообразия функций, выполняемых белками, первостепенное значение имеют структурная, или пластическая, и каталитическая. Это универсальные функции, поскольку они присущи всем живым организмам.
Структурные белки формируют каркас внутриклеточных органелл и внеклеточных структур, а также участвуют в стабилизации клеточных мембран. Такие структурные белки, как коллаген и эластин составляют основу соединительной и костной тканей высших животных и человека. Структурными белками, в частности, являются кератины кожи, волос, ногтей, шерсти, когтей, рогов, копыт, перьев, клювов, а также фиброин шелка, паутины.
Каталитически активными белками являются ферменты. Они ускоряют химические реакции, обеспечивая тем самым необходимые скорости протекания обменных процессов в клетке.
Многие белки, присущие отдельным живым организмам, выполняют специфические функции, среди которых наиболее важными являются транспортная, регуляторная, защитная, рецепторная, сократительная, запасная и некоторые др.
Транспортные белки переносят различные молекулы и ионы внутри организма. Например: гемоглобин — кислород от легких к тканям; миоглобин — кислород внутри клеток; сывороточный альбумин с током крови — жирные кислоты, а также ионы некоторых металлов. Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Регуляторные белки участвуют в регуляции обмена веществ как внутри клеток, так и в целом организме. Например, такие сложные процессы, как биосинтез белков и нуклеиновых кислот, протекают под строгим «контролем» множества регуляторных белков. Специфические белковые ингибиторы регулируют активность многих ферментов.
Защитные белки формируют защитную систему живых организмов. Например, иммуноглобулины (антитела) и интерфероны предохраняют организм от проникновения в его внутреннюю среду вирусов, бактерий, чужеродных соединений, клеток и тканей. Белки свертывающей системы крови — фибриноген, тромбин — препятствуют потере крови при повреждениях кровеносных сосудов.
Рецепторные белки воспринимают сигналы, поступающие из внешней среды, и воздействуют на внутриклеточные процессы. Например, белки-рецепторы, сосредоточенные на поверхности клеточных мембран, избирательно взаимодействуют с регуляторными молекулами (например, гормонами).
Рецепторными белками являются родопсин, участвующий в зрительном акте, вкусовой сладкочувствительный и обонятельный белки.
Сократительные белки способны преобразовывать свободную химическую энергию в механическую работу. Например, белки мышц миозин и актин обеспечивают мышечное сокращение.
Запасные белки представляют собой резервный материал, предназначенный для питания развивающихся клеток. Запасными белками являются яичный альбумин, глиадин пшеницы,
Казеин кукурузы, казеин молока и многие другие. Запасные белки — существенный источник пищевого белка для человека.
Некоторые организмы вырабатывают токсические белки. Таковы яды змей, дифтерийный токсин, рицин семян клещевины, лектины семян бобовых и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info