7 Примеры реакции замещения: подробные пояснения —
Примеры реакции замещения имеют место, когда реагент заменяется другим реагентом. Это исследование будет представлять подробные объяснения примеров реакции смещения.
Ниже перечислены некоторые эффективные примеры реакций смещения:
Пример 1: Реакция одиночного замещенияВ этих реакциях с одним замещением только один из реагентов высвобождает ион и заменяет другой реагент с образованием нового соединения.
Реакция между железом и сульфатом меди является идеальным и простейшим примером реакции одиночного замещения. Здесь сульфат меди высвобождает ион сульфата, который присоединяется к металлическому железу и дает сульфат железа и металлическую медь.
Уравнение:
Fe + CuSO4 = FeSO4 + Cu
Кроме того, когда металлический цинк реагирует с соляной кислотой, можно заметить, что происходит одиночная реакция замещения. В этой реакции образуется хлорид цинка, когда ион хлорида присоединяется к металлическому цинку. В результате реакции образуются пузырьки, что указывает на образование газообразного водорода.
В результате реакции образуются пузырьки, что указывает на образование газообразного водорода.
Уравнение:
Zn + 2HCl = ZnCl2 + h3
Другой эффективный пример реакции одиночного замещения можно объяснить, это реакция между оксидом железа и коксом. Кокс заменяют углекислым газом, и в качестве продукта получают свободное металлическое железо.
Уравнение:
2Fe2O3 +3C = 4Fe + 3CO2
Узнайте больше о Реакция смещения
Пример 2: Двойная реакция замещенияКогда две соли реагируют друг с другом, и оба реагента замещаются друг другом, например, положительные и отрицательные ионы обмениваются друг с другом, такой тип реакции замещения называется реакцией двойного замещения.
Реакция между сульфидом натрия и соляной кислотой дает хлорид натрия и сероводород. Здесь сульфид натрия обменивает свой сульфид-ион на HCl, а HCl обменивает свой хлорид-ион на сульфид натрия.
Уравнение:
Na2S + 2HCl = 2NaCl + h3S
Кроме того, при взаимодействии нитрата серебра с хлоридом натрия они обмениваются своими анионами с образованием хлорида серебра и нитрата натрия.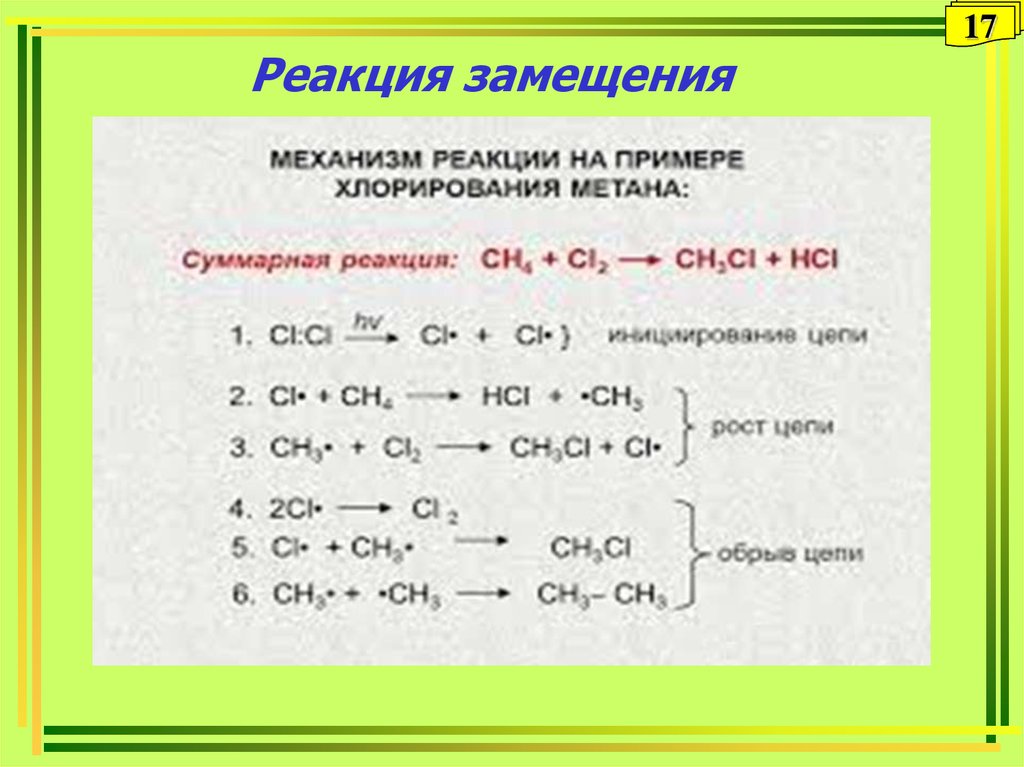 Это пример осадков реакция также. Было установлено, что здесь осаждается AgCl.
Это пример осадков реакция также. Было установлено, что здесь осаждается AgCl.
Реакция между хлоридом бария и сульфатом натрия дает осадок сульфата бария и хлорид натрия.
Уравнение:
BaCl2 + 2NaSO4 = Ba(SO4)2 + 2NaCl
Пример 3: Примеры реакции замещения на основе реакционной способности элементовРеакция замещения происходит в зависимости от реакционной способности металлов. Более реакционноспособные металлы легко замещают менее реакционноспособные металлы в соединениях. Это основная причина реакции смещения.
Ряд реакционных металлов для от ВикипедияКогда свинец вступает в реакцию с хлоридом меди, он выделяет хлорид свинца и свободную металлическую медь. Поскольку свинец более реакционноспособен, чем медь, он легко разрушает связь между медью и ионом хлора.
Уравнение:
Pb + CuCl2 = PbCl2 + Cu
Другой Пример можно описать, упомянув реакцию между цинком и медным купоросом. Это реактивный цинк становится успешным в извлечении иона сульфата из сульфата меди с ума дает сульфат цинка.
Это реактивный цинк становится успешным в извлечении иона сульфата из сульфата меди с ума дает сульфат цинка.
Уравнение:
Zn + CuSO4 = ZnSO4 + Cu
Пример 4: Кислотно-основные реакцииРеакции нейтрализации между кислотой и основанием считаются яркими примерами реакции замещения. Когда кислота нейтрализует основание, замена ионов среди кислот и оснований имеет место и поддерживает принцип реакции смещения. Здесь в любом случае имеет место реакция двойного вытеснения.
Например, когда соляная кислота вступает в реакцию с гидроксидом калия, она нейтрализует основание и достигает определенного нейтрального уровня pH, замена соляной кислоты меняет ион хлорида на калий и дает природную соль хлорида калия.
Уравнение;
HCl + КОН = KCl + h3O
Приготовление поваренной соли происходит по тому же принципу, что и описанное выше. NaCl обычно называют поваренной солью. Когда сильная соляная кислота реагирует с сильным основанием гидроксидом натрия, образуется поваренная соль и вода.
Уравнение:
HCl + NaOH = NaCl + h3O
Это пример реакции сильной кислотно-основной нейтрализации.
Узнайте больше о Реакция нейтрализации
Пример 5: Ржавление железаРжавчина лучше всего пример окисления реакция, а также реакция замещения. Когда вещи, сделанные из металлического железа, находятся на открытом воздухе, газообразный кислород окисляет металлическое железо, в результате чего образуется красновато-коричневый слой.
В этой реакции металл (железо) замещается под действием газообразного кислорода, и в результате этой реакции замещения образуется ржавчина, которая представляет собой Fe2O3, h3O. Влажный воздух является причиной окисления ионов металлов.
Ржавление происходит как примеры реакции вытеснения из ВикипедияПоскольку эта реакция окисления происходит путем замены металла его оксидом, эта реакция рассматривается как один из практических примеров реакции замещения.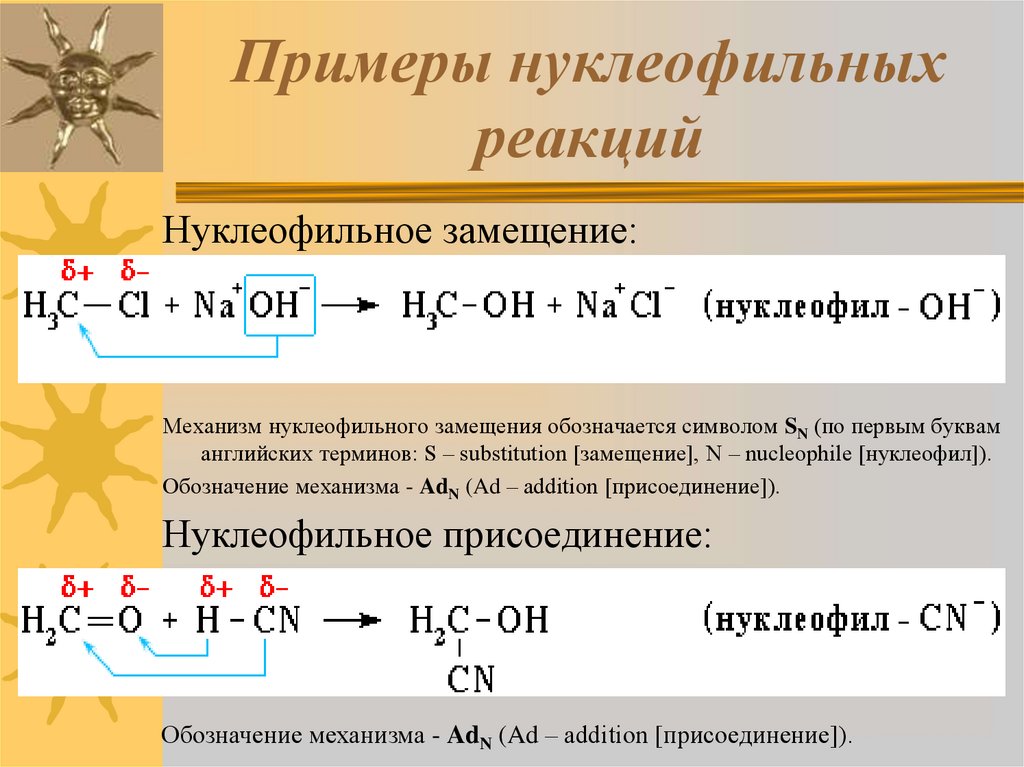
Реакция выпечки соды а уксус — один из лучших примеров реакции замещения. Эта реакция происходит в два этапа, первая реакция является реакцией двойного замещения.
Уксусная кислота, содержащаяся в уксусе, реагирует с карбонат натрия в пищевой соде. Эта реакция происходит путем замены как уксусной кислоты, так и карбоната. Следовательно, это происходит при соблюдении принципов реакции двойного вытеснения.
Реакция между уксусом и пищевой содой из ВикипедияПродуктами реакции являются ацетат натрия и угольная кислота. Затем нестабильная угольная кислота разлагается, и следующая реакция протекает как реакция разложения.
Уравнение:
NaHCO3 + HC2h4O2 = NaC2h4O2 + h3CO3
Это простой пример реакции двойного замещения.
Пример 7: ФотосинтезРеакция одиночного смещения происходит в процессе фотосинтеза. Это основной процесс изготовления пищи растений.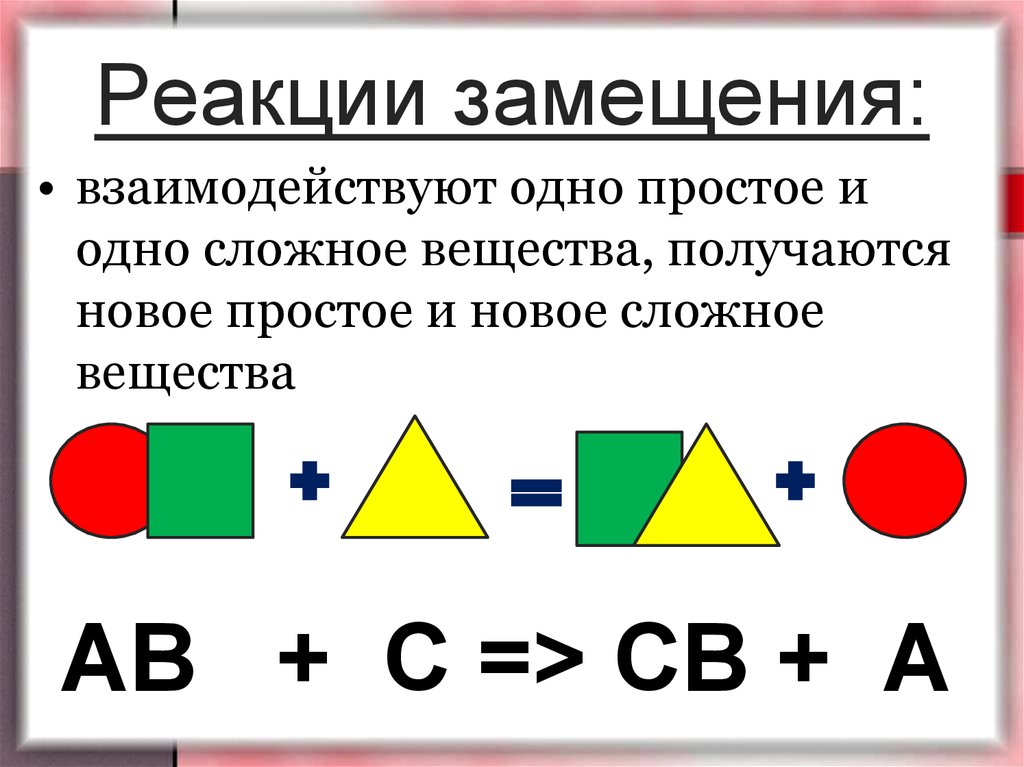 Однократная реакция замещения протекает в течение Цикл Кальвина. В легкой реакции, когда молекулы водорода отделяются от молекулы воды, чтобы заменить молекулы углекислого газа с образованием глюкозы.
Однократная реакция замещения протекает в течение Цикл Кальвина. В легкой реакции, когда молекулы водорода отделяются от молекулы воды, чтобы заменить молекулы углекислого газа с образованием глюкозы.
Уравнение:
6СО2 + 6Н2О = С6Н12О6 + 6О2
Поскольку только один реагент заменяется другим, это реакция относится к категории реакции одиночного замещения. Эта реакция также взята в качестве примера комбинированной реакции. Однако при фотосинтезе реакция замещения протекает достаточно интенсивно.
Пример 8: Клеточное дыханиеРеакция двойного замещения имеет место при клеточном дыхании. Это не единичная реакция. Замечено, что здесь протекают как реакции окисления, так и восстановления. Поэтому это отличный пример окислительно-восстановительной реакции.
С другой стороны, эта реакция надежна, поглощая свойства экзергонической реакции. То есть он выделяет определенное количество энергии с продуктами. Свойства двойного смещения можно показать на клеточное дыхание так же.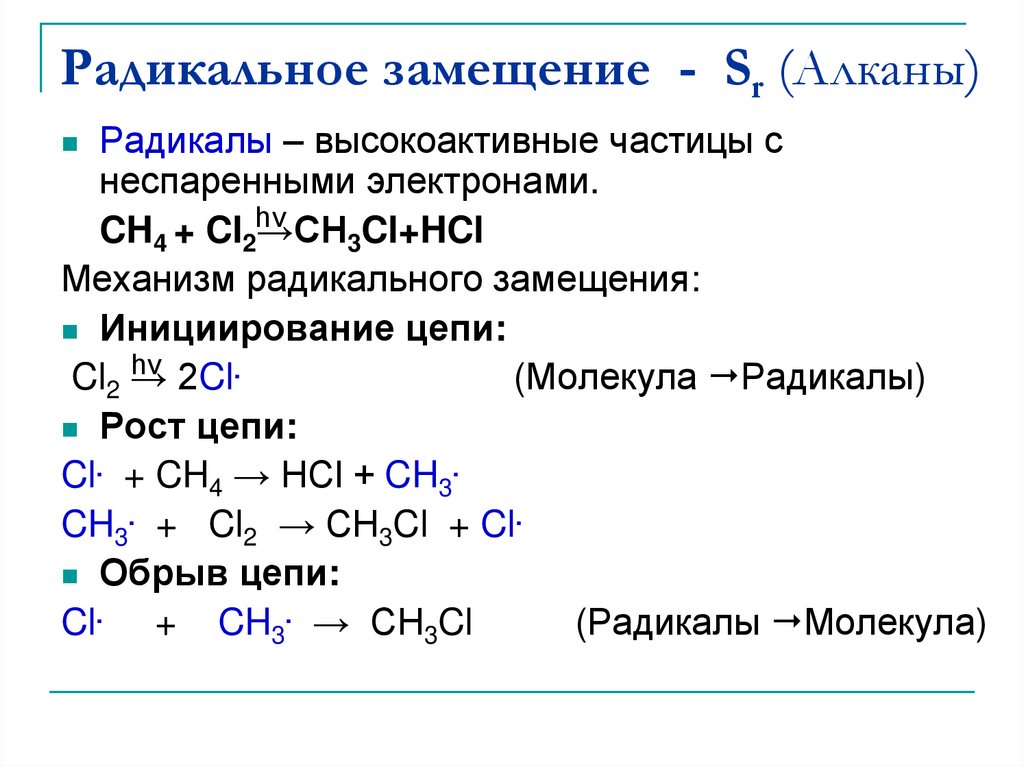
Когда глюкоза окисляется, а газообразный кислород восстанавливается, каждый из реагентов заменяется другим реагентом. Следовательно, это реакция двойного замещения.
Уравнение:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О
Часто задаваемые вопросы (FAQ)Вопрос 1: Существует ли возможность реакции замещения, когда менее реакционноспособный металл вступает в реакцию с соединением, содержащим более реакционноспособный металл?Ответ: Менее активный металл не может вытеснить более активный металл, поскольку более активный металл имеет тенденцию создавать стабильную связь с ионами. Становится труднее разорвать эту связь для менее реактивного металла. Следовательно, реакция замещения не может иметь место в этом виде реакции.
Вопрос 2: Считаются ли кислотно-основные реакции реакцией замещения? Если да, то какой тип реакции замещения происходит в кислотно-основных реакциях?Ответ: Реакция нейтрализации между кислотой и основанием является Пример реакции смещения. Обмен ионами друг с другом для получения нейтральной соли является основным фактом реакции замещения между кислотами и основаниями.
Обмен ионами друг с другом для получения нейтральной соли является основным фактом реакции замещения между кислотами и основаниями.
Эти реакции являются реакцией двойного замещения, поскольку и кислота, и основание заменяют друг друга путем обмена ионами.
Вопрос 3. Как зависит реакция замещения от реакционной способности металлов?Ответ: Когда более реакционноспособные металлы вступают в реакцию с соединением, содержащим менее реакционноспособные металлы, эти более реакционноспособные металлы проявляют тенденцию вытеснять менее реакционноспособный металл из соединения, занимая место этого менее реакционноспособного соединения и укрепляя новое соединение. Таким образом, реакция замещения зависит от реакционной способности металлов.
Вопрос 4. Какой тип реакции замещения можно отметить при фотосинтезе?Ответ: Замечено, что при фотосинтезе происходит реакция одиночного замещения, когда глюкоза образуется в результате замещения газообразного кислорода из углекислого газа.
Ответ: На первой стадии реакции происходит двойное смещение. Уксус содержит уксусную кислоту, заменяется натрием и получается ацетат натрия, а карбонат заменяется на углекислый, получая молекулу водорода.
Из-за нестабильной природы угольной кислоты она разлагается и реакция разложения происходит на следующем шаге.
Узнайте больше о реакция разложения
Реакции замещения и обмена. Химия. 8 класс. Конспект урока – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
УМК «Химия. 8 класс» О. В. Габриеляна.
Тип урока: комбинированный.
Цели:
- образовательные: дать понятие о сущности реакций замещения, обмена; продолжить формирование умения записывать уравнения химических реакций и предвидеть продукты реакций замещения и обмена.
- развивающие: развитие самостоятельных умений и навыков; развитие практических умений и навыков; развитие бережливости и аккуратности.
- воспитательные: продолжить формирование взаимопомощи; доброжелательное отношение друг к другу; умения выслушать других при работе в классе, группе.
Задачи: развивать умения записывать уравнения реакций и расставлять коэффициенты, распознавать реакции замещения и обмена среди остальных типов химических реакций.
Использованные источники:
- О.С.Габриелян. Химия. 8–9 классы: Методическое пособие-2-е издание. – М.: Дрофа, 2000.
- О.С.Габриелян, Н.П.Воскобойникова, А.В.Яшукова. «Химия. 8 класс». Настольная книга для учителя.
 – М.: Дрофа, 2004.
– М.: Дрофа, 2004.
I. Организационный момент
II. Проверка домашнего задания
– Фронтальный опрос (что такое химическая реакция, назовите признаки химических реакций, какие типы химических реакций вы знаете, что такое реакция соединения, что такое реакция разложения).
– Опрос у доски (выполнение упражнений после §27, упр. 3).
III. Актуализация знаний учащихся
– Допишите уравнения реакций и определите, к какому виду они относятся:
Fe + Cl2 → ? (FeCl2 – реакция соединения.)
2CaO → 2Ca + ? (O2 – реакция разложения.)
Fe + CuSO4 → FeSO4 + ? (Cu –реакция замещения.)
IV. Изучение нового материала
– К какому типу относится эта реакция? Это мы и узнаем сегодня на уроке. (Проведение лабораторного опыта.)
Инструкция по выполнению опыта №1
Техника безопасности:
- Соблюдайте осторожность при работе со стеклянной посудой.
- Используйте небольшое количество раствора сульфата меди (II).
- На столе соблюдайте чистоту и порядок.
- Работу выполняйте на своём рабочем столе над подносом.
- Будьте внимательны и аккуратны при выполнении лабораторного опыта.
Содержание и порядок выполнения опыта:
- Налейте в 2 пробирки по 2 мл раствора сульфата меди(II) – CuSO4. Опишите цвет вещества.
- Осторожно погрузите в 1 из пробирок железный гвоздь. Опишите условия протекания реакции. Наблюдения и выводы сделайте через 7–10 минут (на реакцию нужно время). Назовите признаки реакции.
- Извлеките гвоздь из раствора и опишите произошедшие с ним изменения. Образованием, какого вещества они вызваны?
- Опишите и сравните цвет образовавшегося и исходного растворов.
- Напишите уравнение реакции взаимодействия CuSO4 с Fe, учитывая, что при этом образуется сульфат железа (II) – FeSO4.

– Что же называют реакцией замещения? (Атомы простого вещества замещают атомы одного из элементов в сложном веществе).
Демонстрация
– В пробирку с раствором щёлочи (NaOH) прильём несколько капель ф-ф, а затем – избыток кислоты (HCl): раствор обесцвечивается:
NaOH + HCl
(Работа с таблицей индикаторов.)
– А что получилось? (NaCl + HOH, т.к. разноимённые частички притягиваются).
– Верно, в 1-й пробирке реакция была щелочная, в другой – кислотная, а получилась нейтральная. Отсюда и название реакции – нейтрализации.
– Реакции нейтрализации – это случай реакций обмена, т.е. реакций, в результате которых два сложных вещества обмениваются своими составными частями, например ионами.
Na+OH– + H+Cl– = NaCl + H2O
– А только ли щёлочи дают реакцию нейтрализацию? Ведь есть ещё и нерастворимые основания (проведение лабораторного опыта).
Инструкция по выполнению опыта №2
Техника безопасности:
- Соблюдайте осторожность при работе со стеклянной посудой.

- Используйте небольшое количество раствора сульфата меди (II) и гидроксида натрия.
- На столе соблюдайте чистоту и порядок.
- Работу выполняйте на своём рабочем столе над подносом.
- Будьте внимательны и аккуратны при выполнении лабораторного опыта.
Содержание и порядок выполнения опыта:
- Налейте в одну пробирку 2 мл раствора раствора сульфата меди(II) – CuSO4 . Опишите цвет вещества.
- Осторожно добавьте в пробирку, содержащую раствор сульфата меди(II) – CuSO
- Опишите произошедшие изменения. Образованием, какого вещества они вызваны? Назовите признаки реакции.
- Опишите и сравните цвет образовавшихся веществ и исходных растворов.
- Напишите уравнение реакции взаимодействия CuSO4 с NaOH, учитывая, что при этом образуется гидроксид меди(II) – Cu(OH)2 и сульфат натрия – Na2SO4.
 Расставьте коэффициенты в уравнении реакции.
Расставьте коэффициенты в уравнении реакции.
– Запишите уравнение реакции.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
– Проведём реакцию нейтрализации (демонстрация) – к полученномуCu(OH)2 добавимсерную кислоту (H2SO4). Реакция прошла успешно, т.к. осадок растворился:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
V. Закрепление
Выполнение упражнений («Рабочая тетрадь», с. 105 – упр.1а,б,в. – у доски; с. 106 – упр. 4; с. 107 – упр. 2.)
VI. Подведение итогов урока
VII. Домашнее задание
§31, упр.1 – 3; §32, упр.1 – 4.
Когда и как это делать
- Главная
- Замена и Многоточие
- Замена
Замена в английской грамматике — это замена слова, фразы или предложения в предложении другим словом или фразой (например, one, do, this) во избежание повторения ранее использованного слова.
В этих примерах замены слово/фраза, выделенная синим цветом, позже была заменена словом, выделенным красным цветом:
Мой муж хочет поехать в Испанию, но мне там не нравится.
Он обнаружил, что провалил экзамен. Это очень расстроило его.
Все торты выглядят красиво, но можно мне тот, что с глазурью, пожалуйста?
Вот некоторые общие слова и фразы, которые мы используем для замены в английской грамматике.
Примеры замены в английской грамматике
Да и Нет
Мы часто используем слова да и нет вместо длинных последовательностей других слов. Это клаузальных замен , так как они заменяют целые пункты:
A: Вы знаете, что хотите посмотреть по телевизору сегодня вечером?
Б: Да. (= Я знаю, что я хочу посмотреть по телевизору сегодня вечером)
Здесь и Там
Мы используем такие слова, как здесь и там в качестве замены в английской грамматике , чтобы заменить детали о месте. Другими словами, чтобы заменить наречия места:
Другими словами, чтобы заменить наречия места:
- Джон пригласил меня поужинать в Toni’s Italian, но я не хотел туда идти, так как в выходные там очень многолюдно.
- Я так рада, что переехала в Австралию. Надеюсь, ты однажды навестишь меня здесь.
Тогда и в то время
, чтобы заменить подробности о времени (наречия времени), мы используем такие слова, как , затем и в то время:
- Он предложил нам пойти в 5 часов, но я не хотел тогда идти.
- Я предпочитаю ездить за границу на Рождество, и мои друзья тоже любят ездить в это время года.
Один, Один и Тот же
Их часто называют именными заменами , поскольку они заменяют существительные в предложении:
- Оба курса выглядят хорошо, поэтому я не уверен, какой из них выбрать.
- Мы закончили этот кроссворд. Вы хотите начать еще один?
- Не покупайте эти туфли — я думаю, вы можете найти и получше.

- Он хочет гамбургер из говядины с сыром, и я думаю, что возьму такой же.
Делать
Это часто называют словесной заменой , так как это вспомогательный глагол, используемый для замены глаголов или глагольных фраз:
- Я уверен, что вы вернетесь домой раньше, чем я.
Мы также иногда комбинируем и с , поэтому и — это одно и то же , чтобы заменить:
- Он тренируется каждый день. Вы должны сделать то же самое.
- Оливия любит блины, и Джейн тоже.
Так или нет
Эти два слова обычно используются для замены предложений, и поэтому они являются заменой предложений .
А: Как вы думаете, Джон сдаст экзамен по вождению с первого раза?
B: Нет, я не думаю, , поэтому
ИЛИ
B: Я думаю, , а не 9 0088
То и то
Мы используем это и то для замена в английской грамматике для обозначения более длинных фрагментов текста, которые обычно не могут быть связаны с определенной частью предложения, как в приведенных выше примерах.
Они будут классифицироваться как замены пунктов , поскольку они заменяют целые пункты:
- В стране инфляция и рост безработицы. Это/это создаст проблемы для правительства на выборах.
- Она даже не удосужилась меня поблагодарить, и поэтому я больше не буду ей помогать.
Это и , что часто взаимозаменяемы при замене, как в первом примере, но мы используем , что , чтобы отмежеваться от чего-то или кого-то, как во втором примере.
Теперь проверьте себя в этом тесте на замену >>
Подробнее о замене и многоточии:
Подпишитесь на бесплатные советы по грамматике, тесты и уроки, прямо в ваш почтовый ящик
90 010 Подпишитесь на бесплатную грамматику Советы в ваш почтовый ящик!Новинка! Комментарии
Есть вопросы или комментарии по поводу грамматики, обсуждаемой на этой странице?
Оставьте свой комментарий здесь.
Замена
«Заменить» означает поставить вместо другого.
Замена
В алгебре «подстановка» означает подстановку чисел вместо букв:
| Когда у нас есть: | х — 2 | |
| А мы знаем, что х=6 … | |
|
| … тогда мы можем заменить 6 на x : | 6 — 2 = 4 |
Пример: Когда x=2, сколько будет
10/x + 4 ?Поместите «2», где «х»:
10/2 + 4 = 5 + 4 = 9
Пример: Когда x=5, сколько будет
x + x/2 ?
Поставьте «5», где «х»:
5 + 5/2 = 5 + 2,5 = 7,5
Пример: если x=3 и y=4, то чему равно
x 2 + xy ?Поставьте «3» вместо «x» и «4» вместо «y»:
3 2 + 3×4 = 3×3 + 12 = 21
Пример: если x=3 (но мы не знаем «y»), то чему равно
x 2 + xy ?Поставьте «3», где «х»:
3 2 + 3y = 9 + 3 года
(насколько это возможно)
Как показал последний пример, мы не всегда можем получить число для ответа, иногда просто более простую формулу.
