Сера — биологическая роль
Обратно в Витамины и минералыОбмен веществ
Эндокринная система
Красота и здоровье кожи
Сера является структурным макроэлементом, ее содержание в организме взрослого человека составляет около 140 г.
Сера в значительных количествах также находится и в растениях, где она содержится виде неорганических и органических соединений (содержащие серу гликозиды, аминокислоты и пр.).
Биологическая роль
Как и элементы органогены, сера в виде отдельного элемента не обладает биологическим значением. Ее биологическая роль состоит в том, что она входит в структуру таких аминокислот, как цистеин и метионин, которые и выполняют в животных организмах (в том числе у человека), ряд незаменимых функций:
- придает необходимую для их функционирования пространственную организацию молекулам белков за счет образования дисульфидных мостиков
- является компонентом многих ферментов, гормонов (в частности — инсулина), и серосодержащих аминокислот
- является компонентом таких активных веществ, как гистамин, витамина биотин, витаминоида липоевой кислоты и др.

- сульфгидрильные группы образуют активные центры ряда ферментов
- обеспечивает передачу энергии в клетке: атом серы принимает на свободную орбиталь один из электронов кислорода
- участвует в переносе метильных групп
- входит в состав коэнзимов, включая коэнзим А
Какие продукты содержат серу
Наиболее важными источниками серы являются: яйцо, кунжут, соя, курица, тунец, ростки пшеницы, овес, орехи, кукуруза, фасоль, капуста, чечевица, нежирная говядина, молоко, рыба, моллюски, сыры, гречневая крупа, хлебобулочные изделия.
Дефицит серы
Причины дефицита серы
- нарушение обмена
Возможные последствия дефицита серы:
Клинические описания специфических расстройств, вызванных недостатком серы в рационе, отсутствуют.
- патологии печени, суставов, кожи
- нарушения метаболизма серосодержащих соединений
Избыток серы
Некоторые соединения серы обладают высокой токсичностью – сероуглерод, сероводород, оксиды серы. Отравление этими веществами происходит в результате работы во вредных условиях труда, пожаров на химических складах, неблагоприятных условиях окружающей среды.
Отравление этими веществами происходит в результате работы во вредных условиях труда, пожаров на химических складах, неблагоприятных условиях окружающей среды.
Использование серосодержащих соединений (сульфитов) в качестве консервантов в пищевых продуктах является одной из возможных причин избыточного поступления серы в организм человека. Некоторые исследователи считают, что увеличение поступления в организм сульфитов отвечает за повышение заболеваемости бронхиальной астмой. Для профилактики отрицательного влияния сульфитов рекомендуется увеличить в рационе содержание сыра, яиц, жирного мяса, птицы.
Причины избытка серы:
- чрезмерное поступление серы или ее соединений
- нарушение обмена
Последствия избытка серы:
- анемия
- болезни верхних дыхательных путей, бронхит
- кожный зуд, фурункулез
- боли в глазах, ощущение «песка» в глазах, появление мелких дефектов на роговице, светобоязнь, слезотечение
- общая слабость
- головные боли, головокружение, снижение слуха, психические нарушения, понижение интеллекта
- расстройства пищеварения, поносы, тошнота
- снижение массы тела
Суточная потребность в сере:
оценивается на уровне 4-5 грамм (обратите внимание, необходима не сама сера, а ее соединения)
Обратно в Витамины и минералы
Презентация «Биологическое значение серы» | Презентация к уроку по химии (9 класс) на тему:
Слайд 1
Биологическое значение серы.
Слайд 2
Сера ( S ) – один из основных элементов в организме человека, занимающий по значению 4 место после кислорода, воды и солей – это биогенный элемент
Слайд 3
Растения 0,3 – 1,2 % СОДЕРЖАНИЕ СЕРЫ Человек 0,16 % Животные 0,5 – 2,0 %
Слайд 4
СЕРА кожа суставы печень мышцы кровь ногти волосы Витамин В1 белок инсулин
Слайд 5
СЕРА — это элемент чистоты организма. При её нехватке страдает кожа: она приобретает грязный, нездоровый вид, появляются различные высыпания, шелушения, пятна, при недостатке — хрупкость костей, болезненность суставов, тусклость и выпадение волос, снижается иммунитет от количества серы зависит твердость и прочность ногтей,
Слайд 6
В организме человека – около 1400 г серы Суточная потребность – 4,5 грамма
Слайд 7
Продукты, содержащие серу говядина рыба капуста сыр молоко яйца фасоль чеснок лук бобовые
Слайд 8
Продукты, содержащие серу
Слайд 9
Сера, входящая в состав чеснока и дающая ему его специфически острый аромат, уменьшает количество вредного холестерина, понижает кровяное давление и даже снижает риск рака желудка .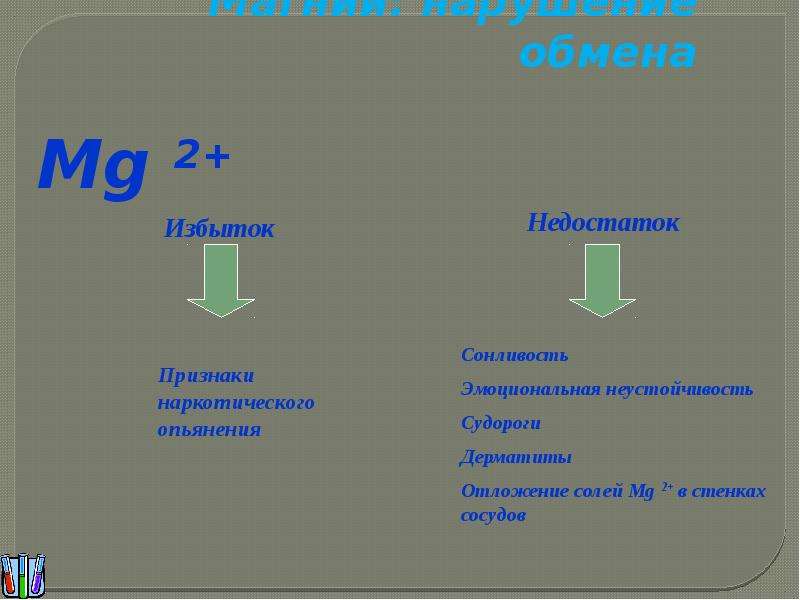 Если зубчики чеснока воткнуть в горшок с растением, они защитят его от грибных заболеваний и будут способствовать укреплению его иммунной системы. Продукты, содержащие серу
Если зубчики чеснока воткнуть в горшок с растением, они защитят его от грибных заболеваний и будут способствовать укреплению его иммунной системы. Продукты, содержащие серу
Слайд 10
ЛУК – от семи недуг « Кто ест лук, того Бог избавит от мук » Он положительно влияет на работу головного мозга. Соединения серы, входящие в его состав, легко усваиваются организмом и предотвращают преждевременно старение головного мозга. Лук повышает восприимчивость положительных эмоций, а также способствует восстановлению памяти. Соединения серы омолаживают клетки головного мозга и стимулируют их активность. Он укрепляет иммунитет и содействует общему оздоровлению организма. Полезнее всего употреблять лук, растертый с медом.
Слайд 11
Сера в медицине CaSO 4 · 2 H 2 O альбуцид
Слайд 12
Пока наши знания о сере — это лишь вершина айсберга, большая часть которого скрыта под водной поверхностью и ждет своих исследователей. Шигеру Оае (крупнейший японский биохимик)
Слайд 13
Успехов в изучении химии !
Биологическая роль р-элементов VIA группы.
 Применение их соединений в медицине
Применение их соединений в медицине
Кислород
По содержанию в организме человека (62%) кислород относится к макроэлементам. Он незаменим и относится к числу важнейших элементов, составляющих основу живых систем, т. е. является органогеном. Кислород входит в состав огромного числа молекул, начиная от простейших и кончая биополимерами. Велика роль кислорода в процессах жизнедеятельности, так как окисление кислородом питательных веществ (углеводов, белков, жиров) служит источником энергии, необходимой для работы органов и тканей живых организмов. Большинство окислительно-восстановительных реакций в организме протекает при участии кислорода и его активных форм.
Фагоцитарные (защитные) функции организма также связаны с наличием кислорода, и уменьшение содержания кислорода в организме понижает его защитные свойства. В фагоцитах (клетках, способных захватывать и переваривать посторонние тела) кислород 0
В медицинской практике кислород применяют для вдыхания при болезненных состояниях, сопровождающихся кислородной недостаточностью (гипоксией), заболеваниях дыхательных путей, сердечнососудистой системы, отравлениях оксидом углерода (II) СО, синильной кислотой HCN, а также при заболеваниях с нарушениями функций дыхания.
Широко используется в клинической практике гипербарическая оксигенация — применение кислорода под повышенным давлением.
Гипербарическая оксигенация
Аллотропную модификацию кислорода — озон О3 как очень сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды.
Сера
По содержанию в организме человека (0,16%) сера относится к макроэлементам. Как и кислород, она жизненно необходима. Суточная потребность взрослого человека в сере около 4—5 г. Сера входит в состав многих биомолекул белков, аминокислот (цистина, цистеина, метионина и др.), гормонов (инсулина), витаминов (витамин B1 ). Много серы содержится в каротине волос, костях, нервной ткани.
В живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Кроме того, образуются тиосульфаты, цементная сера и политионовые кислоты.
Селен
По содержанию в организме (10−5—10−7%) селен относится к микроэлементам. Некоторые исследователи относят его к жизненно необходимым элементам.
Некоторые исследователи относят его к жизненно необходимым элементам.
Селен поступает с пищей 55—110 мг в год. Селен в основном концентрируется в печени и почках. Концентрация селена в крови составляет 0,001—0,004 ммоль/л.
Несомненна связь селена с серой в живых организмах. При больших дозах селен в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты.
Известна и способность селена предохранять организм от отравления ртутью Hg и кадмием Cd. Селен способствует связыванию этих токсичных металлов с другими активными центрами, с теми, на которые их токсическое действие не влияет. Интересен факт взаимосвязи между высоким содержанием селена в рационе и низкой смертностью от рака.
В больших дозах селен токсичен. Распад соединений селена в организме животных приводит к выделению высокотоксичного диметилселена, имеющего чесночный запах.
Сера | справочник Пестициды.ru
Содержание:
- Физические и химические свойства
- Содержание в природе
- Содержание серы в различных типах почв
- Сульфофиксация
- Круговорот серы в почве
- Торфяные почвы, солонцы и солончаки
- Супесчаные и песчаные почвы Нечерноземной зоны
- Дерново-подзолистые почвы
- Роль в растении
- Биохимические функции
- Основные функции серы
- Формы и соединения серы в тканях растений
- Источники питания серой
- Недостаток (дефицит) серы в растениях
- Избыток серы
- Симптомы избытка:
- Капуста и другие крестоцветные, злаковые
- Содержание серы в различных соединениях
- Способы применения
- Эффект от применения серосодержащих удобрений
- Кукуруза, кормовая брюква, кормовая капуста, бобовые травы, люпин
- Озимая пшеница (зерна), озимая рожь, ячмень, овес, семена клевера, клубни картофеля, корни брюквы, турнепс
Этот элемент можно добыть не только путем сложных химических реакций, но и непосредственно из мест его природного скопления в горных породах и геологических отложениях.
Серу находили во множестве минеральных источников. Один из таких есть в Новой Зеландии; из-за присутствия соединений серы и особого состава обитающих там водорослей вода в нем имеет ядовито-зеленый цвет. Естественно, еще с незапамятных времен этому источнику дали зловещее название «Ванна Дьявола»…
Словом, сера как элемент и как химическое вещество длительное время была окружена многочисленными домыслами.
Кристаллы серы
Использовано изображение:
Физические и химические свойства
Сера (Sulfur), S – элемент главной подгруппы VI группы периодической системы Менделеева. Атомный номер – 16, атомная масса – 3,07.
Атомный номер – 16, атомная масса – 3,07.
Сера при обычных условиях – хрупкие кристаллы желтого цвета.
- Плотность – 2,07 г/см3,
- Температура плавления – +112,8 °С,
- Температура кипения – +444,6 °С.
Сера нерастворима в воде, однако хорошо растворяется в сероуглероде и бензоле. При испарении данных жидкостей можно получить ромбическую серу, кристаллы которой имеют форму октаэдров со срезанными углами или ребрами.
Встречается также моноклинная модификация серы с температурой плавления + 119,3 °С и плотностью 1,96 г/см3. Она устойчива только при температуре выше +96 °С. При более низкой температуре превращается в ромбическую серу.
Различия в свойствах кристаллических модификаций вызваны неодинаковой структурой кристаллов.
Сера обладает свойствами типичных неметаллов. Со многими металлами сера способна соединяться непосредственно. Реакции сопровождаются выделением большого количества теплоты. Сера вступает в реакции соединения и со всеми неметаллами, но гораздо труднее, чем с металлами.[3]
Сера вступает в реакции соединения и со всеми неметаллами, но гораздо труднее, чем с металлами.[3]
Сера – фунгицид и акарицид
Содержание в природе
В природе сера встречается и в свободном состоянии, и в различных соединениях.
Широко распространены соединения серы с различными металлами. Многие из них считаются ценными рудами (свинцовый блеск, цинковая обманка, медный блеск) и являются источниками получения цветных металлов.[3]
Сера принадлежит к широко распространенным в природе элементам. Встречается в горных породах, минералах, углях, нефти, почвах, присутствует и содержится во всех живых организмах. В геологических отложениях насчитывается около 40 минералов группы сульфидов и столько же минералов группы сульфатов.
В глубоких горизонтах почвы сера представлена в форме пирита, марказита; в сульфатах – в сочетаниях со щелочными и щелочноземельными металлами.[2]
Содержание серы в различных типах почв
Главным источником серы в почвах служат почвообразующие породы. Среднее содержание серы в почве составляет 0,04 %, реже это значение достигает 0,2–0,3 %. В верхних горизонтах серы содержится больше, поскольку она входит в состав перегнойных кислот.
Среднее содержание серы в почве составляет 0,04 %, реже это значение достигает 0,2–0,3 %. В верхних горизонтах серы содержится больше, поскольку она входит в состав перегнойных кислот.
Сульфофиксация
До 80–90 % серы в почве присутствует в органических формах, а 10–20 % – в минеральных. Как правило, это сульфаты калия, натрия, кальция и магния.
Большое количество серы поступает в почву с атмосферными осадками. В форме органических соединений сера совершает долгий путь в цикле почвообразования и становится доступной растениям при разложении органических веществ и образовании минеральных соединений.[1] Этот процесс и называют сульфофикацией. Он имеет сезонный характер – минимальный весной, максимальный летом и затихающий к осени. Высвобождение серы идет в том же соотношении, в котором она находится в органических остатках и гумусе.[5]
Потребность с/х культур в сере и симптомы её недостатка, согласно данным:[6][5] |
||
Культура |
П |
Симптомы недостатка |
Бобовые |
В |
Вся листовая пластинка молодых листьев, в том числе жилки, светло-зеленой или желтой окраски; На поздних стадиях старые листья желтеют; Содержание белков низкое |
Горчица |
В |
Замедление развития растений; Уменьшение размера листьев, стебли удлиняются, листья и черешки деревянистые; В отличие от азотного голодания, при серном листья не отмирают, хотя цвет их становиться бледным |
Капуста и другие крестоцветные |
В |
Замедляется развитие растений; Уменьшается размер листьев, стебли удлиняются, листья и черешки деревянистые; В отличие от азотного голодания, при серном листья не отмирают, хотя цвет их становиться бледным |
Томаты |
В |
Нижние листья желтовато-зеленые; Стебли твердые, деревянистые; Корневая система хорошо развита в длину и сильно ветвится, но диаметр корней и стеблей мал; Стебли томатов удлиняются без увеличения диаметра; В растении много углеводов и иногда азота |
Огурцы |
В |
Рост растений ограничен; Листья маленькие, загнуты вниз, бледно-зеленые до желтого, на старых листьях желтизны меньше; Края молодых листьев зазубрены |
Круговорот серы в почве
Растения перехватывают минеральную серу и возвращают в верхние слои почвы снова в виде органических веществ. Таким образом, совершается непрерывное преобразование форм серы в процессах обмена веществ между растениями и почвой.[2]
Таким образом, совершается непрерывное преобразование форм серы в процессах обмена веществ между растениями и почвой.[2]
Содержание сульфатов в почве меняется в течение сезона. Больше всего сульфатов в почве в летнее время. Именно тогда, когда минерализация (сульфофикация) идет наиболее активно.[1]
отличаются большим содержанием серы. часто бедны по содержанию соединений серы.[5]характеризуются наличием доступной для растений сульфатной серы в количестве от 30 до 90 кг/га. Дефицит серы в данном типе почв ощутим на легких малогумусных и переувлажненных почвах.[1]Роль в растении
Биохимические функции
Сера активно участвует в окислительно-восстановительных процессах, активировании энзимов, белковом обмене. Она способствует фиксации азота из атмосферы путем усиления образования клубеньков у бобовых.[5]
Сера является составной частью белков и содержится в важнейших аминокислотах – цистине и метионине. Встречается данный элемент и в других органических соединениях – в аллил-горчичном масле из горчичных семян, в чесночном масле. Сера входит также в состав гликозидов, витамина В, биотина, некоторых антибиотиков (пенициллина).[2]
Встречается данный элемент и в других органических соединениях – в аллил-горчичном масле из горчичных семян, в чесночном масле. Сера входит также в состав гликозидов, витамина В, биотина, некоторых антибиотиков (пенициллина).[2]
Важнейшее соединение, содержащее серу и участвующее в окислительно-восстановительных реакциях – глутатион. В его состав сера входит в виде производного цистина – цистеина. Цистин содержит серу в виде дисульфидной группы, цистеин – в виде сульфгидрильной.[2]
В растущих органах растений с преобладанием синтетических процессов сера обнаруживается в восстановленной форме. По мере старения, когда процессы гидролиза начинают преобладать над процессами синтеза, в растении возрастает количество окисленной формы соединений серы.[5]
Сера поглощается растениями из почвы только в виде аниона серной кислоты (в окисленной форме). Однако во всех выше указанных соединениях она содержится в восстановленной форме (восстановителями сульфатов в растениях выступают углеводы). И именно в таком виде элемент участвует в окислительно-восстановительных процессах, связанных с дыханием.[2]
И именно в таком виде элемент участвует в окислительно-восстановительных процессах, связанных с дыханием.[2]
С органическими веществами сера связана дисульфидной (-S-S-) или сульфгидрильной (-SH) группами. Эти группы выполняют важные функции в процессе окислительно-восстановительных реакций. В частности, сульфгидрильная группа при окислении теряет водород и превращается в дисульфидную группу.[5]
Источником питания серой для растений служат соли серной кислоты. Частично сера в виде сернистого газа (SO2) поглощается растениями из воздуха. Окисленная форма серы – исходный продукт для синтеза белков. Эта же форма является и конечным продуктом при распаде белковой молекулы.[5]
Дефицит серыДефицит серы
1 — у табака, 2 – у пшеницы (справа)
Использованы изображения:[9][8]
Недостаток (дефицит) серы в растениях
Недостаток серы приводит к задержке синтеза белков, поскольку затрудняется образование аминокислот, содержащих данный элемент. Из-за этого визуальные проявления недостаточности серы похожи на признаки азотного голодания: замедляется развитие растений, уменьшается размер листьев, стебли удлиняются, листья и черешки становятся деревянистыми. В отличие от азотного голодания, при серном листья не отмирают, хотя их цвет становится бледным.
Из-за этого визуальные проявления недостаточности серы похожи на признаки азотного голодания: замедляется развитие растений, уменьшается размер листьев, стебли удлиняются, листья и черешки становятся деревянистыми. В отличие от азотного голодания, при серном листья не отмирают, хотя их цвет становится бледным.
Установлено, что бобовые и крестоцветные не испытывают недостатка в сере, если в почве содержится сульфатов более 11–14 мг/кг, злаковые – если более 7 мг/кг.[5]
Избыток серы
Избыток серы в почве незначительно снижает урожайность растений из семейства крестоцветных. Так же он влияет и на злаковые. Урожайность злаковых снижается значительнее, чем крестоцветных. Визуально наблюдается общее огрубение растений, листья мельчают, края их становятся коричневыми, затем бледно-желтыми.[6]
Симптомы избытка:
:- Снижается урожай,
- Общее огрубение растений,
- Листья маленькие, тускло-зеленые, стебли твердые, поздние листья скручиваются внутрь и покрываются наростами,
- Края коричневые, позднее – бледно–желтые.

Содержание серы в различных соединениях
Чистая сера – слишком дорогой продукт для использования в качестве удобрения в больших количествах. Но в районах расположения месторождений серы с недостаточным процентом элемента для использования в промышленности серные породы служат удобрением.[2]
В основном для устранения серной недостаточности используются серосодержащие удобрения:
- Простой суперфосфат (20 % P2O5, 13 % S). С ним на поля поступает преобладающее количество серы. В связи с тем, что потребность в фосфоре и сере приблизительно одинакова, при внесении данного удобрения удовлетворяется и потребность в сере.
- Сульфат аммония (21 % N, 24 % S) – второе место по снабжению почвы серой.
- Сернокислый калий (48 % K2O, 17,6 % S) и калимагнезия (28 % K2O, 18,3 % S) – калийные, бесхлорные удобрения. Применяются в ограниченном количестве и поэтому играют небольшую роль в обеспечении почв серой.

- Гипс (18,6 % S) хорошо доступен растениям. Представляет собой быстродействующую нейтральную сернокислую соль кальция.
- Фосфогипс (22 % S) – отходы химических заводов, выпускающих двойной суперфосфат. Подобен гипсу по составу, но включает в себя примеси фосфора и других элементов. Служит серосодержащим удобрением местного значения. Его недостаток – влажность 30–35 %.
- Сульфат магния содержит 28–30 % серы. Данное удобрение используется в закрытом грунте.[4]
- Полисульфид аммония – темная, красно-бурая, до черного цвета жидкость. Содержит около 20 % азота и 40 % серы.
- Тиосульфат аммония – жидкость красноватого цвета, содержит 12 % азота и 26 % серы.[2]
- Навоз – содержит серу в количестве до 1 кг SO3 в 1 т или от 0,6 до 0,15 %.[5]
Кроме указанных удобрений, сера входит в состав сульфатной нитрофоски и некоторых микроэлементов, а также поступает в почву с навозом и пестицидами. [4]
[4]
NOW MSM 1000 120 кап.
Принимать по одной капсуле в день.Показания к применению
— Аллергии, вызванные бытовыми раздражителями. Лица, имеющие тяжелые хронические аллергические заболевания, вызванные такими бытовыми аллергенами, как домашняя пыль, шерсть животных, перо, пыльца и др., и применявшие МСМ, отмечали значительное облегчение состояния.
— Пищевые и лекарственные аллергии. Лица, страдающие от аллергических реакций на лекарства (в частности, нестероидные противовоспалительные препараты и пероральные антибиотики) либо на различные продукты (злаки, морепродукты, молоко и т.д.), и применявшие метилсульфонилметан, отмечали либо уменьшение непереносимости указанных медикаментов и пищевых компонентов, либо полное исчезновение аллергических реакций при их употреблении.
— Болевой синдром при системных воспалительных заболеваниях. Лица, страдающие от боли и воспалительных явлений, вызванных повреждениями и различными заболеваниями костно-мышечной системы, отмечали выраженное и продолжительное уменьшение этих симптомов. В большинстве случаев сначала использовался только метилсульфонилметан, затем — МСМ в комбинации с аскорбиновой кислотой (Эстер Си), причем более выраженный эффект был отмечен при комбинированном приеме. Также метилсульфонилметан успешно использовался спортсменами после физических нагрузок для снятия онемения и болевых ощущений в напряженных либо воспаленных мышцах.
В большинстве случаев сначала использовался только метилсульфонилметан, затем — МСМ в комбинации с аскорбиновой кислотой (Эстер Си), причем более выраженный эффект был отмечен при комбинированном приеме. Также метилсульфонилметан успешно использовался спортсменами после физических нагрузок для снятия онемения и болевых ощущений в напряженных либо воспаленных мышцах.
— Желудочно-кишечные заболевания. МСМ эффективен при различных желудочно-кишечных расстройствах, в частности, вызванных паразитической инфекцией либо употреблением некоторых медикаментов, а также при поносах, хронических запорах, тошноте, изжоге, болях в эпигастральной области и других гастроинтестинальных
симптомах.
— Паразитическая инфекция. Испытания показывают, что МСМ активно действует против ряда паразитов кишечного и мочеполового тракта, таких, как лямблии, трихомонады и круглые черви. МСМ конкурирует с ними за связующие
участки на поверхности слизистых, тем самым блокируя контакт возбудителей со слизистыми оболочками.
А также отмечено, что использование MСM в качестве биологически активной добавки при медикаментозной терапии является эффективным при следующих состояниях:
аллергии, болезни легких, артриты, системная красная волчанка, рак груди и толстой кишки, диабет, гиперчувствительность к лекарствам, стрессы, термические и солнечные ожоги, рубцовые процессы, угри, укусы насекомых, храп.
Кроме того, употребление метилсульфонилметан способствует поддержанию здорового состояния глаз, зубов, кожи, ногтей и волос, нормальному функционированию суставов, улучшению мозговой деятельности.
Минимальная доза — 750 мг. Для быстрого достижения результата можно увеличить суточную дозу до 1500 — 5000 мг.
Эффект воздействия усиливается при совместном использовании МСМ и «Эстер Си». Результаты приема МСМ обычно становятся заметны на 2 — 21 день применения. Несмотря на то, что МСМ не токсичен (токсичность его равна токсичности обычной воды), некоторые люди всё же могут испытывать негативные ощущения в процессе детоксикации организма в первые десять дней приема МСМ. Проявлениями этого процесса могут быть головная боль и/или чувство усталости, диарея, сыпь на коже. В целом, чем большее количество токсинов присутствует в организме, тем более выражены данные проявления — и тем более велика необходимость применения МСМ.
Проявлениями этого процесса могут быть головная боль и/или чувство усталости, диарея, сыпь на коже. В целом, чем большее количество токсинов присутствует в организме, тем более выражены данные проявления — и тем более велика необходимость применения МСМ.
Противопоказания: индивидуальная непереносимость компонентов.
Юный химик
1. Неорганические вещества в живой природе. Общее знакомство с ролью неорганических веществ в живой природе – с ролью воды, кислорода, хлора, натрия и т.д. Решение задач с межпредметным содержанием.
2. Щелочные и щелочноземельные металлы. Натрий. Химические свойства натрия, взаимодействие щелочных металлов с кислородом. Применение щелочных металлов. Кальций. Химические свойства кальция, его роль в зарождении жизни на Земле. Распространенность кальция, природные соединения кальция. Роль кальция в процессах регуляции мышц и нервной системы. Роль ионов кальция в процессах свертывания крови. Фосфат кальция в составе скелета. Потребность организма в кальции. Болезни, связанные с недостатком кальция.
Фосфат кальция в составе скелета. Потребность организма в кальции. Болезни, связанные с недостатком кальция.
Биологическое значение магния и строения. История открытия магния, физические и химические свойства магния. Роль магния в процессах фотосинтеза. Роль магния в регуляции кровяного давления, работы нервной системы. Задачи с межпредметным содержанием. Методика составления и решения этих задач.
3. Углерод и кремний. Углерод в неорганической природе, углерод в органической природе. Особенности атома углерода, углерод – углеродные связи, размеры атомов углерода и водорода. Другие элементы в составе органических веществ.
Биологическая роль оксида углерода (ІІ) и (ІV). Оксид углерода (ІV) – продукт дыхания, его количество в крови. Углекислый газ в космических полетах. Роль углекислого газа в питании растений.
Оксид углерода (ІІ), его физиологическая роль. Оксид углерода (ІІ) из вулканов. Физиологические основы действия оксида углерода (ІІ). Угарный газ и охрана окружающей среды. Решение задач с межпредметным содержанием.
Решение задач с межпредметным содержанием.
Биологическая роль кремния. Кремний в природе, получение кремния в лаборатории и промышленности. Кремний в растениях. Качественное определение кремния в хвощах. Кремний в животных организмах, в организме человека. Кремний и атеросклероз. Кремний в составе нуклеиновых кислот.
Биологическая роль мышьяка. Мышьяк в природе, свойства мышьяка. Мышьяк в организмах человека и животных, растениях. Применение мышьяка. Мышьяк и яды. Роль мышьяка в жизнедеятельности человека, применение его соединений в зубоврачебном деле. Лечебная минеральная вода.
4. Азот и фосфор. Двойственная роль азота. История открытия азота, роль азота в растительных организмах (работы О. Либиха, Ж. Буссенго). Роль азота в питании растений. Азот атмосферный. Физические свойства азота, кессонная болезнь. Роль азота в хранении пищевых продуктов. Оксиды азота. Работа Г. Деви. Оксид азота (I) – анестезирующее средство. Азот в составе белков.
Биологическая роль фосфора. Фосфор неорганический. Открытие фосфора Г. Брандом. Фосфор и религия. Аллотропия фосфора. Химическая активность фосфора. Содержание фосфора в организме человека. Фосфор в почве. Фосфорные удобрения. Связь фосфора и кальция. Фосфор в энергетике живых организмов, фосфор в составе сложных органических веществ. Фосфорная буферная система крови. Потребность в фосфоре у человека. Продукты, содержащие фосфор. Решение задач с межпредметным содержанием.
Фосфор неорганический. Открытие фосфора Г. Брандом. Фосфор и религия. Аллотропия фосфора. Химическая активность фосфора. Содержание фосфора в организме человека. Фосфор в почве. Фосфорные удобрения. Связь фосфора и кальция. Фосфор в энергетике живых организмов, фосфор в составе сложных органических веществ. Фосфорная буферная система крови. Потребность в фосфоре у человека. Продукты, содержащие фосфор. Решение задач с межпредметным содержанием.
5. Биологическая роль металлов. Биологическое значение железа. Железо в составе гемоглобина. Его роль для животных и человека. Гемоглобин и его функции Цитохромоксидазная система. Круговорот железа в организме. Источники железа. Железо в медицине. Железодефицитное состояние в организме человека. Железо в растениях.
Биологическое значение меди, золота, серебра. Медь в природе. Медь – катализатор внутри клеточных окислительных процессов. «Лизуха» у животных, содержание меди в организме сайгака. Биологическое значение золота.
Химические свойства золота. Золото в медицине, золото в растениях.
Золото в медицине, золото в растениях.
Биологическая роль серебра. Серебряная вода. Серебро в микроорганизмах.
Биологическая роль марганца. Открытие марганца К. Шееле. Значение марганца для животных организмов; содержание марганца в растениях и животных.
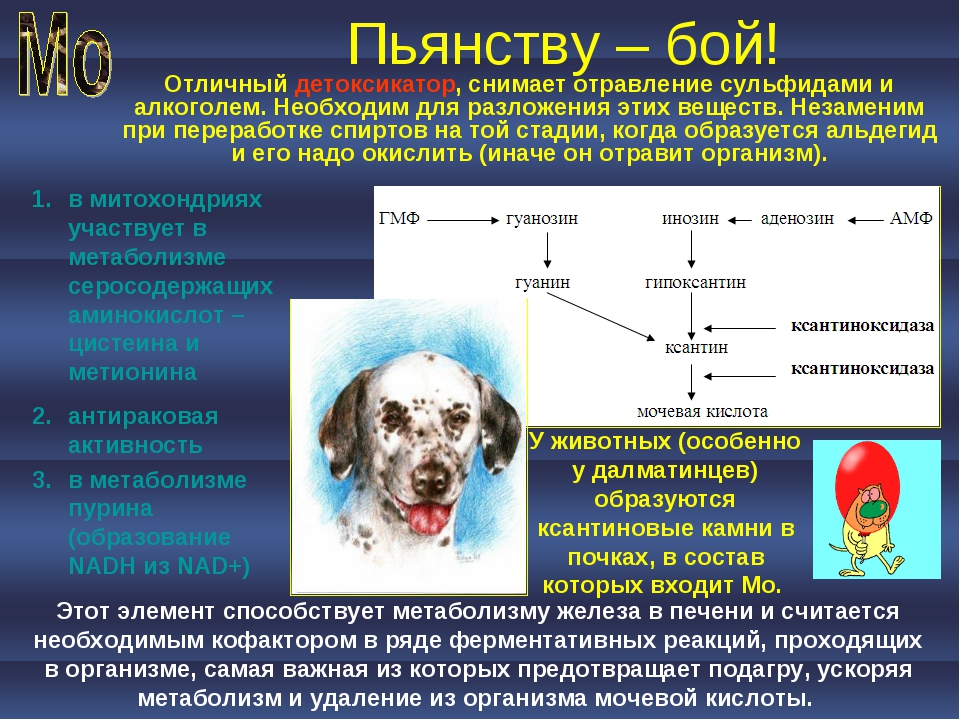
Биологическая роль хрома. Хром в природе. Окраска солей хрома. Биологическая роль титана, молибдена. Молибден в растениях и животных. Роль молибдена в усвоении азота растениями. Молибден и подагра.
6.Биологическое значение кислорода. История открытия кислорода. Особенности молекулы кислорода. Получение кислорода в лаборатории и технике. Физические и химические свойства кислорода. Физиологическая роль кислорода: кислород в дыхании. Кислород в космических кораблях. Роль кислорода в энергетике живых организмов. Жидкий кислород.
7. Биологическая роль серы. Самородная сера. Сера в природе. Соединения серы. Сера в составе белков. Качественное определение серы в составе белков.
| Раздел 1. Введение | ||||||
| 1.1. | Понятие о биосфере — области распространения жизни | Лекции | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 1.2. | Развитие взглядов на концепцию биосферы | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 1.3. | Работа с лекцией и учебной литературой | Сам. работа | 3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| Раздел 2. Организованность биосферы | ||||||
| 2.1. | Общая характеристика биосферы | Лекции | 3 | 1 | ОПК-2, ОПК-5 | Л1. 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.2. | Возникновение и эволюция биосферы | Практические | 3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.3. | Работа с лекцией и учебной литературой, подготовка к пз, тестированию, оформление отчета | Сам. работа | 3 | 6 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.4. | Анализ химического состава компонентов биосферы | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.5. | Вещество в биосфере | Лекции | 3 | 1 | ОПК-2, ОПК-5 | Л1. 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.6. | Общие географические закономерности в пределах биосферы | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.7. | Работа с лекцией и учебной литературой | Сам. работа | 3 | 6 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.8. | Биокосные системы | Лекции | 3 | 1 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.9. | Биосфера как открытая термодинамическая система | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1. 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.10. | Экологические законы биосферы | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 2.11. | Работа с лекцией и учебной литературой, подготовка к пз, тестированию, оформление отчета | Сам. работа | 3 | 6 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| Раздел 3. Биогеохимический круговорот вещества и энергии | ||||||
| 3.1. | Миграция химических элементов | Лекции | 3 | 1 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.2. | Геохимический состав и функции живого вещества | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1. 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.3. | Водная миграция химических элементов | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.4. | Работа с лекцией и учебной литературой, подготовка к пз, оформление презентаций, доклада | Сам. работа | 3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.5. | Биогеохимические циклы | Лекции | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.6. | Биогеохимические круговороты веществ | Практические | 3 | 4 | ОПК-2, ОПК-5 | Л1. 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 3.7. | Работа с лекцией и учебной литературой, подготовка к тестированию | Сам. работа | 3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| Раздел 4. Техногенез и устойчивость биосферы | ||||||
| 4.1. | Техногенная миграция | Лекции | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.2. | Эволюция биосферы, ноосфера | Практические | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.3. | Работа с лекцией и учебной литературой, подготовка и оформление реферата | Сам. работа работа |
3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.4. | Переход биосферы в ноосферу | Лекции | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.5. | Работа с лекцией и учебной литературой, оформление отчета по РГР, подготовка к коллоквиуму | Сам. работа | 3 | 2 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.6. | Техногенез и устойчивость биосферы | Практические | 3 | 4 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.7. | Работа с лекцией и учебной литературой, подготовка к собеседованию | Сам. работа работа |
3 | 5 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 |
| 4.8. | Экзамен | 3 | 27 | ОПК-2, ОПК-5 | Л1.1, Л2.1, Л2.2, Л1.2, Л2.3, Л1.3 | |
Сера — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: сера
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе вонючие отложения, скунсы и запах ада.Все они начинаются с буквы S, как и элемент этой недели. Вот Стив Майлон.
Вот Стив Майлон.
Стив Майлон
«Как пахло?» Это был единственный вопрос, который мне нужно было задать своему коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о химическом составе, лежащем в основе. Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным только для восстановленной серы.
Может быть, поэтому сера имеет такую плохую репутацию.Мой сын полгода не ел яйца, когда почувствовал запах своего первого тухлого яйца. В Библии кажется, что всякий раз, когда что-то случается или вот-вот должно произойти, горящая сера изображена на картинке:
Например,
В Бытие мы слышим, «Господь пролил дождем горящую серу на Содом и Гоморру»
И в Откровении мы читаем, что грешники найдут свое место в огненном озере из горящей серы ».
Странно то, что в обоих случаях мы не должны ожидать появления чего-либо пахнущего.Когда сера горит на воздухе, она обычно образует диоксид серы или триоксид серы, последний из которых не имеет запаха [исправлено из аудиофайла подкаста, в котором говорится, что диоксид серы не имеет запаха]. Эти соединения могут далее окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке Соединенных Штатов, поскольку богатые серой угли сжигаются для выработки электроэнергии в штатах Среднего Запада и уносятся на восток преобладающими ветрами, когда серная кислота выпадает, вызывая всевозможные экологические проблемы.
Эти соединения могут далее окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке Соединенных Штатов, поскольку богатые серой угли сжигаются для выработки электроэнергии в штатах Среднего Запада и уносятся на восток преобладающими ветрами, когда серная кислота выпадает, вызывая всевозможные экологические проблемы.
Кроме того, сочетание горящего угля и тумана создает смог во многих промышленных городах, вызывая респираторные заболевания у местных жителей. Здесь также виноваты диоксид серы и серная кислота. Но опять же, с этой формой серы не связано никакого запаха.
Так что, если говорят, что ад или дьявол «пахнет серой», может быть, это не так уж и плохо.
Но уменьшите серу, отдав ей пару электронов, и ее запах будет безошибочным. Требование восстановления серы до сульфида явно потеряно при переводе.
Ад, пахнущий сероводородом или любым другим сероорганическим соединением, совсем не будет хорошим местом.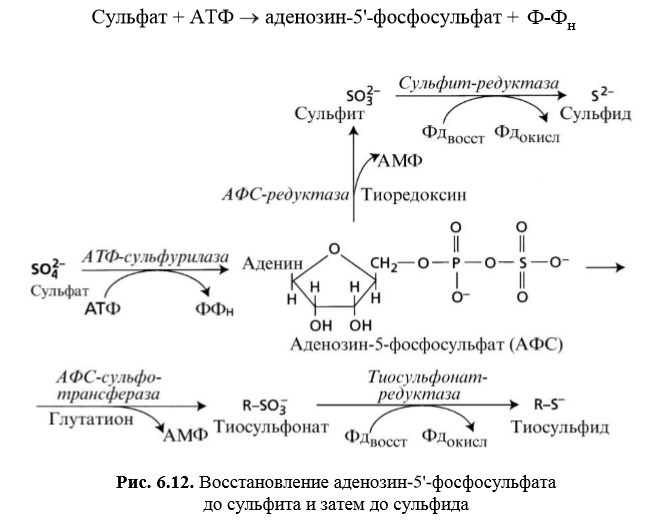 Органические сульфидные соединения, известные как тиолы или меркаптаны, настолько плохо пахнут, что их обычно добавляют в природный газ без запаха в очень небольших количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит, когда восстановленная сера придает неприятный (вонючий) привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе.
Органические сульфидные соединения, известные как тиолы или меркаптаны, настолько плохо пахнут, что их обычно добавляют в природный газ без запаха в очень небольших количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит, когда восстановленная сера придает неприятный (вонючий) привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе.
Итак, откуда берется «запах ада» в бескислородных отложениях. Интересно, что некоторые бактерии эволюционировали, чтобы использовать окисленную серу, сульфат, в качестве акцептора электронов во время дыхания. Подобно тому, как люди превращают элементарный кислород в воду, эти бактерии восстанавливают сульфат до сероводорода — они явно не обращают внимания на запах.
Запах — не единственный интересный химический состав, который сопровождает восстановленную серу.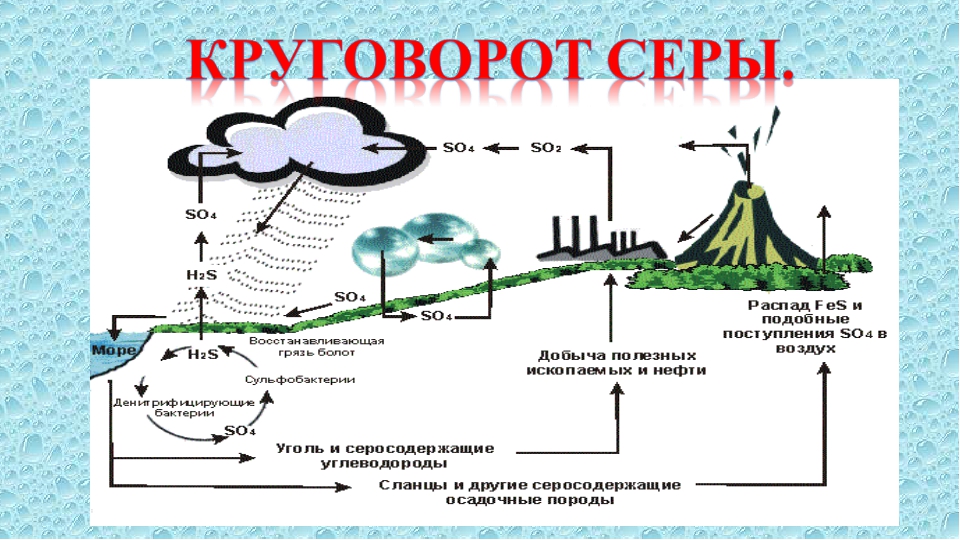 Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов.
Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов.
Промышленность — это то место, где вы почти наверняка найдете серу или, что более важно, серную кислоту, которая используется в различных процессах, от производства удобрений до нефтепереработки.На самом деле серная кислота считается самым производимым химическим веществом в промышленно развитом мире. Представьте, что элемент с такой адской репутацией стал одним из самых важных.
А некоторые даже предполагают, что сера может спасти планету. Биогенное соединение диметилсульфид (ДМС) образуется в результате расщепления диметилсульфоноприопоната, осмотического регулирующего соединения, вырабатываемого планктоном в океане. 12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты.
12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты.
Представьте себе более высокие температуры, за которыми следует более высокая биологическая активность, приводящая к большему выбросу DMS в атмосферу. Образовавшееся облако может охладить нагреющуюся планету. Это похоже на то, как планктон раскрывает зонт, частично состоящий из серы. Из символа проклятия в спасителя … что за поворот !!.
Крис Смит
Стив Майлон нюхает вонючую историю Sulphur. К счастью, элемент на следующей неделе намного менее пахучий.
Джон Эмсли
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.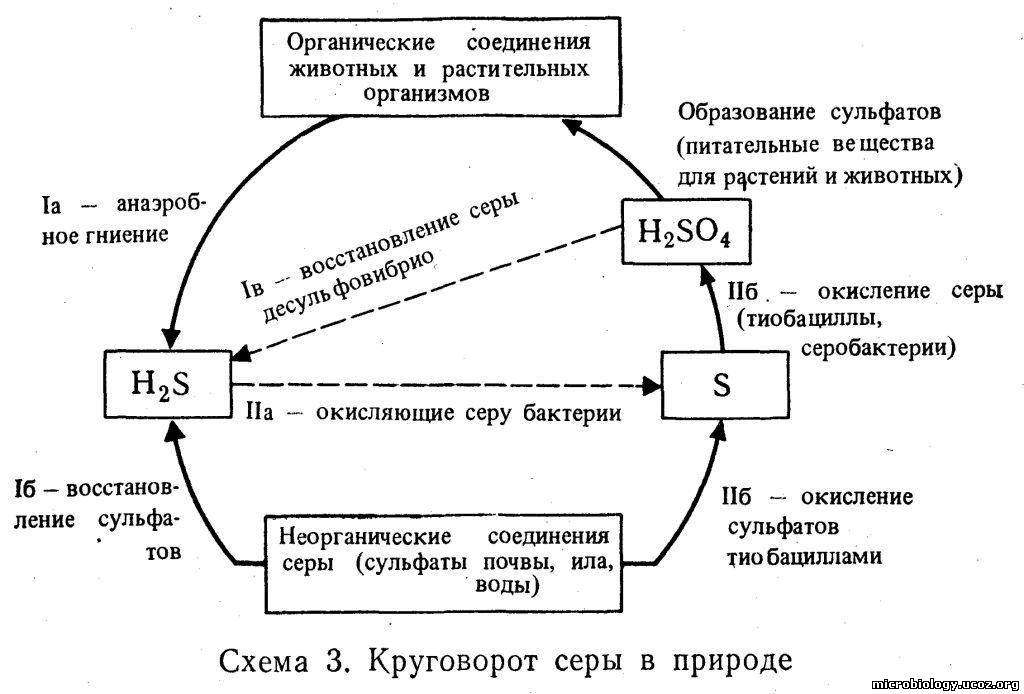 Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент.
Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент.
Крис Смит
И этот новый элемент был аргоном, прозванным ленивым элементом, потому что первоначально ученые думали, что он ни с чем не будет реагировать. Теперь мы знаем, что это неправда, и Джон Эмсли будет здесь, чтобы раскрыть секреты Аргона в программе «Химия в ее элементе» на следующей неделе. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Биология и сера | Природа Химическая биология
Evolution сделала интригующий выбор в выборе элементарных компонентов живых систем. Хотя ионы металлов занимают центральное место в биохимии, группа элементов, сгруппированных в начале периодической таблицы Менделеева, — углерод, азот, кислород и фосфор — широко представлена в молекулах жизни.Иногда легко упустить из виду биологическое значение другого важного элемента, серы, ароматного соседа элементов, из которых состоит большинство органических соединений. Фактически, сера присутствует во всех основных классах биомолекул, включая белки, сахара, нуклеиновые кислоты, кофакторы витаминов и метаболиты, и требуется всем живым организмам. Хотя многие серосодержащие биомолекулы были известны уже несколько десятилетий, только сейчас исследователи начинают понимать их сложное биосинтетическое происхождение и функциональную роль.Эти достижения, некоторые из которых освещены в этом выпуске журнала Nature Chemical Biology , позволяют по-новому взглянуть на роль серы в биологии.
Хотя ионы металлов занимают центральное место в биохимии, группа элементов, сгруппированных в начале периодической таблицы Менделеева, — углерод, азот, кислород и фосфор — широко представлена в молекулах жизни.Иногда легко упустить из виду биологическое значение другого важного элемента, серы, ароматного соседа элементов, из которых состоит большинство органических соединений. Фактически, сера присутствует во всех основных классах биомолекул, включая белки, сахара, нуклеиновые кислоты, кофакторы витаминов и метаболиты, и требуется всем живым организмам. Хотя многие серосодержащие биомолекулы были известны уже несколько десятилетий, только сейчас исследователи начинают понимать их сложное биосинтетическое происхождение и функциональную роль.Эти достижения, некоторые из которых освещены в этом выпуске журнала Nature Chemical Biology , позволяют по-новому взглянуть на роль серы в биологии.
Гибкость серосодержащих биомолекул следует из разнообразного химического состава этого элемента. Как члены одной и той же периодической группы, сера и кислород имеют общие черты химической активности. Однако более низкое положение серы в периодической таблице наделяет ее соединения отчетливыми свойствами, которые полезны для биологических систем.Например, тиолы являются превосходными нуклеофилами по сравнению со спиртами, а также служат универсальными активирующими группами в биохимии тиоэфиров. Дисульфидные связи (RS-SR) более стабильны, чем пероксидные связи (RO-OR), и биология воспользовалась этой стабильностью, используя дисульфидные связи как структурные особенности белков. Сера может принимать более широкий спектр степеней окисления, чем кислород, например, при окислении цистеина до сульфеновой (R-SOH), сульфиновой (R-SO 2 H) и сульфоновой (R-SO 3 H) кислот.Сера также менее электроотрицательна, чем кислород, что позволяет ей легче принимать положительный заряд, который используется рядом кофакторов ферментов.
Как члены одной и той же периодической группы, сера и кислород имеют общие черты химической активности. Однако более низкое положение серы в периодической таблице наделяет ее соединения отчетливыми свойствами, которые полезны для биологических систем.Например, тиолы являются превосходными нуклеофилами по сравнению со спиртами, а также служат универсальными активирующими группами в биохимии тиоэфиров. Дисульфидные связи (RS-SR) более стабильны, чем пероксидные связи (RO-OR), и биология воспользовалась этой стабильностью, используя дисульфидные связи как структурные особенности белков. Сера может принимать более широкий спектр степеней окисления, чем кислород, например, при окислении цистеина до сульфеновой (R-SOH), сульфиновой (R-SO 2 H) и сульфоновой (R-SO 3 H) кислот.Сера также менее электроотрицательна, чем кислород, что позволяет ей легче принимать положительный заряд, который используется рядом кофакторов ферментов.
S -аденозилметионин (SAM или AdoMet), который образуется в результате реакции метионина и АТФ, является важным кофактором многих ферментов. SAM служит донором метила для биологического метилирования, и эта реакция легко протекает на основе химической реакционной способности нуклеофилов с его электрофильным ионом сульфония. Помимо того, что SAM является «метилиодидом» клетки, он связан с ферментами, которые катализируют широкий спектр химических реакций, включая многие радикальные реакции.Эти разнообразные превращения с участием SAM являются следствием различных реакций, которые могут поддерживаться в серном центре кофактора, как подчеркивается в биосинтезе биотина.
SAM служит донором метила для биологического метилирования, и эта реакция легко протекает на основе химической реакционной способности нуклеофилов с его электрофильным ионом сульфония. Помимо того, что SAM является «метилиодидом» клетки, он связан с ферментами, которые катализируют широкий спектр химических реакций, включая многие радикальные реакции.Эти разнообразные превращения с участием SAM являются следствием различных реакций, которые могут поддерживаться в серном центре кофактора, как подчеркивается в биосинтезе биотина.
Биотин — важный кофактор фермента, который участвует в ферментах, катализирующих реакции карбоксилирования. Несмотря на широко распространенное понимание важной физиологической роли биотина, последний этап синтеза биотина до сих пор не изучен. Эта сложная реакция, которая требует введения серы между двумя неактивированными атомами углерода, катализируется биотинсинтазой, ферментом, который содержит два кластера железо-сера [Fe-S] и SAM.В биотинсинтазе химические свойства серы, которые присутствуют как в SAM, так и в кластерах [Fe-S], имеют решающее значение для стимулирования образования связи углерод-сера. Источник серы для реакции и механизм ее введения до сих пор не решены и активно обсуждаются. Предлагаемые механизмы этой реакции обсуждаются в комментариях Fontecave (стр. 171) и обзоре Mueller (стр. 185).
Источник серы для реакции и механизм ее введения до сих пор не решены и активно обсуждаются. Предлагаемые механизмы этой реакции обсуждаются в комментариях Fontecave (стр. 171) и обзоре Mueller (стр. 185).
Все чаще доказывается, что цистеин-десульфуразы играют ключевую роль в образовании многочисленных серосодержащих биомолекул.Десульфуразы цистеина катализируют образование персульфида цистеина (Cys-S-SH) путем переноса атома серы от свободного цистеина к цистеину в активном центре фермента. Полученный персульфид может действовать в последующих реакциях либо как электрофил, либо как нуклеофил, чтобы мобилизовать атомы серы в биомолекулы и из них. Широкое применение персульфидов для незаконного оборота серы обсуждается в обзоре Мюллера (стр. 185). Статья Лаухона в News & Views (стр. 182) посвящена недавнему исследованию ( Mol.Cell 21 , 97–108, 2006), в котором подробно описан сложный путь биосинтеза, начиная с десульфуразы цистеина, для генерации модифицированного нуклеозида, 2-тиуридина. Цистеиновые десульфуразы также участвуют в образовании кластеров [Fe-S], но многие аспекты биосинтеза кластеров до сих пор полностью неизвестны. Проблемы в понимании этого пути обсуждаются в комментарии Fontecave (стр. 171).
Цистеиновые десульфуразы также участвуют в образовании кластеров [Fe-S], но многие аспекты биосинтеза кластеров до сих пор полностью неизвестны. Проблемы в понимании этого пути обсуждаются в комментарии Fontecave (стр. 171).
Учитывая разнообразные свойства серы, существует множество возможностей использовать химический состав серы для инженерных биологических систем.Недавние примеры включают разработку сульфотрансферазной системы для создания новых антибиотиков (см. Основные исследования на стр. 184) и модуляцию клеточной дифференцировки за счет включения тиолов на поверхность клетки ( Nat. Chem. Biol. 2 , 149–152, 2006). До сих пор химическая биология фокусировалась на ограниченном наборе химических элементов. Однако возросшее участие химиков в качестве исследователей периодической таблицы дает большие надежды на раскрытие химии, лежащей в основе выбора основных элементов эволюцией.
Об этой статье
Цитируйте эту статью
Биология и сера. Nat Chem Biol 2, 169 (2006). https://doi.org/10.1038/nchembio0406-169
Nat Chem Biol 2, 169 (2006). https://doi.org/10.1038/nchembio0406-169
Скачать цитату
Дополнительная литература
-
Синтез неприродных аналогов ManNAc для экспрессии тиолов на сиаловых кислотах на клеточной поверхности
- Шриниваса-Гопалан Сампаткумар
- , Адриенн В. Ли
- и Кевин Дж. Ярема
Протоколы природы (2006)
-
Метаболическая экспрессия тиол-производных сиаловых кислот на поверхности клетки и их количественная оценка методом проточной цитометрии
- Шриниваса-Гопалан Сампаткумар
- , Марк Б.
 Джонс
Джонс - и Кевин Дж. Ярема
Протоколы природы (2006)
Sulphur — обзор | Темы ScienceDirect
ВВЕДЕНИЕ
Сера является необходимым диетическим компонентом, который может быть токсичным при чрезмерных концентрациях.Тела животных содержат около 0,15% серы по весу (NRC, 1989, 2006). Сера включена во многие важные молекулы, включая биотин, хондроитинсульфат, мукополисахариды хряща, кофермент А, фибриноген, глутатион, гепарин, липоевую кислоту, муцины и тиамин (NRC, 1989, 1998, 2006). В дополнение к этим биологически активным соединениям сера является сложным компонентом серосодержащих аминокислот, таких как метионин, цистеин, цистин, гомоцистеин и таурин. За исключением тиамина и биотина, все содержащие серу соединения в организме могут быть синтезированы из метионина (NRC, 1996).Таким образом, тиамин, биотин и метионин являются важными питательными веществами в рационе животных с однокамерным желудком, но микробы жвачных животных могут синтезировать эти соединения из неорганических сульфатов в рационе (Block et al . , 1951). Различия между видами таковы, что кошки не могут синтезировать таурин из метионина, что делает его важным питательным веществом в их рационе. Рекомендуемое дневное потребление серы составляет 0,15%, 0,14–0,26%, 0,15–0,2% и 0,2–0,25% от рациона лошадей, овец, мясного и молочного скота соответственно (NRC, 1985, 1988, 1989, 1996).
, 1951). Различия между видами таковы, что кошки не могут синтезировать таурин из метионина, что делает его важным питательным веществом в их рационе. Рекомендуемое дневное потребление серы составляет 0,15%, 0,14–0,26%, 0,15–0,2% и 0,2–0,25% от рациона лошадей, овец, мясного и молочного скота соответственно (NRC, 1985, 1988, 1989, 1996).
Жвачные животные, как правило, более чувствительны к токсическим эффектам пищевой серы / сульфата из-за эффективного микробного преобразования в биоактивные виды в рубце. Но как пищевые, так и водные источники серы / сульфата обладают схожим токсическим потенциалом и должны быть учтены в общем суточном потреблении, чтобы установить потенциальный риск.
Помимо пищевой серы токсичными могут быть и другие серосодержащие соединения. Газообразный диоксид серы из промышленных отходящих газов, а также газообразный сероводород из навозных ям, добычи природного газа и сырой нефти могут быть токсичными для домашнего скота.Токсические эффекты этих газообразных форм серы лучше описать отдельно от пищевых токсикозов.
Растения могут накапливать высокие концентрации серы. Вода с высоким содержанием сульфатов может вызвать двойное увеличение общего суточного потребления серы через воду и проглатывание ближайшей растительности. Было показано, что концентрация серы в растениях увеличивается с увеличением содержания сульфата в почве (Reddy и др. ., 1981; Hardt и др. ., 1991; Leustek and Saito, 1999). В матриксе почвы сульфат может активно восстанавливаться и осаждаться; однако это только изолирует серу до тех пор, пока изменение окружающей среды не позволит повторно окислить серу обратно в сульфат.В условиях засухи осажденная сера подвергается воздействию кислорода и повторно окисляется. Полученный сульфат становится биодоступным для усвоения растениями.
Химия и биохимия природных соединений серы: ключевые промежуточные продукты метаболизма и окислительно-восстановительной биологии
Обзор
. 2020 29 сентября; 2020: 8294158.
DOI: 10.1155 / 2020/8294158.
Электронная коллекция 2020.
2020 29 сентября; 2020: 8294158.
DOI: 10.1155 / 2020/8294158.
Электронная коллекция 2020.Принадлежности Расширять
Принадлежности
- 1 Отделение биохимических наук «А. Росси Фанелли», Римский университет Ла Сапиенца, 00185 Рим, Италия.
- 2 Кафедра органической химии, Instituto Universitario de Bio-Orgánica Antonio González, Университет Ла-Лагуна, Ла-Лагуна, 38296 Тенерифе, Испания.
Элемент в буфере обмена
Обзор
Антонио Франчиозо и др. Oxid Med Cell Longev.
.
Oxid Med Cell Longev.
.
Показать варианты
Формат АннотацияPubMedPMID
.2020 29 сентября; 2020: 8294158. DOI: 10.1155 / 2020/8294158. Электронная коллекция 2020.Принадлежности
- 1 Отделение биохимических наук «А.
 Росси Фанелли», Римский университет Ла Сапиенца, 00185 Рим, Италия.
Росси Фанелли», Римский университет Ла Сапиенца, 00185 Рим, Италия. - 2 Кафедра органической химии, Instituto Universitario de Bio-Orgánica Antonio González, Университет Ла-Лагуна, Ла-Лагуна, 38296 Тенерифе, Испания.
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Сера вносит значительный вклад в химическое разнообразие природы и благодаря своим особым свойствам допускает фундаментальные биологические реакции, которые не допускаются ни одним другим элементом.Природные соединения серы используются всеми живыми существами и в зависимости от функции распределяются по разным царствам. Неслучайно морские организмы являются одним из важнейших источников природных продуктов серы, поскольку большая часть неорганической серы метаболизируется в океанской среде, где этот элемент присутствует в изобилии. Наземные организмы, такие как растения и микроорганизмы, также могут включать серу в органические молекулы для производства первичных метаболитов (например, метионина, цистеина) и более сложных уникальных химических структур с разнообразными биологическими функциями.Животные не способны связывать неорганическую серу в биомолекулы и полностью зависят от предварительно образованных органических сернистых соединений для удовлетворения своих потребностей в сере. Тем не менее, некоторые высшие виды, такие как люди, способны создавать новые серосодержащие химические соединения, особенно на основе сероорганических предшественников растений. Обмен серы у человека очень сложен и играет центральную роль в окислительно-восстановительной биохимии. Химические свойства, большое количество степеней окисления и разносторонняя реакционная способность халькогенов семейства кислорода делают серу идеальной для окислительно-восстановительных биологических реакций и процессов переноса электронов.В этом обзоре будет исследован метаболизм серы, связанный с окислительно-восстановительной биохимией, и будут описаны различные классы серосодержащих соединений, распространенных во всех природных царствах. Мы опишем химию и биохимию хорошо известных метаболитов, а также неизвестных и малоизученных природных продуктов серы, которые все еще находятся в поисках биологической роли.
Неслучайно морские организмы являются одним из важнейших источников природных продуктов серы, поскольку большая часть неорганической серы метаболизируется в океанской среде, где этот элемент присутствует в изобилии. Наземные организмы, такие как растения и микроорганизмы, также могут включать серу в органические молекулы для производства первичных метаболитов (например, метионина, цистеина) и более сложных уникальных химических структур с разнообразными биологическими функциями.Животные не способны связывать неорганическую серу в биомолекулы и полностью зависят от предварительно образованных органических сернистых соединений для удовлетворения своих потребностей в сере. Тем не менее, некоторые высшие виды, такие как люди, способны создавать новые серосодержащие химические соединения, особенно на основе сероорганических предшественников растений. Обмен серы у человека очень сложен и играет центральную роль в окислительно-восстановительной биохимии. Химические свойства, большое количество степеней окисления и разносторонняя реакционная способность халькогенов семейства кислорода делают серу идеальной для окислительно-восстановительных биологических реакций и процессов переноса электронов.В этом обзоре будет исследован метаболизм серы, связанный с окислительно-восстановительной биохимией, и будут описаны различные классы серосодержащих соединений, распространенных во всех природных царствах. Мы опишем химию и биохимию хорошо известных метаболитов, а также неизвестных и малоизученных природных продуктов серы, которые все еще находятся в поисках биологической роли.
Авторские права © 2020 Antonio Francioso et al.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рисунок 1
Неорганические и органические формы…
Рисунок 1
Неорганические и органические формы поступления серы в биосинтетический метаболизм растений…
Рисунок 1Неорганические и органические формы поступления серы в биосинтетический метаболизм растений и микроорганизмов.
Рисунок 2
Включение сульфат-аниона в аденозин…
Рисунок 2
Включение сульфат-аниона в аденозинфосфосульфат (APS) из АТФ.
фигура 2Включение сульфат-аниона в аденозинфосфосульфат (APS) из АТФ.
Рисунок 3
Важные серосодержащие кофакторы и витамины.
Рисунок 3
Важные серосодержащие кофакторы и витамины.
Рисунок 3Важные серосодержащие кофакторы и витамины.
Рисунок 4
Сероорганические амины. (1) Метионин. (2)…
Рисунок 4
Сероорганические амины.(1) Метионин. (2) Цистеин. (3) Гипотаврин. (4) Метионинсульфон. (5) Метионин…
Рисунок 4Сероорганические амины. (1) Метионин. (2) Цистеин. (3) Гипотаврин. (4) Метионинсульфон. (5) Метионин-N-метилсульфоксид. (6) Таурин. (7) Тиотаурин.
Рисунок 5
Гистидин и ароматический амин сераорганическая…
Рисунок 5
Гистидин и сероорганические производные ароматических аминов.(8) 1-Метил-5-меркапто-L-гистидин. (9) Дисульфидные производные 1-метил-5-меркапто-L-гистидина. (10)…
Рисунок 5.Гистидин и сероорганические производные ароматических аминов. (8) 1-Метил-5-меркапто-L-гистидин. (9) Дисульфидные производные 1-метил-5-меркапто-L-гистидина. (10) 2,5-S, S-дицистеинилдопа. (11) Эрготионеин.
Рисунок 6
Серосодержащие производные индола.(12) Дендродоин.…
Рисунок 6
Серосодержащие производные индола. (12) Дендродоин. (13) Дизиденины. (14) Улицикламид. (15) Улитиацикламид.
Рисунок 6Серосодержащие производные индола. (12) Дендродоин. (13) Дизиденины. (14) Улицикламид.(15) Улитиацикламид.
Рисунок 7
Ферментативное превращение аллина (16) в…
Рисунок 7
Ферментативное превращение аллина (16) в аллицин (17) в измельченном свежем чесноке.
Рисунок 7Ферментативное превращение аллина (16) в аллицин (17) в измельченном свежем чесноке.
Рисунок 8
Гидролиз глюкозинолата (18) и изотиоцианат…
Рисунок 8
Гидролиз глюкозинолата (18) и образование изотиоцианата.
Рисунок 8Гидролиз глюкозинолата (18) и образование изотиоцианата.
Рисунок 9
Биоактивные изотиоцианаты. (19) Аллилизотиоцианаты.…
Рисунок 9
Биоактивные изотиоцианаты.(19) Аллилизотиоцианаты. (20) Сульфорафан.
Рисунок 9Биоактивные изотиоцианаты. (19) Аллилизотиоцианаты. (20) Сульфорафан.
Рисунок 10
Циклический полисульфид (21) лентионин и…
Рисунок 10
Циклический полисульфид (21) лентионин и (22) фитохелатины.
Рисунок 10.Циклический полисульфид (21) лентионин и (22) фитохелатины.
Рисунок 11
Путь транссульфурации / трансметилирования. Метионин (1), SAM…
Рисунок 11
Путь транссульфурации / трансметилирования.Метионин (1), SAM (2), S-аденозилгомоцистеин (3), гомоцистеин (4), цистатионин (5) и…
Рисунок 11.Путь транссульфурации / трансметилирования. Метионин (1), SAM (2), S-аденозилгомоцистеин (3), гомоцистеин (4), цистатионин (5) и цистеин (6). MAT: Met аденозилтрансфераза; SAH: гидролаза SAHCy; МС: Мет-синтаза; BHMT: бетаин: гомоцистеинметилтрансфераза; CBS: цистатионин β -синтаза; CSE: цистатионин γ -лиаза.
Рисунок 12
Продукты распада S-аденозил-L-метионина (SAM).
Рисунок 12
Продукты распада S-аденозил-L-метионина (SAM).
Рисунок 12.Продукты распада S-аденозил-L-метионина (SAM).
Рисунок 13
Метаболизм цистина под действием ферментов транссульфурации.…
Рисунок 13
Метаболизм цистина под действием ферментов транссульфурации. CAT: цистеинаминотрансфераза; CBS: цистатионин β -синтаза; CDO:…
Рисунок 13Метаболизм цистина под действием ферментов транссульфурации.CAT: цистеинаминотрансфераза; CBS: цистатионин β -синтаза; CDO: цистеиндиоксигеназа; CSAD: цистеинсульфинатдекарбоксилаза; CSE: цистатионин γ -лиаза; MST: меркаптопируват-серотрансфераза; TRX: тиоредоксин.
Рисунок 14
Глутатион (GSH) и его ферментативные…
Рисунок 14
Глутатион (GSH) и продукты его ферментативной деградации, глутамат (Glu) и цистеинилглицин (Cys-Gly).
Диаграмма 14Глутатион (GSH) и продукты его ферментативной деградации, глутамат (Glu) и цистеинилглицин (Cys-Gly).
Рисунок 15
Коэнзим А. Химическая структура…
Рисунок 15
Коэнзим А.Химическая структура КоА и его компонентов.
Рисунок 15.Коэнзим А. Химическая структура КоА и его компонентов.
Рисунок 16
Биосинтез и деградация КоА.
Рисунок 16
Биосинтез и деградация КоА.
Рисунок 16Биосинтез и деградация КоА.
Рисунок 17
Биосинтез таурина. Альтернативные маршруты для…
Рисунок 17
Биосинтез таурина.Альтернативные пути биосинтеза таурина из цистеина или цистеамина. АДО: цистеамин…
Рисунок 17.Биосинтез таурина. Альтернативные пути биосинтеза таурина из цистеина или цистеамина. ADO: цистеаминдиоксигеназа; CDO: цистеиндиоксигеназа; CSAD: цистеинсульфинатдекарбоксилаза.
Рисунок 18
Путь транссульфурации тиотаурина.
Рисунок 18
Путь транссульфурации тиотаурина.
Рисунок 18Путь транссульфурации тиотаурина.
Рисунок 19
Биологические тиоэфиры, относящиеся к…
Рисунок 19
Биологические тиоэфиры, относящиеся к классу лантионинов
Рисунок 19Биологические тиоэфиры, относящиеся к классу лантионинов
Рисунок 20
Цистатионин β -синтаза (CBS), катализируемая…
Рисунок 20
Цистатионин β -синтаза (CBS), катализируемый синтезом лантионинов.
Рисунок 20.Цистатионин β -синтаза (CBS), катализируемый синтезом лантионинов.
Рисунок 21
Лантионины и родственные серосодержащие циклические соединения…
Рисунок 21
Лантионины и родственные серосодержащие циклические кетимины, образующиеся в результате альтернативного пути транссульфурации мозга.
Рисунок 21Лантионины и родственные серосодержащие циклические кетимины, образующиеся в результате альтернативного пути транссульфурации мозга.
Рисунок 22
Восстановленные кетимины лантионина. Эти соединения…
Рисунок 22
Восстановленные кетимины лантионина.Было обнаружено, что эти соединения в качестве их предшественников производятся…
Рисунок 22.Восстановленные кетимины лантионина. Было обнаружено, что эти соединения в качестве их предшественников ферментативно продуцируются в определенных тканях человека.
Рисунок 23
Природные гетероциклические пятичленные кольцевые соединения.…
Рисунок 23
Природные гетероциклические пятичленные кольцевые соединения. (а) Тиазолин-4-карбоновая кислота (производное формилцистеина). (b) Тиазолидин-4-карбоновая кислота…
Рисунок 23Природные гетероциклические пятичленные кольцевые соединения. (а) Тиазолин-4-карбоновая кислота (производное формилцистеина).(б) Тиазолидин-4-карбоновая кислота (тиопролин). (c) 2-амино-2-тиазолин-4-карбоновая кислота (ATCA). (d) 2-амино-3-метил-5-сульфанилимидазол-4-илпропановая кислота (овотиол A).
Рисунок 24
Структурная связь нейроактивной серы…
Рисунок 24
Структурная связь нейроактивных аминов серы и аминокислот.Эти соединения могут действовать…
Рисунок 24Структурная связь нейроактивных аминов серы и аминокислот. Эти соединения могут действовать как агонисты ГАМК или глутамата.
Все фигурки (24)
Похожие статьи
-
Серосодержащие аминокислоты и липидный обмен.
Blachier F, Andriamihaja M, Blais A. Blachier F, et al. J Nutr. 2020 1 октября; 150 (Дополнение 1): 2524S-2531S. DOI: 10,1093 / JN / NXAA243. J Nutr. 2020. PMID: 33000164 Рассмотрение.
-
Биология активных форм серы (RSS).
Gruhlke MC, Slusarenko AJ. Gruhlke MC, et al. Plant Physiol Biochem. 2012 Октябрь; 59: 98-107. DOI: 10.1016 / j.plaphy.2012.03.016. Epub 2012 7 апреля. Plant Physiol Biochem. 2012 г. PMID: 22541352 Рассмотрение.
-
Структурная биология метаболизма серы в растениях: от сульфата до глутатиона.
Jez JM. Jez JM. J Exp Bot. 2019 августа 19; 70 (16): 4089-4103. DOI: 10.1093 / jxb / erz094. J Exp Bot. 2019. PMID: 30825314 Рассмотрение.
-
Работа с метионином / гомоцистеином серой: метаболизм цистеина до таурина и неорганической серы.
Стипанук М.Х., Уэки И. Стипанук М.Х. и соавт. J Inherit Metab Dis. 2011 Февраль; 34 (1): 17-32. DOI: 10.1007 / s10545-009-9006-9. Epub 2010 17 февраля. J Inherit Metab Dis. 2011 г. PMID: 20162368 Бесплатная статья PMC. Рассмотрение.
-
Устойчивость к окислению серных аминокислот: метионина и цистеина.
Бинь П, Хуан Р., Чжоу Х. Bin P и др.Biomed Res Int. 2017; 2017: 9584932. DOI: 10.1155 / 2017/9584932. Epub 2017 27 декабря. Biomed Res Int. 2017 г. PMID: 29445748 Бесплатная статья PMC. Рассмотрение.
Процитировано
1 артикул-
Редокс-гомеостаз у птицы: регулирующая роль NF-κB.
Сурай П.Ф., Кочиш II, Кидд М.Т.Сурай П.Ф. и др. Антиоксиданты (Базель). 2021, 28 января; 10 (2): 186. DOI: 10.3390 / antiox10020186. Антиоксиданты (Базель). 2021 г. PMID: 33525511 Бесплатная статья PMC. Рассмотрение.
использованная литература
-
- Уорд Н. П., ДеНикола Г. М. Обмен серы и его вклад в злокачественные новообразования. Использование питательных веществ в клетках и рак.2019; 347: 39–103. DOI: 10.1016 / bs.ircmb.2019.05.001. — DOI — PubMed
-
- Броснан Дж.Т., Броснан М. Э. Серосодержащие аминокислоты: обзор. Журнал питания. 2006; 136 (6): 1636S – 1640S. DOI: 10.1093 / JN / 136.6.1636S. — DOI — PubMed
-
- Гриффит О.W. Метаболизм серных аминокислот у млекопитающих: обзор. Методы энзимологии. 1987. 143: 366–376. DOI: 10.1016 / 0076-6879 (87) 43065-6. — DOI — PubMed
-
- Нимни М.Э., Хан Б., Кордова Ф. Достаточно ли мы получаем серы с пищей? Питание и обмен веществ. 2007; 4 (1): с. 24. DOI: 10.1186 / 1743-7075-4-24. — DOI — ЧВК — PubMed
-
- РОУЗ В., КУН М., ЛОКХАРТ Х., ЛАМБЕРТ Г. Потребности человека в аминокислотах. 11. Требования к треонину и метионину. Журнал биологической химии. 1955. 215 (1): 101–110. — PubMed
Показать все 258 ссылок
Условия MeSH
- Гликозидгидролазы / метаболизм
- Соединения серы / химия
- Соединения серы / метаболизм *
цитировать
КопироватьФормат: AMA APA ГНД NLM
Серный цикл
Сера — один из компонентов, входящих в состав белков и витаминов.Белки состоят из аминокислот, содержащих атомы серы. Сера важна для функционирования белков и ферментов у растений и животных, которые зависят от растений для получения серы. Растения поглощают серу, когда она растворяется в воде. Животные потребляют эти растения, так что они потребляют достаточно серы для поддержания своего здоровья.
Большая часть земной серы связана в породах и солях или погребена глубоко в океане в океанических отложениях. Сера также содержится в атмосфере. Он попадает в атмосферу как из естественных, так и из человеческих источников.Природные ресурсы могут быть, например, извержениями вулканов, бактериальными процессами, испарением из воды или разлагающимися организмами. Когда сера попадает в атмосферу в результате деятельности человека, это, главным образом, является следствием промышленных процессов, при которых в больших масштабах выделяются газы двуокись серы (SO 2 ) и сероводород (H 2 S).
Когда диоксид серы попадает в атмосферу, он вступает в реакцию с кислородом с образованием газообразного триоксида серы (SO 3 ) или с другими химическими веществами в атмосфере с образованием солей серы.Диоксид серы может также реагировать с водой с образованием серной кислоты (H 2 SO 4 ). Серная кислота может также производиться из деметилсульфида, который выбрасывается в атмосферу видами планктона.
Все эти частицы осядут обратно на землю или вступят в реакцию с дождем и снова упадут на землю в виде кислотных отложений. Затем частицы снова будут поглощены растениями и выпущены обратно в атмосферу, так что цикл серы начнется снова.
Схематическое изображение цикла серы:
Для получения дополнительной информации о сере перейдите к периодической диаграмме
Для получения дополнительной информации о сероводороде в пресноводных экосистемах
Вернуться на главную страницу циклов веществ
К вопросу о циклах загрязнения стр.
| Сера — это поливалентный неметалл, содержащийся в большом количестве, без вкуса и запаха.В своей самородной форме сера представляет собой желтое кристаллическое твердое вещество. В природе он встречается как чистый элемент или как сульфидные и сульфатные минералы. Хотя сера печально известна своим запахом, который часто сравнивают с запахом тухлых яиц, этот запах на самом деле характерен для сероводорода (H 2 S). Приложения Основным производным серы является серная кислота (h3SO4), один из важнейших элементов, используемых в качестве промышленного сырья. Сера в окружающей среде Жизнь на Земле могла быть возможна из-за серы. Условия в ранних морях были такими, что простые химические реакции могли генерировать ряд аминокислот, которые являются строительными блоками жизни. Сера естественным образом встречается возле вулканов. Самородная сера встречается в природе в виде массивных отложений в Техасе и Луизиане в США. Известны многие сульфидные минералы: пирит и маркаист — сульфид железа; стибнит — сульфид сурьмы; галенит — сульфид свинца; киноварь — это сульфид ртути, а сфалерит — сульфид цинка. Другими, более важными сульфидными рудами являются халькопирит, борнит, пенландит, миллерит и молибденит.
Источники таблицы Менделеева. Вернуться к периодической таблице элементов . Для получения дополнительной информации о месте серы в окружающей среде перейдите к циклу серы . |
|
какова роль серы в живых организмах
В чем разница между научным фактом, наблюдением и умозаключением? (Уметь идентифицировать все 3 из примера.)
В чем заключается наибольшее преимущество использования разных методов, приводящих к одинаковому результату?
Использование базы данных продуктов питания Это упражнение поможет вам достичь следующих образовательных целей: Вы оцените решение сложной реальной проблемы на основе … научные знания.Вы оцените аргументы в пользу принятых объяснений или решений, чтобы определить достоинства аргументов. Направления Прочтите инструкции для этого самопроверяемого задания. Введите свой ответ на каждый вопрос и проверьте свои ответы. В конце упражнения напишите краткую оценку своей работы. Деятельность В этом упражнении вы воспользуетесь Центром данных о продуктах питания Министерства сельского хозяйства США, чтобы проанализировать последние три продукта, которые вы съели, и заполнить таблицу витаминов и минералов, содержащихся в каждом продукте. При поиске каждого продукта помните следующие примечания: Вы можете искать любые продукты в базе данных, в том числе фирменные продукты.Безводные напитки могут быть включены в ваш поиск. Если вы не можете найти точную еду, используйте ближайшую версию, которую сможете найти. Сделав выбор, вы попадете на страницу, где сможете настроить размер порции. Оцените размер потребленной вами порции. Затем прокрутите вниз, чтобы найти общее количество витаминов и минералов в каждом продукте. Некоторые продукты не содержат в списке определенных минералов или витаминов, если они не присутствуют в этих продуктах. И в некоторых редких случаях запись в базе данных может быть неполной.Сравните выбранную вами запись с аналогичными записями об этом продукте, чтобы определить, есть ли в продукте это питательное вещество. Если вы не уверены, выберите другую еду. Часть А Теперь заполните таблицу. Введите название каждого продукта питания и количество содержащихся в нем витаминов. Обязательно укажите правильные единицы измерения (пример: 25 граммов). Обратите внимание, что микрограмм = мкг. Часть B Используйте справочные таблицы диетического потребления витаминов и минералов, чтобы найти рекомендуемое потребление этих микроэлементов для людей вашего возраста. Если бы вы ели эти три продукта каждый день все три приема пищи, выполнили бы вы свои ежедневные рекомендации по витамину C, калию, витамину B12 и железу? Часть C Эксперты по питанию рекомендуют большинству людей употреблять менее 2300 миллиграммов натрия в день для хорошего здоровья сердца.Какой процент от этого лимита вы потребляли, употребляя в пищу эти три продукта? Вас удивляет эта сумма? Объясните свой ответ. Часть D Большинству людей не нужно считать каждый съеденный питательный микроэлемент. Вместо этого врачи рекомендуют придерживаться сбалансированной диеты с большим разнообразием здоровой пищи. Почему эта рекомендация важна для поддержания гомеостаза в организме? Используйте данные, собранные для трех ваших продуктов, в качестве обоснования своего объяснения.
Кто-нибудь из США ??????? Не комментируйте, если не
Если на вашу кожу попала кислота, немедленно смойте слабая база.О, много воды. мыло. О масло.
Всем, кто связан с отношениями, я посылаю вам песню под названием «Я буду с вами от Заката до самого низа».
Деятельность У Брианны диабет, а это значит, что ее организм не может эффективно контролировать уровень сахара в крови. Она смотрит на этикетки с питанием двух сна … кликните, чтобы определить, какой из них она хочет съесть. Просмотрите этикетки и ответьте на следующие вопросы. Этикетка пищевых продуктов, на которой указаны сведения о пищевой ценности пищевого продукта (слева), этикетка пищевых продуктов, на которой представлены сведения о пищевой ценности пищевого продукта (справа) Часть А Врачи советуют ей съедать не более 30 граммов углеводов в день во время перекуса.Поскольку пищевые волокна не оказывают отрицательного воздействия на уровень сахара в крови, ей не нужно учитывать их в общем количестве углеводов. Если Брианна съест две порции каждого из этих продуктов, попадет ли она под лимит, рекомендованный врачом для перекуса? Объясните свои рассуждения. Часть B Врач Брианны рекомендует употреблять 28 граммов клетчатки в день. Она уже потребила 60% дневной нормы клетчатки. Если она съест две порции каждого перекуса, будет ли она выполнять свои ежедневные рекомендации по клетчатке? Насколько она больше или меньше? Часть C Врач Брианны хочет, чтобы менее 30% ее дневных калорий приходилось на жиры.Брианна придерживается диеты, состоящей из 1800 калорий. Используйте информацию на этикетках, чтобы рассчитать процент от общего количества рекомендованных ею калорий из жиров, если она съела две порции закуски 1. Часть D Считаете ли вы, что процент суточной нормы (% DV) является полезным инструментом даже для людей, которые не придерживаются диеты в 2000 калорий? Объясните свой ответ.
Дефицит железа — один из наиболее распространенных недостатков питания у женщин в пременопаузе. Железо — жизненно важная часть гемоглобина, которая переносит кислород в … красные кровяные клетки.Как вы думаете, почему женщинам в пременопаузе нужно больше железа, чем мужчинам того же возраста?
В СМИ доминируют темы питания. Как определить, является ли заявление о питательной ценности продукта слишком хорошим, чтобы быть правдой? На каком языке размещается реклама … использовать то, что вызывает подозрения?
Мотыльки выделяют химические вещества, называемые феромонами, для привлечения партнера. а) Какой процесс отвечает за распространение этих химикатов по воздуху? б) … Если моль обнаруживает феромоны, как она может определить, откуда они приходят? в) В чем преимущество мотылька, выделяющего феромоны ночью при слабом ветре?
.
 03.06. Экология и природопользование — Направления подготовки
03.06. Экология и природопользование — Направления подготовки