Посттравматическая невропатия (посттравматическая нейропатия, травматический неврит, посттравматические неврологические расстройства)
Посттравматическая невропатия (посттравматическая нейропатия, травматический неврит, посттравматические неврологические растройства)
Посттравматическая невропатия – заболевание нервного корешка (ствола периферического нерва), которое происходит вследствие механической травмы нерва после операций, ранений, механических повреждений (в том числе после инъекций), ударов, переломов или вывихов костей. Процесс также может инициировать артрит, грыжа межпозвоночного диска, остеохондроз. В общем случае невритами называют поражения отдельных периферических нервов, обусловленные воздействиями различных факторов. Невриты различают локальные и множественные (полиневрит). Заболевание считается не опасным и излечимым, однако характерно развитием достаточно сильных болевых ощущений. Кроме болевой симптоматики болезнь может проявляться также снижением чувствительности и парезом мышц (слабостью).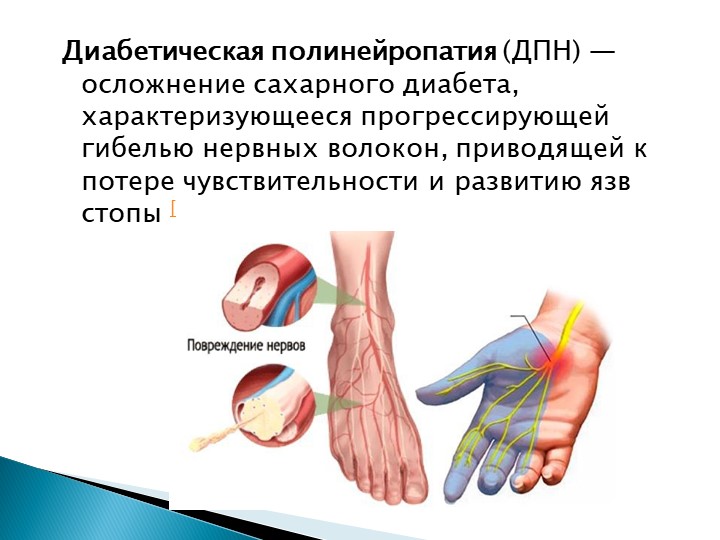
Симптомы
Основным симптомами являются боль, приступообразно распространяющаяся по ходу воспаленного нерва, потеря чувствительности, двигательные расстройства, может возникнуть парез.
Лечение
Лечение при нейропатии подбирается исключительно индивидуально и включает в себя комплекс консервативных процедур. А суть лечебного воздействия сводится к освобождению нервной ткани от сдавливания обломками кости или воспаленными окружающими тканям. С точки зрения ТКМ неврит имеет природу дефицита «холода» в меридианах печени и желчного пузыря. При этом, как правило, будет нарушен внутренний путь хода по меридианам, потеряна чувствительность в месте поражения и разовьется слабость мышц.
При лечении неврита, терапия должна обязательно строиться с учетом причин, его спровоцировавших, механизма развития болезни и все ее клинической картины. При лечении травматического неврита боль и воспаление устраняется при использовании иглоукалывания. При парезах мышц, различных онемениях применение этого метода приводит к усилению обмена веществ в поражённых нервных тканях, возвращению активного процесса регенерации, что в итоге ведет к восстановлению чувствительности и усилению двигательной активности в поражённых мышцах.
Нейропатия: причины развития заболевания, симптоматика и возможные последствия | | Infopro54
В зависимости от количества и расположения пораженных нервов различают: мононейропатию, множественную мононейропатию и полинейропатию.
Симптомы
Симптоматика зависит от того, какой нерв был поврежден. Проявлений нейропатии множество, но характерных мало.
Диабетическая форма нейропатии проявляется:
- чувством покалывания в ногах;
- попеременное ощущение холода и жара в конечностях;
- боль в конечностях, которая появляется чаще всего ночью;
- повышенная чувствительность к прикосновениям, даже легкое касание вызывает боль;
- изменение форм мышечной структуры рук и ног;
- жжение в кистях и ступнях;
- долго заживают раны;
- характерный признак – чувство «перчаток или носков» при их отсутствии.

При автономной диабетической нейропатии к вышеперечисленным симптомам добавляются:
- тошнота и рвота;
- головокружение;
- проблемы с ЖКТ;
- тахикардия в состоянии покоя;
- отсутствие позывов к мочеиспусканию при переполненном мочевом пузыре;
- сильное потоотделение.
Вегетативная диабетическая нейропатия проявляется безболевым или бессимптомным инфарктом, гипогликемией без симптомов, диарея, рвота, гастропарез, урогенитальными симптомами, проблемами с терморегуляцией.
При периферической диабетической нейропатии характерны онемение, боли в ногах, появление ран и язв, атрофия и парез мышц рук и ног.
Нейропатия лицевого нерва, или еще ее называют поражением тройничного нерва, самый часто проявляющийся вид заболевания.
Ее симптомы:
- застывшая сторона лица, где поражен нерв;
- нарушение вкуса;
- слюно и слезотечение;
- характерный признак – онемение передней части языка.

Поражение малоберцового нерва обычно диагностируют у девушек 10-19 лет. При этой форме наблюдается:
- утрата способности вращать стопой;
- во время ходьбы или бега нога неожиданно подворачивается;
- невозможность ходить на пятках.
При моторной периферической нейропатии появляются судороги, мышечная слабость, невозможность удержать в руках предметы.
Комплексное проявление симптомов характерно для полинейропатии – поражении нескольких нервных волокон в одной зоне.
Поражение единичного нерва – мононейропатия – проявляется небольшим комплексом симптомов. Чаще всего поражает руки (лучевой или локтевой нерв), например, «туннельный синдром».
Причины
В 30% случаев возникновения нейропатии причины не установлены. В 70% нейропатия развивается вследствие тяжелого заболевания, сложных интоксикаций, в результате травм.
Диабетическая форма появляется из-за поражения высоким уровнем сахара и липидов нервных волокон.
Токсическая форма возникает после инфекционных заболеваний: ВИЧ, герпес, дифтерия и других. Может развиться после отравления химическими препаратами и лекарствами из-за поражения нервного сплетения.
Посттравматическая диагностируется в результате сдавления волокон, нарушения миелиновой оболочки нерва.
Причинами развития заболевания могут стать проблемы с почками, печенью, ревматоидный артрит, остеохондроз, системная красная волчанка, онкология и новообразования. К развитию нейропатии приводят гиповитаминоз, недостаточный уровень гормонов щитовидной железы, хронический алкоголизм, наследственная предрасположенность.
Последствия
После перенесенной нейропатии могут возникнуть:
- расстройство чувствительности: сильные простреливающие боли, постоянные неприятные ощущения, потеря чувствительности;
- вегетативно-трофические изменения: выпадение волос, сухость кожи, появление пигментных пятен и незаживающих язв, гангрена;
- двигательные нарушения: судороги, мышечные спазмы, слабость и атрофия мышц, снижение коленного и ахиллового рефлексов.

Большинство видов нейропатии не излечиваются и переходят в хроническую форму.
Нейропатия: симптомы, лечение, боль без причины
Когда вы задели большим пальцем ноги угол дивана — боль острая, жутко неприятная, но быстро проходит. Если же палец или другой участок тела покалывает, жжёт, «постреливает» или немеет без какой-либо причины — возможно, это нейропатия. И это гораздо опаснее, чем просто удариться ногой об угол дивана.
Впрочем, если вы провели день в неудобных туфлях или уснули в неудобном положении, а потом у вас занемели ноги и заболела спина — всё пройдёт само. В течение дня-двух.
Есть всего три вида нейропатий: диабетическая, токсическая и посттравматическая. Диабетическая возникает при повышенном содержании сахаров и липидов в крови. Токсическая — при серьёзных инфекционных заболеваниях. Посттравматическая — как результат сильной травмы.
Нейропатия — это повреждение нервной системы. Чаще всего это следствие болезни, о которой вы можете даже не знать.
— Если беспричинные боли повторяются хаотично, но часто становятся систематическими — обязательно обратитесь ко врачу и не затягивайте.
— При нейропатии возможна повышенная утомляемость, ощущения постоянного стресса и даже депрессия. Если вам кажется, что боль не причиняет особого дискомфорта — скорее всего, ваш организм так не считает и тратит много сил на борьбу.
— Не бойтесь идти к неврологу. Либо у вас всё в порядке, либо вам помогут избавиться от дискомфорта и начать лечение.
Главное: почти все виды нейропатии на ранних стадиях легко поддаются лечению. Но нередко бывает так, что человек привыкает к нейропатической боли и не обращается за помощью. Тем временем нейропатия прогрессирует, и со временем лечить её будет всё труднее.
— Спорт, отказ от алкоголя и курения, а также сбалансированное питание помогают лечению. Но не могут его заменить. Это не тот случай, когда «пройдёт само» или когда можно заниматься самолечением народными припарками (их тоже нередко назначают врачи, но только в качестве дополнительной стимулирующей терапии).
Это не тот случай, когда «пройдёт само» или когда можно заниматься самолечением народными припарками (их тоже нередко назначают врачи, но только в качестве дополнительной стимулирующей терапии).
— Обезболивающие не помогут. По крайней мере те, что продаются в аптеках без рецепта. Здесь нужно лечить не следствие, а причину. Обычными обезболивающими вы только притупите симптомы и навредите себе. В случае сильных болей врачи выпишут рецептурные препараты.
— Универсального лекарства от нейропатии нет. Так как у неё десятки причин, то и лечение будет индивидуальным. Но как правило, для восстановления нормальной работы нервных волокон выписывают вазоактивные препараты: они улучшают кровоснабжение поражённых тканей. Нередко назначают витамины группы B, которые стимулируют проводимость волокон и обладают незначительным обезболивающим эффектом, а также успокаивают нервную систему, что помогает ей восстанавливаться быстрее.
Итак, если вы обнаружили у себя симптомы нейропатии — первым делом отправляйтесь к врачу. И при своевременном лечении вы быстро и навсегда избавитесь от боли.
И при своевременном лечении вы быстро и навсегда избавитесь от боли.
Неврология / КонсультантПлюс
│ НЕВРОЛОГИЯ │
├───┬─────────┬─────────────────────────┬──────────────────┬──────────────────────────┬─────────────────────┤
│27 │07.00.001│Комплексное лечение │G61.0, G70.0 │Острая воспалительная │Комплексное │
│ │ │больных (старше 18 лет) │ │демиелинизирующая │консервативное │
│ │ │с тяжелым течением │ │полинейропатия или │лечение │
│ │ │острой воспалительной │ │миастенический криз │ │
│ │ │демиелинизирующей │ │тяжелого течения с │ │
│ │ │полинейропатии, │ │развитием грубого │ │
│ │ │миастенических кризов │ │тетрапареза, парапареза, │ │
│ │ │ │ │слабости мышц туловища: │ │
│ │ │ │ │- без бульбарного │ │
│ │ │ │ │синдрома; │ │
│ │ │ │ │- с бульбарным синдромом; │ │
│ │ │ │ │- с дыхательной │ │
│ │ │ │ │недостаточностью с │ │
│ │ │ │ │проведением длительной ИВЛ│ │
│ │ │ │ │до 90 и более суток │ │
├───┼─────────┼─────────────────────────┼──────────────────┼──────────────────────────┼─────────────────────┤
│28 │07. 00.002│Медицинская │T91.3 │Пациенты с выраженными │Комплексное │
00.002│Медицинская │T91.3 │Пациенты с выраженными │Комплексное │
│ │ │реабилитация больных │ │двигательными нарушениями │консервативное │
│ │ │(старше 18 лет) с │ │с поражением спинного │лечение │
│ │ │выраженными │ │мозга │ │
│ │ │двигательными, ├──────────────────┼──────────────────────────┼─────────────────────┤
│ │ │чувствительными, │T90 │Пациенты с выраженными │Комплексное │
│ │ │координаторными │ │двигательными, │консервативное │
│ │ │расстройствами при │ │координаторными, │лечение │
│ │ │посттравматических │ │бульбарными и речевыми │ │
│ │ │(в том числе │ │нарушениями с поражением │ │
│ │ │послеоперационных) │ │головного мозга │ │
│ │ │поражениях головного и │ │ │ │
│ │ │спинного мозга в раннем │ │ │ │
│ │ │восстановительном │ │ │ │
│ │ │периоде (до 1 года) с │ │ │ │
│ │ │использованием │ │ │ │
│ │ │роботизированной │ │ │ │
│ │ │механотерапии, │ │ │ │
│ │ │прикладной │ │ │ │
│ │ │кинезотерапии │ │ │ │
├───┴─────────┴─────────────────────────┴──────────────────┴──────────────────────────┴─────────────────────┤
лицевой паралич | стоматология | челюстно-лицевая хирургия
Лицевой паралич(специалисты ЦНИИС: Сомова Марина Михайловна, Салихов Камиль Саламович)
В настоящее время возросло количество пациентов с поражением лицевого нерва (в связи с увеличением числа травматического повреждения челюстно-лицевой области, огнестрельных ранений головы, врожденной патологии, увеличением процента онкологических заболеваний лица, патологией околоушной слюнной железы и осложнениями после проведения пластических операций и косметических манипуляций). Среди заболеваний периферической нервной системы, поражение лицевого нерва занимает второе место (Альперович П.Н., Гречко В.Е., 1990г., Яхно Н.Н. 2003 г. Калина В.О.2003г, Шустер М.А.2003г.).
Среди заболеваний периферической нервной системы, поражение лицевого нерва занимает второе место (Альперович П.Н., Гречко В.Е., 1990г., Яхно Н.Н. 2003 г. Калина В.О.2003г, Шустер М.А.2003г.).
Нейропатия лицевого нерва является состоянием, приводящим к стойким функциональным нарушениям и эстетическому дефекту. Тактика лечения пациентов зависит от нозологии и продолжительности заболевания. В остром периоде лечение направлено на снятие отека, в случае компрессии, восстановление кровообращения и проводимости по нерву.
Не всегда весь комплекс мероприятий, проводимых для восстановления лицевого нерва, может привести к желаемому результату. У пациентов могут в дальнейшем развиваться стойкие, не поддающиеся лечению, осложнения, приводящие к дезадаптации в обществе и личной жизни. Внедрение ботулинотерапии явилось «рукой помощи» в тактике реабилитационного лечения. Однако и этот, казалось бы, «революционный шаг» не может воздействовать на стойкие повреждения анатомической целостности лицевого нерва.
Метод хирургического лечения лицевого нерва, при потере анатомической целостности, в раннем периоде (до 1,5 лет) является приоритетным и единственным методом восстановления утраченной функции. Наш научный, клинический опыт и индивидуальный подход в выборе комплекса методов лечения пациентов, как до операции, так и после, приводит к ранней социальной реабилитации.
Основные причины развития лицевого паралича
Идиопатическая невропатия лицевого нерва «паралич Белла»
Инфекционная: Наружный отит, средний отит, ветряная оспа, Herpes Zoster oticus, энцефалит, боррелиоз, бруцеллез, лептоспироз, дифтерии, сифилис и т.д.
Аутоиммунная: системная красная волчанка, склеродермия, дерматомиозит, узелковый полиартериит, ревматизм, ревматоидный артрит и др.
Метаболическая: сахарный диабет, гипертиреоидизм, беременность, гипертензия и т.д.
Токсическая: этилен гликоль, алкоголизм, интоксикация мышьяком.
Опухоли: холестиотома, плеаморфная аденома околоушной слюнной железы, невринома преддверно-улиткового нерва, первичная опухоль лицевого нерва, метастатическая опухоль, лимфома и т.д.
Травма: переломы основания черепа, повреждения лица, проникающая травма среднего уха, родовая травма, баротравма и т.д.
Ятрогенная: Челюстно-лицевая хирургия: субтотальная резекция околоушной слюной железы, пластическая хирургия, косметология.
Симптомы:
Быстро развивающаяся слабость или паралич одной половины лица.
Затруднение мимики, перекошенная улыбка.
Повышенная чувствительность к звуку с одной стороны.
Опущение одного века.
Боль в ухе с пораженной стороны.
Боль в области челюсти
Головная боль.
Нарушение выработки слюны и слезной жидкости.
Нарушение вкуса.
Хирургическое лечение лицевого паралича.
1)Декомпрессия и невролиз лицевого нерва,
2)Аутотрансплантация икроножного нерва,
3)Формирование вставок с использованием большого ушного нерва,
4)Формирование периферических анастомозов с использованием жевательного нерва с лицевым нервом,
5)Формирование обходных анастомозов с использованием икроножного нерва с лицевым нервом,
6)Формирование периферических анастомозов с использованием подъязычного нерва с лицевым нервом,
7)Формирование периферических анастомозов с использованием челюстно-подъязычного нерва,
8)Транспозиция жевательной мышцы,
9)Транспозиция височной мышцы,
10)Аутотрансплантация мышц,
11)Статическая коррекция,
12)Устранение паралитического лагофтальма.
Удаление доброкачественных новообразований околоушных желез с выделением и сохранением ствола и ветвей лицевого нерва.
Хирургическое лечение пациентов с посттравматическими и послеоперационными нейропатиями лицевого нерва.
Лечение гипертрофии жевательных мышц.
Комплексная послеоперационная реабилитация пациентов:
1)медикаментозное лечение,
2)физиотерапевтическое лечение,
3)ботулинотерапия,
4)логопедическая коррекция.
Физиотерапевтическое лечение:
Периферическая электромиостимуляция использование импульсных токов, в целях профилактики атрофии в обездвиженных мышцах.Назад
Центр неврологический
Руководитель центра — Гончарова Зоя Александровна, доктор медицинских наук, врач-невролог высшей категории, профессор кафедры нервных болезней и нейрохирургии. Является членом исполнительного комитета Российского общества исследователей рассеянного склероза (РОКИРС). Защитила докторскую диссертацию на тему: ”Клинико-эпидемиологическая характеристика рассеянного склероза (проспективное 20-летнее исследование)”, является соавтором вышедшей в 2016г. монографии ”Паранеопластический неврологический синдром”, занимается научными исследованиями в области оптимизации диагностики, прогнозирования течения и лечения пациентов с демиелинизирующими заболеваниями.
Защитила докторскую диссертацию на тему: ”Клинико-эпидемиологическая характеристика рассеянного склероза (проспективное 20-летнее исследование)”, является соавтором вышедшей в 2016г. монографии ”Паранеопластический неврологический синдром”, занимается научными исследованиями в области оптимизации диагностики, прогнозирования течения и лечения пациентов с демиелинизирующими заболеваниями.
Центр неврологический является клинический базой двух кафедр: кафедры нервных болезней и нейрохирургии и кафедры неврологии и нейрохирургии с курсом мануальной терапии и рефлексотерапии ФПК и ППС. В Центре проводится консервативное и хирургическое лечение всех видов патологии центральной и периферической нервной системы, реабилитация пациентов с заболеваниями центральной нервной системы.
Высокий уровень диагностического и лечебного процесса достигнут за счет слаженной работы коллектива, благодаря преемственности поколений — молодые активно занимающиеся лечебной и научно-исследовательской работой врачи трудятся вместе с врачами-педагогами сотрудниками кафедр, обладающими многолетним опытом и знаниями современных достижений неврологии и нейрохирургии, сохранившими вековые традиции Ростовской школы неврологов и нейрохирургов.
Работа Центра построена таким образом, что ведение пациента начинается с амбулаторного этапа (врач-невролог, врач-нейрохирург консультативно-диагностической поликлиники), затем может продолжаться в условиях стационара (круглосуточного, дневного), работа в котором основана на принципах мультидисциплинарной бригады (врач-невролог, врач-нейрохирург, врач-реаниматолог, врач-иглорефлексотерапевт, врач-кардиолог, врач-психиатр, врач-психотерапевт, врач ЛФК, логопед, психолог), что обеспечивает индивидуальный комплексный подход к пациенту.
Основные направления научной деятельности, осуществляемой на базе Центра:
- Демиелинизирующие заболевания центральной и периферической нервной системы: эпидемиология, диагностика, лечение
- Проблема боли: этиология, патогенез, диагностика, профилактика и лечение болевых лицевых и вертеброгенных синдромов
- Нейроонкология
- Нейродегенеративные заболевания
- Цереброваскулярные заболевания: патогенез, диагностика, лечение
- Эпилепсия и пароксизмальные состояния
- Эпилепсия и пароксизмальные состояния
Накопленный опыт диагностики и лечения различных заболеваний нервной системы в совокупности с современным лечебно-диагностическим оборудованием дает возможность оказания высокоэффективной медицинской помощи пациентам со следующими заболеваниями нервной системы:
- Цереброваскулярные заболевания (определение факторов риска заболеваний, первичная и вторичная профилактика инсульта, индивидуальная схема консервативной терапии, рекомендации по реабилитации)
- Острые нарушения мозгового кровообращения (транзиторная ишемическая атака, ишемический, геморрагический инсульт, субарахноидальное кровоизлияние)
- Болевые синдромы (головная боль различной природы, постгерпетические невралгии, невралгия тройничного нерва, другие лицевые боли) (дифференциальная диагностика (уточнение причины), подбор индивидуальной схемы лечения, проведение терапии ботулиническим токсином типа А, выполнение лечебных блокад, определение показаний к хирургическому лечению)
- Рассеянный склероз и другие демиелинизирующие заболевания нервной системы (дифференциальная диагностика с использованием иммунологических, радиологических и электрофизиологических методик, подбор индивидуальных схем лечения с проведением гормонотерапии, плазмафереза (по показаниям), проведение школ для пациентов и их родственников)
- Головокружение (дифференциальная диагностика с использованием вестибулярных проб, выполнение вестибулярной гимнастики, рекомендации по реабилитации, подбор индивидуальных схем лечения)
- Болезнь Паркинсона и паркинсонизм (дифференциальная диагностика, подбор схем современной комплексной патогенетической терапии, обучение пациентов и родственников, постановка на учет в Городском Центре диагностики и лечения экстрапирамидных расстройств с последующим динамическим наблюдением врачом-паркинсологом Центра
- Дистонии (уточнение этиологии и формы заболевания, индивидуальная консервативная терапия с подбором современных схем, определение показаний и проведение ботулинотерапии с последующим динамическим наблюдением в Городском Центре диагностики и лечения экстрапирамидных расстройств)
- Дегенеративные и наследственные заболевания нервной системы (боковой амиотрофический склероз, деменции, оливопонтоцеребеллярная атрофия (дифференциальная диагностика, генетические исследования, доклиническое обследование родственников пациента, комплексная консервативная терапия)
- Эпилепсия и другие пароксизмальные состояния (вегето-сосудистая дистония, психо-вегетативные кризы) (дифференциальная диагностика с использованием радиологических и электрофизиологических методик, разработка индивидуальных схем лечения, подбор и коррекция дозы противоэпилептических препаратов, коррекция когнитивных и психо-эмоциональных расстройств)
- Остеохондроз позвоночника, грыжи межпозвонковых дисков (консервативная терапия, выполнение лечебных блокад, индивидуальная схема физиотерапии, ЛФК, определение показаний к хирургическому лечению)
- Миастения и другие нервно-мышечные заболевания, полинейропатии (дифференциальная диагностика, патогенетическая терапии с использованием выполнением плазмафереза, гормонотерапии (по показаниям), индивидуальные рекомендации амбулаторного лечения).

В центре оказывается нейрохирургическое лечение больных со следующими заболеваниями нервной системы:
- Опухоли головного и спинного мозга (выполняется микрохирургическое удаление опухоли; биопсия опухоли)
- Опухоли костей черепа (выполняется микрохирургическое удаление опухоли)
- Дегенеративно-дистрофические заболевания позвоночника (выполняется микрохирургическое удаление грыжи диска)
- Невралгия тройничного нерва (микрохирургическая декомпрессия нерва)
- Гидроцефалия, ликворошунтирующие операции
- Аномалия Арнольда-Киари (выполняется хирургическая коррекция аномалии Арнольда-Киари)
- Сирингомиелия (выполняется сирингосубарахноидальное шунтирование; сирингоперитонеальное шунтирование)
- Последствие черепно-мозговой травмы (дефекты костей черепа, посттравматическая ликворея) (выполняется закрытие дефектов свода и основание черепа; люмбоперитонеостомия)
В круглосуточном режиме бригада врачей (неврологов и реаниматологов), оказывает медицинскую помощь жителям Кировского и Пролетарского районов г. Ростова-на-Дону, а также других районов города и области, с острым нарушением мозгового кровообращения.
Ростова-на-Дону, а также других районов города и области, с острым нарушением мозгового кровообращения.
В Центре осуществляется комплексная реабилитация пациентов с последствиями перенесенного инсульта, черепной и спинальных травм, спастическими синдромами различного происхождения, в том числе – мероприятия с использованием аппаратных методик на основе биологической обратной связи.
Врачи-неврологи отделения оказывают медицинскую помощь детям с заболеваниями нервной системы (с 3-х летнего возраста), как на амбулаторно-поликлиническим приеме, так и в стационарных условиях (при наличии показаний).
Лечение пациентов осуществляется согласно стандартам медицинской помощи и клинических рекомендаций.
Сформированы гибкие варианты госпитализации больных, как в рамках обязательного медицинского страхования, так и по платным медицинским услугам.
Имеются палаты повышенной комфортности со всеми удобствами, трехразовое питание.
Разработаны и эффективно используются комплексные лечебно-диагностические программы:
Специалисты, работающие в Центре.
Сотрудники отделения принимают участие в международных программах клинических испытаний новых лекарственных средств.
Руководитель Центра — Гончарова Зоя Александровна, доктор медицинских наук, врач-невролог высшей категории, профессор кафедры нервных болезней и нейрохирургии, главный внештатный невролог г.Ростова-на-Дону.
Неотложная помощь (консервативная и хирургическая) пациентам с острым нарушением мозгового кровообращения (25 коек, из них 6 составляют блок интенсивной терапии и реанимации (БИТР), где проводится интенсивная терапия и реанимация, включая коррекцию нарушений жизненно важных функций организма).
Неотложную помощь неврологическим больным оказывают следующие врачи-специалисты Центра:
- Андриященко Ангелина Левоновна, врач-невролог
- Гагарина Яна Сергеевна, врач-невролог
- Глущенкова Наталья Владимировна, врач-невролог
- Дмитриев Максим Николаевич, к.
 м.н., врач-психиатр
м.н., врач-психиатр - Кадян Норайр Грачаевич, врач-невролог
- Крамаренко Елена Владимировна, врач-невролог высшей категории
- Наумова Олеся Андреевна, врач-кардиолог
- Овсепян Кристина Гивиевна, врач-невролог
- Свиридкина Дина Ивановна, врач-реаниматолог-анестезиолог высшей категории
- Толмачева Виктория Владимировна, врач-невролог
- Рудь Эвелина Германовна, врач-невролог
- Ужахов Руслан Мурадович, врач-невролог
- Хадзиева Хади Измаиловна, врач-невролог
Неотложную помощь неврологическим больным оказывают следующие врачи-специалисты Центра:
Плановая медицинская помощь пациентам с различными неврологическими заболеваниями (47 круглосуточных коек, 15 дневного стационара) осуществляется следующими врачами-специалистами:
- Балязина Елена Викторовна, д.м.н., врач-невролог высшей категории, профессор кафедры
- Будаева Елена Викторовна, врач-невролог высшей категории
- Гельпей Маргарита Александровна, врач невролог
- Ковалева Наталья Сергеевна, к.
 м.н., врач-невролог высшей категории, ассистент кафедры нервных болезней и нейрохирургии;
м.н., врач-невролог высшей категории, ассистент кафедры нервных болезней и нейрохирургии; - Милованова Ольга Владимировна, врач-невролог второй категории;
- Мешкова Яна Юрьевна, врач-невролог;
- Милованова Ольга Владимировна, врач-невролог второй категории;
- Рабаданова Екатерина Адгямовна, врач-невролог
- Руденко Ольга Юрьевна, к.м.н., врач-невролог высшей категории;
- Сафонова Ирина Александровна, к.м.н., врач-невролог высшей категории, доцент кафедры
- Фомина-Чертоусова Неонила Анатольевна, к.м.н., врач-невролог высшей категории, ассистент кафедры
- Ярош Наталья Михайловна, врач-невролог второй категории.
- Балязин Виктор Александрович, врач-нейрохирург, д.м.н., профессор врач высшей категории
- Балязин-Парфенов Игорь Викторович, д.
 м.н., врач высшей категории, ассистент кафедры
м.н., врач высшей категории, ассистент кафедры - Сехвейл Салах М.М., врач-нейрохирург, к.м.н., доцент кафедры
Оперативное лечение (10 коек нейрохирургического профиля) — при наличии показаний к оперативному лечению — проводят врачи-нейрохирурги высшей категории:
- Ковалев Александр Иванович — врач-психиатр, психотерапевт высшей категории
- Агафонова Дарья Сергеевна — врач-психиатр, психотерапевт
- Лубянко Игорь Александрович — врач-психиатр, психотерапевт
- Омельченко Александра Анатольевна — врач-психиатр, психотерапевт.
Терапия психосоматической патологии (3 койки круглосуточного стационара, 10 — дневного стационара) пациентов с различными нарушениями психической сферы.
Все сотрудники Центра регулярно проходят стажировку в ведущих российских и зарубежных университетах и клиниках, принимают активное участие в научных форумах и конгрессах.
Сотрудники Центра принимают участие в международных программах клинических испытаний новых лекарственных средств.
Авторитет Центра в настоящее время признан не только в г. Ростове-на-Дону и Ростовской области, но и в регионах Южного и Северо-Кавказского федеральных округов. Об этом свидетельствует неуклонный рост количества пациентов неврологического и нейрохирургического профиля из этих регионов. Благодаря чуткому и отзывчивому медицинскому персоналу в неврологическом центре поддерживается теплая и дружественная атмосфера, благотворно сказывающаяся на состоянии пациентов и сроках их выздоровления.
Ростове-на-Дону и Ростовской области, но и в регионах Южного и Северо-Кавказского федеральных округов. Об этом свидетельствует неуклонный рост количества пациентов неврологического и нейрохирургического профиля из этих регионов. Благодаря чуткому и отзывчивому медицинскому персоналу в неврологическом центре поддерживается теплая и дружественная атмосфера, благотворно сказывающаяся на состоянии пациентов и сроках их выздоровления.
Контактная информация:
тел.:+7 (863)294-34-38
тел.: 8-918-554-34-38
эл. почта:[email protected]
Кабинет лечения боли
Кабинет лечения боли
Записаться на прием
Белевский Евгений Вячеславович
Врач противоболевой терапии, врач — анестезиолог-реаниматолог, кандидат медицинских наук, врач 1 квалификационной категории
Боль
— самый частый спутник, как неврологических, так и
соматических заболеваний человека. Нередко боль является
основной жалобой пациента и фактором, причиняющим наибольшие
страдания. Боль снижает качество жизни не только пациента,
но и членов его семьи, близких и любимых людей. Видя, как
человек страдает от невыносимой боли, окружающие невольно
вовлекаются в этот процесс, испытывая стресс, пытаясь помочь
больному. Проблема лечения боли в России не решена,
пациент зачастую продолжает страдать и остается один на один
с болью. В настоящее время в Москве и других городах
открываются Клиники лечения боли. Каждая из этих клиник
использует различные методы лечения боли — медикаментозный,
физиотерапевтический, рефлексотерапию, мануальную терапию,
остеопатию, многие предлагают малоинвазивные техники в
борьбе с болью — лечебные блокады. Как же пациенту
разобраться во всем многообразии предложений на рынке
медицинских услуг? Кто-то ориентируется на рекомендации
знакомых, кто-то на телевидение, где в прямом эфире
«повелители боли» быстро убирает боль и пациент «оживает» на
глазах у изумленной публики, кто-то изучает форумы и отзывы
на полях всемирной паутины.
Боль снижает качество жизни не только пациента,
но и членов его семьи, близких и любимых людей. Видя, как
человек страдает от невыносимой боли, окружающие невольно
вовлекаются в этот процесс, испытывая стресс, пытаясь помочь
больному. Проблема лечения боли в России не решена,
пациент зачастую продолжает страдать и остается один на один
с болью. В настоящее время в Москве и других городах
открываются Клиники лечения боли. Каждая из этих клиник
использует различные методы лечения боли — медикаментозный,
физиотерапевтический, рефлексотерапию, мануальную терапию,
остеопатию, многие предлагают малоинвазивные техники в
борьбе с болью — лечебные блокады. Как же пациенту
разобраться во всем многообразии предложений на рынке
медицинских услуг? Кто-то ориентируется на рекомендации
знакомых, кто-то на телевидение, где в прямом эфире
«повелители боли» быстро убирает боль и пациент «оживает» на
глазах у изумленной публики, кто-то изучает форумы и отзывы
на полях всемирной паутины.
В чем наши плюсы?
Используем авторские уникальные методы лечения боли — внутрикостные блокады и внутрикостные инфузии. Множество учеников применяют внутрикостные блокады в России и зарубежом.
Мы успешно помогаем, как молодым, так и пожилым пациентам, улучшая их двигательную активность и качество жизни.Помогаем
пациентам с болями в спине и шее, болевыми синдромами
после операции на позвоночнике, головными и лицевыми
болями, мигренью, острыми травматическими и
посттравматическими болями, болями при диабетической
полинейропатии, нейропатии после позиционного сдавления
(туннельные нейропатии), болями после опоясывающего
герпеса, суставными болями (в тазобедренных, коленных,
голеностопных, плечевых, локтевых скставах), тазовыми
болями у мужчин и женщин, болями при остеопорозе
позвоночника у пожилых.
Также есть положительный опыт работы с редкими болевыми синдромами — эритромелалгией, болями при спастичности после инсульта, болями после внутричерепной или спинальной травмы, фантомными болями, болями при паркинсонизме и при рассеянном склерозе, болями при ювенильном остеопорозе.
Основной метод терапии — внутрикостные блокады.
Внутрикостная блокада — это
высокоэффективный способ лечения боли и связанных с ней
чувствительных, двигательных, спастических, сосудистых и
других нарушений методом введения лекарственного
раствора в губчатое вещество кости. Метод
внутрикостных блокад разрабатывается отечественными
учеными с 50-х годов 20 века. Основоположниками метода
внутрикостных блокад являются Шуляк Г. М., Акилова А.Т.,
позднее внутрикостные блокады изучали Протасов В.Я.,
1970; А.Р. Варфоломеев, 1971; В.А. Поляков, 1990; Г.А.
Янковский, 1982, Е.Л. Соков, 1983, 1994, 1995, 2001,
2007, 2013, 2015. За прошедшее время были раскрыты
механизмы лечебного действия внутрикостных блокад,
доказана их безопасность и высокая эффективность.
Значительную роль в разработке и внедрению метода
внутрикостных блокад сыграли труды проф. Сокова Е.Л. и
Корниловой Л.Е., ими были раскрыты механизмы лечебного
действия внутрикостных блокад, изложенные в «Остеогенной
теории нейроортопедических заболеваний», разработана и
внедрена в практику наиболее эффективная методика
внутрикостных блокад. За свои открытия профессор Соков
Е.Л. в 2009 году в Германии (Ганновер) удостоен медали
Роберта Коха.
М., Акилова А.Т.,
позднее внутрикостные блокады изучали Протасов В.Я.,
1970; А.Р. Варфоломеев, 1971; В.А. Поляков, 1990; Г.А.
Янковский, 1982, Е.Л. Соков, 1983, 1994, 1995, 2001,
2007, 2013, 2015. За прошедшее время были раскрыты
механизмы лечебного действия внутрикостных блокад,
доказана их безопасность и высокая эффективность.
Значительную роль в разработке и внедрению метода
внутрикостных блокад сыграли труды проф. Сокова Е.Л. и
Корниловой Л.Е., ими были раскрыты механизмы лечебного
действия внутрикостных блокад, изложенные в «Остеогенной
теории нейроортопедических заболеваний», разработана и
внедрена в практику наиболее эффективная методика
внутрикостных блокад. За свои открытия профессор Соков
Е.Л. в 2009 году в Германии (Ганновер) удостоен медали
Роберта Коха. , научные исследования Сокова Е.Л.в данном
направлении были поддержаны Российским Фондом
Фундаментальных исследований (2012-2014 г.), а
монография Корниловой Л.Е., Сокова Е.Л., Атюкова О.П.
«Внутрикостные блокады (клинические наблюдения)»
удостоена сертификата и золотой медали Парижского
книжного салона (Париж, 2015). Согласно «Остеогенной
теории нейроортопедических заболеваний» лечебное
действие внутрикостных блокад обусловлено следующими
механизмами:
, научные исследования Сокова Е.Л.в данном
направлении были поддержаны Российским Фондом
Фундаментальных исследований (2012-2014 г.), а
монография Корниловой Л.Е., Сокова Е.Л., Атюкова О.П.
«Внутрикостные блокады (клинические наблюдения)»
удостоена сертификата и золотой медали Парижского
книжного салона (Париж, 2015). Согласно «Остеогенной
теории нейроортопедических заболеваний» лечебное
действие внутрикостных блокад обусловлено следующими
механизмами:
— Введение лекарственного раствора в костную ткань приводит к раскрытию запустевших сосудов кости, что улучшает кровоток, как в самой кости, так и окружающих ее тканях.
— под действием различных
этиологических факторов внутрикостное давление
повышается и приводит к формированию боли и других
симптомов, введение же иглы в кость снижает
внутрикостное давление и уменьшает или купирует болевой
и другие симптомы, — микроотверстие от иглы в
кости зарастает 4-6 недель и в течение этого время
поддерживается нормальное внутрикостное давление в
кости, тем самым создаются условия для поддержания
ремиссии болевого синдрома на длительный период времени,
— Используемые во время процедуры стволовые клетки
аутологичного костного мозга стимулируют восстановление
поврежденной костной ткани и окружающих кость мышц,
связок, хрящей, межпозвонковых дисков — усиливается
репаративная регенерация и метаболическая активность
костной ткани, т. е. происходит «омоложение»
позвоночника. Эффект от внутрикостной блокады 50%
пациентов ощущают прямо «на игле», т.е. сразу после
проведения манипуляции. Часто пациенты в кабинете
забывают трости и костыли, так как боль быстро и
значительно уменьшается. У 30% пациентов – уменьшение
болевого синдрома отмечается на следующий день. У 15%
пациентов – через одну-две недели после окончания
лечения. У 5% пациентов – внутрикостные блокады
неэффективны. В этом случае необходимо проводить
дальнейший диагностический поиск для уточнения причины
болевого синдрома. Для получения стойкого и
длительного эффекта требуется проведение курса из 5-7
внутрикостных блокад с интервалом между процедурами в
1-3 дня.
е. происходит «омоложение»
позвоночника. Эффект от внутрикостной блокады 50%
пациентов ощущают прямо «на игле», т.е. сразу после
проведения манипуляции. Часто пациенты в кабинете
забывают трости и костыли, так как боль быстро и
значительно уменьшается. У 30% пациентов – уменьшение
болевого синдрома отмечается на следующий день. У 15%
пациентов – через одну-две недели после окончания
лечения. У 5% пациентов – внутрикостные блокады
неэффективны. В этом случае необходимо проводить
дальнейший диагностический поиск для уточнения причины
болевого синдрома. Для получения стойкого и
длительного эффекта требуется проведение курса из 5-7
внутрикостных блокад с интервалом между процедурами в
1-3 дня.
Белевский Евгений Вячеславович
В 2011 году закончил Тверскую ГМА, в 2018 году защитил кандидатскую диссертацию в г. Санкт-Петербург «Тактика послеоперационного обезболивания пациентов, перенёсших большие операции на органах брюшной полости с сопутствующей ишемической болезнью сердца».
Санкт-Петербург «Тактика послеоперационного обезболивания пациентов, перенёсших большие операции на органах брюшной полости с сопутствующей ишемической болезнью сердца».
С 2016 года активно занимается регионарный анестезией и лечением хронической и послеоперационной боли. Автор более 15 научных статей.
Член общества специалистов лечения боли.
Список болевых синдромов, лечением которых осуществляется:
- Боли в пояснице или крестцовом отделе, включая «радикулит», люмбалгию, ишиас, боль при остеохондрозе позвоночника, боль при грыжах межпозвонковых дисков, воспаление седалищного нерва, синдром грушевидной мышцы, асептический спондилит
- Боли в шее, боли отдающие из шеи в затылок, плечи или руки, боли и ограничение движений в плечевом суставе в плечевом суставе (артроз плечевого сустава, плечелопаточный периатртроз), боль в шее при остеохондрозе шейного отдела позвоночника, боль в шее при грыжах межпозвонковых дисков, невралгия затылочного нерва.

- Лицевые боли, невралгия или неврит тройничного нерва, боль после удаления зуба, атипичные лицевые боли.
- Посттравматические боли в руках или ногах, боли после травмы или повреждения нерва, комплексный регионарный болевой синдром, каузалгия.
- Боли при заболеваниях суставов: артрозах, артритах тазобедренных, коленных, локтевых, плечевых и других суставов. Боли при эпикондилитах, пяточных шпорах и т.д.
- Боль и спастичность после инсультов
Преимущества лечебных блокад перед другими методами лечения боли:
1. При медикаментозном методе лекарственные препараты сначала попадают в общий кровоток (где они не так нужны) и только потом, в меньшем количестве — в болезненный очаг. При лечебной блокаде же лекарственные вещества доставляются непосредственно в патологический очаг (где они наиболее необходимы), и только потом в меньшем количестве поступают в общий кровоток.
2. При электронейростимуляции, иглотерапии и других физических методах происходит стимуляция преимущественно быстрых нервных проводников, что рефлекторно и опосредованно тормозит хроническую болевую импульсацию, которая распространяется по медленным проводникам./32/32.jpg) При лечебной блокаде же анестетик непосредственно уменьшает повышенную импульсацию преимущественно по медленным проводникам, по которым и распространяется хроническая боль.
При лечебной блокаде же анестетик непосредственно уменьшает повышенную импульсацию преимущественно по медленным проводникам, по которым и распространяется хроническая боль.
3. При нейрохирургических методах алкоголизации и перерезке нервных проводников на различных уровнях, которые являются методами отчаяния и, по существу, свидетельством бессилия медицины, происходит длительное или постоянное прерывание не только болевой, но и нормальной импульсации, что приводит к целому ряду побочных явлений и осложнений. При лечебной блокаде же анестетик лишь временно прерывает болевую, патологическую импульсацию, сохраняя другие виды нормальных нервных импульсов. Однако временная, но многократная блокада болевой импульсации из патологического очага позволяет добиться выраженного и продолжительного терапевтического эффекта. В отличие от нейрохирургических методов, лечебные блокады могут применяться многократно, при каждом обострении. Лечебные блокады снимают на длительное время местное патологическое мышечное напряжение и сосудистый спазм. Они восстанавливают нарушенную трофику местных тканей. Лечебные блокады, прерывая болевую импульсацию из патологического очага, приводят к нормализации рефлекторных взаимоотношений на всех уровнях центральной нервной системы. Лечебные блокады являются патогенетическим методом терапии клинических проявлений нейроортопедических заболеваний. опыт применения лечебных блокад, а также крупные статистические исследования в США и других западных странах говорят о том, что лечебные блокады являются одним из наиболее эффективных методов лечения клинических проявлений нейроортопедических заболеваний и, прежде всего, болевого синдрома. Применение же наиболее патогенетических внутрикостных блокад, которые являются приоритетно российскими и не применяются за рубежом, позволяет значительно повысить эффективность комплексной терапии этих заболеваний.
Они восстанавливают нарушенную трофику местных тканей. Лечебные блокады, прерывая болевую импульсацию из патологического очага, приводят к нормализации рефлекторных взаимоотношений на всех уровнях центральной нервной системы. Лечебные блокады являются патогенетическим методом терапии клинических проявлений нейроортопедических заболеваний. опыт применения лечебных блокад, а также крупные статистические исследования в США и других западных странах говорят о том, что лечебные блокады являются одним из наиболее эффективных методов лечения клинических проявлений нейроортопедических заболеваний и, прежде всего, болевого синдрома. Применение же наиболее патогенетических внутрикостных блокад, которые являются приоритетно российскими и не применяются за рубежом, позволяет значительно повысить эффективность комплексной терапии этих заболеваний.
Профилирование пациентов с посттравматической невропатией тройничного нерва
Цели:
Описать причину, клинические признаки и симптомы пациентов, поступающих в центр третичной медицинской помощи с ятрогенными поражениями нижнечелюстных ветвей тройничного нерва.
Методы: Анамнез боли, оценка боли с использованием визуальной аналоговой шкалы и результаты механосенсорного тестирования были записаны у 93 пациентов с ятрогенными повреждениями язычного нерва (LNI) и у 90 пациентов с ятрогенными повреждениями нижнего альвеолярного нерва (IANI).Результаты были проанализированы с использованием статистического программного обеспечения SPSS. Для непараметрического тестирования частот применялись критерии хи-квадрат, где P 0,05 указывал на статистическую значимость. Соответствующие корреляции были также выполнены между некоторыми наборами данных.
Полученные результаты:
Женщин было направлено значительно больше, чем мужчин (P <0,05). В целом операция на третьем моляре (TMS) вызвала 73% LNI с последующей местной анестезией (LA) (17%). Более разнообразные процедуры вызвали IANI, включая TMS (60%), LA (19%), имплантаты (18%) и эндодонтию (8%). Примерно у 70% пациентов наблюдалась невропатическая боль, совпадающая с анестезией и парестезией. Невропатия была продемонстрирована у всех пациентов с различной степенью потери механосенсорной функции, парестезией, дизестезией, аллодинией и гипералгезией. Функционально пациенты с IANI и LNI в основном имели проблемы с речью и питанием, причем речь была нарушена у значительно большего числа пациентов с LNI (P <.001). Сон, чистка зубов и питье были значительно более проблематичными для пациентов IANI (P <0,05, P <0,001 и P <0,0001, соответственно).
Более разнообразные процедуры вызвали IANI, включая TMS (60%), LA (19%), имплантаты (18%) и эндодонтию (8%). Примерно у 70% пациентов наблюдалась невропатическая боль, совпадающая с анестезией и парестезией. Невропатия была продемонстрирована у всех пациентов с различной степенью потери механосенсорной функции, парестезией, дизестезией, аллодинией и гипералгезией. Функционально пациенты с IANI и LNI в основном имели проблемы с речью и питанием, причем речь была нарушена у значительно большего числа пациентов с LNI (P <.001). Сон, чистка зубов и питье были значительно более проблематичными для пациентов IANI (P <0,05, P <0,001 и P <0,0001, соответственно).
Заключение:
Нейропатическая боль, а также анестезия часто возникают после ятрогенного повреждения тройничного нерва, как и другие посттравматические повреждения сенсорного нерва. Клиницисты должны признать это относительно распространенной проблемой, и информированное согласие, надлежащим образом сформулированное для пациентов с риском повреждения тройничного нерва, в связи со стоматологией требует пересмотра.
Посттравматическая невропатия тройничного нерва. Исследование 63 случаев
Med Oral Patol Oral Cir Bucal. 2012 Март; 17 (2): e297 – e300.
, 1 , 2 , 3 и 4Мария Пеньярроча
1 Доцент кафедры челюстно-лицевой хирургии. Медицинская и стоматологическая школа Валенсийского университета
Давид Пеньярроча
2 Хирург-стоматолог. Магистр челюстно-лицевой хирургии и имплантологии.Медицинский и стоматологический факультет Университета Валенсии
Хосе В. Баган
3 Заведующий кафедрой оральной медицины. Медицинский и стоматологический факультет Валенсийского университета. Заведующий отделением стоматологии больницы общего профиля Университета Валенсии
Мигель Пеньярроча
4 Заведующий отделением стоматологической хирургии. Медицинская и стоматологическая школа Валенсийского университета. Валенсия (Испания)
Валенсия (Испания)
1 Доцент кафедры челюстно-лицевой хирургии. Медицинская и стоматологическая школа Валенсийского университета
2 Хирург-стоматолог.Магистр челюстно-лицевой хирургии и имплантологии. Медицинский и стоматологический факультет Валенсийского университета
3 Заведующий кафедрой оральной медицины. Медицинская и стоматологическая школа Валенсийского университета. Заведующий отделением стоматологии больницы общего профиля Университета Валенсии
4 Заведующий отделением стоматологической хирургии. Медицинская и стоматологическая школа Валенсийского университета. Валенсия (Испания)
Автор, ответственный за переписку.Поступило 15 ноября 2010 г .; Принято 16 сентября 2011 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Реферат
Введение. Невропатия тройничного нерва чаще всего является вторичной по отношению к травме. В настоящем исследовании исследуются основные причины и факторы, влияющие на выздоровление.
Материал и методы. Было проведено ретроспективное исследование с участием 63 пациентов с невропатией тройничного нерва травматологического происхождения, находящихся под наблюдением не менее 12 месяцев.
Полученные результаты. Пятьдесят четыре процента всех случаев были диагностированы после операции на третьем моляре нижней челюсти.У 37 и 19 пациентов сенсорный дефект располагался на территории, иннервируемой подбородочным и язычным нервом соответственно. О боли сообщалось в 57% случаев, особенно у пожилых пациентов. Что касается инвалидности пациентов, качество жизни не изменилось в трех случаях, в то время как легкие изменения были зарегистрированы у 25 субъектов, а серьезные изменения — у 8. Частичное или полное выздоровление наблюдалось в 25 случаях через 6 месяцев и в 32 случаях через год. По прошествии этого периода случаев выздоровления было немного.Выздоровление оказалось более быстрым у самых маленьких пациентов, которые, к тому же, были людьми с наименьшей болью.
Заключение. Наши пациенты с невропатией тройничного нерва выздоравливали, в частности, в первые 6 месяцев и до одного года после травмы. Пациенты старшего возраста чаще страдали от боли, связанной с сенсорным дефектом. С другой стороны, их дискомфорт был более сильным, и пациенты с наибольшей болью и худшими клиническими показателями также демонстрировали сравнительно более слабое течение.
По прошествии этого периода случаев выздоровления было немного.Выздоровление оказалось более быстрым у самых маленьких пациентов, которые, к тому же, были людьми с наименьшей болью.
Заключение. Наши пациенты с невропатией тройничного нерва выздоравливали, в частности, в первые 6 месяцев и до одного года после травмы. Пациенты старшего возраста чаще страдали от боли, связанной с сенсорным дефектом. С другой стороны, их дискомфорт был более сильным, и пациенты с наибольшей болью и худшими клиническими показателями также демонстрировали сравнительно более слабое течение.
Ключевые слова: Посттравматическая нейропатия тройничного нерва.
Введение
Травмы, случайные или ятрогенные, являются наиболее частой причиной невропатии тройничного нерва (TN) (1). Большинство случаев посттравматической TN является результатом хирургических операций на ротовой полости, в частности, удаления ретинированных нижних третьих моляров. Сенсорные дефекты локализуются в основном на территориях, иннервируемых нижним альвеолярным нервом и язычным нервом (2). Большинство этих повреждений обратимы, хотя более стойкие случаи могут отрицательно сказаться на качестве жизни пациента (3).
Большинство этих повреждений обратимы, хотя более стойкие случаи могут отрицательно сказаться на качестве жизни пациента (3).
В настоящем исследовании оценивается серия из 63 пациентов с посттравматическим ТН с целью выявления основных причин, клинических проявлений и факторов, влияющих на выздоровление.
Материалы и методы
Ретроспективное исследование было проведено с участием 63 пациентов, обследованных по поводу сенсорных изменений лица с диагнозом невропатия тройничного нерва травматического происхождения в период 1996-2009 гг. Были установлены следующие критерии включения: пациенты с сенсорным дефектом на кожно-слизистой территории, иннервируемые одной или несколькими ветвями тройничного нерва, вызванные травматическим процессом, и минимальный период наблюдения — 12 месяцев.Случаи с бессимптомным периодом между моментом травмы и появлением невропатии были исключены. Все пациенты дали информированное согласие на участие в исследовании.
Не было зарегистрировано никаких непосредственных передних травм, способных объяснить невропатию. Регистрировали наличие, степень и продолжительность сопутствующего дискомфорта, который оценивался следующим образом: жжение, зуд, колющие боли, мигающая боль. Для оценки степени инвалидности, вызванной невропатией тройничного нерва, использовалась клиническая шкала: отсутствие эффекта (не влияет на повседневную жизнедеятельность), легкая (вызывает некоторые опасения, предотвращает некоторую необычную активность), умеренная (препятствует нормальной жизни, ограничивает некоторые обычные виды деятельности. ) или тяжелой (вызывает серьезную инвалидность).
Регистрировали наличие, степень и продолжительность сопутствующего дискомфорта, который оценивался следующим образом: жжение, зуд, колющие боли, мигающая боль. Для оценки степени инвалидности, вызванной невропатией тройничного нерва, использовалась клиническая шкала: отсутствие эффекта (не влияет на повседневную жизнедеятельность), легкая (вызывает некоторые опасения, предотвращает некоторую необычную активность), умеренная (препятствует нормальной жизни, ограничивает некоторые обычные виды деятельности. ) или тяжелой (вызывает серьезную инвалидность).
Внеротовые панорамные рентгеновские снимки были получены во всех случаях. В некоторых случаях выполнялась компьютерная томография челюстно-лицевой или черепной частей. Был назначен комплекс витаминов B, а при болях — амитриптилин 50-75 мг / день и / или карбамазепин 400-600 мг / день. Клинический курс оценивался через один, 6 и 12 месяцев после посещения клиники и при последнем контроле и оценивался как полное выздоровление, частичное выздоровление или отсутствие улучшения.
Был проведен описательный анализ всех переменных исследования.Сравнение качественных переменных проводилось с использованием критерия хи-квадрат, принимая статистическую значимость для p <0,05.
Результаты
Средний возраст пациентов составлял 45,4 года (диапазон 17-76). Мужчин было 11, женщин — 52 (соотношение 1: 5).
Были зарегистрированы следующие предшествующие травмы: удаление ретинированного третьего моляра нижней челюсти (34 пациента, 54%), простое удаление (9 пациентов), удаление фрагментов ретинированного корня (4 пациента), установка имплантата (9 пациентов), стоматологическая анестезия в консервативное стоматологическое лечение (4 пациента), эндодонтическое лечение (1 пациент) и прямые травмы лица (2 пациента).
В 46% случаев нейропатия располагалась слева, в 49% — справа, а в 5% случаев заболевание оказалось двусторонним. Наиболее часто поражаемая территория соответствовала третьей ветви тройничного нерва: нижний альвеолярный нерв в 37 случаях и язычный нерв в 19 случаях. Территория второй ветви тройничного нерва была поражена в четырех случаях, в то время как вторая и третья ветви были поражены у двух испытуемых. Наконец, в одном случае были затронуты все три ветви пятого черепного нерва.
Территория второй ветви тройничного нерва была поражена в четырех случаях, в то время как вторая и третья ветви были поражены у двух испытуемых. Наконец, в одном случае были затронуты все три ветви пятого черепного нерва.
Помимо сенсорного дефекта 57% пациентов (36 случаев) страдали сопутствующей болью. Боль описывалась как жгучая в 19 случаях, зуд в 6, колющая в 5 и мигающая или трепещущая в трех. У трех пациентов боль была плохо выражена. Что касается инвалидности пациентов, качество жизни не было затронуто в трех случаях, в то время как легкие изменения были зарегистрированы у 25 субъектов, а умеренные или тяжелые изменения — у 8.
Что касается медикаментозного лечения, 5 пациентов не получали лечения, а 25 получали только витамин B. сложный.Комбинация карбамазепина и амитриптилина была назначена 18 пациентам, четверо — только карбамазепин, а 9 — амитриптилин. Наконец, двое пациентов получали другие лекарства и анальгетики.
Через 6 и 12 месяцев наблюдения улучшились 25 и 32 пациента соответственно. По поводу последнего контроля (в среднем 3 года) у 35 пациентов улучшилось состояние. Полное выздоровление произошло в 9 случаях в течение первых 6 месяцев наблюдения и еще в 7 случаях в течение следующих 6 месяцев.Однако после этого периода выздоровления не было ().
По поводу последнего контроля (в среднем 3 года) у 35 пациентов улучшилось состояние. Полное выздоровление произошло в 9 случаях в течение первых 6 месяцев наблюдения и еще в 7 случаях в течение следующих 6 месяцев.Однако после этого периода выздоровления не было ().
Таблица 1
Клиническое течение больных.
Незначительные различия были зарегистрированы при сравнении наличия боли по возрастным интервалам (хи-квадрат = 5,612, p = 0,06). Из пациентов старше 60 лет 81,3% жаловались на боли. В возрастном диапазоне 41–60 лет эта доля снизилась до 55%, в то время как самые молодые пациенты (20–40 лет) сообщили о боли в 44,4% случаев.Средний возраст пациентов с сопутствующей болью составлял 50,41 года по сравнению с 38,7 года в случае пациентов без боли (t-критерий Стьюдента для независимых выборок = -3,084, p = 0,003). Статистически значимая связь наблюдалась между возрастом пациента и наличием боли.
Статистически значимые различия наблюдались при сопоставлении возраста пациентов с интенсивностью боли (r = 0,385, p = 0,002). Фактически, интенсивность боли увеличивалась с возрастом. Это было подтверждено дисперсионным анализом (ANOVA) между возрастными группами и интенсивностью боли (F = 3.862, p = 0,026) — самые старые испытуемые, сообщавшие о наибольшей интенсивности боли (рис.).
Фактически, интенсивность боли увеличивалась с возрастом. Это было подтверждено дисперсионным анализом (ANOVA) между возрастными группами и интенсивностью боли (F = 3.862, p = 0,026) — самые старые испытуемые, сообщавшие о наибольшей интенсивности боли (рис.).
Интенсивность боли по возрастным группам. Средняя интенсивность боли, возраст 1, возраст 2, возраст 3.
О боли сообщили четыре мужчины и 32 женщины, хотя статистически значимых различий в наличии боли между двумя полами не наблюдалось (хи-квадрат = 2,350, p = 0,125), поскольку в серию исследований было включено много женщин. Не было обнаружено корреляций между полом пациента и характеристиками, частотой или продолжительностью боли.
Напротив, наблюдалась значительная взаимосвязь между интенсивностью боли и клиническим течением. Эта взаимосвязь была исследована с помощью смешанного дисперсионного анализа, принимая в качестве независимых переменных время, прошедшее от одного клинического контроля до следующего (через 1, 6 и 12 месяцев, и последний контроль), и интенсивность боли (нет, слабая, умеренная, сильная). , в то время как в качестве зависимой переменной принималось восстановление или невосстановление. (Рис.) Указывает на то, что пациенты с менее интенсивной болью со временем выздоравливали лучше.
Улучшение со временем и первоначальная боль. (Y: среднее улучшение). Без боли, слабая, умеренная, сильная, 1 месяц, 6 месяцев, 12 месяцев, последний контроль.
Смешанный двухфакторный дисперсионный анализ ANOVA использовался для сравнения клинической шкалы с курсом пациента во времени, принимая в качестве первого фактора прошедшее время (1, 6 и 12 месяцев и последний контроль), а в качестве второго фактора — клинический балл. В свою очередь, улучшение состояния пациента было принято в качестве зависимой переменной. Анализ выявил статистически значимую взаимосвязь, при которой более низкие клинические показатели коррелировали с более значительным средним улучшением состояния пациента (рис.).
Улучшение с течением времени и по клинической шкале (Y: среднее улучшение). Нет эффекта, легкий, средний, тяжелый, 1 месяц, 6 месяцев, 12 месяцев, последний контроль.
Обсуждение
Невропатия тройничного нерва чаще всего является вторичной по отношению к травме, ее доля составляет около 40% всех случаев (1). Наиболее частая причина — удаление третьего моляра нижней челюсти (4,5). Пятьдесят четыре процента наших пациентов страдали невропатией после удаления нижних третьих моляров с наблюдением локальных сенсорных дефектов.Область нижнего альвеолярного нерва была поражена более чем в двух третях всех случаев, а территория язычного нерва — почти в одной трети. Повреждение нижнего альвеолярного нерва объясняется анатомической близостью между верхушками третьего моляра и каналом, в котором находится нерв (4,6). Разделение коронки представляется жизнеспособным вариантом в тех случаях, когда полное удаление зуба представляет значительный риск повреждения нижнего альвеолярного нерва (7).
Аналогичным образом, из-за анатомического положения язычного нерва по отношению к третьему коренному зубу, первый может быть поврежден во время маневрирования по извлечению моляра (6,8-10).Schultze-Mosgau и Reich (11) в серии экстракций 1107 моляров сообщили о невропатии, поражающей нижний альвеолярный нерв и язычный нерв в 2,2% и 1,4% случаев соответственно. Филдинг и др. (12) в опросе 452 челюстно-лицевых хирургов обнаружили, что 343 заявили, что у них были пациенты с языковыми сенсорными дефектами после удаления ретинированных нижних моляров, и что эти изменения оказались постоянными в 18,6% случаев. Кипп и др. (13) после удаления 1377 нижних моляров сообщили о 60 случаях дизестезии или гипестезии, причем 13 из этих случаев были постоянными.Хирургия такого рода представляет опасность даже при максимальной осторожности, и пациент должен быть должным образом проинформирован об этом факте.
Невропатия тройничного нерва (TN), вторичная по отношению к стоматологической анестезии, мало описана в литературе и была зарегистрирована в четырех случаях нашей серии. Chan и Mulford (14) опубликовали случай ятрогенного TN в результате инъекции местной анестезии. Онемение подбородка после установки дентального имплантата было описано как следствие прямого повреждения нижнего альвеолярного нерва хирургическим сверлом или самим имплантатом (15).Знание о распределении кровоснабжения альвеолярных сосудов в области третьего моляра важно при выполнении хирургических процедур, которые могут повлиять на эти структуры (16). После блокады нижнего альвеолярного нерва может произойти необратимое повреждение нерва (17). Сообщалось о случае после стоматологической анестезии в контексте хирургических вмешательств такого рода без прямого повреждения нерва имплантатом (18). Нижний альвеолярный нерв может быть поврежден во время удаления нижнего моляра в результате прямого травматизма или нейротоксичности (19), как это произошло в одном из наших случаев.
Согласно Karas et al. (20) сенсорные нарушения по отношению к TN чаще встречаются у женщин, в то время как Sandstedt и Sörensen (4) обнаружили, что женщины страдают от более продолжительной и продолжительной боли, чем мужчины. Большинство наших пациентов были женщинами, и мы не обнаружили существенных различий в соотношении пола пациентов с наличием или характеристиками боли. Было замечено, что пациенты старшего возраста страдают от большей боли. Эти данные совпадают с данными, опубликованными Сандштедтом и Соренсеном (4). Похожая ситуация была обнаружена в случае постгерпетической невралгии тройничного нерва, где по неизвестной причине заболеваемость увеличивалась с возрастом, затрагивая 30-50% всех пациентов старше 60 лет (14).
Прогноз зависит от тяжести повреждения нерва. Кипп и др. (13) после удаления 1377 пораженных нижних третьих моляров сообщили о сенсорных изменениях в 60 случаях, из которых 64% исчезли в течение первых 6 месяцев. Из наших случаев в 9 случаях было отмечено полное выздоровление через 6 месяцев, в то время как еще 7 пациентов показали полное выздоровление через 12 месяцев. Однако по истечении этого периода дальнейших выздоровлений практически не было. Некоторые авторы (21) сообщают, что частота спонтанного выздоровления через 6 месяцев после причинного поражения очень низка, и что если регенерация аксонов не происходит в течение двух лет, шансы на регенерацию теряются, и повреждение становится постоянным.
Sandstedt и Sörensen (4) обследовали 226 пациентов с сенсорными расстройствами тройничного нерва, которым требовалась экономическая компенсация от страховых компаний. Семьдесят девять процентов случаев были следствием удаления третьего моляра нижней челюсти, а 70% пациентов жаловались на парестезии. Женщины и пожилые люди сообщали о наибольшем дискомфорте после повреждения нервов. Боль может обусловливать как функциональные, так и психологические последствия у этих пациентов (22,23). Более половины наших пациентов страдали от боли, связанной с сенсорным дефектом, особенно пожилые пациенты.С другой стороны, эти пожилые пациенты страдали более сильной болью, с более низкими клиническими показателями и сравнительно более слабым течением.
Ссылки
1. Peñarrocha MA, Mora E, Bagán JV, García B, Peñarrocha M. Идиопатические невропатии тройничного нерва: описание 15 случаев. J Oral Maxillofac Surg. 2009. 67: 2364–8. [PubMed] [Google Scholar] 2. Блэкберн CW. Метод оценки при повреждении язычного нерва. Br J Oral Maxillofac Surg. 1990; 28: 238–45. [PubMed] [Google Scholar] 3. Джерджес В., Упиле Т., Шах П., Нхембе Ф., Гудка Д., Кафас П.Факторы риска, связанные с повреждением нижних альвеолярных и язычных нервов после операции на третьем моляре. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010; 109: 335–45. [PubMed] [Google Scholar] 4. Sandstedt P, Sörensen S. Нейросенсорные нарушения тройничного нерва: долгосрочное наблюдение за травматическими повреждениями. J Oral Maxillofac Surg. 1995; 53: 498–505. [PubMed] [Google Scholar] 5. Роберт Р.К., Баккетти П., Погрель М.А. Частота повреждений тройничного нерва после удаления третьего моляра.J Oral Maxillofac Surg. 2005; 63: 732–5. [PubMed] [Google Scholar] 6. Робинсон ПП. Влияние травмы на свойства афферентных волокон язычного нерва. Br J Oral Maxillofac Surg. 1992; 30: 39–45. [PubMed] [Google Scholar] 7. Ланди Л., Маниконе П.Ф., Пиччинелли С., Райя А., Райя Р. Новый хирургический подход к ретенированным третьим молярам нижней челюсти для снижения риска парестезии: серия случаев. J Oral Maxillofac Surg. 2010; 68: 969–74. [PubMed] [Google Scholar] 8. Уолтерс Х. Уменьшение повреждения язычного нерва при хирургии третьего моляра: клинический аудит 1350 случаев.Бр Дент Дж. 1995; 178: 140–4. [PubMed] [Google Scholar] 9. Бранн Ч.Р., Брикли М.Р., Шепард Дж.П. Факторы, влияющие на повреждение нервов во время операции на нижнем третьем моляре. Бр Дент Дж. 1999; 186: 514–6. [PubMed] [Google Scholar] 10. Погрель М.А., Ле Х. Этилогия повреждений язычного нерва в области третьего моляра: труп и гистологическое исследование. J Oral Maxillofac Surg. 2006; 64: 1790–4. [PubMed] [Google Scholar] 11. Schultze-Mosgau S, Reich RH. Оценка нарушений нижних альвеолярных и язычных нервов после зубочелюстной хирургии и восстановления чувствительности.Int J Oral Maxillofac Surg. 1993; 22: 214–7. [PubMed] [Google Scholar] 12. Филдинг AF, Rachiele DP, Frazier G. Парестезия язычного нерва после операции на третьем моляре: ретроспективное клиническое исследование. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997; 84: 345–8. [PubMed] [Google Scholar] 13. Кипп Д.П., Гольдштейн Б.Х., Вайс WWJr. Дизестезия после хирургии третьего моляра нижней челюсти: ретроспективное исследование и анализ 1377 хирургических вмешательств. J Am Dent Assoc. 1980; 100: 185–92. [PubMed] [Google Scholar] 14.Чанг В.К., Малфорд Г.Дж. Ятрогенная сенсомоторная нейропатия тройничного нерва в результате местной анестезии: отчет о клиническом случае. Arch Phys Med Rehabil. 2000. 81: 1591–3. [PubMed] [Google Scholar] 15. Бартлинг Р., Фриман К., Краут Р.А. Частота изменения чувствительности подбородочного нерва после установки имплантата на нижней челюсти. J Oral Maxillofac Surg. 1999; 57: 1408–12. [PubMed] [Google Scholar] 16. Погрель М.А., Дорфман Д., Фаллах Х. Анатомическая структура нижнего альвеолярного сосудисто-нервного пучка в области третьего моляра.J Oral Maxillofac Surg. 2009. 67: 2452–4. [PubMed] [Google Scholar] 17. Погрель М.А. Необратимое повреждение нервов из-за блокады нижних альвеолярных нервов. Расширение за счет включения артикаина. J Calif Dent Assoc. 2007; 35: 271–3. [PubMed] [Google Scholar] 18. Фланаган Д. Отсроченное начало измененных ощущений после установки дентального имплантата и местной анестезии ментального блока: описание случая. Имплант Дент. 2002; 11: 324–30. [PubMed] [Google Scholar] 19. Погрель М.А. Повреждение нижнего альвеолярного нерва в результате терапии корневых каналов.J Am Dent Assoc. 2007; 138: 65–9. [PubMed] [Google Scholar] 20. Карас Н.Д., Бойд С.Б., Синн Д.П. Восстановление нейросенсорной функции после ортогнатической операции. J Oral Maxillofac Surg. 1990; 48: 124–34. [PubMed] [Google Scholar] 21. Wofford DT, Миллер RI. Проспективное исследование дизестезии после удаления зубов ретинированных третьих моляров нижней челюсти. J Oral Maxil¬lofac Surg. 1987. 45: 15–9. [PubMed] [Google Scholar] 22. Sandstedt P, Sörensen S. Нейросенсорные нарушения тройничного нерва: долгосрочное наблюдение за травматическими повреждениями.J Oral Maxillofac Surg. 1995; 53: 498–505. [PubMed] [Google Scholar] 23. Peñarrocha-Diago M, Mora-Escribano E, Bagán JV, Peñarrocha-Diago M. Неопластическая невропатия тройничного нерва: презентация 7 случаев. Med Oral Patol Oral Cir Bucal. 2006; 11: E106–11. [PubMed] [Google Scholar]Посттравматическая нейропатия тройничного нерва: корреляция между объективными и субъективными оценками и модель прогнозирования нейросенсорного восстановления | Журнал головной боли и боли
В этом проспективном когортном исследовании с апреля 2018 по май 2020 года 46 пациентам в нашем отделении был поставлен диагноз PTN.Девять из этих пациентов были исключены из-за отсутствия данных, а один пациент отказался от информированного согласия. Остальную группу из 36 пациентов составили 23 женщины и 13 мужчин, средний возраст которых составлял 42 года (стандартное отклонение 12,5, диапазон 23–68). Характеристики пациентов показаны в дополнительной таблице S2. Практически все пациенты были направлены специалистом по челюстно-лицевой хирургии ( n = 32; 89%). Остальных четырех пациентов направил внешний стоматолог.
Средняя продолжительность травмы при первичном клиническом осмотре составила 210 дней (SD 289, диапазон 3–1073).Средний период последующего наблюдения составил 566 дней (стандартное отклонение 218, диапазон 149–865), в среднем шесть последующих посещений, во время которых повторялись объективные и субъективные оценки (диапазон 3–8). Всего проведено 199 нейросенсорных консультаций.
Распределение случаев по механизму травмы показало, что удаление третьего моляра является наиболее частым у 47% пациентов ( n = 17), за которым следуют 11% случаев установки имплантата и травмы лица (каждый, n = 4). ), 8% для местной анестезии ( n = 3) и 6% для удаления зуба мудрости и эндодонтического лечения ( n = 2).В общей сложности 14% случаев были классифицированы как «прочие» ( n = 5) (дополнительный рисунок S2).
IAN был поражен у 23 пациентов (64%), LN — у 10 (28%), верхнечелюстной нерв — у 7 (19%) и глазной нерв — у одного (3%). Правосторонний ПТН имелся у 19 пациентов (53%), а 17 пациентов сообщили о левостороннем ПТС (47%). Случаев двустороннего поражения не выявлено.
Количественные сенсорные тесты были проведены у пяти пациентов. Из семи пациентов, которым была проведена магнитно-резонансная томография, результаты пяти из них привели к изменению тактики ведения, включая повторное хирургическое вмешательство у трех.Микрохирургия выполнена в семи случаях (19%). Хирургическое лечение всегда носило исследовательский характер и состояло из внешнего невролиза, внутреннего невролиза, нейрорафии и / или иссечения невромы. В этой серии не использовались межпозиционные трансплантаты.
Объективные оценки
Средний процент пораженного дерматома составлял 91% (стандартное отклонение 21%) на исходном уровне. При окончательном наблюдении средний процент пораженного дерматома снизился до 40% (SD 46%). У 11 пациентов (31%) площадь оставалась идентичной исходным данным, а у 16 пациентов (44%) нейросенсорные тесты больше не могли определить пораженную область.В этой последней группе потребовалось в среднем 253 дня (медиана 187, SD 200), прежде чем нейропатическая зона перестала быть разграниченной.
Первоначальная двухточечная дискриминация показала в среднем 14 мм (SD 7 мм) для пораженной стороны и 6 мм (SD 3 мм) для здоровой стороны. Эти измерения привели к средней конечной двухточечной дискриминации 8 мм (стандартное отклонение 5 мм) для пораженной стороны в общей популяции исследования. Девять пациентов (25%) имели бескомпромиссную двухточечную дискриминацию на исходном уровне.У пациентов, у которых двухточечная дискриминация для пораженной стороны достигла значений, идентичных непораженной стороне, среднее время до этого результата составило 227 дней.
Одиннадцать пациентов (31%) имели аллодинию мазка кистью при первичном обращении. В течение периода наблюдения у 15 пациентов (42%) по крайней мере один раз была выявлена аллодиния мазка кистью. При последнем наблюдении аллодиния мазка кистью оставалась у пяти пациентов (14%), из которых у троих она была при первоначальном обращении, а у двоих она развилась и сохранялась впоследствии.
Локализация стимула полностью отсутствовала у 11 пациентов (31%) во время первоначальных измерений, тогда как у 18 пациентов (50%) локализация стимула не была нарушена на исходном уровне. Однако при окончательном наблюдении 28 пациентов (78%) имели значения, аналогичные таковым у здоровых людей, со средним временем до этого результата 70 дней (SD 53). Восемь пациентов (22%) продолжали испытывать неоптимальную способность определять местонахождение раздражителя.
Направленная дискриминация показала аналогичную картину: она отсутствовала у 10 пациентов (28%), а у 18 пациентов (50%) не было нарушений на исходном уровне.В общей сложности 29 пациентов (81%) достигли оптимальных значений окончательного периода наблюдения в среднем за 81 день (SD 102). Семь пациентов с PTN не могли точно определить направление движения в конце периода оценки.
Исходные и последующие оценки MRCS и Сандерленд показаны на дополнительном рисунке S3 и дополнительном рисунке S4 соответственно. Исходно оценка MRCS составляла S0 для пяти пациентов, S2 для одного пациента, S2 + для десяти пациентов, S3 для восьми пациентов и S3 + для 11. Один пациент имел исходную оценку MRCS, равную 4.По завершении исследования 23 пациента (64%) показали полное выздоровление (S4), у семи была оценка S3 +, а у одного — S3, всего восемь дополнительных пациентов (22%) с ограниченными негативными клиническими симптомами и нет остаточной чрезмерной реакции на раздражители. Остальные пять пациентов (14%) не достигли выздоровления после S2 + и, таким образом, продолжали иметь положительную симптоматику.
Распределение по классификации Сандерленда показало, что тестирование уровня A (группа I) не нарушено у 10 пациентов (28%) на исходном уровне и обнаружение контакта с легкими нарушениями (тестирование уровня B; группа II) — у пяти пациентов (14%).Тестирование уровня C выявило умеренное снижение болевой чувствительности у пяти пациентов (14%, группа III), тяжелое нарушение у 11 пациентов (31%, группа IV) и полное обезболивание у пяти пациентов (14%, группа V). По завершении исследования 25 пациентов (69%) были классифицированы в группу I, 3 пациента (8%) во II группу, 2 (6%) в группу III и 6 (17%) остались в группе IV.
Распределение по сенсорному фенотипу показано на дополнительном рисунке S5. Большинство пациентов начинали со смешанной потери чувствительности (22 пациента; 61%) и отсутствия гиперестезии (19 пациентов; 53%).Изолированная механическая гипестезия наблюдалась у 9 (25%) пациентов, у одного пациента (3%) — тепловая гипестезия. У пяти пациентов (14%) наблюдалась изолированная механическая гиперестезия, у одного (3%) — термическая гиперестезия. У четырех пациентов (11%) не было отрицательных симптомов, а у одиннадцати (31%) были смешанные положительные симптомы при первоначальном обращении.
Субъективные оценки
Самым частым симптомом было онемение в 31 случае (86%), за которым следовала боль в 16 случаях (44%) и жалящая боль в 11 (31%).Ощущения тяги, жжения, чувствительности и припухлости описали 10 пациентов (27%). О ощущении покалывания или тяги сообщили семь пациентов (по 19% каждый), а электрическое ощущение или щекотание — шесть пациентов (по 17% каждый) (дополнительная таблица S2).
Среднее качество жизни увеличилось с 59/100 до 72/100 за период исследования. У пациентов с болью в качестве основной жалобы среднее исходное значение боли по ВАШ составляло 46/100 (стандартное отклонение 27), а среднее значение качества жизни — 52/100 (стандартное отклонение 20). При последнем наблюдении средняя боль по ВАШ в этой группе составляла 26/100 (стандартное отклонение 37), а среднее качество жизни — 69/100 (стандартное отклонение 16).При первичном обращении 8 из 13 мужчин (62%) сообщили о боли, тогда как только 8 из 23 женщин (35%) сделали это. Что касается болезненного PTN, у женщин средний исходный показатель боли по ВАШ составлял 33/100 (SD 21) и повышенный окончательный показатель VAS составлял 41/100 (SD 44). Напротив, мужчины с болезненным PTN начинали со средним баллом по ВАШ 57/100 (SD 28) и заканчивали с VAS 15/100 (SD 28). Женщины с болезненным PTN имели среднее качество жизни 50/100 (SD 24) при первом посещении, которое увеличилось до 64/100 (SD 20). У мужчин с болезненным PTN среднее качество жизни снизилось с 54 (SD 17) до 74 (SD 13).Опросник
GAD-7 выявил исходное отсутствие тревоги у 16 пациентов (44%), легкую тревогу у 15 пациентов (42%), умеренную тревогу у одного пациента (3%) и сильную тревогу у 4 пациентов (11%). . При окончательном наблюдении группа без тревоги увеличилась до 22 пациентов (61%), легкая тревога снизилась до 8 пациентов (22%), умеренная тревога закончилась у 2 пациентов (5%) и тяжелая тревога у 3 пациентов (8%). ). Трое из четырех пациентов с тяжелой тревогой на исходном уровне все еще имели серьезную тревогу при последнем наблюдении.Четвертый пациент имел умеренную тревогу при последнем наблюдении, но с полным исчезновением нейросенсорных нарушений.
Результаты опроса PHQ-9 показали отсутствие депрессии у 12 человек (33%) при первоначальном измерении, легкую депрессию у 15 пациентов (42%), умеренную депрессию у 5 пациентов (14%), умеренно тяжелую депрессию у 2 (6 человек). %), тяжелая депрессия — у 2 (6%). В конце исследования группа без депрессии выросла до 20 пациентов (56%), легкая депрессия уменьшилась до 8 пациентов (22%), а умеренная депрессия — до одного пациента (3%).Число пациентов с депрессией средней степени тяжести увеличилось до трех (8%), а число пациентов с депрессией тяжелой степени увеличилось до четырех пациентов (11%).
При первоначальном диагнозе соматическая тяжесть симптомов (PHQ-15) отсутствовала у 13 (36%), низкая — у 8 (22%), средняя — у 11 (31%) и высокая — у 4 (11%). . После периода наблюдения симптомы отсутствовали у 18 (50%), низкие — у 9 (25%), средние — у 7 (19%) и высокие — у 2 (6%).
На исходном уровне общая исследуемая популяция набрала в среднем 3/7 балла по анкете DN4.Это значение снизилось с течением времени в среднем до 1/7 при последнем наблюдении.
Самовосприятие субъективного функционирования показано на дополнительном рисунке S6. Первоначально 23 пациента указали на потерю нейросенсора как на основное бремя, тогда как 13 пациентов сообщили, что их нарушение функционирования в основном было вызвано жалобами на боль или другими положительными симптомами. По мере продвижения исследования повторяющиеся вопросы, касающиеся самооценки функционирования, выявляли аналогичные тенденции во времени и величине к нормальному функционированию, с небольшим количеством выбросов, представленных с обеих сторон, которые не испытали возврата к самооценке нормального функционирования.
Корреляции
Объективные измерения
Корреляции между всеми объективными измерениями показаны на рисунке 1. Этот рисунок показывает, что большинство объективных нейросенсорных измерений статистически значимо ( P <0,05) коррелировали друг с другом. Наблюдалась очень сильная положительная корреляция между локализацией стимула и направленной дискриминацией (ρ = 0,83), между сенсорным кодом потери функции и двухточечной дискриминацией (ρ = 0,72), а также между двухточечной дискриминацией и оценкой Сандерленда (ρ = 0.75). Была замечена очень сильная отрицательная корреляция между оценкой MRCS и процентом пораженного дерматома (ρ = - 0,71), направленной дискриминацией и Сандерлендом (ρ = - 0,71), а также локализацией стимула и Сандерлендом (ρ = - 0,71). Аллодиния мазка кистью и сенсорный код прироста функции достоверно коррелировали ( P <0,05) только с процентом пораженного дерматома, оценкой MRCS и друг другом.
Рис. 1Корреляция между объективными нейросенсорными измерениями.Коэффициенты корреляции значимых положительных корреляций ( P <0,05) показаны зеленым цветом. Коэффициенты корреляции значимых отрицательных корреляций ( P <0,05) показаны красным. Незначимые корреляции ( P <0,05) отображаются серым цветом. Нейросенсорные тесты включали процент пораженного дерматома, направленное различение, наличие аллодинии мазка кистью, локализацию стимула, двухточечную дискриминацию, потерю сенсорного фенотипа и усиление функции, MRCS и оценку Сандерленда
Биплоты были построены с использованием нагрузки и баллы из анализа главных компонентов.Диаграмма всех объективных измерений показана на рис. 2. Ориентация векторов относительно друг друга иллюстрирует их корреляцию друг с другом. Острый угол между разными измерениями указывает на положительную корреляцию. Угол в 90 градусов означает отсутствие корреляции между двумя переменными, а тупой угол означает отрицательную корреляцию. Чем больше похоже направление двух векторов, тем сильнее корреляция между нейросенсорными тестами. На рисунке 2 показано, что более высокая двухбалльная дискриминация, оценка Сандерленда и сенсорный код потери функции сильно коррелировали друг с другом и с процентом пораженного дерматома.Их векторы почти выглядят как зеркальное отражение направленной дискриминации, локализации стимула и оценки MRCS, что указывает на сильную отрицательную корреляцию для этих факторов. Прирост функции сенсорного кода и аллодиния мазка кистью сильно коррелировали друг с другом, но гораздо меньше коррелировали с другими переменными.
Рис. 2Биплот объективных нейросенсорных измерений. Острый угол указывает на положительную корреляцию. Угол в 90 градусов указывает на отсутствие корреляции между двумя переменными, а тупой угол указывает на отрицательную корреляцию.Чем ближе направление двух векторов, тем сильнее корреляция между этими переменными. Этот график показывает сильную корреляцию между двухточечной дискриминацией, оценкой Сандерленда, сенсорным кодом потери функции и процентом пораженного дерматома. Кроме того, различие по направлению, локализация стимула и оценка MRCS демонстрируют сильную корреляцию. Сенсорный код усиления функции и аллодиния мазка кистью сильно коррелируют друг с другом, но гораздо меньше коррелируют с другими переменными
Субъективные измерения
Корреляции между всеми субъективными измерениями показаны на рис.3. Как видно из рисунка, большинство субъективных нейросенсорных измерений статистически значимо ( P <0,05) коррелировали друг с другом. ВАШ боли значительно коррелировал с GAD-7, PHQ-9, PHQ-15, DN4, субъективной оценкой и качеством жизни. Кроме того, результаты следующих анкет коррелировали друг с другом на статистически значимом уровне: GAD-7 с PHQ-9, PHQ-15, DN4 и субъективной оценкой; PHQ-9 с PHQ-15, DN4 и субъективной оценкой; PHQ-15 с DN4 и субъективной оценкой; и DN4 с субъективной оценкой.Обнаружилась статистически значимая отрицательная корреляция между качеством жизни и GAD-7, PHQ-9, PHQ-15, DN4 и субъективной оценкой. Таким образом, более высокий балл по одному из этих вопросников обычно был связан с более низким самооценкой качества жизни, а баллы по PHQ-9 и GAD-7 показали самую сильную корреляцию с качеством жизни. Обезболивание (BPI) с использованием назначенного режима приема лекарств статистически значимо коррелировало с оценками EQ5D-5 L для болевого дискомфорта, подвижности и самопомощи, а также с максимальным, минимальным, средним и ВАШ по шкале VAS, но не с другими опросниками. .
Рис. 3Корреляция между субъективными нейросенсорными измерениями. Коэффициенты корреляции для значимых положительных корреляций ( P <0,05) показаны зеленым. Коэффициенты корреляции для значимых отрицательных корреляций ( P <0,05) показаны красным. Незначимые корреляции ( P > 0,05) отображаются серым цветом. Опросники включали оценку визуального аналога боли (ВАШ), пятимерную шкалу EuroQol (EQ5D-5 L), краткий перечень боли (BPI), общее тревожное расстройство 7 (GAD-7), анкеты здоровья пациента 9 и 15 ( PHQ-9 и PHQ-15), Douleur Neuropathique 4 (DN4) и субъективное функционирование.Этот рисунок показывает, что большинство анкет статистически значимо коррелировали друг с другом, например Боль-ВАШ достоверно коррелировала с GAD-7, PHQ-9, PHQ-15, DN4, субъективной оценкой и качеством жизни (EQ5D: QoL). Кроме того, качество жизни показало значительную отрицательную корреляцию (выделено красным цветом) с большинством результатов опроса. GAD-7 и PHQ-9 показали самую сильную отрицательную корреляцию с качеством жизни
Двойной график всех субъективных измерений показан на рис. 4. Чем больше схожее направление двух векторов, тем сильнее корреляция между различными анкетами.Сильная положительная корреляция предполагает, что в двух анкетах была представлена практически одинаковая информация. Качество жизни отрицательно коррелировало со всеми другими анкетами. Боль-ВАШ, DN4 и субъективная оценка имеют сходные направления в сторону верхнего левого квадранта, что указывает на сильную положительную корреляцию между этими измерениями. Опросники PHQ-9, PHQ-15 и GAD-7 оценивают все проекты в одинаковых направлениях в сторону нижнего левого квадранта, что указывает на сильную положительную корреляцию между ними.Кроме того, что касается корреляции между отдельными вопросами для каждого вопросника, те вопросы шкалы EQ5D-5 L, которые меньше всего коррелировали друг с другом и показывают наибольший разброс по квадрантам на графике. Однако эти индивидуальные подшкалы действительно коррелировали в значительной степени с другими категориально связанными опросниками, например, EQ5D-Pain коррелировали с DN4 и Pain-VAS, а EQ5D-Anxiety коррелировали с GAD-7 и PHQ-9 и -15. Следовательно, эти субшкалы EQ5D-5 L могут служить хорошими показателями для оценки субъективного благополучия пациента.
Рис. 4Биплот субъективных нейросенсорных измерений. Чем ближе направление двух векторов, тем сильнее корреляция между этими переменными. Сильная положительная корреляция предполагает, что две анкеты предлагают практически одинаковую информацию. Этот рисунок показывает отрицательную корреляцию между качеством жизни и всеми другими опросниками. Существует сильная положительная корреляция между оценкой боли по ВАШ, DN4 и субъективной оценкой, а также между оценками PHQ-9, PHQ-15 и GAD-7.Кроме того, что касается корреляции между отдельными вопросами для каждой анкеты, вопросы шкалы EQ5D-5 L меньше всего коррелировали друг с другом. Однако эти отдельные вопросы достоверно коррелировали с другими категориально связанными анкетами, например, EQ5D-Pain коррелировал с DN4 и Pain-VAS, а EQ5D-Anxiety коррелировал с GAD-7 и PHQ-9 и -15. Таким образом, EQ5D-5 L может служить хорошим скрининговым опросником для оценки субъективного благополучия пациента
Объективные и субъективные измерения
Корреляции между всеми объективными и субъективными измерениями показаны на рис.5. Как видно из рисунка, большинство объективных нейросенсорных измерений не коррелировали ( P <0,05) с субъективными опросниками. Однако качество жизни значительно коррелировало с процентом пораженного дерматома, наличием аллодинии мазка кистью, сенсорным кодом прироста функции, MRCS и Сандерлендом. Качество жизни существенно не коррелировало с направленной дискриминацией, локализацией стимула, двухточечной дискриминацией или сенсорным кодом с потерей функции.Боль-ВАШ, GAD-7 и PHQ-9 значимо коррелировали с процентом пораженного дерматома, аллодинией мазка кистью, сенсорным кодом усиления функции и MRCS. PHQ-15 значительно коррелировал с процентом пораженного дерматома, аллодинией мазков кисти и сенсорным кодом усиления функции, но не с MRCS. Показатели DN4 показали значительную корреляцию с процентом пораженного дерматома, аллодинией мазка кистью, двухточечной дискриминацией, сенсорным кодом усиления функции, MRCS и Сандерлендом. Как правило, размер пораженного участка, наличие аллодинии мазка кистью и положительные симптомы коррелируют с различными баллами в анкете.
Рис. 5Корреляция между объективными (столбцы) и субъективными (строки) нейросенсорными измерениями. Коэффициенты корреляции для значимых положительных корреляций ( P <0,05) показаны зеленым. Коэффициенты корреляции значимых отрицательных корреляций ( P <0,05) показаны красным. Незначимые корреляции ( P > 0,05) показаны серым цветом. На этом рисунке показана закономерность, в которой размер пораженного участка, наличие аллодинии мазка кистью и положительные симптомы коррелируют с различными баллами в анкете e.грамм. Качество жизни (EQ5D: QoL) значительно коррелировало с процентом пораженного дерматома, аллодинией мазков кисти, сенсорным кодом прироста функции, MRCS и Сандерлендом. Боль-ВАШ, GAD-7 и PHQ-9 значимо коррелируют с процентом пораженного дерматома, аллодинией мазков кисти, сенсорным кодом усиления функции и MRCS. PHQ-15 значительно коррелировал с процентом пораженного дерматома, аллодинией мазков кисти и сенсорным кодом усиления функции, но не с MRCS. Показатели DN4 показали значительную корреляцию с процентом пораженного дерматома, аллодинией мазка кистью, двухточечной дискриминацией, сенсорным кодом усиления функции, MRCS и Sunderland
. Двойной график всех объективных и субъективных измерений показан на рис.6. Как уже отмечалось, чем более схожи направления двух векторов, тем сильнее корреляция между переменными. Качество жизни отрицательно коррелировало с усилением сенсорного кода, аллодинией мазков кисти и процентом пораженного дерматома. Кроме того, другие показатели анкеты (PHQ-15, GAD-7, PHQ-9, субъективная оценка, Pain-VAS и DN4) положительно коррелировали с сенсорным кодом прироста функции, аллодинией мазка кистью и процентом пораженного дерматома. . Была обнаружена слабая корреляция или ее отсутствие для каждого из баллов анкеты и объективных измерений локализации стимула, различения по направлению, дискриминации по двум точкам, показателя Сандерленда и сенсорного кода потери функции.
Рис. 6Биплот всех объективных и субъективных нейросенсорных измерений. Острый угол указывает на положительную корреляцию. Угол в 90 градусов указывает на отсутствие корреляции между двумя переменными, а тупой угол указывает на отрицательную корреляцию. Отрицательная корреляция качества жизни с сенсорным кодом прироста функции, аллодинией мазков кисти и процентом пораженного дерматома. Кроме того, другие показатели анкеты (PHQ-15, GAD-7, PHQ-9, субъективная оценка, Pain-VAS и DN4) положительно коррелировали с сенсорным приростом функции, аллодинией мазка кистью и процентом пораженного дерматома.Практически не было выявлено никакой корреляции между различными оценками анкеты и объективными измерениями локализации стимула, направленной дискриминации, двухточечной дискриминации, оценки Сандерленда и сенсорной потери функции
Модель прогнозирования
Модель прогнозирования для нейросенсорного восстановления после 6 месяцев наблюдения были построены с использованием исходных измерений и в соответствии с заявлением TRIPOD [30]. Критерии, используемые для определения почти полного восстановления, показаны в дополнительной таблице S3.Все критерии должны были быть проверены, чтобы претендовать на статус почти полного выздоровления. Детали модели прогнозирования через 6 месяцев показаны в таблице 1.
Таблица 1 Модель прогнозирования нейросенсорного восстановления в PTN через 6 месяцевДля модели значения Pain-VAS (0–100), процент пораженного дерматома (0–100%), сенсорный код усиления функции (0–3) и двухточечная дискриминация пораженной стороны (в мм) умножались на соответствующий им коэффициент. Затем эти значения суммировались, и значение точки пересечения добавлялось к общей сумме.Если результат был больше или равен нулю, модель предсказывала, что PTN разрешится через 6 месяцев. Если значение было отрицательным, модель предсказывала отсутствие разрешения PTN через 6 месяцев. Сила этой связи проиллюстрирована в Таблице 2. Когда модель предсказывала отсутствие выздоровления через 6 месяцев, шансы на отсутствие выздоровления были высокими при отрицательной прогностической ценности 87%. Однако, когда результат был положительным и, таким образом, предсказывал почти полное выздоровление через 6 месяцев, положительная прогностическая ценность составляла только 60%.Чувствительность модели составила 43%, специфичность — 93%.
Таблица 2 Мощность модели прогнозирования нейросенсорного восстановления при посттравматической невропатии тройничного нерва через 6 месяцевЧем отличается посттравматическая невралгия от сложного регионарного болевого синдрома (CRPS)?
Галер Б.С., Шварц Л., Аллен Р.Дж. Лезер Д.Д., Батлер С.Х., Чепмен Р.С., Тюрк, округ Колумбия, (ред.). Комплексные регионарные болевые синдромы — Тип I: рефлекторная симпатическая дистрофия и тип II: каузалгия, в: Bonica’s management of pain .Филадельфия: Липпинкотт Уильямс и Уилкинс; 2001. 388-411.
Галер Б.С., Дженсен М. Симптомы пренебрежения при комплексном региональном болевом синдроме: результаты самостоятельного обследования. J Устранение болевых симптомов . 1999 Сентябрь 18 (3): 213-7. [Медлайн].
Харден Р.Н., Брюль С., Галер Б.С. и др. Комплексный регионарный болевой синдром: являются ли диагностические критерии IASP достоверными и достаточно полными? Боль . 1999 ноябрь 83 (2): 211-9.[Медлайн].
Брюль С., Харден Р.Н., Галер Б.С. и др. Внешняя проверка диагностических критериев IASP для комплексного регионального болевого синдрома и предложенных диагностических критериев исследования. Международная ассоциация изучения боли. Боль . 1999 Май. 81 (1-2): 147-54. [Медлайн].
Harden RN, Bruehl S, Stanton-Hicks M, Wilson PR. Предложены новые критерии диагностики сложного регионарного болевого синдрома. Медицина боли . 2007 г.6 (4): 326 31.
Уилсон П.Р., Стэнтон-Хикс, М., Харден Р.Н. CRPS. Современная диагностика и терапия. Progress in Pain Research and Management Series . IASP Press: Сиэтл, Вашингтон; 2005. Vol. 32:
Брюль С., Харден Р.Н., Галер Б.С., Сальц С., Баконья М., Стэнтон-Хикс М. Комплексный региональный болевой синдром: существуют ли отдельные подтипы и последовательные стадии синдрома ?. Боль . 2002, январь, 95 (1-2): 119-24. [Медлайн].
Харден Р.Н., Оклендер А.Л., Бертон А.В., Перес Р.С., Ричардсон К., Свон М. и др.Комплексный регионарный болевой синдром: практические рекомендации по диагностике и лечению, 4-е издание. Болеутоляющее . 2013 14 февраля (2): 180-229. [Медлайн].
Барон Р., Левин Дж. Д., Поля HL. Каузалгия и рефлекторная симпатическая дистрофия: способствует ли симпатическая нервная система возникновению боли? Мышечный нерв . 1999 июн., 22 (6): 678-95. [Медлайн].
Джордано Дж., Босуэлл М.В. Нейробиология ноцицептивной и антиноцицептивной систем.Manchikanti L, Singh V (ред.). Методы вмешательства при хронической боли в спине . Падука, Кентукки: издательство ASSIP; 2007. 17-32.
Каваками, Чатения К., Вайнштейн Дж. AH, Schofferman JA (ред.). Анатомия, биохимия и физиология боли в пояснице, в White Spine Care: диагностика и консервативное лечение . Сент-Луис: Mosby Press; 1995. С. 84-103.
Уиллер А.Х., Мюррей ДБ. Боль в позвоночнике: патогенез, эволюционные механизмы и лечение.Паппагалло М, изд. Неврологические основы боли . Нью-Йорк: Макгроу-Хилл; 2003. 421-52.
Рокетт М. Диагностика, механизмы и лечение комплексного регионарного болевого синдрома. Анестезиол Curr Opin . 2014 27 октября (5): 494-500. [Медлайн].
Барон Р., Биндер А. Паппагалло М. (ред.). комплексные регионарные болевые синдромы, в Неврологические основы боли . Нью-Йорк: Макгроу-Хилл; 2005:. 359-378.
Беннетт РМ.Новые концепции в нейробиологии хронической боли: свидетельства аномальной сенсорной обработки при фибромиалгии. Mayo Clin Proc . 1999, апрель, 74 (4): 385-98. [Медлайн].
Carlton SM, Zhou S, Coggeshall RE. Доказательства взаимодействия глутамата и рецепторов NK1 на периферии. Брейн Рес . 1998 20 апреля. 790 (1-2): 160-9. [Медлайн].
Mendell LM, Wall PD. Ответы одиночных клеток спинного мозга на немиелинизированные периферические кожные волокна. Природа . 1965 г. 3 апреля. 206: 97-9. [Медлайн].
Поля HL. Боль . Нью-Йорк: Макгроу-Хилл; 1987.
Schofferman JA. 23-6. White AH, Schofferman JA (ред.). Прикладная нейрофизиология боли в позвоночнике: диагностика и консервативное лечение . Сент-Луис: Mosby Press; 1995.
Рассел И.Дж. Нейрохимический патогенез синдрома фибромиалгии. J Скелетно-мышечная боль .1996. 4: 61-92.
Lee DH, Lee KJ, Cho KI, Noh EC, Jang JH, Kim YC и др. Изменения головного мозга и нейрокогнитивная дисфункция у пациентов со сложным региональным болевым синдромом. Дж. Боль . 2015 июн. 16 (6): 580-6. [Медлайн].
Pleger B, Draganski B, Schwenkreis P, Lenz M, Nicolas V, Maier C, et al. Сложный региональный болевой синдром I типа влияет на структуру головного мозга в префронтальной и моторной коре. PLoS One . 2014. 9 (1): e85372.[Медлайн]. [Полный текст].
Чжоу Г., Хотта Дж., Лехтинен М.К., Форсс Н., Хари Р. Увеличение сосудистого сплетения при сложном региональном болевом синдроме. Научная репутация . 2015 21 сентября. 5: 14329. [Медлайн].
van Velzen GA, Rombouts SA, van Buchem MA, Marinus J, van Hilten JJ. Действительно ли мозг пациентов с комплексным региональным болевым синдромом отличается? евро J Pain . 2016 г. 10 мая. [Medline].
Janig W, Koltzendbrg M.Bond MR, Charlton EJ, Woolf CJ (ред.). симпатическая рефлекторная активность и изменение передачи нейрофакторов после хронических нервных поражений в материалах VI Всемирного конгресса по боли . Амстердам: Elsevier Science; 1991. 365-371.
Барон Р., Васнер Г., Боргестедт Р. и др. Влияние симпатической активности на вызванную капсаицином боль, гипералгезию и расширение сосудов Неврология. 1999. 52: 923-932.
Wasner G, Schattschneider J, Heckmann K, Maier C, Baron R.Сосудистые аномалии при рефлекторной симпатической дистрофии (КРБС I): механизмы и диагностическое значение. Мозг . 2001, март, 124: 587-99. [Медлайн].
Драммонд П.Д., Финч П.М., Гиббинс И. Иннервация гипералгезирующей кожи у пациентов со сложным региональным болевым синдромом. Клин Дж. Боль . 1996 Сентябрь 12 (3): 222-31. [Медлайн].
Харден Р.Н., Дык Т.А., Уильямс Т.Р., Коли Д., Кейт Дж.С., Грейсли Р.Х. Уровни норэпинефрина и адреналина в пораженных и здоровых конечностях при симпатической боли. Клин Дж. Боль . 1994 Декабрь 10 (4): 324-30. [Медлайн].
Триде Р. Д., Дэвис К. Д., Кэмпбелл Дж. Н., Раджа С. Н.. Пластичность кожной гипералгезии при блокаде симпатических ганглиев у пациентов с нейропатической болью. Мозг . 1992, апр. 115 (Pt 2): 607-21. [Медлайн].
Chelimsky TC, Low PA, Naessens JM, Wilson PR, Amadio PC, O’Brien PC. Значение вегетативного тестирования при рефлекторной симпатической дистрофии. Mayo Clin Proc .1995 ноябрь 70 (11): 1029-40. [Медлайн].
Яниг В. Экспериментальный подход к рефлекторной симпатической дистрофии и родственным синдромам. Боль . 1991 Сентябрь 46 (3): 241-5. [Медлайн].
Яниг В., Левин Дж. Д., Михаэлис М. Взаимодействие симпатических и первичных афферентных нейронов после повреждения нерва и травмы ткани. Prog Brain Res . 1996. 113: 161-84. [Медлайн].
Маклахлан Е.М., Яниг В., Девор М., Михаэлис М.Повреждение периферических нервов запускает норадренергическое разрастание в ганглиях задних корешков. Природа . 1993, 10 июня. 363 (6429): 543-6. [Медлайн].
Ши Т.С., Винцер-Серхан У., Лесли Ф., Хокфельт Т. Распределение и регуляция альфа (2) -адренорецепторов в ганглиях задних корешков крыс. Боль . 2000 февраль 84 (2-3): 319-30. [Медлайн].
Джениг В., Барон Р. Комплексный регионарный болевой синдром — заболевание центральной нервной системы. Clin Auton Res .2002 июн. 12 (3): 150-64. [Медлайн].
Раджа А.Н., Триде Р.Д., Дэвис К.Д. и др. Системная альфа-адренергическая блокада фентоламином: диагностический тест на симпатическую поддерживаемую боль. Анестезиология . 1991. 74: 691-698.
Стэнтон-Хикс М., Яниг В., Хассенбуш С., Хаддокс Дж. Д., Боас Р., Уилсон П. Рефлекторная симпатическая дистрофия: изменение концепций и таксономии. Боль . 1995 Октябрь 63 (1): 127-33. [Медлайн].
Вульф CJ, Мэннион Р.Дж.Невропатическая боль: этиология, симптомы, механизмы и лечение. Ланцет . 1999, 5 июня. 353 (9168): 1959-64. [Медлайн].
Rommel O, Gehling M, Dertwinkel R, et al. Нарушение полусенсора у пациентов со сложным регионарным болевым синдромом. Боль . 1999 Март 80 (1-2): 95-101. [Медлайн].
Юоттонен К., Гокель М., Силен Т., Хурри Х, Хари Р., Форсс Н. Изменение центральной сенсомоторной обработки у пациентов со сложным региональным болевым синдромом. Боль . 2002 августа 98 (3): 315-23. [Медлайн].
Фукумото М., Ушида Т., Зинчук В.С., Ямамото Х., Йошида С. Контралатеральная таламическая перфузия у пациентов с синдромом рефлекторной симпатической дистрофии. Ланцет . 1999 20 ноября. 354 (9192): 1790-1. [Медлайн].
Schattschneider J, Wenzelburger R, Deuschl G, et al. Харден Р.Н., Барон Р., Джениг В. (ред.). Кинематический анализ верхней конечности при КРБС, Прогресс в исследовании и лечении боли: комплексный региональный болевой синдром .IASP Press: Сиэтл; 1999. 119–128.
Deuschl, Blumberg S, Jensen M. Тремор при рефлекторной симпатической дистрофии. Arch Neurol . 1999. 48: 1247-1252.
Shokouhi M, Clarke C, Morley-Forster P, Moulin DE, Davis KD, St Lawrence K. Структурные и функциональные изменения мозга на ранних и поздних стадиях комплексного регионального болевого синдрома. Дж. Боль . 2018 февраля 19 (2): 146-157. [Медлайн].
Галер Б.С., Батлер С., Дженсен М.П.Отчеты о случаях и гипотеза: синдром пренебрежения может быть причиной двигательных нарушений при рефлекторной симпатической дистрофии (комплексный региональный болевой синдром-1). J Устранение болевых симптомов . 1995 июл.10 (5): 385-91. [Медлайн].
Sandroni P, Benrud-Larson LM, McClelland RL, Low PA. Комплексный региональный болевой синдром I типа: заболеваемость и распространенность в округе Олмстед, популяционное исследование. Боль . 2003 май. 103 (1-2): 199-207. [Медлайн].
Veldman PH, Reynen HM, Arntz IE, Goris RJ.Признаки и симптомы рефлекторной симпатической дистрофии: проспективное исследование 829 пациентов. Ланцет . 1993, 23 октября. 342 (8878): 1012-6. [Медлайн].
Геллман Х., Кинан М.А., Стоун Л., Харди С.Е., Уотерс Р.Л., Стюарт С. Рефлекторная симпатическая дистрофия у пациентов с повреждениями головного мозга. Боль . 1992 декабрь 51 (3): 307-11. [Медлайн].
Розен PS, Грэм В. Синдром плеча-руки: исторический обзор с наблюдениями за семидесяти тремя пациентами. Кан Мед Ассо Дж. . 1957 15 июля. 77 (2): 86-91. [Медлайн].
de Mos M, de Bruijn AG, Huygen FJ, Dieleman JP, Stricker BH, Sturkenboom MC. Заболеваемость комплексным региональным болевым синдромом: популяционное исследование. Боль . 2007 май. 129 (1-2): 12-20. [Медлайн].
Кемлер М.А., ван де Вуссе А.С., ван ден Берг-Лунен Е.М., Барендсе Г.А., ван Клиф М., Вебер В.Е. HLA-DQ1 ассоциирован с рефлекторной симпатической дистрофией. Неврология .1999, 12 октября. 53 (6): 1350-1. [Медлайн].
Ван Хилтен Дж.Дж., Ван Де Бик В.Дж., Роэп Б.О. Мультифокальная или генерализованная тоническая дистония, комплексный региональный болевой синдром: отчетливая клиническая сущность, связанная с HLA-DR13. Энн Нейрол . 2000. 48: 113-116.
Ван Де Бик В.Дж., Роеп Б.О., Ван Дер Слик А.Р. и др. Локусы восприимчивости к сложному региональному болевому синдрому. Неврология . 2003. 103: 93-97.
Veldman PH, Reynen HM, Arntz IE, Goris RJ.Признаки и симптомы рефлекторной симпатической дистрофии: проспективное исследование 829 пациентов. Ланцет . 1993, 23 октября. 342 (8878): 1012-6. [Медлайн].
Аллен Г., Галер Б.С., Шварц Л. Эпидемиология комплексного регионального болевого синдрома: ретроспективный обзор 134 пациентов. Боль . 1999 Апрель 80 (3): 539-44. [Медлайн].
Low P, Wilson PR, Sandroni P, et al. Джениг В., Стэнтон-Хикс М. (ред.). Клинические характеристики пациентов с рефлекторной симпатической дистрофией (симпатическая поддерживаемая боль) в Соединенных Штатах, в прогрессе в исследованиях и лечении боли: рефлекторная симпатическая дистрофия: переоценка .Сиэтл: IASP Press; 1996. 49-66.
Барон Р., Блимберг, Х., Джениг, В. Джаниг, В., Стэнтон-Хайокс, М. (ред.). Клинические характеристики пациентов со сложным региональным болевым синдромом в Германии, с особым акцентом на вазомоторную функцию, в Progress in Pain Research and Management: Reflex Sympathetic Dystrophy: A Reappraisal . Сиэтл: IASP Press; 1996. 25-48.
Stengel M, Binder A, Baron R. Последние сведения о диагностике и лечении комплексного регионального болевого синдрома. Уход за болью . 2007. (3): 96-104.
Тодорович-Тирнаник М., Обрадович В., Хан Р., Гольднер Б., Станкович Д., Секулич Д. Диагностический подход к рефлекторной симпатической дистрофии после перелома: рентгенография или сцинтиграфия костей ?. евро J Nucl Med . 1995 22 октября (10): 1187-93. [Медлайн].
Козин Ф., Соин Дж. С., Райан Л. М., Каррера Г. Ф., Вортманн Р. Л.. Сцинтиграфия костей при синдроме рефлекторной симпатической дистрофии. Радиология .1981 Февраль 138 (2): 437-43. [Медлайн].
Зылюк А. Полезность количественной оценки трехфазной сцинтиграфии в диагностике посттравматической рефлекторной симпатической дистрофии. J Hand Surg (Br) . 1999. 24: 16-21.
Уайлдер РТ. Ref lex симпатическая дистрофия у детей и подростков: отличия от взрослых. Джениг В., доктор медицины Стэнтон-Хикс, редакторы. Рефлекторная симпатическая дистрофия: переоценка. Progress in Pain Research and Management Series .Сиэтл, Вашингтон: IASP Press; 1996. Vol.6: 67-78.
Graif M, Schweitzer ME, Marks B, Matteucci T, Mandel S. Синовиальный выпот при рефлекторной симпатической дистрофии: дополнительный признак для диагностики и определения стадии. Скелетная радиология . 1998 Май. 27 (5): 262-5. [Медлайн].
Rommel O, Malin JP, Zenz M, Janig W. Количественное сенсорное тестирование, нейрофизиологическое и психологическое обследование у пациентов с комплексным региональным болевым синдромом и гемисенсорными дефицитами. Боль . 2001 сентябрь 93 (3): 279-93. [Медлайн].
Price DD, Long S, Huitt C. Сенсорное тестирование патофизиологических механизмов боли у пациентов с рефлекторной симпатической дистрофией. Боль . 1992 Май. 49 (2): 163-73. [Медлайн].
Gulevich SJ, Conwell TD, Lane J, Lockwood B, Schwettmann RS, Rosenberg N. Стрессовая инфракрасная телетермография полезна в диагностике сложного регионарного болевого синдрома I типа (ранее — рефлекторной симпатической дистрофии). Клин Дж. Боль . 1997 13 марта (1): 50-9. [Медлайн].
Birklein F, Riedl B, Neundorfer B et al. Симпатический вазоконстрикторный рефлекс у пациентов со сложным регионарным болевым синдромом. Боль . 1998. 75: 93-100.
Huygen FJ, De Bruijn AG, De Bruin MT et al. Доказательства местного воспаления при комплексном региональном болевом синдроме 1 типа. Медиаторы воспаления . 2002. 11: 47-51.
Huygen FJ, Ramdhani N, van Toorenenbergen A, Klein J, Zijlstra FJ.Тучные клетки участвуют в воспалительных реакциях при комплексном региональном болевом синдроме 1 типа. Immunol Lett . 2004 15 февраля. 91 (2-3): 147-54. [Медлайн].
Groeneweg JG, Huygen FJ, Heijmans-Antonissen C et al. Повышенный уровень эндотелина-1 и пониженный уровень оксида азота в волдырях у пациентов с комплексным региональным болевым синдромом промежуточного типа простуды типа 1. BMC Musculoskelet Disord . 2006. 7:91.
Munnikes RJ, Muis C, Boersma M et al.Промежуточная стадия сложного регионального болевого синдрома 1 типа не связана с проинфиамниаторными цитокинами. Медиаторы воспаления . 2005. 14: 366-72.
Oaklander AL, Rissmiller JG, Gelman LB et al. Свидетельства локальной дегенерации аксонов мелких волокон при комплексном региональном болевом синдроме-1 (рефлекторная симпатическая дистрофия). Боль . 2006. 120: 235-43.
Джениг В., Барон Р. Является ли CRPS I синдромом нейропатической боли? Боль. 2006. 120: 227-9.
Forouzanfar T, Köke AJ, van Kleef M, Weber WE. Лечение комплексного регионального болевого синдрома I типа. Eur J Pain . 2002. 6 (2): 105-22. [Медлайн].
Кингери WS. Критический обзор контролируемых клинических исследований периферической невропатической боли и сложных региональных болевых синдромов. Боль . 1997 ноябрь 73 (2): 123-39. [Медлайн].
Perez RS, Kwakkel G, Zuurmond WW, de Lange JJ. Лечение рефлекторной симпатической дистрофии (КРБС типа 1): синтез результатов 21 рандомизированного клинического исследования. J Устранение болевых симптомов . 2001, 21 июня (6): 511-26. [Медлайн].
Kozin, F. McCarty, Sims, J, et al. Синдром рефлекторной симпатической дистрофии: I. Клинические и гистологические исследования: доказательства двустороннего действия, ответ на кортикостероиды и поражение суставов. Джем Дж. Мед . 1976. 60: 321-331.
Кристенсен К., Дженсен Э.М., Ноер И. Реакция синдрома рефлекторной дистрофии на лечение системными кортикостероидами. Акта Чир Сканд . 1982. 148 (8): 653-5. [Медлайн].
Braus DF, Krauss JK, Strobel J. Синдром плеча-руки после инсульта: проспективное клиническое испытание. Энн Нейрол . 1994, ноябрь 36 (5): 728-33. [Медлайн].
Gobelet C, Waldburger M, Meier JL. Эффект добавления кальцитонина к физиотерапии при рефлекторной симпатической дистрофии. Боль . 1992 Февраль 48 (2): 171-5. [Медлайн].
Adami S, Fossaluzza V, Gatti D, Fracassi E, Braga V.Бисфосфонатная терапия синдрома рефлекторной симпатической дистрофии. Энн Рум Дис . 1997 г., 56 (3): 201-4. [Медлайн].
Варенна М., Цукки Ф., Гирингелли Д., Бинелли Л., Бевилаква М., Беттика П. Внутривенное введение клодроната в лечении синдрома рефлекторной симпатической дистрофии. Рандомизированное двойное слепое плацебо-контролируемое исследование. Дж. Ревматол . 2000 июн.27 (6): 1477-83. [Медлайн].
Manicourt DH, Brasseur JP, Boutsen Y, Depreseux G, Devogelaer JP.Роль алендроната в терапии посттравматического комплекса регионарного болевого синдрома I типа нижних конечностей. Революционный артрит . 2004 ноябрь 50 (11): 3690-7. [Медлайн].
Галер Б.С. Лидокаин для местного применения снимает периферическую невропатическую боль (abst). Ежегодное собрание Американской академии неврологии . 1995.
Галер Б.С., Миллер К.В., Роуботэм М.С. Ответ на внутривенное вливание лидокаина зависит от клинического диагноза и места повреждения нервной системы. Неврология . 1993 июн. 43 (6): 1233-5. [Медлайн].
Глейзер С, Портеной РК. Системные местные анестетики для купирования боли. J Устранение болевых симптомов . 1991, 6 (1): 30-9. [Медлайн].
Деверс А., Галер Б.С. Лидокаиновый пластырь для местного применения снимает множество невропатических болей: открытое пилотное исследование. Клин Дж. Боль . 2000 (в печати).
van Hilten BJ, van de Beek WJ, Hoff JI, Voormolen JH, Delhaas EM.Интратекальный баклофен для лечения дистонии у пациентов с рефлекторной симпатической дистрофией. N Engl J Med . 2000 31 августа. 343 (9): 625-30. [Медлайн].
Mellick GA, Mellicy LB, Mellick LB. Габапентин в лечении рефлекторной симпатической дистрофии. J Устранение болевых симптомов . 1995 Май. 10 (4): 265-6. [Медлайн].
Серпелл МГ. Группа изучения невропатической боли. Габапентин при нейропатических болевых синдромах: рандомизированный.двойное слепое плацебо-контролируемое исследование. Боль . 2002. 99: 557-66.
van de Vusse AC, Goossens VJ, Kemler MA, Weber WE. Скрининг пациентов со сложным регионарным болевым синдромом на предшествующие инфекции. Клин Дж. Боль . 2001 июн. 17 (2): 110-4. [Медлайн].
Роуботэм М., Харден Н., Стейси Б., Бернштейн П., Магнус-Миллер Л. Габапентин для лечения постгерпетической невралгии: рандомизированное контролируемое исследование. ЯМА .1998, декабрь 2. 280 (21): 1837-42. [Медлайн].
Scadding JW, Wall PD, Parry CB, Brooks DM. Клинические испытания пропранолола при посттравматической невралгии. Боль . 1982, 14 ноября (3): 283-92. [Медлайн].
Abram SE, Lightfoot RW. Лечение давней каузалгии празозином. Рег Анест . 1981. 6: 79-81.
Ghostine SY, Comair YG, Turner DM, et al. Феноксибензамин в лечении каузалгии. Отчет о 40 случаях. Дж. Нейросург . 1984. 60: 1263-1268.
Стивенс Д.С., Робинс В.Ф., Цена HM. Лечение сочувственно поддерживаемой боли теразозином. Рег Анест . 1993 сентябрь-октябрь. 18 (5): 318-21. [Медлайн].
Дэвис К.Д., Триде Р.Д., Раджа С.Н., Мейер Р.А., Кэмпбелл Дж. Местное применение клонидина снимает гипералгезию у пациентов с поддерживаемой симпатической болью. Боль . 1991 Декабрь 47 (3): 309-17. [Медлайн].
Ziegler D, Lynch SA, Muir J, et al. Трансдермальный клондин в сравнении с плацебо при болезненной диабетической невропатии. Боль . 1992. 48: 403-8.
Byas-Smith MG, Max MB, Muir J, Kingman A. Трансдермальный клонидин в сравнении с плацебо при болезненной диабетической невропатии с использованием двухэтапной схемы «расширенного набора». Боль . 1995 г., 60 (3): 267-74. [Медлайн].
Деверс А., Галер Б.С. Открытые испытания геля клонидина для местного применения для лечения постгерпетической невралгии и сложного регионального болевого синдрома. Представлено Американским обществом боли, . Ноябрь 1998.
Cepeda MS, Lau J, Carr DB. Определение терапевтической роли местной анестезии симпатической блокады в комплексном региональном болевом синдроме: повествовательный и систематический обзор. Клин Дж. Боль . 2002 июль-авг. 18 (4): 216-33. [Медлайн].
Schott GD. Прерывание симпатического оттока при каузалгии и рефлекторной симпатической дистрофии. BMJ . 1998 14 марта.316 (7134): 792-3. [Медлайн].
Прайс Д.Д., Лонг С., Уилси Б., Рафии А. Анализ максимальной величины и продолжительности обезболивания, производимого местными анестетиками, вводимыми в симпатические ганглии пациентов со сложным региональным болевым синдромом. Клин Дж. Боль . 1998 Сентябрь 14 (3): 216-26. [Медлайн].
Cepeda MS, Carr DB, Lau J. Местная анестезирующая симпатическая блокада при комплексном региональном болевом синдроме, Cochrane Database Syst Rev. 2005. 4: CD004598.
Hogan QH, Abram SE. Нервная блокада для диагностики и прогноза. Обзор. Анестезиология . 1997, январь, 86 (1): 216-41. [Медлайн].
Wulf H, Gleim M, Schele HA. Концентрация бупивакаина в плазме после поясничной симпатической блокады. Анест Аналг . 1994 Ноябрь 79 (5): 918-20. [Медлайн].
Баконья М., Гомбар К. Уровни лидокаина в сыворотке после симпатической блокады звездчатых ганглиев и внутривенной инъекции лидокаина. Дж. Боль Симптон Менеджер . 1992. 7: 2-3.
Dellemijn PJI, Fields HL, Allen RR, et al. Интерпретация обезболивания и сенсорных изменений после симпатической блокады. Мозг . 1994. 17: 1475-1487.
Furst CI. Биохимия гуанетидина. Рек. Лекарств . 1967. 4: 133-161.
Bonelli S, Conoscente F, Movilia PG, Restelli L, Francucci B, Grossi E. Региональное внутривенное введение гуанетидина vs.блокада звездчатого ганглия при рефлекторных симпатических дистрофиях: рандомизированное исследование. Боль . 1983 июл.16 (3): 297-307. [Медлайн].
Rocco AG, Kaul AF, Reisman RM, Gallo JP, Lief PA. Сравнение местного внутривенного введения гуанетидина и резерпина при рефлекторной симпатической дистрофии. Контролируемое рандомизированное двойное слепое перекрестное исследование. Клин Дж. Боль . 1989 Сентябрь 5 (3): 205-9. [Медлайн].
Blanchard J, Ramamurthy S, Walsh N, Hoffman J, Schoenfeld L.Внутривенный регионарный симпатолиз: двойное слепое сравнение гуанетидина, резерпина и физиологического раствора. J Устранение болевых симптомов . 1990 декабрь 5 (6): 357-61. [Медлайн].
Поле Дж., Аткинс, РМ. Влияние гуанетидина на естественное течение посттравматической альгодистрофии. Энн Рум Дис . 1993 июн.52 (6): 467-9. [Медлайн].
Geertzen JHB, deBruijn H, deBruijn-Kofman AT, et al. Рефлекторная симпатическая дистрофия: раннее лечение и психологические аспекты. Arch Phys Rehabil . 1994. 75: 442-446.
Джадад А.Р., Кэрролл Д., Глинн С.Дж. и др. Внутривенная регионарная симпатическая блокада для облегчения боли при рефлекторной симпатической дистрофии: системный обзор и рандомизированное двойное слепое перекрестное исследование. J Устранение болевых симптомов . 1995. 10: 13-20.
Рамамурти С., Хоффман Дж., Группа GS. Внутривенное регионарное введение гуанетидина в лечении рефлекторной симпатической дистрофии / каузалгии: рандомизированное двойное слепое исследование. Анест Аналг . 1995. 81: 718-723.
Хорд А.Х., Грачи М.Д., Стивенс Б.О., Роджерс Г.Г., Флеминг Л.Л. Внутривенный регионарный бретилий и лидокаин для лечения рефлекторной симпатической дистрофии: рандомизированное двойное слепое исследование. Анест Аналг . 1992 июн. 74 (6): 818-21. [Медлайн].
Kettler RE, Abram SE. Внутривенное регионарное введение дроперидола в лечении рефлекторной симпатической дистрофии: двойное слепое плацебо-контролируемое перекрестное исследование. Анестезиология . 1988 декабрь 69 (6): 933-6. [Медлайн].
Ханна Х.М., Торф С.Дж. Кетансерин при рефлекторной симпатической дистрофии. Двойное слепое плацебо-контролируемое перекрестное исследование. Боль . 1989. 38: 145-150.
Glynn CJ, Stannard C, Collins PA, Casale R. Роль периферической судомоторной блокады в лечении пациентов с симпатически поддерживаемой болью. Боль . 1993 апр. 53 (1): 39-42. [Медлайн].
Torebjork HE, Hallin RG.Изменения восприятия, сопровождающие контролируемое преимущественное блокирование ответов волокон A и C в неповрежденных кожных нервах человека. Опыт Мозгов . 1973. 16: 321-332.
Ramirez JM, French AS. Фентоламин избирательно влияет на быстрый натриевый компонент сенсорной адаптации механорецепторов насекомых. Дж. Нейробиол . 1990, 21 сентября (6): 893-9. [Медлайн].
Verdugo R, Очоа JL. Сочувственно поддерживаемая боль. I. Блок фентоламина ставит под сомнение эту концепцию. Неврология . 1994. 44: 1003-1010.
Галер Б.С. Предварительный отчет: максимальное облегчение боли задерживается, а продолжительность облегчения увеличивается после внутривенной инфузии фентоламина. Рег Анест . 1995. 20: 444-447.
Raja SN, Turnquist JL, Meleka SM, et al. Мониторинг адекватности адренергической блокады после системного введения фентоламина. Боль . 1996. 64: 197-204.
Backonja M, Arndt G, Gombar KA, Check B, Zimmermann M.Ответ хронических нейропатических болевых синдромов на кетамин: предварительное исследование. Боль . 1994, январь, 56 (1): 51-7. [Медлайн].
Пела CN. Антагонисты NMDA-рецепторов при невропатической боли: от экспериментальных методов к клиническим испытаниям. J Устранение болевых симптомов . 2000, 19 января (1 приложение): S21-5. [Медлайн].
Эйде К., Стубхауг А., Ой И., Брейвик Х. Непрерывное подкожное введение антагониста рецептора N-метил-D-аспарагиновой кислоты (NMDA) кетамина при лечении постгерпетической невралгии. Боль . 1995 Май. 61 (2): 221-8. [Медлайн].
Адмад М., Акерман В.Е., Минур М.А., Салим М. Антагонисты рецепторов NMDA. Последние достижения в лечении хронической боли. Клиника боли . 2001. 25–31.
Покет С. Синаптическая пластичность спинного мозга и хроническая боль. Анест Аналг . 1995, январь 80 (1): 173-9. [Медлайн].
Карпентер К.Дж., Дикенсон А.Х. Рецепторы NMDA и боль — надежда на новые анальгетики. Reg Anesth Pain Med . 1999 ноябрь-декабрь. 24 (6): 506-8. [Медлайн].
Sunder RA, Toshniwal G, Dureja G. Кетамин в качестве адъюванта при симпатических блоках для управления центральной сенсибилизацией после повреждения периферических нервов. J Повреждение периферического нерва плечевого сплетения . 2008 25 октября, 3:22. [Медлайн]. [Полный текст].
Correll GE, Maleki J, Gracely EJ, Muir JJ, Harbut RE. Субанестетическая инфузионная терапия кетамином: ретроспективный анализ нового терапевтического подхода к комплексному региональному болевому синдрому. Болеутоляющее . 2004 Сентябрь 5 (3): 263-75. [Медлайн].
Kiefer RT, Rohr P, Ploppa A, Dieterich HJ, Grothusen J, Koffler S, et al. Эффективность кетамина в дозировке анестетика для лечения рефрактерного комплексного регионального болевого синдрома: открытое исследование фазы II. Болеутоляющее . 2008 г., 9 (8): 1173-201. [Медлайн].
Sigtermans MJ, van Hilten JJ, Bauer MC, Arbous MS, Marinus J, Sarton EY. Кетамин обеспечивает эффективное и долгосрочное обезболивание у пациентов с комплексным региональным болевым синдромом 1 типа. Боль . 2009 Октябрь 145 (3): 304-11. [Медлайн].
Schwartzman RJ, Alexander GM, Grothusen JR, Paylor T, Reichenberger E, Perreault M. Амбулаторное внутривенное введение кетамина для лечения сложного регионального болевого синдрома: двойное слепое плацебо-контролируемое исследование. Боль . 2009 15 декабря. 147 (1-3): 107-15. [Медлайн].
Goebel A, Baranowski A, Maurer K, Ghiai A, McCabe C, Ambler G. Внутривенное лечение иммуноглобулином сложного регионального болевого синдрома: рандомизированное исследование. Энн Интерн Мед. . 2 февраля 2010 г. 152 (3): 152-8. [Медлайн].
Collins S, Zuurmond WW, de Lange JJ, van Hilten BJ, Perez RS. Внутривенное введение магния пациентам с комплексным региональным болевым синдромом 1 типа (КРБС 1): пилотное исследование. Болеутоляющее . 2009 июль-авг. 10 (5): 930-40. [Медлайн].
Фишер С.Г., Коллинз С., Бугард С., Лоер С.А., Зуурмонд В.В., Перес Р.С. Внутривенное введение магния при хроническом комплексном региональном болевом синдроме 1 типа (КРБС-1). Болеутоляющее . 2013 сентября, 14 (9): 1388-99. [Медлайн].
Groeneweg G, Huygen FJ, Niehof SP, Wesseldijk F, Bussmann JB, Schasfoort FC, et al. Влияние тадалафила на кровоток, боль и функцию при хроническом холодном комплексном региональном болевом синдроме: рандомизированное контролируемое исследование. BMC Musculoskelet Disord . 20 октября 2008 г. 9: 143. [Медлайн]. [Полный текст].
Birklein F, Sommer C. Внутривенный иммуноглобулин для борьбы со сложными региональными болевыми синдромами: надежды и сомнения. Энн Интерн Мед. . 2 февраля 2010 г. 152 (3): 188-9. [Медлайн].
Rauck RL, Eisenach JC, Jackson K, Young LD, Southern J. Эпидуральное лечение клонидином рефрактерной рефлекторной симпатической дистрофии. Анестезиология . 1993 декабрь 79 (6): 1163-9; обсуждение 27A. [Медлайн].
AbuRahma AF, Робинсон PA, Powell M, Bastug D, Boland JP. Симпатэктомия при рефлекторной симпатической дистрофии: факторы, влияющие на результат. Энн Васк Сург .1994 июл.8 (4): 372-9. [Медлайн].
Bandyk DF, Johnson BL, Kirkpatrick AF et al. Хирургическая симпатэктомия при синдромах рефлекторной симпатической дистрофии. J Vasc Surg . 2002. 35: 269-77.
Schwartzman RJ, Liu JE, Smullens SN, Hyslop T., Tahmoush AJ. Отдаленный результат симпатэктомии по поводу комплексного регионарного болевого синдрома 1 типа (RSD). J Neurol Sci . 1997, 10 сентября. 150 (2): 149-52. [Медлайн].
Сингх Б., Мудли Дж., Шайк А.С., Роббс СП.Симпатэктомия при сложном регионарном болевом синдроме. J Vasc Surg . 2003 марта 37 (3): 508-11. [Медлайн].
Kemler MA, Barendse GA, van Kleef M, de Vet HC, Rijks CP, Furnee CA. Стимуляция спинного мозга у пациентов с хронической рефлекторной симпатической дистрофией. N Engl J Med . 2000 31 августа. 343 (9): 618-24. [Медлайн].
Кемлер М.А., Фурне Калифорния. Экономическая оценка стимуляции спинного мозга при хронической рефлекторной симпатической дистрофии. Неврология . 2002, 22 октября. 59 (8): 1203-9. [Медлайн].
Calvillo O, Racz G, Didie J, Smith K. Нейроаугментация в лечении сложного регионарного болевого синдрома верхней конечности. Acta Orthop Belg . 1998 Mar.64 (1): 57-63. [Медлайн].
Стэнтон-Хикс М. Стимуляция спинного мозга для лечения сложных региональных болевых синдромов. Нейромодуляция . 1999. 193-201.
Беннетт Д., Ало К., Окли Дж. И др.Стимуляция спинного мозга при комплексном региональном болевом синдроме I (RSD): ретроспективный многоцентровый опыт 1995-1998 годов из 101 патента. Нейромодуляция . 1999. 3: 202-10.
Poree L, Krames E, Pope J, Deer TR, Levy R, Schultz L. Стимуляцию спинного мозга как лечение комплексного регионального болевого синдрома следует рассматривать раньше, чем лечение последней инстанции. Нейромодуляция . 2013 март-апрель. 16 (2): 125-41. [Медлайн].
Kriek N, Schreurs MWJ, Groeneweg JG, Dik WA, Tjiang GCH, Gültuna I, et al.Стимуляция спинного мозга у пациентов с комплексным регионарным болевым синдромом: возможная цель для иммуномодуляции ?. Нейромодуляция . 2018 21 января (1): 77-86. [Медлайн].
Нардоне Р., Бриго Ф., Хёллер Ю., Себастианелли Л., Версаче В., Салтуари Л. и др. Исследования транскраниальной магнитной стимуляции при комплексном региональном болевом синдроме I типа: обзор. Acta Neurol Scand . 2018 Февраль 137 (2): 158-164. [Медлайн].
Pleger B, Janssen F, Schwenkreis P, Völker B, Maier C, Tegenthoff M.Повторяющаяся транскраниальная магнитная стимуляция моторной коры ослабляет восприятие боли при комплексном региональном болевом синдроме I типа. Neurosci Lett . 2004 12 февраля. 356 (2): 87-90. [Медлайн].
Пагани С., Веронези Ф., Альдини Н. Н., Фини М. Комплексный региональный болевой синдром типа I, ослабляющий и плохо понятый синдром. Возможная роль импульсных электромагнитных полей: обзорный обзор. Врач по обезболиванию . 2017 20 сентября (6): E807-E822. [Медлайн].
Шерри Д.Д., Уоллес К.А., Келли С., Киддер М., Сапп Л. Краткосрочные и отдаленные результаты лечения детей с комплексным региональным болевым синдромом I типа с помощью лечебной физкультуры. Клин Дж. Боль . 1999 Сентябрь 15 (3): 218-23. [Медлайн].
Oerlemans HM, Остендорп, RA, de Boo T, Goris RJ. Оценка трех методов оценки нарушений у пациентов со сложным регионарным болевым синдромом I одной верхней конечности. Clin Rehabil . 2000 июн.14 (3): 331-9. [Медлайн].
Кемлер MA, Rijks CP, de Vet HC. Какие пациенты с хронической рефлекторной симпатической дистрофией с наибольшей вероятностью получат пользу от физиотерапии? J Manipulative Physiol Ther. 2001. 24: 272-8.
Severens JL, Oerlemans HM, Weegels AJ, van ‘t Hof MA, Остендорп, RA, Горис, RJ. Анализ экономической эффективности адъювантной физической или профессиональной терапии для пациентов с рефлекторной симпатической дистрофией. Arch Phys Med Rehabil .1999 Сентябрь 80 (9): 1038-43. [Медлайн].
Moseley CL. Успешная реабилитация сложного регионарного болевого синдрома связана с постоянным вниманием к пораженной конечности? Рандомизированное клиническое исследование, Боль . 2005. 114: 54-61.
Ли Б. Х., Шарфф Л., Сетна Н. Ф., Маккарти К. Ф., Скотт-Сазерленд Дж., Ши А. М.. Физическая терапия и когнитивно-поведенческое лечение сложных региональных болевых синдромов. Дж. Педиатр . 2002 Июль 141 (1): 135-40.[Медлайн].
де Йонг JR, Vlaeyen JW, Onghena P, Cuypers C, den Hollander M, Ruijgrok J. Снижение страха, связанного с болью, при сложном региональном болевом синдроме I типа: применение градуированной экспозиции in vivo. Боль . 2005 августа 116 (3): 264-75. [Медлайн].
Gierthmühlen J, Binder A, Baron R. Механическое лечение сложных региональных болевых синдромов. Нат Рев Нейрол . 2014 Сентябрь 10 (9): 518-28. [Медлайн].
Стэнтон-Хикс М., Барон Р., Боас Р., Горд Т., Харден Н., Хендлер Н.Комплексные регионарные болевые синдромы: рекомендации по терапии. Клин Дж. Боль . 1998, 14 июня (2): 155-66. [Медлайн].
Барон Р., Биндер А., Ульрих В. и др. Рефлекторная симпатическая дистрофия. Рефлекторная симпатическая дистрофия и каузалгия. Несвенарцт . 2002. 73: 305-18, (на немецком языке).
Evans JA. Рефлекторная симпатическая дистрофия. Акушерский гинекологический хирург . 1946. 82: 36-44.
Галер Б.С., Брюль С., Харден Р.Диагностические критерии IASP для комплексного регионального болевого синдрома: предварительное эмпирическое валидационное исследование. Международная ассоциация изучения боли. Клин Дж. Боль . 1998 14 марта (1): 48-54. [Медлайн].
Geertzen JH, Dijkstra PU, van Sonderen EL. Взаимосвязь между нарушениями, инвалидностью и физическими недостатками у пациентов с рефлекторной симпатической дистрофией: долгосрочное последующее исследование. Clin Rehabil . 1998. 12: 402-412.
Кемлер М.А., ван де Вуссе А.С., ван ден Берг-Лунен Е.М., Барендсе Г.А., ван Клиф М., Вебер В.Е.HLA-DQ1 ассоциирован с рефлекторной симпатической дистрофией. Неврология . 1999, 12 октября. 53 (6): 1350-1. [Медлайн].
Курверс HA. Рефлекторная симпатическая дистрофия: факты и гипотезы. Васк Мед . 1998. 3 (3): 207-14. [Медлайн].
Mense S. Биохимический патогенез миофасциальной боли. J Скелетно-мышечная боль . 1996. 4: 145-62.
Мерский Х., Богдук Н. Классификация хронической боли. Сиэтл: IASP Press . 1994.
Очоа JL. Правда, ошибки и ложь вокруг «рефлекторной симпатической дистрофии» и «сложного регионального болевого синдрома». Дж. Нейрол . 1999 Октябрь 246 (10): 875-9. [Медлайн].
Oerlemans HM, Остендорп, RA, de Boo T, Goris RJ. Боль и снижение подвижности при комплексном региональном болевом синдроме I: результат проспективного рандомизированного контролируемого клинического исследования адъювантной физиотерапии по сравнению с оккупационной терапией. Боль . 1999 Октябрь 83 (1): 77-83. [Медлайн].
Oerlemans HM, Остендорп, РА, де Бу Т., Перес, Р. Дж., Горис. Признаки и симптомы комплексного регионального болевого синдрома I типа / рефлекторной симпатической дистрофии: оценка врача по сравнению с объективным измерением. Клин Дж. Боль . 1999 Сентябрь 15 (3): 224-32. [Медлайн].
Паппагалло М. Сложные регионарные болевые синдромы. Обзоры неврологии . 2000.25-29.
Портеной РК.Компания Дэвиса. Невропатическая боль . Филадельфия: FA: Лечение боли: теория и практика .; 1996. 83-125.
Робертс WJ. Гипотеза о физиологической основе каузалгии и связанных с ней болей. Боль . 1986, 24 марта (3): 297-311. [Медлайн].
Шурманн М., Градл Г., Андресс Х.Дж., Фурст Х., Шильдберг Ф.В. Оценка функции периферической симпатической нервной системы для диагностики раннего посттравматического комплекса регионального болевого синдрома I. Боль . 1999 г., 80 (1-2): 149-59. [Медлайн].
Тиминёр М.А., Саберски Л. Комплексный региональный болевой синдром I типа (RSD) или периферическая мононевропатия? Обсуждение трех случаев. Клин Дж. Боль . 1996 июн. 12 (2): 145-50. [Медлайн].
van der Laan L, ter Laak HJ, Gabreels-Festen A, Gabreels F, Goris RJ. Комплексный региональный болевой синдром I типа (RSD): патология скелетных мышц и периферических нервов. Неврология .1998 июл 51 (1): 20-5. [Медлайн].
Veldman PH, Reynen HM, Arntz IE, Goris RJ. Признаки и симптомы рефлекторной симпатической дистрофии: проспективное исследование 829 пациентов. Ланцет . 1993, 23 октября. 342 (8878): 1012-6. [Медлайн].
Васнер Г., Биндер А., Коппер Ф, Барон Р. Отсутствие влияния симпатической судомоторной активности на вызванную капсаицином продолжающуюся боль и гипералгезию. Боль . 2000 Февраль 84 (2-3): 331-8. [Медлайн].
Зылюк А.Естественное течение посттравматической рефлекторной симпатической дистрофии. J Hand Surg Br . 1998 23 февраля (1): 20-3. [Медлайн].
(PDF) Профилирование пациентов с посттравматической невропатией тройничного нерва
Для описания причины, клинических признаков и симптомов пациентов, поступающих в центр третичной медицинской помощи с ятрогенными поражениями нижнечелюстных ветвей тройничного нерва. Анамнез боли, оценка боли с использованием визуальной аналоговой шкалы и результаты механосенсорного тестирования были записаны у 93 пациентов с ятрогенными повреждениями язычного нерва (LNI) и у 90 пациентов с ятрогенными повреждениями нижнего альвеолярного нерва (IANI).Результаты были проанализированы с использованием статистического программного обеспечения SPSS. Для непараметрического тестирования частот применялись критерии хи-квадрат, где P 0,05 указывал на статистическую значимость. Соответствующие корреляции были также выполнены между некоторыми наборами данных. Женщин было направлено значительно больше, чем мужчин (P <0,05). В целом операция на третьем моляре (TMS) вызвала 73% LNI с последующей местной анестезией (LA) (17%). Более разнообразные процедуры вызвали IANI, включая TMS (60%), LA (19%), имплантаты (18%) и эндодонтию (8%).Примерно у 70% пациентов наблюдалась невропатическая боль, совпадающая с анестезией и парестезией. Невропатия была продемонстрирована у всех пациентов с различной степенью потери механосенсорной функции, парестезией, дизестезией, аллодинией и гипералгезией. Функционально пациенты с IANI и LNI в основном имели проблемы с речью и питанием, причем речь была нарушена у значительно большего числа пациентов с LNI (P <0,001). Сон, чистка зубов и питье были значительно более проблематичными для пациентов IANI (P <.05, P <0,001 и P <0,0001 соответственно). Нейропатическая боль, а также анестезия часто возникают после ятрогенного повреждения тройничного нерва, как и другие посттравматические повреждения сенсорного нерва. Клиницисты должны признать это относительно распространенной проблемой, и информированное согласие, надлежащим образом сформулированное для пациентов с риском повреждения тройничного нерва, в связи со стоматологией требует пересмотра.
Рисунки — загружены Тарой Рентон Автор контентаВсе рисунки в этой области были загружены Тарой Рентон
Контент может быть защищен авторским правом.
Посттравматическая нейропатия ладонной кожной ветви срединного нерва: четыре случая. Разрыв или ловушка?
Аль-Каттан М.М. (1997) Анатомическая классификация участков сдавления ладонной кожной ветви срединного нерва. J Hand Surg Br 22 (1): 48–49
CAS Статья PubMed Google ученый
Аль-Каттан М.М., Робертсон Г.А. (1993) Захватывающая невропатия кожного нерва ладони в его туннеле.J Hand Surg B 18B: 465–466
Google ученый
Bergeron JW, Braddom RL (1998) Запись кожного нерва ладони и уточнение генераторов медианного премоторного потенциала. Am J Phys Med Rehabil 77 (5): 399–406
CAS Статья PubMed Google ученый
Бакмиллер Дж. Ф., Рикард Т. А. (1987) Изолированная компрессионная невропатия ладонной кожной ветви срединного нерва.J Hand Surg Am 12 (1): 97–99
CAS PubMed Google ученый
Chang C-W, Lien I-N (1991) Сравнение сенсорной нервной проводимости в ладонной кожной ветви и первой пальцевой ветви срединного нерва: новый метод диагностики синдрома запястного канала. Мышечный нерв 14: 1173–1176
CAS Статья PubMed Google ученый
De Smet L (1998) ущемление ладонной кожной ветви срединного нерва.J Hand Surg Br 23 (1): 115–116
Артикул PubMed Google ученый
Gessini L, Jandolo B, Pietrangeli A, Senese A (1983) Сдавление ладонного кожного нерва ганглиями запястья. J Neurosurg Sci 27: 241–243
CAS PubMed Google ученый
Haskin JS (1994) Ганглиозная компрессионная нейропатия ладонно-кожной ветви срединного нерва: отчет о двух случаях.J Hand Surg Am 19 (5): 827–828
Артикул PubMed Google ученый
Имаи Т., Вада Т., Мацумото Х (2004) Невропатия защемления ладонной кожной ветви срединного нерва при синдроме запястного канала. Clin Neurophysiol 115 (11): 2514–2517
Статья PubMed Google ученый
Lindley SG, Kleinert JM (2003) Преобладание анатомических вариаций, встречающихся при плановом освобождении запястного канала.J Hand Surg Am 28 (5): 849–855
Артикул PubMed Google ученый
Rathakrishnan R, Therimadasamy AK, Chan YH, Wilder-Smith EP (2007) Срединный ладонный кожный нерв у здоровых субъектов и CTS. Clin Neurophysiol 118: 776–780
Статья PubMed Google ученый
Райегани С.М., Вафаи Х., Багбани М., Бахрами М.Х. (2005) Ладонная кожная ветвь исследования проводимости срединного нерва.Электромиогр. Clin Neurophysiol 45 (1): 29–32
CAS PubMed Google ученый
Семер Н., Кримминс С., Форд Джонс Н. (1996) Компрессионная нейропатия ладонной кожной ветви срединного нерва от передней фасции. J Hand Surg Br 5: 666–667
Google ученый
Симидзу К., Ивасаки Р., Хошикава Х., Ямамуро Т. (1988) Невропатия защемления ладонной кожной ветви срединного нерва фасцией поверхностного сгибателя пальцев.J Hand Surg Am 13 (4): 581–583
CAS Статья PubMed Google ученый
Stellbrink G (1972) Сдавление ладонной ветви срединного нерва атипичной длинной ладонной мышцей. Handchirurgie 4: 155–157
CAS PubMed Google ученый
Tagliafico et Pugliese F, Bianchi S, Bodner G, Padua L, Rubino M, Martinoli C (2008) Сонография с высоким разрешением ладонной кожной ветви срединного нерва.AJR 191: 107–113
Статья Google ученый
Вада Т., Имаи Т., Исии С. (2002) Невропатия защемления ладонной кожной ветви срединного нерва, сопутствующая синдрому запястного канала: отчет о клиническом случае. J Hand Surg Br 6: 583–585
Google ученый
Невропатии — Физиопедия
Клинически значимая анатомия [править | править источник]
Периферические невропатии включают нарушения периферических нервных клеток и волокон, которые возникают вторично по отношению к широкому спектру патологий.Эти нервы включают: черепные нервы; корешки и ганглии спинномозговых нервов; нервные стволы и отделы; нервы вегетативной нервной системы.
Несколько методов используются для классификации периферических невропатий, включая
- Классифицируя их как мононейропатии, мультифокальные невропатии и полиневропатии.
- Дальнейшие подклассы могут быть сделаны для разделения периферических невропатий на аксональные, демиелинизирующие или смешанные, что важно для лечения и лечения.
Наиболее часто встречающиеся симптомы периферической невропатии включают онемение и парестезии; Эти симптомы могут сопровождать боль, слабость и потеря глубоких сухожильных рефлексов.
Периферические невропатии
- Обычно развиваются в течение месяцев или лет, в то время как некоторые могут развиваться быстрее и иметь прогрессирующий характер.
- Имеют широкий диапазон тяжести и клинических проявлений, поскольку они могут влиять на моторные, сенсорные и вегетативные волокна. [1]
Точная патофизиология периферической невропатии зависит от основного заболевания.
- Хотя широкий спектр различных заболеваний может в конечном итоге привести к периферическим невропатиям, механизмы повреждения периферических нервов имеют сходные закономерности.
- Эти реакции включают сегментарную демиелинизацию, а также дегенерацию валлерова и аксонов [1] .
Периферические невропатии имеют различное происхождение, включая метаболические, системные и токсические причины. Следует учитывать следующие основные этиологии:
- Физические травмы e.грамм. давление от грыжи диска, давление от гипса, травма, артрит.
- Диабет
- Аутоиммунные заболевания, например Синдром Гийена-Барре, синдром Шегрена, волчанка, ревматоидный артрит (РА)
- Недостаток питательных веществ (например, B1, B6, B12, витамин E)
- воспалительные состояния (например, васкулит)
- Инфекции, например ветряная оспа, вирус ветряной оспы (опоясывающий лишай), вирус Белого Нила, СПИД, болезнь Лайма (переносится клещами), вирус Эпштейна-Барра, гепатит C [2]
- Химиотерапевтические препараты
- Лекарства (антибиотики, сердечно-сосудистые препараты)
- Опухоли (вторичные по отношению к компрессии или ассоциированным паранеопластическим синдромам)
- Унаследованные условия (e.г., болезнь Шарко-Мари-Тута, семейный амилоидоз)
- Травма / травма
- Множественная миелома и ее лечение
- Моноклональная гаммопатия неопределенного значения (MGUS)
В некоторых случаях прямая причина может быть неочевидной [1]
- Прибл. 2,4% населения страдают заболеваниями периферических нервов
- Распространенность увеличивается до 8,0% среди пожилых людей.
- Диабетическая невропатия встречается примерно у 50% людей с хроническим диабетом 1 и 2 типа.
- В глобальном масштабе проказа остается частой причиной периферической невропатии, наиболее распространенной в Юго-Восточной Азии.
- Наиболее распространенной генетической сенсомоторной полинейропатией является болезнь Шарко-Мари-Тута, а именно тип 1а.
- Самая распространенная мононевропатия — синдром запястного канала. [1]
- Пример повреждения стопы из-за потери чувствительности Клинические проявления периферической невропатии широко варьируются в зависимости от основного заболевания.
- Пациенты могут жаловаться на симптомы, которые сначала начинаются с пальцев, а затем переходят в проксимальные части конечностей.
- Симптомы варьируются и включают изменения чувствительности, слабость, атрофию, боль, онемение и даже вегетативные нарушения.
- Клинически эти симптомы могут напоминать миелопатии, радикулопатии, аутоиммунные заболевания и заболевания мышц.
- Продвинутое заболевание может прогрессировать до снижения или отсутствия глубоких рефлексов сухожилий, потери чувствительности, мышечной атрофии и слабости по типу ношения перчаток. мышечная атрофия
- Повреждение сенсорного нерва вызывает различные симптомы, поскольку сенсорные нервы выполняют широкий спектр функций.Повреждение крупных сенсорных волокон влияет на способность чувствовать вибрации и прикосновения. Клиент может почувствовать себя одетым в перчатки и чулки. Это повреждение может способствовать потере рефлексов (наряду с повреждением двигательного нерва). Потеря чувства позиции, например, из-за проблемы с балансом. Повреждение «мелких волокон» (без миелиновых оболочек) влияет на передачу болевых и температурных ощущений, что мешает способности чувствовать боль или изменения температуры. Это вызывает невропатическую боль, которая может ухудшить качество жизни человека.
- Повреждение вегетативных нервов поражает аксоны при невропатии мелких волокон. Общие симптомы включают чрезмерное потоотделение, непереносимость тепла, неспособность расширять и сокращать мелкие кровеносные сосуды, регулирующие кровяное давление, и желудочно-кишечные симптомы. [2]
Обследование пациентов с невропатией включает подробный анамнез и физическое обследование, включая обзор текущих и прошлых лекарств. Хотя не существует стандартных лабораторных исследований или визуализационных исследований для проверки периферических невропатий, следующие исследования могут помочь в диагностике и помочь сузить основную причину невропатии (например,г., воспалительный, инфекционный, метаболический)
- Анализы крови, например, на наличие токсины, авитаминоз, сахарный диабет
- Визуализирующий тест напр. КТ, МРТ
- Нервные функциональные пробы, проверка нервной проводимости.
- Биопсия нерва в поисках аномалий
- Биопсия кожи с целью выявления репозиции нервных окончаний [3]
Множество различных проявлений невропатий приводят к необходимости оценки результатов, специфичных для клиента.Обычно связано с мышечной силой, болью, качеством жизни и ограничениями активности. Они включают:
Лечение периферических невропатий должно быть сосредоточено на лечении основного болезненного процесса. Например
- Контроль уровня глюкозы при диабетической невропатии, отказ от алкоголя при алкогольной нейропатии.
- При недостаточности питания можно лечить с добавлением обедненных витаминов или минералов.
Не все периферические невропатии обратимы.
- Физиотерапия и трудотерапия могут помочь в улучшении общей силы и функций пациента.
- Хроническая воспалительная демиелинизирующая нейропатия изначально лечится с помощью кортикостероидов, но также может лечиться с помощью внутривенного иммуноглобулина, плазмафереза и некоторых иммунодепрессантов. [1] .
- Направление к специалисту по боли может быть полезным для тех пациентов, которые страдают от невропатической боли.
- Невропатическая боль, особенно у тех, кто страдает невропатиями мелких волокон, обычно не поддается лечению простыми анальгетиками. Вместо этого эффективное лечение боли, связанной с периферическими невропатиями, может быть с помощью стабилизаторов мембран, некоторых противоэпилептических средств и трициклических антидепрессантов.
- Чрескожная электрическая стимуляция нервов (ЧЭНС) также является вариантом неинвазивного вмешательства для облегчения боли [1] .
Лекарства, используемые для облегчения признаков и симптомов периферической невропатии, включают: [3]
Противосудорожные средства: Габапентин; Прегабалин; Вальпроат
Антидепрессанты: Амитриптилин; Дулоксетин; Венлафаксин
Опиоиды: Декстрометорфан; Замедленное высвобождение морфина; Оксикоден; Тапентадол; Трамадол.
Прочие: Нитратные спреи для местного применения; Крем с капсаицином
Основная роль физиотерапии заключается в
- Восстанавливает или поддерживает мышечную силу и предотвращает укорочение и деформацию мышц
- Баланс, координация и функциональная тренировка.
- Обезболивающее, например предоставление ЧЭНС, массаж
- Наложение шины по мере необходимости для предотвращения деформации и контрактур
- Обучение, изменение условий, предотвращение повреждений и эмоциональная поддержка.
Подробное руководство см. Ниже по отдельным невропатиям.
При тех заболеваниях, при которых периферические нервы страдают от повреждений в результате валлеровской дегенерации или дегенерации аксонов, прогноз хуже, так как восстановление нерва является более сложной задачей.
- Для клинического улучшения аксон должен самовосстанавливаться и реиннервировать пораженную мышцу или орган.
- Прогноз заболеваний, которые возникают вторично по отношению к сегментарной демиелинизации, более благоприятен, потому что ремиелинизация достигается быстрее, что позволяет восстановить функцию аксона.





 м.н., врач-психиатр
м.н., врач-психиатр м.н., врач-невролог высшей категории, ассистент кафедры нервных болезней и нейрохирургии;
м.н., врач-невролог высшей категории, ассистент кафедры нервных болезней и нейрохирургии; м.н., врач высшей категории, ассистент кафедры
м.н., врач высшей категории, ассистент кафедры