Как отличить грипп от ОРВИ у ребенка
02.11.2016
Нередко детский организм сталкивается с различными инфекциями. Потому мамы хотят знать особенности течения разных недугов, чтобы понимать, как действовать в случившейся ситуации. У многих возникает вопрос: как отличить грипп от ОРВИ у ребенка, ведь известно, что вирусными инфекциями часто болеют именно дети?
Что такое ОРВИ и грипп?
ОРВИ — это не название конкретной болезни. Таким термином называют все те поражения дыхательных путей, которые имеют вирусную природу, сюда же относится и грипп. Но его чаще всего рассматривают, как отдельное заболевание.
Можно назвать главные отличия простых ОРВИ от гриппа у детей:
При гриппе состояние ухудшается стремительно, в то время как при обычных вирусных инфекциях симптомы нарастают постепенно.
При гриппе температура за 2 часа становится выше 39°С. Жар при этом сбивается плохо, а такое состояние способно сохраняться несколько дней.
При простуде ребенок жалуется на недомогание, быстро устает. Для гриппа же характерны сильная головная боль, покраснение глаз и слабость в теле, кашель появляется не с начала заболевания, в то время как ОРВИ он сопровождает с первого дня. Насморк является верным спутником ОРВИ, малыши чихают. Для гриппа такие признаки не характерны. Нос у больных закладывает не так сильно и проходит этот симптом уже на 2 сутки. Сильный насморк может возникнуть, если у ребенка есть хронические заболевания носоглотки.
Также отличием в симптомах гриппа и ОРВИ у детей является наличие или, наоборот, отсутствие расстройств ЖКТ. При простуде рвота и жидкий стул встречаются крайне редко. При гриппе у ребенка возможны кишечные расстройства.
При обычных вирусных инфекциях часто можно заметить увеличение лимфатических узлов, красное горло имеет рыхлую структуру, возможен налет на слизистых.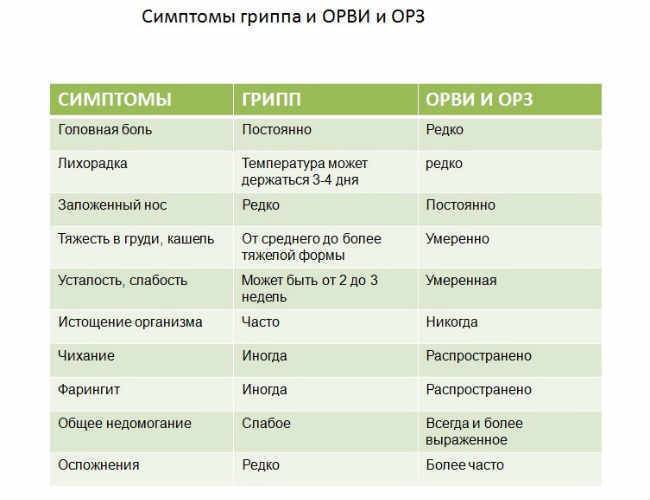
Простуда заканчивается без последствий, через 7-10 дней больной уже может вести обычный образ жизни. После гриппа больной ослабленный, могут быть головокружения, плохой аппетит, понижение или повышение артериального давления, раздражительность, бессонница. Период выздоровления гриппа длиться около 3-4 недель и опасен «второй волной» заболевания.
При возникновении симптомов у вашего ребенка, похожих на грипп или простуду обращайтесь к врачу-педиатру — он точно определит причину болезни и назначит эффективное и безопасное лечение.
первые признаки, симптомы и причины. Как определить ОРВИ у ребенка?
ОРВИ у детей — довольно частое явление: ребенок до пяти лет может болеть в среднем шесть–восемь раз в год[1]. При этом, как отмечает ВОЗ, именно эта возрастная группа находится в зоне риска по развитию тяжелой формы заболевания и осложнений на его фоне[2]. Поэтому крайне важно своевременно начать лечение.
Поэтому крайне важно своевременно начать лечение.
В статье расскажем о первых признаках ОРВИ у ребенка, а также о том, какие факторы способствуют развитию болезни.
Симптомы ОРВИ у детей
Острые респираторные вирусные инфекции быстро прогрессируют, и задача родителя — не пропустить первые тревожные звоночки. Насторожить должны любые негативные перемены в поведении ребенка. Например, о развивающейся инфекции могут сигнализировать слабость и плаксивость.
А уже на второй–третий день после вторжения вируса (в некоторых случаях — через несколько часов) болезнь проявляется более явно[3]. Итак, какие симптомы при ОРВИ у детей?
- Повышенная температура. Это самая распространенная защитная реакция детского организма на ОРВИ. Лихорадка указывает на то, что иммунитет ребенка ведет активную борьбу с инфекцией. Поэтому зачастую врачи рекомендуют не сбивать субфебрильную температуру при ОРВИ у детей и принимать меры, лишь когда градусник показывает больше 38,5 градуса (в этом случае жар уже может представлять опасность для ребенка)[4].
 Однако эта рекомендация актуальна не для всех случаев: в частности, если ребенок тяжело переносит жар или имеет хронические заболевания, врач может назначить жаропонижающие даже при незначительном повышении температуры.
Однако эта рекомендация актуальна не для всех случаев: в частности, если ребенок тяжело переносит жар или имеет хронические заболевания, врач может назначить жаропонижающие даже при незначительном повышении температуры. - Конъюнктивит. Проявляется резью, покраснением сосудов в уголках глаз. Союз педиатров России и Ассоциация медицинских обществ по качеству отмечают этот признак как один из самых ярких симптомов вирусной инфекции[5].
Важно
ОРВИ — это общее название всех вирусных инфекций, поражающих органы дыхания. Чаще всего возбудителями заболевания становятся аденовирусы, вирусы гриппа, энтеровирусы и риновирусы. Для борьбы с «виновниками» болезни применяются противовирусные средства. Однако некоторые родители по незнанию «назначают» своим детям антибиотики. Такое «лечение» может быть опасным: согласно клиническим рекомендациям Минздрава РФ, антибиотикотерапия при неосложненной ОРВИ подавляет нормальную пневмотропную флору, что способствует проникновению стафилококков и, соответственно, развитию осложнений[6]. Необходимо помнить, что применение любого лекарства требует согласования с врачом.
Необходимо помнить, что применение любого лекарства требует согласования с врачом.
- Насморк. Заложенность носа и выделение слизи из носовой полости также считаются характерными признаками ОРВИ у детей. Обильные выделения (прозрачные, желтые, зеленые или белые) появляются в связи с началом воспалительного процесса. Бытует мнение, что желтый или зеленый цвет слизи указывает на присоединение бактериальной инфекции, однако Минздрав опровергает эту информацию[7].
- Кашель. Как правило, начало заболевания сопровождается сухим кашлем, который затем переходит во влажный. К слову, кашель при ОРВИ у детей может возникать в результате раздражения гортани секретом, стекающим из носового хода[8]. А из-за ограниченного носового дыхания (при насморке) ребенок начинает дышать ртом, что также приводит к раздражению горла и ощущению першения, в результате чего усиливается кашлевый рефлекс. Промывание и гигиена носа помогают уменьшить кашель или даже избежать возникновения данного симптома.

- Увеличение лимфоузлов. При ОРВИ, помимо воспаления слизистых (глаз, носа, горла), может возникать воспаление лимфоидных элементов рото- и носоглотки. Лимфатические узлы — важная составляющая иммунной системы, их увеличение и болезненность сигнализируют о патологическом процессе.
Кроме того, во время ОРВИ у ребенка могут наблюдаться и другие неприятные симптомы: жжение и покалывание в носоглотке, шум и боль в ушах, ухудшение слуха, мышечная слабость, судороги, осиплость голоса[9]. Указанные признаки могут проявляться в большей или меньшей степени в зависимости от возбудителя болезни. Например, при гриппе и аденовирусной инфекции высокая температура нередко держится в течение недели, тогда как при других ОРВИ гипертермия сохраняется всего около трех дней[10].
На заметку
Интоксикация, мышечная слабость, воспаление слизистых в совокупности с повышенной температурой могут указывать на то, что причиной болезни стали вирусы гриппа[11].
Стоит отметить, что все эти признаки нельзя назвать специфическими для ОРВИ: врач ставит диагноз по совокупности симптомов, исключая вероятность развития схожих заболеваний.
Причины респираторных заболеваний
Как уже было сказано, дети часто болеют ОРВИ. Дело в том, что неокрепший иммунитет малыша еще только учится реагировать на те или иные вирусы. В идеале последующую атаку уже знакомых патогенов защитные силы будут отражать эффективнее и с меньшими последствиями.
Помимо того, что иммунитет ребенка слаб сам по себе, существует и ряд факторов, способствующих ослаблению иммунной системы. Почему ребенок может заболеть?
- Переохлаждение. Так называемый сезон простуд приходится на период с сентября по апрель, когда температура воздуха снижена и вероятность переохлаждения возрастает[12].
- Сильные стрессы. Негативное влияние стресса на иммунитет подтверждено различными исследованиями[13].

- Несбалансированное питание. Недостаток витаминов и минералов в пище может приводить к развитию дефицита того или иного элемента в организме ребенка, что, в свою очередь, сказывается на его здоровье в целом. Например, некоторые исследователи отмечают особую роль витамина Д в формировании защитных сил организма. Витамин Д — своеобразный иммуномодулятор: он укрепляет врожденный иммунитет и необходим для профилактики респираторных инфекций[14].
- Низкая или повышенная физическая активность. Умеренные физические нагрузки необходимы для поддержания нормального здоровья, в то время как отсутствие спорта, равно как и «перетренированность»[15], могут ослаблять иммунитет и повышать чувствительность организма к заболеваниям.
- Нарушенный режим сна. Сон положительно влияет на здоровье ребенка. По некоторым данным, при недостатке сна вероятность развития инфекции повышается[16].
Стоит помнить, что ОРВИ может передаваться воздушно-капельным и контактно-бытовым путем. Поэтому важно следить за гигиеной рук ребенка и по возможности не допускать его контакта с зараженными людьми.
Поэтому важно следить за гигиеной рук ребенка и по возможности не допускать его контакта с зараженными людьми.
Очевидно, что для профилактики ОРВИ важно исключить факторы, негативно влияющие на иммунитет ребенка, и в целом обеспечить ему условия для здорового образа жизни. А для повышения защитных сил детского организма, как отмечает Роспотребнадзор, можно использовать иммуностимулирующие средства — с разрешения и под контролем врача[17].
Вся информация, касающаяся здоровья и медицины, представлена исключительно в ознакомительных целях и не является поводом для самодиагностики или самолечения.
Почему коронавирус опасен для детей не меньше, чем для взрослых
Принято считать, что для детей заболевание коронавирусной инфекцией нового типа является не настолько опасным, как для взрослых пациентов. Отчасти это действительно так — в большинстве случаев юные пациенты переносят COVID-19 в легкой форме или бессимптомно. Однако это не значит, что болезнь проходит бесследно для их здоровья.
— Как дети переносят коронавирусную инфекцию нового типа?
— Коронавирусную инфекцию SARS COV2 (COVID-19) дети переносят по-разному. Чаще всего они болеют легко. Более того, часть детей, и не малая, вообще переносит болезнь бессимптомно. Но это не значит, что нет проблем. Есть даже две проблемы. Во-первых, больные являются источником для инфицирования окружающих: в школе, семье, где угодно. Например, ребенок болел бессимптомно и инфицировал всех членов семьи, которые продолжают распространять вирус. Иногда COVID-19 напоминает легкое течение ОРВИ, и в этих случаях дети тоже являются разносчиками инфекции. Это первое.
Вторая проблема – через месяц-полтора у ребенка, который болел легко или бессимптомно, может развиться тяжелое осложнение – мультисистемный воспалительный синдром, который по клиническим проявлениям напоминает синдром Кавасаки: высокая лихорадка, дерматит, хейлит, стоматит, лимфоаденопатия, признаки системного васкулита. Причем происходит это внезапно: вот ребенок вроде бы выздоровел, а через месяц-полтора оказывается в больнице. Недавно у нас был такой случай — родители болели, ребенок был здоров. А через полтора месяца ребенок поступает к нам в тяжелейшем состоянии: лихорадка, температура 39 градусов, интоксикация, клиника мультисистемно-воспалительного синдрома, когда сразу страдают несколько органов. Это уже не инфекция, это тяжелые последствия инфекции.
Причем происходит это внезапно: вот ребенок вроде бы выздоровел, а через месяц-полтора оказывается в больнице. Недавно у нас был такой случай — родители болели, ребенок был здоров. А через полтора месяца ребенок поступает к нам в тяжелейшем состоянии: лихорадка, температура 39 градусов, интоксикация, клиника мультисистемно-воспалительного синдрома, когда сразу страдают несколько органов. Это уже не инфекция, это тяжелые последствия инфекции.
close
100%
Заведущая кафедрой педиатрии Московского государственного медико-стоматологического университета им. А. И. Евдокимова, профессор, доктор медицинских наук Ольга Зайцева
Распознать COVID-19 у детей сложно, так как симптомы, наблюдаемые у взрослых при этом заболевании, частно не проявляются у детей. Как я уже говорила, большинство из них переносит коронавирусную инфекцию как легкое ОРВИ, кроме того, дети крайне редко теряют обоняние и вкусовые ощущения. Конечно, бывают и тяжелые случаи коронавирусной инфекции среди детей, но намного реже, чем у взрослых пациентов. Эти дети обязательно госпитализируются.
Конечно, бывают и тяжелые случаи коронавирусной инфекции среди детей, но намного реже, чем у взрослых пациентов. Эти дети обязательно госпитализируются.
— Давайте немного подробнее остановимся на тех последствиях, которые наблюдаются у детей после перенесенного COVID-19…
— Дети, переболевшие COVID-19, в течение нескольких месяцев после выздоровления могут легко заболеть бактериальной инфекцией, например, пневмонией в тяжелой форме. Вроде бы здоровый ребенок, перенес коронавирусную инфекцию, перенес легко. Однако у него снижена сопротивляемость организма, причем снижена довольно долго.
— То есть получается, что COVID-19 оказывает какой-то комплексный угнетающий эффект на иммунную систему?
— Да. Этот аспект еще мало изучен, поэтому нельзя сказать точно, когда и какие возникают иммунологические последствия, но просто по опыту мы видим, что эти дети потом тяжелее болеют инфекционными заболеваниями. Сопротивляемость у них определенно ниже. На самом деле, это очень характерно и для других инфекций. Например, инфекционный мононуклеоз или корь тоже имеют иммуносупрессивный эффект. Это хорошо изученные болезни, когда снижение иммунитета наблюдается 2-3 месяца — достаточно долго. В случае с COVID-19 у меня складывается впечатление, что происходит аналогичный процесс, потому что в результате редко болеющие дети вдруг поступают к нам с тяжелейшей пневмонией. Некоторые дети на фоне мультисистемного синдрома дают тяжелое осложнение на почки и на сердце.
Например, инфекционный мононуклеоз или корь тоже имеют иммуносупрессивный эффект. Это хорошо изученные болезни, когда снижение иммунитета наблюдается 2-3 месяца — достаточно долго. В случае с COVID-19 у меня складывается впечатление, что происходит аналогичный процесс, потому что в результате редко болеющие дети вдруг поступают к нам с тяжелейшей пневмонией. Некоторые дети на фоне мультисистемного синдрома дают тяжелое осложнение на почки и на сердце.
— То есть получается, что представление о том, что для детей COVID-19 не особенно опасен, на самом деле не соответствует действительности?
— Конечно.
— Что же тогда делать родителям, если где-то в очаге инфекции оказались дети? Например, если заболел кто-то из родителей, или инфекция появилась в коллективе, где находится ребенок? Что можно предпринять?
— Главная мысль заключается в том, что это все-таки респираторная вирусная инфекция, и методы профилактики для всех вирусных инфекций одинаковы. Они имеют два основных направления.
Первое направление – это уменьшить вероятность инфицирования или хотя бы количество инфекционного возбудителя.
Это то, чему мы сейчас научились – маски, мытье рук, орошение полости носа соленой водой, лучше всего морской. Для этого есть специальные растворы, позволяющие смыть, уменьшить количество вируса, попавшего в организм, если это вдруг произошло. Очень хорошо для профилактики использовать спрей, капли, гель или мазь на основе препаратов интерферона альфа.
Второе направление профилактики – это повышение иммунитета.
Вести здоровый образ жизни, гулять, дышать свежим воздухом, долго не сидеть у компьютера. Кстати, вести здоровый образ жизни — самое сложное. Кроме того, обязательно нужно, чтобы носоглотка и зубы были здоровы. Для этого ребенка надо регулярно показывать ЛОР-врачу и стоматологу. Иногда родители спрашивают: «Почему ребенок болеет?» А у него во рту все зубы кариозные, или в носоглотке запущенный аденоидит. Важно, чтобы в организме не было очагов хронической инфекции.
Если же ребенок находится в близком контакте с инфекцией, например, если заболел кто-то из членов семьи, то рекомендуется в профилактических целях назначить ему — пока существует опасность заболеть — Арбидол (умифеновир).
— Получается, детям, как и взрослым, необходимо носить маски?
— Конечно. Разумеется, маска полностью не спасет от вирусов, но она позволит уменьшить количество, попавших в организм. Недавно было опубликовано очень интересное исследование: ученые отметили, что в этом году практически не было гриппа и в разы снизилось количество случаев острых респираторных заболеваний. Почему? Да просто потому, что мы соблюдали эти, казалось бы, примитивные меры профилактики.
— Дети – это достаточно общее понятие. Можно ли говорить о том, что дети какого-то возраста больше подвержены тяжелому течению заболевания или у них чаще наступают какие-то негативные последствия после COVID-19?
— Есть группы детей, которые действительно склонны к частым заболеваниям. Во-первых, это младенцы, так как они еще плохо защищены собственным иммунитетом. Во-вторых, дети, которые родились недоношенными. В-третьих, дети раннего возраста, лет до 3-4. Кроме того, в группе риска дети из социально неблагополучных семей, дети с хроническими заболеваниями: болезнями ЛОР-органов, сердца, почек, аллергики. Они более подвержены заболеваниям любыми респираторными инфекциями, в том числе и коронавирусом. Дети, ослабленные по какой-то другой причине: например, они только что перенесли тяжелое заболевание. Очевидно, если снижена иммунная защита, то вероятность заразиться выше. И, разумеется, риск выше, если они посещают какие-то детские коллективы.
Во-первых, это младенцы, так как они еще плохо защищены собственным иммунитетом. Во-вторых, дети, которые родились недоношенными. В-третьих, дети раннего возраста, лет до 3-4. Кроме того, в группе риска дети из социально неблагополучных семей, дети с хроническими заболеваниями: болезнями ЛОР-органов, сердца, почек, аллергики. Они более подвержены заболеваниям любыми респираторными инфекциями, в том числе и коронавирусом. Дети, ослабленные по какой-то другой причине: например, они только что перенесли тяжелое заболевание. Очевидно, если снижена иммунная защита, то вероятность заразиться выше. И, разумеется, риск выше, если они посещают какие-то детские коллективы.
— Каковы клинические рекомендации Минздрава относительно профилактики и лечения детей от коронавирусной инфекции нового типа?
— В отношении профилактики и лечение COVID-19 у Минздрава есть очень четкие рекомендации, которые во многом отражают международные гайдлайны. В Клинических рекомендациях от 8 февраля 2021 года указано, что ребенку с легким течением коронавирусной инфекцией COVID-19 необходимо назначить препараты интерферона альфа. Например, эндоназально Генферон лайт в виде капель или спрея. Более сильное, системное действие оказывают свечи. Поэтому, если ребенок заболел, то есть смысл не только вводить препараты интерферона в носовые ходы, но и сочетать с введением ректальных свечей. Это рекомендации для детей с легким течением заболевания. Если же у ребенка заболевание средней степени тяжести, то мы должны одновременно назначить препараты интерферона и как раз Арбидол.
Например, эндоназально Генферон лайт в виде капель или спрея. Более сильное, системное действие оказывают свечи. Поэтому, если ребенок заболел, то есть смысл не только вводить препараты интерферона в носовые ходы, но и сочетать с введением ректальных свечей. Это рекомендации для детей с легким течением заболевания. Если же у ребенка заболевание средней степени тяжести, то мы должны одновременно назначить препараты интерферона и как раз Арбидол.
— А с какого возраста можно применять эти препараты?
— Собственно Арбидол — с двух лет, а интерфероны — с рождения, можно даже недоношенным детям. До двух лет — только препараты интерферона альфа. Ну и тут, конечно нельзя забывать, что если нет признаков бактериальной инфекции, то антибиотики не назначаются.
— Расскажите, пожалуйста, а насколько рекомендации Минздрава совпадают с подходами к лечению, принятыми в других странах? Например, тот же Арбидол используется только в России, или и в других странах мира тоже?
— Вообще он широко используется и в других странах. Например, в Китае, Иране. Китайцы провели широкомасштабные исследования по эффективности и безопасности умифеновира при COVID-19, и теперь сами производят умифеновир. Понятно, что препарат с успехом применяют в странах постсоветского пространства. Кроме того, очень интересное исследование провели ученые из США: они изучили in vitro антивирусную активность против коронавируса у 48 препаратов, в том числе и у умифеновира. Этот тест показал высокую эффективность умифеновира.
Например, в Китае, Иране. Китайцы провели широкомасштабные исследования по эффективности и безопасности умифеновира при COVID-19, и теперь сами производят умифеновир. Понятно, что препарат с успехом применяют в странах постсоветского пространства. Кроме того, очень интересное исследование провели ученые из США: они изучили in vitro антивирусную активность против коронавируса у 48 препаратов, в том числе и у умифеновира. Этот тест показал высокую эффективность умифеновира.
— Давайте мы попробуем подвести некий результирующий итог этой беседы. Что мы можем посоветовать родителям для профилактики заражения их детей COVID-19, и что делать, если ребенок все же заболел?
— Есть один важный нюанс, о котором необходимо упомянуть: лечение вируса надо начинать рано, при первых признаках заболевания. Если человек болеет уже несколько дней, то прием противовирусных препаратов менее эффективен. Согласно рекомендациям ВОЗ, противовирусная терапия должна начинаться в первые 48 часов с момента появления симптомов заболевания. Дело в том, что противовирусные препараты не уничтожают вирусы, они прекращают их размножение. Поэтому, при первых признаках респираторного заболевания нужно применять интерферон альфа и Арбидол, они продаются без рецепта. И желательно создать максимальную изоляцию больного от других членов семьи. И обязательно вызвать врача, чтобы спланировать дальнейшее лечение.
Дело в том, что противовирусные препараты не уничтожают вирусы, они прекращают их размножение. Поэтому, при первых признаках респираторного заболевания нужно применять интерферон альфа и Арбидол, они продаются без рецепта. И желательно создать максимальную изоляцию больного от других членов семьи. И обязательно вызвать врача, чтобы спланировать дальнейшее лечение.
Врачи назвали особенности лечения коронавируса у детей :: Общество :: РБК
Она объяснила, что минимизировать контакты ребенка с другими людьми нужно не из-за риска заражения. Дело в том, что от присутствия незнакомых людей груднички испытывают стресс, который негативно сказывается на их иммунитете.
С тем, что коронавирусная инфекция довольно легко протекает у детей, согласился врач-инфекционист, педиатр и главный врач медицинского центра «Лидер-Медицина» Евгений Тимаков.
Читайте на РБК Pro
Врач допустила проблемы с фертильностью у переболевших в детстве COVID«У детей коронавирусная инфекция протекает легче, чем у взрослых, маскируется под ОРВИ. У детей реже бывают осложнения, пневмония, им реже требуется госпитализация. При этом последствия инфекции неизвестны: коронавирус может влиять и на нервную, и на эндокринную, и на репродуктивную систему», — рассказал он.
У детей реже бывают осложнения, пневмония, им реже требуется госпитализация. При этом последствия инфекции неизвестны: коронавирус может влиять и на нервную, и на эндокринную, и на репродуктивную систему», — рассказал он.
Специалист объяснил, что никто из его пациентов не был в тяжелом состоянии. У детей отмечались повышенная температура, заложенность носа, боль в горле и кашель. В связи с этим для них существуют отдельные протоколы лечения. «Они обычно обходятся без антибиотиков и препаратов, разжижающих кровь», — заявил педиатр.
Как и Добрецова, Тимаков уверен, что COVID-19 у грудных детей встречается крайне редко. «У них болезнь протекает в еще более легкой форме: просто температура и небольшой кашель», — сообщил врач.
Вирусологи оценили гипотезу о детях — разносчиках COVIDПо словам инфекциониста, педиатра и профессора кафедры педиатрии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского Елены Мескиной, дети и взрослые получают одинаковые препараты при COVID-19, за исключением лекарств, предназначенных для лечения тяжелых форм, например противомалярийных препаратов или фавипиравира.
М.Ф. Владимирского Елены Мескиной, дети и взрослые получают одинаковые препараты при COVID-19, за исключением лекарств, предназначенных для лечения тяжелых форм, например противомалярийных препаратов или фавипиравира.
«С одной стороны, это обусловлено возрастными ограничениями приема этих препаратов, с другой — дети легче переносят заболевание. А вот умифеновир и препараты интерферона дети получают», — рассказала она.
Если у детей после заболевания появляются осложнения, чаще всего они вызваны не самим вирусом, а последствиями приема препаратов. «Так как этот вирус поражает сосуды, после СOVID-инфекции у детей может появиться тревожность, депрессия, усталость», — объяснила Мескина.
Эпидемиолог назвал неподтвержденной версию о детях — разносчиках COVID-19Серьезные последствия, такие как мультисистемный воспалительный синдром (воспалительный процесс, поражающий одновременно несколько систем организма), у детей также встречаются крайне редко. «Это избыточная иммунная реакция, которую провоцирует COVID. При нем у детей могут поражаться практически все органы. В Московской области было девять таких случаев», — сообщила профессор.
«Это избыточная иммунная реакция, которую провоцирует COVID. При нем у детей могут поражаться практически все органы. В Московской области было девять таких случаев», — сообщила профессор.
Кроме того, несмотря на наличие вируса, вероятность заразиться от ребенка COVID-19 крайне мала, особенно если он носит маску.
«Если, например, семья приехала из-за границы, им нужно сдать анализы и у ребенка нет никаких симптомов, то даже если он является носителем вируса, вероятность передать вирус другому в очереди минимальна, если он будет в маске», — рассказала Мескина.
Попова назвала долю бессимптомных носителей коронавирусаПри этом вероятность, что вирус будет передаваться между детьми, еще меньше. «От ребенка ребенку вирус передается в значительно меньшей степени. Ребенку нужна более высокая вирусная нагрузка, чтобы заразиться. А выделение вируса от другого ребенка меньше. Если дети находятся в масках и соблюдают дистанцию, то они не заразятся», — добавил Тимаков.
«От ребенка ребенку вирус передается в значительно меньшей степени. Ребенку нужна более высокая вирусная нагрузка, чтобы заразиться. А выделение вируса от другого ребенка меньше. Если дети находятся в масках и соблюдают дистанцию, то они не заразятся», — добавил Тимаков.
В сентябре глава Роспотребнадзора Анна Попова заявляла, что дети школьного возраста практически не болеют коронавирусом. По ее словам, на тот момент носителями инфекции были около 2% детей, но никто из них не болел.
Позднее профессор кафедры вирусологии биофака МГУ Алексей Аграновский предположил, что дети становятся бессимптомными разносчиками инфекции из-за отсутствия некоторых рецепторов. В связи с этим он рекомендовал изолировать младших членов семьи от пожилых родственников, для которых COVID-19 является действительно опасным заболеванием.
«Самому маленькому — пять дней».
 Врач — об опасности COVID-19 у детей
Врач — об опасности COVID-19 у детейhttps://ria.ru/20210812/kovid19-1745322377.html
«Самому маленькому — пять дней». Врач — об опасности COVID-19 у детей
«Самому маленькому — пять дней». Врач — об опасности COVID-19 у детей — РИА Новости, 12.08.2021
«Самому маленькому — пять дней». Врач — об опасности COVID-19 у детей
По данным Роспотребнадзора, восемь-десять процентов заболевших COVID-19 — дети. Большинство переносит легко, тем не менее детские ковидные отделения заполнены… РИА Новости, 12.08.2021
2021-08-12T08:00
2021-08-12T08:00
2021-08-12T11:44
наука
москва
здоровье
биология
коронавирус covid-19
коронавирус в россии
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e5/08/0b/1745323063_0:0:559:314_1920x0_80_0_0_f9960e08ccd6af4ac47a75e48e58adba.jpg
МОСКВА, 13 авг — РИА Новости. По данным Роспотребнадзора, восемь-десять процентов заболевших COVID-19 — дети. Большинство переносит легко, тем не менее детские ковидные отделения заполнены. О том, как распознать эту инфекцию у малышей и школьников, о тяжелых осложнениях и лечении рассказал врач-педиатр клинического госпиталя Лапино «Мать и дитя» Антон Равдин. Беседовала Татьяна Пичугина.— Антон Александрович, в последние месяцы мы слышим, что пациенты с COVID-19 значительно помолодели, болеют дети. Это связывают с более агрессивным дельта-штаммом. Вы видите эту тенденцию? Насколько чаще встречается тяжелая форма у детей, есть ли смертельные случаи?— Начну с того, что дети от ковида практически всегда выздоравливают. Единичные трагические случаи по России связаны с очень тяжелыми сопутствующими патологиями. Но обращаться за помощью стали в разы чаще. Это заметно даже по таким косвенным признакам, как отказы от плановых госпитализаций — дети в регионах болеют ковидом и не могут приехать в Москву. Участковые педиатры тоже отмечают большой наплыв пациентов, в том числе тех, кому требуется лечение в стационаре.
Большинство переносит легко, тем не менее детские ковидные отделения заполнены. О том, как распознать эту инфекцию у малышей и школьников, о тяжелых осложнениях и лечении рассказал врач-педиатр клинического госпиталя Лапино «Мать и дитя» Антон Равдин. Беседовала Татьяна Пичугина.— Антон Александрович, в последние месяцы мы слышим, что пациенты с COVID-19 значительно помолодели, болеют дети. Это связывают с более агрессивным дельта-штаммом. Вы видите эту тенденцию? Насколько чаще встречается тяжелая форма у детей, есть ли смертельные случаи?— Начну с того, что дети от ковида практически всегда выздоравливают. Единичные трагические случаи по России связаны с очень тяжелыми сопутствующими патологиями. Но обращаться за помощью стали в разы чаще. Это заметно даже по таким косвенным признакам, как отказы от плановых госпитализаций — дети в регионах болеют ковидом и не могут приехать в Москву. Участковые педиатры тоже отмечают большой наплыв пациентов, в том числе тех, кому требуется лечение в стационаре. Дело в том, что дельта-штамм вызывает заболевание при меньшей вирусной нагрузке, чем уханьский вариант коронавируса. Дельта заразна, как ветряная оспа, считавшаяся до сих пор одной из самых контагиозных вирусных инфекций. Во время нынешнего подъема заболеваемости в Москве заполнились все стационары, где лечат COVID-19, включая детские. Сейчас число госпитализаций идет на спад. К счастью, в силу физиологических особенностей подавляющее число детей болеет легко.— Каков минимальный возраст ваших пациентов?— Самому маленькому — пять дней от роду. В стационаре он провел около десяти дней, поражение легких дошло до 50 процентов. Теперь он полностью здоров. Про отдаленные последствия говорить пока рано, прошло всего пару месяцев.— Он родился у мамы, больной ковидом?— Да.— Какие симптомы ковида у младенцев? Есть ли какие-то особые признаки, по которым можно распознать начало заболевания?— Многие считают, что дети не болеют ковидом или переносят его как ОРВИ, но это не всегда так. Действительно, у детей первого года жизни чаще всего стертое течение.
Дело в том, что дельта-штамм вызывает заболевание при меньшей вирусной нагрузке, чем уханьский вариант коронавируса. Дельта заразна, как ветряная оспа, считавшаяся до сих пор одной из самых контагиозных вирусных инфекций. Во время нынешнего подъема заболеваемости в Москве заполнились все стационары, где лечат COVID-19, включая детские. Сейчас число госпитализаций идет на спад. К счастью, в силу физиологических особенностей подавляющее число детей болеет легко.— Каков минимальный возраст ваших пациентов?— Самому маленькому — пять дней от роду. В стационаре он провел около десяти дней, поражение легких дошло до 50 процентов. Теперь он полностью здоров. Про отдаленные последствия говорить пока рано, прошло всего пару месяцев.— Он родился у мамы, больной ковидом?— Да.— Какие симптомы ковида у младенцев? Есть ли какие-то особые признаки, по которым можно распознать начало заболевания?— Многие считают, что дети не болеют ковидом или переносят его как ОРВИ, но это не всегда так. Действительно, у детей первого года жизни чаще всего стертое течение.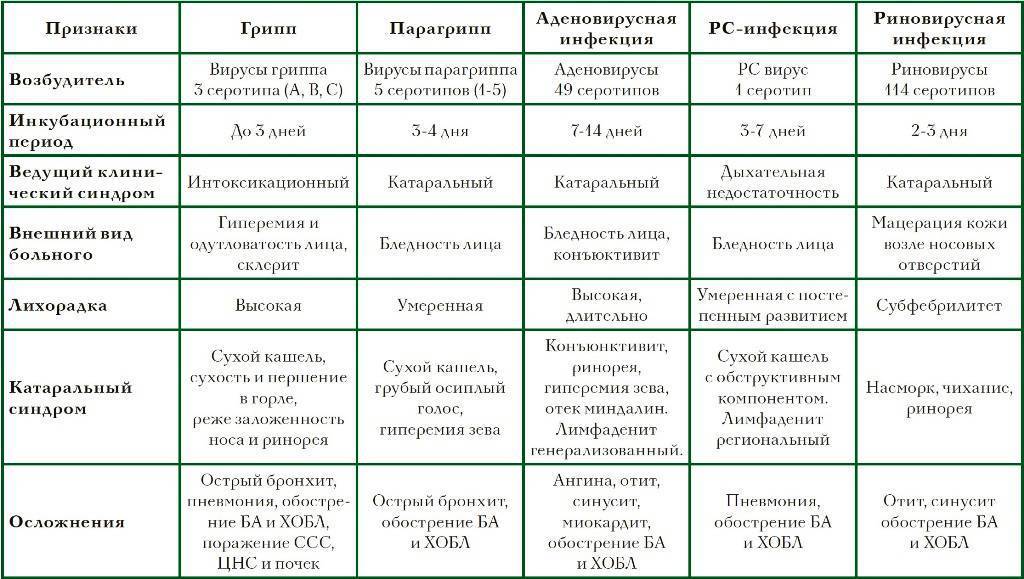 Ни кашля, ни насморка, ни других характерных признаков простуды. Они просто становятся вялыми, хуже едят, больше спят, капризничают. При этом часто поднимается температура до 38, ее трудно сбить, она скачет. Младенец может заразиться только от членов семьи. Поэтому температура при условии, что в семье уже есть ковид, служит поводом для обращения к врачу.— У взрослых часто пропадает обоняние. А у маленьких детей?— Это характерно для подростков, которые вообще нередко болеют как взрослые. Они могут переносить легко с невысокой температурой в течение трех-четырех дней, сопровождаемой, например, повышенной утомляемостью, мышечной болью. Потом несколько дней восстанавливаются и здоровые возвращаются в коллектив. А бывает иначе: 13-14-летние дети болеют тяжело с массивным поражением легких, сильной интоксикацией, длительной стойкой лихорадкой.Нет какого-то одного конкретного признака COVID-19 у всех детей. Нужно бить тревогу, если у ребенка пропал аппетит, появились слабость, светобоязнь, головная боль, стойкая температура.
Ни кашля, ни насморка, ни других характерных признаков простуды. Они просто становятся вялыми, хуже едят, больше спят, капризничают. При этом часто поднимается температура до 38, ее трудно сбить, она скачет. Младенец может заразиться только от членов семьи. Поэтому температура при условии, что в семье уже есть ковид, служит поводом для обращения к врачу.— У взрослых часто пропадает обоняние. А у маленьких детей?— Это характерно для подростков, которые вообще нередко болеют как взрослые. Они могут переносить легко с невысокой температурой в течение трех-четырех дней, сопровождаемой, например, повышенной утомляемостью, мышечной болью. Потом несколько дней восстанавливаются и здоровые возвращаются в коллектив. А бывает иначе: 13-14-летние дети болеют тяжело с массивным поражением легких, сильной интоксикацией, длительной стойкой лихорадкой.Нет какого-то одного конкретного признака COVID-19 у всех детей. Нужно бить тревогу, если у ребенка пропал аппетит, появились слабость, светобоязнь, головная боль, стойкая температура.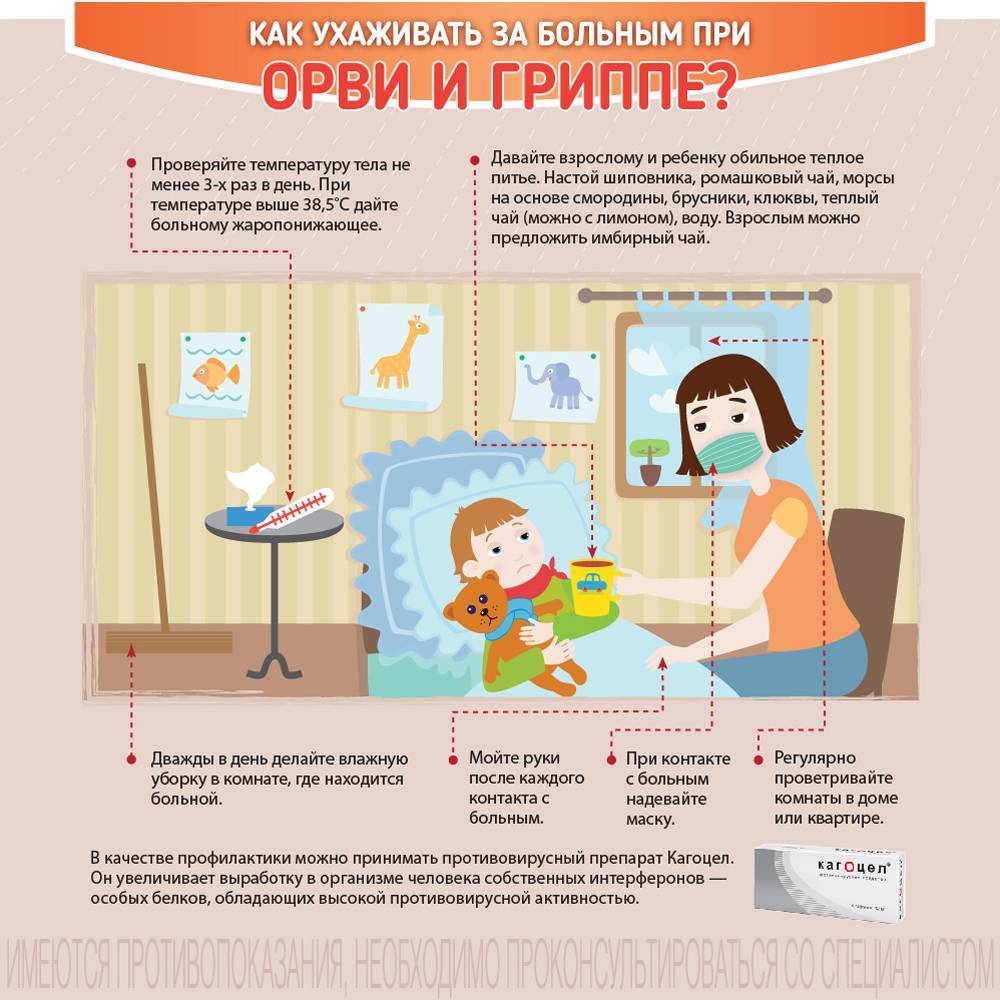 Врач решит, есть ли подозрения на ковид, необходима ли ранняя госпитализация, нужно ли дообследовать.— Диагностику проводят с помощью ПЦР-теста?— Конечно, ничего более точного пока не придумали. Антитела для ранней диагностики не пригодны, на их выработку нужно время. Недавно появились экспресс-тесты на антиген, для которых, как и для ПЦР, берут мазок из носа. Они чувствительны, но этого недостаточно для официального диагноза. В Москве, например, всех с симптомами ОРВИ сначала тестируют на антиген. Если результат положительный, делают ПЦР. Отрицательный — ребенка лечат от сезонной простуды.— А компьютерную томографию детям делают? С какого возраста? Что, если на КТ видно поражение легких, а ПЦР отрицательный?— КТ делают всем, включая новорожденных, противопоказаний по возрасту нет. Если у ребенка поднялась температура, ухудшилось общее самочувствие, в анамнезе — проживание с больными ковидом, на пятый день — кашель, мы отправляем на КТ. И если видим там десять процентов поражения легких в виде так называемых матовых стекол, при этом ПЦР отрицательный, диагноз: «COVID-19, вирус не идентифицирован».
Врач решит, есть ли подозрения на ковид, необходима ли ранняя госпитализация, нужно ли дообследовать.— Диагностику проводят с помощью ПЦР-теста?— Конечно, ничего более точного пока не придумали. Антитела для ранней диагностики не пригодны, на их выработку нужно время. Недавно появились экспресс-тесты на антиген, для которых, как и для ПЦР, берут мазок из носа. Они чувствительны, но этого недостаточно для официального диагноза. В Москве, например, всех с симптомами ОРВИ сначала тестируют на антиген. Если результат положительный, делают ПЦР. Отрицательный — ребенка лечат от сезонной простуды.— А компьютерную томографию детям делают? С какого возраста? Что, если на КТ видно поражение легких, а ПЦР отрицательный?— КТ делают всем, включая новорожденных, противопоказаний по возрасту нет. Если у ребенка поднялась температура, ухудшилось общее самочувствие, в анамнезе — проживание с больными ковидом, на пятый день — кашель, мы отправляем на КТ. И если видим там десять процентов поражения легких в виде так называемых матовых стекол, при этом ПЦР отрицательный, диагноз: «COVID-19, вирус не идентифицирован». Другой случай — у ребенка нет никакого анамнеза, болеет первые несколько дней, мазок отрицательный, но на КТ — матовые стекла. Скорее всего, его будут вести как больного ковидом, просто в силу того, что есть вероятность развития тяжелой формы. Если вирусная пневмония — другой природы, то опаснее, чем при ковиде, не будет.Самый тяжелый пациент, который был в Лапино, — с КТ-2-3. Это 50-процентное поражение легких.— Как отличаются протоколы лечения в зависимости от возраста детей?— На амбулаторном этапе протоколы похожи. Как правило, это интерфероны в назальной, ректальной форме, обильное питье, снижение температуры. При средней тяжести добавляют антибактериальную терапию и проводят дополнительные исследования, которые помогают понять картину болезни и дать прогноз. В остальном детей, болеющих легко или даже в стертой форме, лечат одинаково, а различия в протоколах определяются возрастными ограничениями применения лекарств и индивидуальными особенностями организма. Так, например, детям первых лет жизни спреи запрещены, им назначают капли.
Другой случай — у ребенка нет никакого анамнеза, болеет первые несколько дней, мазок отрицательный, но на КТ — матовые стекла. Скорее всего, его будут вести как больного ковидом, просто в силу того, что есть вероятность развития тяжелой формы. Если вирусная пневмония — другой природы, то опаснее, чем при ковиде, не будет.Самый тяжелый пациент, который был в Лапино, — с КТ-2-3. Это 50-процентное поражение легких.— Как отличаются протоколы лечения в зависимости от возраста детей?— На амбулаторном этапе протоколы похожи. Как правило, это интерфероны в назальной, ректальной форме, обильное питье, снижение температуры. При средней тяжести добавляют антибактериальную терапию и проводят дополнительные исследования, которые помогают понять картину болезни и дать прогноз. В остальном детей, болеющих легко или даже в стертой форме, лечат одинаково, а различия в протоколах определяются возрастными ограничениями применения лекарств и индивидуальными особенностями организма. Так, например, детям первых лет жизни спреи запрещены, им назначают капли. Чаще всего ребенок потемпературил два дня — и все, внешне он здоров. Но есть нюанс. Дети могут длительно выделять вирус. Даже при стертом течении ПЦР порой остается положительным до двух недель. Поэтому нужен 14-дневный карантин.— Расскажите о мультисистемном Кавасаки-подобном синдроме у детей. Многие его опасаются.— Это аутоиммунный системный васкулит — заболевание, вызванное иммунной системой, приводит к воспалению мелких кровеносных сосудов. По механизму возникновения и течению похож на синдром Кавасаки, только без воспаления сосудов, которые питают мышечную стенку сердца — миокард. Обычно развивается через две-восемь недель после выздоровления от COVID-19. Недомогание, быстрая утомляемость, температура, кожная сыпь — в течение четырех-пяти дней эта симптоматика нарастает. При синдроме Кавасаки все происходит медленнее.Нужно внимательно следить за переболевшим ребенком, обращать внимание на его состояние. Если недомогает, а на следующий день поднялась температура — срочно к врачу. Он решит, стоит ли исследовать кровь на воспалительные изменения.
Чаще всего ребенок потемпературил два дня — и все, внешне он здоров. Но есть нюанс. Дети могут длительно выделять вирус. Даже при стертом течении ПЦР порой остается положительным до двух недель. Поэтому нужен 14-дневный карантин.— Расскажите о мультисистемном Кавасаки-подобном синдроме у детей. Многие его опасаются.— Это аутоиммунный системный васкулит — заболевание, вызванное иммунной системой, приводит к воспалению мелких кровеносных сосудов. По механизму возникновения и течению похож на синдром Кавасаки, только без воспаления сосудов, которые питают мышечную стенку сердца — миокард. Обычно развивается через две-восемь недель после выздоровления от COVID-19. Недомогание, быстрая утомляемость, температура, кожная сыпь — в течение четырех-пяти дней эта симптоматика нарастает. При синдроме Кавасаки все происходит медленнее.Нужно внимательно следить за переболевшим ребенком, обращать внимание на его состояние. Если недомогает, а на следующий день поднялась температура — срочно к врачу. Он решит, стоит ли исследовать кровь на воспалительные изменения. При мультисистемном синдроме нарастают все неспецифические изменения в крови — С-реактивный белок, интерлейкин, СОЭ, прокальцитонин. Как будто у ребенка менингит. При этом нет очага — воспаления почек, ангины, пневмонии. Виноват в этом исключительно ковид, при котором вырабатываются антитела, запускающие воспаление.У взрослых мультисистемный синдром не встречается, но у них из-за иммунного ответа другие проблемы — страдают разные системы организма, возникают нарушения, в частности свертываемости крови, неврологические, проблемы с внутренними органами, ослабление слуха или зрения.Мультисистемный синдром успешно лечат, он обратим. Ребенок находится в стационаре не менее двух недель. Самое сложное — диагностика. Когда сталкиваешься с чем-то, не укладывающимся в рамки распространенных болезней, отсутствием явного очага воспаления, думаешь сразу о мультисистемном синдроме и как минимум направляешь на госпитализацию. Уже в стационаре врачи в первую очередь будут исключать это постковидное осложнение.
При мультисистемном синдроме нарастают все неспецифические изменения в крови — С-реактивный белок, интерлейкин, СОЭ, прокальцитонин. Как будто у ребенка менингит. При этом нет очага — воспаления почек, ангины, пневмонии. Виноват в этом исключительно ковид, при котором вырабатываются антитела, запускающие воспаление.У взрослых мультисистемный синдром не встречается, но у них из-за иммунного ответа другие проблемы — страдают разные системы организма, возникают нарушения, в частности свертываемости крови, неврологические, проблемы с внутренними органами, ослабление слуха или зрения.Мультисистемный синдром успешно лечат, он обратим. Ребенок находится в стационаре не менее двух недель. Самое сложное — диагностика. Когда сталкиваешься с чем-то, не укладывающимся в рамки распространенных болезней, отсутствием явного очага воспаления, думаешь сразу о мультисистемном синдроме и как минимум направляешь на госпитализацию. Уже в стационаре врачи в первую очередь будут исключать это постковидное осложнение. — Нужна ли реабилитация детям, переболевшим ковидом? Существует ли постамбулаторный контроль?— Если ребенок после обширного поражения легких, то ему, конечно, нужен период восстановления, чтобы укрепить организм. Общефизические упражнения, медикаментозная терапия обменных процессов, физиотерапия. Перенесшие мультисистемный синдром находятся три месяца на амбулаторном наблюдении.Детям, переболевшим легко, в принципе это не нужно. Что касается отдаленных последствий, то мы наблюдаем наших первых пациентов в течение года и пока ничего особенного не замечаем. Я говорю это с осторожностью, конечно. Тех, кто у нас на амбулаторном учете с другими диагнозами и переболел, мы регулярно обследуем. Детей, лежавших в стационаре, мы периодически обзваниваем, спрашиваем, как дела.— Доступна ли вам общероссийская статистика по заболевшим COVID-19 детям? Есть ли московский или общероссийский детский ковидный штаб? Как происходит обмен опытом?— Доступна общая статистика по заболеваемости. Но, на мой взгляд, лучше опираться на статистику по госпитализации. Она показывает нарастание волны, степень нагрузки на систему здравоохранения, медицинский персонал. На нее можно опираться при прогнозировании. По моим данным, число обращений, госпитализаций детей, тяжелых случаев снизились в разы. Если в первую и вторую волну мы пролечили двух пациентов с мультисистемным синдромом, то за последние месяцы примерно двадцать.Мы тесно сотрудничаем с детской городской больницей имени З. А. Башляевой в Москве, первой принявшей детей с ковидом. Там есть кафедра педиатрии, выезжаем друг к другу на консультации.— Напоследок посоветуйте родителям, как укрепить иммунитет ребенка, чтобы он не заболел или, если заразится, перенес как можно легче.— Тяжесть заболевания не в последнюю очередь зависит от вирусной нагрузки. Чем больше вируса получил организм, тем хуже. Поэтому стоит воздержаться от посещения мест скопления людей — ТЦ, массовых мероприятий. Играет роль и генетическая предрасположенность, особенно это заметно по семьям, где все тяжело болеют, включая молодых, и это не зависит от того, закалялись ли они всю жизнь, принимали ли витамины, эхинацею и другие БАД.Общие рекомендации — обильное питье, регулярное проветривание квартиры, прогулки, рациональное закаливание. Идеально было бы меньше контактировать с потенциальными носителями инфекции, но для детей это нереально. Маски до пяти лет неэффективны и даже вредны в силу возрастных особенностей. Да и масочный режим, социальное дистанцирование во дворе, школе вряд ли удастся соблюдать.
— Нужна ли реабилитация детям, переболевшим ковидом? Существует ли постамбулаторный контроль?— Если ребенок после обширного поражения легких, то ему, конечно, нужен период восстановления, чтобы укрепить организм. Общефизические упражнения, медикаментозная терапия обменных процессов, физиотерапия. Перенесшие мультисистемный синдром находятся три месяца на амбулаторном наблюдении.Детям, переболевшим легко, в принципе это не нужно. Что касается отдаленных последствий, то мы наблюдаем наших первых пациентов в течение года и пока ничего особенного не замечаем. Я говорю это с осторожностью, конечно. Тех, кто у нас на амбулаторном учете с другими диагнозами и переболел, мы регулярно обследуем. Детей, лежавших в стационаре, мы периодически обзваниваем, спрашиваем, как дела.— Доступна ли вам общероссийская статистика по заболевшим COVID-19 детям? Есть ли московский или общероссийский детский ковидный штаб? Как происходит обмен опытом?— Доступна общая статистика по заболеваемости. Но, на мой взгляд, лучше опираться на статистику по госпитализации. Она показывает нарастание волны, степень нагрузки на систему здравоохранения, медицинский персонал. На нее можно опираться при прогнозировании. По моим данным, число обращений, госпитализаций детей, тяжелых случаев снизились в разы. Если в первую и вторую волну мы пролечили двух пациентов с мультисистемным синдромом, то за последние месяцы примерно двадцать.Мы тесно сотрудничаем с детской городской больницей имени З. А. Башляевой в Москве, первой принявшей детей с ковидом. Там есть кафедра педиатрии, выезжаем друг к другу на консультации.— Напоследок посоветуйте родителям, как укрепить иммунитет ребенка, чтобы он не заболел или, если заразится, перенес как можно легче.— Тяжесть заболевания не в последнюю очередь зависит от вирусной нагрузки. Чем больше вируса получил организм, тем хуже. Поэтому стоит воздержаться от посещения мест скопления людей — ТЦ, массовых мероприятий. Играет роль и генетическая предрасположенность, особенно это заметно по семьям, где все тяжело болеют, включая молодых, и это не зависит от того, закалялись ли они всю жизнь, принимали ли витамины, эхинацею и другие БАД.Общие рекомендации — обильное питье, регулярное проветривание квартиры, прогулки, рациональное закаливание. Идеально было бы меньше контактировать с потенциальными носителями инфекции, но для детей это нереально. Маски до пяти лет неэффективны и даже вредны в силу возрастных особенностей. Да и масочный режим, социальное дистанцирование во дворе, школе вряд ли удастся соблюдать.
https://ria.ru/20210731/koronavirus-1743723305.html
https://ria.ru/20210803/kovid-1743972604.html
https://ria.ru/20200519/1571642125.html
https://ria.ru/20210727/vaktsinatsiya-1742994136.html
москва
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e5/08/0b/1745323063_3:0:546:407_1920x0_80_0_0_dc52410546a6685beb5ddb9666771828.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
москва, здоровье, биология, коронавирус covid-19, коронавирус в россии
МОСКВА, 13 авг — РИА Новости. По данным Роспотребнадзора, восемь-десять процентов заболевших COVID-19 — дети. Большинство переносит легко, тем не менее детские ковидные отделения заполнены. О том, как распознать эту инфекцию у малышей и школьников, о тяжелых осложнениях и лечении рассказал врач-педиатр клинического госпиталя Лапино «Мать и дитя» Антон Равдин. Беседовала Татьяна Пичугина.— Антон Александрович, в последние месяцы мы слышим, что пациенты с COVID-19 значительно помолодели, болеют дети. Это связывают с более агрессивным дельта-штаммом. Вы видите эту тенденцию? Насколько чаще встречается тяжелая форма у детей, есть ли смертельные случаи?
— Начну с того, что дети от ковида практически всегда выздоравливают. Единичные трагические случаи по России связаны с очень тяжелыми сопутствующими патологиями. Но обращаться за помощью стали в разы чаще. Это заметно даже по таким косвенным признакам, как отказы от плановых госпитализаций — дети в регионах болеют ковидом и не могут приехать в Москву. Участковые педиатры тоже отмечают большой наплыв пациентов, в том числе тех, кому требуется лечение в стационаре.Дело в том, что дельта-штамм вызывает заболевание при меньшей вирусной нагрузке, чем уханьский вариант коронавируса. Дельта заразна, как ветряная оспа, считавшаяся до сих пор одной из самых контагиозных вирусных инфекций. Во время нынешнего подъема заболеваемости в Москве заполнились все стационары, где лечат COVID-19, включая детские. Сейчас число госпитализаций идет на спад. К счастью, в силу физиологических особенностей подавляющее число детей болеет легко.
— Каков минимальный возраст ваших пациентов?
— Самому маленькому — пять дней от роду. В стационаре он провел около десяти дней, поражение легких дошло до 50 процентов. Теперь он полностью здоров. Про отдаленные последствия говорить пока рано, прошло всего пару месяцев.
— Он родился у мамы, больной ковидом?
31 июля, 06:09Распространение коронавирусаВрач: дети стали значительно чаще болеть COVID-19— Какие симптомы ковида у младенцев? Есть ли какие-то особые признаки, по которым можно распознать начало заболевания?
— Многие считают, что дети не болеют ковидом или переносят его как ОРВИ, но это не всегда так. Действительно, у детей первого года жизни чаще всего стертое течение. Ни кашля, ни насморка, ни других характерных признаков простуды. Они просто становятся вялыми, хуже едят, больше спят, капризничают. При этом часто поднимается температура до 38, ее трудно сбить, она скачет. Младенец может заразиться только от членов семьи. Поэтому температура при условии, что в семье уже есть ковид, служит поводом для обращения к врачу.
— У взрослых часто пропадает обоняние. А у маленьких детей?
— Это характерно для подростков, которые вообще нередко болеют как взрослые. Они могут переносить легко с невысокой температурой в течение трех-четырех дней, сопровождаемой, например, повышенной утомляемостью, мышечной болью. Потом несколько дней восстанавливаются и здоровые возвращаются в коллектив. А бывает иначе: 13-14-летние дети болеют тяжело с массивным поражением легких, сильной интоксикацией, длительной стойкой лихорадкой.
Нет какого-то одного конкретного признака COVID-19 у всех детей. Нужно бить тревогу, если у ребенка пропал аппетит, появились слабость, светобоязнь, головная боль, стойкая температура. Врач решит, есть ли подозрения на ковид, необходима ли ранняя госпитализация, нужно ли дообследовать.
3 августа, 08:00НаукаКовид всемогущий. Куда пропали грипп и другие сезонные инфекции— Диагностику проводят с помощью ПЦР-теста?
— Конечно, ничего более точного пока не придумали. Антитела для ранней диагностики не пригодны, на их выработку нужно время. Недавно появились экспресс-тесты на антиген, для которых, как и для ПЦР, берут мазок из носа. Они чувствительны, но этого недостаточно для официального диагноза. В Москве, например, всех с симптомами ОРВИ сначала тестируют на антиген. Если результат положительный, делают ПЦР. Отрицательный — ребенка лечат от сезонной простуды.
— А компьютерную томографию детям делают? С какого возраста? Что, если на КТ видно поражение легких, а ПЦР отрицательный?
— КТ делают всем, включая новорожденных, противопоказаний по возрасту нет. Если у ребенка поднялась температура, ухудшилось общее самочувствие, в анамнезе — проживание с больными ковидом, на пятый день — кашель, мы отправляем на КТ. И если видим там десять процентов поражения легких в виде так называемых матовых стекол, при этом ПЦР отрицательный, диагноз: «COVID-19, вирус не идентифицирован».
Другой случай — у ребенка нет никакого анамнеза, болеет первые несколько дней, мазок отрицательный, но на КТ — матовые стекла. Скорее всего, его будут вести как больного ковидом, просто в силу того, что есть вероятность развития тяжелой формы. Если вирусная пневмония — другой природы, то опаснее, чем при ковиде, не будет.
Самый тяжелый пациент, который был в Лапино, — с КТ-2-3. Это 50-процентное поражение легких.
— Как отличаются протоколы лечения в зависимости от возраста детей?
— На амбулаторном этапе протоколы похожи. Как правило, это интерфероны в назальной, ректальной форме, обильное питье, снижение температуры. При средней тяжести добавляют антибактериальную терапию и проводят дополнительные исследования, которые помогают понять картину болезни и дать прогноз. В остальном детей, болеющих легко или даже в стертой форме, лечат одинаково, а различия в протоколах определяются возрастными ограничениями применения лекарств и индивидуальными особенностями организма. Так, например, детям первых лет жизни спреи запрещены, им назначают капли.
Чаще всего ребенок потемпературил два дня — и все, внешне он здоров. Но есть нюанс. Дети могут длительно выделять вирус. Даже при стертом течении ПЦР порой остается положительным до двух недель. Поэтому нужен 14-дневный карантин.
1 из 4
Новорожденный ребенок в акушерском отделении для беременных с коронавирусом в роддоме № 1 в Краснодаре
2 из 4
Медик с юным пациентом ГБУЗ «ДГКБ им. З. А. Башляевой», где проходят лечение дети с коронавирусной инфекцией COVID-19
© РИА Новости / Илья ПиталевВрачи с пациентом в кабинете компьютерной томографии Национального медицинского исследовательского центра здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
3 из 4
Врачи с пациентом в кабинете компьютерной томографии Национального медицинского исследовательского центра здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
© РИА Новости / Илья ПиталевНМИЦ здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
4 из 4
НМИЦ здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
1 из 4
Новорожденный ребенок в акушерском отделении для беременных с коронавирусом в роддоме № 1 в Краснодаре
2 из 4
Медик с юным пациентом ГБУЗ «ДГКБ им. З. А. Башляевой», где проходят лечение дети с коронавирусной инфекцией COVID-19
3 из 4
Врачи с пациентом в кабинете компьютерной томографии Национального медицинского исследовательского центра здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
4 из 4
НМИЦ здоровья детей Министерства здравоохранения России, где проходят лечение дети с коронавирусной инфекцией COVID-19
— Расскажите о мультисистемном Кавасаки-подобном синдроме у детей. Многие его опасаются.
— Это аутоиммунный системный васкулит — заболевание, вызванное иммунной системой, приводит к воспалению мелких кровеносных сосудов. По механизму возникновения и течению похож на синдром Кавасаки, только без воспаления сосудов, которые питают мышечную стенку сердца — миокард. Обычно развивается через две-восемь недель после выздоровления от COVID-19. Недомогание, быстрая утомляемость, температура, кожная сыпь — в течение четырех-пяти дней эта симптоматика нарастает. При синдроме Кавасаки все происходит медленнее.
Нужно внимательно следить за переболевшим ребенком, обращать внимание на его состояние. Если недомогает, а на следующий день поднялась температура — срочно к врачу. Он решит, стоит ли исследовать кровь на воспалительные изменения. При мультисистемном синдроме нарастают все неспецифические изменения в крови — С-реактивный белок, интерлейкин, СОЭ, прокальцитонин. Как будто у ребенка менингит. При этом нет очага — воспаления почек, ангины, пневмонии. Виноват в этом исключительно ковид, при котором вырабатываются антитела, запускающие воспаление.
У взрослых мультисистемный синдром не встречается, но у них из-за иммунного ответа другие проблемы — страдают разные системы организма, возникают нарушения, в частности свертываемости крови, неврологические, проблемы с внутренними органами, ослабление слуха или зрения.
Мультисистемный синдром успешно лечат, он обратим. Ребенок находится в стационаре не менее двух недель. Самое сложное — диагностика. Когда сталкиваешься с чем-то, не укладывающимся в рамки распространенных болезней, отсутствием явного очага воспаления, думаешь сразу о мультисистемном синдроме и как минимум направляешь на госпитализацию. Уже в стационаре врачи в первую очередь будут исключать это постковидное осложнение.
19 мая 2020, 08:00НаукаУ детей обнаружили редкий воспалительный синдром. Причина в коронавирусе?— Нужна ли реабилитация детям, переболевшим ковидом? Существует ли постамбулаторный контроль?
— Если ребенок после обширного поражения легких, то ему, конечно, нужен период восстановления, чтобы укрепить организм. Общефизические упражнения, медикаментозная терапия обменных процессов, физиотерапия. Перенесшие мультисистемный синдром находятся три месяца на амбулаторном наблюдении.
Детям, переболевшим легко, в принципе это не нужно. Что касается отдаленных последствий, то мы наблюдаем наших первых пациентов в течение года и пока ничего особенного не замечаем. Я говорю это с осторожностью, конечно. Тех, кто у нас на амбулаторном учете с другими диагнозами и переболел, мы регулярно обследуем. Детей, лежавших в стационаре, мы периодически обзваниваем, спрашиваем, как дела.
— Доступна ли вам общероссийская статистика по заболевшим COVID-19 детям? Есть ли московский или общероссийский детский ковидный штаб? Как происходит обмен опытом?
— Доступна общая статистика по заболеваемости. Но, на мой взгляд, лучше опираться на статистику по госпитализации. Она показывает нарастание волны, степень нагрузки на систему здравоохранения, медицинский персонал. На нее можно опираться при прогнозировании. По моим данным, число обращений, госпитализаций детей, тяжелых случаев снизились в разы. Если в первую и вторую волну мы пролечили двух пациентов с мультисистемным синдромом, то за последние месяцы примерно двадцать.
Мы тесно сотрудничаем с детской городской больницей имени З. А. Башляевой в Москве, первой принявшей детей с ковидом. Там есть кафедра педиатрии, выезжаем друг к другу на консультации.
— Напоследок посоветуйте родителям, как укрепить иммунитет ребенка, чтобы он не заболел или, если заразится, перенес как можно легче.
— Тяжесть заболевания не в последнюю очередь зависит от вирусной нагрузки. Чем больше вируса получил организм, тем хуже. Поэтому стоит воздержаться от посещения мест скопления людей — ТЦ, массовых мероприятий. Играет роль и генетическая предрасположенность, особенно это заметно по семьям, где все тяжело болеют, включая молодых, и это не зависит от того, закалялись ли они всю жизнь, принимали ли витамины, эхинацею и другие БАД.
Общие рекомендации — обильное питье, регулярное проветривание квартиры, прогулки, рациональное закаливание. Идеально было бы меньше контактировать с потенциальными носителями инфекции, но для детей это нереально. Маски до пяти лет неэффективны и даже вредны в силу возрастных особенностей. Да и масочный режим, социальное дистанцирование во дворе, школе вряд ли удастся соблюдать.
27 июля, 08:00Наука»Спутник V». В России снова испытывают вакцину от коронавирусаЛечим ОРВИ: распространенные ошибки родителей
Когда дети болеют ОРВИ, а с такой напастью сталкиваются в каждой семье, родители нередко становятся «домашними педиатрами», распознающими симптомы простуды и знающими схемы лечения. Однако, сами того не подозревая, многие мамы и бабушки совершают одни и те же ошибки, которые затягивают процесс болезни, мешая быстрому выздоровлению.
Ошибка № 1: отказ от свежего воздуха
Мы привыкли автоматически закрывать окна и форточки в доме, как только у ребенка появляются первые признаки простуды. Само собой, переохлаждаться заболевшему малышу нельзя. Но длительное нахождение в непроветриваемом помещении, особенно если включено центральное отопление, может нанести не меньший вред. Вредоносные микроорганизмы и вирусы прекрасно чувствуют себя в сухой и теплой среде. Поэтому родителям следует чаще проветривать комнаты, чистый холодный воздух снижает концентрацию и активность вирусов. Ребенка же в момент проветривания просто уводите в другое помещение, а возвращайтесь, когда свежий воздух успеет прогреться.
Ошибка № 2: принудительное кормление
Снижение аппетита — абсолютно нормальная реакция организма на болезнь. Это связано с тем, что его силы направлены на борьбу с инфекцией, а переваривание пищи может создать дополнительную нагрузку. К тому же, простуженный ребенок мало двигается и, соответственно, тратит меньше энергии. Отнеситесь с пониманием к нежеланию малыша полноценно обедать и ужинать. Уменьшите порции и сделайте меню легким на время лечения и восстановления.
Ошибка № 3: строгий постельный режим
Если ребенок серьезно заболел и страдает от жара и слабости, вам наверняка не придется долго укладывать его в постель. Но если у малыша нет высокой температуры, а чувствует он себя относительно бодро, нет смысла заставлять его проводить весь день в кровати. Наоборот, умеренная физическая активность помогает ребенку отвлечься от болезни. Тогда как необходимость полного покоя нагнетает обстановку.
Ошибка № 4: попытки сбить температуру
Не секрет, что повышенная температура тела свидетельствует о борьбе организма с вирусом. Жаропонижающие средства рекомендуется принимать, когда температура поднимается до опасного уровня, то есть выше 38,5°. Но до этой отметки прием препаратов чаще всего, не требуется.
Ошибка № 5: укутывание ребенка с температурой
Мы хорошо усвоили бабушкин урок о том, что при высокой температуре надо «пропотеть». Поэтому многие из нас укутывают ребенка на ночь в теплую одежду и несколько одеял. Но на самом деле, малыша во время жара нельзя перегревать, поскольку это нарушает процессы терморегуляции и ухудшает ситуацию. На ребенка не стоит надевать много одежды, и вся она должна быть свободной, из натуральных тканей.
Ошибка № 6: самовольный выбор антибиотиков
Некоторые родители привыкли «прописывать» ребенку антибиотики при первых же признаках ОРВИ. Этого делать категорически нельзя. Антибактериальные препараты должен назначать только лечащий врач. Иначе антибиотики могут нанести ущерб детскому организму, ослабив его за счет уничтожения естественной микрофлоры кишечника. Кроме того, самостоятельное принятие антибиотиков нередко изменяет симптомы протекающей болезни, что впоследствии только осложняет постановку диагноза и затрудняет лечение.
Врач-педиатр ОКДЦ Анна Погорелова
Профилактика гриппа и ОРВИ у детей
Острые респираторные вирусные инфекции — наиболее частые заболевания у детей и иметь представление о них для родителей очень важно. При этих заболеваниях поражаются органы дыхания, поэтому они и называются респираторными. Виновниками острых респираторных вирусных инфекций могут стать более трехсот разновидностей вирусов и бактерий. Наиболее часто причиной заболеваний являются вирусы гриппа, парагриппа, аденовирусы, риновирусы, респираторно-синцитиальные вирусы. Наиболее часто «простудные» заболевания отмечаются у детей со сниженным или ослабленным иммунитетом, а также у имеющих многочисленные контакты в детских дошкольных учреждениях и школах. Маленький ребенок легко может заболеть при встрече с возбудителем, к которому у него нет иммунитета.
Источником инфекции являются больные и носители вируса. Передается заболевание воздушно-капельным путем, однако заразиться можно и через предметы и вещи, находившиеся в пользовании больного, например через полотенца и носовые платки. Восприимчивость к инфекции высока и зависит от состояния иммунитета человека. Возможно и повторное заболевание, что особенно часто отмечается у ослабленных детей. Продолжительность болезни зависит от тяжести заболевания, типа вируса, наличия или отсутствия осложнений.
Признаки заболевания обусловлены интоксикацией и катаральными явлениями. Интоксикация организма различна: от легкого недомогания и невысокой температуры до значительных нарушений общего состояния при гриппе с сильной головной болью, лихорадкой, рвотой, бредом, помрачением сознания, болями в мышцах и суставах, судорогами. Для гриппа характерны также носовые кровотечения. Катаральный синдром проявляется в виде насморка, заложенности носа и кашля. Кашель обычно отмечается с первых дней болезни, вначале сухой и частый, затем влажный с выделением мокроты. Болезнь поражает практически все органы дыхания. При воспалении гортани на фоне хриплого голоса и грубого «лающего кашля» может развиться стеноз, который проявляется внезапным затруднением дыхания, резкой бледностью или появлением синеватого оттенка кожи. Такое состояние ребенка требует принятия срочных мер, при этом необходимо вызвать «Скорую помощь». У ослабленных и часто болеющих детей возможно развитие воспаления легких. Родители должны знать признаки, позволяющие заподозрить пневмонию у ребенка. Температура выше 38 градусов более трех дней, кряхтящее дыхание, учащенное дыхание, втяжение податливых мест грудной клетки при вдохе, посинение губ и кожи, полный отказ от еды, беспокойство или сонливость — это признаки, требующие повторного вызова врача.
Вирусные заболевания могут сопровождаться бактериальными осложнениями, и тогда картина болезни усложняется. Бактериальные инфекции могут проявляться как боль в ухе, гноетечение из уха или из глаз, отек и покраснение кожи щеки или вокруг глаз, увеличение и болезненность лимфоузлов, боль при глотании.
Общие принципы лечения ОРВИ
— Режим больного должен соответствовать его состоянию — постельный в тяжелых случаях, полупостельный при улучшении состояния и обычный — через один-два дня после падения температуры. Температура в комнате должна быть 20-21ºС, а во время сна — ниже; частое проветривание облегчает дыхание, уменьшает насморк.
— Питание не требует особой коррекции. Если ребенок не ест, не надо настаивать — при улучшении состояния аппетит восстановится.
— Питьевой режим имеет немаловажное значение. Больной теряет много жидкости с потом, при дыхании, поэтому он должен много пить: чай, морсы, овощные отвары. Растворы для приема внутрь, продающиеся в аптеках, лучше давать пополам с чаем, соком, кипяченой водой.
— Лекарственные препараты должен назначить врач. Какие медикаменты нужны ребенку — решает врач в зависимости от состояния организма. Выбор и назначение лекарств зависят также от признаков и тяжести заболевания.
— Повторный вызов врача необходим в следующих ситуациях: сохранение температуры выше 38°С в течение двух-трех дней после начала лечения, усиление беспокойства или чрезмерной сонливости, появление рвоты и нарушения сознания, появление признаков стеноза гортани или пневмонии.
Неспецифическая профилактика ОРВИ
Правильная организация режима дня ребенка, не требующая материальных затрат, но требующая максимального внимания и времени родителей, — это основа здоровья растущего организма. Достаточное и разнообразное питание обеспечит потребность в витаминах и микроэлементах. Важно оздоровить воздушную среду в доме — часто проветривать комнаты, спать с открытым окном. Среди общеукрепляющих мер наиболее эффективнозакаливание. Оно позволяет, если и не полностью избежать «простуд», то снизить вероятность заболевания ребенка. Хорошо закаливает охлаждение подошв ног, кожи шеи, поясницы, однако для получения равномерного эффекта лучше всего воздействовать на все тело. Максимальная длительность холодового воздействия на ребенка не должна превышать десяти-двадцати минут, гораздо важнее его повторность и постепенность. Начинать закаливание надо с первых недель жизни — это воздушные ванны во время пеленания, гимнастика перед купанием, купание, растирание полотенцем после купания. Уже с первого месяца жизни следует приучать ребенка к прогулкам на воздухе, постепенно доводя их продолжительность до трех-четырех часов в день. Летом надо разрешать ребенку бегать босиком. Хорошо закаливает купание в открытом водоеме, посещение бани или сауны. Опасными для ребенка считаются такие виды закаливания, как «моржевание», хождение босиком по снегу, обливание холодной водой, при этом ребенок охлаждается намного быстрее взрослого и заболевает. Закаливание после нетяжелой острой респираторной инфекции можно начать через десять-четырнадцать дней, а в случае заболевания с длительной температурной реакцией — через четыре-пять недель после выздоровления.
Специфическая профилактика ОРВИ
Об угрозе гриппа знает каждый, предотвратить заболевание гриппом, особенно ребенка — первоочередная забота, как родителей, так и педиатров.
В настоящее время в России зарегистрированы и разрешены к применению различные препараты живых и инактивированных гриппозных вакцин. Для детей рекомендуется применять инактивированные вакцины, которые представляют собой высокоочищенные иммунизирующие антигены вирусов гриппа типов А и Б. Вакцины нового поколения содержат лишь убитые, разрушенные вирусы гриппа, в результате специальной обработки удалены частицы вируса, вызывающие побочные реакции, и сохранены главные компоненты, которые обеспечивают длительную защиту от разных вариантов вируса гриппа. Это позволило существенно уменьшить частоту нежелательных реакций при сохранении высокой эффективности вакцинации. Вакцины нового поколения разрешено применять как у взрослых, так и у детей. Из наиболее известных противогриппозных вакцин следует отметить вакцины Гриппол (Россия), Инфлювак (Германия), Флюарикс (Бельгия). Эти вакцины можно применять у детей начиная с шести месячного возраста. Вакцины подтвердили свою высокую результативность и отличную переносимость. Это особенно важно для детей с хроническими заболеваниями органов дыхания, сердечно-сосудистой системы, патологией центральной нервной системы. Эти дети тяжело болеют гриппом, их обязательно нужно прививать.
Городская детская больница №3
Сугутская Галина Дмитриевна, заведующая дошкольно-школьным отделением
Лечение ОРВИ у детей в Киеве
Простуда — самая частая причина недуга ребенка и обращения к педиатрам. Простуда может быть вызвана сотнями вирусов, вызывающих аналогичные симптомы; поэтому при обращении с ним пациенты ставят диагноз «Острая респираторная вирусная инфекция» — острая респираторная вирусная инфекция.
СИМПТОМЫ ОРВИ
Группа ОРВИ включает более двух сотен различных вирусов, которые проявляются практически одинаковыми симптомами:
- насморк, чихание;
- кашель;
- боль в горле, его покраснение;
- озноб, боли в суставах, мышцах;
- головная боль, слабость, вялость;
- увеличение лимфатических узлов;
- повышенная температура;
- жжение и боль в глазах.
Комплекс симптомов и их выраженность могут как-то различаться в зависимости от того, какая инфекция поразила ребенка (аденовирус, ревовирус, риновирус и др.), И от состояния его иммунитета.
ПРИЧИНЫ ОРВИ
Единственная причина развития болезни — заражение одним из вирусов, входящих в широкую группу ОРВИ, от уже инфицированного ребенка или взрослого. Вирус выделяется при кашле или чихании и передается через поцелуи, совместное пользование посудой и средствами личной гигиены, находясь в комнате с больным человеком.
Заболевание имеет ярко выраженный сезонный характер, поражая детей преимущественно в осенне-зимний период. Ребенок очень часто заболевает, начиная ходить в детский сад или школу, где тесно контактирует с другими детьми, в том числе с инфицированными.
Возможны ситуации, когда ребенок, только что переживший простуду, снова заражается. Это связано с тем, что у ребенка, перенесшего ОРВИ, вырабатывается кратковременный иммунитет, но только против конкретного вируса, а не всей группы ОРВИ.Рецидивирующее заболевание может быть вызвано другим вирусом, но схожесть симптомов не позволяет его определить.
ДИАГНОСТИКА И ЛЕЧЕНИЕ ОРВИ
В большинстве случаев организм самостоятельно справляется с ОРВИ за 5-7 дней. В этом случае задача педиатра — назначить лечение, которое уменьшит неприятные симптомы и проконтролировать, чтобы не возникли осложнения.
Дополнительная диагностика, определяющая, какой именно вирус поразила организм ребенка, обычно не проводится.Это связано с тем, что организм быстро нейтрализует вирус самостоятельно, без применения антивирусной терапии. К тому же анализы и обследования занимают какое-то время (до нескольких дней), а когда анализы готовы, организм уже справляется с инфекцией.
Только в том случае, если болезнь протекает тяжело и длительно, а ребенок регулярно болеет, целесообразно проведение дополнительных обследований.
Симптоматическое лечение, назначенное врачом, может включать жаропонижающие и противовоспалительные препараты, препараты для облегчения боли в горле, ингаляции, кварцевые тубусы и т. Д.
Самолечение ОРВИ без помощи педиатра не рекомендуется, так как родители не всегда распознают ранние признаки возможных осложнений.
Записаться на прием к педиатру можно, позвонив нам или заполнив форму обратной связи на нашем сайте.
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ОРИ) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Однако соотношение легкой и тяжелой формы заболевания варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть ИПП у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может в некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей тяжело уносят жизни, особенно там, где медицинская помощь недоступна или к ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5% всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой LRI у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был наиболее важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванных Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда выявляют патоген, который является причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae, и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат ссылается на конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются редкими этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две функции, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще признаются важной причиной инфекционных заболеваний кишечника у детей и, возможно, второй по значимости причиной госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с сокращением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования, проведенные в Финляндии, показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Дуглас и Майлз, 1984; Леманн и другие, 1991; Райли и другие, 1981; Райли, Леманн и Альперс, 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами. вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. Три исследования оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5–37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению пневмококкового отита, подтвержденного посевом, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Эскола и др., 2001; Килпи и др., 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991 г.) используются два ключевых клинических признака: частота дыхания , , чтобы отличить детей с пневмонией от детей без, и , втягивание нижней грудной клетки, , для выявления тяжелой пневмонии, требующей направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывала относительно низкая чувствительность этого подхода, при котором могло быть пропущено от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание между ребрами, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей неустойчиво. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования предполагали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что внутримышечный сукцинат хлорамфеникола с большей вероятностью вызывает побочные эффекты, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, изучающим альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из этих препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, при его достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. дефицитный. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
-
Нетяжелая пневмония до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
-
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и терапия пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы объединяем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизированные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения пациентов, которые различаются по тяжести инфекции и точке лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
-
нетяжелая пневмония, которую лечит местный медработник
-
нетяжелая пневмония, лечение в медицинском учреждении
-
тяжелая пневмония, лечение в больнице
-
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения случаев и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности должно быть проведено три контрольных визита, а не два раза в день в течение 10 дней, рекомендованных в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны во всех регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (в печати), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, в котором целая когорта новорожденных до четырехлетнего возраста избежала ранней детской смертности от клинической пневмонии из-за вмешательства и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от числа пролеченных лиц, и не учитывались постоянные затраты на запуск программы, где их в настоящее время не существует.
представляет конкретные региональные ССВ для четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем дохода лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне стационара было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение работником здравоохранения по месту жительства, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, в то время как другие рекомендуют использовать вакцину только в избранных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватят почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате действия всех этих факторов фактический спрос на вакцину оставался низким даже при наличии поддержки через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ по стратегии ведения случаев ОРИ включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что ежегодно от пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей с меньшей вероятностью получат антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа по ведению пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную общинную программу по уходу за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
-
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 округов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была опробована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, которые были установлены консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела здоровья детей и подростков ВОЗ (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, все страны, которые сталкиваются с высоким бременем Hib-инфекции, должны создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе основал инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продукции и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
-
Повышение специфичности клинических диагностических критериев.
-
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
-
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
-
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
-
- Тяжелая пневмония: В рандомизированном клиническом исследовании в контролируемой среде, Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
-
Проанализировать данные об исключениях из исследования.
-
Определите предикторы, которые могут помочь отличить детей, которые нуждаются в госпитализации и у которых впоследствии ухудшается состояние.
-
Пересмотреть рекомендуемые ВОЗ критерии неэффективности лечения тяжелой пневмонии с учетом общих высоких показателей неудач терапии.
-
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев с втягиванием нижней грудной стенки.
-
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
-
- LRI смертей:
-
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и передовые лабораторные методы.
-
- Кислородная терапия:
-
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
-
Соберите базовую информацию о наличии и доставке кислорода, а также его использовании в больницах в странах с низким уровнем дохода.
-
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
-
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
-
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
-
Изучить влияние широкого применения ко-тримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
-
-
Этиология: данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применять и оценивать эту стратегию будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документирования их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами, связанными с обращением за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем доходов одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
-
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отитис в педиатрии развивающихся стран 961, часть 1126–31. [PubMed: 7596700]
-
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность в младенчестве конъюгата олигосахаридов Haemophilus influenzae вакцины типа B в популяции Соединенных Штатов: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-1 инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7
- 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990. 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, проведенное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Duke T, Mgone J., Frank D. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. С., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у тяжелобольных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae .Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Хемент Дж. М., Аэртс П. К., Флир А., Ван Дейк Х., Хармсен Т., Кимпен Дж. Л., Вольфс Т.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed: 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Jiang Z., Nagata N., Molina E., Bakaletz L.O., Hawkins H., Patel J. A. Опосредованное фимбрией усиленное прикрепление нетипируемого Haemophilus influenzae , не являющегося типом, к инфицированным респираторным синцитиальным вирусом респираторным эпителиальным клеткам. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
-
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Vaccation and World Health: Fourth Annual Public Health Forum of the London School of Hygiene and Tropical Medicine , ed.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропических регионах Южной Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
-
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернхэм Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Madhi SA, Petersen K., Madhi A., Khoosal M., Klugman KP Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающих тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе. Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Воздействие вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
-
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Mulholland K., Hilton S., Adegbola R., Usen S., Oparaugo A., Omosigho C. et al. Рандомизированное исследование Haemophilus influenzae конъюгированной вакцины против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed: 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12
- 8]
- Оньянго Ф. Э., Стейнхофф М. С., Вафула Э. М., Вариуа С., Мусия Дж., Китони Дж. Гипоксемия у кенийских детей раннего возраста с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на базе местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
-
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
-
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
-
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из полисахарида Haemophilus influenzae типа B и Neisseria meningitidis наружно-мембранного белкового комплекса у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 16]
- Сазавал С., Блэк Р. Э. Группа испытаний по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
-
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шэнн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шенн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии выбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999; 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96
- ]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
-
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочной пункции: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О.С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, недавно принявших на вооружение . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
-
Венгер, Дж. Д. и М. М. Левин, ред. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
-
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
-
———. 2003. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезии и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
-
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
-
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118 ]
-
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997 гг. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106
]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ARI) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Однако соотношение легкой и тяжелой формы заболевания варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть ИПП у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может в некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей тяжело уносят жизни, особенно там, где медицинская помощь недоступна или к ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5% всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой LRI у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был наиболее важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванных Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда выявляют патоген, который является причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae, и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат ссылается на конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются редкими этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две функции, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще признаются важной причиной инфекционных заболеваний кишечника у детей и, возможно, второй по значимости причиной госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с сокращением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования, проведенные в Финляндии, показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Дуглас и Майлз, 1984; Леманн и другие, 1991; Райли и другие, 1981; Райли, Леманн и Альперс, 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами. вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. Три исследования оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5–37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению пневмококкового отита, подтвержденного посевом, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Эскола и др., 2001; Килпи и др., 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991 г.) используются два ключевых клинических признака: частота дыхания , , чтобы отличить детей с пневмонией от детей без, и , втягивание нижней грудной клетки, , для выявления тяжелой пневмонии, требующей направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывала относительно низкая чувствительность этого подхода, при котором могло быть пропущено от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание между ребрами, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей неустойчиво. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования предполагали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что внутримышечный сукцинат хлорамфеникола с большей вероятностью вызывает побочные эффекты, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, изучающим альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из этих препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, при его достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. дефицитный. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
-
Нетяжелая пневмония до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
-
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и терапия пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы объединяем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизированные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения пациентов, которые различаются по тяжести инфекции и точке лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
-
нетяжелая пневмония, которую лечит местный медработник
-
нетяжелая пневмония, лечение в медицинском учреждении
-
тяжелая пневмония, лечение в больнице
-
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения случаев и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности должно быть проведено три контрольных визита, а не два раза в день в течение 10 дней, рекомендованных в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны во всех регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (в печати), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, в котором целая когорта новорожденных до четырехлетнего возраста избежала ранней детской смертности от клинической пневмонии из-за вмешательства и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от числа пролеченных лиц, и не учитывались постоянные затраты на запуск программы, где их в настоящее время не существует.
представляет конкретные региональные ССВ для четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем дохода лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне стационара было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение работником здравоохранения по месту жительства, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, в то время как другие рекомендуют использовать вакцину только в избранных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватят почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате действия всех этих факторов фактический спрос на вакцину оставался низким даже при наличии поддержки через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ по стратегии ведения случаев ОРИ включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что ежегодно от пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей с меньшей вероятностью получат антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа по ведению пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную общинную программу по уходу за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
-
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 округов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была опробована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, которые были установлены консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела здоровья детей и подростков ВОЗ (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, все страны, которые сталкиваются с высоким бременем Hib-инфекции, должны создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе основал инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продукции и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
-
Повышение специфичности клинических диагностических критериев.
-
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
-
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
-
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
-
- Тяжелая пневмония: В рандомизированном клиническом исследовании в контролируемой среде, Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
-
Проанализировать данные об исключениях из исследования.
-
Определите предикторы, которые могут помочь отличить детей, которые нуждаются в госпитализации и у которых впоследствии ухудшается состояние.
-
Пересмотреть рекомендуемые ВОЗ критерии неэффективности лечения тяжелой пневмонии с учетом общих высоких показателей неудач терапии.
-
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев с втягиванием нижней грудной стенки.
-
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
-
- LRI смертей:
-
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и передовые лабораторные методы.
-
- Кислородная терапия:
-
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
-
Соберите базовую информацию о наличии и доставке кислорода, а также его использовании в больницах в странах с низким уровнем дохода.
-
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
-
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
-
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
-
Изучить влияние широкого применения ко-тримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
-
-
Этиология: данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применять и оценивать эту стратегию будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документирования их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами, связанными с обращением за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем доходов одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
-
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отитис в педиатрии развивающихся стран 961, часть 1126–31. [PubMed: 7596700]
-
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность в младенчестве конъюгата олигосахаридов Haemophilus influenzae вакцины типа B в популяции Соединенных Штатов: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-1 инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7
- 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990. 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, проведенное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Duke T, Mgone J., Frank D. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. С., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у тяжелобольных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae .Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Хемент Дж. М., Аэртс П. К., Флир А., Ван Дейк Х., Хармсен Т., Кимпен Дж. Л., Вольфс Т.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed: 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Jiang Z., Nagata N., Molina E., Bakaletz L.O., Hawkins H., Patel J. A. Опосредованное фимбрией усиленное прикрепление нетипируемого Haemophilus influenzae , не являющегося типом, к инфицированным респираторным синцитиальным вирусом респираторным эпителиальным клеткам. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
-
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Vaccation and World Health: Fourth Annual Public Health Forum of the London School of Hygiene and Tropical Medicine , ed.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропических регионах Южной Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
-
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернхэм Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Madhi SA, Petersen K., Madhi A., Khoosal M., Klugman KP Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающих тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе. Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Воздействие вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
-
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Mulholland K., Hilton S., Adegbola R., Usen S., Oparaugo A., Omosigho C. et al. Рандомизированное исследование Haemophilus influenzae конъюгированной вакцины против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed: 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12
- 8]
- Оньянго Ф. Э., Стейнхофф М. С., Вафула Э. М., Вариуа С., Мусия Дж., Китони Дж. Гипоксемия у кенийских детей раннего возраста с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на базе местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
-
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
-
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
-
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из полисахарида Haemophilus influenzae типа B и Neisseria meningitidis наружно-мембранного белкового комплекса у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 16]
- Сазавал С., Блэк Р. Э. Группа испытаний по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
-
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шэнн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шенн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии выбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999; 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96
- ]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
-
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочной пункции: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О.С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, недавно принявших на вооружение . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
-
Венгер, Дж. Д. и М. М. Левин, ред. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
-
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
-
———. 2003. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезии и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
-
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
-
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118 ]
-
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997 гг. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106
]
Острые респираторные инфекции у детей — приоритеты борьбы с заболеваниями в развивающихся странах
Острые респираторные инфекции (ARI) классифицируются как инфекции верхних дыхательных путей (URI) или инфекции нижних дыхательных путей (LRIs).Верхние дыхательные пути состоят из дыхательных путей от ноздрей до голосовых связок в гортани, включая придаточные пазухи носа и среднее ухо. Нижние дыхательные пути покрывают продолжение дыхательных путей от трахеи и бронхов к бронхиолам и альвеолам. ОРИ не ограничиваются дыхательными путями и имеют системные эффекты из-за возможного распространения инфекции или микробных токсинов, воспаления и снижения функции легких. Дифтерия, коклюш (коклюш) и корь — это болезни, которые можно предотвратить с помощью вакцин, которые могут иметь компонент дыхательных путей, но также влияют на другие системы; они обсуждаются в главе 20.
За исключением неонатального периода, ОРИ являются наиболее частой причиной как болезней, так и смертности у детей в возрасте до пяти лет, у которых в среднем от трех до шести эпизодов ОРИ ежегодно, независимо от того, где они живут или каково их экономическое положение (Kamath and others 1969; Монто и Ульман 1974). Однако соотношение легкой и тяжелой формы заболевания варьируется между странами с высоким и низким уровнем доходов, и из-за различий в конкретной этиологии и факторах риска тяжесть ИПП у детей в возрасте до пяти лет хуже в развивающихся странах, что приводит к более высокому уровню заболеваемости. летальность.Хотя медицинская помощь может в некоторой степени снизить как тяжесть заболевания, так и летальный исход, многие тяжелые формы LRI не поддаются лечению, в основном из-за отсутствия высокоэффективных противовирусных препаратов. Ежегодно умирает около 10,8 миллиона детей (Black, Morris, and Bryce, 2003). По оценкам, в 2000 году 1,9 миллиона из них умерли от ОРИ, 70 процентов из них — в Африке и Юго-Восточной Азии (Williams and others 2002). По оценкам Всемирной организации здравоохранения (ВОЗ), 2 миллиона детей в возрасте до пяти лет умирают от пневмонии ежегодно (Bryce and others 2005).
Причины ОРИ и бремя болезней
ОРИ у детей тяжело уносят жизни, особенно там, где медицинская помощь недоступна или к ней не обращаются.
Инфекции верхних дыхательных путей
URI являются наиболее распространенными инфекционными заболеваниями. К ним относятся ринит (простуда), синусит, инфекции уха, острый фарингит или тонзиллофарингит, эпиглоттит и ларингит, из которых инфекции уха и фарингит вызывают более серьезные осложнения (глухота и острая ревматическая лихорадка соответственно).Подавляющее большинство URI имеют вирусную этиологию. Риновирусы составляют от 25 до 30 процентов URI; респираторно-синцитиальные вирусы (РСВ), вирусы парагриппа и гриппа, метапневмовирус человека и аденовирусы — от 25 до 35 процентов; вирусы короны на 10 процентов; и неопознанные вирусы для остальных (Denny 1995). Поскольку большинство URI являются самоограничивающимися, их осложнения более важны, чем инфекции. Острые вирусные инфекции предрасполагают детей к бактериальным инфекциям носовых пазух и среднего уха (Berman 1995a), а аспирация инфицированных секретов и клеток может привести к LRIs.
Острый фарингит
Острый фарингит у детей младшего возраста более чем в 70% случаев вызывается вирусами. Типичны легкое покраснение глотки, отек и увеличение миндалин. Стрептококковая инфекция редко встречается у детей до пяти лет и более часто встречается у детей старшего возраста. В странах с многолюдными условиями жизни и группами населения, которые могут иметь генетическую предрасположенность, постстрептококковые последствия, такие как острый ревматизм и кардит, распространены у детей школьного возраста, но могут также возникать у детей младше пяти лет.Острый фарингит в сочетании с развитием перепонки в горле почти всегда вызывается в развивающихся странах Corynebacterium diphtheriae . Однако при почти повсеместной вакцинации младенцев вакциной АКДС (дифтерия-столбняк-коклюш) дифтерия встречается редко.
Острая ушная инфекция
Острая ушная инфекция встречается у 30 процентов URI. В развивающихся странах с неадекватной медицинской помощью это может привести к перфорации барабанных перепонок и хроническим выделениям из уха в более позднем детстве и, в конечном итоге, к ухудшению слуха или глухоте (Berman 1995b).Хроническая ушная инфекция после повторных эпизодов острой ушной инфекции распространена в развивающихся странах, поражая от 2 до 6 процентов детей школьного возраста. Связанная с этим потеря слуха может приводить к инвалидности и влиять на обучение. Повторные ушные инфекции могут привести к мастоидиту, который, в свою очередь, может распространить инфекцию на мозговые оболочки. Мастоидит и другие осложнения, вызванные ОРВИ, являются причиной почти 5% всех смертей от ОРИ во всем мире (Williams и др., 2002).
Инфекции нижних дыхательных путей
Распространенными инфекциями нижних дыхательных путей у детей являются пневмония и бронхиолит.Частота дыхания является ценным клиническим признаком для диагностики острой LRI у кашляющих и учащенно дышащих детей. Наличие втягивания нижней грудной стенки указывает на более тяжелое заболевание (Mulholland и др., 1992; Shann, Hart, and Thomas 1984).
В настоящее время наиболее частыми причинами вирусных LRIs являются RSV. Они, как правило, очень сезонные, в отличие от вирусов парагриппа, следующей наиболее частой причины вирусных LRI. Эпидемиология вирусов гриппа у детей в развивающихся странах заслуживает срочного исследования, поскольку доступны безопасные и эффективные вакцины.До эффективного использования противокоревой вакцины вирус кори был наиболее важной вирусной причиной заболеваемости и смертности детей, связанных с респираторными путями, в развивающихся странах.
Пневмония
И бактерии, и вирусы могут вызывать пневмонию. Бактериальная пневмония часто вызывается Streptococcus pneumoniae (пневмококк) или Haemophilus influenzae, в основном типом b (Hib) и иногда Staphylococcus aureus или другими стрептококками.Всего от 8 до 12 из множества типов пневмококка вызывают большинство случаев бактериальной пневмонии, хотя конкретные типы могут различаться у взрослых и детей и в разных географических регионах. Другие патогены, такие как Mycoplasma pneumoniae и Chlamydia pneumoniae, , вызывают атипичные пневмонии. Их роль как причины тяжелых заболеваний у детей до пяти лет в развивающихся странах неясна.
Бремя LRIs, вызванных Hib или S. pneumoniae , трудно определить, поскольку современные методы установления бактериальной этиологии не обладают чувствительностью и специфичностью.Результаты посева из глотки не всегда выявляют патоген, который является причиной LRI. Бактериальные культуры образцов аспирата легких часто считаются золотым стандартом, но они не подходят для применения в полевых условиях. Обзор нескольких исследований Вуори-Холопайнен и Пелтола (2001) показывает, что на S. pneumoniae, и Hib приходится от 13 до 34 процентов и от 1,4 до 42,0 процентов бактериальных пневмоний, соответственно, тогда как исследования Адегбола и др. (1994), Шэнн, Граттен и другие (1984) и Уолл и другие (1986) предполагают, что Hib составляет от 5 до 11 процентов случаев пневмонии.
Пониженные уровни клинической или радиологической пневмонии при клинических испытаниях девятивалентной пневмококковой конъюгированной вакцины дают оценку бремени болезней, предупреждаемых с помощью вакцины ( валентность указывает количество серотипов, от которых вакцина обеспечивает защиту; конъюгат ссылается на конъюгации полисахаридов с белковым остовом). В исследовании, проведенном в Гамбии, было предотвращено 37 процентов радиологической пневмонии, что отражает количество заболеваний, вызванных S.pneumoniae, , а смертность снизилась на 16 процентов (Cutts and others 2005).
Колонизация верхних дыхательных путей потенциально патогенными организмами и аспирация зараженных секретов участвуют в патогенезе бактериальной пневмонии у детей младшего возраста. Было показано, что инфицирование верхних дыхательных путей вирусом гриппа или RSV увеличивает связывание как H. influenzae (Jiang и др., 1999), так и S. pneumoniae (Hament and others 2004; McCullers and Bartmess 2003) с подкладкой. клетки носоглотки.Это открытие может объяснить, почему рост пневмококковой пневмонии идет параллельно с эпидемиями гриппа и RSV. Исследование, проведенное в Южной Африке, показало, что вакцинация девятивалентной пневмококковой конъюгированной вакциной снижает заболеваемость вирус-ассоциированной пневмонией, вызывающей госпитализацию, на 31 процент, что свидетельствует о том, что пневмококк играет важную роль в патогенезе вирус-ассоциированной пневмонии (Madhi, Petersen, Мадхи, Васас и др. 2000).
Попадание бактерий из кишечника с распространением через кровоток в легкие также было предложено для патогенеза грамотрицательных организмов (Fiddian-Green and Baker 1991), но такие бактерии являются редкими этиологическими агентами пневмонии у иммунокомпетентных дети.Однако у новорожденных и младенцев грудного возраста грамотрицательная пневмония не редкость (Quiambao готовится к печати).
Вирусы ответственны за от 40 до 50 процентов инфекций у младенцев и детей, госпитализированных по поводу пневмонии в развивающихся странах (Hortal and others 1990; John and others 1991; Tupasi and others 1990). Вирус кори, RSV, вирусы парагриппа, вирус гриппа типа A и аденовирусы являются наиболее важными причинами вирусной пневмонии. Рентгенологически сложно отличить вирусную пневмонию от бактериальной, отчасти потому, что поражения выглядят одинаково, а отчасти потому, что бактериальная суперинфекция возникает при гриппе, кори и инфекциях RSV (Ghafoor и др., 1990).
В развивающихся странах уровень летальности среди детей с вирусной пневмонией колеблется от 1,0 до 7,3 процента (John and others 1991; Stensballe, Devasundaram, and Simoes 2003), с бактериальной пневмонией от 10 до 14 процентов и со смешанной вирусной и вирусной пневмонией. бактериальные инфекции от 16 до 18 процентов (Ghafoor и др., 1990; Shann, 1986).
Бронхиолит
Бронхиолит возникает преимущественно в первый год жизни и с уменьшающейся частотой во второй и третий годы.Клинические признаки включают учащенное дыхание и втягивание нижней грудной стенки, лихорадку в одной трети случаев и хрипы (Cherian и др., 1990). Воспалительная обструкция мелких дыхательных путей, которая приводит к гиперинфляции легких и коллапсу сегментов легкого. Поскольку признаки и симптомы также характерны для пневмонии, работникам здравоохранения может быть сложно провести различие между бронхиолитом и пневмонией. Две функции, которые могут помочь, — это определение сезонности RSV в данной местности и умение обнаруживать хрипы.RSV являются основной причиной бронхиолита во всем мире и могут вызывать до 70 или 80 процентов LRI в высокий сезон (Simoes 1999; Stensballe, Devasundaram и Simoes 2003). Недавно обнаруженный метапневмовирус человека также вызывает бронхиолит (Van den Hoogen и др., 2001), который неотличим от болезни RSV. Другие вирусы, вызывающие бронхиолит, включают вирус парагриппа 3-го типа и вирусы гриппа.
Грипп
Несмотря на то, что вирусы гриппа обычно вызывают инфекционные заболевания дыхательных путей у взрослых, они все чаще признаются важной причиной инфекционных заболеваний кишечника у детей и, возможно, второй по значимости причиной госпитализации детей с ОРВ после RSV (Neuzil and others 2002). .Хотя грипп считается нечастым в развивающихся странах, его эпидемиология еще требует тщательного изучения. Потенциальное бремя гриппа как причина смерти детей неизвестно. Вирус гриппа типа A может вызывать сезонные вспышки, а тип B может вызывать спорадические инфекции. В последнее время вирус птичьего гриппа стал причиной инфекции, болезней и смерти небольшого числа людей, включая детей, в нескольких азиатских странах. Его потенциал для возникновения вспышек среди людей или пандемии неизвестен, но он может иметь разрушительные последствия для развивающихся стран (Peiris and others 2004) и может представлять угрозу для здоровья во всем мире.Новые штаммы вирусов типа А почти наверняка возникнут в результате мутации, как это произошло в случае пандемий в Азии и Гонконге в 1950-х и 1960-х годах.
ВИЧ-инфекция и педиатрические LRIs
Во всем мире 3,2 миллиона детей живут с ВИЧ / СПИДом, 85 процентов из них — в странах Африки к югу от Сахары (ЮНЭЙДС, 2002). В южной части Африки инфекционные заболевания, связанные с ВИЧ, составляют от 30 до 40 процентов случаев госпитализации детей и имеют показатель летальности от 15 до 34 процентов, что намного выше, чем 5-10 процентов для детей, не инфицированных ВИЧ (Bobat and others 1999; Мадхи, Петерсен, Мадхи, Хосал и другие, 2000; Натху и другие, 1993; Цви, Петтифиор и Содерлунд, 1999). Pneumocystis jiroveci и цитомегаловирус являются важными условно-патогенными инфекциями более чем у 50 процентов ВИЧ-инфицированных младенцев (Jeena, Coovadia, and Chrystal 1996; Lucas and others 1996). Грамотрицательные бактерии также важны для более чем 70 процентов ВИЧ-инфицированных детей с недостаточным питанием (Ikeogu, Wolf, and Mathe, 1997). Исследования пациентов подтвердили частую ассоциацию этих бактерий, но добавили S. pneumoniae и S. aureus в качестве важных патогенов (Gilks 1993; Goel and others 1999).В первом южноафриканском отчете об общем бремени инвазивной пневмококковой инфекции сообщается о 41,7-кратном увеличении числа ВИЧ-инфицированных детей по сравнению с неинфицированными детьми (Фарли и др., 1994).
Вмешательства
Вмешательства по борьбе с ОРИ можно разделить на четыре основные категории: иммунизация против конкретных патогенов, ранняя диагностика и лечение заболеваний, улучшение питания и более безопасная среда (John 1994). Первые два относятся к сфере компетенции системы здравоохранения, тогда как последние два относятся к сфере общественного здравоохранения и требуют многосекторального участия.
Прививки
Широкое использование вакцин против кори, дифтерии, коклюша, Hib, пневмококка и гриппа может существенно снизить заболеваемость ОРИ у детей в развивающихся странах. Влияние вакцин против кори, дифтерии и коклюша обсуждается в главе 20. Ограниченные данные о гриппе в развивающихся странах не позволяют провести подробный анализ потенциальных преимуществ этой вакцины. Поэтому в этой главе основное внимание уделяется потенциальному воздействию вакцин против Hib и пневмококка на LRI.
Вакцина против Hib
В настоящее время доступны три конъюгированные вакцины против Hib для применения у младенцев и детей младшего возраста. Эффективность вакцины против Hib в предотвращении инвазивных заболеваний (в основном менингита, но также и пневмонии) была хорошо задокументирована в нескольких исследованиях, проведенных в промышленно развитых странах (Black and others 1992; Booy and others 1994; Eskola and others 1990; Fritzell and Plotkin 1992; Heath 1998; Lagos and others 1996; Santosham and others 1991) и в одном исследовании в Гамбии (Mulholland and others 1997).Все исследования показали защитную эффективность более 90% против лабораторно подтвержденных инвазивных заболеваний, независимо от выбора вакцины. Следовательно, все промышленно развитые страны включают вакцину против Hib в свои национальные программы иммунизации, что приводит к фактической ликвидации инвазивной болезни Hib из-за иммунитета у вакцинированных и эффекта стада у тех, кто не вакцинирован. Имеющиеся данные из нескольких развивающихся стран показывают аналогичный эффект стада (Адегбола и др., 1999; Венгер и др., 1999).
Первоначальное обещание и последующее общее мнение заключалось в том, что вакцина против Hib предназначена для защиты от менингита, но в развивающихся странах вакцина, вероятно, будет иметь больший эффект в предотвращении LRI. Эффект легко измерить при инвазивных заболеваниях, включая бактериемическую пневмонию. Вакцина, вероятно, оказывает влияние на небактериемическую пневмонию, но этот эффект трудно определить количественно из-за отсутствия адекватного метода установления бактериальной этиологии. В Бангладеш, Бразилии, Чили и Гамбии вакцина против Hib была связана с сокращением на 20-30 процентов числа госпитализированных с рентгенологически подтвержденной пневмонией (de Andrade and others 2004; Levine and others 1999; Mulholland and others 1997; WHO 2004a ).Однако результаты большого исследования в Ломбоке, Индонезия, не дали окончательных результатов в отношении влияния вакцины против Hib на пневмонию (Gessner and others 2005).
Пневмококковые вакцины
В настоящее время доступны два вида вакцин против пневмококков: 23-валентная полисахаридная вакцина (23-PSV), которая больше подходит для взрослых, чем для детей, и 7-валентная полисахаридная вакцина, конъюгированная с белком (7- PCV). 9-валентная вакцина (9-PCV) прошла клинические испытания в Гамбии и Южной Африке, а 11-валентная вакцина (11-PCV) проходит испытания на Филиппинах.
Исследования эффективности полисахаридной вакцины в профилактике ОРИ или ушных инфекций у детей в промышленно развитых странах показали противоречивые результаты. В то время как некоторые исследования этой вакцины не показывают значительной эффективности (Douglas and Miles 1984; Sloyer, Ploussard and Howie 1981), исследования, проведенные в Финляндии, показывают в целом защитный эффект против серотипов, содержащихся в 14-PSV (Douglas and Miles 1984; Karma and другие 1980; Макела и другие 1980). Эффективность была более выражена у детей старше двух лет, чем у детей младшего возраста.Единственные исследования, оценивающие действие полисахаридной вакцины на детей в развивающихся странах, — это серия из трех испытаний, проведенных в Папуа-Новой Гвинее (Дуглас и Майлз, 1984; Леманн и другие, 1991; Райли и другие, 1981; Райли, Леманн и Альперс, 1991). . Анализ объединенных данных этих испытаний показал снижение смертности от LRI на 59 процентов среди детей до пяти лет на момент вакцинации и на 50 процентов среди детей до двух лет. На основании этих и других исследований исследователи пришли к выводу, что вакцина оказывает влияние на тяжелую пневмонию.Более высокая, чем ожидалось, эффективность в этих испытаниях была приписана большему вкладу более иммуногенных серотипов взрослых в пневмонию в Папуа-Новой Гвинее (Douglas and Miles 1984; Riley, Lehmann, and Alpers 1991). Из-за низкой иммуногенности антигенов в 23-PSV против преобладающих детских серотипов внимание теперь направлено на более иммуногенные конъюгированные вакцины (Mulholland 1998; Obaro 1998; Temple 1991).
Эффективность 7-PCV и 9-PCV была оценена на предмет эффективности против инвазивного пневмококкового заболевания в четырех испытаниях, которые продемонстрировали эффективность вакцины от 71.От 0 до 97,4 процента (от 58 до 65 процентов для ВИЧ-положительных детей, среди которых заболеваемость пневмококком в 40 раз выше, чем среди ВИЧ-отрицательных детей) (Black and others 2000; Cutts and others 2005; Klugman and others 2003; O ‘ Брайен и другие 2003).
В США 7-PCV был включен в плановую вакцинацию младенцев и детей в возрасте до двух лет в 2000 году. К 2001 году заболеваемость всеми инвазивными пневмококковыми заболеваниями в этой возрастной группе снизилась на 69 процентов, а заболевания, вызываемые включенными серотипами. вакцины и родственных серотипов снизились на 78 процентов (Whitney and others 2003).Подобные сокращения были подтверждены в исследовании в северной Калифорнии (Black and others 2001). Наблюдалось небольшое увеличение частоты инвазивных заболеваний, вызванных серотипами пневмококков, не включенных в вакцину, но оно было недостаточно большим, чтобы компенсировать существенное снижение заболеваемости, вызванное вакциной. Исследования также обнаружили значительное снижение инвазивной пневмококковой инфекции в непривитых старших возрастных группах, особенно среди взрослых в возрасте от 20 до 39 лет и в возрасте 65 лет и старше, что позволяет предположить, что вакцинация маленьких детей оказала значительный эффект в обществе.Такое преимущество может иметь место даже там, где распространенность ВИЧ-инфекции среди взрослых высока, а пневмококковая инфекция может быть рецидивирующей и опасной для жизни.
Воздействие вакцины на пневмококковую пневмонию как таковое трудно определить из-за проблем, связанных с установлением бактериальной этиологии пневмонии. Три исследования оценивали влияние вакцины на рентгенологическую пневмонию (независимо от этиологического агента) и показали снижение на 20,5–37,0% случаев пневмонии, подтвержденной рентгенологически (9.0 процентов для ВИЧ-инфицированных) (Black and others 2000; Cutts and others 2005; Klugman and others 2003).
Несколько полевых испытаний оценили эффективность PCV против ушной инфекции. Несмотря на то, что вакцина привела к значительному сокращению пневмококкового отита, подтвержденного посевом, чистого снижения ушной инфекции среди вакцинированных детей не наблюдалось, вероятно, из-за увеличения частоты отита, вызванного видами пневмококков, не охваченных вакциной, ЧАС.influenzae и Moraxella catarrhalis (Эскола и др., 2001; Килпи и др., 2003). Однако испытание в северной Калифорнии показало, что вакцина обладает защитным действием против частых инфекций уха и снижает потребность в установке тимпаностомической трубки (Fireman and others 2003). Таким образом, вакцина от ушной инфекции может быть полезной в развивающихся странах с высокими показателями хронического отита и кондуктивной тугоухости, и ее следует оценивать с помощью клинических испытаний.
Самым заметным преимуществом вакцины для общественного здравоохранения в развивающихся странах будет очевидное снижение смертности.Хотя первичным результатом исследования в Гамбии изначально была детская смертность, она была изменена на радиологическую пневмонию. Тем не менее, испытание показало снижение смертности на 16 процентов (уровень достоверности 95 процентов, от 3 до 38). Это испытание проводилось в сельской местности на востоке Гамбии, где трудно обеспечить круглосуточную лечебную помощь, включая ведение больных. Это испытание демонстрирует, что иммунизация, проводимая в рамках аутрич-программ, принесет значительную пользу для здоровья и экономики таких групп населения.Еще одно исследование, оценивающее влияние 11-PCV на радиологическую пневмонию, продолжается на Филиппинах; результаты ожидаются во второй половине 2005 года.
Ведение пациентов
Упрощение и систематизация ведения пациентов для ранней диагностики и лечения ОРИ позволили значительно снизить смертность в развивающихся странах, где доступ к педиатрам ограничен. В клинических рекомендациях ВОЗ по ведению случаев ОРИ (ВОЗ, 1991 г.) используются два ключевых клинических признака: частота дыхания , , чтобы отличить детей с пневмонией от детей без, и , втягивание нижней грудной клетки, , для выявления тяжелой пневмонии, требующей направления и госпитализации.Детям со слышимым стридором в спокойном и спокойном состоянии или такими опасными признаками тяжелого заболевания, как неспособность есть, также требуется направление. Дети без этих признаков классифицируются как страдающие ОРИ, но не пневмонией. Детей, у которых наблюдается только учащенное дыхание, лечат пневмонию амбулаторно. Детей, которые кашляют более 30 дней, направляют для дальнейшего обследования на туберкулез и другие хронические инфекции.
Диагностика пневмонии на основе учащенного дыхания
Первоначальные рекомендации по выявлению пневмонии на основе учащенного дыхания были разработаны в Папуа-Новой Гвинее в 1970-х годах.В исследовании 200 последовательных педиатрических пациентов и 50 последовательных госпитализаций (Shann, Hart, and Thomas 1984) 72 процента детей со слышимым хрипом в легких имели частоту дыхания 50 или более вдохов в минуту, тогда как только 19 процентов детей без потрескивания дышал с такой стремительной скоростью. Поэтому в первоначальных рекомендациях ВОЗ использовался порог в 50 вдохов в минуту, при достижении которого кашель у ребенка считался пневмонией.
Основное беспокойство вызывала относительно низкая чувствительность этого подхода, при котором могло быть пропущено от 25 до 40 процентов случаев пневмонии.Исследование в Веллоре, Индия, показало, что чувствительность можно улучшить, снизив порог до 40 для детей в возрасте от 1 до 4 лет, сохранив порог в 50 вдохов в минуту для младенцев в возрасте от 2 до 11 месяцев (Cherian and others 1988). Последующие исследования показали, что при использовании этих пороговых значений чувствительность улучшилась с 62 до 79 процентов на Филиппинах и с 65 до 77 процентов в Свазиленде, но в то же время специфичность упала с 92 до 77 процентов на Филиппинах и с 92 до 80 процентов. процентов в Свазиленде (Mulholland и др., 1992).На основе этих и других данных (Кэмпбелл, Байасс и др., 1989; Колстад и др., 1997; Перкинс и др., 1997; Редд, 1994; Симоес и др., 1997; Вебер и др., 1997) ВОЗ рекомендует ограничить частоту дыхания на 50 вдохов. в минуту для детей в возрасте от 2 до 11 месяцев и 40 вдохов в минуту для детей в возрасте от 12 месяцев до 5 лет.
Учащенное дыхание, по определению ВОЗ, выявляет около 85 процентов детей с пневмонией, и более 80 процентов детей с потенциально смертельной пневмонией, вероятно, успешно выявляются и лечатся с использованием диагностических критериев ВОЗ.Было показано, что лечение детей с учащенным дыханием антибиотиками снижает смертность (Sazawal and Black 2003). Проблема низкой специфичности критерия учащенного дыхания заключается в том, что от 70 до 80 процентов детей, которые могут не нуждаться в антибиотиках, получат их. Тем не менее, для работников первичной медико-санитарной помощи, для которых важна простота диагностики, учащенное дыхание, несомненно, является наиболее полезным клиническим признаком.
Диагноз пневмонии на основании втягивания грудной стенки
Дети поступают в больницу с тяжелой пневмонией, когда медицинские работники считают, что необходимы кислородные или парентеральные антибиотики (антибиотики, вводимые не перорально), или когда они не уверены в способности матери справиться .Обоснование парентеральных антибиотиков состоит в том, чтобы достичь более высоких уровней антибиотиков и преодолеть опасения по поводу абсорбции пероральных препаратов у больных детей.
В исследовании Папуа-Новой Гвинеи (Shann, Hart, and Thomas 1984) втягивание грудной клетки использовалось в качестве основного показателя тяжести, но исследования, проведенные в разных частях мира, показывают большие различия в темпах втягивания из-за различных определений. Ограничение этого термина втягиванием нижней грудной стенки, определяемым как движение внутрь костных структур грудной стенки с вдохом, предоставило лучший индикатор тяжести пневмонии, который можно научить медработникам.Он более специфичен, чем втяжение межреберных промежутков, которое часто встречается при бронхиолите.
В исследовании, проведенном в Гамбии (Кэмпбелл, Байасс и др., 1989), когорта из 500 детей от рождения до четырех лет посещалась дома еженедельно в течение одного года. За это время в клинику было направлено 222 эпизода LRI (учащенное дыхание, любое втягивание грудной стенки, расширение носа, свистящее дыхание, стридор или признаки опасности). Втяжение грудной клетки имело место в 62 процентах этих случаев, во многих случаях втягивание межреберных мышц.Если бы всех детей с каким-либо втягиванием грудной клетки госпитализировали, их количество превысило бы количество детских стационаров.
Исследования, проведенные на Филиппинах и в Свазиленде (Mulholland и др., 1992), показали, что втягивание нижней грудной стенки было более специфичным, чем втягивание между ребрами, для диагностики тяжелой пневмонии, требующей госпитализации. В исследовании Веллора (Cherian and others 1988) втягивание нижней грудной стенки правильно предсказало 79 процентов детей с LRI, которые были госпитализированы педиатром.
Варианты противомикробных препаратов для перорального лечения пневмонии
Выбор противомикробного препарата для лечения основан на хорошо известных данных о том, что большинство бактериальных пневмоний у детей вызывается S. pneumoniae или H. influenzae . Однократная инъекция бензатин-пенициллина, хотя и длится долго, не обеспечивает адекватных уровней пенициллина для уничтожения H. influenzae . У ВОЗ есть технические документы, помогающие оценить соответствующие факторы при выборе противомикробных препаратов первого и второго ряда и сравнения различных противомикробных препаратов в отношении их антибактериальной активности, эффективности лечения и токсичности (ВОЗ, 1990).
Возникновение устойчивости к противомикробным препаратам у S. pneumoniae и H. influenzae вызывает серьезную озабоченность. В некоторых условиях тесты in vitro показывают, что более 50 процентов респираторных изолятов обеих бактерий устойчивы к ко-тримоксазолу, а устойчивость к пенициллину к S. pneumoniae постепенно становится проблемой во всем мире.
При пневмонии, в отличие от менингита, устойчивость возбудителя in vitro не всегда приводит к неэффективности лечения.Сообщения из Испании и Южной Африки предполагают, что пневмонию, вызванную устойчивым к пенициллину S. pneumoniae , можно успешно лечить с помощью достаточно высоких доз пенициллина. Амоксициллин концентрируется в тканях и макрофагах, и уровни препарата напрямую зависят от пероральных дозировок. Поэтому для успешного лечения ушных инфекций, вызванных устойчивым к пенициллину S. pneumoniae , в настоящее время используются более высокие дозы, чем в прошлом, — назначаемые дважды в день. Амоксициллин явно лучше пенициллина при таких инфекциях.Ситуация с ко-тримоксазолом менее ясна (Strauss and others 1998), и перед лицом высоких показателей устойчивости к ко-тримоксазолу амоксициллин может быть лучше для детей с тяжелой пневмонией.
Внутримышечные антибиотики для лечения тяжелой пневмонии
Несмотря на то, что хлорамфеникол активен против S. pneumoniae и H. influenzae, его пероральное всасывание у чрезвычайно больных детей неустойчиво. Таким образом, рекомендации ВОЗ рекомендуют вводить хлорамфеникол внутримышечно в половине суточной дозы до срочного направления пациентов с тяжелой пневмонией.Дополнительным объяснением является то, что у крайне больных детей может быть сепсис или менингит, которые трудно исключить, и их необходимо немедленно лечить. Хотя внутривенный хлорамфеникол превосходит внутримышечный хлорамфеникол, процедура может отсрочить срочно необходимое лечение и увеличивает его стоимость.
Исследователи поставили под сомнение адекватность и безопасность внутримышечного хлорамфеникола. Хотя ранние исследования предполагали, что уровни взрослого в крови после внутримышечного введения были значительно ниже, чем после внутривенного введения, внутримышечный путь введения получил широкое признание после клинических отчетов, которые подтвердили его эффективность.Местные осложнения при внутримышечном введении сукцината левомицетина возникают редко, в отличие от более ранних внутримышечных препаратов. Хотя беспокойство по поводу апластической анемии после приема хлорамфеникола является обычным явлением, это осложнение крайне редко встречается у маленьких детей. Нет никаких доказательств того, что внутримышечный сукцинат хлорамфеникола с большей вероятностью вызывает побочные эффекты, чем другие формы и пути введения хлорамфеникола.
Диагностика гипоксемии на основе критериев ВОЗ
Стратегии ведения случаев ОРИ и комплексного ведения болезней грудного и детского возраста (ИВБДВ) зависят от точного направления больных детей в больницу и правильного стационарного лечения ИРН с применением кислорода или антибиотиков.Гипоксемия (дефицит кислорода в крови) у детей с LRI является хорошим предиктором смертности, коэффициент летальности в 1,2-4,6 раза выше при гипоксемическом LRI, чем при негипоксемическом LRI (Duke, Mgone, and Frank 2001; Onyango and others 1993). ), а кислород снижает смертность. Таким образом, важно как можно раньше выявлять гипоксемию у детей с LRI, чтобы предотвратить смерть. Хотя диагноз острой LRIs очень легко устанавливается путем распознавания тахипноэ, и хотя тяжелая LRI связана с втягиванием грудной стенки, клиническое распознавание гипоксемии более проблематично.Были изучены различные наборы клинических правил для прогнозирования наличия гипоксемии у детей с LRI (Cherian и др., 1988; Onyango и др., 1993; Usen и др., 1999). Хотя некоторые клинические инструменты обладают высокой чувствительностью для выявления гипоксемии, большое количество детей с гипоксемией все же будет пропущено при использовании этих критериев. Пульсоксиметрия — лучший инструмент для быстрого выявления гипоксемии у больных детей. Однако пульсоксиметры дороги и требуют периодических затрат на замену датчиков, по которым они недоступны в большинстве районных или даже специализированных больниц в развивающихся странах.
Руководство по лечению
Текущие рекомендации включают прием ко-тримоксазола два раза в день в течение пяти дней при пневмонии и внутримышечный пенициллин или хлорамфеникол для детей с тяжелой пневмонией. Проблемы повышения устойчивости к ко-тримоксазолу и ненужные направления детей с втягиванием грудной стенки привели к исследованиям, изучающим альтернативы антибиотикам, которые в настоящее время используются при лечении ОРИ. Одно исследование показало, что амоксициллин и котримоксазол одинаково эффективны при нетяжелой пневмонии (Catchup Study Group 2002), хотя амоксициллин стоит в два раза дороже, чем котримоксазол.Что касается продолжительности лечения антибиотиками, исследования в Бангладеш, Индии и Индонезии показывают, что трехдневный пероральный прием котримоксазола или амоксициллина так же эффективен, как пять дней приема любого из этих препаратов у детей с нетяжелой пневмонией (Agarwal and others 2004; Kartasasmita 2003). ). В многоцентровом исследовании пенициллина, вводимого внутримышечно, и перорального амоксициллина у детей с тяжелой пневмонией, Аддо-Йобо и другие (2004) обнаружили схожие показатели излечения. Поскольку пациенты получали кислород при необходимости от гипоксемии и были переведены на другие антибиотики в случае неудачи, этот режим не подходит для лечения тяжелой пневмонии в амбулаторных условиях.
ВОЗ рекомендует назначать кислород, при его достаточном количестве, детям с признаками и симптомами тяжелой пневмонии и, если подача ограничена, детям с любым из следующих признаков: неспособность есть и пить, цианоз, частота дыхания выше или равный 70 вдохам в минуту, или серьезное втягивание грудной стенки (ВОЗ, 1993). Кислород следует вводить со скоростью 0,5 литра в минуту для детей младше 2 месяцев и 1 литр в минуту для детей старшего возраста. Поскольку кислород стоит дорого и его не хватает, особенно в отдаленных сельских районах развивающихся стран, ВОЗ рекомендует простые клинические признаки для выявления и лечения гипоксемии.Несмотря на эти рекомендации, исследование 21 учреждения первого уровня и районной больницы в семи развивающихся странах показало, что более 50 процентов госпитализированных детей с LRI неправильно лечились антибиотиками или кислородом (Nolan and others 2001), а в некоторых случаях кислород был недостаточным. дефицитный. Очевидно, что обеспечение кислородом младенцев с гипоксемией спасает жизнь, хотя никаких рандомизированных испытаний, подтверждающих это, не проводилось.
Профилактика и лечение пневмонии у ВИЧ-позитивных детей
Текущие рекомендации группы ВОЗ по ведению пневмонии у ВИЧ-позитивных детей и профилактике Pneumocystis jiroveci следующие (ВОЗ 2003):
-
Нетяжелая пневмония до 5 лет. Пероральный котримоксазол должен оставаться антибиотиком первой линии, но следует использовать пероральный амоксициллин, если он доступен по цене или если ребенок проходил профилактику котримоксазолом.
-
Тяжелая или очень тяжелая пневмония. Нормальные руководящие принципы ВОЗ по ведению больных следует использовать для детей в возрасте до 2 месяцев. Детям от 2 до 11 месяцев рекомендуются инъекционные антибиотики и терапия пневмонии Pneumocystis jiroveci , а также начинается профилактика пневмонии Pneumocystis jiroveci после выздоровления.Для детей в возрасте от 12 до 59 месяцев лечение состоит из инъекционных антибиотиков и терапии пневмонии Pneumocystis jiroveci . Pneumocystis jiroveci Профилактика пневмонии должна проводиться в течение 15 месяцев детям, рожденным от ВИЧ-инфицированных матерей; однако эта рекомендация редко выполнялась.
Рентабельность вмешательств
Пневмония является причиной примерно пятой части из примерно 10,6 миллиона случаев смерти детей в возрасте до пяти лет в год.Там, где первичная медико-санитарная помощь является слабой, сокращение смертности с помощью мер общественного здравоохранения является приоритетной задачей. Как отмечалось ранее, доступные вмешательства — это первичная профилактика путем вакцинации и вторичная профилактика путем раннего выявления и ведения случаев заболевания.
Рентабельность вакцин против Hib обсуждается в главе 20. Мы не пытались анализировать рентабельность пневмококковых вакцин, потому что глобальные и региональные оценки бремени пневмококковой пневмонии в настоящее время разрабатываются и будут доступны только после позже в 2005 году.Кроме того, текущие цены на вакцины относительно стабильны в развитых странах, но ожидается, что цены для стран с низким и средним уровнем доходов будут значительно ниже, если вакцины закупаются на глобальном тендере.
Мы оцениваем стратегии вмешательства по ведению случаев LRIs у детей в возрасте до пяти лет. Медицинские работники, которые внедряют ведение пациентов, диагностируют LRI на основании учащенного дыхания, втягивания нижней грудной стенки или отдельных признаков опасности у детей с респираторными симптомами.Поскольку этот метод не делает различий между пневмонией и бронхиолитом, а также между бактериальной и вирусной пневмонией, мы объединяем эти состояния в общую категорию «клиническая пневмония» (Rudan and others 2004). Этот подход предполагает, что большая часть клинической пневмонии имеет бактериальное происхождение и что медицинские работники могут значительно снизить летальность посредством диагностики частоты дыхания и своевременного приема антибиотиков (Sazawal and Black 2003). Мы рассчитали затраты на лечение по регионам Всемирного банка, используя стандартизированные исходные затраты, предоставленные редакторами томов, и затраты, опубликованные в Международном справочнике по индикаторам цен на лекарства (Management Sciences for Health 2005) и другой литературе ().В анализе рассматриваются четыре категории ведения пациентов, которые различаются по тяжести инфекции и точке лечения:
Таблица 25.1
Входные данные для ведения случаев пневмонии в странах с низким и средним уровнем доходов.
-
нетяжелая пневмония, которую лечит местный медработник
-
нетяжелая пневмония, лечение в медицинском учреждении
-
тяжелая пневмония, лечение в больнице
-
очень тяжелая пневмония, лечение в больнице.
Информация об этих категориях ведения случаев и их результатах взята из отчета о методологии и предположениях, использованных для оценки затрат на расширение масштабов отдельных медицинских вмешательств, направленных на детей (ВОЗ и Здоровье детей-подростков, готовится к печати). Мы предположили, что для каждого пациента, которого лечит местный медицинский работник, в общей сложности должно быть проведено три контрольных визита, а не два раза в день в течение 10 дней, рекомендованных в отчете. Мы также предположили, что все пациенты с тяжелой пневмонией проходят рентгенологическое обследование, а не только 20 процентов, как это предлагается в отчете.Более того, мы приняли пятичасовой рабочий день для общинного медработника, минимальный рабочий день, необходимый для общинных медицинских работников в рамках инициативы «Здоровье и выживание детей» Агентства США по международному развитию (Bhattacharyya and others 2001).
представляет региональные оценки средних затрат на лечение на эпизод для четырех стратегий ведения случая. Поскольку мы считали, что цены на торгуемые товары, такие как лекарства и кислород, постоянны во всех регионах, региональные различия были вызваны различиями в расходах на больницы и медицинских работников.Латинская Америка и Карибский бассейн, Ближний Восток и Северная Африка имели самые высокие затраты на лечение.
Таблица 25.2
Средние затраты на лечение за один эпизод вмешательств по ведению пациентов с острой респираторной инфекцией нижних дыхательных путей (2001 долл. США).
Мы рассчитали региональные коэффициенты экономической эффективности (ССВ) для модельной численности населения в 1 миллион человек в каждом регионе, следуя стандартизированным руководящим принципам для экономического анализа (подробности см. В главе 15). Входные переменные включали стоимость лечения, подробно описанную в и, региональные показатели заболеваемости LRI, адаптированные из материалов Рудана и других (в печати), региональные показатели смертности и возрастные структуры, предоставленные редакторами томов, а также соотношение городского и сельского населения по регионам (World Банк 2002).Регион Европы и Центральной Азии был исключен из этого анализа из-за отсутствия информации о заболеваемости. В связи с отсутствием информации по регионам, мы предположили, что уровни эффективности вмешательства будут одинаковыми.
Количество лет жизни с поправкой на инвалидность можно предотвратить за счет сокращения продолжительности болезни и снижения смертности с помощью лечения. Мы предположили, что средняя продолжительность болезни составляет 8,5 дней для тех, кто не лечился, и 6,0 дней для тех, кто лечился. Мы использовали снижение летальности на 36,0% за счет лечения (Sazawal and Black 2003) и специфичность диагноза 78.5 процентов для пациентов, которым поставлен диагноз только на основании частоты дыхания. Вес нетрудоспособности одновременно с инфекцией составил 0,28. Мы не рассматривали инвалидность, вызванную хроническими последствиями LRI, потому что неясно, вызывает ли LRI в детстве долгосрочное нарушение функции легких или дети, у которых развивается нарушение функции легких, более склонны к инфекции (von Mutius 2001).
Поскольку один год этих вмешательств дает только одновременные выгоды — поскольку эффективно пролеченные люди не обязательно доживают до ожидаемой продолжительности жизни, учитывая, что они, вероятно, снова заразятся в следующем году, — мы рассчитали рентабельность пятилетнего вмешательства .Этот период времени позволил нам рассмотреть случай, в котором целая когорта новорожденных до четырехлетнего возраста избежала ранней детской смертности от клинической пневмонии из-за вмешательства и получила преимущество, дожившее до ожидаемой продолжительности жизни. Наконец, в этом анализе учитывались только долгосрочные предельные затраты, которые варьируются в зависимости от числа пролеченных лиц, и не учитывались постоянные затраты на запуск программы, где их в настоящее время не существует.
представляет конкретные региональные ССВ для четырех категорий ведения случаев, а также ССВ для предоставления всех четырех категорий населению в 1 миллион человек.Во всех странах с низким и средним уровнем дохода лечение нетяжелой клинической пневмонии было более рентабельным на уровне учреждения, чем на уровне общины, и из всех четырех категорий ведения случая лечение очень тяжелой клинической пневмонии на уровне стационара было более эффективным. наименее рентабельный. Лечение нетяжелой клинической пневмонии на уровне учреждения было более рентабельным, чем лечение работником здравоохранения по месту жительства, из-за более низкой стоимости одного посещения медицинского учреждения, чем многократных посещений медицинского работника.CER предоставления всех уровней лечения для всех стран с низким и средним уровнем доходов оценивается в 398 долларов США на год жизни с поправкой на инвалидность.
Таблица 25.3
ССВ вмешательств по ведению пациентов с пневмонией (2001 долл. США / год жизни с поправкой на инвалидность).
Поскольку мы предположили, что показатели эффективности были постоянными, региональные различия в CER для каждой категории ведения случая были связаны только с вариациями затрат на вмешательство, а относительные рейтинги экономической эффективности для стратегий были одинаковыми для всех регионов.Различия в ССВ для оказания всех категорий медицинской помощи также были обусловлены региональным соотношением городского и сельского населения. Мы предположили, что все пациенты в городских районах обращаются за лечением на уровне учреждения или выше, тогда как 80 процентов нетяжелых пациентов в сельской местности получают лечение на уровне сообщества, а остальные обращаются за лечением на уровне учреждения.
Внедрение стратегий борьбы с ОРИ: уроки опыта
Уроки стратегий профилактики и контроля ОРИ, реализованные в рамках национальных программ, включают стратегии вакцинации и ведения больных, описанные ниже.
Вакцины. Стратегии
Вакцина против Hib была включена в календарь плановой иммунизации младенцев в Северной Америке и Западной Европе в начале 1990-х годов. С созданием Глобального альянса по вакцинам и иммунизации (ГАВИ) и Фонда вакцин был достигнут прогресс в их внедрении в развивающихся странах, хотя серьезные препятствия остаются. К 2002 г. только 84 из 193 стран-членов ВОЗ ввели вакцину против Hib. С тех пор пять стран получили одобрение ГАВИ на поддержку внедрения вакцины против Hib в 2004–2005 годах.
Соединенные Штаты добавили 7-PCV в программу иммунизации младенцев в 2000 году. Некоторые другие промышленно развитые страны планируют включить вакцину в свои национальные программы иммунизации в 2005 году, в то время как другие рекомендуют использовать вакцину только в избранных группах высокого риска. . В некоторых из этих последних стран определение высокого риска является довольно широким и включает значительную долю всех младенцев. В лицензированном в настоящее время 7-PCV отсутствуют определенные серотипы, важные для развивающихся стран, но 9-PCV и 11-PCV охватят почти 80 процентов серотипов, вызывающих серьезные заболевания во всем мире.
Несмотря на успех вакцины против Hib в промышленно развитых странах и общепризнанное значение LRI как причины детской смертности, в результате действия ряда взаимосвязанных факторов внедрение вакцины в развивающихся странах было медленным. Устойчивое использование вакцины находится под угрозой в нескольких странах, которые ввели вакцину. Во-первых, масштабы заболеваний и смертей, вызванных Hib, не признаются в этих странах, отчасти из-за недостаточного использования бактериологической диагностики (в результате нехватки оборудования и ресурсов).Во-вторых, поскольку охват, достигнутый с помощью традиционных расширенных программ иммунизации вакцинами, остается низким во многих странах, добавление дополнительных вакцин не было определено в качестве приоритета. В-третьих, развивающиеся страны не предпринимали усилий по установлению полезности вакцины до тех пор, пока вакцина не была лицензирована и не использовалась регулярно в течение нескольких лет в промышленно развитых странах. Следовательно, вакцинация против Hib воспринималась как средство вмешательства для богатых стран. В результате действия всех этих факторов фактический спрос на вакцину оставался низким даже при наличии поддержки через ГАВИ и Фонд вакцин.
В 2004 году правление ГАВИ поручило целевой группе по Hib изучить, как лучше всего поддержать национальные усилия по принятию основанных на фактических данных решений о внедрении вакцины против Hib. На основе рекомендаций целевой группы правление ГАВИ одобрило создание Инициативы против Hib для поддержки тех стран, которые желают либо продолжить вакцинацию против Hib, либо изучить вопрос о том, должно ли внедрение вакцины против Hib быть приоритетом для их систем здравоохранения. Консорциум, состоящий из Школы общественного здравоохранения Блумберга Джонса Хопкинса, Лондонской школы гигиены и тропической медицины, Центров по контролю и профилактике заболеваний и ВОЗ, был выбран для руководства этими усилиями.
Стратегии ведения случаев
Метаанализ исследований Сазавала и Блэка (Sazawal and Black, 2003) на уровне сообществ по стратегии ведения случаев ОРИ включает 10 исследований, в которых оценивалось ее влияние на смертность, 7 с одновременной контрольной группой. Метаанализ показал снижение смертности от всех причин на 27 процентов среди новорожденных, на 20 процентов среди младенцев и на 24 процента среди детей в возрасте от одного до четырех лет. Смертность от LRI снизилась на 42, 36 и 36 процентов соответственно. Эти данные ясно показывают, что относительно упрощенное, но стандартизованное ведение случаев ОРИ может иметь значительное влияние на смертность не только от пневмонии, но и от других причин у детей от рождения до четырех лет.В настоящее время стратегия ведения пациентов с ОРИ включена в стратегию ИВБДВ, которая в настоящее время применяется более чем в 80 странах (см. Главу 63).
Несмотря на то, что ежегодно от пневмонии гибнет огромное количество людей, обещания, заложенные в упрощенном ведении больных, не были успешно реализованы во всем мире. Одна из основных причин — недостаточное использование медицинских учреждений в странах или сообществах, в которых многие дети умирают от ОРИ. В Бангладеш, например, 92 процента больных детей не попадают в соответствующие медицинские учреждения (ВОЗ, 2002 г.).В Боливии 62 процента умерших детей не были доставлены к врачу в случае болезни (Aguilar and others 1998). В Гвинее 61 процент умерших больных детей не были доставлены к врачу (Schumacher and others 2002). Исследование Шелленберга и других (2003), проведенное в Танзании, показывает, что дети из более бедных семей с меньшей вероятностью получат антибиотики от пневмонии, чем дети из более обеспеченных семей, и что только 41 процент больных детей доставляют в медицинские учреждения.Таким образом, исследования неизменно подтверждают, что больные дети, особенно из бедных семей, не посещают медицинские учреждения.
Ряд стран разработали крупномасштабные и устойчивые программы лечения на уровне сообществ:
- В Гамбии действует национальная программа по ведению пневмонии на уровне общин (ВОЗ 2004b).
- В районе Сиая в Кении неправительственная организация эффективно предоставляет медицинскими работниками лечение пневмонии и других детских болезней (ВОЗ, 2004b).
- В Гондурасе управление ОРИ было включено в Национальную интегрированную общинную программу по уходу за детьми, в соответствии с которой добровольцы из местных сообществ проводят мониторинг роста, проводят санитарное просвещение и лечат пневмонию и диарею в более чем 1800 сообществах (ВОЗ 2004b).
-
В Бангладеш Комитет по развитию сельских районов Бангладеш и правительство внедрили программу борьбы с ОРИ, охватывающую 10 округов, с привлечением добровольцев из местных медицинских работников. Каждый работник отвечает за лечение детской пневмонии примерно в 100–120 домашних хозяйствах после трехдневной программы обучения.
- В Непале в 1986–89 гг. Общинная программа лечения ОРИ и диарейных заболеваний была опробована в двух округах и показала существенное снижение смертности от LRI (Pandey and others 1989, 1991). В результате программа была интегрирована в службы здравоохранения Непала и реализуется в 17 из 75 округов страны женщинами-добровольцами, обученными выявлять и лечить пневмонию.
- В Пакистане в программе Lady Health Worker Program работает около 70 000 женщин, которые работают в общинах, обеспечивая образование и ведение детской пневмонии более чем 30 миллионам человек (ВОЗ 2004b).
Программа исследований и разработок
Программа исследований и разработок, изложенная ниже, суммирует приоритеты, которые были установлены консультативными группами Инициативы по исследованиям вакцин (стратегии вмешательства в отношении вакцин) и Отдела здоровья детей и подростков ВОЗ (случай — стратегии управления).
Стратегии вакцинации
Целевая группа ГАВИ по иммунизации против Hib дала ряд рекомендаций, которые различаются в зависимости от страны.Страны, внедрившие вакцину против Hib, должны сосредоточиться на документировании ее эффекта и должны использовать данные для информирования национальных органов власти, партнеров по развитию и других учреждений, занимающихся общественным здравоохранением, для обеспечения постоянной поддержки таких программ вакцинации. Страны, имеющие право на поддержку ГАВИ, которые еще не внедрили вакцины против Hib, часто сталкиваются с ограничениями из-за отсутствия местных данных и недостаточной осведомленности о региональных данных. Они могут решать эти вопросы на субрегиональных встречах, на которых страновые эксперты могут объединять данные и анализировать информацию из других стран.Кроме того, большинству стран необходимо проводить экономический анализ, основанный на стандартизированном инструменте. Наконец, все страны, которые сталкиваются с высоким бременем Hib-инфекции, должны создать лабораторное оборудование, чтобы они могли определять заболеваемость Hib-менингитом в выбранных местах. Страны, в которых бремя болезни остается неясным, могут иметь ограниченные возможности для документирования случаев заболевания Hib с использованием протоколов, основанных на эпиднадзоре за инвазивным менингитом. Им необходимо будет изучить возможности использования альтернативных методов измерения бремени болезней, включая использование исследований вакцины.
Основываясь на опыте внедрения вакцин против Hib и гепатита B, ГАВИ проявил инициативу и в 2003 году на базе Школы общественного здравоохранения Джона Хопкинса в Балтиморе основал инициативу по реализации программы ускоренной разработки и внедрения пневмококковых вакцин ( PneumoADIP; см. Http://www.preventpneumonia.org). Целью программы является установление и информирование о ценности пневмококковых вакцин и поддержка их доставки. Установление ценности вакцины требует разработки местных данных о бремени болезни и потенциальном воздействии вакцины на здоровье населения.Эти усилия могут быть достигнуты за счет усиленного эпиднадзора за болезнями и соответствующих клинических испытаний в выбранном количестве ведущих стран. После создания доказательная база будет передана лицам, принимающим решения, и ключевым лидерам общественного мнения, чтобы гарантировать принятие решений на основе данных. После того, как будет установлена рентабельность плановой вакцинации, необходимо будет создать системы доставки, и странам потребуется финансовая поддержка, чтобы вакцины могли быть включены в их программы иммунизации.Эти мероприятия инициируются до выпуска вакцин, предназначенных для использования в развивающихся странах, чтобы информировать о планировании потенциала, доступности продукции и ценообразовании.
Стратегии ведения случаев
В 2003 г. Отдел здоровья детей и подростков ВОЗ созвал совещание для обзора данных и доказательств недавних исследований лечения ОРИ и предложения следующих изменений в руководящие принципы ведения случаев и приоритеты будущих исследований:
- Нетяжелая пневмония:
-
Повышение специфичности клинических диагностических критериев.
-
Пересмотреть текущие рекомендуемые ВОЗ критерии для выявления и лечения неудач лечения с учетом высоких показателей неудач терапии.
-
Проведите повторный анализ данных краткосрочных курсов терапии, чтобы лучше определить факторы, определяющие неэффективность лечения.
-
Провести плацебо-контролируемые испытания среди детей с хрипом и пневмонией в выбранных условиях с высокой распространенностью хрипов, чтобы определить, нуждаются ли такие дети в антибиотиках.
-
- Тяжелая пневмония: В рандомизированном клиническом исследовании в контролируемой среде, Аддо-Йобо и другие (2004) показали, что пероральный амоксициллин так же эффективен, как парентеральный пенициллин или ампициллин; тем не менее, прежде чем его можно будет рекомендовать в целом, необходимо предпринять следующие действия:
-
Проанализировать данные об исключениях из исследования.
-
Определите предикторы, которые могут помочь отличить детей, которые нуждаются в госпитализации и у которых впоследствии ухудшается состояние.
-
Пересмотреть рекомендуемые ВОЗ критерии неэффективности лечения тяжелой пневмонии с учетом общих высоких показателей неудач терапии.
-
Провести описательные исследования в условиях общественного здравоохранения в нескольких центрах по всему миру, чтобы оценить клинические результаты перорального приема амоксициллина у детей в возрасте от 2 до 59 месяцев с втягиванием нижней грудной стенки.
-
Задокументировать эффективность руководящих принципов ВОЗ по лечению детей с пневмонией и ВИЧ-инфекцией.
-
- LRI смертей:
-
Чтобы помочь разработать более эффективные меры по снижению смертности от LRI, подробно изучите эпидемиологию смертей от LRI в различных регионах, используя рутинные и передовые лабораторные методы.
-
- Кислородная терапия:
-
Проведите исследования, чтобы показать эффективность кислорода для лечения тяжелых респираторных инфекций.
-
Соберите базовую информацию о наличии и доставке кислорода, а также его использовании в больницах в странах с низким уровнем дохода.
-
Изучите возможности пульсоксиметрии для оптимизации кислородной терапии в различных клинических условиях.
-
Провести исследования для улучшения специфичности клинических признаков при наложении признаков и симптомов малярии и пневмонии.
-
Изучите быстрые диагностические тесты на малярию, чтобы оценить их эффективность в различении малярии и пневмонии.
-
Изучить влияние широкого применения ко-тримоксазола на устойчивость к сульфадоксин-пириметамину к Plasmodium falciparum .
-
-
Этиология: данные об этиологии пневмонии у детей несколько устарели, и необходимы новые этиологические исследования, в которых используются современные технологии для идентификации патогенов.
Выводы: обещания и ловушки
Фактические данные ясно показывают, что подход ВОЗ к ведению больных и более широкое использование имеющихся вакцин снизят смертность от ОРИ среди детей младшего возраста от половины до двух третей. Само по себе систематическое применение упрощенного ведения больных, стоимость которого достаточно низка, чтобы быть доступным практически для любой развивающейся страны, снизит смертность от ОРИ как минимум на треть.Срочно нужно воплотить эту информацию в жизнь.
Стратегия ведения случая должна применяться и проспективно оцениваться, чтобы возникающие проблемы устойчивости к противомикробным препаратам, снижение эффективности текущего лечения рекомендованными противомикробными препаратами или появление неожиданных патогенов могли быть обнаружены на ранней стадии и чтобы можно было быстро принять меры по исправлению положения. Если действия медицинских работников на уровне сообществ будут дополнены внедрением стратегии ИВБДВ на всех уровнях первичной медико-санитарной помощи, то применять и оценивать эту стратегию будет проще.Такая синергия также может помочь в сборе информации, которая поможет в дальнейшей точной настройке клинических признаков, чтобы даже сельские медицинские работники могли лучше отличить бронхиолит и хрипы от бактериальной пневмонии. Критике того, что меры по ведению пациентов могут привести к чрезмерному использованию противомикробных препаратов, следует противодействовать путем документирования их чрезмерного и неправильного использования врачами и другими медицинскими работниками. Хотя наблюдается возрождение интереса к проведению вмешательств на уровне сообществ, наш анализ показывает, что это может оказаться нерентабельным.В самом деле, ведение пациентов с ОРИ в учреждении первого уровня все еще может быть наиболее рентабельным в сочетании с более эффективными поведенческими вмешательствами, связанными с обращением за медицинской помощью.
Международное медицинское сообщество только начинает осознавать потенциальные преимущества вакцин против Hib и пневмококка. В настоящее время они дороги по сравнению с вакцинами Расширенной программы иммунизации, но цена вакцины Hib может упасть с выходом на рынок большего числа производителей в ближайшие несколько лет. Тем не менее, убедительные доказательства экономической эффективности вакцин необходимы для облегчения принятия национальных решений по внедрению вакцины и ее устойчивому использованию.В странах с низким уровнем доходов одних только положительных соотношений затрат и выгод и экономической эффективности оказывается недостаточно для включения этих вакцин в национальные программы иммунизации.
Ссылки
- Аддо-Йобо Э., Чисака Н., Хассан М., Хибберд П., Лозано Дж. М., Джина П. и др. Пероральный амоксициллин по сравнению с инъекционным пенициллином при тяжелой пневмонии у детей в возрасте от 3 до 59 месяцев: рандомизированное многоцентровое исследование эквивалентности. Ланцет. 2004. 364 (9440): 1141–48. [PubMed: 15451221]
- Адегбола Р.A., Falade A. G., Sam B. E., Aidoo M., Baldeh I., Hazlett D. et al. Этиология пневмонии у недоедающих и хорошо питающихся детей Гамбии. Журнал детских инфекционных болезней. 1994. 13 (11): 975–82. [PubMed: 7845751]
- Адегбола Р. А., Усен С. О., Вебер М., Ллойд-Эванс Н., Джоб К., Малхолланд К. и др. Haemophilus influenzae Менингит типа B в Гамбии после введения конъюгированной вакцины. Ланцет. 1999; 354 (9184): 1091–92. [PubMed: 10509502]
-
Агилар, А.М., Р. Альварадо, Д. Кордеро, П. Келли, А. Замора и Р. Сальгадо. 1998. Обследование смертности в Боливии: окончательный отчет — исследование и определение причин смерти детей в возрасте до пяти лет . Вена, Вирджиния: Базовая поддержка проекта институционализации выживания детей.
- Берман С. Средний отит у детей. Медицинский журнал Новой Англии. 1995a; 332 (23): 1560–65. [PubMed: 7739711]
- ———. 1995b Отитис в педиатрии развивающихся стран 961, часть 1126–31. [PubMed: 7596700]
-
Бхаттачарья, К., П. Винч, К. ЛеБан и М. Тьен. 2001. «Стимулы и сдерживающие факторы для работников здравоохранения в сообществе: как они влияют на мотивацию, удержание и устойчивость». Basic Support for Institutionalizing Child Survival Project Агентства США по международному развитию, Арлингтон, Вирджиния.
- Блэк Р. Э., Моррис С. С., Брайс Дж. Где и почему 10 миллионов детей умирают каждый год? Ланцет. 2003. 361 (9376): 2226–34. [PubMed: 12842379]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Льюис Э., Рэй П., Хансен Дж. Р. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Журнал детских инфекционных болезней. 2000. 19 (3): 187–95. [PubMed: 10749457]
- Блэк С. Б., Шайнфилд Х. Р., Файерман Б., Хиатт Р. Безопасность, иммуногенность и эффективность в младенчестве конъюгата олигосахаридов Haemophilus influenzae вакцины типа B в популяции Соединенных Штатов: возможные последствия для оптимального использования.Журнал инфекционных болезней. 1992; 165 (Приложение 43): S139–43. [PubMed: 1588149]
- Блэк С. Б., Шайнфилд Х. Р., Хансен Дж., Элвин Л., Лауфер Д., Малиноски Ф. Постлицензионная оценка эффективности семивалентной пневмококковой конъюгированной вакцины. Журнал детских инфекционных болезней. 2001. 20 (12): 1105–7. [PubMed: 11740313]
- Бобат Р., Кувадия Х. М., Мудли Д., Коутсудис А. Смертность в когорте детей, рожденных ВИЧ-1 инфицированными женщинами из Дурбана, Южная Африка. Южноафриканский медицинский журнал.1999. 89 (6): 646–48. [PubMed: 10443216]
- Booy R., Hodgson S., Carpenter L., Mayon-White R. T., Slack M. P., Macfarlane J. A. et al. Эффективность Haemophilus influenzae PRP-T конъюгированной вакцины типа B. Ланцет. 1994. 344 (8919): 362–66. [PubMed: 7
- 6]
- Брайс Дж., Боски-Пинто К., Сибуя К., Блэк Р. Э. Справочная группа ВОЗ по эпидемиологии здоровья детей. . Оценки ВОЗ причин смерти у детей. Ланцет. 2005; 365: 1147–52. [PubMed: 15794969]
- Кэмпбелл Х., Армстронг Дж. Р. М., Байасс П. Загрязнение воздуха в помещениях в развивающихся странах и острая респираторная инфекция у детей. Ланцет. 1989; 1 (8645): 1012. [PubMed: 2565480]
- Кэмпбелл Х., Байасс П., Ламонт А. С., Форги И. М., О’Нил К. П., Ллойд-Эанс Н., Гринвуд Б. М. Оценка клинических критериев для выявления тяжелых острых инфекций нижних дыхательных путей у детей. Ланцет. 1989; 1 (8633): 297–99. [PubMed: 2563457]
- Группа изучения догоняющих событий. Клиническая эффективность ко-тримоксазола по сравнению с амоксициллином дважды в день для лечения пневмонии: рандомизированное контролируемое клиническое испытание в Пакистане.Архив болезней детства. 2002; 86: 113–18. [Бесплатная статья PMC: PMC1761064] [PubMed: 11827905]
- Cherian T., John T. J., Simoes E. A., Steinhoff M. C., John M. Оценка простых клинических признаков для диагностики острой инфекции нижних дыхательных путей. Ланцет. 1988. 2: 125–28. [PubMed: 2899187]
- Cherian T., Simoes E. A., Steinhoff M. C., Chitra K., John M., Raghupathy P. et al. Бронхиолит в тропической южной Индии. Американский журнал болезней детей. 1990. 144 (9): 1026–30.[PubMed: 2396617]
- Каттс Ф. Т., Заман С. М. А., Энвере Г., Джаффар С., Левин О. С., Ококо Дж. Б. и др. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет. 2005; 365 (9465): 1139–46. [PubMed: 15794968]
- де Андраде А. Л., де Андраде Дж. Г., Мартелли К. М., Сильва С. А., де Оливейра Р. М., Коста М. С. и др. Эффективность конъюгированной вакцины Haemophilus influenzae B при детской пневмонии: исследование случай-контроль в Бразилии.Международный журнал эпидемиологии. 2004. 33 (1): 173–81. [PubMed: 15075166]
- Денни Ф. У. мл. Клиническое влияние респираторных вирусных инфекций человека. Американский журнал респираторной медицины и реанимации. 1995; 152 (4, часть 2): S4–12. [PubMed: 7551411]
- Dobson M. Концентраторы кислорода обеспечивают экономию средств для развивающихся стран: исследование, проведенное на Новой Гвинее. Анестезия. 1991; 146: 217–19. [PubMed: 2014901]
- Дуглас Р. М., Майлз Х. Б. Вакцинация против Streptococcus pneumoniae в детстве: отсутствие очевидной пользы для маленьких австралийских детей.Журнал инфекционных болезней. 1984. 149 (6): 861–69. [PubMed: 6376653]
- Duke T, Mgone J., Frank D. Гипоксемия у детей с тяжелой пневмонией в Папуа-Новой Гвинее. Международный журнал туберкулеза и болезней легких. 2001; 5: 511–19. [PubMed: 11409576]
- Эскола Дж., Кайхти Х., Такала А. К., Пелтола Х., Роннберг П. Р., Кела Э. и др. Рандомизированное проспективное полевое испытание конъюгированной вакцины для защиты младенцев и детей младшего возраста от инвазивной болезни Haemophilus influenzae типа B.Медицинский журнал Новой Англии. 1990. 323 (20): 1381–87. [PubMed: 2233904]
- Eskola J., Kilpi T., Palmu A., Jokinen J., Haapakoski J., Herva E. et al. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. Медицинский журнал Новой Англии. 2001. 344 (6): 403–409. [PubMed: 11172176]
- Фарли Дж., Кинг Дж. С., Наир П., Хайнс С. Э., Трессиер Р. Л., Винк П. Э. Инвазивное пневмококковое заболевание среди инфицированных и неинфицированных детей матерей с инфекцией, вызванной вирусом иммунодефицита человека.Журнал педиатрии. 1994; 124: 853–58. [PubMed: 8201466]
- Фиддиан-Грин Р. Г., Бейкер С. Нозокомиальная пневмония у тяжелобольных: продукт аспирации или перемещения? Реанимационная медицина. 1991; 19: 763–69. [PubMed: 2055052]
- Файерман Б., Блэк С. Б., Шайнфилд Х. Р., Ли Дж., Льюис Э., Рэй П. Воздействие пневмококковой конъюгированной вакцины на средний отит. Журнал детских инфекционных болезней. 2003. 22 (1): 10–16. [PubMed: 12544402]
- Фритцелл Б., Плоткин С. Эффективность и безопасность вакцины, конъюгированной с капсульным полисахаридом столбняка и белком столбняка, Haemophilus influenzae .Журнал педиатрии. 1992. 121 (3): 355–62. [PubMed: 1517908]
- Гесснер Б. Д., Сутанто А., Линехан М., Джелантик И. Г., Флетчер Т., Герудуг И. К. и др. Заболеваемость гемофильной пневмонией и менингитом, предотвращаемым вакцинацией, Haemophilus Influenzae у индонезийских детей: рандомизированное исследование вакцины Hamlet. Ланцет. 2005; 365 (9453): 43–52. [PubMed: 15643700]
- Гафур А., Номани Н. К., Исхак З., Заиди С. З., Анвар Ф., Берни М. И. и др. Диагностика острых инфекций нижних дыхательных путей у детей в Равалпинди и Исламабаде, Пакистан.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S907–14. [PubMed: 2270413]
- Гилкс К. Ф. Пневмококковая болезнь и ВИЧ-инфекция. Анналы внутренней медицины. 1993; 118: 393–94. [PubMed: 8430986]
- Гоэль А., Бэмфорд Л., Хансло Д., Хасси Г. Первичная стафилококковая пневмония у детей раннего возраста: обзор 100 случаев. Журнал тропической педиатрии. 1999. 45 (4): 233–36. [PubMed: 10467836]
- Хемент Дж. М., Аэртс П. К., Флир А., Ван Дейк Х., Хармсен Т., Кимпен Дж. Л., Вольфс Т.F. Повышенная адгезия Streptococcus pneumoniae к эпителиальным клеткам человека, инфицированным респираторно-синцитиальным вирусом. Педиатрические исследования. 2004; 55 (6): 972–78. [PubMed: 15103015]
- Heath P. T. Haemophilus influenzae Конъюгированные вакцины типа B: обзор данных об эффективности. Журнал детских инфекционных болезней. 1998. 17 (9 доп.): S117–22. [PubMed: 9781743]
- Hortal M., Mogdasy C., Russi J. C., Deleon C., Suarez A. Микробные агенты, ассоциированные с пневмонией у детей из Уругвая.Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S915–22. [PubMed: 2270414]
- Икеогу М. О., Вольф Б., Мате С. Легочные проявления у ВИЧ-серопозитивных и недоедающих детей в Зимбабве. Архив болезней детства. 1997. 76: 124–28. [Бесплатная статья PMC: PMC1717076] [PubMed: 01]
- Джина П. М., Кувадия Х. М., Кристал В. Pneumocystis carinii и cytomegalo Вирусные инфекции у тяжелобольных ВИЧ-инфицированных африканских младенцев. Анналы тропической педиатрии.1996; 16: 361–68. [PubMed: 8985536]
- Jiang Z., Nagata N., Molina E., Bakaletz L.O., Hawkins H., Patel J. A. Опосредованное фимбрией усиленное прикрепление нетипируемого Haemophilus influenzae , не являющегося типом, к инфицированным респираторным синцитиальным вирусом респираторным эпителиальным клеткам. Инфекция и иммунитет. 1999; 67: 187–92. [Бесплатная статья PMC: PMC96295] [PubMed: 9864214]
-
Джон Т. Дж. 1994. «Кто определяет национальную политику здравоохранения?» In Vaccation and World Health: Fourth Annual Public Health Forum of the London School of Hygiene and Tropical Medicine , ed.Каттс Ф. Т., Смит П. Г., 205–11. Чичестер, Великобритания: Джон Вили.
- Джон Т. Дж., Чериан Т., Стейнхофф М. К., Симоэс Э. А., Джон М. Этиология острых респираторных инфекций у детей в тропических регионах Южной Индии. Обзоры инфекционных болезней. 1991; 13 (Приложение 6): S463–69. [PubMed: 1862277]
- Камат К. Р., Фельдман Р. А., Рао П. С., Уэбб Дж. К. Инфекция и болезнь в группе южноиндийских семей. Американский журнал эпидемиологии. 1969; 89: 375–83. [PubMed: 5778926]
- Карма П., Луотонен Дж., Тимонен М., Понтинен С., Пукандер Дж., Херва Э. и др. Эффективность пневмококковой вакцины против рецидивирующего среднего отита: предварительные результаты полевых испытаний в Финляндии. Annals of Otology, Rhinology, and Laryngology Suppl. 1980. 89 (3, часть 2): 357–62. [PubMed: 6778346]
-
Картасасмита, С. 2003. «Пероральный котримоксазол три или пять дней при нетяжелой пневмонии». Документ, представленный на Консультативном совещании Всемирной организации здравоохранения по обзору текущих исследований и лечению острых респираторных инфекций, Женева, 29 сентября — 1 октября.
- Килпи Т., Ахман Х., Йокинен Дж., Ланкинен К. С., Палму А., Саволайнен Х. и др. Защитная эффективность второй пневмококковой конъюгированной вакцины против пневмококкового острого среднего отита у младенцев и детей: рандомизированное контролируемое испытание семивалентной конъюгированной вакцины комплекса пневмококкового полисахарида и менингококкового белка внешней мембраны с 7-валентными соединениями у 1666 детей. Клинические инфекционные болезни. 2003. 37 (9): 1155–64. [PubMed: 14557958]
- Клугман К. П., Мадхи С. А., Хюбнер Р.E., Kohberger R., Mbelle N., Pierce N. et al. Испытание пневмококковой конъюгированной вакцины 9-Valent у детей с ВИЧ-инфекцией и без нее. Медицинский журнал Новой Англии. 2003. 349 (14): 1341–48. [PubMed: 14523142]
- Колстад П. Р., Бернхэм Г., Калтер Х. Д., Кения-Мугиша Н., Блэк Р. Э. Комплексное ведение детских болезней в Западной Уганде. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 77–85. [Бесплатная статья PMC: PMC2486998] [PubMed: 9529720]
- Lagos R., Хорвиц И., Торо Дж., Сан Мартин О., Абрего П., Бустаманте С. и др. Крупномасштабная, постлицензионная, селективная вакцинация чилийских младенцев конъюгированной вакциной PRP-T: практичность и эффективность в предотвращении инвазивных инфекций Haemophilus influenzae типа B. Журнал детских инфекционных болезней. 1996; 15: 216–22. [PubMed: 8852909]
- Леманн Д., Маршалл Т. Ф., Райли И. Д., Альперс М. П. Влияние пневмококковой вакцины на заболеваемость острыми инфекциями нижних дыхательных путей у детей Папуа-Новой Гвинеи.Анналы тропической педиатрии. 1991. 11 (3): 247–57. [PubMed: 1719924]
- Левин О. С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А. М., Абрего П. и др. Определение бремени пневмонии у детей, которую можно предотвратить с помощью вакцинации против Haemophilus influenzae Тип B. Журнал детских инфекционных болезней. 1999. 18 (12): 1060–64. [PubMed: 10608624]
- Лукас С. Б., Пикок С. С., Хунноу А., Браттегаард К., Коффи К., Хонд М. и др. Заболевание детей, инфицированных ВИЧ в Абиджане, Кот-д’Ивуар.Британский медицинский журнал. 1996; 312: 335–38. [Бесплатная статья PMC: PMC2350283] [PubMed: 8611829]
- Madhi SA, Petersen K., Madhi A., Khoosal M., Klugman KP Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающих тяжелые инфекции нижних дыхательных путей, приобретенные в сообществе. Дети, инфицированные вирусом иммунодефицита человека 1. Клинические инфекционные болезни. 2000. 31: 170–76. [PubMed: 10 7]
- Мадхи С. А., Петерсен К., Мадхи А., Васас А., Клугман К. П.Воздействие вируса иммунодефицита человека типа 1 на спектр заболеваний Streptococcus pneumoniae у детей Южной Африки. Журнал детских инфекционных болезней. 2000. 19 (12): 1141–47. [PubMed: 11144373]
- Макела П. Х., Сибаков М., Херва Э., Хенрихсен Дж., Луотонен Дж., Тимонен М. и др. Пневмококковая вакцина и средний отит. Ланцет. 1980; 2 (8194): 547–51. [PubMed: 6106735]
-
Управленческие науки для здравоохранения. 2005. Международный справочник по индикаторам цен на лекарства .Кембридж, Массачусетс: Управленческие науки для здоровья.
- МакКуллерс Дж. А., Бартмесс К. С. Роль нейраминидазы в летальном синергизме между вирусом гриппа и Streptococcus pneumoniae . Журнал инфекционных болезней. 2003. 187: 1000–9. [PubMed: 12660947]
- Монто А. С., Ульман Б. М. Острое респираторное заболевание в американском сообществе: исследование Текумсе. Журнал Американской медицинской ассоциации. 1974. 227 (2): 164–69. [PubMed: 4357298]
- Малхолланд К., Усен С., Адегбола Р., Вебер Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998. 352 (9127): 575–76. [PubMed: 9716087]
- Малхолланд Э. К., Симоэс Э. А., Касталес М. О., МакГрат Э. Дж., Маналак Э. М., Гоув С. Стандартизированная диагностика пневмонии в развивающихся странах. Журнал детских инфекционных болезней. 1992; 11: 77–81. [PubMed: 1741202]
- Mulholland K., Hilton S., Adegbola R., Usen S., Oparaugo A., Omosigho C. et al. Рандомизированное исследование Haemophilus influenzae конъюгированной вакцины против столбняка с белком типа B для профилактики пневмонии и менингита у младенцев в Гамбии.Ланцет. 1997. 349 (9060): 1191–97. [PubMed: 39]
- Натху К. Дж., Нкрума Ф. К., Ндлову Д., Нхембе Д., Пири Дж., Ково Х. Острая инфекция нижних дыхательных путей у госпитализированных детей в Зимбабве. Анналы тропической педиатрии. 1993; 13: 253–61. [PubMed: 7505550]
- Нойзил К. М., Чжу Ю., Гриффин М. Р., Эдвардс К. М., Томпсон Дж. М., Толлефсон С. Дж., Райт П. Ф. Бремя межпандемического гриппа у детей младше 5 лет: 25-летнее перспективное исследование. Журнал инфекционных болезней.2002; 185: 147–52. [PubMed: 11807687]
- Nolan T., Angos P., Cunha A. J., Muhe L., Qazi S., Simoes E. A. et al. Качество стационарной помощи тяжелобольным детям в менее развитых странах. Ланцет. 2001. 357 (9250): 106–10. [PubMed: 11197397]
- Обаро С., Лич А., Макадам К. В. Использование пневмококковой полисахаридной вакцины у детей. Ланцет. 1998; 352 (9127): 575. [PubMed: 9716086]
- О’Брайен К. Л., Моултон Л. Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование.Ланцет. 2003. 362 (9381): 355–61. [PubMed: 12
- 8]
- Оньянго Ф. Э., Стейнхофф М. С., Вафула Э. М., Вариуа С., Мусия Дж., Китони Дж. Гипоксемия у кенийских детей раннего возраста с острой инфекцией нижних дыхательных путей. Британский медицинский журнал. 1993. 306 (6878): 612–15. [Бесплатная статья PMC: PMC1676956] [PubMed: 8369033]
- Пандей М. Р., Даулер Н. М., Старбак Э. С., Хьюстон Р. М., Макферсон К. Снижение общей смертности детей в возрасте до пяти лет в Западном Непале с помощью противомикробного лечения пневмонии на базе местных сообществ.Ланцет. 1991. 338 (8773): 993–97. [PubMed: 1681351]
- Пандей М. Р., Шарма П. Р., Губхаджу Б. Б., Шакья Г. М., Неупане Р. П., Гаутам А. и др. Воздействие пилотной программы борьбы с острыми респираторными инфекциями (ОРИ) в сельском сообществе Горного региона Непала. Анналы тропической педиатрии. 1989. 9 (4): 212–20. [PubMed: 2482002]
- Педерсон Дж., Найроп М. Анестезиологическое оборудование для развивающихся стран. Британский журнал анестезии. 1991; 66: 264–70. [PubMed: 1817634]
- Пейрис Дж.S., Yu W. C., Leung C. W., Cheung C. Y., Ng W. F., Nicholls J. M. et al. Повторное появление заболевания подтипа H5N1 гриппа человека со смертельным исходом. Ланцет. 2004; 363 (9409): 617–19. [Бесплатная статья PMC: PMC7112424] [PubMed: 14987888]
- Перкинс Б. А., Цукер Дж. Р., Отинео Дж., Джафари Х. С., Пакстон Л., Редд С. С. и др. Оценка алгоритма интегрированного ведения детских болезней в районе Кении с высоким уровнем передачи малярии. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 33–42.[Бесплатная статья PMC: PMC2487004] [PubMed: 9529716]
-
Киамбао, Б. П., Э. А. Симоес, Э. Абучехо-Ладесма, Л. С. Гозум, С. П. Луписан, Л. Т. Сомбреро и П. Дж. Рууту (Консорциум ARIVAC). Скоро. «Серьезные детские инфекции, приобретенные в сообществе, в сельских районах Азии (остров Бохол, Филиппины)». Журнал детских инфекционных болезней .
-
Редд С. Диагностика и лечение острых респираторных инфекций в Лесото. Политика и управление здравоохранением. 1994; 5: 255–60.
- Райли И. Д., Эверингем Ф. А., Смит Д. Э., Дуглас Р. М. Иммунизация поливалентной пневмококковой вакциной: влияние респираторной смертности у детей, живущих в Высокогорье Новой Гвинеи. Архив болезней детства. 1981. 56 (5): 354–57. [Бесплатная статья PMC: PMC1627425] [PubMed: 7020609]
- Райли И. Д., Леманн Д., Альперс М. П. Испытания пневмококковой вакцины в Папуа-Новой Гвинее: взаимосвязь между эпидемиологией пневмококковой инфекции и эффективностью вакцины. Обзоры инфекционных болезней.1991; 13 (Приложение 6): S535–41. [PubMed: 1862283]
- Рудан И., Томаскович Л., Боски-Пинто К., Кэмпбелл Х. Справочная группа ВОЗ по эпидемиологии здоровья детей. Глобальная оценка заболеваемости клинической пневмонией среди детей в возрасте до пяти лет. Бюллетень Всемирной организации здравоохранения. 2004. 82 (12): 895–903. [Бесплатная статья PMC: PMC2623105] [PubMed: 15654403]
-
Рудан и другие. Скоро.
- Santosham M., Wolff M., Reid R., Hohenboken M., Bateman M., Goepp J.и другие. Эффективность конъюгированной вакцины, состоящей из полисахарида Haemophilus influenzae типа B и Neisseria meningitidis наружно-мембранного белкового комплекса у младенцев навахо. Медицинский журнал Новой Англии. 1991. 324 (25): 1767–72. [PubMed: 16]
- Сазавал С., Блэк Р. Э. Группа испытаний по ведению больных с пневмонией: влияние ведения больных с пневмонией на смертность новорожденных, младенцев и детей дошкольного возраста — метаанализ испытаний на уровне сообществ. Ланцетные инфекционные болезни.2003; 3: 547–56. [PubMed: 12954560]
- Schellenberg J. A., Victora C.G., Mushi A., de Savigny D., Schellenberg D., Mshinda H. et al. Неравенство среди очень бедных: здравоохранение для детей в сельских районах Южной Танзании. Ланцет. 2003. 361 (9357): 561–66. [PubMed: 12598141]
- Шнайдер Г. Обеспечение кислородом в сельских районах Африки: личный опыт. Международный журнал туберкулеза и болезней легких. 2001. 5 (6): 524–26. [PubMed: 11409578]
-
Шумахер, Р., Э. Сведберг, М.О. Диалло, Д. Р. Кейта, Х. Кальтер, О. Паша. 2002. Исследование смертности в Гвинее: исследование причин смерти детей в возрасте до пяти лет . Арлингтон, Вирджиния: Спасите детей и базовая поддержка для институционализации проекта выживания детей.
- Шэнн Ф. Этиология тяжелой пневмонии у детей в развивающихся странах. Детская инфекционная болезнь. 1986. 5 (2): 247–52. [PubMed: 3952013]
- Шэнн Ф., Граттен М., Гермер С., Линнеманн В., Хазлетт Д., Пейн Р. Этиология пневмонии у детей в больнице Горока, Папуа-Новая Гвинея.Ланцет. 1984; 2 (8402): 537–41. [PubMed: 6147602]
- Шенн Ф., Харт К., Томас Д. Острые инфекции нижних дыхательных путей у детей: возможные критерии выбора пациентов для антибактериальной терапии и госпитализации. Бюллетень Всемирной организации здравоохранения. 1984; 62: 749–51. [Бесплатная статья PMC: PMC2536213] [PubMed: 6334573]
- Simoes E. A. Респираторно-синцитиальная вирусная инфекция. Ланцет. 1999; 354 (9181): 847–52. [PubMed: 10485741]
- Симоэс Э. А., Деста Т., Тессема Т., Gerbresellassie T., Dagnew M., Gove S. Эффективность медицинских работников после обучения комплексному ведению детских болезней в Гондэре, Эфиопия. Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 43–53. [Бесплатная статья PMC: PMC2487005] [PubMed: 9529717]
- Слойер Дж. Л. Дж., Плуссард Дж. Х., Хоуи В. М. Эффективность пневмококковой полисахаридной вакцины в предотвращении острого среднего отита у младенцев в Хантсвилле, Алабама. Обзоры инфекционных болезней. 1981; 3 (Прил.): S119–23. [PubMed: 7280444]
- Стенсбаль Л.Г., Девасундарам Дж. К., Симоэс Э. А. Эпидемии респираторно-синцитиального вируса: взлеты и падения сезонного вируса. Журнал детских инфекционных болезней. 2003; 22 (2 доп.): S21–32. [PubMed: 12671449]
- Штраус В. Л., Кази С. А., Кунди З., Номани Н. К., Шварц Б. Группа по изучению ко-тримоксазола. Устойчивость к противомикробным препаратам и клиническая эффективность ко-тримоксазола по сравнению с амоксициллином при пневмонии у детей в Пакистане: рандомизированное контролируемое исследование. Ланцет. 1998. 352: 270–74. [PubMed: 96
- ]
- Темпл К., Гринвуд Б., Инскип Х., Холл А., Коскела М., Лейнонен М. Ответ антител на пневмококковую капсульную полисахаридную вакцину у африканских детей. Журнал детских инфекционных болезней. 1991. 10 (5): 386–90. [PubMed: 2067888]
- Тупаси Т. Э., Лусеро М. Г., Магдангал Д. М., Мангубат Н. В., Сунико М. Э., Торрес К. У. и др. Этиология острой инфекции нижних дыхательных путей у детей из Алабанга, Метро Манила. Обзоры инфекционных болезней. 1990; 12 (Приложение 8): S929–39. [PubMed: 2270415]
-
ЮНЭЙДС (Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу).2002. Обновление эпидемии СПИДа . Женева: ЮНЭЙДС.
- Усен С., Вебер М., Малхолланд К., Джаффар С., Опарауго А., Омосиго С. и др. Клинические предикторы гипоксемии у детей Гамбии с острой инфекцией нижних дыхательных путей: проспективное когортное исследование. Британский медицинский журнал. 1999. 318 (7176): 86–91. [Бесплатная статья PMC: PMC27680] [PubMed: 9880280]
- Van den Hoogen BG, de Jong JC, Groen J., Kuiken T., de Groot R., Fouchier RA, Osterhaus AD Недавно обнаруженный человеческий пневмовирус, выделенный у детей раннего возраста при заболевании дыхательных путей.Природная медицина. 2001; 7: 719–24. [Бесплатная статья PMC: PMC7095854] [PubMed: 11385510]
- Вуори-Холопайнен Э., Пелтола Х. Переоценка легочной пункции: обзор старого метода для лучшей этиологической диагностики детской пневмонии. Клинические инфекционные болезни. 2001. 32 (5): 715–26. [PubMed: 11229839]
- Вебер М. В., Малхолланд Э. К., Джаффар С., Трёдссон Х., Гоув С., Гринвуд Б. М. Оценка алгоритма комплексного ведения детских болезней в районе с сезонной малярией в Гамбии.Бюллетень Всемирной организации здравоохранения. 1997; 75 (Приложение 1): 25–32. [Бесплатная статья PMC: PMC2486992] [PubMed: 9529715]
- Венгер Дж. Д., ДиФабио Дж., Ландаверде Дж. М., Левин О.С., Гаафар Т. Внедрение конъюгированных вакцин против Hib в непромышленно развитых странах: опыт в четырех странах, недавно принявших на вооружение . Вакцина. 1999. 18 (78): 736–42. [PubMed: 10547434]
-
Венгер, Дж. Д. и М. М. Левин, ред. 1997. Эпидемиологическое влияние конъюгированной вакцины на инвазивное заболевание, вызываемое Haemophilus influenzae Тип B .Нью-Йорк: Марсель Деккер.
- Уитни К. Г., Фарли М. М., Хадлер Дж., Харрисон Л. Х., Беннет Н. М., Линфилд Р. и др. Снижение инвазивного пневмококкового заболевания после введения протеин-полисахаридной конъюгированной вакцины. Медицинский журнал Новой Англии. 2003. 348 (18): 1737–46. [PubMed: 12724479]
-
ВОЗ (Всемирная организация здравоохранения). 1990. «Антибиотики в лечении острых респираторных инфекций у детей раннего возраста». Неопубликованный документ WHO / ARI / 90.10, доступный по запросу в Отделе здоровья и развития детей, бывшего Отдела борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 1991. «Ведение маленького ребенка с острой респираторной инфекцией. Модуль обучения навыкам супервизии». Неопубликованный документ, доступный по запросу в Отделе здоровья и развития детей ВОЗ, бывшем Отделении борьбы с диарейными и острыми респираторными заболеваниями, ВОЗ, Женева.
-
———. 2002. Многострановая оценка эффективности, затрат и воздействия ИВБДВ (MCE): отчет о ходе работы, май 2001 г. — апрель 2002 г. .WHO / FCH / CAH / 02.16. Женева: Отдел здоровья и развития детей и подростков, ВОЗ.
-
———. 2003. Консультативное совещание по ведению детей с пневмонией и ВИЧ-инфекцией, 30–31 января 2003 г., Хараре, Зимбабве . WHO / FCH / CAH / 03.4. Женева: ВОЗ.
- ———. 2004a Группа по обзору Haemophilus influenzae Бремя болезни типа B (Hib) в Бангладеш, Индонезии и других азиатских странах, Бангкок, 28–29 января 2004 г. Еженедельный эпидемиологический отчет 79 (18): 173–75.[PubMed: 15168565]
-
———. 2004b. «Совместное заявление ВОЗ / ЮНИСЕФ: ведение пневмонии в общественных местах». WHO / FCH / CAG / 04.06. ВОЗ, Женева.
-
ВОЗ (Всемирная организация здравоохранения) и здоровье детей-подростков. Скоро. Отчет о методологии и предположениях, использованных для оценки затрат на расширение отдельных мероприятий по охране здоровья детей до 95% с целью снижения смертности детей в возрасте до пяти лет . Женева: ВОЗ.
- Уильямс Б. Г., Гоус Э., Боски-Пинто К., Брайс Дж., Дай С. Оценки глобального распределения детской смертности от острых респираторных инфекций. Ланцетные инфекционные болезни. 2002; 2: 25–32. [PubMed: 118 ]
-
Всемирный банк. 2002. Показатели мирового развития . CD-ROM. Вашингтон, округ Колумбия: Всемирный банк.
- Цви К. Дж., Петтифиор Дж. М., Содерлунд Н. Педиатрическая больница при городской региональной больнице Южной Африки: влияние ВИЧ, 1992–1997 гг. Анналы тропической педиатрии. 1999; 19: 135–42. [PubMed: 106
]
Респираторно-синцитиальный вирус (RSV) у детей
Не то, что вы ищете?Что такое респираторно-синцитиальный вирус (РСВ) у детей?
RSVis вирусное заболевание, вызывающее такие симптомы, как затрудненное дыхание.Его самая частая причина воспаления мелких дыхательных путей в легких (бронхиолит) и пневмония у младенцев.
Что вызывает RSV у ребенка?
RSV передается при контакте ребенка с жидкостью из нос или рот инфицированного человека. Это может произойти, если ребенок прикоснется к зараженному предмету. поверхность и касается его или ее глаз, рта или носа.Это также может произойти при вдыхании капли от чихания или кашля инфицированного человека.
Какие дети подвержены риску RSV?
Ребенок более подвержен риску RSV, если: он или она находится рядом с другими людьми с вирусом. RSV часто возникает при ежегодных вспышках. в сообщества, классы и центры по уходу за детьми. RSV чаще встречается зимой и рано весенние месяцы.
RSV может повлиять на человека любого возраст, но вызывает большинство проблем для очень молодых и очень старых. Большинство младенцев были инфицированы хотя бы один раз к 2 годам. Младенцы также могут быть повторно инфицированы с вирусом. Заражение может повториться в любой момент на протяжении всей жизни. Инфекция RSV в Детям старшего возраста и взрослым может показаться приступом тяжелой астмы. Рожденные младенцы преждевременно или с заболеваниями сердца, легких или иммунной системы подвержены повышенному риску более тяжелая болезнь.
Каковы симптомы RSV у ребенка?
Симптомы проявляются примерно через 2-5 дней. после контакта с вирусом.
Ранняя фаза RSV у младенцев а у маленьких детей часто бывает легким, как простуда. У детей младше 3 лет болезнь может перейти в легкие и вызвать кашель и хрипы. У некоторых детей в инфекция переходит в тяжелое респираторное заболевание.Вашему ребенку может потребоваться лечение в в больницу, чтобы помочь с дыханием.
Наиболее частые симптомы RSV включают:
- Насморк
- Лихорадка
- Кашель
- Короткие периоды без дыхания (апноэ)
- Проблемы с едой, питьем или глотание
- Свистящее дыхание
- Расширение ноздрей или напряжение груди или живота при дыхании
- Дыхание быстрее обычного, или затрудненное дыхание
- Посинение вокруг губ и кончики пальцев
Симптомы RSV могут казаться как и другие состояния здоровья.Убедитесь, что ваш ребенок посещает своего врача. для диагностики.
Как диагностируют RSV у ребенка?
Медицинский работник спросит о симптомах вашего ребенка и история здоровья. Он или она также может спросить о недавнем заболевании в вашей семье или Другие дети в детском саду или школе. Он или она проведет медицинский осмотр вашего ребенка. Ваш ребенку также могут быть сданы анализы, такие как мазок из носа или мазок для промывания.Это безболезненный тест на Смотреть на вирус в жидкости из носа.
Как лечится РСВ у ребенка?
Лечение будет зависеть от вашего симптомы ребенка, возраст и общее состояние здоровья. Это также будет зависеть от того, насколько серьезным состояние есть.
Антибиотики не используются для лечения RSV. Лечение RSV проводится для облегчения симптомов.Лечение может включать:
- Еще жидкости. Очень важно Убедитесь, что ваш ребенок пьет много жидкости. При необходимости ваш ребенок получит внутривенная (IV) линия для введения жидкости и электролитов.
- Кислород. Это дополнительный кислород, поступающий через маску, носовые канюли или кислородную палатку.
- Отсасывание слизи. Тонкая трубка ввести в легкие, чтобы удалить лишнюю слизь.
- Бронходилатирующие препараты. Эти могут использоваться для открытия дыхательных путей вашего ребенка. Их часто вводят в виде аэрозольного тумана. маску или через ингалятор.
- Питание через зонд. Это можно сделать, если ребенок плохо сосет.Тонкую трубку вводят через нос ребенка в желудок. Жидкое питание отправляется по трубке.
- Механическая вентиляция. Ребенок, который очень болен, может потребоваться поставить дыхательный аппарат (вентилятор), чтобы помочь с дыхание.
- Противовирусные препараты. Некоторые дети с тяжелыми инфекциями мая необходимость лечение противовирусным препаратом лекарства.
Обратитесь в медицинский центр вашего ребенка поставщиков о рисках, преимуществах и возможных побочных эффектах всех видов лечения.
Какие возможные осложнения РСВ у ребенка?
У младенцев из группы высокого риска RSV может привести к тяжелому респираторному заболеванию и пневмония. Это может стать опасным для жизни. РСВ в младенчестве может быть связан с астмой потом в детстве.
Как я могу предотвратить РСВ у моего ребенка?
Американская академия педиатрии (AAP) рекомендует детям с высоким риском RSV принимать лекарство под названием паливизумаб. Просить лечащий врач вашего ребенка, если ваш ребенок подвержен высокому риску заражения RSV. Если да, спросите о ежемесячные инъекции во время сезона RSV, чтобы предотвратить заражение.
Чтобы снизить риск RSV, AAP рекомендует всем младенцам, особенно недоношенным:
- На грудном вскармливании
- Беречь от контакта с курить
- Не ходить в детский сад с большим количеством дети в первый зимний сезон
- Не контактировать с больными
Также убедитесь, что участники моют руки или используют средство для мытья рук на спиртовой основе до и после прикосновения ребенок с RSV.
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Позвоните поставщику медицинских услуг, если у вашего ребенка:
- Симптомы, которые не проходят или не ухудшаются
- Новые симптомы
Основные сведения о РСВ у детей
- RSV — вирусное заболевание, вызывающее затрудненное дыхание.Чаще встречается в зимние и ранние весенние месяцы.
- Большинство младенцев были инфицированы в хотя бы один раз к тому времени, когда им исполнится 2 года. Младенцы также могут быть повторно инфицированы вирус. Заражение может повториться в любой момент на протяжении всей жизни.
- Лечение RSV может включать дополнительные кислород. Это дополнительный кислород, поступающий через маску, носовые канюли или кислородную палатку. А ребенку, который очень болен, возможно, потребуется подключить дыхательный аппарат (вентилятор), чтобы помочь с дыханием
- У детей из группы высокого риска RSV может привести к тяжелые респираторные заболевания и пневмония.Это может стать опасным для жизни. RSV как а ребенок может быть связан с астмой в более позднем детстве.
- Младенцы с высоким риском РСВ получают лекарство под названием паливизумаб. Спросите у врача, есть ли у вашего ребенка в высокий риск RSV.
Следующие шаги
Советы, которые помогут получить максимальную отдачу от визит к лечащему врачу вашего ребенка:
- Знайте причину визита и что вы хотите, чтобы это произошло.
- Перед визитом запишите вопросы, на которые вы хотите получить ответы.
- При посещении запишите имя новый диагноз и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые дает ваш врач для вашего ребенка.
- Знайте, почему новое лекарство или лечение прописан и как это поможет вашему ребенку.Также знаю, какие побочные эффекты находятся.
- Спросите, может ли состояние вашего ребенка лечили другими способами.
- Знайте, почему тест или процедура рекомендуются и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимайте лекарства, не проходите анализы или процедуры.
- Если у вашего ребенка будет наблюдение о назначении, запишите дату, время и цель визита.
- Узнайте, как можно связаться с детским провайдер в нерабочее время. Это важно, если ваш ребенок заболел и у вас вопросы или нужен совет.
Роль ПЦР в диагностике ОРВИ у детей
Реферат
Острые респираторные вирусные инфекции (ОРВИ) являются наиболее частой патологией в структуре заболеваемости и смертности среди инфекционных заболеваний во всем мире.
Материалы и методы: Материалом для лабораторного исследования служили мазки из носоглотки в первые 2 дня от начала заболевания у пациентов в возрасте до 18 лет. Мазки были обнаружены на наличие генетического материала вирусов гриппа A и B, парагриппа, респираторно-синцитиального вируса (RSV), аденовируса, риновируса, метапневмовируса, бокавируса и коронавируса методом ПЦР-детекции в реальном времени были доставлены в лабораторию гриппа и гриппа. как болезнь.
Результаты и обсуждение: Среди 607 опрошенных пациентов частота выявления РНК / ДНК респираторных вирусов в разные годы колебалась от 55% до 72% (в среднем 65%), что в большинстве случаев подтверждает вирусную этиологию ORI.Анализ результатов показал, что в 88% случаев респираторные вирусы выявляли моноинфекцию, а в 12% случаев наблюдали одновременное заражение двумя и более возбудителями. В структуре возбудителей ОРВИ в качестве основных этиологических агентов ОРВИ преобладали парагрипп (24%), риновирусы (16%) и RSV (16%). Частота выявления вирусов гриппа А и бокавирусов составила 11% и 4% соответственно. С одинаковой частотой выявлялись вирусы метапневмо-, адено- и гриппа В (5%), коронавирус был изолирован в 2% случаев.
Анализ результатов исследования методом ПЦР мазков из носоглотки, взятых у пациентов с симптомами ОРВИ, позволяет сделать следующие ВЫВОДЫ:
-
Ø в большинстве случаев (65%) острые респираторные инфекции являются вирусными
-
Ø применение метода ПЦР для обнаружения широкого спектра респираторных вирусов и сочетанного заражения несколькими вирусами.
Сноски
Цитируйте эту статью как: European Respiratory Journal 2019; 54: Дополнение.63, PA4539.
Это тезисы Международного конгресса ERS. Полнотекстовая версия недоступна. Дополнительные материалы, сопровождающие этот тезис, могут быть доступны на сайте www.ers-education.org (только для членов ERS).
- Авторские права © авторы 2019
Клиническое исследование острой респираторной вирусной инфекции
Краткое название
Клиническое исследование эффективности и безопасности рафамина в лечении ОРВИ у детей 12-18 лет
Официальное название
Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование эффективности и безопасности рафамина в лечении острой респираторной вирусной инфекции у детей 12-18 лет в параллельных группах
Краткое содержание
Многоцентровое двойное слепое плацебо-контролируемое исследование рандомизировано в параллельную группу.Цель
Целью этого исследования является оценка эффективности и безопасности Рафамина при лечении острого
Респираторно-вирусная инфекция (ОРВИ) у детей 12-18 лет.
Подробное описание
Дизайн: многоцентровое, двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование в параллельных группах.
испытание.
В исследование будут включены амбулаторные пациенты любого пола в возрасте 12-18 лет с клиническими
проявлений ОРВИ в первые дни после
начало болезни.Набор пациентов будет проводиться при сезонной заболеваемости ОРВИ.
Сбор анамнеза, термометрия, объективное обследование, лабораторные исследования, запись
Сопутствующая терапия будет проводиться после подписания родителем / приемным родителем информационного листа и
Форма информированного согласия на участие ребенка в клиническом исследовании, для детей ≥14 лет
лет после подписания информационного листа пациента и формы информированного согласия для детей ≥14 лет
лет для участия в клиническом исследовании.Выраженность симптомов ОРВИ будет
оценен по 4-балльной шкале.
Мазки из носоглотки для ПЦР-диагностики и проверки респираторных вирусов будут
выполнено до начала терапии для подтверждения вирусной этиологии ОРВИ. Чтобы исключить инфекцию
, вызванный новым коронавирусом COVID-19 (Коронавирусная болезнь 2019), быстрый тест на
Будет создан антиген SARS-CoV-2. В случае положительного результата теста на SARS-CoV-2 врач
действовать в соответствии с действующей редакцией Временного методического регламента МЗ РФ.
рекомендаций «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)».
Если пациент соответствует всем критериям включения и не имеет критериев исключения, при посещении
1 (День 1), он / она будет рандомизирован в одну из двух групп: пациенты группы 1 будут принимать
Рафамин по схеме приема 5 дней; пациенты группы 2 будут принимать плацебо
с использованием 5-дневного режима приема Рафамина.
В исследовании будет использоваться электронный дневник пациента (ЭПД) для записи утром и вечером.
Температура тела в подмышечных впадинах (по классическому безртутному термометру) и симптомы заболевания
(оценка тяжести симптомов).Кроме того, дозировка жаропонижающего (если применимо) и любое ухудшение
в состоянии пациента (если применимо, для оценки безопасности / документации по НЯ) также будет
занесено в дневник пациента. Исследователь предоставит инструкции по заполнению дневника.
На визите 1 родитель / приемный родитель вместе с исследователем зафиксирует симптом ОРВИ.
степень тяжести и температура тела в дневнике.
Наблюдение за пациентами 14 дней (скрининг, рандомизация — до 1 дня, лечение
период — 5 дней, срок наблюдения — до 2 дней; отложенный «телефонный визит» — день 14).
В течение периода лечения и последующего наблюдения пациенты / врачи совершат 3 посещения и
Четвертый «телефонный визит» будет запланирован дополнительно: 1) посещения врача / пациента — по дням
1, 5 и 7 (посещения 1, 2 и 3) — в учебном центре или дома; 2) «визит по телефону» (Посещение 4) —
в день 14.
При посещениях 2 и 3 следователь проведет объективное обследование, внесет изменения в документацию.
в симптомах и сопутствующих лекарствах, а также проверьте дневники пациентов.В лаборатории Визита 3
Будет проведено
тестов и проверено соответствие.
«Телефонный визит» будет проводиться для беседы с родителями / приемными родителями о пациенте.
Состояние
, наличие / отсутствие вторичных бактериальных / вирусных осложнений и использование
антибиотиков.
Во время исследования разрешена симптоматическая терапия и терапия их сопутствующих заболеваний с
за исключением препаратов, указанных в разделе «Запрещенное сопутствующее лечение».
Критерии исследования
Критерии включения:
1. Пациенты любого пола в возрасте от 12 до 18 лет.
2. Диагностика ОРВИ на основании медицинского обследования: температура в подмышечных впадинах ≥ 37,8 ° C при
обследование + неспецифические гриппоподобные симптомы ≥4 баллов, симптом из носа / горла / грудной клетки
оценка ≥2.
3. Первые 24 часа после начала ОРВИ.
4. Противозачаточные меры, применяемые сексуально активными подростками обоего пола во время
учиться.5. Информационный лист пациента (форма информированного согласия), подписанный одним из родителей / приемных родителей.
пациента, а также имеется подписанный информационный лист пациента (информированное согласие
форма) для детей от 14 лет.
Критерий исключения:
1. Клинические симптомы тяжелого гриппа / ОРВИ, требующие госпитализации.
2. Положительный тест на антиген SARS-CoV-2 (COVID-19 / Coronavirusdisease2019).
3. Подозрение на пневмонию, бактериальную инфекцию (включая средний отит, синусит, мочевыводящие пути).
инфекция тракта, менингит, сепсис и др.) требующие приема антибиотиков
с первого дня болезни.
4. Подозрение на начальные проявления заболеваний с симптомами, аналогичными ОРВИ в начале.
(другие инфекционные заболевания, гриппоподобный синдром в дебюте системной соединительной
заболевания тканей и другие патологии).
5. Пациенты, которым требуются противовирусные препараты, запрещенные в рамках исследования.
6. История болезни первичного и вторичного иммунодефицита.
7. Анамнез / подозрение на онкологию любой локализации (кроме доброкачественной).
новообразования).8. Обострение или декомпенсация хронических заболеваний (сахарный диабет, детский
церебральный паралич, муковисцидоз, первичная цилиарная дискинезия, бронхолегочные
дисплазия, врожденные пороки дыхания и ЛОР-органов и т. д.), влияющие на дееспособность пациента.
для участия в клиническом исследовании.
9. Синдром мальабсорбции, включая врожденную или приобретенную лактазу или другую
дисахаридазная недостаточность, галактоземия.
10. Аллергия / гиперчувствительность к любому компоненту исследуемых препаратов, используемых в лечении.11. Беременность. Кормление грудью.
12. Использование лекарственных препаратов, указанных в разделе «Запрещенная сопутствующая терапия» в рамках
за две недели до включения в исследование.
13. Пациенты, родители / усыновители которых, с точки зрения исследователя, не будут
соблюдать требования к наблюдению во время исследования или следовать процедуре для
прием исследуемых препаратов.
14. Медицинский анамнез психических заболеваний пациента или его родителя (ей) / приемных родителей.15. Участие в других клинических испытаниях за 3 месяца до включения в это исследование.
16. Родители / усыновители пациента, которые связаны с кем-либо из исследователей на месте.
непосредственно участвуют в исследовании или являются ближайшими родственниками исследователя.
«Ближайший родственник» означает мужа, жену, родителя, сына, дочь, брата или сестру.
(независимо от того, естественные они или усыновленные).
17. Родитель / усыновитель пациента, работающий в ООО «НПФ« МАТЕРИА МЕДИКА ХОЛДИНГ »(т.е. в
сотрудники компании, временные работники по контракту, назначенные должностные лица, ответственные за
проведение исследования или любые ближайшие родственники вышеупомянутого). 