Низкое расположение плаценты
Главная / Гинеколог / Низкое расположение плаценты
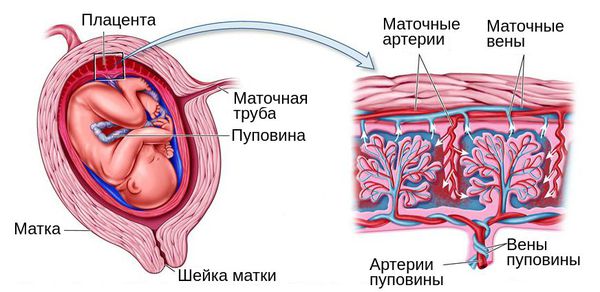
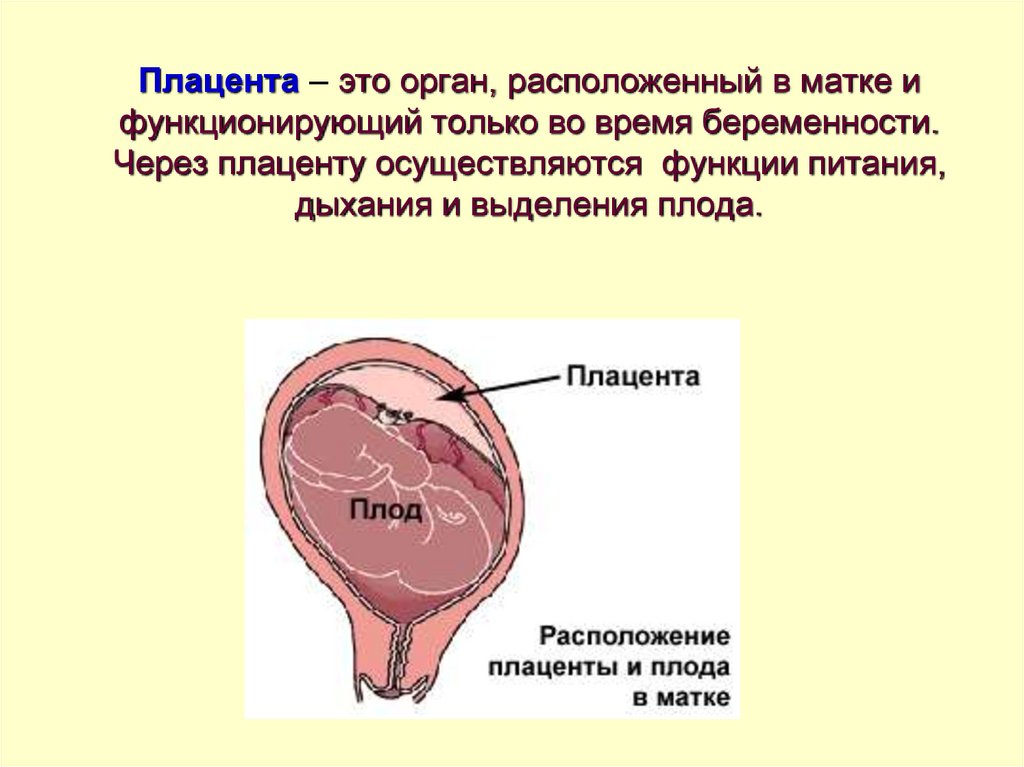
Плацента — временный орган, который образуется в теле беременной женщины для того, чтобы поддерживать связь между её организмом и плодом. Она фильтрует кровь, которой питается ещё не родившийся малыш, очищая её от токсинов и других вредных веществ.
Данная патология может быть весьма опасной в некоторых случаях, в других же проходит без всякого лечения и не приносит проблем.
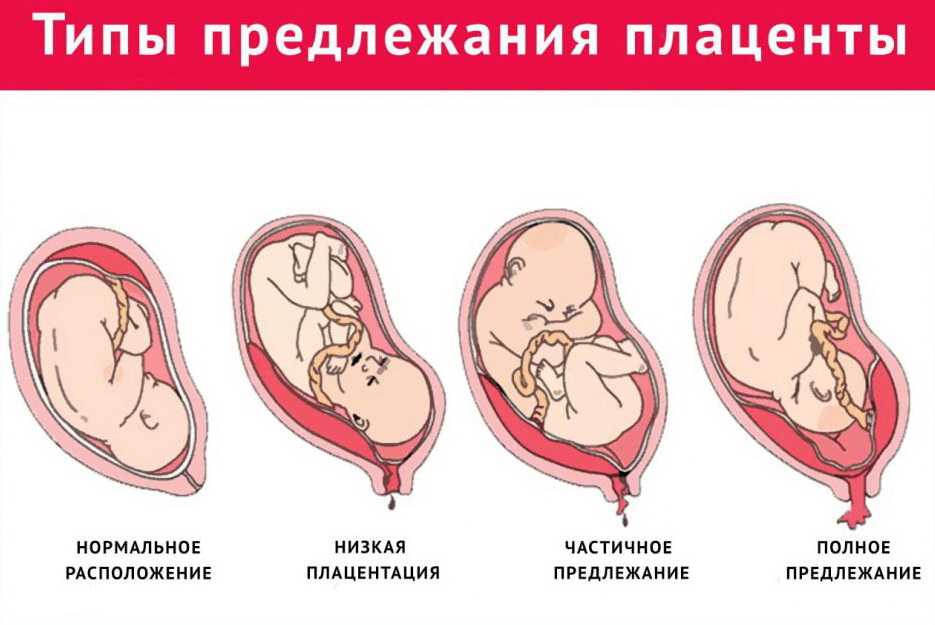
Виды расположения плаценты
Обычно плацента крепится на задней стенке матки ближе к ее дну. Стоит заметить, что матка – сосуд перевернутый, и дно у нее расположено сверху. Это самый оптимальный вариант расположения плаценты. Однако так получается не всегда. В некоторых случаях плацента крепится к передней стенке. Что так же не является патологией.
Низкое расположение плаценты при беременности гораздо опаснее. Если плацента расположена низко, она подвергается более сильному давлению со стороны плода, да и при любом внешнем воздействии риск повреждения плаценты или ее отслоения возрастает. Кроме того, на поздних сроках активно двигающийся ребенок тоже может повредить плаценту, или же пережать пуповину.
Кроме того, на поздних сроках активно двигающийся ребенок тоже может повредить плаценту, или же пережать пуповину.
Низким называется такое расположение плаценты, когда между ее нижним краем и зевом матки менее 6 см.
Если плацента расположена низко, но по задней стенке матки, то скорее всего, ситуация выправится самостоятельно, и плацента мигрирует в более высокое положение. Передняя стенка имеет большую склонность к растяжению, и миграция для нее также характерна, однако направление миграции противоположно: обычно плацента движется наоборот, вниз, к шейке матки.
Еще более сложной и опасной патологией расположения плаценты является ее частичное или полное предлежание. Предлежанием называется такое состояние, когда плацента частично или полностью заслоняет зев матки.
Причины низкого расположения плаценты
Многие причины низкого расположения плаценты обусловлены внутренними факторами — заболеваниями во время беременности и состоянием половых органов женщины.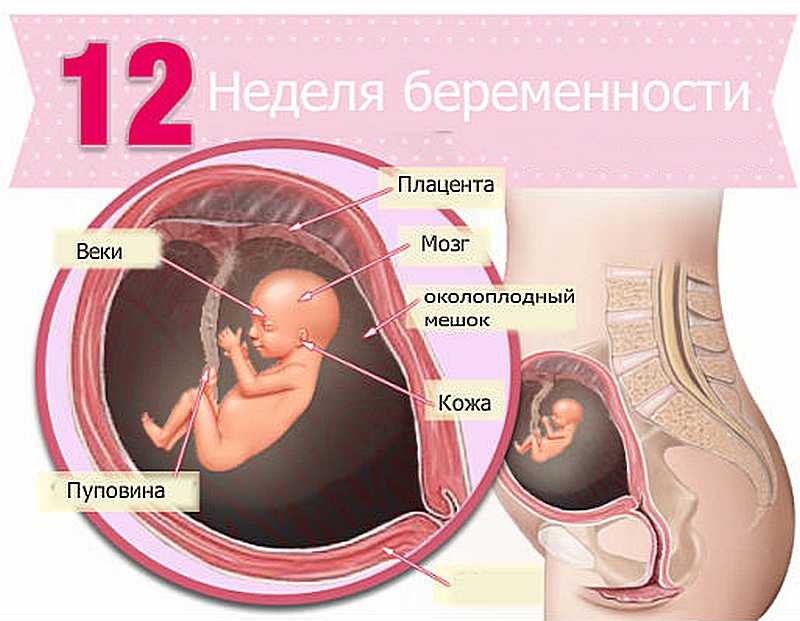 Ими могут стать:
Ими могут стать:
- повреждения слизистой оболочки матки;
- воспалительные процессы;
- инфекции;
- предыдущие аборты;
- выкидыши в прошлом;
- кесарева сечения;
- различные гинекологические операции;
- патологии строения, развития, функционирования матки;
- многоплодная беременность;
- неправильный образ жизни: активное курение, чрезмерное употребление алкоголя;
- перенесённые ранее заболевания матки: эндометрит, миома;
- паритет — много родов в прошлом;
- возраст женщины более 35 лет.
Выскабливание матки в прошлом — основная причина данной патологии. Повреждение слизистой мешает плодному яйцу закрепиться в верхнем сегменте этого органа, и оно остаётся внизу, у шейки.
Симптомы низкого расположения плаценты
Опасность данной патологии в том, что она практически никак себя не проявляет. Обычно признаки того, что с плацентой не всё в порядке, являются следствием уже запущенных и необратимых процессов — например, её отслоения.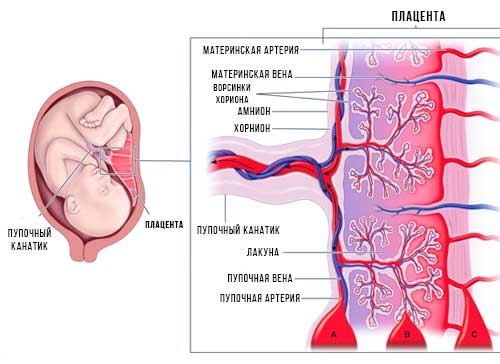 Это могут быть:
Это могут быть:
- тянущие боли, чувство тяжести в области живота;
- кровянистые выделения при низком расположении плаценты — тревожный сигнал того, что необходимо вызывать скорую помощь;
- замирание плода в утробе на продолжительное время или же, наоборот, его слишком бурная активность — это вызвано гипоксией;
- на УЗИ при такой патологии в 50% случаев является неправильное предлежание плода;
- в 30% случаев женщины мучаются сильным токсикозом.
Сама беременная не может заподозрить у себя низкое расположение плаценты. Это можно увидеть только на плановых УЗИ, которые необходимо проходить всем обязательно. После ультразвукового обследования смогут не только уточнить или опровергнуть диагноз, но и определить вид патологии.
Лечение и профилактика низкой плацентации
Ведение беременности при низкой плацентации всегда очень внимательное. Женщине предстоит много раз пройти УЗИ, ограничивать физическую активность и прекратить половую жизнь.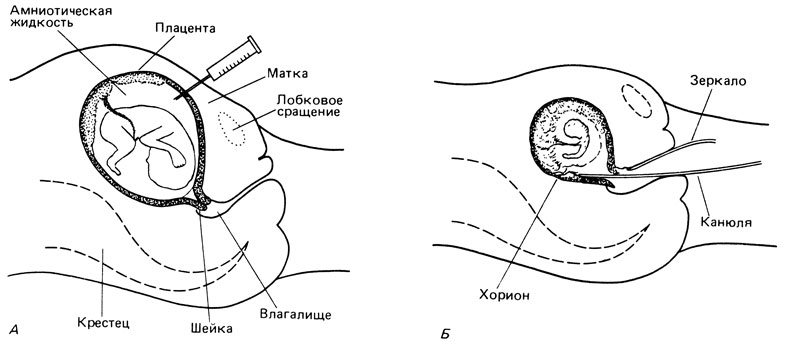 Продолжительное время повышенный тонус матки может провоцировать отслойку неправильно расположенной плаценты, оттуда и кровотечения, и возможно смерть плода в результате острой гипоксии, если отслойка плаценты большая. Кровотечение может спровоцировать даже гинекологический осмотр шейки матки, потому без особых на то причин врачи стараются не проводить осмотры на кресле.
Продолжительное время повышенный тонус матки может провоцировать отслойку неправильно расположенной плаценты, оттуда и кровотечения, и возможно смерть плода в результате острой гипоксии, если отслойка плаценты большая. Кровотечение может спровоцировать даже гинекологический осмотр шейки матки, потому без особых на то причин врачи стараются не проводить осмотры на кресле.
Слушайтесь врачей и надейтесь на лучшее. Многие женщины рожают самостоятельно или с помощью операции кесарева сечения здоровых деток при низком предлежании плаценты.
Если Вам необходима помощь опытного гинеколога, записывайтесь на консультацию по телефонам 8 (49244) 9-32-49, 8 (910) 174-77-72.
Новости Все
Поздравляем Вас с радостным и светлым весенним праздником, с Пасхой!
Подробнее…
ЛЕЧЕНИЕ ПАТОЛОГИЙ ШЕЙКИ МАТКИ В МЕДЦЕНТРЕ «СЕВЕР»
Подробнее.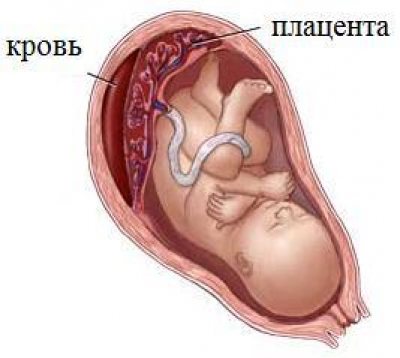 ..
..
Опрос
Каких еще врачей Вы хотели бы видеть в нашем центре
| Травматолог | |
| Хирург | |
| Офтальмолог | |
| Стоматолог | |
| Аллерголог | |
| Онколог |
Другой вариант ответа?
Макаров И.О. • Предлежание плаценты
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
При нормальном течении беременности плацента обычно располагается в области дна или тела матки, по задней стенке, с переходом на боковые стенки, т.е. в тех областях, где лучше всего кровоснабжаются стенки матки. На передней стенке плацента располагается несколько реже, так как передняя стенка матки подвергается значительно большим изменениям, чем задняя. Кроме того, расположение плаценты по задней стенке предохраняет ее от случайных травм.
Кроме того, расположение плаценты по задней стенке предохраняет ее от случайных травм.
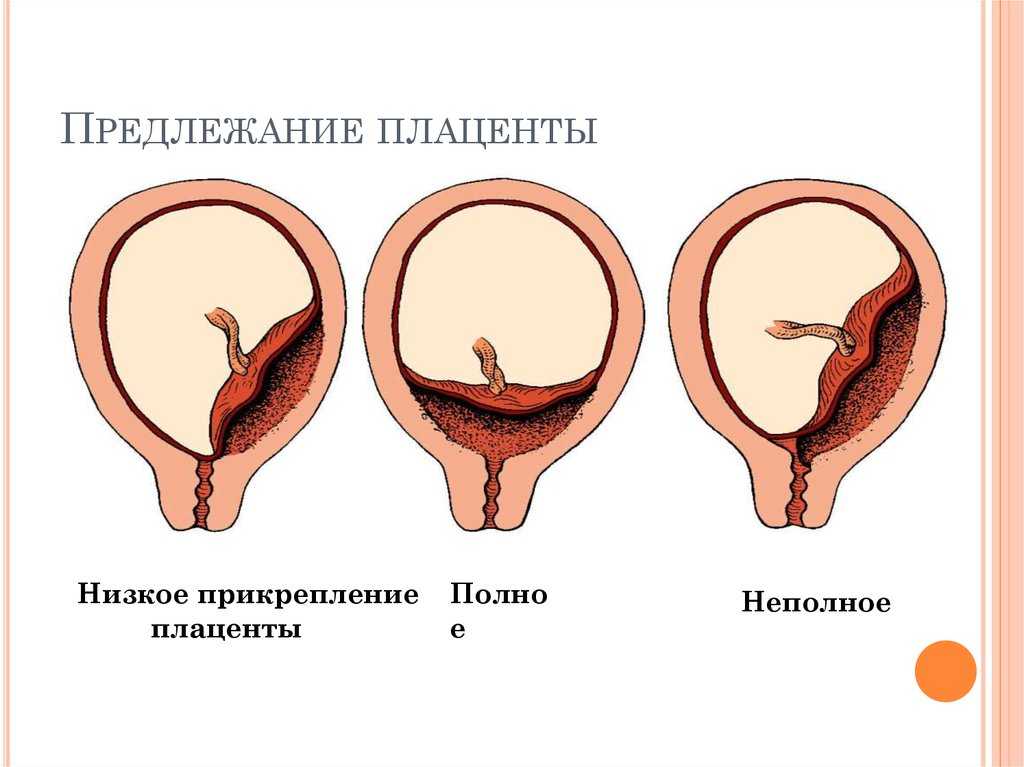
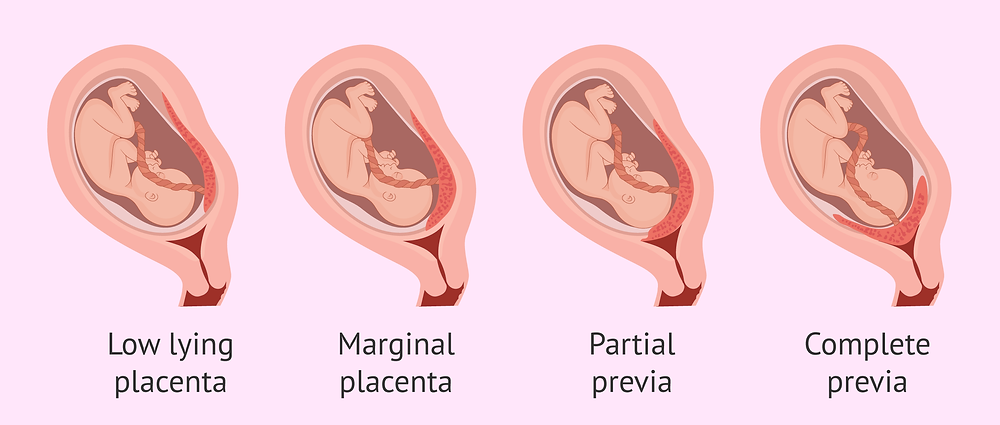
Предлежание плаценты — это патология, при которой плацента располагается в нижних отделах матки по любой стенке, частично или полностью перекрывая область внутреннего зева. Частота возникновения предлежания плаценты составляет в среднем от 0,1% до 1% от общего числа родов.
Если плацента только частично перекрывает область внутреннего зева, то — это неполное предлежание, которое отмечается с частотой 70-80% от общего числа предлежаний. Если плацента полностью перекрывает область внутреннего зева то, это является полным предлежанием плаценты. Такой вариант встречается с частотой 20-30%.
Различают также и низкое расположение плаценты, когда её край находится на более низком уровне, чем это должно быть в норме, но не перекрывает область внутреннего зева.
Причины формирования низкого расположения или предлежания плаценты
Существует несколько причин формирования низкого расположения или предлежания плаценты. Наиболее частыми причинами являются патологические изменения внутреннего слоя матки (эндометрия) вследствие воспаления, оперативных вмешательств (выскабливания, кесарево сечение, удалением миоматозных узлов и др.), многократных осложненных родов. Кроме того, нарушения прикрепления плаценты могут быть обусловлены миомой матки, эндометриозом, недоразвитием матки, истмикоцервикальной недостаточностью, воспалением шейки матки, многоплодной беременностью. Следует отметить, что предлежание плаценты более характерно для повторно беременных женщин, чем для первородящих. В связи с этими факторами, плодное яйцо, попадающее в полость матки после оплодотворения не может своевременно имплантироваться в верхних отделах матки, и этот процесс осуществляется только тогда, когда плодное яйцо опустилось уже в ее нижние отделы.
Наиболее частыми причинами являются патологические изменения внутреннего слоя матки (эндометрия) вследствие воспаления, оперативных вмешательств (выскабливания, кесарево сечение, удалением миоматозных узлов и др.), многократных осложненных родов. Кроме того, нарушения прикрепления плаценты могут быть обусловлены миомой матки, эндометриозом, недоразвитием матки, истмикоцервикальной недостаточностью, воспалением шейки матки, многоплодной беременностью. Следует отметить, что предлежание плаценты более характерно для повторно беременных женщин, чем для первородящих. В связи с этими факторами, плодное яйцо, попадающее в полость матки после оплодотворения не может своевременно имплантироваться в верхних отделах матки, и этот процесс осуществляется только тогда, когда плодное яйцо опустилось уже в ее нижние отделы.
Наиболее частым проявлением при предлежании плаценты является повторяющееся кровотечение из половых путей. Кровотечения могут возникать в различные периоды беременности, начиная с самых ранних ее сроков.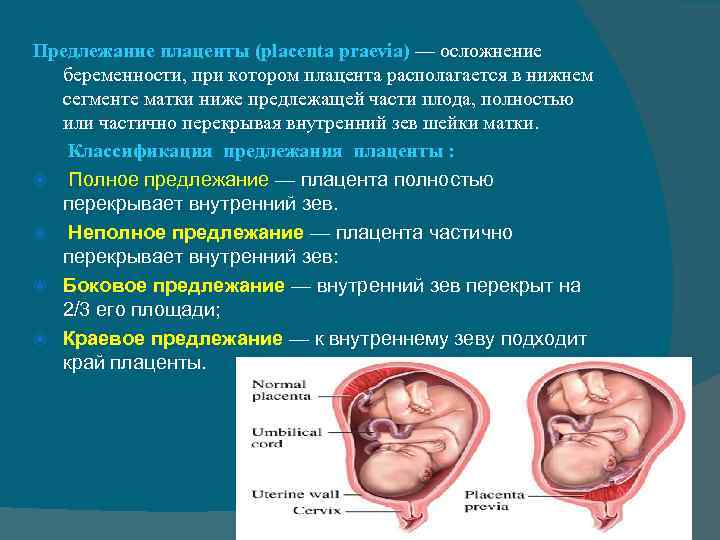 Однако чаще всего они наблюдаются уже во второй половине беременности вследствие формирования нижнего сегмента матки. В последние недели беременности, когда сокращения матки становятся более интенсивными, кровотечения могут усиливаться.
Однако чаще всего они наблюдаются уже во второй половине беременности вследствие формирования нижнего сегмента матки. В последние недели беременности, когда сокращения матки становятся более интенсивными, кровотечения могут усиливаться.
Причина кровотечений заключается в повторяющейся отслойке плаценты, которая неспособна растягиваться вслед за растяжением стенки матки при прогрессировании беременности или начале родовой деятельности. При этом плацента частично отслаивается, и кровотечение происходит из сосудов матки. Плод не теряет кровь. Однако ему угрожает кислородное голодание, так как отслоившаяся часть плаценты не участвует в газообмене.
Провоцирующими факторами возникновения кровотечения при беременности могут быть: физическая нагрузка, резкое кашлевое движение, влагалищное исследование, половой акт, повышение внутрибрюшного давления при запоре, тепловые процедуры (горячая ванна, сауна).
При полном предлежании плаценты кровотечение часто появляется внезапно, без болевых ощущений, и может быть очень обильным. Кровотечение может прекратиться, но спустя некоторое время возникнуть вновь, или может продолжаться в виде скудных выделений. В последние недели беременности кровотечение возобновляется и/или усиливается.
Кровотечение может прекратиться, но спустя некоторое время возникнуть вновь, или может продолжаться в виде скудных выделений. В последние недели беременности кровотечение возобновляется и/или усиливается.
При неполном предлежании плаценты кровотечение может начаться в самом конце беременности. Однако чаще это происходит в начале родов. Сила кровотечения зависит от величины предлежащего участка плаценты. Чем больше предлежит плацентарной ткани, тем раньше и сильнее начинается кровотечение.
Повторяющиеся кровотечения при беременности, осложненной предлежанием плаценты в большинстве случаев приводят к развитию анемии.
Беременность при предлежании плаценты часто осложняется угрозой прерывания, что, обусловлено теми же причинами, что и возникновение неправильного расположения плаценты. Преждевременные роды чаще всего имеют место у пациенток с полным предлежанием плаценты.
Для беременных с предлежанием плаценты характерно наличие пониженного артериального давления, что встречается в 25%-34% наблюдений.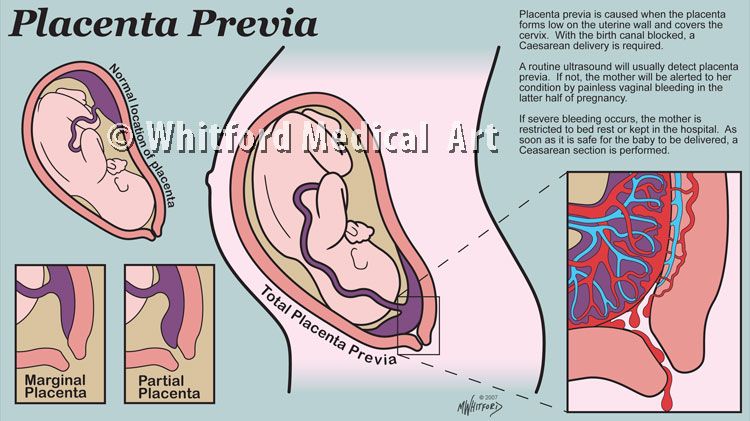
Гестоз (нефропатия, поздний токсикоз) также не является исключением для беременных с предлежанием плаценты. Это осложнение, протекающее на фоне нарушения функции ряда органов и систем, а также и с явлениями нарушений свертываемости крови в значительной степени ухудшает характер повторяющихся кровотечений.
Предлежание плаценты часто сопровождается плодово-плацентарная недостаточностью, нехваткой кислорода для плода и задержкой его развития. Отслоившаяся часть плаценты выключается из общей системы маточно-плацентарного кровообращения и не участвует в газообмене. При предлежании плаценты нередко формируется неправильное положение плода (косое, поперечное) или тазовое предлежание, которые в свою очередь сопровождаются определенными осложнениями.
В акушерской практике широко укоренился термин «миграция плаценты», который, на самом деле, не отражает реальной сущности происходящего. Изменение расположения плаценты осуществляется за счет изменения строения нижнего сегмента матки в процессе беременности и направленности роста плаценты в сторону лучшего кровоснабжения участков стенки матки (к дну матки) по сравнению с ее нижними отделами. Более благоприятный прогноз с точки зрения миграции плаценты отмечается при её расположении на передней стенке матки. Обычно процесс «миграции плаценты протекает в течение 6-10 нед и завершается к середине 33-34 неделям беременности.
Более благоприятный прогноз с точки зрения миграции плаценты отмечается при её расположении на передней стенке матки. Обычно процесс «миграции плаценты протекает в течение 6-10 нед и завершается к середине 33-34 неделям беременности.
Диагностика предлежания плаценты
Выявление предлежания плаценты не представляет особых сложностей. О наличии предлежания плаценты могут свидетельствовать жалобы беременной на кровотечения. При этом повторяющиеся кровотечения со второй половине беременности, как правило, связаны с полным предлежанием плаценты. Кровотечение в конце беременности или в начале родов чаще связано с неполным предлежанием плаценты.
При наличии кровотечений следует внимательно осмотреть стенки влагалища и шейку матки при помощи зеркал для исключения травмы или патологии шейки матки, которые также могут сопровождаться наличием кровяных выделений.
При влагалищном исследовании беременной также легко выявляются четкие диагностические признаки, указывающие на неправильное расположение плаценты. Однако такое исследование необходимо выполнять максимально бережно, с соблюдением всех необходимых правил предотвращения возможного кровотечения.
Однако такое исследование необходимо выполнять максимально бережно, с соблюдением всех необходимых правил предотвращения возможного кровотечения.
В настоящее время наиболее объективным и безопасным методом диагностики предлежания плаценты является ультразвуковое исследование (УЗИ), которое позволяет установить сам факт предлежания плаценты и вариант предлежания (полное, неполное), определить размеры, структуру и площадь плаценты, оценить степень отслойки, а также получить точное представление о миграции плаценты.
Если при УЗИ выявлено полное предлежание плаценты, то влагалищное исследование проводить, вообще не следует. Критерием низкого расположения плаценты в III триместре беременности (28 — 40 нед) является расстояние от края плаценты до области внутреннего зева 5 см и менее. О предлежании плаценты свидетельствует обнаружение плацентарной ткани в области внутреннего зева.
О характере локализации плаценты во II и III триместрах беременности (до 27 недель) судят по соотношению расстояния от края плаценты до области внутреннего зева, с величиной диаметра (БПР) головы плода.
При выявлении неправильного расположения плаценты следует проводить динамическое исследование для контроля за ее «миграцией». Для этих целей целесообразно выполнение как минимум трехкратного эхографического контроля на протяжении беременности в 16, 24-26 и в 34-36 недель.
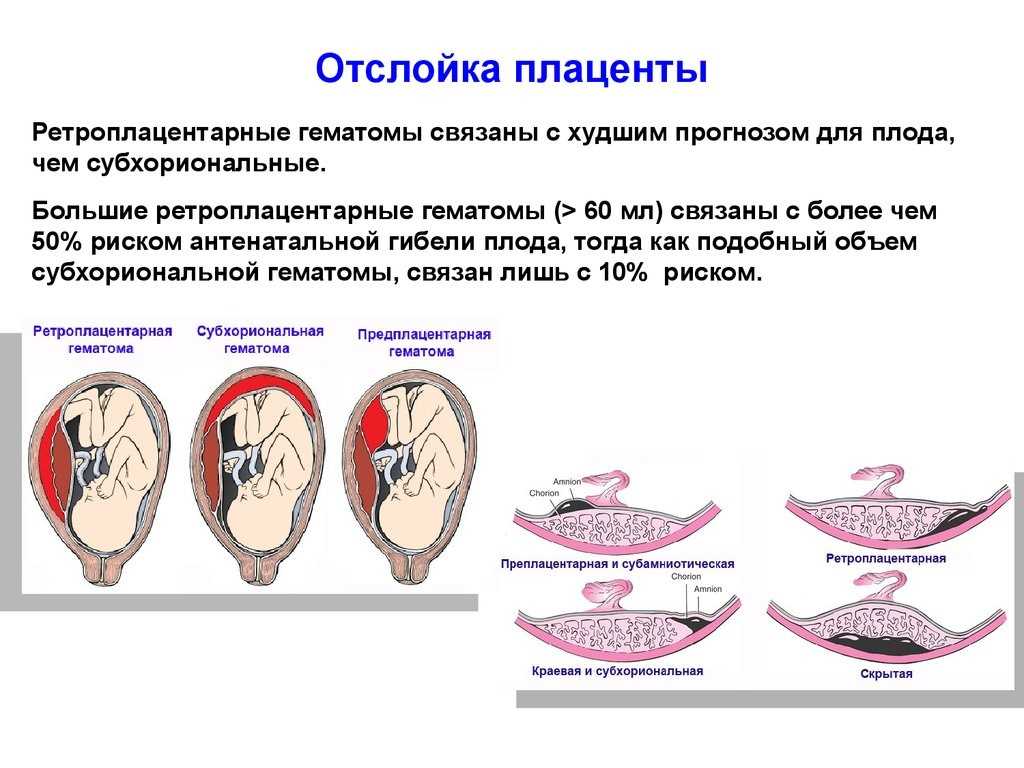
УЗИ следует проводить при умеренном наполнении мочевого пузыря. С помощью УЗИ возможно также определение наличия скопления крови (гематомы) между плацентой и стенкой матки при отслойке плаценты (в том случае если не произошло излитие крови из полости матки). Если участок отслойки плаценты занимает не более 1/4 площади плаценты, то прогноз для плода является относительно благоприятным. В том случае если гематома занимает более 1/3 площади плаценты, то чаще всего это приводит к гибели плода.
Медицинское сопровождение беременных с предлежанием плаценты
Характер ведения и лечение беременных с предлежанием плаценты зависит от выраженности кровотечения и величины кровопотери.
В первой половине беременности если кровяные выделения отсутствуют, то беременная может находиться дома под амбулаторным контролем с соблюдением режима исключающего действие провоцирующих факторов способных вызвать кровотечение (ограничение физической нагрузки, половой жизни, стрессовых ситуаций и т.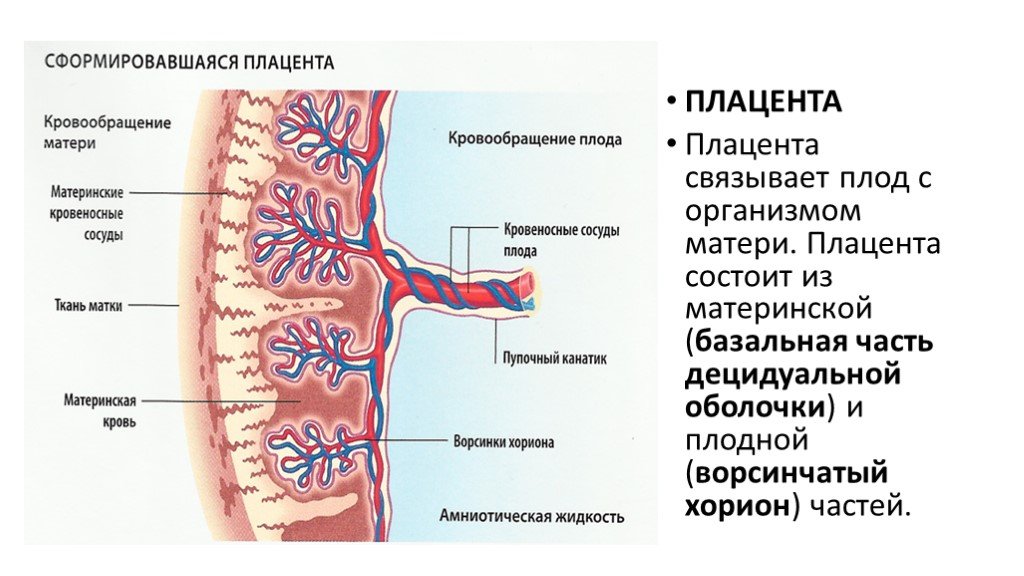 п.)
п.)
Наблюдение и лечение при сроке беременности свыше 24 недель осуществляется только в акушерском стационаре.
Лечение, направленное на продолжение беременности до 37-38 недель возможно, если кровотечение необильное, а общее состояние беременной и плода удовлетворительное. Даже, несмотря на прекращение кровянистых выделений из половых путей, беременные с предлежанием плацента ни при каких условиях не может быть выписана из стационара до родов.
Ведение беременных в акушерском стационаре предусматривает: соблюдение строгого постельного режима; применение лекарств обеспечивающих оптимизацию нормализацию сократительной деятельности; лечение анемии и плодово-плацентарной недостаточности.
Показаниями к кесареву сечению в экстренном порядке независимо от срока беременности являются: повторяющиеся кровотечения; сочетание небольших кровопотерь с анемией и снижением артериального давления; одномоментная обильная кровопотеря; полное предлежание плаценты и начавшееся кровотечение.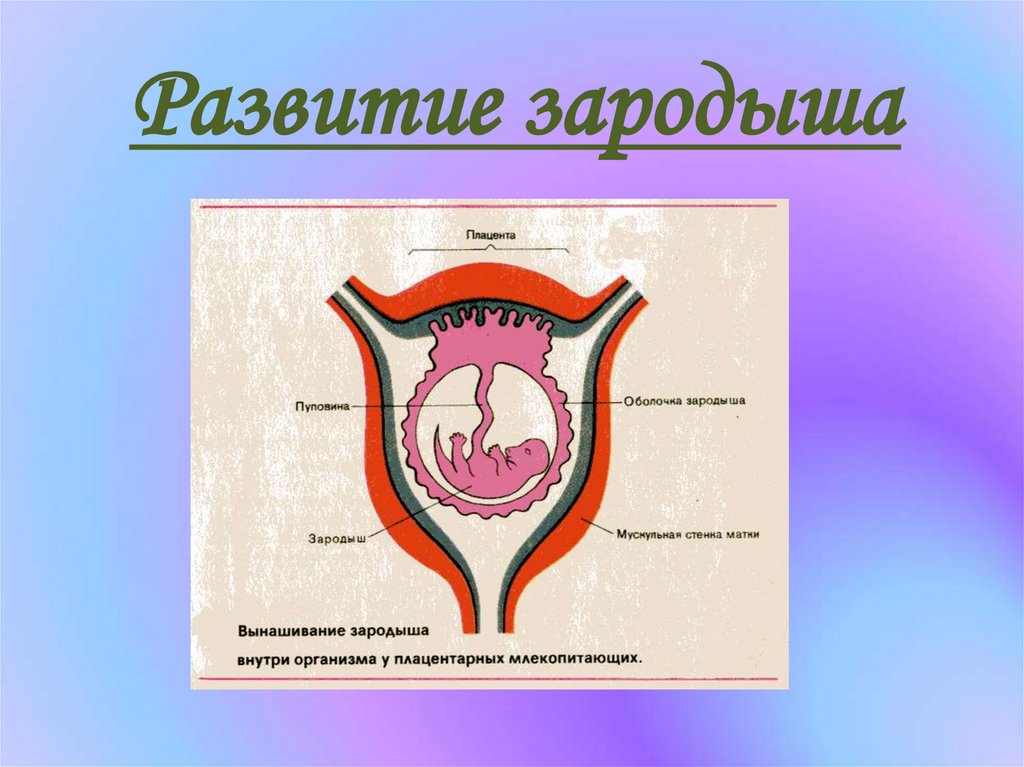
Операцию выполняют по жизненным показаниям со стороны матери независимо от срока беременности и состояния плода.
В том случае если беременность удалось доносить до 37-38 недель и сохраняется предлежание плаценты, в зависимости от сложившейся ситуации в индивидуальном порядке выбирают наиболее оптимальный способ родоразрешения.
Абсолютным показанием к кесареву сечению в плановом порядке является полное предлежание плаценты. Роды через естественные родовые пути в этой ситуации невозможны, так как перекрывающая внутренний зев плацента, не позволяет предлежащей части плода (головка плода или тазовый конец) вставиться во вход таз. Кроме того, в процессе нарастания сокращений матки, плацента будет отслаивается все более и более, а кровотечение значительно усиливается.
При неполном предлежании плаценты и при наличии сопутствующих осложнений (тазовое предлежание, неправильное положение плода, рубец на матке, многоплодная беременность, выраженное многоводие, узкий таз, возраст первородящей старше 30 лет и др. ) следует также выполнить кесарево сечение в плановом порядке.
) следует также выполнить кесарево сечение в плановом порядке.
Если вышеуказанные сопутствующие осложнения отсутствуют и нет кровяных выделений, то можно дождаться момента начала самостоятельной родовой деятельности с последующим ранним вскрытием плодного пузыря. В том случае если после вскрытия плодного пузыря все-таки началось кровотечение, то необходимо решить вопрос о выполнении кесарева сечения.
Если при неполном предлежании плаценты кровотечение возникает до начала родовой деятельности, то вскрывают плодный пузырь. Необходимость и целесообразность этой процедуры обусловлена тем, что при вскрытии плодных оболочек головка плода вставляется во вход в таз и прижимает отслоившуюся часть плаценты к стенке матки и таза, что способствует прекращению дальнейшей отслойки плаценты и остановке кровотечения. Если кровотечение после вскрытия плодного пузыря продолжается и/или шейка матки незрелая, то производят кесарево сечение. В случае остановки кровотечения возможно ведение родов через естественные родовые пути (при благоприятной акушерской ситуации).
Кровотечение может начаться и на ранних этапах развития родовой деятельности с момента первых схваток. В этом случае также показано раннее вскрытие плодного пузыря.
Таким образом, ведение родов при неполном предлежании плаценты через естественные родовые пути возможно, если: кровотечение остановилось после вскрытия плодного пузыря; шейка матки зрелая; родовая деятельность хорошая; имеется головное предлежание плода.
Однако кесарево сечение является одним из наиболее часто избираемых акушерами методов родоразрешения при предлежании плаценты и выполняется с частотой 70% -80% при данной патологии.
Другими типичными осложнениями в родах при неполном предлежании плаценты являются слабость родовой деятельности и недостаточное снабжение плода кислородом (гипоксия плода). Обязательным условием ведения родов через естественные родовые пути является постоянный мониторный контроль за состоянием плода и сократительной деятельностью матки.
После рождения ребенка кровотечение может возобновиться из-за нарушения процесса отделения плаценты, так как плацентарная площадка располагается в нижних отделах матки, сократительная способность которых снижена.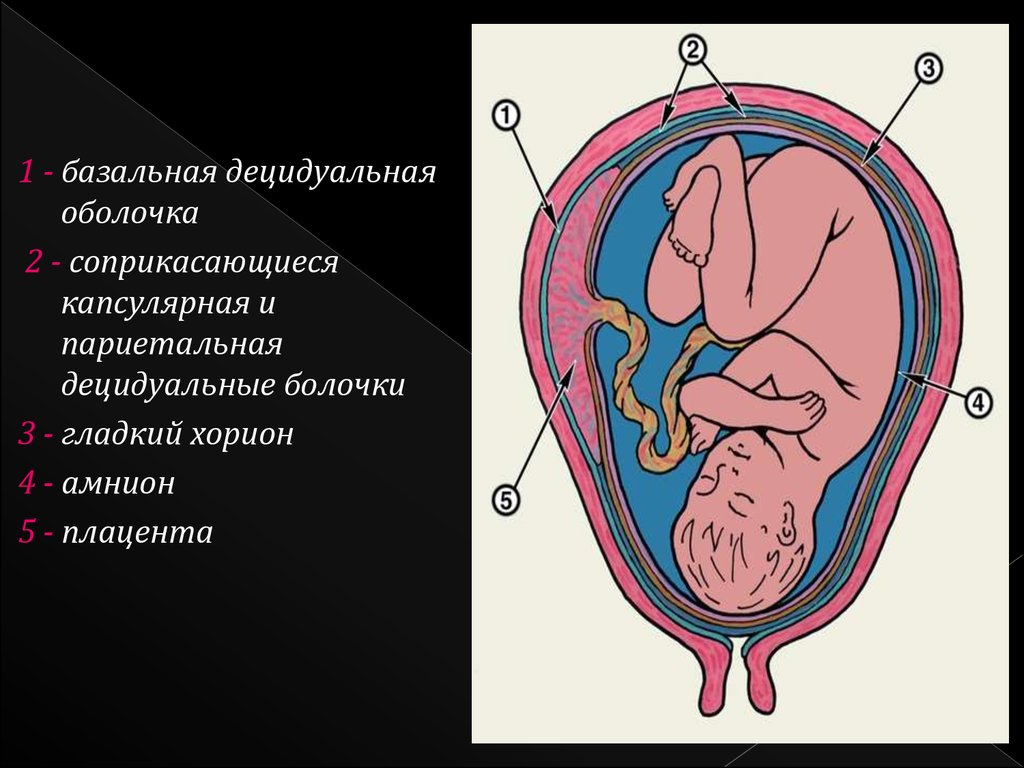
Обильные кровотечения нередко возникают в раннем послеродовом периоде в связи со снижением тонуса матки и повреждением обширной сосудистой сети шейки матки.
Профилактика предлежания плаценты
Профилактика предлежания плаценты заключается в уменьшении количества абортов, в раннем выявлении и лечении различных воспалительных заболеваний органов репродуктивной системы и гормональных нарушений.
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Эмбриология, плацента — StatPearls — NCBI Bookshelf
Введение
Плацента — жизненно важный орган, выполняющий множество функций, таких как эндокринная, иммунная и физиологическая. Плацента формируется постепенно в течение первых трех месяцев беременности, а после четвертого месяца растет параллельно развитию матки. После завершения он напоминает губчатый диск диаметром 20 см и толщиной 3 см.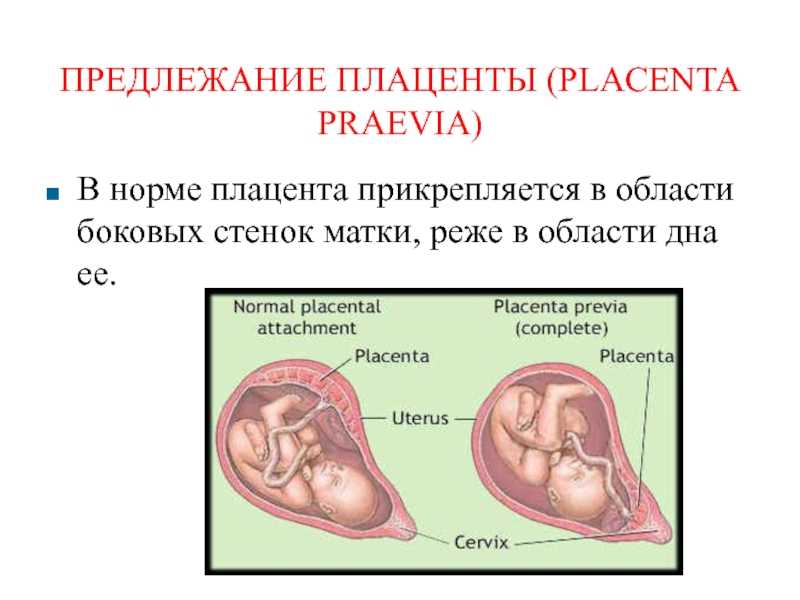 Это временный орган, генетические характеристики которого идентичны характеристикам развивающегося ребенка. Плацента взаимодействует с окружающей средой, в которой она находится, и наоборот. Правильное развитие плаценты необходимо для успешной беременности. Этот тонкий орган состоит из нескольких слоев ткани, которые должны нормально развиваться для правильного функционирования во время беременности. Без надлежащего функционирования могут быть разрушительные последствия для беременности.
Это временный орган, генетические характеристики которого идентичны характеристикам развивающегося ребенка. Плацента взаимодействует с окружающей средой, в которой она находится, и наоборот. Правильное развитие плаценты необходимо для успешной беременности. Этот тонкий орган состоит из нескольких слоев ткани, которые должны нормально развиваться для правильного функционирования во время беременности. Без надлежащего функционирования могут быть разрушительные последствия для беременности.
Развитие
Плацента представляет собой орган плода, состоящий из паренхимы, хориона, амниона и пуповины. Структуры плода формируются из зиготы и поэтому отделяют плод от эндометрия. Ткани плода формируются из хорионического мешка, в который входят амнион, хорион, желточный мешок и аллантоис. Эти ткани доставляются после рождения. Материнская часть происходит из эндометрия и называется децидуальной оболочкой. Децидуальная оболочка состоит из трех частей: базальная децидуальная оболочка (глубоко в месте имплантации), капсульная децидуальная оболочка (покрывает место имплантации) и париетальная децидуальная оболочка (все остальное) [1].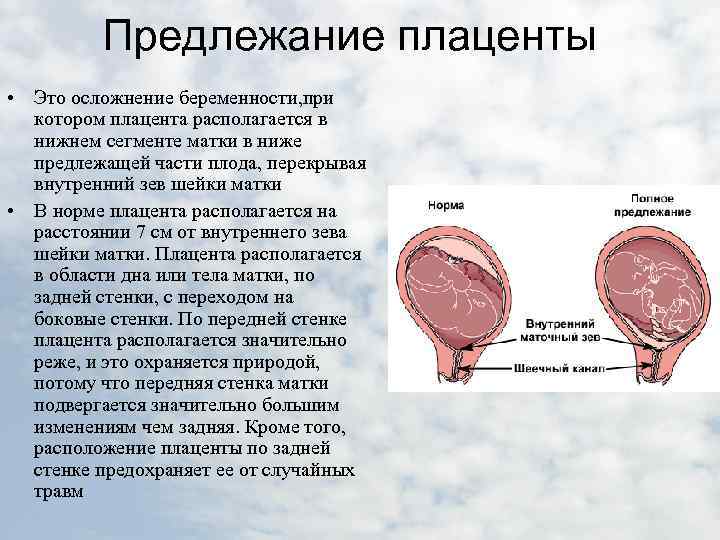
После оплодотворения оплодотворенная яйцеклетка превращается в морулу, которая разовьется в эмбрион и плодную плаценту. Внутренняя клеточная масса развивается в эмбриобласт, а наружная клеточная масса — в трофобласт. Затем морула поглощает жидкость и образует бластоцисту с трофобластом, окружающим внутреннюю клеточную массу и жидкость. Бластоциста имплантируется в матку примерно через шесть дней после оплодотворения. Контакт трофобласта с эндометрием вызывает развитие синцитиотрофобласта, который секретирует хорионический гонадотропный гормон человека (ХГЧ), и цитотрофобласта, который секретирует ферменты, разрушающие связь между клетками эндометрия, поэтому синцитиотрофобласт может проникнуть в стенку эндометрия. И цитотрофобласт, и синцитиотрофобласт являются частью хориона, который развивается в плаценту вместе с экстраэмбриональной мезодермой.
Хорион образует плаценту и состоит из синцитиотрофобласта, цитотрофобласта и экстраэмбриональной мезодермы. Цитотрофобласт врастает в синцитиотрофобласт в виде пальцевидных отростков, которые называются первичными ворсинками хориона. Внезародышевая мезодерма разделяется на соматическую и внутренностную мезодерму, а соматическая мезодерма прорастает в первичные ворсинки, образуя вторичные ворсинки. Мезенхима дает начало клеткам крови и сосудам, которые при формировании обозначают третичные ворсинки. От ворсинок отрастают капиллярные русла, которые соединяются с сердцем зародыша. Материнская кровь, текущая по эмбриональным капиллярам, обеспечивает плод кислородом и питательными веществами. Ворсинки продолжают расти и разветвляются на хорион ворсинок, который представляет собой плаценту плода.[5]
Внезародышевая мезодерма разделяется на соматическую и внутренностную мезодерму, а соматическая мезодерма прорастает в первичные ворсинки, образуя вторичные ворсинки. Мезенхима дает начало клеткам крови и сосудам, которые при формировании обозначают третичные ворсинки. От ворсинок отрастают капиллярные русла, которые соединяются с сердцем зародыша. Материнская кровь, текущая по эмбриональным капиллярам, обеспечивает плод кислородом и питательными веществами. Ворсинки продолжают расти и разветвляются на хорион ворсинок, который представляет собой плаценту плода.[5]
По мере развития клетки цитотрофобласта продолжают расширяться через синцитиотрофобласт, чтобы в конечном итоге сформировать цитотрофобластическую оболочку. По мере повышения уровня прогестерона соединительная ткань децидуальной оболочки превращается в «клетки децидуальной оболочки», которые помогают защитить матку от инвазии синцитиотрофобласта. По мере роста мешка капсульная децидуальная оболочка ворсинок дегенерирует и в конечном итоге исчезает, сливаясь с париетальной децидуальной оболочкой.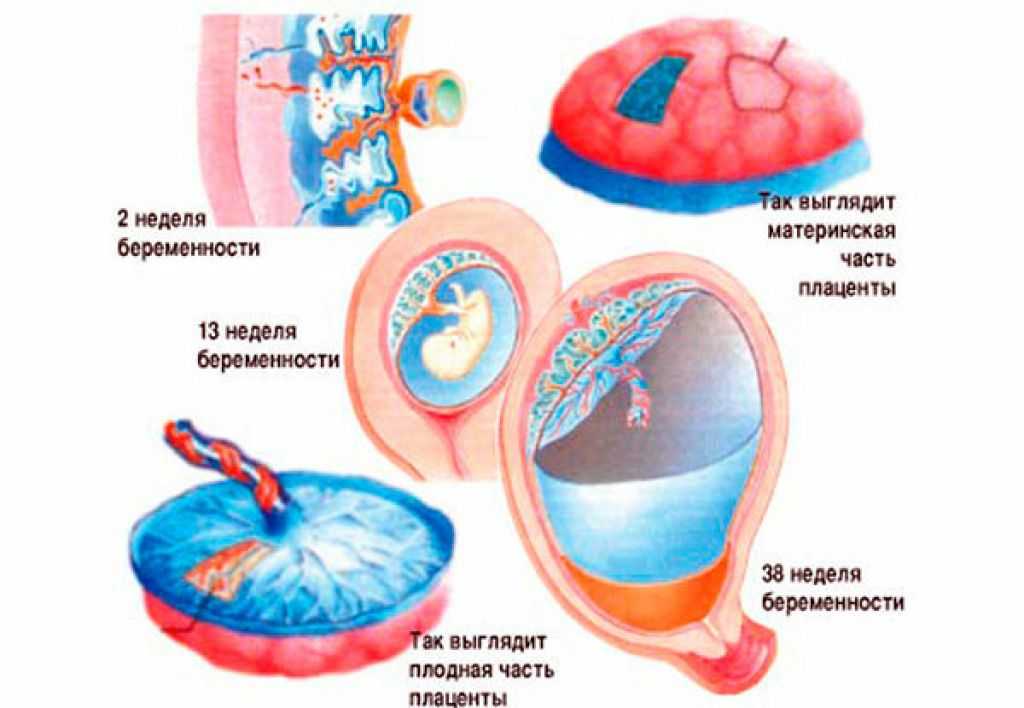
Амниотический мешок увеличивается быстрее, чем хорионический мешок, что приводит к тому, что они в конечном итоге соприкасаются и сливаются в амниохориальную мембрану. Затем амниохориальная мембрана сливается с капсульной децидуальной оболочкой и, в конечном счете, с париетальной децидуальной оболочкой для обеспечения стабильности. Амниохориальная оболочка разрывается во время родов. Амниохориальная оболочка с сосудами плода составляет хорионическую пластинку. Части базальной децидуальной оболочки врастают в пластинку хориона, разделяя ее на отдельные перегородки, называемые семядолями, каждая из которых содержит стволовые ворсинки.
Плодо-материнское соединение обеспечивает стабильность хориона. Ворсинки хориона, прикрепляющиеся к базальной децидуальной оболочке, служат якорем хорионического мешка плода к эндометрию. Сосуды эндометрия, называемые спиральными артериями, проходят через отверстия в цитотрофобластической оболочке и располагаются внутри ворсинок, где они выпускают материнскую кровь для омывания ворсинок хориона в каждой семядоле; это позволяет материнской крови снабжать плод кислородом и питательными веществами через плацентарную мембрану.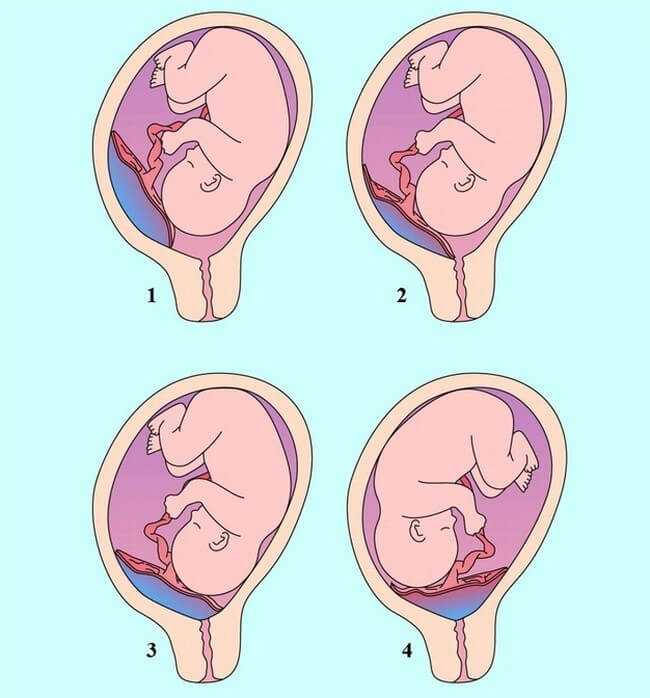 Вены эндометрия затем дренируют кровь. Хотя сосуды плода омываются материнской кровью, в норме эритроциты матери и плода не смешиваются [7].
Вены эндометрия затем дренируют кровь. Хотя сосуды плода омываются материнской кровью, в норме эритроциты матери и плода не смешиваются [7].
Плацентарная оболочка — это место, где мать и плод обмениваются газами, питательными веществами и т. д. Мембрана образуется из синцитиотрофобласта, цитотрофобласта, эмбриональной соединительной ткани (вартоново желе) и эндотелия кровеносных сосудов плода.
Пуповина служит для прикрепления плода к плаценте и состоит из двух пупочных артерий и одной пупочной вены.
Клеточная
Плацента имеет несколько клеточных структур для защиты здоровья плода. Мы можем найти вещества, которые являются частью суперсемейства АТФ-связывающих кассет (ABC), такие как белок множественной лекарственной устойчивости типа 1, белок устойчивости к раку молочной железы, белок множественной лекарственной устойчивости, подобный белкам типа 2 и 5.
Плаценту можно рассматривать как иммунный и эндокринный орган. Он продуцирует многие гормоны и факторы роста в аутокринном и паракринном режимах, такие как прогестерон, кортикотропин-рилизинг-гормон, хорионический гонадотропин человека, плацентарный лактоген человека, фактор роста фибробластов и многие другие.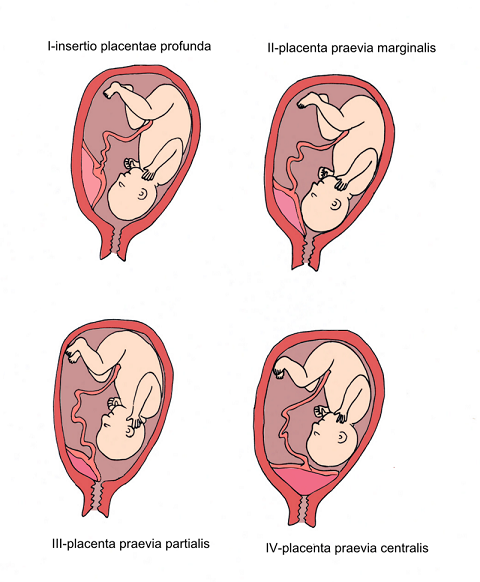
Биохимический
Плацента выполняет несколько метаболических функций, жизненно важных для здорового роста плода. Плацента может производить собственный гликоген и холестерин из материнской глюкозы и жирных кислот соответственно. Гликоген запасается в качестве энергии для плода, а холестерин используется для производства гормонов, таких как прогестерон, эстроген и глюкокортикоиды. Он также синтезирует пептидные гормоны, такие как хорионический гонадотропин человека (ХГЧ) и плацентарный лактоген человека (hPL), гормон роста (GH), фактор роста эндотелия сосудов (VEGF), кортикотропин-рилизинг-гормон (CRH), инсулиноподобный фактор роста (IGF). ), плацентарный фактор роста (PIGF) и цитокины.]
Молекулярный уровень
Несколько молекул взаимодействуют с плацентой. Например, лептин обеспечивает здоровье плаценты благодаря своему действию в качестве гомеостатического агента, пролиферации и синтеза белка в качестве антиапоптотической молекулы. В свою очередь лептин находится под контролем других веществ, таких как инсулин, многие факторы роста, хорионический гонадотропин человека, стероиды и гипоксия.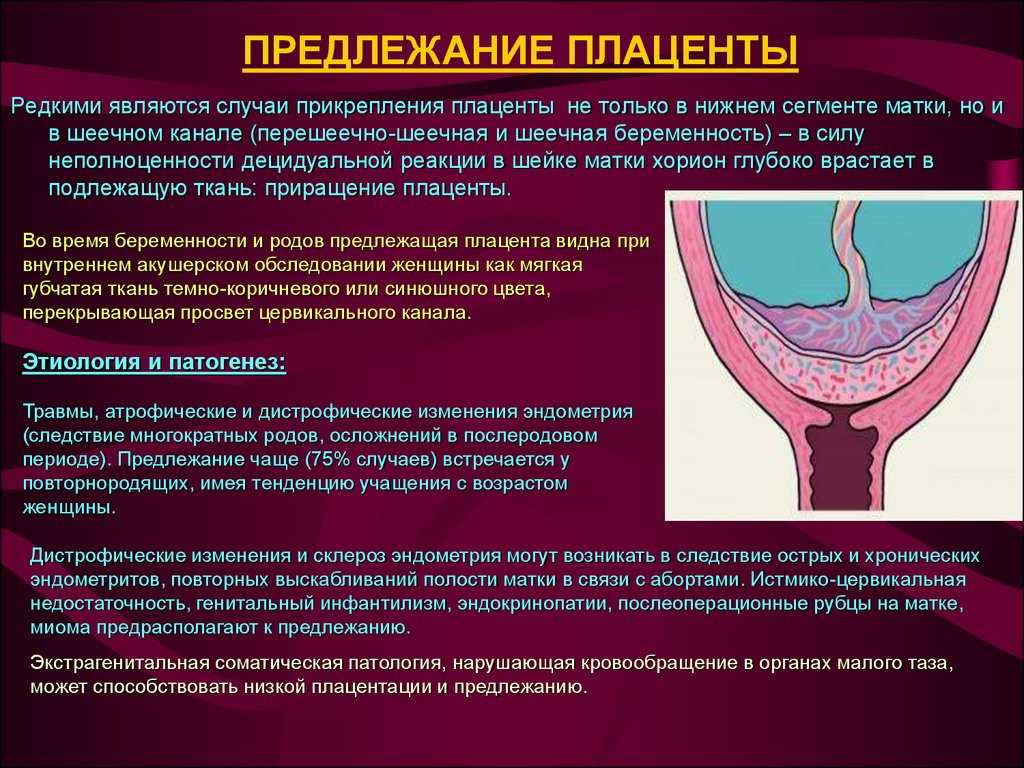
Функция
Плацента является средством связи между мамой и плодом. В плацентарной оболочке происходит обмен веществ между матерью и плодом. Этот обмен необходим для переноса газов, электролитов, гормонов, материнских антител, отходов плода и питательных веществ, таких как вода, аминокислоты, глюкоза, витамины и свободные жирные кислоты. Отходы плода включают мочевину, мочевую кислоту и билирубин. Также происходит обмен альфа-фетопротеина и других белков. Эти переносы полезны для плода, но многие вредные вещества могут проникать через плацентарную мембрану, например, некоторые лекарства, живые вакцины, угарный газ, анти-Rh-антитела и некоторые инфекционные агенты (инфекции ToRCHEs).[10][11] ] Сопротивление растворителя — это объемный поток воды, который приносит питательные вещества через плацентарную мембрану в каждую семядолю для поглощения. Чем выше давление, тем больше питательных веществ будет поглощено.[12] Растворенные вещества и газы поглощаются путем простой диффузии в зависимости от их молекулярного состава и свойств.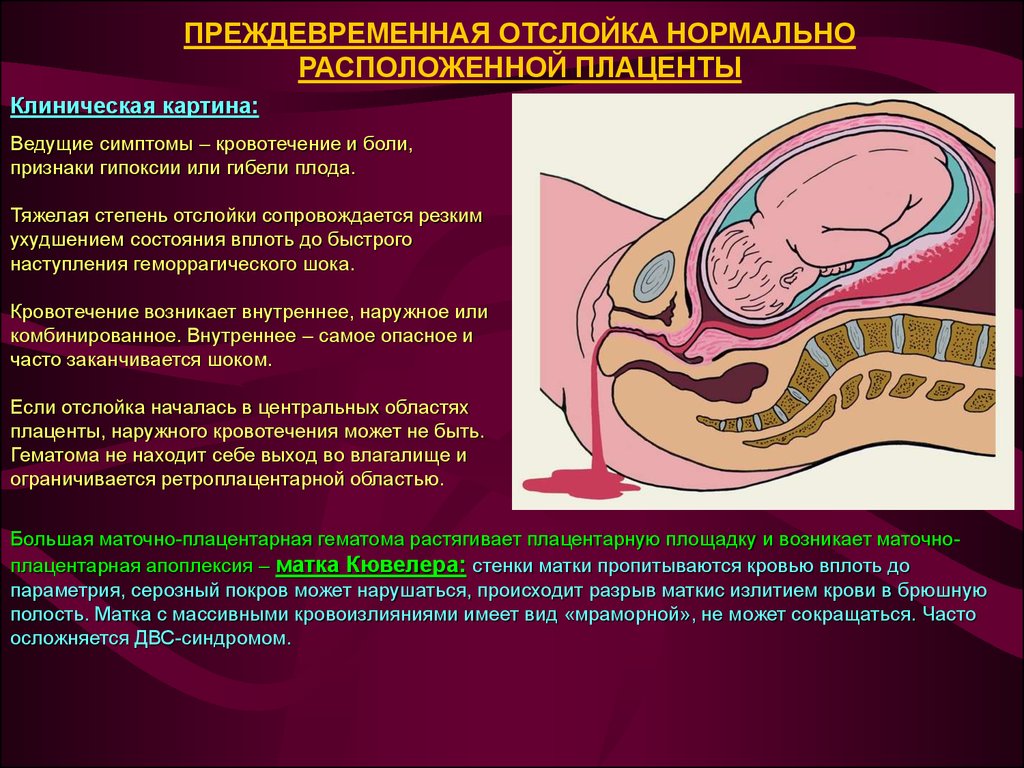 Кислород и углекислый газ хорошо проникают через ткани плаценты из-за их липофильности. Их обмен ограничен перфузией, что может вызвать ограничение роста плода при тканевой гипоксии.[13] Плацента также использует каналы для транспорта ионов по их электрохимическому градиенту, облегченную диффузию глюкозы с использованием белков-носителей и активный транспорт некоторых растворенных веществ.
Кислород и углекислый газ хорошо проникают через ткани плаценты из-за их липофильности. Их обмен ограничен перфузией, что может вызвать ограничение роста плода при тканевой гипоксии.[13] Плацента также использует каналы для транспорта ионов по их электрохимическому градиенту, облегченную диффузию глюкозы с использованием белков-носителей и активный транспорт некоторых растворенных веществ.
Из-за многочисленных питательных свойств многие млекопитающие, помимо человека, имеют привычку поедать извергнутую плаценту после родов.
Механизм
Кровообращение плода течет от плода к двум пупочным артериям (деоксигенированным), затем к хорионическим артериям в семядолях, через капиллярные русла для обмена газами с материнской кровью, затем обратно к плоду через единственную пупочную вену ( кислородом).
Тестирование
Биопсия ворсин хориона (CVS) — это либо трансабдоминальная, либо трансцервикальная процедура, при которой врачи берут образцы плаценты на сроке от 10 до 13 недель беременности для генетического тестирования. Этот тест выгоден тем, что его можно сделать намного раньше, чем амниоцентез, и, следовательно, получить результаты скрининга раньше. Если результаты приводят к прерыванию беременности, существует меньше рисков, чем позднее прерывание. Более ранняя беременность также приводит к менее точным результатам. Осложнения процедуры могут включать инфекцию, кровотечение, повреждение плода и гибель плода.[15][16]
Этот тест выгоден тем, что его можно сделать намного раньше, чем амниоцентез, и, следовательно, получить результаты скрининга раньше. Если результаты приводят к прерыванию беременности, существует меньше рисков, чем позднее прерывание. Более ранняя беременность также приводит к менее точным результатам. Осложнения процедуры могут включать инфекцию, кровотечение, повреждение плода и гибель плода.[15][16]
Амниоцентез — аналогичная трансабдоминальная процедура, при которой берутся амниотические жидкости для генетического анализа. Эту процедуру можно проводить в любое время после 15 недель. Амниотическая жидкость содержит клетки и вещества, созданные плодом, которые можно измерять для оценки таких заболеваний, как синдром Дауна, инфекции, дефекты нервной трубки, определение группы крови плода и развитие легких. Риски аналогичны CVS, включая инфекцию, повреждение плода или гибель плода, а также подтекание амниотической жидкости.[17]
Патофизиология
В норме смешение крови плода и матери не происходит.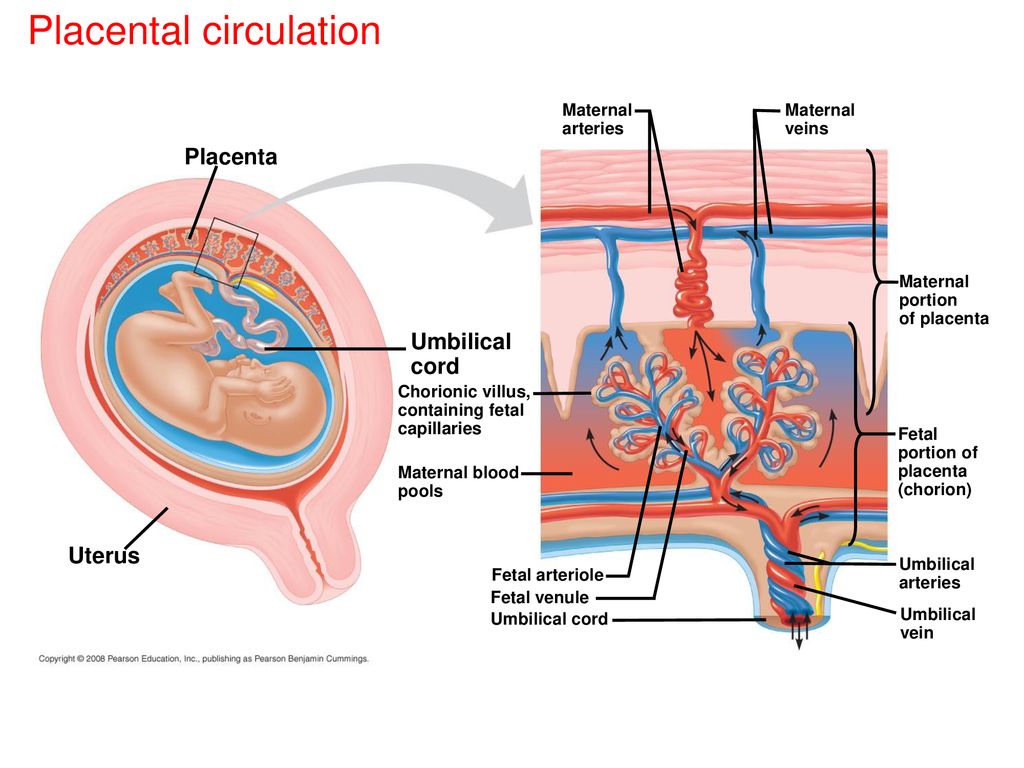 Хотя это возможно при специфических инфекционных агентах или небольших разрывах плацентарной оболочки, которые могут случиться во время родов. Если в мембране есть разрывы, материнские эритроциты могут попасть в кровоток плода и наоборот. Бледная трепонема (сифилитическая инфекция) может преодолевать барьер без разрывов мембраны. Toxoplasma gondii (токсоплазменная инфекция) может создавать собственные разрывы в мембране, проникать в кровоток плода и заражать его.
Хотя это возможно при специфических инфекционных агентах или небольших разрывах плацентарной оболочки, которые могут случиться во время родов. Если в мембране есть разрывы, материнские эритроциты могут попасть в кровоток плода и наоборот. Бледная трепонема (сифилитическая инфекция) может преодолевать барьер без разрывов мембраны. Toxoplasma gondii (токсоплазменная инфекция) может создавать собственные разрывы в мембране, проникать в кровоток плода и заражать его.
Эритробластоз плода, также называемый гемолитической болезнью новорожденных, возникает, когда мать вырабатывает антитела к резус-фактору плода после контакта резус-отрицательной матери с резус-положительной кровью плода. Мать вырабатывает антитела IgG к резус-фактору, которые могут проникать через плаценту. Первая беременность не является проблемой, потому что маме требуется время, чтобы вызвать эту реакцию, но это может вызвать проблемы при будущих беременностях резус-положительным плодом. Антитела могут проникать через плаценту и атаковать эритроциты плода, вызывая водянку плода (анемию и отек). [18]
[18]
Приращение плаценты — это когда плацента прорастает слишком далеко в миометрий из-за отсутствия децидуальной оболочки, что позволяет ворсинкам прикрепляться к миометрию. У placenta increta ворсинки погружаются еще глубже в миометрий. Placenta percreta — это когда плацента прорастает всю толщину миометрия и достигает серозной оболочки матки. Это вторжение в миометрий может вызвать кровотечение во время беременности и послеродовые кровотечения.
Здоровая пуповина должна содержать две пупочные артерии и одну пупочную вену. Если есть только одна артерия, у плода могут быть и другие дефекты, такие как задержка роста или генетические аномалии.[21] Также может быть несколько артерий, которые также могут быть связаны с генетическими аномалиями или врожденными дефектами. Также могут быть кисты в пуповине, заполненные жидкостью. Они видны на УЗИ на протяжении всей беременности.[23] Кисты могут рассасываться сами по себе, или, если кист несколько, могут быть и хромосомные аномалии.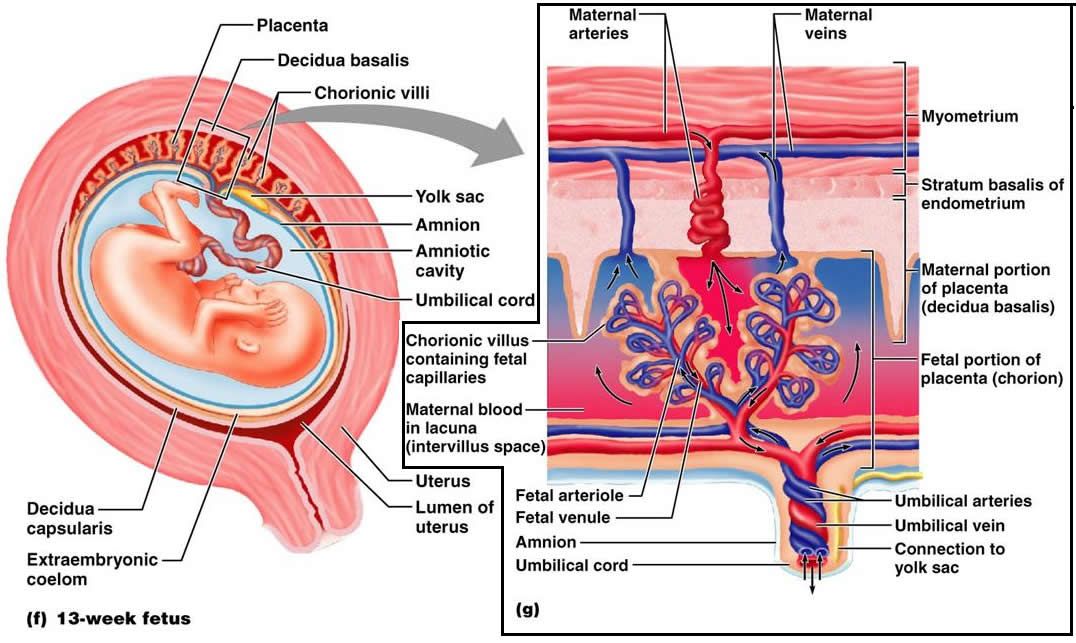 [24] Редким осложнением кисты может быть перекрут или гематома, которые потенциально могут вызвать гибель плода.[25] Истинные и ложные узлы также являются аномалией пуповины. Ложный узел – это когда сосуды внутри пуповины становятся извилистыми, но в самом пуповине узла нет. Нет никакого неблагоприятного результата, связанного с этим типом узла. Однако настоящий узел может быть опасен для плода. Настоящий узел — это когда пуповина фактически скручивается в узел, который потенциально может привести к гибели плода, если он слишком тугой.
[24] Редким осложнением кисты может быть перекрут или гематома, которые потенциально могут вызвать гибель плода.[25] Истинные и ложные узлы также являются аномалией пуповины. Ложный узел – это когда сосуды внутри пуповины становятся извилистыми, но в самом пуповине узла нет. Нет никакого неблагоприятного результата, связанного с этим типом узла. Однако настоящий узел может быть опасен для плода. Настоящий узел — это когда пуповина фактически скручивается в узел, который потенциально может привести к гибели плода, если он слишком тугой.
В норме пуповина прикрепляется к центру плаценты. Пуповина может аномально имплантироваться как в плод, так и в плаценту. В плаценте может быть оболочечное или краевое прикрепление. Оболочечная вставка — это когда сосуды разделяются по мере их развития между амнионом и хорионом по мере их роста к плаценте. По мере приближения к плаценте они обнажаются и не защищены вартоновым студнем; это может быть опасно, особенно при предлежании сосудов, когда сосуды особенно склонны к разрыву. [28] Краевое прикрепление — это место, где пуповина прикрепляется к краю плаценты. По-прежнему существует повышенный риск предлежания и отслойки плаценты, но не такой высокий, как при прикреплении оболочки [29].][30]
[28] Краевое прикрепление — это место, где пуповина прикрепляется к краю плаценты. По-прежнему существует повышенный риск предлежания и отслойки плаценты, но не такой высокий, как при прикреплении оболочки [29].][30]
Многие патологии плаценты видны при гистологическом исследовании, но некоторые патологии видны макроскопически.[31] Макроскопические патологии включают зеленое обесцвечивание мионекроза мекония, желто-зеленое обесцвечивание при васкулите, абсцессы, оранжевое обесцвечивание при инфаркте плаценты, массы, кисты, тромбы и неполное скопление тканей, указывающее на задержку плаценты. Плаценту можно хранить в холодильнике в свежем виде или помещать в фиксатор, если это необходимо для дальнейшего исследования после родов.
Отслойка плаценты является очень опасным обстоятельством: если это происходит, то на самом деле происходит отслоение плаценты от матки, вызывая сильное кровотечение, ставя под угрозу не только жизнь плода, который недополучает больше кислорода и питательных веществ необходимо, чтобы выжить, но и будущей матери. Отслойка плаценты может быть обусловлена: артериальной гипертензией, перерастяжением стенок матки из-за избытка околоплодных вод (многоводием), многоплодной беременностью, сахарным диабетом, употреблением наркотиков.
Отслойка плаценты может быть обусловлена: артериальной гипертензией, перерастяжением стенок матки из-за избытка околоплодных вод (многоводием), многоплодной беременностью, сахарным диабетом, употреблением наркотиков.
Клиническая значимость
Плацента является жизненно важным органом плода, необходимым для здоровой беременности как матери, так и плода. Неполное или нарушенное развитие плаценты также может вызвать аномалии развития плода или нежелательные явления у матери. На ранних сроках гестации можно провести забор плаценты для выявления аномалий развития плода, но эти процедуры сопряжены с риском для здоровья плода. В случае аномального родоразрешения или пороков развития плода плацента может пройти обследование на макроскопический и гистологический анализы.
Большинство заболеваний плаценты можно лечить, предохраняя беременную и плод от тяжелых последствий. Предлежание плаценты: часто низкая плацента возвращается в свое нормальное положение через несколько недель благодаря толчку матки.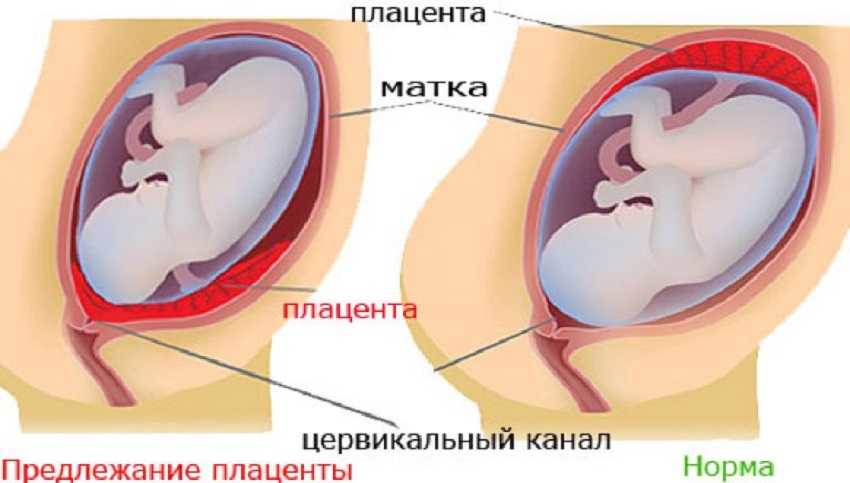 Если состояние низкой плаценты сохраняется на протяжении всей беременности, настоятельно рекомендуется кесарево сечение. Placenta accreta: для предотвращения риска кровотечения рекомендуется раннее кесарево сечение в течение нескольких недель. В этих случаях нельзя исключать гистерэктомию или удаление матки без исключения будущих беременностей. Возрастная плацента: диета, основанная на витаминах и кальции, и хорошие привычки (например, отказ от курения) предотвращает кальцификацию плаценты. Плацентарная недостаточность: специфического лечения этого типа проблемы не существует. Хорошо проходить периодические проверки рядом друг с другом, чтобы следить за развитием плода, а также, где это возможно, лечить поведение или патологию беременной. Отслойка плаценты: в зависимости от типа отслойки будет оцениваться гипотеза наблюдения за пациенткой с просьбой о полном покое или, как в большинстве случаев, продолжения кесарева сечения, в зависимости от срока беременности.
Если состояние низкой плаценты сохраняется на протяжении всей беременности, настоятельно рекомендуется кесарево сечение. Placenta accreta: для предотвращения риска кровотечения рекомендуется раннее кесарево сечение в течение нескольких недель. В этих случаях нельзя исключать гистерэктомию или удаление матки без исключения будущих беременностей. Возрастная плацента: диета, основанная на витаминах и кальции, и хорошие привычки (например, отказ от курения) предотвращает кальцификацию плаценты. Плацентарная недостаточность: специфического лечения этого типа проблемы не существует. Хорошо проходить периодические проверки рядом друг с другом, чтобы следить за развитием плода, а также, где это возможно, лечить поведение или патологию беременной. Отслойка плаценты: в зависимости от типа отслойки будет оцениваться гипотеза наблюдения за пациенткой с просьбой о полном покое или, как в большинстве случаев, продолжения кесарева сечения, в зависимости от срока беременности.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Рисунок
Развитие плодной оболочки и плаценты, Диаграмма, показывающая расширение амниона и разграничение пупка, Сердце, Передняя кишка, Эмбрион, Амниотическая полость, Плацентарные ворсинки. Предоставлено Gray’s Anatomy Plates
Рисунок
Развитие плодной оболочки и плаценты. Схема поперечного сечения, показывающая способ формирования амниона у цыпленка. Амниотические складки почти слились по средней линии, эктодерма синего цвета — мезодерма; красный – энтодерма (подробнее…)
Рисунок
Развитие оболочек плода и плаценты, Модель человеческого эмбриона длиной 1,3 мм, Нервный канал, Нервная борозда, Амнион, Стебель тела, Желточные вены, Энтодерма, Спланхническая мезодерма, Желточный мешок, Соматическая мезодерма. Предоставлено Gray’s Anatomy Plates (подробнее…)
Рисунок
Развитие оболочек плода и плаценты, схема плацентарного кровообращения, маргинальный синус, хорион, амнион, трофобласт, пупочные артерии и вены пуповины. Предоставлено Grey’s Anatomy Plates
Предоставлено Grey’s Anatomy Plates
Рисунок
На рисунке показана человеческая плацента. Предоставлено Бруно Бордони, доктором философии.
Ссылки
- 1.
Burton GJ, Jauniaux E. Что такое плацента? Am J Obstet Gynecol. 2015 окт; 213 (4 Дополнение): S6.e1, S6-8. [PubMed: 26428504]
- 2.
Гуттмахер А.Е., Мэддокс Ю.Т., Спонг С.Ю. Проект «Человеческая плацента»: структура, развитие и функция плаценты в режиме реального времени. Плацента. 2014 май; 35(5):303-4. [Бесплатная статья PMC: PMC3999347] [PubMed: 24661567]
- 3.
Wamaitha SE, Niakan KK. Предгаструляционное развитие человека. Curr Top Dev Biol. 2018;128:295-338. [PubMed: 29477167]
- 4.
Мэтр JL. Механика морфогенеза бластоцисты. Биол Клетка. 2017 сен; 109 (9): 323-338. [PubMed: 28681376]
- 5.
Солница-Крезель Л., Сепич Д.С. Гаструляция: создание и формирование зародышевых листков.
 Annu Rev Cell Dev Biol. 2012;28:687-717. [В паблике: 22804578]
Annu Rev Cell Dev Biol. 2012;28:687-717. [В паблике: 22804578]- 6.
Favaron PO, Carvalho RC, Borghesi J, Anunciação AR, Miglino MA. Амниотическая мембрана: разработка и возможные применения — обзор. Репрод Дом Аним. 2015 декабрь; 50 (6): 881-92. [PubMed: 26510939]
- 7.
Labarrere CA, DiCarlo HL, Bammerlin E, Hardin JW, Kim YM, Chaemsaithong P, Haas DM, Kassab GS, Romero R. Отсутствие физиологической трансформации спиральных артерий, эндотелиальных и активация клеток трофобласта и острый атероз базальной пластинки плаценты. Am J Obstet Gynecol. 2017 март; 216(3):287.e1-287.e16. [Бесплатная статья PMC: PMC5881902] [PubMed: 28034657]
- 8.
Hahn D, Blaschitz A, Korgun ET, Lang I, Desoye G, Skofitsch G, Dohr G. От глюкозы матери к гликогену плода: экспрессия ключевых регуляторов в организме человека плацента. Мол Хум Репрод. 2001 г., декабрь 7(12):1173-8. [PubMed: 11719595]
- 9.
Herrera E, Amusquivar E, López-Soldado I, Ortega H.
 Метаболизм липидов у матери и перенос липидов через плаценту. Горм Рез. 2006; 65 Дополнение 3:59-64. [PubMed: 16612115]
Метаболизм липидов у матери и перенос липидов через плаценту. Горм Рез. 2006; 65 Дополнение 3:59-64. [PubMed: 16612115]- 10.
Neu N, Duchon J, Zachariah P. Инфекции TORCH. Клин Перинатол. 2015 март;42(1):77-103, viii. [PubMed: 25677998]
- 11.
Каплан К. Гросс Исследование плаценты. Сург Патол Клин. 2013 март;6(1):1-26. [PubMed: 26838700]
- 12.
Браунбилл П., Махендран Д., Оуэн Д., Суонсон П., Торнбург К.Л., Нельсон Д.М., Сибли К.П. Денудации как парацеллюлярные пути альфафетопротеина и креатинина через синцитиотрофобласт человека. Am J Physiol Regul Integr Comp Physiol. 2000 март; 278(3):R677-83. [В паблике: 10712288]
- 13.
Картер А.М. Факторы, влияющие на транспорт газов через плаценту и снабжение плода кислородом. Дж Дев Физиол. 1989 Декабрь; 12 (6): 305-22. [PubMed: 2701106]
- 14.
Сибли С.П., Браунбилл П., Глейзер Д.Д., Гринвуд С.Л. Необходимы знания об обменной физиологии плаценты.
 Плацента. 2018 Апрель;64 Дополнение 1:S9-S15. [PubMed: 29370939]
Плацента. 2018 Апрель;64 Дополнение 1:S9-S15. [PubMed: 29370939]- 15.
Вапнер Р.Дж. Биопсия хориона. Obstet Gynecol Clin North Am. 1997 марта; 24(1):83-110. [PubMed: 9086520]
- 16.
Sileo FG, Curado J, Bhide A. Обзор современной клинической практики взятия проб ворсин хориона. Пренат Диагн. 2019 март; 39(4):299-302. [PubMed: 30682214]
- 17.
Baird PA, Yee IM, Sadovnick AD. Популяционное исследование отдаленных результатов после амниоцентеза. Ланцет. 1994 г., 22 октября; 344 (8930): 1134-6. [PubMed: 7934498]
- 18.
ALLEN FH, DIAMOND LK. Эритробластоз плода. N Engl J Med. 1957 10 октября; 257(15):705-12 продолжение. [PubMed: 13477375]
- 19.
Khong TY. Патология приращения плаценты, всемирная эпидемия. Джей Клин Патол. 2008 декабрь; 61 (12): 1243-6. [PubMed: 18641410]
- 20.
Пинас Каррильо А., Чандрахаран Э. Спектр приращения плаценты: факторы риска, диагностика и лечение с особой ссылкой на процедуру Triple P.
 Женское здоровье (Лондон). 2019 янв-декабрь;15:1745506519878081. [Бесплатная статья PMC: PMC6777059] [PubMed: 31578123]
Женское здоровье (Лондон). 2019 янв-декабрь;15:1745506519878081. [Бесплатная статья PMC: PMC6777059] [PubMed: 31578123]- 21.
Ghezzi F, Raio L, Di Naro E, Franchi M, Cromi A, Dürig P. Одиночные и множественные кисты пуповины на ранних сроках беременности: два разных образования. УЗИ Акушерство Гинекол. 2003 март; 21(3):215-9. [PubMed: 12666213]
- 22.
Бек Р., Наулти СМ. Пуповина человека с четырьмя артериями. Клин Педиатр (Фила). 1985 февраля; 24 (2): 118-9. [PubMed: 3967448]
- 23.
Аоки С., Хата Т., Ариюки Ю., Макихара К., Хата К., Китао М. Антенатальная диагностика аберрантных пупочных сосудов. Гинеколь Обстет Инвест. 1997;43(4):232-5. [PubMed: 9194620]
- 24.
Сепульведа В., Рейес М., Гонсалвеш Л.Ф. Две необычные аномалии пупочных сосудов у плода с трисомией 18. Prenat Diagn. 1998 октября; 18 (10): 1098-9. [PubMed: 9826906]
- 25.
Sepulveda W, Wong AE, Gonzalez R, Vasquez P, Gutierrez J.
 Смерть плода из-за гематомы пуповины: редкое осложнение кисты пуповины. J Matern Fetal Neonatal Med. 2005 Декабрь; 18 (6): 387-90. [PubMed: 16390804]
Смерть плода из-за гематомы пуповины: редкое осложнение кисты пуповины. J Matern Fetal Neonatal Med. 2005 Декабрь; 18 (6): 387-90. [PubMed: 16390804]- 26.
Гембрух Ю, Башат АА. Истинный узел пуповины: транзиторный констриктивный эффект на кровоток в пупочной вене, продемонстрированный с помощью допплерографии. УЗИ Акушерство Гинекол. 1996 г., июль; 8 (1): 53-6. [PubMed: 8843621]
- 27.
Hertzberg BS, Bowie JD, Bradford WD, Bolick D. Ложный узел пуповины: сонографический вид и дифференциальный диагноз. Дж. Клин Ультразвук. 1988 окт; 16 (8): 599-602. [PubMed: 3152409]
- 28.
Rocha J, Carvalho J, Costa F, Meireles I, do Carmo O. Вставка пуповины при одноплодной беременности: невыясненная причина экстренного кесарева сечения — клинический случай. Деловой представитель Акушер-гинеколог. 2012;2012:308206. [Бесплатная статья PMC: PMC3517836] [PubMed: 23243528]
- 29.
Nkwabong E, Njikam F, Kalla G.
 Исходы беременностей с маргинальной вставкой пуповины. J Matern Fetal Neonatal Med. 2021 апр;34(7):1133-1137. [PubMed: 31164018]
Исходы беременностей с маргинальной вставкой пуповины. J Matern Fetal Neonatal Med. 2021 апр;34(7):1133-1137. [PubMed: 31164018]- 30.
Эббинг С., Кисеруд Т., Джонсен С.Л., Альбрехтсен С., Расмуссен С. Распространенность, факторы риска и исходы прикрепления оболочечной и маргинальной пуповины: популяционное исследование 634 741 беременности. ПЛОС Один. 2013;8(7):e70380. [Бесплатная статья PMC: PMC3728211] [PubMed: 23936197]
- 31.
Kaplan CG. Макроскопическая патология плаценты: масса, форма, размер, цвет. Джей Клин Патол. 2008 г., декабрь 61(12):1285-95. [PubMed: 18708423]
- 32.
Робертс Диджей. Плацентарная патология, руководство по выживанию. Arch Pathol Lab Med. 2008 г., апрель; 132(4):641-51. [PubMed: 18384216]
Плацента: многогранный преходящий орган
1. Крофт Лонг Э. 1963 год. Плацента в преданиях и легендах. Бык. Мед. Либр. доц. 51, 233–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Yoshizawa RS.
2013.
Обзор: общественные взгляды на использование плаценты человека в научных исследованиях и медицине. Плацента
34, 9–13. (10.1016/j.placenta.2012.10.014) [PubMed] [CrossRef] [Google Scholar]
Yoshizawa RS.
2013.
Обзор: общественные взгляды на использование плаценты человека в научных исследованиях и медицине. Плацента
34, 9–13. (10.1016/j.placenta.2012.10.014) [PubMed] [CrossRef] [Google Scholar]
3. Mossman HW. 1937 год. Сравнительный морфогенез плодных оболочек и дополнительных структур матки. вклад Эмбриол. 26, 129–246. [PubMed] [Google Scholar]
4. Burton GJ, Kaufmann P, Huppertz B. 2006. Анатомия и генезис плаценты. В Knobil and Neill’s physiology of воспроизводства (изд. Neill JD.), стр. 189–243, 3-е изд. Амстердам, Нидерланды: Academic Press. [Академия Google]
5. Бениршке К., Бертон Г.Дж., Берген Р.Н. 2012. Патология плаценты человека, 6-е изд. Гейдельберг, Германия: Springer. [Google Scholar]
6. Симпсон Р.А., Mayhew TM, Barnes PR. 1992. От 13 недель до срока трофобласт плаценты человека растет за счет непрерывного набора новых пролиферативных единиц: исследование количества ядер с помощью диссектора. Плацента 13, 501–512. ( 10.1016/0143-4004(92)-X) [PubMed] [CrossRef] [Google Scholar]
7. Роббинс Дж.Р., Скшипчинская К.М., Зельдович В.Б., Капиджич М., Бакарджиев А.И.
2010.
Плацентарный синцитиотрофобласт представляет собой основной барьер для вертикальной передачи
Роббинс Дж.Р., Скшипчинская К.М., Зельдович В.Б., Капиджич М., Бакарджиев А.И.
2010.
Плацентарный синцитиотрофобласт представляет собой основной барьер для вертикальной передачи
8. Carter AM. 2000. Плацентарное потребление кислорода. Часть I: исследований in vivo обзор. Плацента 21 (Прил. А), С31–С37. ( 10.1053/plac.1999.0513) [PubMed] [CrossRef] [Google Scholar]
9. Burton GJ, Tham SW. 1992. Формирование сосудисто-синцитиальных мембран в плаценте человека. Дж. Дев. Физиол. 18, 43–47. [PubMed] [Академия Google]
10. Окльфорд К.Д., Уайт А. 1977. Дифференцированные участки поверхности клеток плаценты человека, связанные с обменом веществ между кровью матери и плода: покрытые везикулы. Дж. Клеточные науки. 25, 293–312. [PubMed] [Google Scholar]
11. Gauster M, Huppertz B.
2010.
Парадокс каспазы 8 в слиянии трофобласта ворсин человека.
12. Rote NS, Wei BR, Xu C, Luo L. 2010. Каспаза 8 и дифференцировка цитотрофобласта ворсин человека. Плацента 31, 89–96. (10.1016/j.placenta.2009.12.014) [PubMed] [CrossRef] [Google Scholar]
13. Willis DM, O’Grady JP, Faber JJ, Thornburg KL. 1986 год. Диффузионная проницаемость цианокобаламина в плаценте человека. Являюсь. Дж. Физиол. 250, Р459–Р464. [PubMed] [Google Scholar]
14. Торнбург К.Л., Берри К.Дж., Адамс А.К., Кирк Э.П., Фабер Дж.Дж. 1988 год. Проницаемость плаценты для инулина. Являюсь. Дж. Обст. Гинекол. 158, 1165–1169. ( 10.1016/0002-9378(88)
-3) [PubMed] [CrossRef] [Google Scholar]
15. Bain MD, Copas DK, Taylor A, Landon MJ, Stacey TE. 1990. Проницаемость плаценты человека in vivo для четырех неметаболизированных гидрофильных молекул. Дж. Физиол. 431, 505–513. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Kaufmann P, Schroder H, Leichtweiss HP.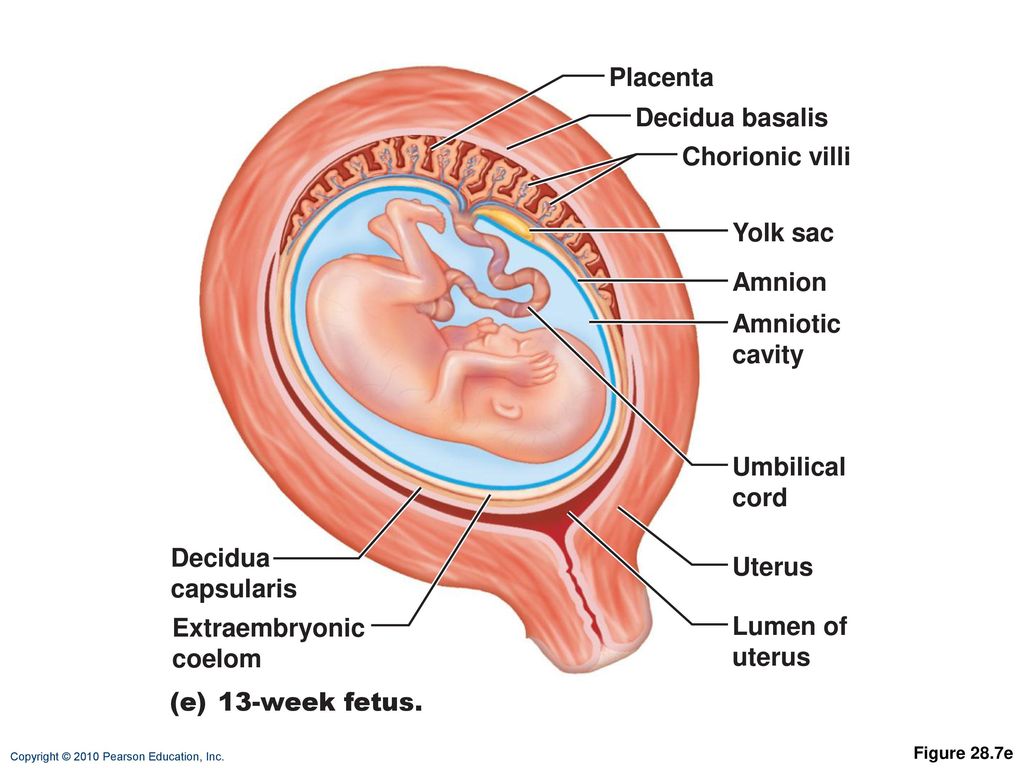 1982.
Смещение жидкости через плаценту: II. Фето-материнская передача пероксидазы хрена морской свинке. Плацента
3, 339–348. ( 10.1016/S0143-4004(82)80027-1) [PubMed] [CrossRef] [Google Scholar]
1982.
Смещение жидкости через плаценту: II. Фето-материнская передача пероксидазы хрена морской свинке. Плацента
3, 339–348. ( 10.1016/S0143-4004(82)80027-1) [PubMed] [CrossRef] [Google Scholar]
17. Burton GJ. 1987. Тонкая структура плаценты человека по данным сканирующей электронной микроскопии. Сканировать. микроск. 1, 1811–1828 гг. [PubMed] [Академия Google]
18. Бертон Г.Дж., Уотсон А.Л. 1997. Структура плаценты человека: значение для инициирования и защиты от вирусных инфекций. преподобный мед. Вирол. 7, 219–228. ( 10.1002/(SICI)1099-1654(199712)7:4<219::AID-RMV205>3.0.CO;2-E) [PubMed] [CrossRef] [Google Scholar]
19. Браунбилл П., Эдвардс Д. , Джонс С., Махендран Д., Оуэн Д., Сибли С., Джонсон Р., Суонсон П., Нельсон Д.М. 1995. Механизмы переноса альфафетопротеина в перфузируемых семядолях плаценты человека при неосложненной беременности. Дж. Клин. Вкладывать деньги. 96, 2220–2226. ( 10.1172/JCI118277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Mayhew TM, Jackson MR, Boyd PA.
1993.
Изменения диффузионной проводимости кислорода плаценты человека в период гестации (10–41 нед) соизмеримы с прибавкой массы плода. Плацента
14, 51–61. ( 10.1016/S0143-4004(05)80248-6) [PubMed] [CrossRef] [Google Scholar]
Mayhew TM, Jackson MR, Boyd PA.
1993.
Изменения диффузионной проводимости кислорода плаценты человека в период гестации (10–41 нед) соизмеримы с прибавкой массы плода. Плацента
14, 51–61. ( 10.1016/S0143-4004(05)80248-6) [PubMed] [CrossRef] [Google Scholar]
21. Решетникова О.С., Бертон Г.Дж., Милованов А.П. 1994. Влияние гипобарической гипоксии на фетоплацентарную единицу: морфометрическая диффузионная способность ворсинчатой оболочки на большой высоте. Являюсь. Дж. Обст. Гинекол. 171, 1560–1565. ( 10.1016/0002-9378(94)
-2) [PubMed] [CrossRef] [Google Scholar]
22. Stulc J, Svihovec J, Drabkova J, Stribrny J, Kobilkova J, Vido I, Dolezal A. 1978 год. Разность электрических потенциалов через среднесрочную плаценту человека. Acta Obstet. Гинекол. Сканд. 57, 125–126. ( 10.3109/00016347809155889) [PubMed] [CrossRef] [Google Scholar]
23. Mellor DJ, Cockburn F, Lees MM, Blagden A.
1969.
Распределение ионов и разность электрических потенциалов между матерью и плодом у человека в срок.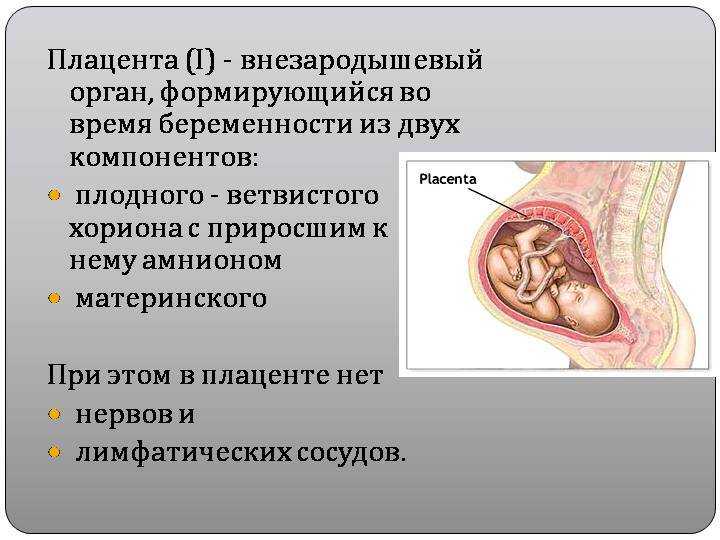 Дж. Обст. Гинеколь. бр. Общ.
76, 993–998. ( 10.1111/j.1471-0528.1969.tb09465.x) [PubMed] [CrossRef] [Google Scholar]
Дж. Обст. Гинеколь. бр. Общ.
76, 993–998. ( 10.1111/j.1471-0528.1969.tb09465.x) [PubMed] [CrossRef] [Google Scholar]
24. Atkinson DE, Boyd RDH, Sibley CP. 2006. Плацентарный перенос. В физиологии репродукции Кнобила и Нейла (изд. Neill JD.), стр. 2787–2846. Амстердам, Нидерланды: Elsevier. [Google Scholar]
25. Tessier DR, Ferraro ZM, Gruslin A. 2013. Роль лептина при беременности: последствия материнского ожирения. Плацента 34, 205–211. ( 10.1016/j.placenta.2012.11.035) [PubMed] [CrossRef] [Google Scholar]
26. Фоуден А.Л., Сферруцци-Перри А.Н., Коан П.М., Констанция М., Бертон Г.Дж. 2009. Плацентарная эффективность и адаптация: эндокринная регуляция. Дж. Физиол. 587, 3459–3472. ( 10.1113/jphysiol.2009.173013) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Sibley CP, et al.
2004.
Плацентарно-специфический инсулиноподобный фактор роста 2 ( Igf2 ) регулирует характеристики диффузионного обмена плаценты мыши. проц. Натл акад. науч. США
101, 8204–8208. ( 10.1073/pnas.0402508101) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
США
101, 8204–8208. ( 10.1073/pnas.0402508101) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Coan PM, Vaughan OR, Sekita Y, Finn SL, Burton GJ, Constancia M, Fowden AL. 2010. Адаптации плацентарного фенотипа поддерживают рост плода при недостаточном питании беременных мышей. Дж. Физиол. 588, 527–538. ( 10.1113/jphysiol.2009.181214) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Sferruzzi-Perri AN, Vaughan OR, Coan PM, Suciu MC, Darbyshire R, Constancia M, Burton GJ, Fowden АЛ. 2011. Дефицит плацентарно-специфического Igf2 изменяет адаптацию развития к недоеданию у мышей. Эндокринология 152, 3202–3212. ( 10.1210/en.2011-0240) [PubMed] [CrossRef] [Google Scholar]
30. Король Б.Ф. 1982. Абсорбция иммуноглобулина G, конъюгированного с пероксидазой, плацентой человека: исследование in vitro . Плацента 3, 395–406. ( 10.1016/S0143-4004(82)80032-5) [PubMed] [CrossRef] [Google Scholar]
31. Hempstock J, Cindrova-Davies T, Jauniaux E, Burton GJ. 2004.
Эндометриальные железы как источник питательных веществ, факторов роста и цитокинов в первом триместре беременности человека: морфологическое и иммуногистохимическое исследование. Воспр. биол. Эндокринол.
2, 58 ( 10.1186/1477-7827-2-58) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2004.
Эндометриальные железы как источник питательных веществ, факторов роста и цитокинов в первом триместре беременности человека: морфологическое и иммуногистохимическое исследование. Воспр. биол. Эндокринол.
2, 58 ( 10.1186/1477-7827-2-58) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Жонио Э., Гулбис Б. 2000. Жидкие компартменты эмбриональной среды. Гум. Воспр. Обновлять 6, 268–278. ( 10.1093/humupd/6.3.268) [PubMed] [CrossRef] [Google Scholar]
33. Кариму А.Л., Бертон Г.Дж. 1994. Влияние материнского сосудистого давления на размеры плацентарных капилляров. бр. Дж. Обст. Гинеколь. 101, 57–63. ( 10.1111/j.1471-0528.1994.tb13011.x) [PubMed] [CrossRef] [Google Scholar]
34. Хатчинсон Э.С., Браунбилл П., Джонс Н.В., Абрахамс В.М., Бейкер П.Н., Сибли К.П., Крокер И.П. 2009 г.. Маточно-плацентарная гемодинамика в патогенезе преэклампсии. Плацента 30, 634–641. ( 10.1016/j.placenta.2009.04.011) [PubMed] [CrossRef] [Google Scholar]
35. Burton GJ, Woods AW, Jauniaux E, Kingdom JC. 2009.
Реологические и физиологические последствия преобразования спиральных артерий матери для маточно-плацентарного кровотока при беременности человека. Плацента
30, 473–482. ( 10.1016/j.placenta.2009.02.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2009.
Реологические и физиологические последствия преобразования спиральных артерий матери для маточно-плацентарного кровотока при беременности человека. Плацента
30, 473–482. ( 10.1016/j.placenta.2009.02.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Wooding FP, Burton GJ. 2008. Сравнительная плацентация. Структуры, функции и эволюция. Берлин, Германия: Springer. [Академия Google]
37. Harris JWS, Ramsey EM. 1966 год. Морфология маточно-плацентарной сосудистой системы человека. вклад Эмбриол. 38, 43–58. [Google Scholar]
38. Pijnenborg R, Vercruysse L, Hanssens M. 2006. Спиральные артерии матки при беременности человека: факты и противоречия. Плацента 27, 939–958. (10.1016/j.placenta.2005.12.006) [PubMed] [CrossRef] [Google Scholar]
39. Whitley GS, Cartwright JE. 2010. Клеточная и молекулярная регуляция ремоделирования спиральных артерий: уроки сердечно-сосудистой системы. Плацента 31, 465–474. ( 10.1016/j.placenta.2010.03.002) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Кам EPY, Гарднер Л., Локе Ю.В., Кинг А.
1999.
Роль трофобласта в физиологических изменениях децидуальных спиральных артерий. Гум. Воспр.
14, 2131–2138. ( 10.1093/humrep/14.8.2131) [PubMed] [CrossRef] [Google Scholar]
Кам EPY, Гарднер Л., Локе Ю.В., Кинг А.
1999.
Роль трофобласта в физиологических изменениях децидуальных спиральных артерий. Гум. Воспр.
14, 2131–2138. ( 10.1093/humrep/14.8.2131) [PubMed] [CrossRef] [Google Scholar]
41. Harris LK. 2010. Взаимодействия трофобласт-сосудистые клетки на ранних сроках беременности: как реконструировать сосуд. Плацента 31, С93–С98. (10.1016/j.placenta.2009.12.012) [PubMed] [CrossRef] [Google Scholar]
42. Hanna J, et al. 2006. Децидуальные NK-клетки регулируют ключевые процессы развития на границе плода и матери человека. Нац. Мед. 12, 1065–1074. ( 10.1038/nm1452) [PubMed] [CrossRef] [Google Scholar]
43. Xiong S, et al. 2013. Рецептор KIR2DS1, активирующий NK-клетки матери, усиливает плацентацию. Дж. Клин. Вкладывать деньги. 123, 4264–4272. ( 10.1172/JCI68991) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Moffett A, Colucci F.
2014.
NK-клетки матки: активные регуляторы взаимодействия матери и плода. Дж. Клин.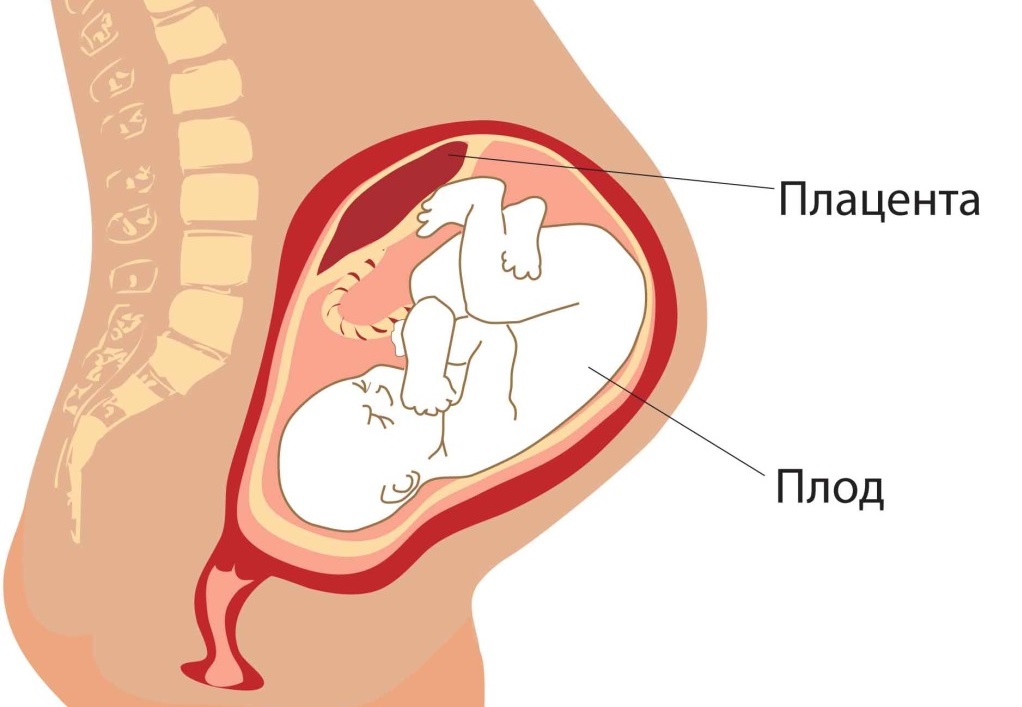 Вкладывать деньги.
124, 1872–1879 гг. ( 10.1172/JCI68107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вкладывать деньги.
124, 1872–1879 гг. ( 10.1172/JCI68107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Hiby SE, et al. 2010. Материнские активирующие KIR защищают от репродуктивной недостаточности человека, опосредованной фетальным HLA-C2. Дж. Клин. Вкладывать деньги. 120, 4102–4110. ( 10.1172/JCI43998) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Brosens I, Pijnenborg R, Vercruysse L, Romero R. 2011. «Большие акушерские синдромы» связаны с нарушениями глубокой плацентации. Являюсь. Дж. Обст. Гинекол. 204, 193–201. ( 10.1016/j.ajog.2010.08.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Redman CW, Sargent IL. 2005. Последние достижения в понимании преэклампсии. Наука 308, 1592–1594. ( 10.1126/science.1111726) [PubMed] [CrossRef] [Google Scholar]
48. Levine RJ, et al. 2004. Циркулирующие ангиогенные факторы и риск преэклампсии. Н. англ. Дж. Мед. 350, 672–683. ( 10.1056/NEJMoa031884) [PubMed] [CrossRef] [Google Scholar]
49. Циндрова-Дэвис Т., Спасич-Боскович О., Жонио Э., Чарнок-Джонс Д.С., Бертон Г.Дж.
2007.
Ядерный фактор-каппа B, p38 и активируемая стрессом протеинкиназа, митоген-активируемые протеинкиназы, сигнальные пути регулируют провоспалительные цитокины и апоптоз в эксплантатах плаценты человека в ответ на окислительный стресс: эффекты витаминов-антиоксидантов. Являюсь. Дж. Патол.
170, 1511–1520. ( 10.2353/ajpath.2007.061035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Циндрова-Дэвис Т., Спасич-Боскович О., Жонио Э., Чарнок-Джонс Д.С., Бертон Г.Дж.
2007.
Ядерный фактор-каппа B, p38 и активируемая стрессом протеинкиназа, митоген-активируемые протеинкиназы, сигнальные пути регулируют провоспалительные цитокины и апоптоз в эксплантатах плаценты человека в ответ на окислительный стресс: эффекты витаминов-антиоксидантов. Являюсь. Дж. Патол.
170, 1511–1520. ( 10.2353/ajpath.2007.061035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Yung HW, Atkinson D, Campion-Smith T, Olovsson M, Charnock-Jones DS, Burton GJ. 2014. Дифференциальная активация плацентарных путей ответа на несвернутые белки предполагает гетерогенность причин преэклампсии с ранним и поздним началом. Дж. Патол. 234, 262–276. ( 10.1002/path.4394) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Yung HW, Calabrese S, Hynx D, Hemmings BA, Cetin I, Charnock-Jones DS, Burton GJ.
2008.
Доказательства ингибирования плацентарной трансляции и стресса эндоплазматического ретикулума в этиологии ограничения внутриутробного развития человека.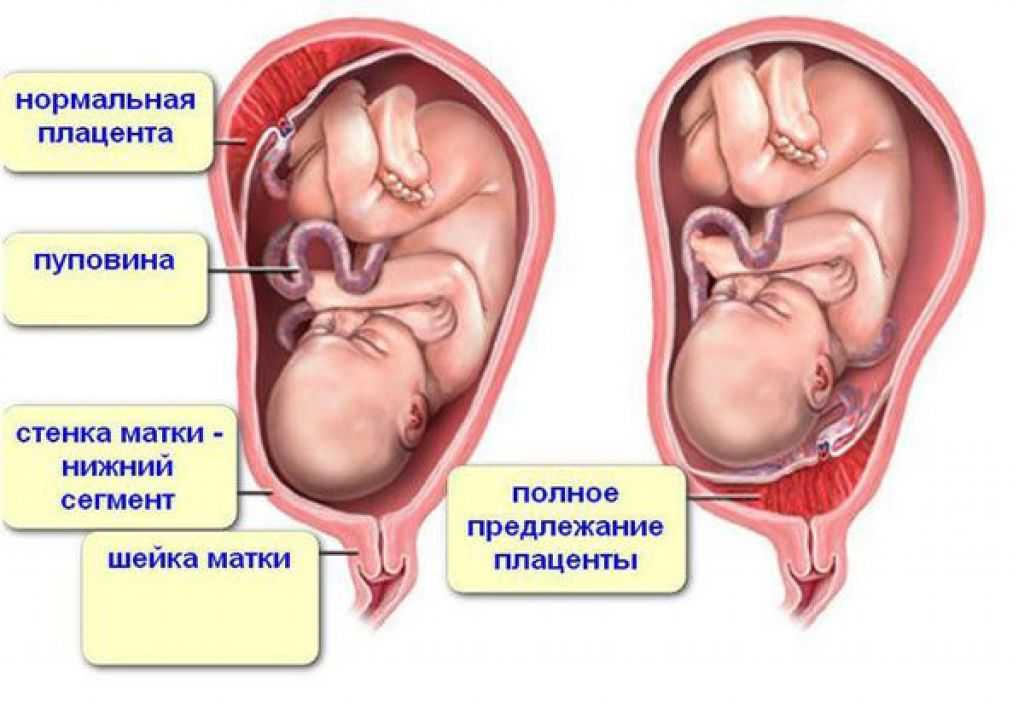 Являюсь. Дж. Патол.
173, 451–462. ( 10.2353/ajpath.2008.071193) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Патол.
173, 451–462. ( 10.2353/ajpath.2008.071193) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Burton GJ, Yung HW, Cindrova-Davies T, Charnock-Jones DS. 2009. Стресс плацентарного эндоплазматического ретикулума и окислительный стресс в патофизиологии необъяснимой задержки внутриутробного развития и ранней преэклампсии. Плацента 30 (Прил. А), С43–С48. (10.1016/j.placenta.2008.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Zhang K, Kaufman RJ. 2008. От стресса эндоплазматического ретикулума до воспалительной реакции. Природа 454, 455–462. ( 10.1038/nature07203) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Абитбол ММ. 1993. Рост плода в брюшной полости. Являюсь. Дж. Физ. Антропол. 91, 367–378. ( 10.1002/ajpa.1330910309) [PubMed] [CrossRef] [Google Scholar]
55. Kauppila A, Koskinen M, Puolakka J, Tuimala R, Kuikka J.
1980.
Снижение межворсинчатого и неизмененный миометриальный кровоток в положении лежа на спине. Обст. Гинекол.
55, 203–205. ( 10.1097/00006250-198003001-00050) [PubMed] [CrossRef] [Google Scholar]
Обст. Гинекол.
55, 203–205. ( 10.1097/00006250-198003001-00050) [PubMed] [CrossRef] [Google Scholar]
56. Hung TH, Burton GJ. 2006. Гипоксия и реоксигенация: возможный механизм плацентарного окислительного стресса при преэклампсии. Тайвань Дж. Обстет. Гинекол. 45, 189–200. ( 10.1016/S1028-4559(09)60224-2) [PubMed] [CrossRef] [Google Scholar]
57. Burton GJ, Charnock-Jones DS, Jauniaux E. 2009. Регуляция роста и функции сосудов в плаценте человека. Воспроизведение 138, 895–902. ( 10.1530/REP-09-0092) [PubMed] [CrossRef] [Google Scholar]
58. Lash GE, Naruse K, Innes BA, Robson SC, Searle RF, Bulmer JN. 2010. Секреция ангиогенных факторов роста ворсинчатым цитотрофобластом и вневорсинчатым трофобластом на ранних сроках беременности человека. Плацента 31, 545–548. ( 10.1016/j.placenta.2010.02.020) [PubMed] [CrossRef] [Google Scholar]
59. Лич Л., Бабавале М.О., Андерсон М., Ламмиман М.
2002.
Васкулогенез, ангиогенез и молекулярная организация эндотелиальных соединений в ранней плаценте человека. Дж. Васк. рез.
39, 246–259. ( 10.1159/000063690) [PubMed] [CrossRef] [Google Scholar]
Дж. Васк. рез.
39, 246–259. ( 10.1159/000063690) [PubMed] [CrossRef] [Google Scholar]
60. Jirkovska M, Janacek J, Kalab J, Kubinova L. 2008. Трехмерное расположение капиллярного русла и его связь с микрореологией в терминальных ворсинах доношенной плаценты. Плацента 29, 892–897. ( 10.1016/j.placenta.2008.07.004) [PubMed] [CrossRef] [Google Scholar]
61. Мятт Л. 1992. Контроль сосудистого сопротивления в плаценте человека. Плацента 13, 329–341. ( 10.1016/0143-4004(92)
-Z) [PubMed] [CrossRef] [Google Scholar]62. Барбер А., Робсон С.К., Мятт Л., Балмер Дж.Н., Лайалл Ф. 2001. Экспрессия гемоксигеназы в плаценте и плацентарном ложе человека: снижение экспрессии эндотелиальной HO-2 плаценты при преэклампсии и задержке роста плода. ФАСЭБ Дж. 15, 1158–1168. ( 10.1096/fj.00-0376com) [PubMed] [CrossRef] [Google Scholar]
63. Cindrova-Davies T, Herrera EA, Niu Y, Kingdom J, Giussani DA, Burton GJ.
2013.
Снижение цистатионин-гамма-лиазы и повышенная экспрессия миР-21 связаны с повышенным сосудистым сопротивлением при беременности с ограничением роста: сероводород как плацентарный вазодилататор.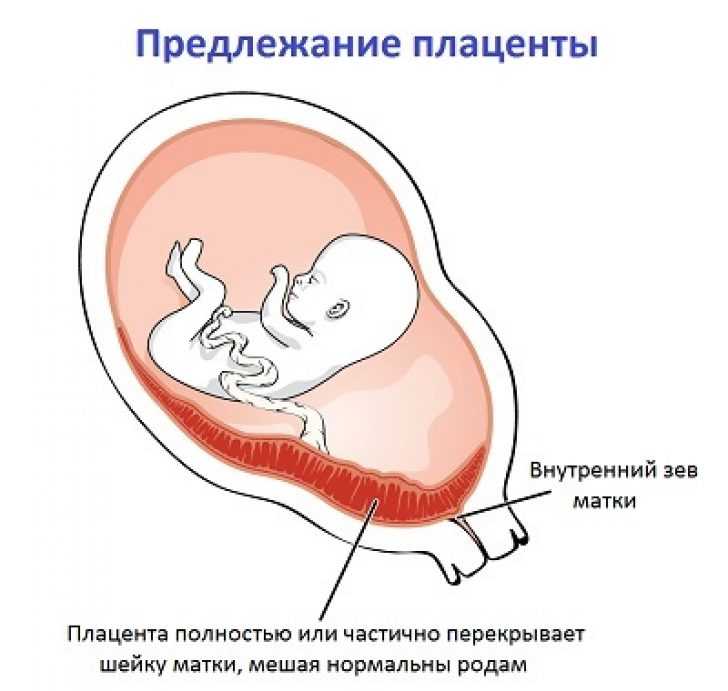 Являюсь. Дж. Патол.
182, 1448–1458. ( 10.1016/j.ajpath.2013.01.001) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Патол.
182, 1448–1458. ( 10.1016/j.ajpath.2013.01.001) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Петралья Ф., Флорио П., Торричелли М. 2006. Плацентарная эндокринная функция. В физиологии воспроизводства Кнобила и Нейла (изд. Neill JD.), стр. 2847–289.7, 3-е изд. Амстердам, Нидерланды: Elsevier. [Google Scholar]
65. Брантон П.Дж., Рассел Дж.А. 2010. Эндокринные изменения функции головного мозга во время беременности. Мозг Res. 1364, 198–215. ( 10.1016/j.brainres.2010.09.062) [PubMed] [CrossRef] [Google Scholar]
66. Фримарк М. 2006. Регуляция метаболизма матери гипофизарными и плацентарными гормонами: роль в развитии плода и метаболическом программировании. Горм. Рез. 65 (прил. 3), 41–49. ( 10.1159/000091505) [PubMed] [CrossRef] [Google Scholar]
67. Ньюберн Д., Фримарк М. 2011. Плацентарные гормоны и контроль метаболизма матери и роста плода. Курс. мнение Эндокринол. Диабет Ожирение. 18, 409–416. (10.1097/MED.0b013e32834c800d) [PubMed] [CrossRef] [Google Scholar]
68. Papper Z, et al.
2009.
Древнее происхождение плацентарной экспрессии генов гормона роста человекообразных приматов. проц. Натл акад. науч. США
106, 17 083–17 088. ( 10.1073/pnas.0908377106) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Papper Z, et al.
2009.
Древнее происхождение плацентарной экспрессии генов гормона роста человекообразных приматов. проц. Натл акад. науч. США
106, 17 083–17 088. ( 10.1073/pnas.0908377106) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Кросс Дж. К., Бачик Д., Добрич Н., Хембергер М., Хьюз М., Симмонс Д. Г., Ямамото Х., Kingdom JCP. 2003. Гены, развитие и эволюция плаценты. Плацента 24, 123–130. ( 10.1053/plac.2002.0887) [PubMed] [CrossRef] [Google Scholar]
70. Ladyman SR, Augustine RA, Grattan DR. 2010. Гормональные взаимодействия, регулирующие энергетический баланс во время беременности. Дж. Нейроэндокринол. 22, 805–817. [PubMed] [Google Scholar]
71. Барбур Л.А., Шао Дж., Цяо Л., Лейтнер В., Андерсон М., Фридман Дж.Е., Дразнин Б.
2004.
Плацентарный гормон роста человека увеличивает экспрессию регуляторной единицы p85 фосфатидилинозитол-3-киназы и вызывает тяжелую резистентность к инсулину в скелетных мышцах. Эндокринология
145, 1144–1150. ( 10.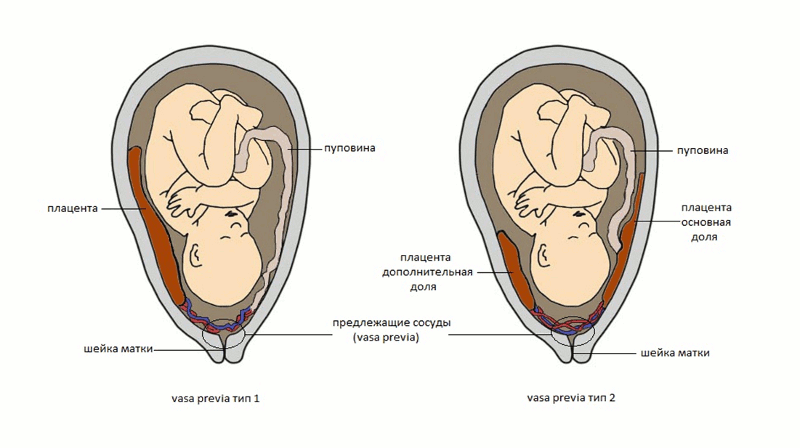 1210/en.2003-1297) [PubMed] [CrossRef] [Google Scholar]
1210/en.2003-1297) [PubMed] [CrossRef] [Google Scholar]
72. Caufriez A, Frankenne F, Hennen G, Copinschi G. 1993. Регуляция материнского IGF-I плацентарным GH при нормальной и аномальной беременности у человека. Являюсь. Дж. Физиол. 265, Е572–577. [PubMed] [Google Scholar]
73. Sferruzzi-Perri AN, Owens JA, Pringle KG, Roberts CT. 2011. Забытая роль инсулиноподобных факторов роста в материнском кровообращении, регулирующая рост плода. Дж. Физиол. 589, 7–20. ( 10.1113/jphysiol.2010.198622) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Блоксам Д.Л. 1985. Энергетический метаболизм плаценты человека: его отношение к перфузии in vitro . вклад Гинекол. Обст. 13, 59–69. [PubMed] [Google Scholar]
75. Jauniaux E, Jurkovic D, Gulbis B, Collin WP, Zaidi J, Campbell S.
1994.
Исследование кислотно-щелочного баланса целомической и амниотической жидкостей на ранних сроках беременности человека. Являюсь. Дж. Обст. Гинекол.
170, 1359–1365. ( 10.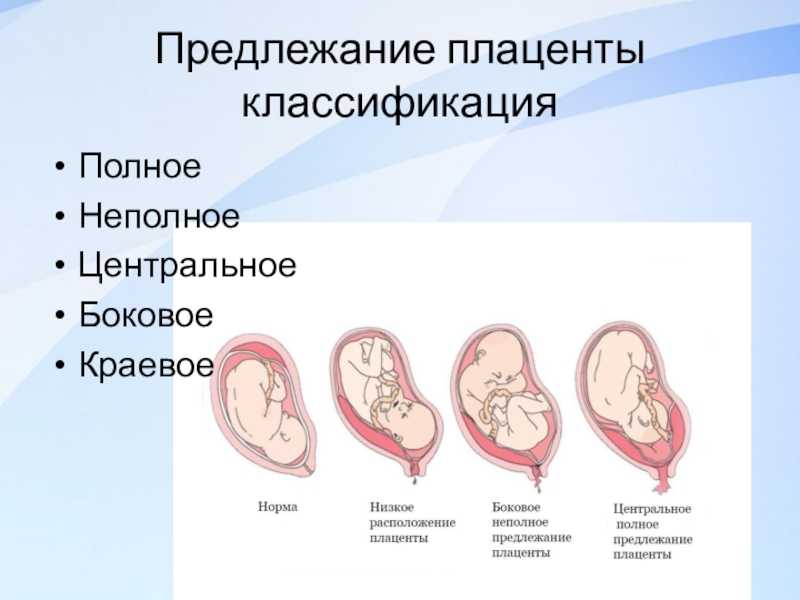 1016/S0002-9378(94)70156-3) [PubMed] [CrossRef] [Google Scholar]
1016/S0002-9378(94)70156-3) [PubMed] [CrossRef] [Google Scholar]
76. Schneider H. 2000. Плацентарное потребление кислорода. Часть II: in vitro исследований-обзор. Плацента 21 (Прил. А), С38–С44. (10.1053/plac.1999.0512) [PubMed] [CrossRef] [Google Scholar]
77. Jauniaux E, Hempstock J, Teng C, Battaglia F, Burton GJ. 2005. Концентрации полиолов в жидкостных отделах человеческого зародыша в течение первого триместра беременности: поддержание окислительно-восстановительного потенциала в среде с низким содержанием кислорода. Дж. Клин. Эндокринол. Метаб. 90, 1171–1175. ( 10.1210/jc.2004-1513) [PubMed] [CrossRef] [Google Scholar]
78. Coller HA. 2014. Является ли рак метаболическим заболеванием? Являюсь. Дж. Патол. 184, 4–17. ( 10.1016/j.ajpath.2013.07.035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Бойд Д.Д. 1959. Гликоген в местах ранней имплантации человека. Воспоминания Соц. Эндокринол. 6, 26–34. [Google Scholar]
80. Burton GJ, Watson AL, Hempstock J, Skepper JN, Jauniaux E.
2002.
Железы матки обеспечивают гистиотрофное питание плода человека в первом триместре беременности. Дж. Клин. Эндокринол. Метаб.
87, 2954–2959. ( 10.1210/jcem.87.6.8563) [PubMed] [CrossRef] [Google Scholar]
Burton GJ, Watson AL, Hempstock J, Skepper JN, Jauniaux E.
2002.
Железы матки обеспечивают гистиотрофное питание плода человека в первом триместре беременности. Дж. Клин. Эндокринол. Метаб.
87, 2954–2959. ( 10.1210/jcem.87.6.8563) [PubMed] [CrossRef] [Google Scholar]
81. McTernan CL, Draper N, Nicholson H, Chalder SM, Driver P, Hewison M, Kilby MD, Stewart PM. 2001. Снижение уровней мРНК плацентарной 11бета-гидроксистероиддегидрогеназы 2 типа при беременности человека, осложненной задержкой внутриутробного развития: анализ возможных механизмов. Дж. Клин. Эндокринол. Метаб. 86, 4979–4983. [PubMed] [Google Scholar]
82. Dy J, Guan H, Sampath-Kumar R, Richardson BS, Yang K.
2008.
Плацентарная 11бета-гидроксистероиддегидрогеназа 2 типа снижена при беременности, осложненной идиопатической задержкой внутриутробного развития: доказательства того, что это связано со сниженным соотношением кортизона к кортизолу в пупочной артерии. Плацента
29, 193–200. (10.1016/j.placenta.2007.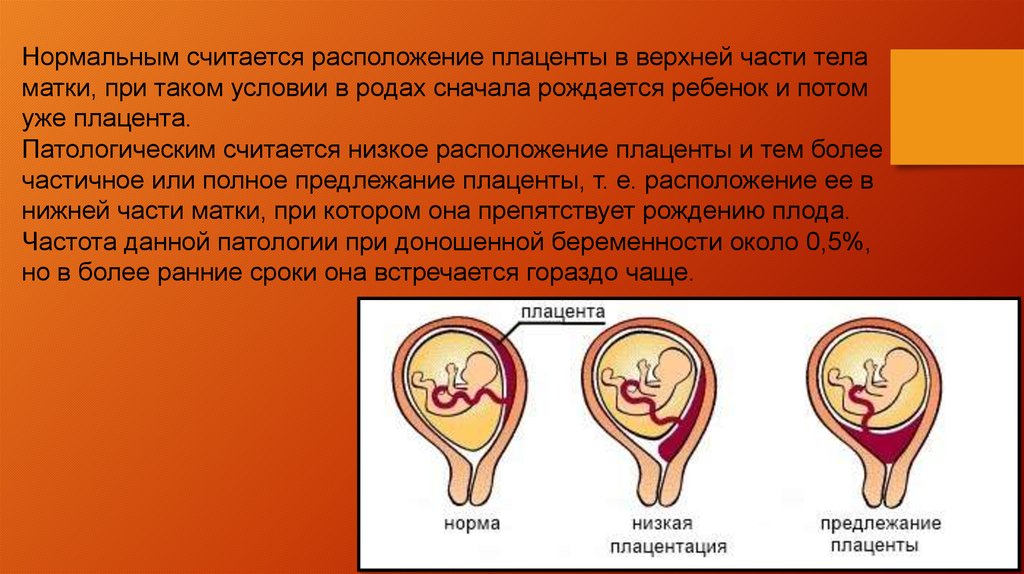 10.010) [PubMed] [CrossRef] [Google Scholar]
10.010) [PubMed] [CrossRef] [Google Scholar]
83. Baron-Cohen S, et al. В прессе. Повышенная стероидогенная активность плода при аутизме. Мол. Психиатрия. ( 10.1038/mp.2014.48) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Старк М.Дж., Райт И.М., Клифтон В.Л. 2009. Специфические для пола изменения активности плацентарной 11бета-гидроксистероиддегидрогеназы 2 и раннее послеродовое клиническое течение после антенатального введения бетаметазона. Являюсь. Дж. Физиол. Регул. интегр. Комп. Физиол. 297, Р510–Р514. ( 10.1152/ajpregu.00175.2009) [PubMed] [CrossRef] [Google Scholar]
85. Сен-Пьер М.В., Серрано М.А., Масиас Р.И., Дабс У., Хечли М., Лаупер У., Мейер П.Дж., Марин Дж.Дж. 2000. Экспрессия членов семейства белков множественной лекарственной устойчивости в доношенной плаценте человека. Являюсь. Дж. Физиол. Регул. интегр. Комп. Физиол. 279, Р1495–Р1503. [PubMed] [Google Scholar]
86. Burton GJ, Fowden AL.
2012.
Обзор: плацента и программирование развития: баланс потребностей плода в питательных веществах с распределением материнских ресурсов.

 Annu Rev Cell Dev Biol. 2012;28:687-717. [В паблике: 22804578]
Annu Rev Cell Dev Biol. 2012;28:687-717. [В паблике: 22804578] Метаболизм липидов у матери и перенос липидов через плаценту. Горм Рез. 2006; 65 Дополнение 3:59-64. [PubMed: 16612115]
Метаболизм липидов у матери и перенос липидов через плаценту. Горм Рез. 2006; 65 Дополнение 3:59-64. [PubMed: 16612115]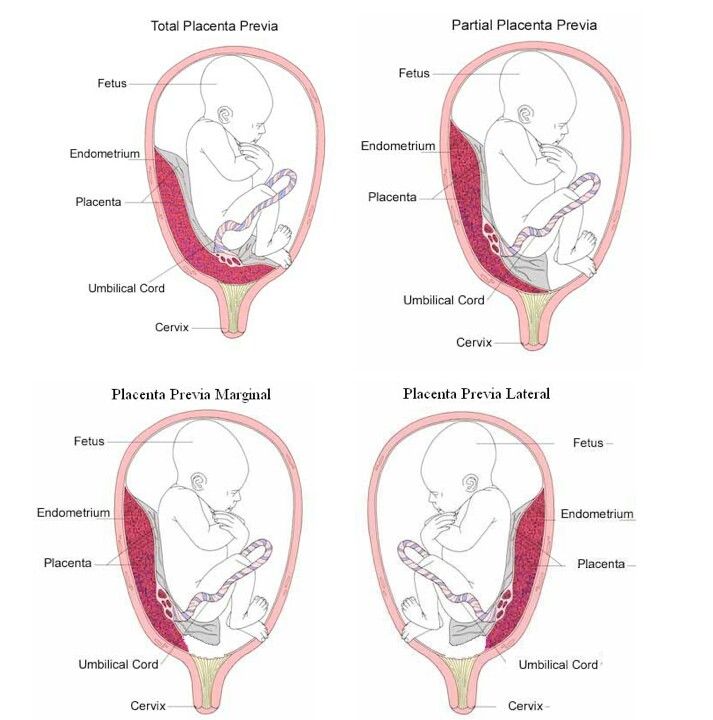 Плацента. 2018 Апрель;64 Дополнение 1:S9-S15. [PubMed: 29370939]
Плацента. 2018 Апрель;64 Дополнение 1:S9-S15. [PubMed: 29370939] Женское здоровье (Лондон). 2019 янв-декабрь;15:1745506519878081. [Бесплатная статья PMC: PMC6777059] [PubMed: 31578123]
Женское здоровье (Лондон). 2019 янв-декабрь;15:1745506519878081. [Бесплатная статья PMC: PMC6777059] [PubMed: 31578123] Смерть плода из-за гематомы пуповины: редкое осложнение кисты пуповины. J Matern Fetal Neonatal Med. 2005 Декабрь; 18 (6): 387-90. [PubMed: 16390804]
Смерть плода из-за гематомы пуповины: редкое осложнение кисты пуповины. J Matern Fetal Neonatal Med. 2005 Декабрь; 18 (6): 387-90. [PubMed: 16390804] Исходы беременностей с маргинальной вставкой пуповины. J Matern Fetal Neonatal Med. 2021 апр;34(7):1133-1137. [PubMed: 31164018]
Исходы беременностей с маргинальной вставкой пуповины. J Matern Fetal Neonatal Med. 2021 апр;34(7):1133-1137. [PubMed: 31164018]