Хирургия релаксации диафрагмы
В основе релаксации диафрагмы (РД) лежит нарушение ее иннервации различного генеза, приводящее к дегенеративным изменениям мышечной части грудобрюшной преграды. В последние годы с развитием кардиохирургии, повышением агрессивности онкологических операций на грудной клетке и шее наметилась тенденция к увеличению числа пациентов с релаксацией диафрагмы. В результате травмы диафрагмального нерва любого происхождения развивается вторичная невротическая дистрофия мышц, диафрагма резко истончается, растягивается и теряет не только свою дыхательную, но и разделительную функции. Сохраняется группа пациентов с так называемой идиопатической релаксацией, т. е. когда не удается выявить причину нарушения иннервации диафрагмы. До настоящего времени взгляды на тактику лечения РД остаются противоречивыми, что во многом связано с относительной редкостью заболевания и малым количеством наблюдений, публикуемых отдельными авторами. Вопросы выбора оперативного доступа, способа хирургической коррекции и сроки, в которые она должна выполняться после манифестации заболевания, остаются предметом обсуждения.
Цель настоящего исследования — определение оптимальной тактики хирургического лечения больных с приобретенной РД.
Материал и методы
В исследовании представлен ретроспективный анализ хирургического лечения 25 больных приобретенной релаксацией диафрагмы в отделении хирургии легких и средостения РНЦХ им. акад. Б.В. Петровского и отделении торакальной хирургии УКБ№ 1 Первого МГМУ им. И.М. Сеченова в период с 1963 по 2016 г. Проанализированы основные демографические и клинические характеристики, диагностические и операционные данные, а также послеоперационный период. Отдаленный результат оценивали путем анкетирования пациентов по почте и телефону.
Среди 25 пациентов было 15 (60%) мужчин и 10 (40%) женщин. Возраст больных варьировал от 39 до 65 лет и в среднем составил 52,1 года (табл. 1). Таблица 1. Распределение пациентов по полу и возрасту (n=25) Большинство больных были трудоспособного возраста.
Возраст больных варьировал от 39 до 65 лет и в среднем составил 52,1 года (табл. 1). Таблица 1. Распределение пациентов по полу и возрасту (n=25) Большинство больных были трудоспособного возраста.
У всех пациентов релаксация диафрагмы носила односторонний характер. У 18 (72%) человек был поражен правый купол диафрагмы, у 7 (28%) левый купол. Установить причину релаксации диафрагмы удалось только у 8 (32%) больных. Среди них 5 пациентов перенесли различные операции на шее или органах грудной клетки, а у 3 больных в анамнезе была закрытая травма груди. У 17 (68%) пациентов выявить причину релаксации не удалось и она расценена как идиопатическая (табл. 2). Таблица 2. Этиология релаксации диафрагмы
У всех пациентов имелись различные клинические проявления заболевания, среди которых основной была жалоба на одышку. Ее интенсивность варьировала от одышки при физической нагрузке до нехватки воздуха в покое. Отмечали кашель у 14 (56%) пациентов, сердцебиение у 9 (36%), боль в грудной клетке у 9 (36%), слабость у 7 (28%). Диспепсические проявления заболевания связывали со смещением органов брюшной полости в грудную клетку. Дисфагию диагностировали у 5 (20%) больных, тяжесть после еды — у 6 (24%), боль в эпигастральной области — у 5 (20%), тошноту — у 4 (16%). При левосторонней локализации (7 пациентов) клинические проявления были наиболее разнообразными, а желудочно-кишечные симптомы и вовсе встречались только в этой группе больных. У большинства пациентов с релаксацией правого купола диафрагмы жалобы ограничивались лишь одышкой при физической нагрузке.
Диспепсические проявления заболевания связывали со смещением органов брюшной полости в грудную клетку. Дисфагию диагностировали у 5 (20%) больных, тяжесть после еды — у 6 (24%), боль в эпигастральной области — у 5 (20%), тошноту — у 4 (16%). При левосторонней локализации (7 пациентов) клинические проявления были наиболее разнообразными, а желудочно-кишечные симптомы и вовсе встречались только в этой группе больных. У большинства пациентов с релаксацией правого купола диафрагмы жалобы ограничивались лишь одышкой при физической нагрузке.
Представленное исследование охватывало период больше 50 лет, в связи с чем протокол обследования больных менялся с развитием диагностических возможностей. В основе инструментальной диагностики лежали лучевые методы исследования. Рентгенографию и рентгеноскопию органов грудной клетки выполнили всем пациентам (табл. 3). Таблица 3. Результаты рентгенологического исследования пациентов (n=25)
Абсолютно у всех больных диагностировали высокое расположение купола диафрагмы (рис. 1). Рис. 1. Компьютерные томограммы. Определяется высокое расположение левого купола диафрагмы. а — под высоко расположенной диафрагмой определяются внутренние органы брюшной полости, содержащие воздух; б — определяется междолевая борозда. Нижняя доля резко уменьшена в размере из-за ее сдавливания диафрагмой. Преобладали пациенты, у которых вершина купола диафрагмы располагалась на уровне переднего отрезка III или IV ребра (табл. 4). Таблица 4. Выраженность релаксации диафрагмы
1). Рис. 1. Компьютерные томограммы. Определяется высокое расположение левого купола диафрагмы. а — под высоко расположенной диафрагмой определяются внутренние органы брюшной полости, содержащие воздух; б — определяется междолевая борозда. Нижняя доля резко уменьшена в размере из-за ее сдавливания диафрагмой. Преобладали пациенты, у которых вершина купола диафрагмы располагалась на уровне переднего отрезка III или IV ребра (табл. 4). Таблица 4. Выраженность релаксации диафрагмы
В 60—70-е годы XX века в дополнение к рентгенографии и рентгеноскопии выполняли рентгенокимографию диафрагмы. При этом отмечали уменьшение амплитуды движений пораженного купола диафрагмы и неправильный характер дыхательных зубцов. Однако этот метод был недостаточно точным. Со временем он потерял свою значимость и в дальнейшем его не использовали.
Рентгеноконтрастное исследование желудочно-кишечного тракта провели только 3 (12%) пациентам с левосторонней локализацией релаксации. При этом диагностировали увеличение газового пузыря и смещение вверх располагающегося под диафрагмой желудка, что подтверждало диагноз релаксации.
С 1981 г. всем пациентам выполняли компьютерную томографию, которая стала основным методом диагностики. Метод позволял оценить толщину мышечной части диафрагмы, а также с уверенностью исключить посттравматический дефект купола диафрагмы и установить правильный диагноз. Современная мультиспиральная компьютерная томография (МСКТ) позволяет правильно спланировать план операции и выбрать оптимальный срок хирургического вмешательства.
Наличие одышки у всех пациентов подтвердили инструментальными методами диагностики. Во всех случаях при спирометрии выявили нарушение функции внешнего дыхания. Среднее снижение жизненной емкости легких составило 35,4%, а ОФВ1 — 41,1%.
Всех пациентов оперировали открытым способом через торакотомный доступ. Используемая нами методика реконструкции купола диафрагмы была предложена Б.В. Петровским в 1957 г. Мы ее применяем с определенной модернизацией, связанной с появлением новых укрепляющих материалов. Укладка пациента на операционном столе была классической — на здоровом боку с отведенной рукой.
 3, а). Рис. 3. Фото этапов операции. Тот же больной. Диафрагма рассечена. Видны большой сальник и край селезенки (а). Созданы 2 диафрагмальных лоскута (б). Имеющиеся спайки органов брюшной полости и диафрагмы рассекали. Это помогало вернуть органы брюшной полости в их физиологическое расположение, а также адекватно сформировать дупликатуру диафрагмы (см. рис. 3, б). При этом с особой тщательностью высвобождали паренхиматозные органы с целью профилактики кровотечения. Значительную помощь оказывал толстый назогастральный зонд, который является ориентиром и помогает визуализировать пищевод и оценить пищеводное отверстие диафрагмы. В 2 (8%) случаях при затруднении низведения органов брюшной полости выполнили резекцию большого сальника.
3, а). Рис. 3. Фото этапов операции. Тот же больной. Диафрагма рассечена. Видны большой сальник и край селезенки (а). Созданы 2 диафрагмальных лоскута (б). Имеющиеся спайки органов брюшной полости и диафрагмы рассекали. Это помогало вернуть органы брюшной полости в их физиологическое расположение, а также адекватно сформировать дупликатуру диафрагмы (см. рис. 3, б). При этом с особой тщательностью высвобождали паренхиматозные органы с целью профилактики кровотечения. Значительную помощь оказывал толстый назогастральный зонд, который является ориентиром и помогает визуализировать пищевод и оценить пищеводное отверстие диафрагмы. В 2 (8%) случаях при затруднении низведения органов брюшной полости выполнили резекцию большого сальника.После низведения органов брюшной полости в привычное положение приступали к пластике диафрагмы (рис. 4). Рис. 4. Фото этапов операции. Тот же больной. Органы погружены в брюшную полость. Внутренний лоскут диафрагмы фиксирован к основанию наружного лоскута (а).

Внутригоспитальной летальности не было. В послеоперационном периоде осложнения возникли у 6 (20%) больных. В их числе у 4 (16%) диагностировали плеврит на стороне операции, что потребовало пункционного лечения. У 1 (4%) больного возникло нагноение послеоперационной раны, которое было купировано местным лечением. Серьезное осложнение диагностировали у одной пациентки с релаксацией левого купола диафрагмы. У нее имелась сопутствующая грыжа пищеводного отверстия диафрагмы. На 3-и сутки после операции возникла клиника ущемления желудка, что в дальнейшем привело к формированию желудочно-плеврального свища. Консервативная терапия в виде дренирования плевры и парентерального питания первоначально имела хороший результат. Больную выписали. Однако спустя несколько дней состояние ее ухудшилось и в стационаре по месту жительства ее экстренно оперировали. Выполнили попытку разобщения свища и ушивание желудка. В дальнейшем пациентка перенесла несколько операций, направленных на разобщение желудочно-пищеводно-плеврального свища.
В отдаленном периоде рецидивов релаксации не было. Отдаленные результаты с детальным обследованием, включая сравнение функции внешнего дыхания до и после операции, удалось проследить только у пациентов, оперированных по поводу релаксации диафрагмы в течение последних 15—20 лет (12 пациентов). Сроки наблюдения у них составили от 8 мес до 12 лет. Поскольку основным клиническим проявлением релаксации диафрагмы была одышка, то основной акцент в изучении отдаленных результатов сделали в изучении этого синдрома. Провели оценку изменения функции внешнего дыхания и выраженности одышки по шкале MRC до и после операции. При этом большинство больных отметили уменьшение одышки, что подтвердили объективными методами диагностики — увеличение показателей ЖЕЛ и ОФВ1 в отдаленном периоде (табл. 5). Таблица 5. Показатели функции внешнего дыхания и степень одышки по MRC пациентов до и после операции
Провели оценку изменения функции внешнего дыхания и выраженности одышки по шкале MRC до и после операции. При этом большинство больных отметили уменьшение одышки, что подтвердили объективными методами диагностики — увеличение показателей ЖЕЛ и ОФВ1 в отдаленном периоде (табл. 5). Таблица 5. Показатели функции внешнего дыхания и степень одышки по MRC пациентов до и после операции
Для оценки качества жизни в отдаленном периоде использовали опросник SF-36, который позволяет дать количественную характеристику физического, эмоционального, социального компонентов качества жизни. Опросник SF-36 относится к неспецифическим опросникам и зарекомендовал себя как надежный, валидный и чувствительный метод. Опросник содержит 36 пунктов, которые сгруппированы в восемь шкал: физическое функционирование (Physical Functioning — PF), ролевая деятельность (Role-Physical Functioning — RP), телесная боль (Bodily pain — BP), общее здоровье (General Health — GH), жизнеспособность (Vitality — VT), социальное функционирование (Social Functioning — SF) и психическое здоровье (Mental Health — MH). Показатели каждой шкалы варьируют от 0 до 100, где последнее представляет полное здоровье. Все шкалы формируют два показателя: душевный и физический компоненты здоровья. Результаты представляются в виде оценок в баллах по 8 шкалам, составленных таким образом, что более высокая оценка указывает на более высокий уровень качества жизни.
Показатели каждой шкалы варьируют от 0 до 100, где последнее представляет полное здоровье. Все шкалы формируют два показателя: душевный и физический компоненты здоровья. Результаты представляются в виде оценок в баллах по 8 шкалам, составленных таким образом, что более высокая оценка указывает на более высокий уровень качества жизни.
Анкетированию подвергли 12 пациентов, оперированных с 2000 по 2016 г. Были получены следующие средние результаты: физическое функционирование — 64,4, ролевая деятельность — 56,3, телесная боль — 61,8, общее здоровье — 58,5, жизнеспособность — 76,9, социальное функционирование — 89,1, эмоциональное состояние — 58,3, психическое здоровье — 81,5. Общий показатель для “физического компонента здоровья” в среднем составил 39,7 балла, для “психического компонента здоровья” — 57,2 балла. Эти показатели находятся на высоком уровне. Несмотря на то что исходного анкетирования не проводили, стоит отметить, что отдельно взятые и обобщенные показатели качества жизни в отдаленном периоде соответствовали средним показателям в общей популяции (табл. 6). Таблица 6. Показатели качества жизни оперированных пациентов и в общей популяции (M±SD) Примечание. * — статистическая значимость при p<0,05.
6). Таблица 6. Показатели качества жизни оперированных пациентов и в общей популяции (M±SD) Примечание. * — статистическая значимость при p<0,05.
Лишь показатель физического функционирования (PF) оказался несколько сниженным, что может быть обусловлено ограничением в выполнении умеренных и тяжелых физических нагрузок оперированными больными.
Обсуждение
Впервые РД описал Petit в 1774 г. на секции пациента, длительное время страдавшего одышкой, усиливающейся после еды [53]. Wieting в 1906 г. первым предложил термин «релаксация диафрагмы» для обозначения этого патологического состояния [67]. Идея пластики диафрагмы путем резекции истонченного участка и создания дупликатуры принадлежит H. Wood. На практике ее реализовал J. Morley в 1920 г., который сообщил об успешной операции при релаксации диафрагмы у девочки 12 лет [46]. После иссечения истонченного участка диафрагмы проведено сшивание ее краев.
Наиболее частыми причинами РД являются злокачественные опухоли, прорастающие в диафрагмальный нерв, или его ятрогенная травма при операции [5, 12, 36, 38, 43, 61, 63]. Распространенные онкологические заболевания органов грудной клетки или шеи с вовлечением в процесс диафрагмального нерва были критериями исключения из нашего исследования, так как у них невозможно проследить отдаленный результат лечения. Реже нарушение иннервации диафрагмы происходит при сдавлении нерва аневризмой аорты, повреждениях при диабете, васкулите, герпесе [41, 58]. Подобных больных у нас не было. Нарушение иннервации диафрагмы центрального генеза — распространенный склероз, синдром Арнольда—Киари, сирингомиелия, нейрофиброматоз, перелом позвоночника на высоком уровне, сопровождающийся тетраплегией, также могут приводить к релаксации диафрагмы [7, 49, 63]. Возможны и различные идиопатические причины [2, 3, 15, 54, 65, 69]. Это составило самую многочисленную группу наших пациентов (17 человек). У них не было указаний на какую-либо травму, в том числе операционную. Повреждение диафрагмального нерва во время операции с развитием в дальнейшем релаксации и атрофии диафрагмы диагностировали у 5 пациентов (см.
Распространенные онкологические заболевания органов грудной клетки или шеи с вовлечением в процесс диафрагмального нерва были критериями исключения из нашего исследования, так как у них невозможно проследить отдаленный результат лечения. Реже нарушение иннервации диафрагмы происходит при сдавлении нерва аневризмой аорты, повреждениях при диабете, васкулите, герпесе [41, 58]. Подобных больных у нас не было. Нарушение иннервации диафрагмы центрального генеза — распространенный склероз, синдром Арнольда—Киари, сирингомиелия, нейрофиброматоз, перелом позвоночника на высоком уровне, сопровождающийся тетраплегией, также могут приводить к релаксации диафрагмы [7, 49, 63]. Возможны и различные идиопатические причины [2, 3, 15, 54, 65, 69]. Это составило самую многочисленную группу наших пациентов (17 человек). У них не было указаний на какую-либо травму, в том числе операционную. Повреждение диафрагмального нерва во время операции с развитием в дальнейшем релаксации и атрофии диафрагмы диагностировали у 5 пациентов (см. табл. 1). В 1 случае имела место операция на шее, в 3 — на органах грудной клетки (у 2 больных при доброкачественных опухолях средостения, у 2 — кардиохирургическая операция). Особую группу составляют пациенты, у которых релаксация диафрагмы развилась после кардиохирургических операций. В этих случаях повреждение диафрагмального нерва может быть обусловлено не только прямым механическим или электрохирургическим повреждением нерва, но и гипотермическим воздействием на него при операциях на открытом сердце после наружного охлаждения внутри перикарда. Возможно ишемическое повреждение нерва, возникшее в результате нарушения кровоснабжения при термическом повреждении внутренней грудной артерии при ее выделении для коронарного шунтирования [5, 6, 8, 12, 24, 36, 39, 56, 60, 71]. Чаще подобные осложнения носят односторонний характер. Показания для пластики диафрагмы у этих больных крайне редкие. В 80% случаев через год у них происходит самостоятельное восстановление функции диафрагмального нерва [36, 63, 64].
табл. 1). В 1 случае имела место операция на шее, в 3 — на органах грудной клетки (у 2 больных при доброкачественных опухолях средостения, у 2 — кардиохирургическая операция). Особую группу составляют пациенты, у которых релаксация диафрагмы развилась после кардиохирургических операций. В этих случаях повреждение диафрагмального нерва может быть обусловлено не только прямым механическим или электрохирургическим повреждением нерва, но и гипотермическим воздействием на него при операциях на открытом сердце после наружного охлаждения внутри перикарда. Возможно ишемическое повреждение нерва, возникшее в результате нарушения кровоснабжения при термическом повреждении внутренней грудной артерии при ее выделении для коронарного шунтирования [5, 6, 8, 12, 24, 36, 39, 56, 60, 71]. Чаще подобные осложнения носят односторонний характер. Показания для пластики диафрагмы у этих больных крайне редкие. В 80% случаев через год у них происходит самостоятельное восстановление функции диафрагмального нерва [36, 63, 64].
Релаксация диафрагмы приводит к значительным изменениям в физиологических процессах дыхания, которые включают в себя образование ателектазов, вентиляционно-перфузионные нарушения, смещение средостения в противоположную сторону, парадоксальное движение диафрагмы, перераспределение легочного кровотока в противоположную сторону. G. Elshafie и соавт. [18] полагают, что перерастяжение одного из куполов диафрагмы значительно снижает подвижность контралатеральной половины, приводя тем самым к еще более грубым функциональным нарушениям.
Б.В. Петровский [3] в 1965 г. выделил 4 типа клинического течения релаксации диафрагмы: 1) бессимптомную форму; 2) форму со стертыми клиническими проявлениями; 3) форму с выраженными клиническими проявлениями; 4) осложненную форму. Несмотря на большое разнообразие возможных симптомов, большинство случаев протекает бессимптомно [2, 7, 31, 69]. Наиболее часто возникают респираторные симптомы, являющиеся результатом потери диафрагмой дыхательной функции. У всех наших пациентов была одышка различной степени выраженности. Бессимптомного течения заболевания мы не наблюдали. По-видимому, это связано с тем, что больные, не предъявлявшие жалоб, не обращались к хирургам, даже при случайно выявленной Р.Д. Реже возникают неспецифические симптомы, связанные с нарушением сердечно-сосудистой системы и желудочно-кишечного тракта, среди которых наиболее часто встречаются дисфагия, тяжесть после еды, тошнота, рвота. Эта группа симптомов, как правило, возникает у пациентов с левосторонней локализацией релаксации диафрагмы. Мы полностью подтверждаем последнее положение — различные гастроэнтерологические жалобы были только у больных с релаксацией левого купола диафрагмы.
У всех наших пациентов была одышка различной степени выраженности. Бессимптомного течения заболевания мы не наблюдали. По-видимому, это связано с тем, что больные, не предъявлявшие жалоб, не обращались к хирургам, даже при случайно выявленной Р.Д. Реже возникают неспецифические симптомы, связанные с нарушением сердечно-сосудистой системы и желудочно-кишечного тракта, среди которых наиболее часто встречаются дисфагия, тяжесть после еды, тошнота, рвота. Эта группа симптомов, как правило, возникает у пациентов с левосторонней локализацией релаксации диафрагмы. Мы полностью подтверждаем последнее положение — различные гастроэнтерологические жалобы были только у больных с релаксацией левого купола диафрагмы.
Диагностика РД основывается на лучевых методах. Для нее характерны высокое расположение пораженного купола, а также нарушение подвижности диафрагмы. При этом ее движения могут сохранять правильный, физиологичный характер, однако амплитуда их, как правило, резко снижена. Возможно возникновение и парадоксальных движений, которые определяются в виде опускания пораженного купола диафрагмы при выдохе и его подъем при вдохе.
Основным методом диагностики в настоящее время является спиральная компьютерная томография высокого разрешения. Она помогает получить исчерпывающие данные о степени растяжения диафрагмы, ее истончения, а также соотношения с прилегающими органами брюшной полости. Этот метод позволяет провести дифференциальный диагноз с посттравматической диафрагмальной грыжей, основным симптомом которой является наличие патологического отверстия в куполе. При этом края диафрагмы не имеют признаков дегенерации, а их толщина соответствует нормальной диафрагме.
Следует констатировать, что до настоящего момента не сложилось унифицированного подхода к тактике лечения Р.Д. Работы, посвященные хирургическому лечению РД, немногочисленны. Большинство авторов обладают небольшим количеством наблюдений, а выбор способа пластики диафрагмы, как правило, определяется эмпирически [14, 16, 21, 25, 26, 35, 41, 57, 61, 70]. Выбор варианта хирургического доступа и способа укрепления диафрагмы основывается на субъективных критериях, когда врач выбирает наиболее привычный ему тот или иной вариант операции.
Одышка, возникающая при незначительной физической нагрузке, значительно ограничивающая физическую активность больного, является основным показанием к хирургическому лечению [9, 18, 50]. Момент, в который хирургическое лечение становится необходимым, широко обсуждается. Рядом авторов рекомендуется оперативное лечение через 3—6 мес после возникновения РД, особенно в случае выраженных клинических проявлений [55]. Иного мнения придерживается E. Summerhill [59], описав восстановление нормального уровня диафрагмы у 11 из 16 пациентов в срок от 5 до 25 мес. Аналогичные результаты отмечены J. Mouroux [48], который избирал выжидательную тактику в течение 18—24 мес, указывая на возможность спонтанного восстановления. В литературе можно встретить единичные наблюдения профилактических френопликаций, выполненных во время операций, требующих резекции диафрагмального нерва [10, 40, 62]. По данным T. Tokunaga и соавт. [62], использовавших френопликацию у 13 пациентов в ходе расширенных онкологических операций, эта мера позволяет эффективно предотвращать респираторные нарушения в послеоперационном периоде. Мы считаем, что оперативное лечение показано при резком истончении диафрагмы, выявляемое при МСКТ, что может свидетельствовать о серьезных дегенеративных изменениях и невозможности ее восстановления. Длительность наблюдения за высоким расположением диафрагмы должна быть не менее 1 года, после чего есть основание для операции. При таких сроках надежды на самостоятельное восстановление иннервации диафрагмы минимальны, особенно учитывая дегенеративные изменения мышечной части грудобрюшной преграды.
Мы считаем, что оперативное лечение показано при резком истончении диафрагмы, выявляемое при МСКТ, что может свидетельствовать о серьезных дегенеративных изменениях и невозможности ее восстановления. Длительность наблюдения за высоким расположением диафрагмы должна быть не менее 1 года, после чего есть основание для операции. При таких сроках надежды на самостоятельное восстановление иннервации диафрагмы минимальны, особенно учитывая дегенеративные изменения мышечной части грудобрюшной преграды.
Работы, посвященные операциям, направленным на восстановление проводимости диафрагмального нерва, крайне редки. M. Kaufman [34] у 68 пациентов с односторонней релаксацией диафрагмы использовал различные варианты операций на диафрагмальном нерве (декомпрессия, протезирование, невротизация). При этом автор отмечает хорошие результаты лечения, сравнимые с результатами лечения больных, которым выполнялась френопликация. Однако эти операции целесообразны в случае сохранения диафрагмой хотя бы минимальной активности, выявляемой при электромиографическом исследовании.
Дискутабельной остается проблема рационального способа пластики диафрагмы при Р.Д. Восстановление нормального уровня истонченной диафрагмы и ее укрепление могут быть достигнуты как за счет собственных тканей, так и с использованием различных укрепляющих материалов. В настоящее время появилась тенденция к расширению показаний к пластике диафрагмы за счет ее собственных тканей [1, 9, 19, 22, 28, 35, 42, 52, 66, 68]. Они достаточно просты, малотравматичны и дают удовлетворительные непосредственные результаты [11]. Предложены различные технические приемы реконструкции диафрагмы: резекция истонченного участка диафрагмы, гофрирование без рассечения диафрагмы, использование матрацных или непрерывных швов, механического шва с помощью эндостеплера [17, 20, 28, 30, 35, 45, 47].
Многочисленные варианты френопликации воспроизводятся как открытым способом, так и видеоторакоскопически. С момента первого описания F. Gharagozloo и соавт. [23] в 1995 г. торакоскопической френопликации и T. Hüttl [32] в 2004 г. лапароскопического доступа появляются сообщения, посвященные малоинвазивным вмешательствам в различных вариантах [33, 35, 37]. R. Freeman [19] приводит наибольший опыт использования френопликации, описывая серию из 41 пациента, среди которых у 30 пациентов был выбран малоинвазивный доступ и 11 подверглись традиционной торакотомии. Улучшение показателей функции внешнего дыхания на 19—23% отмечено у всех больных, за исключением 2 больных с избыточной массой тела и 3 больных с длительно (более 4 лет) существующей релаксацией диафрагмы. Аналогичные результаты сообщают S. Groth и соавт. [27] в ретроспективном анализе лечения 25 пациентов, подвергшихся лапароскопической френопликации. Однако стоит отметить, что имеются рецидивы РД после пластики диафрагмы собственными дегенеративно измененными тканями, особенно в случае полной релаксации. S. Higgs [29] и S. Groth [26] признают эффективность таких операций лишь при ограниченной форме РД и в случае отсутствия выраженных морфологических дегенеративных изменений диафрагмы.
Hüttl [32] в 2004 г. лапароскопического доступа появляются сообщения, посвященные малоинвазивным вмешательствам в различных вариантах [33, 35, 37]. R. Freeman [19] приводит наибольший опыт использования френопликации, описывая серию из 41 пациента, среди которых у 30 пациентов был выбран малоинвазивный доступ и 11 подверглись традиционной торакотомии. Улучшение показателей функции внешнего дыхания на 19—23% отмечено у всех больных, за исключением 2 больных с избыточной массой тела и 3 больных с длительно (более 4 лет) существующей релаксацией диафрагмы. Аналогичные результаты сообщают S. Groth и соавт. [27] в ретроспективном анализе лечения 25 пациентов, подвергшихся лапароскопической френопликации. Однако стоит отметить, что имеются рецидивы РД после пластики диафрагмы собственными дегенеративно измененными тканями, особенно в случае полной релаксации. S. Higgs [29] и S. Groth [26] признают эффективность таких операций лишь при ограниченной форме РД и в случае отсутствия выраженных морфологических дегенеративных изменений диафрагмы. Мы придерживаемся радикальной тактики лечения. У нас не было пациентов с ограниченной Р.Д. Являясь последователями школы академика Б.В. Петровского, считаем, что при истинной релаксации диафрагмы с дегенеративными изменениями ее мышечной части использование только собственных тканей, без их укрепления различными материалами, повышает риск рецидива. Большинство рецидивов заболевания, описанных в литературе, были связаны именно с френопликацией. Каким образом ее выполняли, не имеет значения — открытым способом или торакоскопически. Мы считаем, что не следует повторять ошибки открытой хирургии, имевшие место много лет назад, перенося их в тораковидеоскопическую область.
Мы придерживаемся радикальной тактики лечения. У нас не было пациентов с ограниченной Р.Д. Являясь последователями школы академика Б.В. Петровского, считаем, что при истинной релаксации диафрагмы с дегенеративными изменениями ее мышечной части использование только собственных тканей, без их укрепления различными материалами, повышает риск рецидива. Большинство рецидивов заболевания, описанных в литературе, были связаны именно с френопликацией. Каким образом ее выполняли, не имеет значения — открытым способом или торакоскопически. Мы считаем, что не следует повторять ошибки открытой хирургии, имевшие место много лет назад, перенося их в тораковидеоскопическую область.
Одним из первых использование укрепляющего материала при пластике РД описал D. Monahan [44] в 1951 г., использовав сетку из тантала, которая была пришита поверх дупликатуры диафрагмы. В 1957 г. Б.В. Петровский [3] описал оригинальный способ пластики диафрагмы, заключавшийся в расположении поливинилалкогольной губки между двумя листками рассеченной диафрагмы, которые сшивались по типу дупликатуры. К настоящему времени в литературе предложено большое количество различных синтетических и биологических материалов, используемых для укрепления диафрагмы при ее релаксации [4, 13, 7, 51]. Большинство работ носят характер единичных наблюдений или небольших серий. A. Balci и соавт. [7] сообщили о 28 пациентах с РД, среди которых 9 выполнена только френопликация и у 19 больных, помимо френопликации, диафрагма укреплена сетчатым протезом из пролена и политетрафторэтилена. В обеих группах отмечен хороший функциональный результат операций. Частота осложнений была выше в группе френопликаций (22% против 10%). Авторы описывают один рецидив РД через 6 мес после операции у пациентки, которой была выполнена френопликация. C. Palanivelu и соавт. [51] у 3 пациентов с левосторонней релаксацией диафрагмы применили полипропиленовую сетку, которая была фиксирована по всему периметру поверх дупликатуры, выполненной лапароскопически. Рецидивов релаксации в отдаленном периоде автор не описывает.
К настоящему времени в литературе предложено большое количество различных синтетических и биологических материалов, используемых для укрепления диафрагмы при ее релаксации [4, 13, 7, 51]. Большинство работ носят характер единичных наблюдений или небольших серий. A. Balci и соавт. [7] сообщили о 28 пациентах с РД, среди которых 9 выполнена только френопликация и у 19 больных, помимо френопликации, диафрагма укреплена сетчатым протезом из пролена и политетрафторэтилена. В обеих группах отмечен хороший функциональный результат операций. Частота осложнений была выше в группе френопликаций (22% против 10%). Авторы описывают один рецидив РД через 6 мес после операции у пациентки, которой была выполнена френопликация. C. Palanivelu и соавт. [51] у 3 пациентов с левосторонней релаксацией диафрагмы применили полипропиленовую сетку, которая была фиксирована по всему периметру поверх дупликатуры, выполненной лапароскопически. Рецидивов релаксации в отдаленном периоде автор не описывает.
Аутопластическое укрепление диафрагмы с использованием различных мышечных и мышечно-апоневротических лоскутов из-за высокой травматичности и высокого риска осложнений в настоящее время практически не используют.
Таким образом, релаксация диафрагмы является дегенеративным заболеванием, приводящим к значительным изменениям в физиологических процессах дыхания и зачастую существенно ограничивающая физическую активность больного. В основе диагностики лежат лучевые методы, включающие компьютерную томографию высокого разрешения, которая позволяет получить исчерпывающие данные о степени дегенеративных изменений, уровня расположения соответствующего купола диафрагмы, с уверенностью исключить ее посттравматический дефект и установить правильный диагноз. В настоящее время отсутствует единый подход к лечению Р.Д. Зачастую срок выполнения оперативного вмешательства, выбор оперативного доступа и способа коррекции основаны на личных предпочтениях хирурга. Мы считаем, что ее следует выполнять не ранее, чем через 1 год после первого выявления высокого расположения купола диафрагмы. Работ, посвященных хирургическому лечению РД с высоким уровнем доказательности, практически нет. Как следствие, оценить преимущества того или иного способа коррекции представляется затруднительным. Очевидна необходимость разработки единого подхода к тактике лечения пациентов с РД и оценки результатов лечения в отдаленный период.
Очевидна необходимость разработки единого подхода к тактике лечения пациентов с РД и оценки результатов лечения в отдаленный период.
Авторы заявляют об отсутствии конфликта интересов.
e-mail: [email protected]
e-mail: [email protected]
Релаксация диафрагмы — причины, симптомы, диагностика и лечение
Релаксация диафрагмы – это тотальное или ограниченное расслабление и высокое стояние купола грудобрюшной перегородки с пролабированием прилегающих к ней органов брюшной полости в грудную клетку. Клинически проявляется кардиоваскулярными, респираторными, диспепсическими нарушениями. Преобладание тех или иных симптомов зависит от локализации и выраженности патологического процесса. Ведущими методами диагностики являются рентгенологическое исследование и компьютерная томография органов грудной полости. Единственным способом лечения выступает ауто- или аллопластика диафрагмального купола или его части.
Общие сведения
Релаксация диафрагмы (паралич диафрагмы, мегафрения, первичная диафрагма) обусловлена резкими дистрофическими изменениями мышечной части органа или нарушением его иннервации. Бывает врождённой или приобретённой. Полная (тотальная) релаксация грудобрюшной перегородки чаще встречается слева. Ограниченное выпячивание её участка (дивертикул диафрагмы) обычно локализуется в передней медиальной части правого купола. У детей релаксация диафрагмы возникает очень редко, нарушения формируются постепенно по мере роста человека и под влиянием внешних факторов. Первые симптомы появляются в 25-30-летнем возрасте. Чаще страдают мужчины, занятые тяжёлым физическим трудом.
Бывает врождённой или приобретённой. Полная (тотальная) релаксация грудобрюшной перегородки чаще встречается слева. Ограниченное выпячивание её участка (дивертикул диафрагмы) обычно локализуется в передней медиальной части правого купола. У детей релаксация диафрагмы возникает очень редко, нарушения формируются постепенно по мере роста человека и под влиянием внешних факторов. Первые симптомы появляются в 25-30-летнем возрасте. Чаще страдают мужчины, занятые тяжёлым физическим трудом.
Релаксация диафрагмы
Причины релаксации диафрагмы
К высокому стоянию диафрагмального купола приводит выраженное истончение, вплоть до полного отсутствия, его мышечного слоя. Такое строение грудобрюшной преграды чаще обусловлено нарушением развития органа во внутриутробном периоде. Другой распространённой причиной является паралич диафрагмальной мускулатуры. Выделяют следующие группы этиологических факторов, ведущих к релаксации свода диафрагмы:
- Нарушения эмбриогенеза.
 Сюда относятся дефекты закладки миотомов и дальнейшей дифференцировки мышечных элементов, недоразвитие или внутриутробное повреждение диафрагмального нерва. Врождённая релаксация диафрагмы нередко сочетается с другими пороками развития внутренних органов.
Сюда относятся дефекты закладки миотомов и дальнейшей дифференцировки мышечных элементов, недоразвитие или внутриутробное повреждение диафрагмального нерва. Врождённая релаксация диафрагмы нередко сочетается с другими пороками развития внутренних органов. - Повреждение диафрагмальной мышцы. Бывает воспалительного и травматического характера. Различают самостоятельное воспаление (диафрагматит) и вторичное поражение диафрагмы. Последнее появляется при распространении патологического процесса с прилегающих органов, например, при поддиафрагмальных абсцессах, эмпиеме плевры.
- Паралич диафрагмального купола. Возникает при различного рода нарушениях иннервации диафрагмы. К повреждению нерва приводят травматические процессы, в том числе при хирургических вмешательствах. Тотальный паралич вызывают тяжёлые системные неврологические заболевания (полиомиелит, сирингомиелия). Локальные поражения возникают в результате прорастания опухолью нервного ствола.

Патогенез
При врождённой аномалии, ведущей к релаксации грудобрюшной перегородки, выявляется практически полное отсутствие мышечной ткани. Тонкая диафрагма состоит из плевральных и перитонеальных листков. При приобретённой патологии наблюдается дистрофия мускулатуры разной степени выраженности. Отсутствие мышечного тонуса приводит к утрате части функциональных способностей диафрагмального свода. Из-за разницы давления в грудной и брюшной полостях внутренние органы растягивают диафрагму, способствуют её полному или частичному выпячиванию в область грудной клетки.
Патологический процесс сопровождается сдавлением лёгкого и развитием ателектаза на стороне поражения, смещением средостения в противоположном направлении. Релаксация левого купола поднимает вверх органы брюшной полости. Возникают завороты желудка, селезёночного изгиба толстой кишки. Появляются перегибы пищевода, кровеносных сосудов поджелудочной железы и селезёнки, приводящие к преходящей ишемии органов. Из-за нарушения венозного оттока вены пищевода расширяются, возникают кровотечения. Релаксация правого купола (обычно частичная) вызывает локальную деформацию печени.
Из-за нарушения венозного оттока вены пищевода расширяются, возникают кровотечения. Релаксация правого купола (обычно частичная) вызывает локальную деформацию печени.
Классификация
Патологические изменения внутренних органов и нарушения их функций зависят от причин, распространённости и локализации выпячивания диафрагмальной перегородки. По времени возникновения и этиологическим факторам релаксация диафрагмы делится на врождённую и приобретённую. Процесс может располагаться справа или слева, бывает тотальным или частичным. В зависимости от клинического течения выделяют 4 варианта релаксации диафрагмального свода:
- Бессимптомный. Проявления болезни отсутствуют. Релаксация выявляется случайно при рентгенографии грудной клетки.
- Со стёртыми клиническими симптомами. Такая форма характерна для ограниченного, чаще правостороннего процесса. Пациент обычно не придаёт значения непостоянным, слабо выраженным симптомам болезни.

- С развёрнутой клинической картиной. Проявляется разнообразной симптоматикой, зависящей от степени повреждения дыхательной, пищеварительной, сердечно-сосудистой систем.
- Осложнённый. Характеризуется развитием серьёзных осложнений (завороты, язвы желудка и кишечника, желудочно-кишечные кровотечения и другие).
Симптомы релаксации диафрагмы
Клинические проявления релаксации диафрагмального купола разнообразны. Симптомы более выражены при врождённой патологии. Ограниченная релаксация участка диафрагмы может протекать латентно или с минимальными жалобами. При тотальном отсутствии тонуса грудобрюшной перегородки заболевание сопровождается респираторным, кардиоваскулярным, диспепсическим синдромами. Большинство пациентов предъявляют общие жалобы на эпизоды слабости, немотивированное снижение веса.
Дыхательные нарушения проявляются приступами одышки и сухого непродуктивного мучительного кашля при небольшой физической нагрузке, изменении положения тела, после еды. Чёткая связь симптомов с приёмом пищи является патогномоничным признаком заболеваний диафрагмального купола. Страдает сердечная деятельность. Возникает тахикардия, нарушения ритма работы сердца и ощущение сердцебиения. Периодически пациента беспокоит загрудинная боль давящего, сжимающего характера, напоминающая кардиалгию при стенокардии.
Чёткая связь симптомов с приёмом пищи является патогномоничным признаком заболеваний диафрагмального купола. Страдает сердечная деятельность. Возникает тахикардия, нарушения ритма работы сердца и ощущение сердцебиения. Периодически пациента беспокоит загрудинная боль давящего, сжимающего характера, напоминающая кардиалгию при стенокардии.
Ведущими признаками патологии диафрагмы являются расстройства пищеварения. Приступы острых болей в эпигастральной области, правом или левом подреберьях тоже возникают после еды. Болевые ощущения достаточно интенсивны, продолжаются от 20-30 минут до 2-3 часов, затем самостоятельно купируются. При перегибе пищевода нарушается глотание. В некоторых случаях больной способен проглотить большие куски твёрдой пищи, а жидкостью поперхивается (парадоксальная дисфагия). Пациенты часто предъявляют жалобы на изжогу, икоту, отрыжку, тошноту, реже – рвоту. Больных беспокоят метеоризм и периодические запоры.
Осложнения
Под влиянием ряда факторов, повышающих внутрибрюшное давление, релаксация диафрагмы, особенно врождённая, постепенно прогрессирует. Купол грудобрюшной преграды может достигать уровня второго ребра. При этом происходит выраженное смещение внутренних органов. Лёгкое поджимается, образуются участки ателектаза. Подтянутые кверху желудок и кишечник занимают неправильную позицию. Из-за этого развиваются тяжёлые осложнения со стороны органов пищеварения. Самыми частыми из них являются завороты желудка, кишечника, язвенные процессы, кровотечения. Ведущие специалисты в области хирургии описывают единичные случаи гангрены желудка.
Купол грудобрюшной преграды может достигать уровня второго ребра. При этом происходит выраженное смещение внутренних органов. Лёгкое поджимается, образуются участки ателектаза. Подтянутые кверху желудок и кишечник занимают неправильную позицию. Из-за этого развиваются тяжёлые осложнения со стороны органов пищеварения. Самыми частыми из них являются завороты желудка, кишечника, язвенные процессы, кровотечения. Ведущие специалисты в области хирургии описывают единичные случаи гангрены желудка.
Диагностика
При подозрении на релаксацию диафрагмального купола диагностическим поиском занимается врач-хирург. Опрашивая пациента, он уточняет наличие в анамнезе травм и операций в области грудной клетки и живота, воспалительных процессов лёгких, плевры, средостения, верхнего этажа брюшной полости. Для подтверждения диагноза выполняются следующие исследования:
- Осмотр. Иногда визуально удаётся определить парадоксальное движение одного из диафрагмальных куполов.
 Диафрагма поднимается во время вдоха и опускается на выдохе. Присутствует положительный симптом Гувера – подъём одной из рёберных дуг и смещение кнаружи при глубоком вдохе.
Диафрагма поднимается во время вдоха и опускается на выдохе. Присутствует положительный симптом Гувера – подъём одной из рёберных дуг и смещение кнаружи при глубоком вдохе. - Перкуссия. Определяется расширение кверху поддиафрагмального пространства Траубе. Нижняя граница лёгкого располагается на уровне II-IV ребра по передней поверхности грудной стенки. Границы абсолютной и относительной сердечной тупости смещаются в противоположную сторону.
- Аускультация. В базальных отделах лёгких выслушивается ослабленное дыхание. При аускультации сердца выявляется приглушение тонов, учащение частоты сердечных сокращений, нарушение ритма. В нижней части грудной клетки спереди можно услышать кишечную перистальтику, шум плеска.
- Функциональные исследования. Спирометрия даёт возможность выявить рестриктивные нарушения функции внешнего дыхания, значительное снижение жизненной ёмкости лёгких. На ЭКГ определяются замедление внутрижелудочковой проводимости, экстрасистолия, признаки ишемии миокарда.

- Лучевая диагностика. Рентгенография и КТ грудной клетки являются наиболее информативными методами исследования диафрагмы. На рентгенограмме визуализируется высокое расположение одного из куполов (уровень II–V ребра). При рентгеноскопии обнаруживается парадоксальное движение диафрагмального свода. Использование контраста позволяет выявить перегибы пищевода, желудка, смещение органов пищеварения кверху. КТ наиболее точно определяет степень релаксации, помогает распознать вторичную патологию внутренних органов.
КТ органов грудной клетки. Релаксация, высокое положение правого купола диафрагмы
Полную релаксацию грудобрюшной преграды следует дифференцировать с её разрывом и диафрагмальными грыжами. Иногда высокое стояние одного из сводов может скрывать базальный спонтанный пневмоторакс. Частичная релаксация нередко маскирует неопластические и воспалительные процессы внутренних органов, плевры и брюшины, кисты печени и перикарда.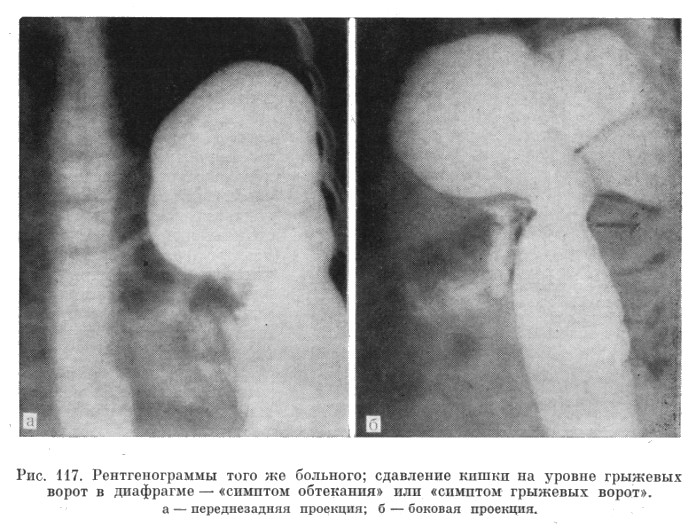
Лечение релаксации диафрагмы
Единственный метод лечения полной или частичной релаксации – хирургический. Пациенты с латентной формой заболевания и стёртой клинической картиной подлежат динамическому наблюдению. Им рекомендуется избегать чрезмерных физических нагрузок, питаться часто малыми порциями, не допускать переедания. При прогрессировании процесса, наличии выраженных кардиоваскулярных, респираторных или диспепсических нарушений показано оперативное вмешательство. Релаксация диафрагмы, осложнённая разрывом органа, заворотом желудка, кишки, кровотечением подлежит экстренной хирургической коррекции.
С учётом локализации патологического процесса выполняется лапаротомия или торакотомия. Разработан малоинвазивный торакоскопический доступ. При умеренной релаксации с частичным сохранением мышечного тонуса возможна френопликация – иссечение истончённой части органа с последующим её удвоением или утроением собственными диафрагмальными тканями. Полная релаксация правого или левого купола является показанием для пластики синтетическим материалом (тефлоном, поливинилалкоголем, териленом). В детской хирургии применяется прошивание грудобрюшной преграды параллельными рядами гофрирующих швов, которые затем стягиваются, образуют складки и низводят диафрагму.
Полная релаксация правого или левого купола является показанием для пластики синтетическим материалом (тефлоном, поливинилалкоголем, териленом). В детской хирургии применяется прошивание грудобрюшной преграды параллельными рядами гофрирующих швов, которые затем стягиваются, образуют складки и низводят диафрагму.
Прогноз и профилактика
Своевременная диагностика и правильная хирургическая тактика приводят к полному выздоровлению. Прогноз ухудшают жизнеугрожающие осложнения и тяжёлая сопутствующая патология. Пренатальное ультразвуковое исследование позволяет выявить отсутствие диафрагмальной мускулатуры у плода. Выявленную релаксацию необходимо корригировать до развития осложнений. Профилактика травматизма, диагностика и адекватное лечение воспалительных процессов лёгочной паренхимы, плевры, средостения, дренирование поддиафрагмальных абсцессов помогают избежать приобретённого паралича диафрагмы.
Физиология, дыхательный объем — StatPearls
Введение
Дыхательный объем — это количество воздуха, которое входит или выходит из легких при каждом дыхательном цикле. Он составляет около 500 мл у среднего здорового взрослого мужчины и около 400 мл у здоровой женщины. Это жизненно важный клинический параметр, который обеспечивает надлежащую вентиляцию легких. Когда человек вдыхает, в легкие поступает кислород из окружающей атмосферы. Затем он диффундирует через альвеолярно-капиллярную поверхность и достигает артериальной крови. В то же время углекислый газ образуется непрерывно, пока идет обмен веществ. Выдох происходит для удаления углекислого газа и предотвращения его накопления в организме. Объем вдыхаемого и выдыхаемого воздуха, который помогает поддерживать стабильный уровень кислорода и углекислого газа в крови, в физиологии называется дыхательным объемом.[1]
Он составляет около 500 мл у среднего здорового взрослого мужчины и около 400 мл у здоровой женщины. Это жизненно важный клинический параметр, который обеспечивает надлежащую вентиляцию легких. Когда человек вдыхает, в легкие поступает кислород из окружающей атмосферы. Затем он диффундирует через альвеолярно-капиллярную поверхность и достигает артериальной крови. В то же время углекислый газ образуется непрерывно, пока идет обмен веществ. Выдох происходит для удаления углекислого газа и предотвращения его накопления в организме. Объем вдыхаемого и выдыхаемого воздуха, который помогает поддерживать стабильный уровень кислорода и углекислого газа в крови, в физиологии называется дыхательным объемом.[1]
Вопросы, вызывающие озабоченность
Дыхательный объем имеет жизненно важное значение, когда речь идет о настройке аппарата ИВЛ у пациентов в критическом состоянии. Цель состоит в том, чтобы обеспечить дыхательный объем, достаточно большой для поддержания адекватной вентиляции, но достаточно малый, чтобы предотвратить травму легких. Первоначально искусственная вентиляция легких включала доставку дыхательных объемов 10 мл/кг идеальной массы тела или выше. Обоснование состояло в том, чтобы уменьшить гипоксемию, предотвратить закрытие дыхательных путей и увеличить функциональную остаточную емкость. Однако вентиляция с большими дыхательными объемами вызывает волюметрию из-за перерастяжения альвеол и повторного раскрытия спавшихся альвеол. В результате инициируется воспалительный каскад, характеризующийся повышенной проницаемостью легких, отеком легких, изменением сурфактанта и выработкой цитокинов, которые повреждают легкие. Не было до 1974, Уэбб и Тирни описали это явление, названное волюмотравмой, когда они продемонстрировали отек легких у крыс после воздействия высокого давления накачки. Повреждение легких во время механической вентиляции может быть вызвано вентиляцией с большими дыхательными объемами в здоровых легких, а также с небольшими дыхательными объемами в поврежденных легких.
Первоначально искусственная вентиляция легких включала доставку дыхательных объемов 10 мл/кг идеальной массы тела или выше. Обоснование состояло в том, чтобы уменьшить гипоксемию, предотвратить закрытие дыхательных путей и увеличить функциональную остаточную емкость. Однако вентиляция с большими дыхательными объемами вызывает волюметрию из-за перерастяжения альвеол и повторного раскрытия спавшихся альвеол. В результате инициируется воспалительный каскад, характеризующийся повышенной проницаемостью легких, отеком легких, изменением сурфактанта и выработкой цитокинов, которые повреждают легкие. Не было до 1974, Уэбб и Тирни описали это явление, названное волюмотравмой, когда они продемонстрировали отек легких у крыс после воздействия высокого давления накачки. Повреждение легких во время механической вентиляции может быть вызвано вентиляцией с большими дыхательными объемами в здоровых легких, а также с небольшими дыхательными объемами в поврежденных легких.
Вентиляция с большими дыхательными объемами также может вызвать баротравму, состояние, характеризующееся разрывом альвеол и последующим скоплением воздуха в плевральной полости или средостении. У пациентов с искусственной вентиляцией легких мониторинг давления на плато является надежным способом прогнозирования риска баротравмы. Давление плато — это давление, оказываемое на мелкие дыхательные пути и альвеолы во время искусственной вентиляции легких. В основном это зависит от растяжимости и дыхательного объема. По мере снижения комплаенса давление плато увеличивается, а вместе с ним и риск баротравмы. Следовательно, увеличение давления плато требует снижения дыхательного объема, чтобы снизить риск разрыва альвеол. В связи с продолжающимися исследованиями в области искусственной вентиляции легких, защищающей легкие, использование дыхательного объема 6 мл / кг прогнозируемой массы тела в настоящее время является обычной практикой. [2] [3] [4]
У пациентов с искусственной вентиляцией легких мониторинг давления на плато является надежным способом прогнозирования риска баротравмы. Давление плато — это давление, оказываемое на мелкие дыхательные пути и альвеолы во время искусственной вентиляции легких. В основном это зависит от растяжимости и дыхательного объема. По мере снижения комплаенса давление плато увеличивается, а вместе с ним и риск баротравмы. Следовательно, увеличение давления плато требует снижения дыхательного объема, чтобы снизить риск разрыва альвеол. В связи с продолжающимися исследованиями в области искусственной вентиляции легких, защищающей легкие, использование дыхательного объема 6 мл / кг прогнозируемой массы тела в настоящее время является обычной практикой. [2] [3] [4]
Задействованные системы органов
Легкие отвечают за обеспечение дыхательного объема, способного поддерживать адекватную вентиляцию. Однако создание точных дыхательных объемов зависит от сложной координации между дыхательным центром в головном мозге и дыхательными мышцами. Водитель ритма дыхания в стволе мозга определяет частоту и глубину дыхания. В ответ на изменения уровня кислорода и углекислого газа в крови центральные и периферические хеморецепторы посылают информацию в ствол мозга, чтобы модулировать частоту и характер срабатывания кардиостимулятора. Диафрагма и другие инспираторные мышцы реагируют изменением дыхательного объема и частоты дыхания. Цель состоит в том, чтобы поддерживать адекватный уровень кислорода и углекислого газа в крови. Во время физических упражнений, например, увеличивается потребление кислорода и накапливается углекислый газ. В результате частота дыхания и дыхательный объем увеличиваются, чтобы удовлетворить растущий спрос.[5]
Водитель ритма дыхания в стволе мозга определяет частоту и глубину дыхания. В ответ на изменения уровня кислорода и углекислого газа в крови центральные и периферические хеморецепторы посылают информацию в ствол мозга, чтобы модулировать частоту и характер срабатывания кардиостимулятора. Диафрагма и другие инспираторные мышцы реагируют изменением дыхательного объема и частоты дыхания. Цель состоит в том, чтобы поддерживать адекватный уровень кислорода и углекислого газа в крови. Во время физических упражнений, например, увеличивается потребление кислорода и накапливается углекислый газ. В результате частота дыхания и дыхательный объем увеличиваются, чтобы удовлетворить растущий спрос.[5]
Функция
Функционально дыхательные пути состоят из проводящих дыхательных путей, идущих от носа к терминальным бронхиолам, и газообменных дыхательных путей, идущих от дыхательных бронхиол к альвеолам в легких. Мертвое пространство относится к участкам легких, которые наполняются воздухом, но не участвуют в газообмене. Первичным детерминантом мертвого пространства является анатомическое мертвое пространство, которое относится к воздуху в проводящих дыхательных путях. Альвеолярное мертвое пространство, с другой стороны, относится к альвеолам, которые заполнены воздухом, но не участвуют в газообмене. Он вносит незначительный вклад в мертвое пространство. Вместе анатомическое и альвеолярное мертвое пространство образуют физиологическое мертвое пространство, которое представляет собой общее количество воздуха в легких, не участвующего в газообмене.
Первичным детерминантом мертвого пространства является анатомическое мертвое пространство, которое относится к воздуху в проводящих дыхательных путях. Альвеолярное мертвое пространство, с другой стороны, относится к альвеолам, которые заполнены воздухом, но не участвуют в газообмене. Он вносит незначительный вклад в мертвое пространство. Вместе анатомическое и альвеолярное мертвое пространство образуют физиологическое мертвое пространство, которое представляет собой общее количество воздуха в легких, не участвующего в газообмене.
Дыхательный объем — это практически каждый вдох человека. Это один из основных факторов, определяющих минутную вентиляцию и альвеолярную вентиляцию. Минутная вентиляция, также известная как общая вентиляция, представляет собой измерение количества воздуха, поступающего в легкие в минуту. Это произведение частоты дыхания и дыхательного объема. Альвеолярная вентиляция, с другой стороны, принимает во внимание физиологическое мертвое пространство. Он представляет собой объем воздуха, который достигает зоны дыхания в минуту.
Поскольку альвеолярная вентиляция учитывает мертвое пространство, она представляет фактическую вентиляцию. Как правило, дыхательный объем и частота дыхания вносят равный вклад в минутную вентиляцию легких. Другими словами, удвоение любого из них приводит к одинаковому увеличению минутной вентиляции. Однако когда дело доходит до альвеолярной вентиляции, увеличение дыхательного объема является более эффективным способом, чем увеличение частоты дыхания. Таким образом, удвоение дыхательного объема улучшает альвеолярную вентиляцию больше, чем удвоение частоты дыхания. Эта концепция оказывается актуальной, когда речь идет о пациентах с гиперкапнией. Гиперкапния вызывает паттерн дыхания, характеризующийся относительно большим увеличением дыхательного объема, чем частота дыхания, чтобы минимизировать вентиляцию мертвого пространства. Другими словами, пациенты с гиперкапнией компенсируют это медленными глубокими вдохами, чтобы оптимизировать выведение CO2. Единственный способ свести к минимуму вентиляцию мертвого пространства — увеличить объем воздуха, достигающего дыхательной зоны, что можно сделать только за счет увеличения дыхательного объема. [6]
[6]
Механизм
Воздух поступает в легкие и выходит из них за счет движений диафрагмы и грудной клетки. Диафрагма является основной мышцей вдоха и именно она вносит наибольший вклад в дыхательные объемы. Когда диафрагма сокращается, грудная полость расширяется вертикально. В результате внутриплевральное давление снижается с -5 см вод. ст. до примерно -8 см вод. ст. Поскольку легкие соединены с грудной стенкой через плевру, отрицательное внутриплевральное давление притягивает легкие к грудной стенке, что приводит к увеличению объема легких. По мере увеличения объема легких давление снижается в соответствии с законом Бойля. В результате субатмосферное внутриальвеолярное давление затем втягивает воздух в альвеолы в зависимости от разницы давлений. После выравнивания давления доставляется дыхательный объем примерно 500 мл.
В отличие от этого, выдох обычно является пассивным процессом, происходящим из-за эластичности легких после расслабления диафрагмы. Расслабление диафрагмы заставляет грудную клетку двигаться ближе к легким, что приводит к увеличению внутриплеврального давления до -5 см вод. ст. В результате объем легких уменьшается, а давление становится выше атмосферного. Это вытесняет воздух из легких в соответствии с перепадом давления, и легкие возвращаются в состояние покоя.
ст. В результате объем легких уменьшается, а давление становится выше атмосферного. Это вытесняет воздух из легких в соответствии с перепадом давления, и легкие возвращаются в состояние покоя.
Дыхательный объем во время сна
Сон различными способами изменяет физиологию дыхания. Быстрый сон, в частности, представляет собой фазу сна с наибольшей степенью нерегулярности дыхания, как по частоте, так и по частоте дыхания. Во время БДГ почти все мышцы тела, включая дыхательные мышцы, становятся гипотоническими, кроме диафрагмы. Следовательно, человек полагается на диафрагму для поддержания адекватного дыхательного объема во время БДГ. Кроме того, снижается дыхательный ответ на гипоксические и гиперкапнические раздражители, не говоря уже о снижении центрального дыхательного драйва, что, наряду с параличом вспомогательных мышц, приводит к незначительному снижению дыхательного объема и минутной вентиляции. Это изменение обычно не заметно у здоровых людей, но становится заметным у пациентов с ранее существовавшим респираторным заболеванием. [7]
[7]
Связанное тестирование
Физиологически легочные объемы могут быть как динамическими, так и статическими. Динамические объемы легких по определению зависят от скорости воздушного потока. Напротив, статические объемы легких не зависят от скорости потока. Различные легочные патологии вызывают изменения легочных объемов. Таким образом, исследование функции легких дает ценную диагностическую информацию, поскольку помогает измерять различные объемы и емкости легких.
Спирометрия является важным тестом, используемым пульмонологами для диагностики рестриктивных и обструктивных заболеваний легких. Он измеряет, как воздух поступает в легкие и выходит из них, и регистрирует несколько объемов и объемов легких. Во время спирометрии пациент делает нормальный вдох, за которым следует полный вдох, максимальный форсированный выдох, а затем еще один нормальный вдох.
Дыхательный объем — это статический легочный объем, который наряду с другими статическими и динамическими легочными объемами важен для диагностики пациентов с обструктивными и рестриктивными заболеваниями легких. Спирометрия регистрирует дыхательный объем, когда пациент дышит спокойно. У здоровых взрослых он составляет примерно 7 мл/кг идеальной массы тела. У среднего здорового взрослого человека 500 мл поступает в легкие при каждом спокойном вдохе, из которых только 350 мл достигают дыхательной зоны, поскольку мертвое пространство составляет примерно 150 мл.[5]
Спирометрия регистрирует дыхательный объем, когда пациент дышит спокойно. У здоровых взрослых он составляет примерно 7 мл/кг идеальной массы тела. У среднего здорового взрослого человека 500 мл поступает в легкие при каждом спокойном вдохе, из которых только 350 мл достигают дыхательной зоны, поскольку мертвое пространство составляет примерно 150 мл.[5]
Клиническая значимость
Рестриктивные заболевания легких
Рестриктивные заболевания легких представляют собой группу хронических заболеваний легких, характеризующихся неспособностью легких полностью расшириться из-за проблем в самих легких или окружающих их структурах. Интерстициальные заболевания легких, такие как идиопатический легочный фиброз и асбестоз, вызывают прогрессирующий фиброз легочной ткани. Как таковые, они представляют собой внутреннюю патологию легких, которая приводит к физиологии рестрикции из-за повышенной жесткости и снижения податливости. Морбидное ожирение и саркоидоз являются примерами внешних проблем, которые вызывают ограничения путем ограничения расширения грудной клетки. При рестриктивном заболевании легких пациент адаптирует частые и поверхностные вдохи, чтобы свести к минимуму работу дыхания.
При рестриктивном заболевании легких пациент адаптирует частые и поверхностные вдохи, чтобы свести к минимуму работу дыхания.
Обструктивные заболевания легких
Отличительной чертой обструктивной болезни легких является затрудненное удаление воздуха из легких из-за прогрессирующего сужения дыхательных путей. Хроническая обструктивная болезнь легких (ХОБЛ) и астма являются двумя типичными примерами обструктивной болезни легких. Бронхиальная астма — это обратимое состояние, характеризующееся гиперреактивностью дыхательных путей на различные раздражители. Это вызывает эпизоды чрезмерного образования слизи, бронхоконстрикции и сужения дыхательных путей. С другой стороны, ХОБЛ представляет собой необратимый хронический воспалительный процесс, приводящий к постепенному уменьшению просвета проводящих дыхательных путей. По мере прогрессирования состояния возникает воздушная ловушка, что приводит к гиперинфляции легких. Поскольку проблема обструктивного заболевания легких связана с выдохом, дыхание с более высоким дыхательным объемом помогает преодолеть сопротивление дыхательных путей. Таким образом, пациенты приобретают паттерн дыхания, состоящий из глубоких и медленных вдохов, чтобы свести к минимуму работу дыхания.
Таким образом, пациенты приобретают паттерн дыхания, состоящий из глубоких и медленных вдохов, чтобы свести к минимуму работу дыхания.
Механическая вентиляция
Острый респираторный дистресс-синдром, или ОРДС, представляет собой состояние, характеризующееся распространенным воспалением легких после провоцирующего легочного или внелегочного события. ОРДС обычно вызывает гипоксическую дыхательную недостаточность или критически низкое давление кислорода в артериальной крови, что требует искусственной вентиляции легких. У пациентов с ОРДС уже есть поврежденные легкие, и искусственная вентиляция легких должна следовать стратегии защиты легких. Другими словами, дыхательные объемы должны быть как можно ниже, чтобы предотвратить волюмотравму и баротравму. Проблема ОРДС заключается в том, что отек легких и коллапс дистальных отделов дыхательных путей уменьшают площадь поверхности вентилируемых легких. Следовательно, вентиляция с большими или даже регулярными дыхательными объемами может вызвать гиперинфляцию здоровой аэрируемой части легких, поскольку воздух не достигает уже спавшихся дыхательных путей. В результате может возникнуть перерастяжение альвеол и повреждение легких. Как правило, стратегии защиты легких у пациентов с ОРДС включают введение дыхательного объема приблизительно 6-8 мл/кг идеальной массы тела.[8][9]]
В результате может возникнуть перерастяжение альвеол и повреждение легких. Как правило, стратегии защиты легких у пациентов с ОРДС включают введение дыхательного объема приблизительно 6-8 мл/кг идеальной массы тела.[8][9]]
Нервно-мышечное заболевание
Нервно-мышечные заболевания относятся к группе заболеваний, характеризующихся прогрессирующей мышечной слабостью из-за проблем в самих мышцах или нервах, которые их иннервируют. У пациентов с нервно-мышечными заболеваниями (НМЗ) в конечном итоге развивается слабость дыхательных мышц. Диафрагма является основной мышцей вдоха и наиболее часто поражается при НМД. Пациенты со слабой диафрагмой полагаются на другие мышцы вдоха, такие как наружные межреберные, для поддержания адекватного дыхательного объема. Во время БДГ-сна возникает генерализованная гипотония всех дыхательных мышц, кроме диафрагмы, и здоровый человек становится диафрагмозависимым. У пациентов с НМД одышка становится заметной ночью из-за слабости диафрагмы. Ночная гиповентиляция, связанная с БДГ, является одним из самых ранних признаков поражения дыхательных мышц при нервно-мышечном заболевании. По мере прогрессирования заболевания дневные симптомы становятся заметными, и пациенты полагаются на паттерн дыхания, аналогичный тому, который наблюдается при других рестриктивных заболеваниях легких, т. е. поверхностное, учащенное дыхание.
Ночная гиповентиляция, связанная с БДГ, является одним из самых ранних признаков поражения дыхательных мышц при нервно-мышечном заболевании. По мере прогрессирования заболевания дневные симптомы становятся заметными, и пациенты полагаются на паттерн дыхания, аналогичный тому, который наблюдается при других рестриктивных заболеваниях легких, т. е. поверхностное, учащенное дыхание.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Sterling GM. Вентиляция. Бр Дж Клин Фармакол. 1979 декабрь; 8 (6): 513-21. [Бесплатная статья PMC: PMC1429904] [PubMed: 391255]
- 2.
Иоаннидис Г., Лазаридис Г., Бака С., Мпуховинас И., Каравасилис В., Лампаки С., Киумис И., Питсиоу Г., Папайванноу А., Каравергу Кацикояннис Н., Сарика Э., Цакиридис К., Коранцис И., Зарогулидис К., Зарогулидис П.
 Баротравма и пневмоторакс. Дж. Торак Дис. 7 февраля 2015 г. (Приложение 1): S38-43. [Бесплатная статья PMC: PMC4332090] [PubMed: 25774306]
Баротравма и пневмоторакс. Дж. Торак Дис. 7 февраля 2015 г. (Приложение 1): S38-43. [Бесплатная статья PMC: PMC4332090] [PubMed: 25774306]- 3.
Лутфи М.Ф. Физиологическая основа и клиническое значение измерения объема легких. Мультидисциплинарный респираторный мед. 2017;12:3. [Бесплатная статья PMC: PMC5299792] [PubMed: 28194273]
- 4.
Mauri T, Cambiaghi B, Spinelli E, Langer T, Grasselli G. Спонтанное дыхание: палка о двух концах, с которой нужно обращаться осторожно. Энн Трансл Мед. 2017 июль;5(14):292. [Бесплатная статья PMC: PMC5537122] [PubMed: 28828367]
- 5.
Пирс Р. Спирометрия: важное клиническое измерение. Врач Ауст Фам. 2005 г., июль; 34 (7): 535-9. [PubMed: 15999163]
- 6.
Браун С.Р. Частота дыхания и характер дыхания. В: Уокер Х.К., Холл В.Д., Херст Дж.В., редакторы. Клинические методы: анамнез, физические и лабораторные исследования. 3-е изд. Баттервортс; Boston: 1990.
 [PubMed: 21250206]
[PubMed: 21250206]- 7.
Се А. Влияние сна на дыхание. Почему повторяющиеся апноэ наблюдаются только во время сна. Дж. Торак Дис. 2012 01 апр;4(2):194-7. [Бесплатная статья PMC: PMC3378217] [PubMed: 22833825]
- 8.
Малхотра А. Вентиляция с низким дыхательным объемом при остром респираторном дистресс-синдроме. N Engl J Med. 2007 г., 13 сентября; 357(11):1113-20. [Бесплатная статья PMC: PMC2287190] [PubMed: 17855672]
- 9.
Боутон Д.Л., Скотт Л.К. Вентиляционное управление неповрежденным легким. Клин Грудь Med. 2016 декабрь; 37 (4): 701-710. [PubMed: 27842750]
- 10.
Aboussouan LS. Нарушение дыхания во сне при нервно-мышечных заболеваниях. Am J Respir Crit Care Med. 2015 01 мая; 191(9):979-89. [PubMed: 25723731]
- 11.
Фермин А.М., Афзал У., Кулебрас А. Сон при нервно-мышечных заболеваниях. Медицинская клиника сна. 2016 март; 11(1):53-64. [PubMed: 26972033]
Объемы легких — Physiopedia
Исходный редактор — Simisola Ajeyalemi Ведущие участники — Симизола Аджеялеми , Учечукву Чуквуэмека , Ким Джексон , Адам Валлели Фаррелл и Жоао Коста
Содержимое
- 1 Описание
- 2 легочных объема
- 3 Объем легких
- 4 Измерение легочных объемов
- 4.
 1 Плетизмография тела
1 Плетизмография тела - 4.2 Промывка азотом
- 4.3 Разбавление гелием
- 4.
- 5 ресурсов
- 6 Каталожные номера
Легочные объемы также известны как дыхательные объемы. Он относится к объему газа в легких в данный момент времени во время дыхательного цикла. Емкости легких получают путем суммирования различных объемов легких. Средняя общая емкость легких взрослого мужчины составляет около 6 литров воздуха. Измерение легочных объемов является неотъемлемой частью исследования функции внешнего дыхания. Эти объемы имеют тенденцию изменяться в зависимости от глубины дыхания, этнической принадлежности, пола, возраста, состава тела [1] и при некоторых респираторных заболеваниях. Ряд легочных объемов можно измерить с помощью спирометрии – дыхательный объем, резервный объем вдоха и резервный объем выдоха. Однако измерение остаточного объема, функциональной остаточной емкости и общей емкости легких осуществляется с помощью плетизмографии тела, вымывания азотом и метода разбавления гелием.
Изображение: легкие in situ — вид спереди [2]
- Дыхательный объем (TV)
Количество воздуха, которое можно вдохнуть или выдохнуть за один дыхательный цикл [3] . Здесь показаны функции дыхательных центров, дыхательных мышц и механика легких и грудной клетки [4] .
Нормальное значение для взрослых составляет 10% жизненной емкости легких (ЖЕЛ), примерно 300-500 мл (6-8 мл/кг) [4] ; но может увеличиваться до 50% ЖЕЛ при упражнении [5]
- Резервный объем вдоха (IRV)
Это количество воздуха, которое можно форсировано вдохнуть после нормального дыхательного объема. IRV обычно сохраняется в резерве, но используется во время глубокого дыхания. Нормальное значение для взрослых составляет 1900-3300 мл.
- Резервный объем выдоха (ERV)
Это объем воздуха, который можно форсировано выдохнуть после выдоха с нормальным дыхательным объемом. Нормальное взрослое значение составляет 700-1200 мл. ERV снижается при ожирении, асците или после операций на верхних отделах брюшной полости [4]
Нормальное взрослое значение составляет 700-1200 мл. ERV снижается при ожирении, асците или после операций на верхних отделах брюшной полости [4]
- Остаточный объем (ОО)
Это объем воздуха, остающийся в легких после максимального выдоха. Нормальное значение для взрослых составляет в среднем 1200 мл (20-25 мл/кг). Оно косвенно измеряется суммированием ФОЕ и ЭРО и не может быть измерено с помощью спирометрии.
При обструктивных заболеваниях легких с признаками неполного опорожнения легких и воздушной ловушки РВ может быть значительно выше. RV также может быть выражен в процентах от общей емкости легких, и значения, превышающие 140%, значительно увеличивают риск баротравмы, пневмоторакса, инфекции и снижения венозного возврата из-за высокого внутригрудного давления, что наблюдается у пациентов с высоким RV, которым требуется хирургическое вмешательство. и, таким образом, механическая вентиляция требует высокого периоперационного давления надувания. [6]
[6]
- Объем вдоха (IC)
Это максимальный объем воздуха, который можно вдохнуть после состояния покоя. Он рассчитывается как сумма резервного объема вдоха и дыхательного объема. ИК = ИРВ+ТВ
- Общая емкость легких (TLC)
Это максимальный объем воздуха, который легкие могут вместить, или сумма всех объемных отсеков или объем воздуха в легких после максимального вдоха. Нормальное значение составляет около 6000 мл (4-6 л). TLC рассчитывается путем суммирования четырех первичных объемов легких (TV, IRV, ERV, RV).
TLC может повышаться у пациентов с обструктивными дефектами, такими как эмфизема, и снижаться у пациентов с рестриктивными аномалиями, включая аномалии грудной клетки и кифосколиоз [7] .
- Жизненная емкость легких (ЖЕЛ)
Это общее количество воздуха, выдыхаемого после максимального вдоха. Значение составляет около 4800 мл и варьируется в зависимости от возраста и размера тела. Он рассчитывается путем суммирования дыхательного объема, резервного объема вдоха и резервного объема выдоха. VC = TV+IRV+ERV.
Он рассчитывается путем суммирования дыхательного объема, резервного объема вдоха и резервного объема выдоха. VC = TV+IRV+ERV.
VC указывает на способность глубоко дышать и кашлять, отражая силу инспираторных и экспираторных мышц. VC должен быть в 3 раза больше TV для эффективного кашля [8] . ЖЕЛ иногда снижается при обструктивных расстройствах и всегда при рестриктивных расстройствах [8]
- Функция Остаточная емкость (ФОЕ)
Это количество воздуха, остающееся в легких в конце нормального выдоха. Он рассчитывается путем сложения остаточных объемов и резервных объемов выдоха. Нормальное значение составляет около 1800-2200 мл. ФОК = RV+ERV.
FRC не зависит от усилия и выделяет положение покоя, когда внутренняя и внешняя упругая отдача уравновешены. ФОЕ снижается при рестриктивных нарушениях. Отношение FRC к TLC является индексом гиперинфляции [9] . При ХОБЛ ФОЕ составляет до 80% от TLC [4] .
Измерение легочных объемов[править | править источник]
Измерения объема легких важны для правильного физиологического диагноза, однако его роль в оценке тяжести заболевания, функциональных нарушений, течения заболевания и реакции на лечение остается спорной. [10] Измерение может быть выполнено с использованием спирометрии, см…., Бодиплетизмографии, вымывания азотом и разбавления гелием, причем последние три метода используются для измерения статических объемов легких [7] .
Плетизмография тела[править | править код]
Плетизмография происходит от греческого слова, означающего увеличение. Плетизмография тела в первую очередь измеряет ФОЕ по закону Бойля. Это особенно подходит для пациентов, у которых есть воздушные пространства в легких, которые не сообщаются с бронхиальным деревом.
Человек удобно сидит в герметичном боксе (статические объемы легких можно получить путем измерения изменений давления в боксе постоянного объема или объема в боксе постоянного давления), в котором можно точно измерить изменения давления и объема.
Вымывание азота[править | править источник]
Этот метод основан на вымывании N2 из легких, в то время как пациент дышит 100% O2, используя свойства газов разбавления.
- Больной дышит 100% кислородом, и весь азот в легких вымывается.
- Измеряются выдыхаемый объем и концентрация азота в этом объеме.
- Разница в объеме азота при начальной концентрации и при конечной концентрации выдыхаемого воздуха позволяет рассчитать внутригрудной объем, обычно ФОЕ.
Разбавление гелия[править | править источник]
Метод измерения легочных объемов основан на уравновешивании газа в легких известным объемом газа, содержащего гелий. Этот метод включает в себя подключение субъекта к спирометру, наполненному 10% гелия в кислороде. После повторного вдоха испытуемым гелий-кислородной смеси и уравновешивания с помощью спирометра концентрация гелия в легких станет такой же, как и в спирометре. Из принципа сохранения массы можно написать, что: C1 × V1 = C2 (V1 + V2), где C1 равно начальной концентрации гелия в спирометре,
- V1 равен начальному объему гелий-кислородной смеси в спирометре,
- C2 соответствует концентрации гелия после уравновешивания,
- V2 соответствует неизвестному объему в легких.

- V2=V1 (C1-C2)/C2
- Если тест начинается в конце нормального дыхательного объема (конец выдоха), объем воздуха, оставшегося в легких, представляет собой ФОЕ.
- Если тест начинается в конце ФЖЕЛ, тест будет измерять ПЖ.
- Точно так же, если тест начинается после максимального вдоха, тогда V2 будет равняться общей емкости легких.
Чтобы лучше понять технику оценки объема легких, посмотрите видео ниже
Европейский респираторный журнал http://erj.ersjournals.com/content/26/3/511
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC32298
Лютфи М.Ф. Физиологические основы и клиническое значение измерения объема легких. Мультидисциплинарная респираторная медицина, 2017; 12:3
Руппель гл. Какова клиническая ценность легочных объемов? Респираторная помощь, 2012 г.; 57(1):126–35.
- ↑ Maiolo C, Mohamed EI, Carbonelli MG. Состав тела и дыхательная функция. Acta Diabetologica, 2003; 40 Приложение 1 (1): S32-8 · DOI: 10.1007/s00592-003-0023-0
- ↑ Легкие на месте — © Kenhub https://www.kenhub.com/en/library/anatomy/the-lung
- ↑ Guyton C, Hall, E. Тестовая книга по медицинской физиологии. Elsevier Inc. Филадельфия, Пенсильвания. 2006 г.; с.475-477.
- ↑ 4,0 4,1 4,2 4.3 Hough, A. Физиотерапия в респираторной терапии; Доказательный подход к лечению органов дыхания и сердца. 3 -й ред. Соединенное Королевство: Nelson Thomes Ltd, 2001 г., стр. 69.
- ↑ Люс Дж.М., Пирсон Д.Дж., Тайлер М.Т. Интенсивная респираторная терапия, WB Saunders, Филадельфия, Пенсильвания, стр. 21.
- ↑ Уайлд М., Наир С., Мэдден Б. Функциональные тесты легких — обзор. Уход за тяжелобольными. 2007 г.; 23 декабря (6): 173-7.
- ↑ 7,0 7,1 Рану Х.


 Сюда относятся дефекты закладки миотомов и дальнейшей дифференцировки мышечных элементов, недоразвитие или внутриутробное повреждение диафрагмального нерва. Врождённая релаксация диафрагмы нередко сочетается с другими пороками развития внутренних органов.
Сюда относятся дефекты закладки миотомов и дальнейшей дифференцировки мышечных элементов, недоразвитие или внутриутробное повреждение диафрагмального нерва. Врождённая релаксация диафрагмы нередко сочетается с другими пороками развития внутренних органов.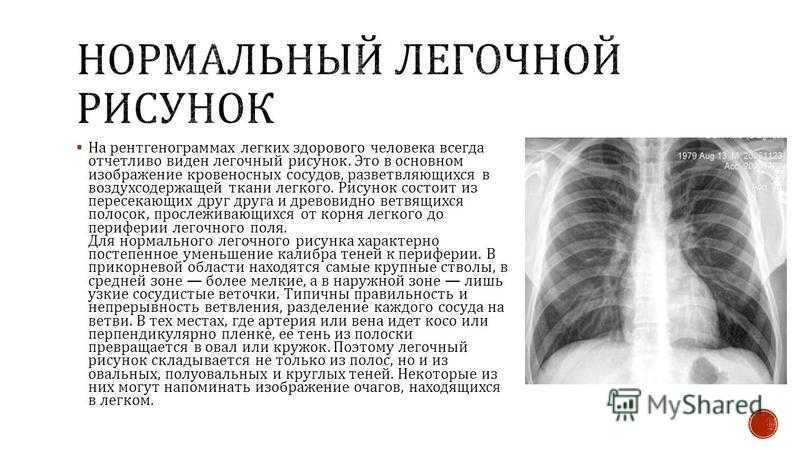

 Диафрагма поднимается во время вдоха и опускается на выдохе. Присутствует положительный симптом Гувера – подъём одной из рёберных дуг и смещение кнаружи при глубоком вдохе.
Диафрагма поднимается во время вдоха и опускается на выдохе. Присутствует положительный симптом Гувера – подъём одной из рёберных дуг и смещение кнаружи при глубоком вдохе.
 Баротравма и пневмоторакс. Дж. Торак Дис. 7 февраля 2015 г. (Приложение 1): S38-43. [Бесплатная статья PMC: PMC4332090] [PubMed: 25774306]
Баротравма и пневмоторакс. Дж. Торак Дис. 7 февраля 2015 г. (Приложение 1): S38-43. [Бесплатная статья PMC: PMC4332090] [PubMed: 25774306]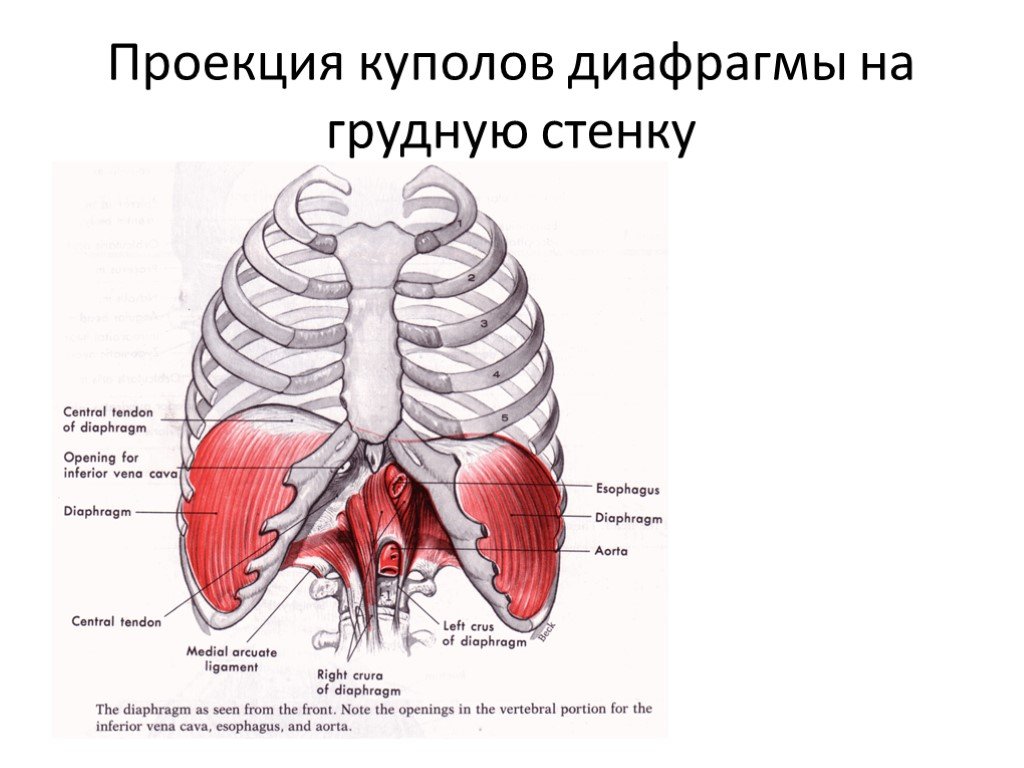 [PubMed: 21250206]
[PubMed: 21250206] 1 Плетизмография тела
1 Плетизмография тела
