Зачем нужны полиненасыщенные жирные кислоты?
Еще в 1928 г. исследователи Эванс и Бэрр обнаружили, что у крыс, получающих рацион, полностью лишенный полиненасыщенных жирных кислот, но содержащих все остальные необходимые компоненты, наблюдается замедление роста и бесплодие. У животных развивался чешуйчатый дерматит, отмирание хвоста, происходило поражение мочевой системы и набухание почек. Позднее, в экспериментах на других животных и человеке было установлено, что у млекопитающих в организме не синтезируются такие полиненасыщенные жирные кислоты как линолевая, α-линоленовая и арахидоновая. Добавляя в пищу эти эссенциальные (незаменимые) кислоты можно проводить лечение экспериментальных животных, если патологические изменения не зашли слишком далеко.
У людей при хроническом голодании также развивается чешуйчатый дерматит и отмечается нарушение транспорта липидов, что наблюдается и у грудных детей, получающих искусственное питание с незначительным содержанием жиров.
Таким образом, необходимость включения в рацион питания полиненасыщенных жирных кислот вполне очевидна.
Что такое незаменимые полиненасыщенные жирные кислоты?
Это неразветвленные одноцепочные жирные кислоты с общим числом атомов углерода от 18 до 24 и содержащие в своем составе от 2 до 6 двойных связей природной цис-конфигурации. Первоначально к незаменимым жирным кислотам относили только линолевую и α-линоленовую кислоты, которые не синтезируются организмом животных. Не вдаваясь в подробности номенклатуры отметим, что эти кислоты можно обозначить как 18:2, ω-6 и 18:3, ω-3, соответственно (Первое число — количество атомов углерода в молекуле, цифра после дроби — число двойных связей, последняя цифра — удаленность первой двойной связи от терминального, ω-конца).
Первоначально к незаменимым жирным кислотам относили только линолевую и α-линоленовую кислоты, которые не синтезируются организмом животных. Не вдаваясь в подробности номенклатуры отметим, что эти кислоты можно обозначить как 18:2, ω-6 и 18:3, ω-3, соответственно (Первое число — количество атомов углерода в молекуле, цифра после дроби — число двойных связей, последняя цифра — удаленность первой двойной связи от терминального, ω-конца).
Позднее, к незаменимым жирным кислотам стали относить также и другие полиненасыщенные жирные кислоты, являющиеся, как правило, метаболитами линолевой и α-линоленовой кислот и которые обладают нормализирующим эффектом. Среди них важнейшую роль играет арахидоновая кислота (20:4, ω-6). Арахидоновая кислота в 10 раз активнее в нормализации нарушений, чем линолевая.
В чем заключается биологическая роль полиненасыщенных жирных кислот?
Полиненасыщенные жирные кислоты являются обязательными компонентами многих клеточных структур организма, прежде всего мембран. Мембраны — это чрезвычайно вязкие, но тем не менее пластичные структуры, окружающие все живые клетки. Их пластичность определяется, прежде всего, степенью ненасыщенности жирных кислот, входящих в состав липидов мембран. Изменения в мембранных структурах могут сказываться на водном балансе, ионных потоках и на многих других процессах, протекающих внутри клетки. Отсутствие какого-то мембранного компонента или изменение мембранного состава приводит к различным заболеваниям. Например, нарушение проницаемости мембран для липопротеидов низкой плотности из-за изменения жирнокислотного состава приводит к развитию гиперхолестеринемии и артериальной коронарной недостаточности. Функциональная роль полиненасыщенных жирных кислот заключается в нормализации деятельности всех мембранных структур клеток и внутриклеточной передачи информации.
Мембраны — это чрезвычайно вязкие, но тем не менее пластичные структуры, окружающие все живые клетки. Их пластичность определяется, прежде всего, степенью ненасыщенности жирных кислот, входящих в состав липидов мембран. Изменения в мембранных структурах могут сказываться на водном балансе, ионных потоках и на многих других процессах, протекающих внутри клетки. Отсутствие какого-то мембранного компонента или изменение мембранного состава приводит к различным заболеваниям. Например, нарушение проницаемости мембран для липопротеидов низкой плотности из-за изменения жирнокислотного состава приводит к развитию гиперхолестеринемии и артериальной коронарной недостаточности. Функциональная роль полиненасыщенных жирных кислот заключается в нормализации деятельности всех мембранных структур клеток и внутриклеточной передачи информации.
Но и это еще не все! Оказалось, что полиненасыщенные жирные кислоты, особенно арахидоновая, являются предшественниками образующихся из них чрезвычайно активных и важных биорегуляторов-эйкозаноидов и изоэйкозаноидов («Эйкоза» обозначает число 20 — столько атомов углерода в этих молекулах).
К эйкозаноидам относятся простагландины, лейкотриены, тромбоксаны и другие оксилипины. Эйкозаноиды принимают участие в коагулологических реакциях крови, влияют практически на все звенья гемостаза, участвуют в обеспечении тромбозорезистентности сосудистой стенки и приобретении ею прокоагуляционных свойств, регулируют межклеточные взаимодействия, модулируют гемостаз плазмы и фибринолитическую активность крови, обеспечивая равновесие между анти- и прокоагуляционными процессами, регулируют и определяют контрактильную и дилататорную активности гладкой мускулатуры дыхательных путей и сосудов, секрецию слизи, проявляют хемокинетическую и хемотактильную активность.
Варьируя соотношением различных полиненасыщенных жирных кислот, прежде всего ω-3 и ω-6 рядов, в пище или в препарате, можно влиять на состав синтезируемых эйкозаноидов. Поэтому представляется возможным воздействовать на протекание отдельных заболеваний с помощью специальной диеты или терапии.
Что является источником незаменимых полиненасыщенных жирных кислот?
Относительно короткие, до С18, и с 2-3 ненасыщенными двойными связями жирные кислоты содержатся в растительных маслах.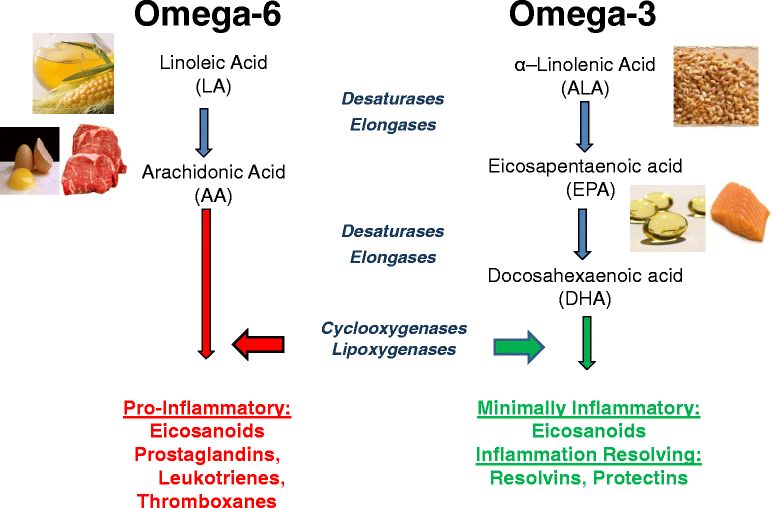

С целью профилактики и лечения целого ряда заболеваний, связанных с дефицитом незаменимых полиненасыщенных жирных кислот, разработано несколько эффективных препаратов на основе природного сырья по оригинальной наукоемкой технологии, защищенной несколькими патентами. Лечебно-профилактическая продукция «Комплекс незаменимых полиненасыщенных высших жирных кислот» выпускается в соответствии с утвержденным регламентом производства, а ее качество соответствует ТУ 9365-003-16539818-98 Госстандарта РФ. Продукция рекомендована институтом питания РАМН в качестве биологически активной добавки к пище для профилактических целей и при ряде заболеваний, имеет регистрационное удостоверение №000798.Р643.06.99г., выданное Министерством Здравоохранения РФ, от 11.06.1999г. В ходе проведенных испытаний не были обнаружены какие-либо побочные действия или противопоказания.
Значение полиненасыщенных жирных кислот в организме человека
Как приблизительно выглядит концентрат энергии?
В питании человека жиры являются наиболее сконцентрированным источником энергии. Получаем почти в два раза больше энергии из жиров, чем из углеводов. К жирам в организме человека относим: насыщенные и ненасыщенные жирные кислоты, жирорастворимые витамины и много других липидных соединений.
Концентрат энергии под лупой
Жиры являются соединениями глицерина (один из спиртов) и жирных кислот. Независимо от того получен ли жир из источника животного, или из растительного, он является композицией различных жирных кислот. Их химическое строение отвечает одному принципу: все жирные кислоты состоят из молекул углерода (C ) и водорода (H), которые присоединяют одну или две молекулы кислорода О, для того чтобы в результате превратиться в органическую кислоту, которая называется карбоновой кислотой (кислотный остаток COOH).
Жирные кислоты, которые содержатся в натуральных жирах, всегда имеют чётное количество атомов углерода. Атомы углерода соединены между собой, как правило, подобно жемчужинам в бусах.
Жиры насыщенные и ненасыщенные, но чем?
В дискуссии о биологическом значении питания для человека важную роль играют две главные группы жирных кислот: насыщенные и ненасыщенные жирные кислоты.
Когда водород насытит все связи в цепи молекул углерода, такая кислота называется насыщенной. Например, масляная кислота:
Ch4Ch3Ch3COOH
Когда два атома углерода имеют двойную связь (=), то каждый из них должен присоединить на одну молекулу водорода меньше. Тогда говорится, что это моно ненасыщенные жирные кислоты, например олеиновая кислота (18: 1)
Ch4(Ch3)7CH = CH(Ch3)7COOH
Существуют также полиненасыщенные жирные кислоты, у которых минимум две двойные связи, напр. линолевая кислота (C18:2, Ω- 6):
линолевая кислота (C18:2, Ω- 6):
Ch4(Ch3)4CH = CHCh3CH = CH(Ch3)7COOH
Как найти сокращения для названий кислот?
Названия жирных кислот включают вначале обозначения количества атомов углерода (C) в цепи, которые входят в состав кислоты.
Как пример, возьмём вышеупомянутую линолевую кислоту. Количество атомов углерода — 18. После двоеточия указывается количество двойных связей. В линолевой кислоте — их две. Получаем в записи 18:2. Информация о том, в каком месте цепи находится двойная связь (считаем с левой стороны), называется позицией омега (Ω) или же в новой номенклатуре может обозначаться буквой «n». Получаем два правильных варианта написания обозначения линолевой кислоты — один C18:2, Ω- 6 и другой C18: 2, n- 6.
О всемогущей альфа и омеге и почему кислоты соревнуются
Выше мы занимались семьей Ω- 6, а ниже находится предшественник всех жирных кислот, включенных в ряд Ω, — 3, с полным наименованием α-линоленовая кислота. Имеет три ненасыщенные связи:
Имеет три ненасыщенные связи:
Ch4Ch3CH = CHCh3CH = CHCh3CH =CH(Ch3)7COOH
α-линоленовая кислота C18:3 Ω-3
В метаболических обменах линолевая кислота (Ω- 6) и α-линоленовая кислота (Ω- 3) конкурируют за одни и те же пищеварительные энзимы (ферменты). Поэтому избыток линолевой кислоты в питании тормозит синтез кислот ЭПК и ДГК и увеличивает синтез арахидоновой кислоты (AрК). ЭПК и ДГК это жирные кислоты, которые получаются в преобразованиях из линолевой кислоты. Избыток арахидоновой кислоты может нарушить равновесие физиологичных процессов в организме человека и привести к определённым патофизиологическим состояниям. Наличие в пище кислот из семьи Ω- 3, а особенно ЭПК и ДГК, предотвращает чрезмерное образование в организме арахидоновой кислоты. Снижается интенсивность превращений, ведущих к образованию арахидоновой кислоты АрК.
От полиненасыщенных жирных кислот много пользы
Полиненасыщенные жирные кислоты необходимы для правильного развития молодых организмов, а также поддержания хорошего состояния здоровья человека. Эти кислоты относятся и к семье Ω- 6, и к семье Ω- 3.
Эти кислоты относятся и к семье Ω- 6, и к семье Ω- 3.
К ним относится и линолевая кислота (C18: 2, Ω- 6) и образующиеся из неё в тканях животных и человека жирные кислоты с более длинными цепями — из семьи Ω- 6:
— дигомо гамма линоленовая кислота (ДГЛК) (C20:3, Ω -6) — арахидоновая кислота (АрК) (C20:4, Ω-6) — альфа-линоленовая кислота (C18:3 Ω-3)
и относящиеся к семье Ω -3
эйкозапентаеновая кислота (ЭПК) (C20:5, Ω-3)
докозагексаеновая кислота (ДГК) (C22:6, Ω-3)
Двадцатиуглеродные кислоты — это субстраты для синтеза эйкозаноидов, в состав которых входят необходимые в метаболизме простагландины, простациклины, тромбоксаны, лейкотриены, гидрокси-эпокси- — жирные кислоты, а также липоксины.
Эйкозаноиды- тканевые гормоны и их бесконечный диапазон обязанностей
Эйкозаноиды можно трактовать, как расположенные наиболее внешне медиаторы I-го ряда, которые на уровне клетки, усиливают либо ослабляют регулирующее действие гормонов и нейромедиаторов. Субстраты для синтеза эйкозаноидов находятся в фосфолипидах клеточной мембраны.
Субстраты для синтеза эйкозаноидов находятся в фосфолипидах клеточной мембраны.
В последние годы накоплено много фактов, свидетельствующих о том, что эйкозаноиды проявляют очень широкий спектр действия.
Существенно влияют на регулирование деятельности сердечно-сосудистой системы, насыщение кислородом тканей, а также имеют антиаритмогенное действие (уменьшают риск развития аритмии). Контролируют регулирование артериального давления, равновесие систем свёртывания и противосвёртывания крови, а также стабильности кровеносных сосудов. Регулируют содержание липопротеинов, особенно фракции ЛПВП («хорошего»), триглицеридов и определенных белков липопротеина.
Влияют на настройку выносливости иммунной системы и процессов воспаления, пролиферации (возрождение и размножение) клеток, деятельности гормонов и нейромедиаторов, экспрессии генов, а также деятельность многих органов, напр. мозга, почек, лёгких и системы пищеварения, а также на ощущение боли и много других физиологическо-биохимических процессов.
Влиятельная семья Ω- 3
Установлено, что люди которые едят большое количество продуктов из моря, которые содержат жирные кислоты из семьи Ω-3, реже болеют характерными для населения промышленно развитых западных стран, так называемыми, метаболическими болезнями цивилизации.
Установлено, что у них реже бывают атеросклероз, ишемическая болезнь сердца, рак молочной железы и толстой кишки, а также тромбоз сосудов и астма. Обнаружено также лечебное действие рыбьего жира в экспериментальном кровоизлиянии в мозг, а также при инфаркте миокарда и псориазе.
Собрано много научных данных, указывающих на то, что жирные кислоты из семьи Ω- 3 имеют очень хорошее влияние на сердечно-сосудистую систему. Установлено, что рыбий жир проявляет сильное гипотензивное действие (снижает кровяное давление), поэтому должен быть рекомендован при артериальной гипертензии. Снижает он уровень ЛПОНП, триглицеридов и холестерина в сыворотке крови, особенно общего холестерина, при одновременном увеличении содержания фракции холестерина ЛПВП.
В чём содержатся представители этих семей?
Масло Ω-3 [%] / Ω-6 [%]
Сафлоровое 0 / 77
Подсолнечное 0 / 69
Кукурузное 1 / 61
Соевое 7 / 54
Из грецкого ореха 5 / 51
Кунжутное 1 / 4
Арахисовое 3 / 3
Рапсовое 10 / 22
Льняное 57 / 16
Оливковое 1 / 8
Стрессовые пропорции
В питании наших предков количество жирных кислот омега-6 было в пять раз выше, чем омега- 3.
В настоящее время, из-за изменения в подборе продуктов питания и метода обработки продуктов, пропорции эти изменились и составляют 24:1, а насытить организм жирными кислотами омега-3 стало трудно. Тем более, что источником омега 3 являются скоропортящиеся продукты, которые разрушаются при нагревании.
На протяжении последних 50 лет потребление жирных кислот в западных странах значительно снизилось. Повлияло это на снижение уровня ДГК (очень, очень важная жирная кислота омега- 3) в организме. Большее потребление жирных кислот омега- 6 связано с их наличием в полиненасыщенных маслах и в обработанных продуктах питания. Едим меньше рыбы, необработанных зерен и семян, которые также богаты жирными кислотами омега- 3.
Большее потребление жирных кислот омега- 6 связано с их наличием в полиненасыщенных маслах и в обработанных продуктах питания. Едим меньше рыбы, необработанных зерен и семян, которые также богаты жирными кислотами омега- 3.
Общее снижение потребления кислот омега- 3 приводит к дефициту ДГК, который угрожает здоровью, особенно здоровью психическому.
Д-р Joseph R. Hibbein и д-р Norman Salem из National Institute of Health в статье, опубликованной на страницах «American Journal of Clinical Nutrition», предполагают, что увеличение количества заболеваний депрессией в Северной Америке на протяжении последнего столетия, следует связывать с постоянным уменьшением потребления ДГК.
Авторы сделали это открытие в 1984 году во время исследований зависимости между низко холестериновым питанием и часто появляющимся депрессивными состоянием у людей.
Объяснить это явление тогда было сложно. Более поздние исследования установили, что люди, живущие близ побережья, питаются в основном свежей, жирной рыбой, такой как лосось и скумбрия.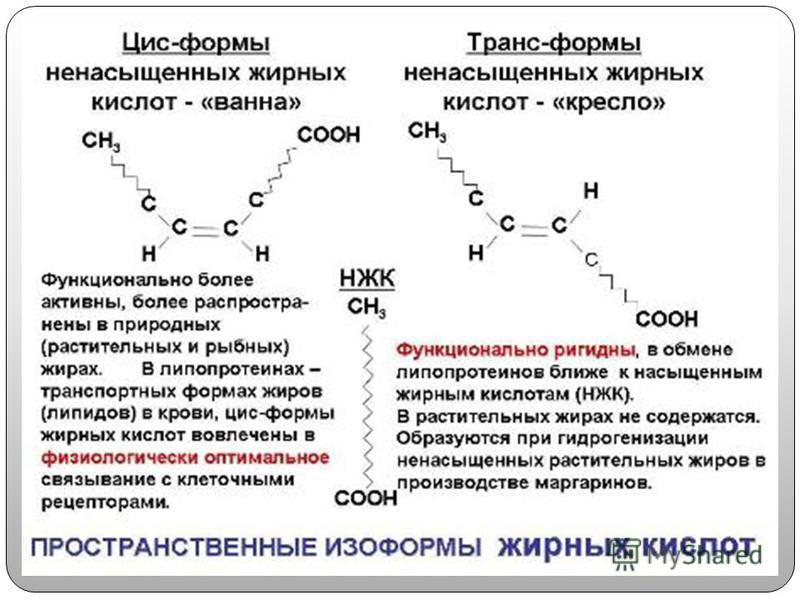 Тем временем люди, которые проживают в глубине суши редко едят рыбу. Открыто также, что чем дальше от побережья, те выше подверженность стрессу как заболеванию.
Тем временем люди, которые проживают в глубине суши редко едят рыбу. Открыто также, что чем дальше от побережья, те выше подверженность стрессу как заболеванию.
Вывод был только один: если в питании присутствуют жирные сорта рыбы, которые содержат большое количество жирных омега-3 кислот, то организм легче переносит стресс. Докозагексаеновую кислоту (ДГК) можно также принимать в виде суплемента, лучше всего две — четыре капсулы (по 250 мг) ежедневно.
Роль жирных кислот в организме человека
Омега-3, омега-6, омега-9: что такое жирные кислоты и зачем они нужны
Что такое омега жирные кислоты? Жиры — природные органические соединения, представляющие собой полные сложные эфиры трехатомного спирта глицерина ижирных кислот. Все жирные кислоты имеют четное число атомов углерода, которые присоединены друг к другу по цепи. Некоторые из них имеют простые связи между атомами углерода и называются насыщенными жирами, другие же имеют двойные связи и считаются ненасыщенными. Омега-3, омега-6 и омега-9 — все эти типы естественных ненасыщенных жиров, которые большинство экспертов в области здорового питания считают значительно полезнее, чем насыщенные жиры.
Омега-3, омега-6 и омега-9 — все эти типы естественных ненасыщенных жиров, которые большинство экспертов в области здорового питания считают значительно полезнее, чем насыщенные жиры.
Если обратиться к химической структуре — начало углеродной цепи называется «альфа», а ее конец — «омега». Омега-3 кислоты имеют тройку в названии, потому что первая молекула с двойной связью находится на три атома углерода от омега-конца (то же самое — с омега-6 и омега-9 жирными кислотами). Условно все жирные кислоты делят на две группы:
- мононенасыщенные — соседние атомы углерода имеют не более одной двойной связи (омега-9). Эти кислоты не относятся к группе незаменимых кислот.
- полиненасыщенные – здесь связей больше (омега-3 и омега-6).Полиненасыщенные жирные кислоты являются одним из очень важных базовых элементов здоровья человека и относятся к незаменимым факторам питания. Они не образуются в организме и должны поступать с пищей.
Наиболее изученными жирными кислотами являются:
из Омега -9:
- олеиновая кислота
- эруковая кислота
- эйкозеновая кислота
- мидовая кислота
- элаидиновая кислота
- нервоновая или селахолевая кислота
Источниками Омега- 9 являются: оливковое масло, арахис, авокадо, орехи и семечки, семена горчицы, льна, кунжута, а также лососевые рыбы. Некоторые из входящих в комплекс Омега -9 жирных кислот при чрезмерном и несбалансированном поступлении имеют свойство накапливаться в организме, что, разумеется, не очень хорошо для здоровья человека. Полезным в Омега -9 является то, что они повышают усвоение глюкозы и этим предупреждают развитие диабета и метаболического синдрома, предотвращают развитие рака молочной железы у женщин, а также участвуют в укреплении иммунитета. Кроме того, Омега -9 снижают уровень холестерина в крови и препятствуют оседанию холестериновых бляшек на стенках сосудов, снижая таким образом риск развития атеросклероза. Омега- 9 снижают риск развития хронических воспалений в организме за счет улучшения тканевого метаболизма. Суточная норма потребности организма человека в мононенасыщенных жирах Омега-9 колеблется в пределах 15-20% от общей калорийности пищевого рациона. В зависимости от общих показателей здоровья, возрастных особенностей и условий проживания, показатель суточной потребности может изменяться.
Некоторые из входящих в комплекс Омега -9 жирных кислот при чрезмерном и несбалансированном поступлении имеют свойство накапливаться в организме, что, разумеется, не очень хорошо для здоровья человека. Полезным в Омега -9 является то, что они повышают усвоение глюкозы и этим предупреждают развитие диабета и метаболического синдрома, предотвращают развитие рака молочной железы у женщин, а также участвуют в укреплении иммунитета. Кроме того, Омега -9 снижают уровень холестерина в крови и препятствуют оседанию холестериновых бляшек на стенках сосудов, снижая таким образом риск развития атеросклероза. Омега- 9 снижают риск развития хронических воспалений в организме за счет улучшения тканевого метаболизма. Суточная норма потребности организма человека в мононенасыщенных жирах Омега-9 колеблется в пределах 15-20% от общей калорийности пищевого рациона. В зависимости от общих показателей здоровья, возрастных особенностей и условий проживания, показатель суточной потребности может изменяться.
из Омега- 6:
- линолевая (ЛК, или, в англоязычном варианте, LA)
- арахидоновая (АРК или ARA)
Источники Омега-6 весьма обширны: в первую очередь это растительные масла — пальмовое, соевое, рапсовое, подсолнечное, энотеры, бораго, чёрной смородины, соевое, конопляное, кукурузное, хлопковое и сафлоровое. Кроме растительных масел, Омега- 6 много в мясе птицы, яйцах, подсолнечных и тыквенных семечках, авокадо, злаках и хлебе, орехах кешью, пекан и кокосовых. Омега-6 обеспечивает здоровье нашей коже и снижает уровень холестерина, улучшает свёртываемость крови, снимает воспаления, ослабляет боль. Потребность организма в Омега-6 индивидуальна для каждого человека и находится в пределах 4,5 – 8 граммов в день (5 – 8% от общей калорийности пищевого рациона).
При этом важно соблюдать соотношение Омега-3 и Омега-6 в рационе. Оптимальным соотношением Омега-3 и Омега- 6 является 1:4, но к сожалению в современном питании это соотношение иногда перекошено в пользу Омега-6 подчас в десятки раз.
из Омега- 3:
- эйкозапентаеновая (ЭПК или EPA)
- докозагексаеновая (ДГК, или DHA)
- альфа-линоленовая (АЛК или ALA)
Источником Омега -3 является, прежде всего, морская рыба. Больше всего Омега-3 содержит жирная и полужирная рыба (скумбрия, сардина, лосось, тунец и др.). Наибольшая польза от свежей рыбы, но есть жирные кислоты и в рыбных консервах в масле.
Из растений наибольшим содержанием Омега-3 могут похвастаться льняное семя и кунжут. Поэтому льняным и кунжутным маслом рекомендуется заправлять овощные салаты. Можно употреблять и порошок из семени льна, он хорош тем, что в нем еще и содержится клетчатка. Много Омега-3 в грецких орехах. Есть Омега-3 (хотя и в меньших количествах) в фасоли, цветной капусте, шпинате, брокколи.
Основная польза омега — 3 жирных кислот заключена в их способности укреплять структуру клеточных мембран. Попадая внутрь организма, кислоты улучшают клеточную деятельность, что естественным образом влияет на нормальное функционирование всех органов и систем организма.
Достаточное количество в организме омега- 3 жирных кислот позволяет достичь следующих результатов:
- улучшается работа мозга, сердечно — сосудистой системы и ЖКТ;
- нормализуется эмоциональное и психологическое состояние человека, после чего пропадает хроническая усталость, раздражение, депрессия;
- пропадают болевые ощущения и воспаление при артрозе и ревматизме;
- улучшается половая функция у мужчин;
- понижается уровень холестерина;
- улучшается работа нервной системы;
- стимулируются репродуктивная система;
- укрепляется иммунная система и выравнивается гормональный фон;
- повышается способность организма к регенерации, быстрому заживлению ран и повреждений внутренних органов;
- организм омолаживается естественным образом, повышается тонус и эластичность кожи, укрепляются ногти и волосяные луковицы;
- существенно снижается вероятность развития онкологических заболеваний.
Современные исследования установили, что на сегодняшний день среднестатистический человек потребляет этих полезных жиров непозволительно мало. Было установлено, что в рационе взрослого человека количество Омега-3 жиров составляет лишь 50-70% от жизненно необходимой нормы. Поэтому особое внимание следует уделять формированию своего пищевого рациона. Для этого необходимо знать, в каких продуктах можно найти эти необходимые Омега-3 жирные кислоты.
Оптимальное ежедневное потребление Омега-3 1 грамм в сутки. Именно такое количество необходимо для нормального функционирования клеток организма. Если перевести на пищевые продукты, то это (на выбор): 1 ст. ложка рапсового масла, 1 чайная ложка льняного семени, 5-10 штук не жареных орехов, 70 граммов лосося, 90 граммов консервированных сардин, 120 граммов тунца.
Противопоказаниями к употреблению омега- 3 являются:
- склонность к аллергии на любой вид морепродуктов;
- тяжёлые травмы, кровопотери;
- послеоперационный период;
- геморрой, болезни желчевыводящих путей, почек и печени;
- активная форма туберкулёза и некоторых заболеваниях щитовидной железы;
Но обычными последствиями, с которыми могут столкнуться здоровые люди при переизбытке омега- 3 в организме – это тошнота, диарея и другие проблемы с ЖКТ.
Для того чтобы Вы были здоровыми, бодрыми, энергичными, следует создавать свой пищевой рацион, сохраняя при этом оптимальный баланс жирных кислот.
Врач – диетолог
Л.В. Иванович
#28 Биологическая роль полиненасыщенных жирных кислот
Полиненасыщенные жирные кислоты относятся к незаменимым факторам питания, они не образуются в организме и должны поступать с пищей.
Биологическая роль полиненасыщенных жирных кислот состоит в следующем:
1.Структурные компоненты липидов. Наличие полиненасыщенных жирных кислот определяет биологическую активность фосфолипидов, свойства биологических мембран.
2.Оказывают антиатеросклеротическое действие:
а) увеличение выведение холестерина с калом;
б) снижение образование липопротеидов низкой плотности;
в) повышение эластичности и снижение проницаемости стенки сосудов.
2. Снижение синтеза жиров в организме.
3. Энергетическая функция.
4. Участие в обмене витаминов группы В.
5. Участие в процессах запоминания и поведенческих реакциях.
6.Являются субстратом для синтеза эйкозаноидов – биологически активных веществ, модулирующих метаболизм и активность как самой клетки, так и окружающих клеток.
Для Человека особенно необходимы линолевая и линоленовая жирные кислоты. Отметим, что линолевая кислота превращается в организме в арахидоновую кислоту, а линоленовая в эйкозопентаеновую. Таким образом, недостаточное поступление с пищей линолевой кислоты вызывает в организме нарушение биосинтеза арахидоновой кислоты, входящей в состав структурных липидов и простагландинов.
Омега-3 – жирные кислоты содержатся в рыбе, рыбепродуктах и моллюсках: в форели, лососе, скумбрии, сельди, а также в растительных маслах: в рапсовом, соевом и из грецкого ореха. Кислоты снижают концентрацию жира в крови, повышенное артериальное давление, уменьшают свёртываемость крови при атеросклерозе, уменьшают воспаление. Основными биологическими добавками к пище, содержащими омега-3 из жиров рыб являются «Эйфитол», «Эйконол», «Полиен», из жиров и льняного масла – «Эйколен».
Омега-6-жирных кислот много в кукурузном и подсолнечном масле. Известно, что они снижают содержание в крови холестерина.
Представителем омега-9-жирных кислот является олеиновая кислота, которой много в оливковом масле. Оказывает благоприятное влияние на обмен холестерина и на состояние желчных путей, по данным экспертов ВОЗ снижает риск сердечно-сосудистых заболеваний.
Однако стоит отметить, что не следует злоупотреблять полиненасыщенными жирными кислотами в рационе. Всё хорошо в меру. Например, известно, что если в организме есть дефицит антиоксидантов (витаминов С, Е, А, флавоноидов, селена), то избыточное употребление полиненасыщенных жирных кислот может серьёзно нарушить обмен веществ. Избыток омега-6 жирных кислот может усилить воспалительные процессы в организме и даже увеличить вероятность рака молочной железы. Поэтому не превышайте суточную норму потребления полиненасыщенных жирных кислот или указанную суточную дозировку биологически активных добавок.
Суточная норма потребления омега-6-жирных кислот для взрослых составляет 8-10 г/сутки (5-8% от калорийности суточного рациона), омега-3 — 0,8-1,6 г/сутки (1-2% калорийности суточного рациона).Оптимальным соотношением омега-6 и омега-3 -жирных кислот является 5-10:1
Microsoft Word — вестник 2009-5 последн.doc
%PDF-1.5 % 1 0 obj > endobj 5 0 obj ) /CreationDate (D:20091115203227+03’00’) /Creator (PScript5.dll Version 5.2.2) /ModDate (D:20091115203227+03’00’) /Producer (Acrobat Distiller 9.0.0 \(Windows\)) /Title >> endobj 2 0 obj > stream application/pdf
Характеристика и биологическая роль эссенциальных полиненасыщенных жирных кислот Текст научной статьи по специальности «Фундаментальная медицина»
ДИССЕРТАНТ
Л.И. ЗАПОРОЖСКАЯ, И.В. ГАММЕЛЬ, д.ф.н., профессор, кафедра управления и экономики фармации и фармацевтической технологии ГБОУ ВПО НижГМА Минздрава России
ХАРАКТЕРИСТИКА И БИОЛОГИЧЕСКАЯ РОЛЬ
ЭССЕНЦИАЛЬНЫХ ПОЛИ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
Баланс дигомо-у-линоленовой, арахидоновой и тимнодоновой кислот в организме человека является индикатором в липидном обмене. Эйкозапентаеновая кислота принадлежит к семейству а-линоленовой кислоты, биологическая активность которой соотносит ее с ролью витамина F. Эссенциальные полиненасыщенные жирные кислоты являются предшественниками эйкозаноидов, которым принадлежит важная роль в развитии, корригировании и устранении многих патологических состояний. Поэтому существует необходимость поиска новых сырьевых источников этих соединений и разработки технологии получения эффективных лекарственных средств на их основе.
Ключевые слова: эйкозапентаеновая кислота, биоконверсия, полиненасыщенные жирные кислоты, витамин F
Липиды служат важнейшими структурными компонентами биологических мембран и обеспечивают их вязкопластичные свойства, выполняют транспортные функции: переносят жирорастворимые витамины А, Д, Е, К и способны модулировать физиологическую активность последних.
Значительно возросший интерес к физиологической роли и химии липидов связан с высшими жирными кислотами (ЖК), входящими в их состав. Согласно жидкомозаичной модели текучесть биомембран обеспечивается за счет соответственного распределения остатков полиненасыщенных жирных кислот (ПНЖК) между молекулами различных фосфолипидов (ФЛ).
Известно, что изменение степени ненасыщен-ности жирно-кислотных компонентов мембран является механизмом гомеостаза у эктотермных животных, способных компенсировать влияние температуры [1]. Акклиматизация организмов к холоду связана с увеличением степени ненасыщен-ности жирно-кислотных остатков ФЛ, что обеспечивает поддержание жидкокристаллического
состояния и необходимой вязкости углеводородной части липидного бислоя мембран [2].
ПНЖК занимают особое место среди ЖК и, собственно, определяют эссенциальность липидов. Недостаточность незаменимых ЖК сопровождает целый ряд соматических заболеваний: диабет, опухоли, кистозный фиброз, рассеянный склероз, болезнь Крона, синдром Рейна, инфаркт миокарда и др. По современным представлениям, эти патологические состояния вызваны нарушениями жирового обмена, структуры и функционирования биологических мембран. Повреждения биомембран часто связывают с усилением процессов пероксидного окисления липидов, сопровождающих течение большинства заболеваний [3].
Первоначально термин «эссенциальные (незаменимые)» относился к линолевой и а-линоленовой кислотам, которые не синтезируются животным организмом de novo и отсутствие которых вызывает симптомы недостаточности [4]. В дальнейшем к ним стали относить кислоты (у-линоленовую, ара-хидоновую, эйкозапентаеновую и др.), которые синтезируются в организме и не являются незаменимыми в строгом смысле этого слова, однако способны устранять симптомы недостаточности [5].
Общую формулу незаменимых ЖК можно представить следующим образом:
СН3(СН2)Х (СН = СНСН2)У (СН2)г СООН
где х = 1, 4, 5, 7; у = 1-6; z = 0-7 с общим числом атомов углерода от 18 до 24 и цис-конфигурацией.
Основные из них представлены в таблице 1.
Эссенциальные ЖК разделяют на две группы, названные семействами: семейство линолевой ю-6 и семейство а-линоленовой ю-3 кислот. Каждая из названных ЖК является родоначальником целого класса, образующегося из исходной путем десатурации и (или) элонгации [6].
Между ЖК ю-3 и ю-6 в организме существуют сложные конкурентные взаимоотношения: возрастание обмена ЖК одного семейства угнетает метаболизм ЖК другого. Это связано с наиболее высоким сродством к ферментам десатурации и элонгации ЖК первой группы (ю-3). Причем запасы ю-3 кислот более устойчивы к пищевому дефициту и сохраняются в тканях намного дольше, чем ю-6 кислоты. Недостаточное потребление ПНЖК вызывает в первую очередь недостаточность ю-6 кислот. Данный взгляд на взаимозависимость метаболизма двух жирно-кислотных семейств получил название концепции Холмана [7].
Наиболее биологически ценными из семейства ю-6 являются дигомо-у-линоленовая, арахидоновая и их биопредшественник — у-линоленовая кислоты, а из семейства ю-3 — эйкозапентаеновая кислота. Особая роль этих кислот выражается различными позитивными эффектами в организме в результате инкорпорирования в фосфолипидном матриксе клеточных мембран или их непосредственного
влияния на ряд метаболических процессов. Так, по последним сообщениям, арахидоновая кислота способна активно или пассивно влиять на внутриклеточную передачу сигнала посредством стимуляции выхода ионов Са2+ из внутриклеточного депо и модулировать активность ряда важных ферментативных систем организма. Впервые опубликованы сведения об антибактериальной активности у-лино-леновой кислоты в отношении грамм-микроорганизмов.
Высокая биологическая ценность именно у-линоленовой ю-6, арахидоновой ю-6, эйкозапен-таеновой ю-3 кислот обусловлена, помимо их самостоятельной активности, способностью непосредственной (для у-линоленовой через дигомо-у-линоленовую кислоту) ферментативной трансформации в эйкозаноиды — мощные внутриклеточные регуляторы функционирования практически всех систем организма. Многочисленные исследования доказывают, что содержание в питании длинноцепочечных полиненасыщенных жирных кислот необходимо для нормального созревания и функционирования здорового организма. ПНЖК ю-3 должны занимать особое место в диете детей раннего возраста, т. к. оказывают влияние на всю последующую жизнь. Эйкозаноиды играют важную роль в развитии воспалительных, аллергических и пролиферативных реакций, регуляции иммуногенеза и гемостаза [8].
Продукты циклооксигеназного пути превращения дигомо-у-линоленовой, арахидоновой, эйкозапентае-новой кислот называют простаноидами (простаглан-дины, простациклины, тромбоксаны и пр.), а к липок-сигеназным метаболитам относят лейкотриены (ЛТ).
Таблица 1. Химический состав основных эссенциальных ЖК
N Тривиальное название ЖК Суммарная формула Индекс кислоты (количество углеродных атомов: количество п-связей) Положение п-связей**
1 Линолевая С 8 3е 2° 18:2 9, 12
2 а-линоленовая сГ о со С_Г 18:3 ю*3 9, 12, 15
3 у-линоленовая сГ о Л со С_Г 18:3 ю*6 6, 9, 12
4 Арахидоновая (эйкозатетраеновая) С о 3е 2° 20:4 ю*6 5, 8, 11, 14
5 Тимнодоновая (эйкозапентаеновая) С и ° С20П28и2 20:5 ю*3 ю*6 5, 8, 11, 14, 17 2, 5, 8, 11, 14
6 Докозагексаеновая (цервоновая) С и ° С22П32°2 22:6 ю*3 4, 7, 10, 13, 16, 19
Примечания:
* м Длина концевой углеродной цепи после го-связи.
** Положение п-связи обозначается номером ближайшего к карбоксильной группе атома углерода.
ДИССЕРТАНТ
ДИССЕРТАНТ
медицинский
совет №122012
Простагландины (ПГ), наряду с циклическими нуклеотидами, фосфоинозитидами и ионами Са+2 относятся к внутриклеточным регуляторам метаболизма, которые образуются или освобождаются в тех же клетках, на которые они воздействуют. Механизмы воздействия на организм производных ЖК до конца не выяснены. Полагают, что ПГ участвуют в клеточных регуляторных процессах благодаря существованию в организме органоспецифических ПГ-рецепторов. Вероятно, влияние их опосредовано системой циклических нуклеотидов.
Другой класс физиологически активных метаболитов эссенциальных кислот — ЛТ нередко называют «медленно реагирующая субстанция анафилаксии». Они обладают свойством вызывать мышечное сокращение и хемотаксис, это позволяет предполагать, что ЛТ играют существенную роль в аллергических реакциях и воспалении [9]. Изучение этой группы метаболитов ПНЖК представляет огромный интерес, т. к. они влияют на иммунную систему организма [10].
Интересно отметить, что синтез простаноидов конкурирует за субстрат с синтезом ЛТ, т. е. между продуктами циклооксигеназного и липоксигеназно-го превращения эссенциальных ПНЖК также присутствует принцип соперничества. Стимуляция простагландин- и лейкотриен-зависимых механизмов осуществляется, как правило, в случаях дисбаланса и служит для контроля гомеостаза в организме. Опосредование эйкозаноидами различных патологических процессов связывают с нарушением физиологических функций этих соединений [11].
Исследуя пути и продукты биоконверсии у-линоленовой, арахидоновой, эйкозапентаеновой кислот, следует отметить, что эти соединения служат родоначальниками трех различающихся между собой групп эйкозаноидов, нередко оказывающих на организм разнонаправленное действие. Причем в каждой группе эйкозаноидов в зависимости от пути трансформации эссенциальной кислоты происходит разделение на простаноиды и лейкотрие-ны, обладающие также часто противоположными или отличающимися по точке воздействия эффектами. Не следует также забывать о конкурентных отношениях за субстрат биосинтеза между эссен-
циальными кислотами семейств ю-6 и ю-3 и между группами простаноидов и ЛТ. Анализируя вышеизложенное, можно предположить, что именно в силу этих причин у-линоленовая, арахидоновая, эйкозапентаеновая кислоты, казалось бы относящиеся к одному классу ПНЖК, проявляют многообразное и иногда взаимоисключающее антагонистичное воздействие на организм, выступая универсальными модуляторами происходящих в нем изменений.
В связи с исключительной ролью эссенциаль-ных кислот в процессах жизнедеятельности организма Gogen и Ganter в 1928 г. назвали линолевую, линоленовую, арахидоновую кислоты биологически активными компонентами жира, или витамином Б (от англ. faet — жир). В отечественной литературе до 1980 г. витамином Б наиболее часто обозначали смеси линолевой и а-линоленовой ЖК или их ЭЭ [12]. Позднее толкование витамина Б расширило и включило в это понятие, помимо собственно эссен-циальных линолевой и а-линоленовой кислот, также олеиновую (их биопредшественник с одной двойной связью), у-линоленовую и арахидоновую (производная линолевой кислоты) ЖК [13-16]. Учитывая непосредственную связь эйкозапентаено-вой кислоты с классом эйкозаноидов и принадлежность к семейству а-линоленовой кислоты, целесообразно отнесение и этой кислоты к витамину Б
Таким образом, каскад дигомо-у-линоленовой. арахидоновой и тимнодоновой кислот служит своеобразным зеркалом информационной ситуации в организме человека. Несомненно, эссенциальным ПНЖК, будь они структурными компонентами биомембран, непосредственно внутриклеточными мессенджерами или биопредшественниками эйкоза-ноидов, принадлежит важная роль в развитии, корригировании и устранении многих патологических состояний. Поэтому определенный интерес представляет необходимость изыскания новых сырьевых источников этих соединений и разработки технологии получения эффективных лекарственных средств на их основе.
Полный список литературы вы можете запросить в редакции.
Функция ненасыщенных жирных кислот в организме
Ненасыщенные жирные кислоты (НЖК) по числу двойных связей разделяются на моно-, ди-, три-, тетра-, пента-, гексаеновые. НЖК с одной или несколькими двойными связями являются структурными элементами фосфолипидов мембран и имеются в организме человека в значительных количествах (незаменимые жирные кислоты линолевая, линоленовая, арахидоновая поступают в организм с пищей). Самой распространенной из ненасыщенных жирных кислот является олеиновая (Е. А. Строев, 1986).
В фосфолипидах животных тканей очень мало содержится линолевой кислоты (0,05-0,4%), так как она превращается в линоленовую и арахидоновую. Линоленовая НЖК содержится в значительных количествах 4-24%, содержание арахидоновой кислоты в фосфолипидах тканей составляет 0,2-22% (табл. 1). Биологическое значение ненасыщенных жирных кислот в метаболизме окончательно не выяснено, механизмы катаболизма НЖК в клетках животных также досконально не изучены. В молекулах НЖК две двойные связи, расположенные следующим образом: -СН=СН-СН=СН–, называются сопряженными (конъюгированными) (Л. Уайт и соавт., 1981).
Двойные связи определяют существование двух разных жирных кислот с 18-20 углеродными атомами, имеющими различное положение в пространстве: трансизомер имеет прямую форму, а углеродная цепь цисизомера всегда изогнута в месте двойной связи. Ненасыщенные жирные кислоты являются только цисизомерами, т.е. они все изогнуты. Жирные кислоты в свободном состоянии редко встречаются в составе мембран. Они являются важным фактором регулирования проницаемости мембран (влияют на поверхностные свойства фосфолипидов, белок-липидные и липид-липидные взаимодействия), функционирования мембранно-связанных ферментов (П. Г. Богач и соавт., 1981). В мембранах располагаются ферменты, активность которых зависит от липидного окружения. В этом окружении ферменты имеют определенную конформацию. Изменение липидного окружения (делипидирование, использование липолитических ферментов, липидообменивающих белков) ведет к изменению конформации белков (ферментов), изменению их каталитической активности (Н. Е. Кучеренко, А. Н. Васильев, 1985). Активность ферментов в мембранах связана с вязкостью липидной фазы мембран, составом липидов (П. Г. Богач и соавт., 1981; Н. Е. Кучеренко, А. Н. Васильев, 1985). Метаболическая активность липидзависимых ферментов определяется изменениями в липидном микроокружении и в первую очередь это касается фосфолипидов: от их состава и метаболизма зависят ферментативные процессы. Это подтверждено для микросомальной монооксигеназной системы. Липидные молекулы являются матриксом, оптимальным для функционирования мембранно-связанных ферментов. НЖК в мембранах придают им такое качество, как жидкостность (текучесть). Увеличение в мембранах содержания холестерина, насыщенность жирнокислотных радикалов в фосфолипидах снижают жидкостность мембран. Подвижность липидов изменяет конформацию полярных головок. Регулирующее влияние на мембранно-связанные ферменты оказывают гликофосфолипиды (стабилизируя мембраны). При модификации липидного состава теряется чувствительность к гормонам, фосфолипиды влияют на функционирование рецепторов, могут регулировать их число (Н. Е. Кучеренко, А. В. Васильев, 1985), взаимодействовать с токсинами. Интенсивность обновления фосфолипидов зависит от скорости синтеза ДНК в клетке. Имеется связь синтеза ДНК с составом липидов, перераспределением фракций фосфолипидов, степенью ненасыщенности жирнокислотных радикалов (насыщенные жирные кислоты тормозят синтез ДНК). Такие фракции фосфолипидов, как фосфатидилэтаноламины, кардиолипины дестабилизируют молекулы ДНК путем усиления активности ДНК-полимеразы. Фосфолипиды влияют на прочность ДНК (стабилизацию структуры). Все эти данные (Н. Е. Кучеренко, А. Н. Васильев, 1985) свидетельствуют о важной регуляторной роли фосфолипидов мембран, составной частью которых являются ненасыщенные жирные кислоты.
Окисление ненасыщенных жирных кислот
Мембраны клетки являются неполярной средой, в которой кислород растворяется в 7-8 раз лучше, чем в полярной (А. Хорст, 1982). Поэтому, по мнению автора, именно в мембранах чаще наблюдается окислительное превращение полиненасыщенных жирных кислот. Реакции окисления протекают в тех местах, где имеются ненасыщенные липиды (фосфолипиды): в мембранах митохондрий, эндоплазматического ретикулума, лизосом, плазматических мембранах. Окисление ненасыщенных жирных кислот протекает по схеме: RH + O2 > ROOH.
К продуктам перекисного окисления ненасыщенных жирных кислот относят гидроперекиси липидов, альдегиды, малоновый диальдегид, другие диальдегиды, кетоны, спирты, эпоксиды. Физиологической функцией перекисного окисления является регуляция обновления, распада ненасыщенных структурных липидов, проницаемости липидов биологических мембран (Е. А. Строев, 1985). По мнению автора, активатором перекисного окисления липидов служат свободнорадикальные формы кислорода, образующиеся при одноэлектронном восстановлении его по схеме:
Кислородные радикалы (супероксидный, гидроксильный, пероксидный), обладая высокой реакционной способностью, ускоряют процесс перекисного окисления ненасыщенных жирных кислот. Активные атомы водорода ненасыщенных жирных кислот для вступления в реакцию, по мнению А. Хорста, нуждаются лишь в минимальных количествах энергии. Это окисление активирует радикальные формы кислорода, ионы металлов и, наоборот, тормозит витамин Е (токоферол), связывая пероксид и ОН-радикал. В присутствии оксидантов (даже небольшого количества) водород переходит к окислителю, что вызывает цепочку реакций, изменяющих структуру и функцию мембран. У насыщенных жирных кислот энергия разрыва С-Н-связи составляет около 381,3 кДж/моль, у ненасыщенных жирных кислот по месту двойной связи она равна 364,9 кДж/моль, т.е. значительно меньше (П. Г. Богач и соавт., 1981). Наименьшую энергию связи имеет водород, который находится в a-положении по отношению к двойной связи, 315,7 кДж/моль. Активные формы кислорода способны отнимать водород из групп СН2 ненасыщенной жирной кислоты, превращая их в свободнорадикальные группы НС– (А. Я. Николаев, 1989). Радикал жирной кислоты легко присоединяет молекулу кислорода и превращается в перекисный радикал жирной кислоты: HC•+O2 > HC–O–O–. Перекисный радикал может отнимать водород от другой молекулы жирной кислоты и восстанавливаться в гидроперекись (за счет окисления этой другой молекулы жирной кислоты в свободный радикал): HC–O-O•+CH2 > HC–O–OH+HC•.
Образовавшийся второй радикал аналогично вступает в реакцию и возникает цепная химическая реакция, которая продолжается уже без инициирующих веществ. Катализировать окислительный процесс может двухвалентное железо: Fe2+ + O2 + H+ > Fe3+ + HO2–. Затем радикал НО2– вступает в реакцию с жирной кислотой: RH + НО2– Н2О2 + R–, в дальнейшем образовавшийся радикал соединяется с молекулой кислорода О2 и образуется перекисный радикал RO2–. Он также может взаимодействовать с нейтральными молекулами жирных кислот и т.д. Перекиси (пероксиды) нестабильны и распадаются с образованием альдегидов в результате разрывов в жирной кислоте углерод-углеродной связи, которая соседствует с перекисной группой. Подобным образом могут окисляться не только ненасыщенные жирные кислоты в фосфолипидах мембран, но и свободные ненасыщенные жирные кислоты, остатки ненасыщенных жирных кислот. В тканях животных основное количество перекисей липидов составляют продукты, полученные из полиненасыщенных β-ацильных остатков эндогенных мембранных фосфатидилэтаноламинов и фосфатидилхолинов.
Однако имеются и иные взгляды на проблему окисления ненасыщенных жирных кислот. Л. С. Страйер (1984) считает, что образованный ковалентными связями скелет биомолекул стабилен в отсутствие ферментов или притока энергии. Для диссоциации углерод-углеродной связи (С-С) необходимо 83 ккал/моль, в то время как содержание энергии, запасенной в молекулах АТФ, составляет лишь 12 ккал/моль. Разрыв С-С связей под действием радикалов кислорода in vivo представляется маловероятным. А. Ленинджер считает, что самоокисление липидов в организме полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты.
Ненасыщенные жирные кислоты, как и насыщенные, подвергаются β-окислению (А. Ленинджер,1985). Положение и число двойных связей в молекулах ненасыщенных жирных кислот определяют особенности их окисления. НЖК окисляются как насыщенные до места двойной связи. Если двойная связь имеет трансконфигурацию и расположение, как в еноил-КоА, образующемся при окислении насыщенных жирных кислот, то дальше окисление идет обычным путем (Е. А. Строев, 1986). При отсутствии этого условия вступает в действие дополнительный фермент, перемещающий двойную связь и меняющий цис- в трансконфигурацию. Двойная связь может восстанавливаться НАДФ•Н2 (Я. Кольман, К. Г. Рем, 2000). Е. А. Строев (1986) отмечает, что скорость окисления ненасыщенных жирных кислот очень высока: олеиновой кислоты в 11 раз, линолевой в 114, линоленовой в 170, арахидоновой в 200 раз выше, чем стеариновой. В исследованиях с олеиновой кислотой, меченной дейтерием, было установлено, что она может редуцироваться, превращаясь в стеариновую, а последняя подвергается β-окислению (И. В. Савицкий, 1973,1982). Такой путь допускали и для других ненасыщенных жирных кислот. Однако, по мнению И. В. Савицкого (1973, 1982), их окисление происходит иначе. На первом этапе под действием липоксигеназы происходит дегидрирование (отщепление) одного атома водорода и жирная кислота превращается на свободный радикал. Липоксигеназы широко представлены в тканях животных и обнаружены в микросомальной фракции гомогенатов клеток. Они катализируют реакции переокисления жирных кислот, которые различаются расположением окисляемого кислородом атома углерода. (В микросомальных мембранах образование перекисей катализирует диоксигеназа фосфолипидов, зависящая от НАДФ-Н2. Для образования перекисей липидов необходимо участие негеминового железа, которое в дальнейшем восстанавливается в микросомальной электронно-транспортной цепи). Образование под влиянием липоксигеназы свободного радикала обусловливает перестройку всей молекулы жирной кислоты. В результате этого превращения двойные связи из изолированных становятся сопряженными (приближаются одна к одной), а кислота с сопряженными двойными связями при наличии кислорода, по мнению автора, окисляется с образованием гидроперекиси и цикличной перекиси. Перекиси и гидроперекиси разлагаются до отдельных фрагментов жирного альдегида (к примеру, капронового), малонового диальдегида, полуальдегида дикарбоновой кислоты (И. В. Савицкий ). При этом имеется прямая зависимость количества образовавшегося малонового диальдегида от количества двойных связей в молекуле ненасыщенной жирной кислоты: линолевая образует одну молекулу малонового диальдегида, линоленовая две, арахидоновая три, клупанодоновая четыре. В качестве примера можно привести окисление линолевой кислоты: она последовательно превращается в свободный радикал линолевой кислоты, затем в ненасыщенную кислоту с двойными сопряженными связями, дальше в гидроперекись и циклическую перекись линолевой кислоты, которые разлагаются на капроновый альдегид, малоновый диальдегид и полуальдегид азелаиновой кислоты. Последние три продукта расщепления претерпевают дальнейшее окисление: образуются капроновая, азелаиновая и малоновая кислоты. Капроновая кислота после превращения в капронилкоэнзим А подвергается β-окислению. Азелаиновая кислота также включается в β-окисление, а малоновая после декарбоксилирования превращается в уксусную кислоту. Таким образом, линолевая кислота превращается в остатки уксусной кислоты, которые затем в цикле Кребса окисляются до СО2 и Н2О. Аналогичным образом (но с другими промежуточными продуктами) окисляются и другие ненасыщенные жирные кислоты: при окислении линоленовой кислоты образуется пропионовая, азелаиновая и две молекулы малоновой кислоты, при окислении арахидоновой капроновая, глютаровая и три молекулы малоновой кислоты. Путем многостадийного процесса линолевая кислота может сначала превратиться в арахидоновую, которая затем подвергается окислению. Таким образом, в данном случае ненасыщенные жирные кислоты подвергаются β-окислению, но это наступает на более поздних этапах после их предварительной фрагментации и образования альдегидов с короткой углеродной цепью. Однако следует напомнить, что приведенная выше в качестве примера окисления линолевая кислота используется для синтеза арахидоновой кислоты и в фосфолипидах тканей содержится лишь в следовых количествах. Продукты превращения линолевой и линоленовой кислот представлены в таблице 2.
Омега-3 жирные кислоты эйкозапентаеновая и докозагексаеновая оказывают выраженное антиатеросклеротическое, вазодилататорное, антитромботическое действие, улучшают реологию крови. Арахидоновая кислота (эйкозатетраеновая), входящая в состав фосфолипидов плазматических мембран, является предшественником эйкозаноидов медиаторов (локальных гормонов), сигнальных веществ, которые образуются почти во всех клетках организма и имеют небольшую дальность действия (Я. Кольман, К. Г. Рем, 2000). К эйкозаноидам относят первичные (классические) простагландины, простациклины, тромбоксаны, лейкотриены, метаболиты простагландинов, гидроперекиси (рис.). Наиболее изучены производные арахидоновой кислоты. В результате ее превращения образуются простагландины Е2, F22, простациклин I2, тромбоксан А2. Эйкозаноиды образуются и из других ненасыщенных жирных кислот эйкозатриеновой, эйкозапентаеновой (т.е. из С20 полиеновых жирных кислот). Продукты превращения различных жирных кислот отличаются своими свойствами. Биосинтез эйкозаноидов начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А2, активность которой контролируется гормонами, другими биорегуляторами, сопряженными с G-белками (активность фосфолипазы А2 повышается и под воздействием липоперекисей). Авторы отмечают два главных пути биосинтеза эйкозаноидов. Инициатором первого пути является простагландин-синтаза (имеет свойства циклооксигеназы и пероксидазы), катализирующая превращение арахидоновой кислоты в циклические эндоперекиси. В результате последующих реакций, катализируемых другими ферментами, образуются простагландины, простациклины и тромбоксаны. Этот путь (циклооксигеназный) блокируют ацетилсалициловая кислота и нестероидные противовоспалительные препараты (в настоящее время различают циклооксигеназы-1 и 2). Их антитромбогенный эффект обусловлен торможением образования тромбоксана и агрегации тромбоцитов. Инициатором второго пути биосинтеза эйкозаноидов является упоминавшаяся выше липоксигеназа (блокирующее действие оказывают витамин Е, рутин). При участии липоксигеназы все полиеновые (полиненасыщенные) жирные кислоты окисляются с образованием гидроперокси- и гидроксипроизводных жирных кислот. В дальнейшем за счет дегидратации, различных реакций переноса из них образуются лейкотриены. Детальные механизмы биосинтеза эйкозаноидов и пути их окисления до конечных продуктов не выяснены. Как отмечают Я. Кольман и К. Г. Рем (2000), эйкозаноиды служат вторичными мессенджерами гидрофильных гормонов, контролируют сокращение гладкомышечных тканей сосудов, бронхов, матки, принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, соляной кислоты, мукоидов), влияют на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию лейкоцитов и тромбоцитов (свертывание крови), являются эффективными лигандами болевых рецепторов. Эйкозаноиды быстро разрушаются (инактивируются в течение нескольких секунд в результате восстановления двойных связей и окисления гидроксигрупп), поэтому действуют как локальные биорегуляторы путем связывания с близко расположенными мембранными рецепторами своей клетки (аутокринное действие) или соседних клеток (паракринное действие). Их действие может быть опосредовано через цАМФ и цГМФ. Особое внимание исследователи уделяют в настоящее время метаболизму арахидоновой кислоты в тромбоцитах и эндотелии. Под действием циклооксигеназы в тромбоцитах образуются циклические эндоперекиси, простагландины, которые под действием тромбоксансинтетазы (содержится в микросомальной фракции тромбоцитов) превращаются в тромбоксан А2 (ТхА2) с периодом полураспада 30 секунд (А. Хорст, 1982). Тромбоксан А2 вызывает агрегацию тромбоцитов, тромбообразование, сужение сосудов, боль, отек. Находящаяся в эндотелии сосудов простациклинсинтетаза превращает эндоперекиси в простациклин ПГI2, который обладает противоположными по отношению к тромбоксану А2 свойствами: подавляет агрегацию тромбоцитов, расширяет сосуды. При повреждении эндотелия выработка в нем простациклинсинтетазы нарушается и преимущественно образуется тромбоксан А2, вызывающий изменения, необходимые для восстановления эндотелия: агрегацию тромбоцитов, тромбоз, спазм сосудов. В данном случае выбор пути метаболизма, очевидно, связан с состоянием эндотелия сосудов. Как отмечает А. Хорст (1982), при метаболизме эндоперекисей образуются свободные радикалы. Освобождаемые при ферментном окислении арахидоновой кислоты свободные радикалы гидрокси-типа, по его мнению, могут быть дополнительными факторами воспаления. В частности, гидроперокси PGE2 образуют свободные радикалы с центральным атомом кислорода.
Имеется функциональная связь между обменом незаменимых полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой) и функционированием костной ткани. При отсутствии незаменимых жирных кислот в пищевом рационе экспериментальных животных замедляется их рост, нарушается работа почек. Образующиеся из НЖК простагландины оказывают влияние на метаболизм костной ткани, воспаление, кровообращение, транспорт ионов через мембраны. Простагландины принимают участие в ремоделировании костной ткани. Так ПГЕ2 влияет на формирование и активность остеокластов, процессы резорбции костной ткани. В частности усиление костной резорбции при иммобилизации, воспалении, злокачественных процессах объясняют действием простагландинов. Влияние ПГЕ2 на костное формирование зависит от концентрации: в концентрации 10–9-10–7 ммоль/л он увеличивает синтез коллагена остеобластами, при концентрации 10–6 ммоль/л замедляет. ПГЕ1 ускоряет выход кальция из кости (А. Уайт и соавт., 1981). Как и паратгормон, ПГЕ1 стимулирует высвобождение из клеток костной ткани лизосомальных ферментов. Ацетилсалициловая кислота, ингибируя биосинтез простагландинов, снимает эти эффекты. Усилению костной резорбции способствуют, образующиеся в процессе окисления липидов, свободные радикалы: они участвуют в активации остеокластов.
Выделяют и третий путь метаболизма арахидоновой кислоты (В. Г. Денисюк и соавт., 1992). Под действием фосфолипазы А2 от молекулы арахидоновой кислоты отщепляется плазменилхолин и образуется предшественник фактора агрегации тромбоцитов (ФАТ) лизоплазменилхолин (лизо-ФАТ, лизофосфатидилхолин). Лизоплазменилхолин подвергается ацетилированию под влиянием ацетилтрансферазы и образуется ФАТ, вызывающий вазоконстрикцию, индуцирующий агрегацию тромбоцитов. Одновременно с увеличением содержания в крови ФАТ активизируется липоксигеназный путь метаболизма арахидоновой кислоты (увеличивается концентрация 5-НЕТЕ–5-гидроокись эйкозапентаеновой кислоты) и синтез лейкотриенов.
Продукты переокисления ненасыщенных жирных кислот легко обнаруживаются in vitro (Н. Е. Кучеренко, А. Н. Васильев, 1985). По мнению авторов in vivo их обнаружить сложно из-за незначительной концентрации, а также нейтрализации антиоксидантами. Кроме того, они включаются в β-окисление, цикл Кребса, а также из них образуются чрезвычайно не стабильные эйкозаноиды. Промежуточные гидроперекиси очень не стабильны и in vitro (Н. А. Тюкавкина, Ю. И. Бауков, 1991) и уже при комнатной температуре распадаются с образованием альдегидов, которые окисляются в конечные продукты реакции кислоты (образуется четыре моно- и дикарбоновые кислоты с короткими углеродными цепями).
Как отмечает А. Лабори (1970), на липидные молекулы окисление действует своеобразно: размещение в пространстве длинных молекул жирных кислот тесно связано с восстановленным или окисленным состоянием связей между различными атомами углерода, с изгибами по месту двойных связей. И окисление молекулы жирной кислоты не ограничивается потерей молекулы водорода, а сопровождается пространственной перестройкой молекулы. Так как молекула находится в мембране, изменяется ее проницаемость.
Резюмируя изложенную информацию, следует отметить, что имеется несколько путей окисления ненасыщенных жирных кислот. К ним относятся следующие.
- β-Окисление, при этом вклад ненасыщенных жирных кислот в энергетические процессы незначителен.
- Перекисное окисление, инициированное активными формами кислорода, (АФК) металлами с переменной валентностью, т.е. неферментативное. Параметры этого процесса не установлены. А. Ленинджер указывает на возможность повреждения молекул ненасыщенных жирных кислот активными формами кислорода, однако в его работах, как и монографиях других всемирно известных биохимиков, отсутствуют данные о перекисном окислении липидов, инициированном АФК, как системном биологическом явлении, о механизмах перекисного окисления липидов. С другой стороны, наличие нормального (фонового) уровня в организме продуктов окисления ненасыщенных жирных кислот (гидроперекисей, диеновых конъюгатов, малонового диальдегида) показывает, что перекисное окисление липидов не может быть случайным, цепным, хаотичным патологическим процессом (тогда он не может и не должен характеризоваться нормой). Если процесс представлен нормой, то возникает вопрос о его физиологической роли в организме. Следует отметить также, что показатель малонового диальдегида не может характеризовать выраженность перекисного окисления липидов, инициированного АФК, ионами металлов с переменной валентностью, так как он образуется и в результате ферментативного перекисного окисления липидов инициированного липоксигеназами (И. В. Савицкий, 1973, 1982).
Метаболический путь продуктов переокисления липидов не прослежен. Накопление продуктов переокисления липидов обнаруживается in vitro. In vivo продукты расщепления ненасыщенных жирных кислот включаются в конечном итоге в энергетические процессы, как это было показано И.В. Савицким, из них образуются «короткоживущие» эйкозаноиды.
- Ферментативное перекисное окисление липидов, осуществляемое с участием липооксигеназ (диоксигеназ в микросомальной сети) при наличии кислорода. Оно описано И.В Савицким (1973, 1982) и достаточно детально представлено выше.
- Окисление арахидоной (эйкозатетраеновой), дигомо-гамма-линолевой (эйкозатриеновой), эйкозапентаеновой кислот (т.е. С20-полиеновых жирных кислот) под влиянием циклооксигеназ, липооксигеназ с образованием эйкозаноидов. Линолевая, линоленовая, арахидоновые кислоты при участии липооксигеназ окисляются до гидроперекисей и гидроксипроизводных жирных кислот, из которых образуются лейкотриены.
Физиологическая роль перекисного окисления НЖК
Представленная выше информация позволяет сделать ряд важных выводов. Прежде всего, необходимо подчеркнуть, что переокисление ненасыщеных жирных кислот в мембранах, благодаря включению продуктов их распада в процесс β-окисления, сопряжено с окислительным фосфорилированием, энергетическими клеточными процессами: продукты распада НЖК в конечном итоге окисляются в цикле Кребса до СО2 и воды. Хотя в целом, как мы отметили выше, вклад ненасыщенных жирных кислот в энергетические процессы незначительный. Окисление ненасыщеных жирных кислот контролируется ферментами. Тот факт, что в организме имеется нормальный физиологический уровень (фоновый) малонового диальдегида (МДА), диеновых конъюгатов (ДК), других продуктов перекисного окисления липидов, свидетельствует о существовании строгого контроля за окислением липидов со стороны всей иерархической системы регуляции и в первую очередь ДНК. Последняя осуществляет контроль за метаболизмом посредством синтеза ферментов и клеточных белков, поэтому утверждение о существовании в клетках неконтролируемых свободнорадикальных реакций в больших масштабах не обосновано. Повреждение активными формами кислорода молекул ненасыщенных жирных кислот фосфолипидов мембран, по мнению А. Ленинджера и других исследователей, возможно, но имеет ограниченное место, т.к. АФК нейтрализуются ферментами, биоантиоксидантами (прежде всего витамином Е и С). Следует отметить, что лишь незначительная часть кислорода (1-3%) используется в свободнорадикальных реакциях, т.е. параметры этого процесса весьма ограничены. Образование перекисей липидов в различных тканях животных является нормальным процессом и осуществляется под контролем ферментов. Специфическое окисление ненасыщенных жирных кислот происходит в липоксигеназной реакции, в эндоплазматической сети его катализирует НАДФ•Н2-зависимая диоксигеназа. Образованные перекиси также подвергаются ферментативной деградации. При участии липоксигеназы все полиеновые кислоты (линолевая, линоленовая, арахидоновая) окисляются до гидроперекисей, гидроксипроизводных жирных кислот, из которых в результате последовательных реакций образуются лейкотриены. Арахидоновая кислота при участии простагландинсинтазы (циклооксигеназа + пероксидаза) превращается в ее метаболиты простагландины, простациклины, тромбоксаны, лейкотриены, т.е. локальные гормоны, обладающие чрезвычайно важной разносторонней физиологической активностью.
Ткани интактных животных имеют определенный, разный для каждого органа, физиологический уровень содержания перекисей липидов (Ю. П. Козлов, 1985; Н. Е. Кучеренко, А. Н. Васильев, 1985). При этом уровень содержания перекисей липидов выше в тканях с высокой метаболической активностью. При различных физиологических состояниях содержание перекисных продуктов в фосфолипидах изменяется. Приведенные П. Г. Богач и соавт. (1981) данные свидетельствуют об увеличении интенсивности переокисления липидов в различных органах животных при дыхании кислородом, физической нагрузке (плавании), раздражении нервов, сокращении мышц. Таким образом, процессы окисления липидов (с образованием перекисей) являются важными для нормального функционирования биологических мембран и организма в целом. Физиологическая роль этих реакций состоит в регуляции обновления и проницаемости липидов биологических мембран, образовании эйкозаноидов медиаторов (локальных гормонов) или сигнальных веществ, играющих важную биологическую роль в организме. Такие важнейшие мембранные процессы, как перенос электронов в дыхательной цепи, окислительное фосфорилирование, метилирование и гидроксилирование ряда субстратов эндогенного и экзогенного происхождения ферментными системами эндоплазматической сети и даже деление клеток, сопровождаются изменениями интенсивности течения процессов переокисления липидов (П. Г. Богач и соавт., 1981). Липоперекиси являются нормальными и необходимыми продуктами не только при биосинтезе простагландинов, простациклинов, тромбоксанов, но и прогестерона, они участвуют в гидроксилировании стирольного кольца холестерина. Свободные радикалы участвуют во многих биохимических процессах, без их образования в нейтрофилах и макрофагах организм погибает в результате нарушения обезвреживания микробов.
Регуляция процессов перекисного окисления НЖК
Выделяют (Н. Е. Кучеренко, А. Н. Васильев, 1985) целый ряд механизмов регуляции перекисного окисления липидов:
- Строгую структурную организацию липидных компонентов мембран: она влияет на количество промежуточных продуктов, скорость перекисного окисления липидов («разрыхление» мембран ведет к его усилению). Состав фосфолипидов мембран определяет количество, качество образующихся перекисей, перекисных радикалов.
- Нормальное функционирование ферментов, обеспечивающих инактивацию активных форм кислорода, свободных радикалов, и ферментов обмена фосфолипидов мембран. Процесс переокисления липидов зависит от степени ненасыщенности ацильных остатков жирных кислот: она оказывает определяющее влияние на количество гидроперекисей, их устойчивость к действию ферментов метаболизирующих гидроперекиси глутатионлипопероксидазы, пероксидазы, каталазы.
- Достаточное содержание биоантиоксидантов в клетке, организме.
Для уровня течения перекисного окисления НЖК большое значение имеют концентрация кислорода в тканях (при его низком уровне интенсивность переокисления снижается, как и других окислительных процессов, высоком усиливается), ферментные и неферментные системы, восстанавливающие перекиси (глутатионпероксидаза, глутатионредуктаза, супероксиддисмутаза, каталаза, пероксидаза, др.). Несколько механизмов регуляции действуют одновременно. С продуктами переокисления в клетке реагируют биоантиоксиданты: токоферолы, убихиноны, витамин К, аскорбиновая кислота. Они снижают активность перекисного окисления липидов. Антиоксидантными свойствами обладают восстановленные фенольные формы этих соединений: их свободные гидроксильные группы взаимодействуют с перекисными радикалами.
На наш взгляд, при анализе механизмов регуляции перекисного окисления ненасыщенных жирных кислот следует учитывать его взаимосвязь с энергетическими внутриклеточными процессами, а также функционированием пентозного цикла. Как это показал И.В. Савицкий, остатки (фрагменты) ненасыщенных жирных кислот, образующихся в процессе переокисления, включаются в конечном итоге в цикл Кребса и «сгорают» до СО2 и воды. Таким образом, их количество в клетке напрямую зависит от функционирования гликолиза, цикла Кребса, окислительно-восстановительной цепи. Имеется сопряженность между энергетическими процессами (окислительным фосфорилированием) в клетке и окислением ненасыщеных жирных кислот. Например, изменение концентрации свободных радикалов при злокачественном перерождении фибробластов в условиях воздействия аденовирусов коррелирует с активностью гликолитической цепи (Н. И. Кучеренко, А. Н. Васильев, 1985). В случае снижения интенсивности процессов окислительного фосфорилирования следует ожидать некоторое уменьшение активности процессов перекисного окисления липидов: уменьшение движения потока электронов по окислительно-восстановительной цепи митохондрий приведет к уменьшению образования активных форм кислорода, а затем к снижению интенсивности процесса переокисления. С другой стороны чрезвычайно важное регулирующее значение для уровня перекисного окисления липидов имеет функционирование пентозного цикла, в котором происходит восстановление НАДФ и окисленного глутатиона. Эти две молекулы, по мнению А. Лабори (1970), являются клеточным запасом водорода, необходимым для восстановления перекисей липидов, ликвидации свободных радикалов. Сульфгидрильные соединения (глутатион, цистеин, метионин, белки, содержащие сульфгидрильные группы), связывая радикалы и разлагая перекиси, снижают количество радикалов в организме. Защитное действие метиленового синего, цистамина, окисленного глутатиона при повышенном давлении О2, ионизирующем влиянии, по мнению А. Лабори, не связано с восстанавливающим действием. Наоборот, метиленовый синий, витамины Е, К могут окислять НАД•Н2, принимая электрон. Окисление, лимитированное НАДФ•Н2, направляет Г-6-Ф в сторону пентозного пути, а последний ведет к восстановлению НАДФ и вторично окисленного глутатиона. Физиологическим восстановителем НАДФ и окисленного глутатиона также является аскорбиновая кислота. Таким образом, в защите против агентов, образующих свободные радикалы и перекиси липидов, важнейшее значение имеет активность пентозного цикла. Ткани, в которых имеется активный пентозный цикл (слизистая оболочка, мышцы тонкого кишечника, яички), высокое содержание НАДФ, окисленного глутатиона, содержат очень мало перекисей.
И, наконец, перекисное окисление НЖК контролируется ДНК путем синтеза ферментов (липоксигеназы, диоксигеназы, глутатионпероксидазы, глутатионредуктазы, пероксидазы, каталазы, супероксиддисмутазы), клеточных белков (глутатиона). Таким образом, процесс перекисного окисления липидов (ненасыщенных жирных кислот) в организме не хаотичный, а контролируемый, имеющий исходный фоновый уровень.
Биологические эффекты продуктов переокисления НЖК
Переокисление ненасыщеных жирных кислот фосфолипидов мембран, значительное увеличение содержания продуктов этого окисления, по мнению П. Г. Богача и соавт. (1981), Н. Е. Кучеренко, А. Н. Васильева (1985), А. Лабори (1970), могут привести к целому ряду отрицательных эффектов, большинство из которых наблюдались in vitro. К этим эффектам относят конформацию липидов и белков, изменение структуры и функции мембран, повышение их проницаемости, нарушение активности мембранно-связанных ферментов. Сведения о свободнорадикальных процессах, полученные в эксперименте (in vitro), нельзя полностью экстраполировать на организм человека, хотя такие исследования помогают прояснить их сущность. Очевидно, что in vivo наиболее серьезные изменения в мембранах наступают в следующих случаях: при влиянии ионизирующей радиации, интенсивном ультрафиолетовом облучении, воздействии токсических веществ, обезвреживание которых совершается в эндоплазматической сети с участием специализированной ферментной системы переноса электронов цитохрома Р-450, НАДФ•Н2; гипербарической оксигенации (гипероксии), интоксикации озоном. При перечисленных воздействиях подтвержден подобный характер изменений и показана эффективность антиоксидантной терапии. Как показывают результаты наших исследований (В.К. Казимирко и соавт., 2004) и анализ литературы, абсолютное большинство заболеваний (прежде всего в острый период и в период обострения) сопровождается интенсификацией окисления НЖК и развитием выраженной в различной степени антиоксидантной недостаточности. Возникающий дефицит биоантиоксидантов требует проведения соответствующей коррекции.
Таким образом, важная роль НЖК в организме определяется, прежде всего, биологическими эффектами специфического для них перекисного окисления и высокой физиологической активностью образующихся эйкозаноидов.
Литература
- Богач П.Г., Курский МД., Кучеренко Н.Е., Рыбальченко В.К. Структура и функция биологических мембран. Вища шк., Киев, 1981, 336 с.
- Казимирко В.К., Мальцев В.И., Бутылин В.Ю., Горобец Н.И. Свободнорадикальное окисление и антиоксидантная терапия. Морион, Киев, 2004, 160 с.
- Козлов Ю.П. Свободнорадикальное окисление липидов в биомембранах в норме и патологии. Биоантиокислители. Наука, Москва, 1985, С.4-5.
- Кольман Я., Рем К.Г. Наглядная биохимия: Пер. с нем. Мир, Москва, 2000, 469 с.
- Кучеренко Н.Е., Васильев А.Н. Липиды. Вища шк., 1985, 247 с.
- Лабори А. Регуляция обменных процессов: Пер. с франц. Медицина, Москва, 1970, 384 с.
- Ленинджер А. Основы биохимии: В 3-х томах. Т.2. Мир, Москва, 1985, 368 с.
- Николаев А.Я. Биологическая химия. Высш.шк., Москва, 1989, 495 с.
- Савицкий И.В. Биологическая химия. Вища шк., Киев, 1982, 472 с.
- Страер Л.С. Биохимия: Пер. с англ. В 3-х томах. Т.1. Мир, Москва,1984, 1232 с.
- Строев Е.А. Биологическая химия. Высш.шк., Москва, 1986, 479 с.
- Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. 2-е изд. Медицина, Москва, 1991, 528 с.
- Уайт Л., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии: в 3-х томах. Т.2. Мир, Москва, 1981, 617 с.
- Хорст А. Молекулярные основы патогенеза болезней: Пер. с польск. Медицина, Москва, 1982, 456 с.
СТАТТІ ЗА ТЕМОЮ
26.09.2021 Кардіологія Корекція енергодефіциту в пацієнтів із серцевою недостатністю: від гострих до хронічних станівЗагальновідомо, що синтез аденозинтрифосфату (АТФ) у мітохондрії – це один з основних аспектів покращення енергозабезпечення. Але слід пам’ятати, що за розвитку ішемії кількість АТФ у клітині ще не встигає зменшитися, а функція органа погіршується практично паралельно зі зниженням рівня фосфокреатину (ФК). Порушення співвідношення ФК/АТФ у бік зростання АТФ є чітким показником прогресування серцевої недостатності (СН). …
26.09.2021 Кардіологія Мілдронат® – наднозологічний препарат для коморбідних пацієнтівПроблема мультиморбідності й коморбідності набуває все більшої актуальності, що підтверджується зростанням числа пацієнтів із ≥5 супутніми хворобами за 10-річний період на 16%. Коморбідні патології часто спостерігаються серед осіб із серцево-судинними захворюваннями (ССЗ), зокрема у представників молодших вікових груп. Ведення коморбідних пацієнтів передбачає високу частоту призначення комбінованого лікування для досягнення цільових показників за кожним із наявних захворювань, що зумовлює необхідність одночасного застосування значної кількості препаратів. Для розв’язання проблеми поліпрагмазії одним із перспективних напрямів може стати так звана наднозологічна фармакотерапія. …
26.09.2021 Кардіологія Канадські рекомендації щодо ведення осіб з ожирінням та пов’язаними з ним ускладненнямиОжиріння – поширене хронічне захворювання, що має прогресуючий і рецидивуючий перебіг. Воно чинить суттєвий негативний вплив на якість життя пацієнтів, підвищує ризик довгострокових клінічних ускладнень, зокрема серцево-судинних (СС). Особи, які страждають на ожиріння, нерідко стикаються зі стигматизацією, що призводить до збільшення захворюваності та смертності незалежно від ваги та індексу маси тіла (ІМТ). Торік було розроблено канадські рекомендації на основі сучасних досягнень в епідеміології, патофізіології, діагностиці, профілактиці та лікуванні осіб з ожирінням, а також експертних суджень та досвіду хворих. При цьому акцент було зроблено на важливості поліпшення здоров’я та якості життя пацієнта, а не лише зниження ваги, а також зазначено важливість зниження ризиків, асоційованих з ожирінням. Пропонуємо до вашої уваги ключові положення даних рекомендацій. …
26.09.2021 Кардіологія Артеріальна гіпертензія із супутніми факторами ризику: як підвищити ефективність терапії?Артеріальна гіпертензія (АГ) є найважливішим фактором ризику (ФР) загальної захворюваності та смертності у всьому світі. При цьому вона рідко виникає ізольовано, тож зазвичай асоційована з іншими визначальними ФР, що зумовлюють розвиток серцево-судинних захворювань (ССЗ). Про особливості антигіпертензивної терапії у межах первинної та вторинної профілактики серцево-судинних (СС) ускладнень у пацієнтів із супутніми ФР розповідає завідувач кафедри функціональної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), д. мед. н., професор Олег Йосипович Жарінов. …
Биологическая роль десатураз ненасыщенных жирных кислот в здоровье и болезнях
Активность десатураз определяет, вместе с потреблением жирных кислот с пищей, качественный и количественный состав ненасыщенных ЖК. Продукты этих ферментов являются важными компонентами всех биологических систем. Точная роль десатураз зависит от организма, в котором они экспрессируются.
3.1. Роль десатураз ненасыщенных жирных кислот в микроорганизмах
Во-первых, были открыты гены десатураз и изучены их функции в микроорганизмах.Например, первый ген D6D был клонирован из cyanobacterium Synechocystis , первый ген D5D был клонирован из гриба Mortierella alpina , а первый ген D8D был клонирован из протиста Euglena gracilis . До сих пор микроорганизмы остаются предметом интереса во многих исследованиях структуры, функции и активности десатураз ненасыщенных жирных кислот [47,48,49].
У бактерий изменения в составе ПНЖК в плазматических мембранах могут помочь приспособиться к неблагоприятным условиям окружающей среды.Эти организмы могут изменять активность десатураз, чтобы адаптировать содержание ПНЖК к изменению температуры, pH и атмосферного давления, чтобы поддерживать соответствующую текучесть плазматических мембран. ПНЖК с длинной цепью обнаруживаются в наибольшем количестве в бактериях, населяющих холодную морскую среду, такую как полярные регионы или глубокие моря. Перенос таких бактерий в более теплую среду привел к изменению экспрессии генов десатураз и снижению содержания ПНЖК в мембранных фосфолипидах [50,51,52,53].
ПНЖК в микроорганизмах обычно содержат 16 или 18 атомов углерода, тем не менее, было показано, что некоторые микроорганизмы синтезируют ARA, EPA и DHA [54]. В настоящее время основными источниками EPA и DHA в нашем рационе являются морские виды рыб. Однако их доступность ограничена из-за ограничений на вылов, введенных для предотвращения истощения ресурсов. Следовательно, использование микроорганизмов, экспрессирующих специфические гомологичные или гетерологичные десатуразы ненасыщенных жирных кислот, способных синтезировать EPA и DHA, кажется многообещающим альтернативным источником омега-3 ЖК [54,55,56,57].Текущие коммерчески используемые микроорганизмы для производства n-3 ПНЖК, такие как Crypthecodinium cohnii , Schizochytrium sp. Или Nannochloropsis sp., Являются результатом процедур интенсивного скрининга и селективного разведения. Генная инженерия десатураз ненасыщенных жирных кислот в микроорганизмах открывает новые возможности для максимизации эффективности предшествующей и последующей обработки [58,59,60,61].
3.2. Роль десатураз ненасыщенных жирных кислот в растениях
Состав ЖК имеет решающее значение для роста и вегетации растений [62].Десатурация ЖК — ключевой фактор, определяющий устойчивость растений к различным стрессорам окружающей среды [63]. Постулируется, что повышенное накопление ПНЖК из-за изменений в уровне экспрессии гена десатуразы способствует адаптации к холоду, поддержанию нормальной текучести и целостности плазматических мембран [64]. Например, во многих растениях экспрессия гена FAD8 (гены, кодирующие десатуразы жирных кислот в растениях, принадлежат к семейству FAD) сильно индуцируется низкими температурами (продукт этого гена, катализируемый превращением диеновых жирных кислот в триеновые жирные кислоты), [64,65].Однако чрезмерное накопление ПНЖК может также усугубить термическое повреждение [66]. Трансгенный табак, трансформированный геном FAD7 , показал большую устойчивость к холоду, тогда как растения с заглушенным FAD7 содержали меньше триеновых жирных кислот и показали лучшую устойчивость к высоким температурам, чем растения дикого типа [67,68]. Кроме того, было показано, что гены FAD2 и FAD6 в проростках активируются солевым и осмотическим стрессом [69]. Мутанты с дефицитом FAD2 накапливали больше ионов натрия (Na +) + в цитоплазме клеток корня и были очень чувствительны к солевому стрессу во время прорастания семян и раннего роста проростков [70].
Активность различных десатураз жирных кислот также имеет решающее значение в контексте питательных свойств пищевых масел, поскольку эти ферменты определяют содержание отдельных ПНЖК в конечном продукте [71,72]. Прогресс в генной инженерии открыл перспективу модификации десатураз жирных кислот для обогащения культурных растений особенно желательными ЖК. Многие исследовательские группы получили трансгенные растения, которые могут синтезировать и накапливать выбранные ЖК, такие как OA, EPA, DHA и SDA [19,73,74,75,76,77].Например, экспрессия D6D бурачника ( Borago officinalis ) в масличных культурах способствовала увеличению уровней SDA до 20% от всех ЖК, присутствующих в этих растениях [73,74]. Сообщалось о высоких уровнях EPA в эфиопской горчице ( Brassica carinata ) после ее трансформации геном D5D гриба [78]. Немногие исследовательские группы смогли произвести DHA в растениях с использованием гена D4D из микроорганизмов [79,80,81,82]. Врачи и диетологи рекомендуют более высокое удельное потребление ПНЖК при некоторых заболеваниях, таких как сердечно-сосудистые заболевания, диабет и воспалительные заболевания.Однако эффективность, качество и безопасность добавок ПНЖК, доступных на рынке, вызывают сомнения, поскольку они не поддаются никакому фармацевтическому контролю [83,84,85]. Несколько исследований, проведенных в географически разных местах, показали, что веганы и вегетарианцы имеют более низкие уровни DHA и EPA в сыворотке по сравнению с всеядными [86,87,88]. Таким образом, использование растений с модифицированными десатуразами жирных кислот представляется многообещающей альтернативой диетическому потреблению n-3 ПНЖК. Это может быть особенно важно для мам-веганов и вегетарианцев во время кормления грудью.
3.3. Роль десатураз ненасыщенных жирных кислот у людей и других млекопитающих
Активность десатураз ненасыщенных жирных кислот и профиль ПНЖК являются следствием диеты и генетической структуры. Было показано, что даже один однонуклеотидный полиморфизм (SNP) в генах FADS (гены десатуразы млекопитающих, принадлежащие к семейству FADS) связан с измененной активностью десатураз жирных кислот и значительными изменениями липидного профиля плазмы [89, 90, 91, 92,93]. Люди с высоким потреблением ALA с пищей, которые несут один или два измененных аллеля FADS1 (так называемый вариант rs174546), имели более низкие концентрации общего холестерина и холестерина не-ЛПВП, чем люди с другими аллельными вариантами, и такое же потребление этого FA ( FADS1 кодирует D5D) [94].Исследовательское исследование, проведенное в Австралии, сообщает, что генотип FADS 1 также может влиять на эффекты добавления длинноцепочечных ПНЖК. Только дети с определенными SNP FADS1 получают пользу от добавок рыбьего жира [95]. Недавние исследования мышиного гена FADS2 (кодирует D6D) показали, что даже один несинонимичный SNP может изменять свойства фермента. SNP A → G был связан с заменой аминокислоты в области, ответственной за связывание железа. Присутствие аллеля G, по-видимому, связано с более низкой активностью десатуразы, поскольку у мышей, несущих этот аллель, были более высокие уровни LA и ALA и более низкие уровни ARA, EPA и DHA.Более того, было показано, что аллель G чаще встречается у мышей с более высокой скоростью основного метаболизма [96]. Белку, кодируемому третьим геном десатуразы жирных кислот млекопитающих, FADS3 , еще не приписана какая-либо специфическая функция. Экспрессия FADS3 была обнаружена во многих органах человека. Неожиданно недавние исследования in vitro продемонстрировали, что продукт FADS3 у крысы кодирует фермент, который может катализировать дельта-13-десатурацию трансвакценовой кислоты (VA, транс-11 18: 1) до транс-11, цис-13, конъюгированной. линолевая кислота (CLA; транс-11, цис-13 18: 2).Следовательно, FADS3 может быть первым геном, кодирующим метил-концевую десатуразу у млекопитающих, но эта концепция до сих пор не подтверждена in vivo [97,98]. Что интересно, некоторые исследования показали, что активность десатуразы ненасыщенных жирных кислот, возникающая в результате генетических вариантов генов FADS , может быть замаскирована. Изменения ген-зависимого профиля ПНЖК наблюдались только у женщин с нормальным весом, в то время как женщины с избыточным весом / ожирением (с ИМТ ≥ 25) в этом отношении менее подвержены влиянию генетических вариантов FADS [99].По-прежнему необходимо изучение взаимодействия генов и ИМТ в общей популяции или мужской субпопуляции.
Десатуразы жирных кислот, по-видимому, по-разному влияют на здоровье человека. Эта функциональная связь является результатом взаимосвязи между конкретными полиморфизмами генов десатуразы и различными метаболическими фенотипами () [100]. Многие исследования продемонстрировали взаимосвязь между активностью этих ферментов и различными сложными заболеваниями, такими как ишемическая болезнь сердца (ИБС). Среди пациентов с ИБС активность D6D была выше по сравнению со здоровыми людьми.Более того, конкретный SNP может изменить вероятность возникновения CAD. Например, SNP в позиции rs174537G / T связан с более высоким риском ИБС. Вариант rs174537T связан с более низким риском ИБС, тогда как вариант rs174537G чаще встречается у пациентов с ИБС [101, 102, 103]. К счастью, есть доказательства того, что соответствующее изменение поступления ПНЖК из рациона может предотвратить неблагоприятные эффекты полиморфизма FADS [104].
Таблица 1
Отдельные признаки, связанные с генетическими вариантами десатураз ненасыщенных жирных кислот — («?» — варианты SNP, не указанные в исследовании).
| Тип десатуразы | Варианты SNP | Ассоциированный признак | Характер изменения | Протестированная популяция | Ссылка | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| FADS1 | rs174551-? | Уровни аланинтрансаминазы | Более высокий уровень АЛТ в сыворотке | Восточноазиатский | [105] | |||||||
| rs174541-C | Биполярное расстройство | Специфический вариант чаще встречается у пациентов с этим заболеванием | Восточноазиатский, европейский | [106,107] | ||||||||
| rs174556-T | Состав жирных кислот грудного молока | Повышенный уровень AA в грудном молоке | Южная Азия | [108] | ||||||||
| rs174549-A | Рак (плоскоклеточный рак гортани) | Специфический вариант, более распространенный у пациентов с заболеванием | Восточноазиатский | [109] | ||||||||
| rs174564-G rs174546-T rs174549-A rs174547-C | Кардиологические особенности | Более короткий интервал QT Учащение пульса Уменьшение пульса в состоянии покоя | Европейский, африканский, Испаноязычный / латиноамериканский Американец, Азия n не указано, родной американец | [110,111,112,113] | ||||||||
| rs174546-C rs174550-T rs174551T rs174547-C rs174546-T | Холестерин более высокий уровень 901 HD1 Более высокий уровень холестерина | ЛПНП Европейский, Восточноазиатский, Южноазиатский, Латиноамериканский / латиноамериканский Американский, африканский Американец / афро- Карибский, Океанский, Коренной американец | [ 114,115,116,117,118,119,120,121,122,123,124,125,126,127] | |||||||||
| rs174550-T | Уровень глюкозы в крови натощак | Повышенный уровень глюкозы в крови натощак | Испанцы / латиноамериканцы американцы, афроамериканцы американцы / афро-американцы, выходцы из Европы из стран Карибского бассейна | [123,128,129,130] |||||||||
| rs174548-G rs174549-A | Десату жирных кислот активность расы | Не указано Низкая активность | Восточноазиатская, европейская | [91,131,132] | ||||||||
| rs174549-A rs174548-Grs174555-C rs174548-G | Гематологические признаки | Более высокие моноциты количество клеток Более высокое количество тромбоцитов, Сумма Количество эозинофилов базофилов Меньшее количество гранулоцитов Нижние эритроциты ширина распределения | Европейский, Восточноазиатский | [133,134,135,136,137] | ||||||||
| rs174547-T | Высота | Восточноазиатская, европейская[133,138] | ||||||||||
| rs174550-T rs174547-T | Plasman-3 уровень полиненасыщенных жирных кислот | Более высокий уровень EPA Низкий уровень ALA Более высокий уровень DPA | 10 [Европейский 139 | ]|||||||||
| rs174550-T rs174547-C rs174546-T | Plasman-6 po люненасыщенные жирные кислотные уровни | Высшая адреновая кислота Низкий уровень ARA Низкий уровень DGLA | Европейский, Восточноазиатский | [131,140] | ||||||||
| rs174546-T | Уровни триглицеридов | 00 Высокий уровень ТГ в Европе | 00 / Латиноамериканец, афроамериканец или афро-карибский, южный азиатский, восточноазиатский, человек из Океании, коренной житель американец | [105,115,116,117,118,119,119,120,121,123,124] | ||||||||
| FADS2 | rs174566100-A | 00 | Специфический вариант, более распространенный у субъектов с заболеванием | Европейский | [141] | |||||||
| rs174592-G rs174581-A | Облысение (тип 1, облысение по мужскому типу) | Специфический вариант, более часто встречающийся у субъектов с болезнь | европейский | [133,142,143] | ||||||||
| rs12226877-A rs28456-G r s174576-A | Биполярное расстройство | Специфический вариант, более часто встречающийся у пациентов с этим заболеванием | Восточноазиатский, европейский | [106,107] | ||||||||
| rs174594-A rs1535-A rs2072113-C | Рак (ларингеальный рак) плоскоклеточный рак , колоректальный рак , рак легких) | Специфический вариант, более часто встречающийся у субъектов с этим заболеванием | Восточноазиатский, европейский, африканский Американский / афро- Карибский | [109,144,145,146,147] | ||||||||
| rs174577- А RS174564-G RS174583-T RS174577-? | Кардиологические признаки | Более короткая продолжительность зубца P Повышенное пульсовое давление Более короткий интервал QT Более короткая продолжительность QRS | Южная Азия, Европа | [111,112,113,148,149,150] | ||||||||
| rs174570-G rs174577s rs174570-T | Уровни холестерина | Более высокий общий холестерин, ЛПВП, уровни ЛПНП Более высокий уровень ЛПВП Более высокий уровень ЛПНП Низкий уровень ЛПНП | Европейский, Латиноамериканец / латиноамериканец Американский, африканец Американский или афро- Карибский, Восточноазиатский | [114,115,116,118,119,120,121,122,125,151,152] | ||||||||
| rs174583-T rs174577-A | Комплексная сила и добавочная мышечная масса | Более высокая комплексная сила и добавочная мышечная масса | Восточноазиатский | Восточноазиатский | 00 G rs2072113-T | Десатуразная активность жирных кислот | Снижение активности | Европейский, Восточноазиатский | [91,131,132] | |||
| rs174601-T | Уровни гондоевой кислоты (20: 1 n-9) | Более высокий уровень ЖК | Восточноазиатский, европейский | [154] | ||||||||
| RS968567-T RS2727271-? rs174570-C rs174577-A rs61897795-G rs2727271-T | Гематологические признаки | Более высокий уровень IgA Низкое соотношение альбумин-глобулин Более высокий уровень гликирования Более низкий уровень гемоглобина Более высокий уровень переноса гемоглобина альбумин уровни белка | Восточная Азия, Южная Азия, Европа | [105,133,134,136,155,156,157] | ||||||||
| rs174574-A | Минеральная плотность пяточной кости | Более высокая минеральная плотность кости | Европейский | [15895,159] | rs174599-?Гипотиреоз | Низшие гормоны щитовидной железы | Европейский | [133] | ||||
| rs4246215-T | Воспалительное заболевание кишечника | Специфический вариант, более часто встречающийся у пациентов с этим заболеванием | Европейский | [16095,161] | rs174574-A rs1535-A | Уровни ПНЖК n-3 в плазме | Нижний уровень EPA, Нижний уровень ALA Высший DPA | Европейский | [139] | |||
| rs174577-C -Ts2727250 rs174578-T | Уровни ПНЖК n-6 в плазме | Более высокий уровень ARA Более высокий уровень LA Нижний уровень LA | Европейский, Восточноазиатский | [131,140] | ||||||||
| rs968567-C | Ревматоидный артрит | Специфический вариант | чаще встречается у субъектов с этим заболеванием Европейский, Восточноазиатский, Афроамериканский Афро-карибский | [162,163] | 900 95||||||||
| rs174560-C | Продолжительность сна | Более длительная обычная продолжительность сна | Европейский | [164] | ||||||||
| rs174564-G rs174577-C | Уровни триглицеридов | 10 Нижний уровень триглицеридов | 10 Европейский уровень TG | [105,115,116,117,118,119,120,121,123,124] | ||||||||
| FADS3 | rs1000778-A | Уровень сфинголипидов | 10 101 в Европе 101 ]||||||||||
| rs174468-A rs174448-A | Уровни ПНЖК n-3 в плазме | Высокий уровень ALA Нижний уровень DPA, EPA | Европейский | [139] | ||||||||
| rs174449-A | 50 rs174449-A | 50 -A | Уровни трансжирных кислот | Более высокие концентрации цис / транс-18: 2 | Европа, Африка Америка n / Афро- Карибский бассейн, Восточная Азия, Латиноамериканец / латиноамериканец Американец | [139,166] |
Поскольку n-3 ПНЖК считаются противовоспалительными веществами, измененный метаболизм ПНЖК способствует хроническому воспалению, наблюдаемому при болезни Крона. (CD).Данные полногеномного исследования ассоциации указывают на несколько SNP в генах FADS , связанных с риском CD [167, 168]. Анализ D6D в биоптатах брыжеечной жировой ткани (аномальная брыжеечная жировая ткань является отличительной чертой CD) показывает более низкий уровень D6D в образцах CD, чем в нормальной ткани, как на уровне мРНК, так и на уровне белка [169]. Однако активность D6D, рассчитанная как индексы активности фермента на основе концентрации жирных кислот в плазме, была значительно выше у пациентов с БК, чем у здоровых добровольцев [170].Более того, исследования показывают, что пациенты с БК получают пользу от добавок n-3 ПНЖК в различной степени [171]. Отсутствие согласованности между исследованиями можно объяснить наличием взаимодействий между генами и диетой. Например, пациенты с конкретными вариантами FADS , ассоциированными с более высокой эндогенной продукцией n-6 ПНЖК, имеют больший риск развития БК даже при более низком потреблении n-6 ПНЖК с пищей, поэтому они могут получить пользу от добавок n-3 ПНЖК, тогда как Пациенты с вариантами FADS , ассоциированными с более низким эндогенным продуцированием n-3 ПНЖК, даже при высоком потреблении ПНЖК с пищей, по-прежнему имеют тенденцию иметь более низкий уровень n-3 ПНЖК, поэтому они получают меньшую пользу от добавок n-3 ПНЖК, чем пациенты с другие варианты FADS [168 172 173].Это говорит о том, что в будущем потребуется более индивидуальный подход.
Многие исследования, проведенные на людях и мышах, показали корреляцию между активностью дельта-5 и дельта-6 десатураз и метаболическим синдромом, инсулинорезистентностью и ожирением. Они сообщили, что существует сильная положительная корреляция между активностью D6D и риском этих состояний, тогда как активность D5D обратно пропорциональна метаболическому синдрому, инсулинорезистентности и ожирению (генетический фон в этих исследованиях не исследовался) [174, 175, 176].Сравнительный генетический анализ лиц с инсулинорезистентностью и нормальной чувствительностью к инсулину продемонстрировал подавление экспрессии D5D в жировой ткани и мышцах первой группы (измерения активности в этом исследовании не проводились) [177]. Проблема еще более усложняется, если принять во внимание тот факт, что определенные SNP могут модулировать активность десатуразы. Некоторые исследования японского населения показывают, что некоторый вариант FADS1 (SNP rs174550) был значительно связан с повышенным риском диабета 2 типа [178].Интересно, что один и тот же SNP в европейской популяции был связан с более низким уровнем глюкозы в плазме натощак в нормальном физиологическом диапазоне, но не с патологическим уровнем глюкозы [179]. Данные многочисленных экспериментов на мышах предполагают, что разработка селективных ингибиторов десатуразы может быть полезной при лечении диабета, ожирения и атеросклеротических сердечно-сосудистых заболеваний у людей [180, 181, 182]. У мышей с нокдауном D6D развилась устойчивость к ожирению, вызванному диетой с высоким содержанием жиров, поэтому, возможно, некоторые метаболические преимущества для людей с ожирением могут быть получены с помощью ингибиторов D6D [183].Поскольку ожирение рассматривается как хроническое воспаление слабой степени, ингибиторы D5D также могут быть полезными. Потенциальный ингибитор D5D может повышать уровень DGLA (предшественник противовоспалительных эйкозаноидов) и снижать уровень AA (предшественник провоспалительных эйкозаноидов). Инсулинорезистентность — сложное состояние, и его развитию способствуют несколько факторов, включая генетический состав, образ жизни и диету. Их рассмотрение по отдельности может привести к несоответствиям в разных исследованиях, например, в случае исследований эффективности добавок ПНЖК.Исследования показали, что добавление n-3 ПНЖК может быть эффективным для предотвращения или реверсии инсулинорезистентности, но только вместе с уменьшением потребления насыщенных ЖК, транс-FA и n-6 ПНЖК. Добавление n-6 PUFA может также снизить инсулинорезистентность, но только если n-6 PUFA заменяет SFA, транс-FA или сахарозу. Замена n-3 PUFA на n-6 PUFA в рационе может ухудшить инсулинорезистентность [184,185,186]. n-3 ПНЖК могут предотвращать инсулинорезистентность с помощью ряда различных механизмов, включая регуляцию воспаления, модуляцию секреции адипонектина и лептина и влияние на экспрессию нескольких генов, участвующих в метаболизме углеводов и липидов [187, 188, 189].Похоже, что связи между десатуразами и сложными метаболическими состояниями, такими как метаболический синдром, инсулинорезистентность и ожирение, все еще не полностью изучены, а некоторые механизмы все еще остаются неуловимыми.
Пациенты с неалкогольной жировой болезнью печени (НАЖБП) демонстрируют более высокий уровень свободных ЖК в сыворотке и измененный профиль ЖК по сравнению со здоровыми субъектами, включая более высокие общие НЖК, более высокие общие МНЖК, более низкие общие ПНЖК [190,191]. Имеющиеся данные показывают, что измененная активность десатураз жирных кислот является одним из факторов риска НАЖБП.Было показано, что пациенты с НАЖБП имеют более высокую активность D6D и более низкую активность D5D, чем здоровые добровольцы [192,193,194]. Аналогичное наблюдение было сделано в случае детской неалкогольной болезни печени [195]. Различия в активности десатураз часто связаны с естественными генетическими вариациями этих генов [196]. Лучшее понимание связи между полиморфизмом локуса и уровнем функционального фермента может привести к разработке персонализированной стратегии лечения НАЖБП в ближайшем будущем.Пилотное исследование 2018 года показало, что пациенты с НАЖБП с аллелями, связанными с низкой активностью D5D, получают больше пользы от добавления n-3 ПНЖК (значительное снижение стеатоза, фиброза, баллонов и показателей активности НАЖБП), чем пациенты с другими вариантами SNP [195] . К настоящему времени SNP в областях пататин-подобного фосфолипазного домена, содержащего белок 3 (PNPLA3) и трансмембранного 6 члена суперсемейства 2 (TM6SF2), были идентифицированы и подтверждены в больших группах пациентов в качестве биомаркера риска НАЖБП.Возможно, в ближайшем будущем SNP в FADS1 станут третьим биомаркером НАЖБП, но некоторые крупномасштабные исследования все еще необходимы [197,198]. Однако ситуация осложняется тем, что при НАЖБП, как и при ИБС, наблюдаются нарушения десатураз ненасыщенных жирных кислот, а НАЖБП часто сопровождается ИБС. Более того, ИБС является одной из ведущих причин смерти в этой группе пациентов. Тем не менее, почти нет исследований ассоциаций между полиморфизмом НАЖБП, ИБС и FADS [199].Более глубокое понимание FADS SNP в контексте НАЖБП с ИБП необходимо, если мы хотим использовать генетический фон для ранней диагностики и профилактики.
Десатуразы ненасыщенных жирных кислот также играют важную роль в канцерогенезе, включая выживаемость раковых клеток, метастазирование и лекарственную устойчивость [200,201]. Полногеномное исследование ассоциации в популяции жителей Восточной Азии выявило карту локусов для генов FADS1 и FADS2 , связанных с колоректальным раком и риском плоскоклеточного рака гортани [109,202].К сожалению, нет информации по этому поводу от популяций с других континентов, поэтому неясно, можно ли это рассматривать как универсальный маркер прогноза. Более того, у пациентов со злокачественной меланомой, злокачественными новообразованиями груди, головного мозга и легких экспрессия и активность D6D в раковых тканях оказались выше, чем в соседних нормальных тканях [203, 204]. Не исключено, что это общая черта всех злокачественных новообразований [205]. В исследованиях на животных ингибирование дельта-6-десатуразы (как с помощью нокдауна, так и с помощью РНКи) эффективно предотвращало рост рака.Поскольку D6D является ферментом, катализирующим лимитирующую стадию синтеза АК, его активность имеет решающее значение для производства провоспалительных эйкозаноидов, последующих метаболитов АК, таких как простагландины, лейкотриены и эпокси-эйкозатриены. Следовательно, кажется логичным, что ингибирование образования основного метаболита (АК) может быть более эффективным способом снижения синтеза провоспалительных эйкозаноидов, чем блокирование каждого конкретного пути (т. Е. Пути циклооксигеназы, липоксигеназы и пути эпоксигеназы цитохрома P450) по отдельности. [206].Снижение активности десатуразы ненасыщенных жирных кислот может иметь антипролиферативный эффект не только из-за снижения доступности эйкозаноидов для передачи сигналов клетками. Другая возможность — измененное соотношение NAD + / NADH в цитозоле, которое может модулировать гликолиз и ферментацию лактата — два важных источника дыхательного топлива в раковых клетках [207]. Исследования показали, что временный нокдаун D5D и D6D в клетках, культивируемых in vitro, приводит к изменению уровня активных форм кислорода (АФК), потребления пирувата и пролиферации клеток [11].Однако необходимы дальнейшие исследования, чтобы выяснить, играет ли отношение NAD + / NADH, опосредованное десатуразами ненасыщенных жирных кислот, важную роль в эффекте Варбурга в раковых клетках. Взяв всю информацию вместе, десатурация жирных кислот может быть новым метаболическим маркером и терапевтической мишенью при определенных типах рака. Однако, по сведениям авторов, никакие ингибиторы FADS1 или FADS2 для лечения рака не проходят клинических испытаний.
Десатуразы жирных кислот также играют важную роль во время беременности и кормления грудью.Материнские уровни ARA, EPA и DHA влияют на количество этих кислот, доставляемых непосредственно плоду или обеспечиваемых материнским молоком после рождения. Следовательно, активность десатуразы влияет на качественный и количественный состав ЖК n-3 и n-6, доставленных ребенку. ЖК, в том числе ARA, EPA и DHA, играют ключевую роль в росте, развитии нейронов и функционировании иммунной системы у младенцев [108,180,208,209,210]. Более того, развитие когнитивных функций и интеллектуальное развитие ребенка может определяться уникальным составом ЖК, содержащихся в материнском молоке [211, 212].Интересно, что в нескольких исследованиях также упоминается взаимосвязь между составом жирных кислот грудного молока и послеродовой передачей ВИЧ-1. ALA можно удлинить для создания ETE или уменьшить насыщенность для создания SDA. Когда D6D менее активен, чем элонгаза 5, количество ETE в грудном молоке увеличивается. Более высокая концентрация ETE была связана с более низким риском передачи ВИЧ-1 [213]. К сожалению, большого проспективного когортного исследования в этом вопросе пока нет.
FA, особенно n-3, могут модулировать поведение и когнитивные функции.Животные, которых содержали на диете, исключающей или ограничивающей субстраты для десатуразы жирных кислот, демонстрировали большую двигательную гиперактивность и худшие когнитивные способности. Было замечено, что дети со специфическими SNP в генах FADS (так называемый DHA-повышающий кластер) набирают больше очков в анкете личных и социальных навыков [214]. Более того, исследования продемонстрировали связь между вариабельностью нуклеотидных последовательностей в генах, кодирующих десатуразу, и частотой синдрома дефицита внимания с гиперактивностью (СДВГ) [215].
Тип ЖК, содержащихся в мембранных фосфолипидах, может модулировать широкий спектр биологических механизмов и путей в головном мозге, включая нейроны, глиальные клетки и целостность и выживаемость эндотелиальных клеток, нейротрансмиссию (дофаминергические, серотонинергические, глутаматергические и холинергические) и нейровоспаление и [216, 217, 218]. ПНЖК, особенно ARA и DHA, являются основными составляющими мембран нейронов. Однако причинно-следственная связь между психическими расстройствами и десатуразами ненасыщенных жирных кислот до сих пор не ясна.У пациентов с психоневрологическими расстройствами, такими как биполярные аффективные расстройства и шизофрения, часто наблюдается избыточная экспрессия и повышенная активность D6D и, в то же время, уровни n-3 PUFA (DPA, DHA) и n-6 PUFA (EDA, ARA, 22: 4 n-6) фосфолипидов мембран нейронов было снижено [219, 220, 221]. Данные исследований на животных in vitro и клинических исследований показывают, что длительное лечение рисперидоном (антипсихотическим препаратом) усиливает экспрессию и активность множества липогенных генов, включая D6D.Интересно, что некоторые исследования на животных моделях предполагают, что пренатальный диетический дефицит ПНЖК (особенно ARA и DHA) может влиять на раннее нейроразвитие потомства и тем самым предрасполагать к развитию шизофрении [222]. Мыши, которые пережили гестационную и раннюю постнатальную диетическую депривацию ARA и DHA, показали шизофренические фенотипы во взрослом возрасте (пониженный уровень мотивации, депрессивные симптомы и нарушение когнитивных функций). Поскольку профиль ПНЖК может быть определен как по потреблению ПНЖК с пищей, так и по активности десатуразы, кажется разумным предположить, что материнская активность десатуразы также может играть роль в риске шизофрении у потомства.В нескольких исследованиях на крысах в конце 1970-х и начале 1980-х годов упоминались изменения активности D5D и D6D у матери, плода и детенышей в ответ на диету матери с низким содержанием основных ЖК, тем не менее, до сих пор нет исследований взаимосвязи между ненасыщенными матерями. десатуразы жирных кислот (активность и / или генетические варианты) и риск шизофрении у потомства [223, 224]. Кроме того, относительно небольшое количество исследований изучали терапевтическую ценность добавок ПНЖК при шизофрении, и ни в одном из них не упоминалось потенциальное использование ингибиторов FADS .Более того, результаты этих исследований противоречивы. Наблюдаемые эффекты от приема ПНЖК варьируются от значительного увеличения тяжести симптомов шизофрении до отсутствия значительного влияния на тяжесть симптомов до снижения интенсивности симптомов и улучшения уровня функционирования пациентов [225, 226, 227].
Все ли полиненасыщенные жирные кислоты n-3 созданы равными? | Липиды в здоровье и болезнях
Kris-Etherton PM, Harris WS, Appel LJ: потребление рыбы, рыбий жир, омега-3 жирные кислоты и сердечно-сосудистые заболевания.Артериосклер Thromb Vasc Biol. 2003, 23 (2): e20-e30.
CAS PubMed Статья Google ученый
Чан Дж. К., Макдональд Б. Э., Джеррард Дж. М., Брюс В. М., Уивер Б. Дж., Голуб Б. Дж .: Влияние диетической альфа-линоленовой кислоты и ее отношения к линолевой кислоте на жирные кислоты тромбоцитов и плазмы и тромбообразование. Липиды. 1993, 28 (9): 811-817.
CAS PubMed Статья Google ученый
Эмкен Э.А., Адлоф Р.О., Галли Р.М.: Линолевая кислота в рационе влияет на десатурацию и ацилирование меченных дейтерием линолевой и линоленовой кислот у молодых взрослых мужчин. Biochim Biophys Acta. 1994, 1213 (3): 277-288.
CAS PubMed Статья Google ученый
Francois CA, Connor SL, Bolewicz LC, Connor WE: Добавление льняного масла кормящим женщинам не увеличивает содержание докозагексаеновой кислоты в их молоке. Am J Clin Nutr.2003, 77 (1): 226-233.
CAS PubMed Google ученый
Wijendran V, Hayes KC: Диетический баланс жирных кислот n-6 и n-3 и здоровье сердечно-сосудистой системы. Анну Рев Нутр. 2004, 24: 597-615.
CAS PubMed Статья Google ученый
Бренна Дж. Т.: Эффективность превращения альфа-линоленовой кислоты в длинноцепочечные n-3 жирные кислоты у человека. Curr Opin Clin Nutr Metab Care.2002, 5 (2): 127-132.
CAS PubMed Статья Google ученый
Бренна Дж. Т., Салем Н., Синклер А. Дж., Куннейн СК: добавление альфа-линоленовой кислоты и преобразование в полиненасыщенные жирные кислоты с длинной цепью n-3 у людей. Простагландины Leukot Essent Fatty Acids. 2009, 80 (2–3): 85-91.
CAS PubMed Статья Google ученый
SanGiovanni JP, Chew EY: Роль длинноцепочечных полиненасыщенных жирных кислот омега-3 в здоровье и заболеваниях сетчатки.Prog Retin Eye Res. 2005, 24 (1): 87-138.
CAS PubMed Статья Google ученый
Литман Б.Дж., Ниу С.Л., Полозова А., Митчелл Д.К.: Роль фосфолипидов, содержащих докозагексаеновую кислоту, в модуляции сигнальных путей, связанных с G-белком: визуальная трансдукция. J Mol Neurosci. 2001, 16 (2-3): 237-242.
CAS PubMed Статья Google ученый
Birch EE, Garfield S, Hoffman DR, Uauy R, Birch DG: рандомизированное контролируемое испытание раннего диетического питания длинноцепочечных полиненасыщенных жирных кислот и умственного развития доношенных детей. Dev Med Child Neurol. 2000, 42 (3): 174-181.
CAS PubMed Статья Google ученый
Салем Н., Литман Б., Ким Х.Й., Гавриш К.: Механизмы действия докозагексаеновой кислоты в нервной системе. Липиды. 2001, 36 (9): 945-959.
CAS PubMed Статья Google ученый
Велч А.А., Лунд Э., Амиано П., Дорронсоро М.: Изменчивость в потреблении рыбы в 10 европейских странах. IARC Sci Publ. 2002, 156: 221-222.
CAS PubMed Google ученый
Muthayya S, Dwarkanath P, Thomas T., Ramprakash S, Mehra R, Mhaskar A, Mhaskar R, Thomas A, Bhat S: Влияние потребления рыбы и омега-3 LCPUFA на низкий вес при рождении у беременных в Индии женщины.Eur J Clin Nutr. 2009, 63 (3): 340-346.
CAS PubMed Статья Google ученый
Менотти А., Кромхаут Д., Блэкберн Х., Фиданза Ф., Бузина Р., Ниссинен А. Модели потребления пищи и 25-летняя смертность от ишемической болезни сердца: межкультурные корреляции в исследовании семи стран. Исследовательская группа семи стран. Eur J Epidemiol. 1999, 15 (6): 507-515.
CAS PubMed Статья Google ученый
Мисра А., Хурана Л., Ишарвал С., Бхардвадж С.: Южноазиатские диеты и инсулинорезистентность. Br J Nutr. 2009, 101 (4): 465-473.
CAS PubMed Статья Google ученый
Caygill CP, Charlett A, Hill MJ: Жир, рыба, рыбий жир и рак. Br J Рак. 1996, 74 (1): 159-164.
PubMed Central CAS PubMed Статья Google ученый
Курики К., Хиросе К., Вакаи К., Мацуо К., Ито Х, Сузуки Т., Хираки А., Сайто Т., Ивата Х .: Риск рака груди и состав эритроцитов n-3 высоконенасыщенных жирных кислот на японском языке. Int J Cancer. 2007, 121 (2): 377-385.
CAS PubMed Статья Google ученый
Колдер PC: Диетическая модификация воспаления с помощью липидов. Proc Nutr Soc. 2002, 61 (3): 345-358.
CAS PubMed Статья Google ученый
Das UN: Незаменимые жирные кислоты — обзор. Curr Pharm Biotechnol. 2006, 7 (6): 467-482.
CAS PubMed Статья Google ученый
Симопулос А.П.: Омега-3 жирные кислоты при воспалениях и аутоиммунных заболеваниях. J Am Coll Nutr. 2002, 21 (6): 495-505.
CAS PubMed Статья Google ученый
Serhan CN, Clish CB, Brannon J, Colgan SP, Gronert K, Chiang N: антимикровоспалительные липидные сигналы, генерируемые пищевыми жирными кислотами N-3 через циклооксигеназу-2 и трансцеллюлярный процессинг: новый механизм для НПВС и терапевтическое действие N-3 PUFA.J. Physiol Pharmacol. 2000, 51 (4 Pt 1): 643-654.
CAS PubMed Google ученый
Серхан С.Н., Клиш С.Б., Браннон Дж., Колган С.П., Чианг Н., Гронерт К.: Новые функциональные наборы медиаторов на основе липидов с противовоспалительным действием, генерируемые из жирных кислот омега-3 через циклооксигеназу 2-нестероидные противовоспалительные препараты и трансцеллюлярный процессинг. J Exp Med. 2000, 192 (8): 1197-1204.
PubMed Central CAS PubMed Статья Google ученый
Серхан С.Н., Хонг С., Гронерт К., Колган С.П., Девчанд П.Р., Мирик Г., Муссиньяк Р.Л.: Резолвины: семейство биоактивных продуктов цепей трансформации жирных кислот омега-3, инициированных обработкой аспирином, которые противодействуют сигналам провоспалительного действия. J Exp Med. 2002, 196 (8): 1025-1037.
PubMed Central CAS PubMed Статья Google ученый
Hong S, Gronert K, Devchand PR, Moussignac RL, Serhan CN: Новые докозатриены и 17S-резольвины, полученные из докозагексаеновой кислоты в мозге мыши, крови человека и глиальных клетках.Аутакоиды в противовоспалительном действии. J Biol Chem. 2003, 278 (17): 14677-14687.
CAS PubMed Статья Google ученый
Marcheselli VL, Hong S, Lukiw WJ, Tian XH, Gronert K, Musto A, Hardy M, Gimenez JM, Chiang N: новые докозаноиды ингибируют опосредованную ишемией-реперфузией инфильтрацию лейкоцитов и экспрессию провоспалительных генов . J Biol Chem. 2003, 278 (44): 43807-43817.
CAS PubMed Статья Google ученый
Mukherjee PK, Marcheselli VL, Serhan CN, Bazan NG: Нейропротектин D1: докозатриен, полученный из докозагексаеновой кислоты, защищает клетки пигментного эпителия сетчатки человека от окислительного стресса. Proc Natl Acad Sci USA. 2004, 101 (22): 8491-8496.
PubMed Central CAS PubMed Статья Google ученый
Das UN: Незаменимые жирные кислоты: биохимия, физиология и патология. Biotechnol J. 2006, 1 (4): 420-439.
CAS PubMed Статья Google ученый
Arita M, Bianchini F, Aliberti J, Sher A, Chiang N, Hong S, Yang R, Petasis NA, Serhan CN: стереохимическое назначение, противовоспалительные свойства и рецептор для липидного медиатора омега-3 резольвина E1. J Exp Med. 2005, 201 (5): 713-722.
PubMed Central CAS PubMed Статья Google ученый
Chavali SR, Zhong WW, Forse RA: Диетическая альфа-линоленовая кислота увеличивает TNF-альфа и снижает IL-6, IL-10 в ответ на LPS: эффекты сезамина на дельта-5-десатурацию омега-6 и омега-3 жирные кислоты у мышей.Простагландины Leukot Essent Fatty Acids. 1998, 58 (3): 185-191.
CAS PubMed Статья Google ученый
Dooper MM, van RB, Graus YM, M’Rabet L: Дигомо-гамма-линоленовая кислота ингибирует продукцию фактора некроза опухоли альфа лейкоцитами человека независимо от активности циклооксигеназы. Иммунология. 2003, 110 (3): 348-357.
PubMed Central CAS PubMed Статья Google ученый
Кумар Г.С., Дас ООН: Влияние простагландинов и их предшественников на пролиферацию лимфоцитов человека и их секрецию фактора некроза опухоли и различных интерлейкинов. Простагландины Leukot Essent Fatty Acids. 1994, 50 (6): 331-334.
CAS PubMed Статья Google ученый
Hong S, Gronert K, Devchand PR, Moussignac RL, Serhan CN: новые докозатриены и 17S-резольвины, полученные из докозагексаеновой кислоты в мозге мыши, крови человека и глиальных клетках.Аутакоиды в противовоспалительном действии. J Biol Chem. 2003, 278 (17): 14677-14687.
CAS PubMed Статья Google ученый
Marcheselli VL, Hong S, Lukiw WJ, Tian XH, Gronert K, Musto A, Hardy M, Gimenez JM, Chiang N: новые докозаноиды ингибируют опосредованную ишемией-реперфузией инфильтрацию лейкоцитов и экспрессию провоспалительных генов . J Biol Chem. 2003, 278 (44): 43807-43817.
CAS PubMed Статья Google ученый
Гронерт К., Махешвари Н., Хан Н., Хассан И. Р., Данн М., Ланиадо С. М.: Роль пути 12/15-липоксигеназы мыши в содействии заживлению эпителиальных ран и защите хозяина. J Biol Chem. 2005, 280 (15): 15267-15278.
CAS PubMed Статья Google ученый
Калон Ф, Лим Г.П., Ян Ф., Морихара Т., Тетер Б., Убеда О., Ростаинг П., Триллер А., Салем Н.: Докозагексаеновая кислота защищает от дендритной патологии на мышиной модели с болезнью Альцгеймера.Нейрон. 2004, 43 (5): 633-645.
PubMed Central CAS PubMed Статья Google ученый
Lukiw WJ, Cui JG, Marcheselli VL, Bodker M, Botkjaer A, Gotlinger K, Serhan CN, Bazan NG: Роль нейропротектина D1, полученного из докозагексаеновой кислоты, в выживании нервных клеток и болезни Альцгеймера. J Clin Invest. 2005, 115 (10): 2774-2783.
PubMed Central CAS PubMed Статья Google ученый
Лейтон Дж., Друри П.Дж., Кроуфорд М.А.: Дифференциальное окисление насыщенных и ненасыщенных жирных кислот in vivo у крыс. Br J Nutr. 1987, 57 (3): 383-393.
CAS PubMed Статья Google ученый
Vermunt SH, Mensink RP, Simonis MM, Hornstra G: Влияние диетической альфа-линоленовой кислоты на превращение и окисление 13C-альфа-линоленовой кислоты. Липиды. 2000, 35 (2): 137-142.
CAS PubMed Статья Google ученый
Burdge GC, Finnegan YE, Minihane AM, Williams CM, Wootton SA: Влияние измененного потребления жирных кислот n-3 с пищей на состав липидов и жирных кислот плазмы, превращение [13C] альфа-линоленовой кислоты в жирные кислоты с более длинной цепью и распределение в сторону бета-окисления у пожилых мужчин. Br J Nutr. 2003, 90 (2): 311-321.
CAS PubMed Статья Google ученый
DeLany JP, Windhauser MM, Champagne CM, Bray GA: Дифференциальное окисление отдельных пищевых жирных кислот у людей.Am J Clin Nutr. 2000, 72 (4): 905-911.
CAS PubMed Google ученый
Cunnane SC, Menard CR, Likhodii SS, Brenna JT, Crawford MA: Рециркуляция углерода в липогенез de novo является основным путем в неонатальном метаболизме линолеата и альфа-линолената. Простагландины Leukot Essent Fatty Acids. 1999, 60 (5-6): 387-392.
CAS PubMed Статья Google ученый
Gao F, Kiesewetter D, Chang L, Ma K, Bell JM, Rapoport SI, Igarashi M: Скорость синтеза-секреции длинноцепочечных n-3 ПНЖК из циркулирующей неэтерифицированной альфа-линоленовой кислоты у крыс без анестезии. J Lipid Res. 2009, 50 (4): 749-758.
PubMed Central CAS PubMed Статья Google ученый
Рапопорт С.И., Игараси М: Может ли печень крысы поддерживать нормальный метаболизм ДГК в головном мозге в отсутствие ДГК с пищей ?.Простагландины Leukot Essent Fatty Acids. 2009,
Google ученый
Pawlosky RJ, Hibbeln JR, Novotny JA, Salem N: физиологический компартментальный анализ метаболизма альфа-линоленовой кислоты у взрослых людей. J Lipid Res. 2001, 42 (8): 1257-1265.
CAS PubMed Google ученый
De SE, eo-Pellegrini H, Boffetta P, Ronco A, Mendilaharsu M: Альфа-линоленовая кислота и риск рака простаты: исследование случай-контроль в Уругвае.Биомаркеры эпидемиологии рака Пред. 2000, 9 (3): 335-338.
Google ученый
Gann PH, Hennekens CH, Sacks FM, Grodstein F, Giovannucci EL, Stampfer MJ: проспективное исследование жирных кислот плазмы и риска рака простаты. J Natl Cancer Inst. 1994, 86 (4): 281-286.
CAS PubMed Статья Google ученый
Джованнуччи Э., Римм Э.Б., Колдиц Г.А., Штампфер М.Дж., Аскерио А., Чут С.К., Виллетт В.С.: проспективное исследование диетического жира и риска рака простаты.J Natl Cancer Inst. 1993, 85 (19): 1571-1579.
CAS PubMed Статья Google ученый
Ramon JM, Bou R, Romea S, Alkiza ME, Jacas M, Ribes J, Oromi J: Потребление жиров и риск рака простаты: исследование случай-контроль в Испании. Контроль причин рака. 2000, 11 (8): 679-685.
CAS PubMed Статья Google ученый
Аттар-Баши Н.М., Фрауман А.Г., Синклер А.Дж.: Альфа-линоленовая кислота и риск рака простаты.Какие есть доказательства ?. J Urol. 2004, 171 (4): 1402-1407.
PubMed Статья Google ученый
Андерссон С.О., Волк А., Бергстром Р., Джованнуччи Е., Линдгрен С., Барон Дж., Адами Х.О .: Энергия, потребление питательных веществ и риск рака простаты: популяционное исследование методом случай-контроль в Швеции. Int J Cancer. 1996, 68 (6): 716-722.
CAS PubMed Статья Google ученый
Schuurman AG, Brandt van den PA, Dorant E, Brants HA, Goldbohm RA: Связь потребления энергии и жира с риском карциномы простаты: результаты голландского когортного исследования. Рак. 1999, 86 (6): 1019-1027.
CAS PubMed Статья Google ученый
Альберг А., Кафонек С., Хуанг Х., Хоффман С., Комсток Г., Хельцлоуэр К. Уровни жирных кислот и последующее развитие рака простаты. Proc Am Assoc Cancer Res.1996, 37: 281-
Google ученый
Фриман В.Л., Мейдани М., Йонг С., Пайл Дж., Фланиган Р.С., Уотерс В.Б., Войчик Е.М.: Уровни жирных кислот в простате и гистопатология локализованного рака простаты. J Urol. 2000, 164 (6): 2168-2172.
CAS PubMed Статья Google ученый
Godley PA, Campbell MK, Miller C, Gallagher P, Martinson FE, Mohler JL, Sandler RS: Корреляция между биомаркерами потребления омега-3 жирных кислот и данными опроса у афроамериканцев и мужчин европеоидной расы в США с и без рака простаты.Биомаркеры эпидемиологии рака Пред. 1996, 5 (2): 115-119.
CAS PubMed Google ученый
Harvei S, Bjerve KS, Tretli S, Jellum E, Robsahm TE, Vatten L: Прогностический уровень жирных кислот в фосфолипидах сыворотки: омега-3 и омега-6 жирные кислоты и риск рака простаты. Int J Cancer. 1997, 71 (4): 545-551.
CAS PubMed Статья Google ученый
Newcomer LM, King IB, Wicklund KG, Stanford JL: Связь жирных кислот с риском рака простаты. Простата. 2001, 47 (4): 262-268.
CAS PubMed Статья Google ученый
Мейер Ф., Байрати И., Фрадет Ю., Мур Л.: Энергетическая ценность и питательные вещества в отношении доклинического рака простаты. Nutr Cancer. 1997, 29 (2): 120-126.
CAS PubMed Статья Google ученый
Mannisto S, Pietinen P, Virtanen MJ, Salminen I, Albanes D, Giovannucci E, Virtamo J: Жирные кислоты и риск рака простаты во вложенном исследовании методом случай-контроль у курящих мужчин. Биомаркеры эпидемиологии рака Пред. 2003, 12 (12): 1422-1428.
PubMed Google ученый
Astorg P: Диетические полиненасыщенные жирные кислоты N-6 и N-3 и риск рака простаты: обзор эпидемиологических и экспериментальных данных. Контроль причин рака.2004, 15 (4): 367-386.
PubMed Статья Google ученый
Дания-Ванефрид W, Price DT, Polascik TJ, Robertson CN, Anderson EE, Paulson DF, Walther PJ, Gannon M, Vollmer RT: пилотное исследование ограничения пищевых жиров и добавок льняного семени у мужчин с раком простаты до хирургия: изучение влияния на гормональный фон, простатоспецифический антиген и гистопатологические особенности. Урология. 2001, 58 (1): 47-52.
Артикул Google ученый
Дания-Ванфрид В., Полашик Т.Дж., Джордж С.Л., Свитцер Б.Р., Мэдден Дж.Ф., Раффин М.Т., Снайдер Д.К., Овзар К., Харс В. Добавка из льняного семени (не ограничение диетических жиров) снижает скорость распространения рака простаты у мужчин. предоперационная. Биомаркеры эпидемиологии рака Пред. 2008, 17 (12): 3577-3587.
Артикул CAS Google ученый
Дания-Ванефрид В., Робертсон К.Н., Вальтер П.Дж., Полашик Т.Дж., Полсон Д.Ф., Фоллмер Р.Т.: пилотное исследование по изучению влияния низкожировой диеты с добавлением льняного семени на пролиферацию доброкачественного эпителия предстательной железы и простатоспецифического антигена. Урология. 2004, 63 (5): 900-904.
Артикул Google ученый
Nomura AM, Kolonel LN: Рак простаты: текущая перспектива. Epidemiol Rev.1991, 13: 200-227.
CAS PubMed Google ученый
Коннолли Дж. М., Коулман М., Роуз Д. П.: Влияние пищевых жирных кислот на рост клеток рака предстательной железы человека DU145 у бестимусных голых мышей. Nutr Cancer. 1997, 29 (2): 114-119.
CAS PubMed Статья Google ученый
Кармали Р.А., Райхель П., Коэн Л.А., Терано Т., Хираи А., Тамура Ю., Йошида С.: Влияние диетических жирных кислот омега-3 на трансплантируемую опухоль предстательной железы человека DU-145. Anticancer Res. 1987, 7 (6): 1173-1179.
CAS PubMed Google ученый
Роуз Д.П., Коэн Л.А.: Влияние диетического масла менхадена и ретинилацетата на рост клеток аденокарциномы предстательной железы человека DU 145, трансплантированных бестимусным голым мышам. Канцерогенез. 1988, 9 (4): 603-605.
CAS PubMed Статья Google ученый
Мори Т., Имаида К., Тамано С., Сано М., Такахаши С., Асамото М., Такешита М., Уэда Х., Шираи Т.: говяжий жир, но не перилла или кукурузное масло, способствует развитию канцерогенеза простаты и кишечника у крыс. 3,2′-диметил-4-аминобифенилом.Jpn J Cancer Res. 2001, 92 (10): 1026-1033.
CAS PubMed Статья Google ученый
du Toit PJ, van Aswegen CH, du Plessis DJ: Эффект незаменимых жирных кислот на рост и продукцию активатора плазминогена урокиназного типа в клетках простаты человека DU-145. Простагландины Leukot Essent Fatty Acids. 1996, 55 (3): 173-177.
CAS PubMed Статья Google ученый
Motaung E, Prinsloo SE, van Aswegen CH, du Toit PJ, Becker PJ, du Plessis DJ: Цитотоксичность комбинированных незаменимых жирных кислот на клеточной линии рака простаты человека. Простагландины Leukot Essent Fatty Acids. 1999, 61 (5): 331-337.
CAS PubMed Статья Google ученый
Гош Дж. Майерс CE: Арахидоновая кислота стимулирует рост клеток рака простаты: критическая роль 5-липоксигеназы. Biochem Biophys Res Commun.1997, 235 (2): 418-423.
CAS PubMed Статья Google ученый
Hughes-Fulford M, Chen Y, Tjandrawinata RR: Жирная кислота регулирует экспрессию генов и рост клеток рака простаты человека PC-3. Канцерогенез. 2001, 22 (5): 701-707.
CAS PubMed Статья Google ученый
Pandalai PK, Pilat MJ, Yamazaki K, Naik H, Pienta KJ: Влияние жирных кислот омега-3 и омега-6 на рост рака простаты in vitro.Anticancer Res. 1996, 16 (2): 815-820.
CAS PubMed Google ученый
Роуз Д.П., Коннолли Дж. М.: Влияние жирных кислот и ингибиторов синтеза эйкозаноидов на рост двух клеточных линий рака простаты человека. Простата. 1991, 18 (3): 243-254.
CAS PubMed Статья Google ученый
Chung BH, Mitchell SH, Zhang JS, Young CY: Эффекты докозагексаеновой кислоты и эйкозапентаеновой кислоты на андроген-опосредованный рост клеток и экспрессию генов в клетках рака простаты LNCaP.Канцерогенез. 2001, 22 (8): 1201-1206.
CAS PubMed Статья Google ученый
Нараянан Н.К., Нараянан Б.А., Редди Б.С.: Комбинация докозагексаеновой кислоты и целекоксиба предотвращает рост клеток рака простаты in vitro и связана с модуляцией ядерного фактора-каппаВ и рецепторов стероидных гормонов. Int J Oncol. 2005, 26 (3): 785-792.
CAS PubMed Google ученый
Нараянан Н.К., Нараянан Б.А., Босланд М., Кондон М.С., Нарги Д.: Докозагексаеновая кислота в сочетании с целекоксибом модулирует белки HSP70 и p53 в клетках рака простаты. Int J Cancer. 2006, 119 (7): 1586-1598.
CAS PubMed Статья Google ученый
Berquin IM, Min Y, Wu R, Wu J, Perry D, Cline JM, Thomas MJ, Thornburg T., Kulik G: Модуляция генетического риска рака простаты с помощью омега-3 и омега-6 жирных кислот.J Clin Invest. 2007, 117 (7): 1866-1875.
PubMed Central CAS PubMed Статья Google ученый
Келавкар UP, Hutzley J, Dhir R, Kim P, Allen KG, McHugh K: Рост и рецидив опухоли простаты можно модулировать с помощью соотношения омега-6: омега-3 в диете: модель бестимусного ксенотрансплантата мыши, имитирующая радикальная простатэктомия. Неоплазия. 2006, 8 (2): 112-124.
PubMed Central CAS PubMed Статья Google ученый
Кобаяши Н., Барнард Р.Дж., Хеннинг С.М., Элашофф Д., Редди С.Т., Коэн П., Леунг П., Хонг-Гонсалес Дж., Фридленд С.Дж.: Влияние изменения соотношения жирных кислот омега-6 / омега-3 в рационе на состав мембран рака простаты. циклооксигеназа-2 и простагландин E2. Clin Cancer Res. 2006, 12 (15): 4662-4670.
PubMed Central CAS PubMed Статья Google ученый
MacLean CH, Newberry SJ, Mojica WA, Khanna P, Issa AM, Suttorp MJ, Lim YW, Traina SB, Hilton L: Эффекты омега-3 жирных кислот на риск рака: систематический обзор.ДЖАМА. 2006, 295 (4): 403-415.
CAS PubMed Статья Google ученый
Ritch CR, Wan RL, Stephens LB, Taxy JB, Huo D, Gong EM, Zagaja GP, Brendler CB: Диетические жирные кислоты коррелируют со степенью биопсии и объемом рака простаты у мужчин Ямайки. J Urol. 2007, 177 (1): 97-101.
CAS PubMed Статья Google ученый
Norrish AE, Skeaff CM, Arribas GL, Sharpe SJ, Jackson RT: Риск рака простаты и потребление рыбьего жира: исследование случай-контроль на основе диетических биомаркеров.Br J Рак. 1999, 81 (7): 1238-1242.
PubMed Central CAS PubMed Статья Google ученый
Wallstrom P, Bjartell A, Gullberg B, Olsson H, Wirfalt E: проспективное исследование диетического жира и заболеваемости раком простаты (Мальмё, Швеция). Контроль причин рака. 2007, 18 (10): 1107-1121.
PubMed Статья Google ученый
Klein V, Chajes V, Germain E, Schulgen G, Pinault M, Malvy D, Lefrancq T, Fignon A, Le FO: Низкое содержание альфа-линоленовой кислоты в жировой ткани молочной железы связано с повышенным риском рак молочной железы.Eur J Cancer. 2000, 36 (3): 335-340.
CAS PubMed Статья Google ученый
Maillard V, Bougnoux P, Ferrari P, Jourdan ML, Pinault M, Lavillonniere F, Body G, Le FO, Chajes V: жирные кислоты N-3 и N-6 в жировой ткани груди и относительный риск рак груди в исследовании случай-контроль в Туре, Франция. Int J Cancer. 2002, 98 (1): 78-83.
CAS PubMed Статья Google ученый
Voorrips LE, Brants HA, Kardinaal AF, Hiddink GJ, Brandt van den PA, Goldbohm RA: Потребление конъюгированной линолевой кислоты, жира и других жирных кислот в отношении рака груди в постменопаузе: когортное исследование диеты и рака в Нидерландах. Am J Clin Nutr. 2002, 76 (4): 873-882.
CAS PubMed Google ученый
Камано К., Окуяма Х, Кониси Р., Нагасава Х: Влияние диеты с высоким содержанием линолеата и альфа-линолената на спонтанный онкогенез молочной железы у мышей.Anticancer Res. 1989, 9 (6): 1903-1908.
CAS PubMed Google ученый
Фриче К.Л., Джонстон П.В.: Влияние диетической альфа-линоленовой кислоты на рост, метастазирование, профиль жирных кислот и выработку простагландинов двух аденокарцином молочной железы мыши. J Nutr. 1990, 120 (12): 1601-1609.
CAS PubMed Google ученый
Chen J, Stavro PM, Thompson LU: диетическое льняное семя подавляет рост и метастазирование рака груди человека и подавляет экспрессию инсулиноподобного фактора роста и рецептора эпидермального фактора роста.Nutr Cancer. 2002, 43 (2): 187-192.
CAS PubMed Статья Google ученый
Power KA, Chen JM, Saarinen NM, Thompson LU: Изменения биомаркеров рецептора эстрогена и сигнальных путей фактора роста в опухолях MCF-7 после краткосрочного и длительного лечения соевым и льняным семенами. J Стероид Biochem Mol Biol. 2008,
Google ученый
Чен Дж., Пауэр К.А., Манн Дж., Ченг А., Томпсон Л.У .: Взаимодействие диетического льняного семени с тамоксифеном вызывало регрессию опухоли у бестимусных мышей с ксенотрансплантатами MCF-7 путем подавления экспрессии продуктов генов, связанных с эстрогеном, и путей передачи сигнала .Nutr Cancer. 2007, 58 (2): 162-170.
PubMed Статья Google ученый
Maillard V, Hoinard C, Arab K, Jourdan ML, Bougnoux P, Chajes V: Диетический бета-каротин подавляет канцерогенез молочной железы у крыс в зависимости от содержания в рационе альфа-линоленовой кислоты. Br J Nutr. 2006, 96 (1): 18-21.
PubMed Central CAS PubMed Статья Google ученый
Yu FL, Greenlaw R, Fang Q, Bender W, Yamaguchi K, Xue BH, Yu CC: Исследования химиопрофилактических возможностей растительных масел и ненасыщенных жирных кислот против канцерогенеза рака груди в начале. Eur J Cancer Пред. 2004, 13 (4): 239-248.
PubMed Статья Google ученый
Chajes V, Sattler W, Stranzl A, Kostner GM: Влияние жирных кислот n-3 на рост клеток рака груди человека in vitro: связь с пероксидами и витамином E.Лечение рака груди Res. 1995, 34 (3): 199-212.
CAS PubMed Статья Google ученый
Багга Д., Андерс К. Х., Ван Х. Дж., Гласпи Дж. А.: Соотношения длинноцепочечных полиненасыщенных жирных кислот n-3 к n-6 в жировой ткани груди у женщин с раком груди и без него. Nutr Cancer. 2002, 42 (2): 180-185.
CAS PubMed Статья Google ученый
Шеннон Дж., Кинг И.Б., Мошофски Р., Лампе Дж. В., Гао Д.Л., Рэй Р.М., Томас ДБ: Эритроцитарные жирные кислоты и риск рака груди: исследование случай-контроль в Шанхае, Китай. Am J Clin Nutr. 2007, 85 (4): 1090-1097.
CAS PubMed Google ученый
Stripp C, Overvad K, Christensen J, Thomsen BL, Olsen A, Moller S, Tjonneland A: Потребление рыбы положительно связано с уровнем заболеваемости раком груди. J Nutr. 2003, 133 (11): 3664-3669.
CAS PubMed Google ученый
Holmes MD, Colditz GA, Hunter DJ, Hankinson SE, Rosner B, Speizer FE, Willett WC: потребление мяса, рыбы и яиц и риск рака груди. Int J Cancer. 2003, 104 (2): 221-227.
CAS PubMed Статья Google ученый
Vatten LJ, Solvoll K, Loken EB: Частота потребления мяса и рыбы и риск рака груди в проспективном исследовании с участием 14 500 норвежских женщин.Int J Cancer. 1990, 46 (1): 12-15.
CAS PubMed Статья Google ученый
Хаббард Н.Е., Лим Д., Эриксон К.Л.: Изменение онкогенеза молочной железы мышей путем обогащения рациона жирными кислотами n-3 в рыбьем жире. Cancer Lett. 1998, 124 (1): 1-7.
CAS PubMed Статья Google ученый
Роуз Д.П., Коннолли Дж. М.: Влияние диетических жирных кислот омега-3 на рост рака груди человека и метастазы у мышей nude.J Natl Cancer Inst. 1993, 85 (21): 1743-1747.
CAS PubMed Статья Google ученый
Rose DP, Connolly JM, Rayburn J, Coleman M: Влияние диет, содержащих эйкозапентаеновую или докозагексаеновую кислоту, на рост и метастазирование клеток рака груди у голых мышей. J Natl Cancer Inst. 1995, 87 (8): 587-592.
CAS PubMed Статья Google ученый
Брейден Л.М., Кэрролл К.К .: Диетические полиненасыщенные жиры в связи с канцерогенезом молочной железы у крыс. Липиды. 1986, 21 (4): 285-288.
CAS PubMed Статья Google ученый
Jurkowski JJ, Cave WT: Диетические эффекты масла менхадена на рост и липидный состав мембран опухолей молочной железы крыс. J Natl Cancer Inst. 1985, 74 (5): 1145-1150.
CAS PubMed Google ученый
Jourdan ML, Maheo K, Barascu A, Goupille C, De Latour MP, Bougnoux P, Rio PG: Повышенный уровень белка BRCA1 в опухолях молочной железы у крыс, получавших морские жирные кислоты омега-3. Oncol Rep.2007, 17 (4): 713-719.
CAS PubMed Google ученый
Hardman WE, Avula CP, Fernandes G, Cameron IL: Трехпроцентный диетический концентрат рыбьего жира повысил эффективность доксорубицина против ксенотрансплантатов рака молочной железы MDA-MB 231. Clin Cancer Res.2001, 7 (7): 2041-2049.
CAS PubMed Google ученый
Shao Y, Pardini L, Pardini RS: Диетическое масло менхадена усиливает противоопухолевую активность митомицина C в отношении карциномы молочной железы человека MX-1. Липиды. 1995, 30 (11): 1035-1045.
CAS PubMed Статья Google ученый
Barascu A, Besson P, Le FO, Bougnoux P, Jourdan ML: CDK1-циклин B1 опосредует ингибирование пролиферации, индуцированной омега-3 жирными кислотами в клетках рака молочной железы MDA-MB-231.Int J Biochem Cell Biol. 2006, 38 (2): 196-208.
CAS PubMed Статья Google ученый
Chamras H, Ardashian A, Heber D, Glaspy JA: Модуляция жирными кислотами пролиферации, апоптоза и дифференцировки клеток рака молочной железы человека MCF-7. J Nutr Biochem. 2002, 13 (12): 711-716.
CAS PubMed Статья Google ученый
Menendez JA, Mehmi I, Verma VA, Teng PK, Lupu R: Фармакологическое ингибирование синтазы жирных кислот (FAS): новый терапевтический подход к химиопрофилактике рака груди благодаря его способности подавлять Her-2 / neu ( erbB-2) злокачественная трансформация, вызванная онкогеном.Mol Carcinog. 2004, 41 (3): 164-178.
CAS PubMed Статья Google ученый
Hunt DA, Lane HM, Zygmont ME, Dervan PA, Hennigar RA: стабильность MRNA и сверхэкспрессия синтазы жирных кислот в клеточных линиях рака молочной железы человека. Anticancer Res. 2007, 27 (1А): 27-34.
CAS PubMed Google ученый
Menendez JA, Vazquez-Martin A, Ropero S, Colomer R, Lupu R: HER2 (erbB-2) -нацеленные эффекты полиненасыщенной жирной кислоты омега-3, альфа-линоленовой кислоты (ALA; 18: 3n-3), в клетках рака груди: «жирные особенности» «средиземноморской диеты» как «коктейля против HER2».Clin Transl Oncol. 2006, 8 (11): 812-820.
CAS PubMed Статья Google ученый
Chajes V, Bougnoux P: Соотношение полиненасыщенных жирных кислот омега-6 / омега-3 и рак. World Rev Nutr Diet. 2003, 92: 133-151.
CAS PubMed Статья Google ученый
Dabrosin C, Chen J, Wang L, Thompson LU: Льняное семя подавляет метастазирование и снижает фактор роста эндотелия внеклеточных сосудов в ксенотрансплантатах рака груди человека.Cancer Lett. 2002, 185 (1): 31-37.
CAS PubMed Статья Google ученый
Tsuzuki T, Kawakami Y: Подавление ангиогенеза опухоли альфа-элеостеариновой кислотой, изомером линоленовой кислоты с конъюгированной триеновой системой, через рецептор гамма, активируемый пролифератором пероксисом. Канцерогенез. 2008, 29 (4): 797-806.
CAS PubMed Статья Google ученый
Кимура Y: Карповое масло или олеиновая кислота, но не линолевая или линоленовая кислота, подавляет рост опухоли и метастазирование у мышей с карциномой легких Льюиса. J Nutr. 2002, 132 (7): 2069-2075.
CAS PubMed Google ученый
Menendez JA, Vazquez-Martin A, Ropero S, Colomer R, Lupu R: HER2 (erbB-2) -направленные эффекты полиненасыщенной жирной кислоты омега-3, альфа-линоленовой кислоты (ALA; 18: 3n-3), в клетках рака груди: «жирные особенности» «средиземноморской диеты» как «коктейля против HER2».Clin Transl Oncol. 2006, 8 (11): 812-820.
CAS PubMed Статья Google ученый
Abou-el-Ela SH, Prasse KW, Farrell RL, Carroll RW, Wade AE, Bunce OR: Влияние D, L-2-дифторметилорнитина и индометацина на развитие опухоли молочной железы у крыс, получавших высокий n-3 и / или диеты с содержанием n-6 жиров. Cancer Res. 1989, 49 (6): 1434-1440.
CAS PubMed Google ученый
Роуз Д.П., Коннолли Дж. М.: Влияние жирных кислот и ингибиторов синтеза эйкозаноидов на рост линии клеток рака груди человека в культуре. Cancer Res. 1990, 50 (22): 7139-7144.
CAS PubMed Google ученый
Collett ED, Davidson LA, Fan YY, Lupton JR, Chapkin RS: n-6 и n-3 полиненасыщенные жирные кислоты по-разному модулируют онкогенную активацию Ras в колоноцитах. Am J Physiol Cell Physiol. 2001, 280 (5): C1066-C1075.
CAS PubMed Google ученый
Лю G, Bibus DM, Bode AM, Ma WY, Holman RT, Dong Z: жирные кислоты омега-3, но не омега-6, ингибируют активность AP-1 и трансформацию клеток в клетках JB6. Proc Natl Acad Sci USA. 2001, 98 (13): 7510-7515.
PubMed Central CAS PubMed Статья Google ученый
Bing RJ, Miyataka M, Rich KA, Hanson N, Wang X, Slosser HD, Shi SR: оксид азота, простаноиды, циклооксигеназа и ангиогенез при раке толстой кишки и молочной железы.Clin Cancer Res. 2001, 7 (11): 3385-3392.
CAS PubMed Google ученый
Коннолли Дж. М., Роуз Д. П.: Усиление ангиогенеза и роста трансфицированных 12-липоксигеназным геном клеток рака груди человека MCF-7 у бестимусных голых мышей. Cancer Lett. 1998, 132 (1-2): 107-112.
CAS PubMed Статья Google ученый
Форма DM, Auerbach R: PGE2 и ангиогенез.Proc Soc Exp Biol Med. 1983, 172 (2): 214-218.
CAS PubMed Статья Google ученый
McCarty MF: Рыбий жир может препятствовать ангиогенезу и инвазивности опухоли за счет подавления протеинкиназы C и модулирования продукции эйкозаноидов. Мед-гипотезы. 1996, 46 (2): 107-115.
CAS PubMed Статья Google ученый
Wen B, Deutsch E, Opolon P, Auperin A, Frascogna V, Connault E, Bourhis J: n-3 полиненасыщенные жирные кислоты уменьшают реакции слизистой оболочки / эпидермиса и усиливают противоопухолевый эффект ионизирующего излучения с ингибированием ангиогенеза опухоли .Br J Рак. 2003, 89 (6): 1102-1107.
PubMed Central CAS PubMed Статья Google ученый
Chiu LC, Wan JM: индукция апоптоза в клетках HL-60 эйкозапентаеновой кислотой (EPA) связана с подавлением экспрессии bcl-2. Cancer Lett. 1999, 145 (1-2): 17-27.
CAS PubMed Статья Google ученый
Нараянан Б.А., Нараянан Н.К., Редди Б.С.: Гены и факторы транскрипции, регулируемые докозагексаеновой кислотой, индуцируют апоптоз в клетках рака толстой кишки человека.Int J Oncol. 2001, 19 (6): 1255-1262.
CAS PubMed Google ученый
Шварц С.А., Эрнандес А., Марк Е.Б.: Роль белков NF-kappaB / IkappaB при раке: значение для новых стратегий лечения. Surg Oncol. 1999, 8 (3): 143-153.
CAS PubMed Статья Google ученый
Wang M, Liu YE, Ni J, Aygun B, Goldberg ID, Shi YE: Индукция дифференцировки молочных желез с помощью гена, происходящего из молочной железы, связанного с ингибитором роста, который взаимодействует с омега-3 жирной кислотой при ингибировании роста клетки рака груди.Cancer Res. 2000, 60 (22): 6482-6487.
CAS PubMed Google ученый
Li YC, Park MJ, Ye SK, Kim CW, Kim YN: Повышенные уровни богатых холестерином липидных рафтов в раковых клетках коррелируют с чувствительностью к апоптозу, индуцированной агентами, истощающими холестерин. Am J Pathol. 2006, 168 (4): 1107-1118.
PubMed Central CAS PubMed Статья Google ученый
Эль-Сохеми A, Archer MC: Регулирование синтеза мевалоната у мышей с нокаутом рецепторов липопротеинов низкой плотности, получавших n-3 или n-6 полиненасыщенные жирные кислоты. Липиды. 1999, 34 (10): 1037-1043.
CAS PubMed Статья Google ученый
Couet C, Delarue J, Ritz P, Antoine JM, Lamisse F: Влияние диетического рыбьего жира на массу жира и базальное окисление жира у здоровых взрослых. Int J Obes Relat Metab Disord. 1997, 21 (8): 637-643.
CAS PubMed Статья Google ученый
Jones PJ, Schoeller DA: Соотношение полиненасыщенных: насыщенных жиров в рационе влияет на использование энергетических субстратов в организме человека. Обмен веществ. 1988, 37 (2): 145-151.
CAS PubMed Статья Google ученый
Barre DE, Mizier-Barre KA, Griscti O, Hafez K: Высокие дозы льняного масла могут повлиять на контроль уровня глюкозы в сыворотке крови натощак у людей с диабетом 2 типа.J Oleo Sci. 2008, 57 (5): 269-273.
CAS PubMed Статья Google ученый
Klein-Platat C, Drai J, Oujaa M, Schlienger JL, Simon C: жирнокислотный состав плазмы связан с метаболическим синдромом и слабым воспалением у подростков с избыточным весом. Am J Clin Nutr. 2005, 82 (6): 1178-1184.
CAS PubMed Google ученый
Goh YK, Jumpsen JA, Ryan EA, Clandinin MT: Влияние омега-3 жирных кислот на содержание липидов плазмы, холестерина и липопротеинов жирных кислот у пациентов с NIDDM. Диабетология. 1997, 40 (1): 45-52.
CAS PubMed Статья Google ученый
McManus RM, Jumpson J, Finegood DT, Clandinin MT, Ryan EA: Сравнение эффектов n-3 жирных кислот из льняного масла и рыбьего жира при хорошо контролируемом диабете типа II.Уход за диабетом. 1996, 19 (5): 463-467.
CAS PubMed Статья Google ученый
Enriquez YR, Giri M, Rottiers R, Christophe A: Жирнокислотный состав фосфолипидов эритроцитов связан с уровнем инсулина, секрецией и резистентностью у страдающих ожирением диабетиков 2 типа, принимающих метформин. Clin Chim Acta. 2004, 346 (2): 145-152.
CAS PubMed Статья Google ученый
Javadi M, Geelen MJ, Lemmens AG, Lankhorst A, Schonewille JT, Terpstra AH, Beynen AC: влияние диетической линолевой и альфа-линоленовой кислоты на состав тела и активность ключевых ферментов липогенеза печени и окисления жирных кислот у мышей . J Anim Physiol Anim Nutr (Берл). 2007, 91 (1-2): 11-18.
CAS Статья Google ученый
Гафорунисса, Ибрагим А., Натараджан С. Замена диетической линолевой кислоты альфа-линоленовой кислотой улучшает чувствительность к инсулину у крыс, получавших сахарозу.Biochim Biophys Acta. 2005, 1733 (1): 67-75.
CAS PubMed Статья Google ученый
Chicco AG, D’Alessandro ME, Hein GJ, Oliva ME, Lombardo YB: Диетические семена чиа (Salvia hispanica L.), богатые альфа-линоленовой кислотой, улучшают ожирение и нормализуют гипертриацилглицеролемию и инсулинорезистентность при дислипеозе. Br J Nutr. 2008, 1-10.
Google ученый
Mustad VA, Demichele S, Huang YS, Mika A, Lubbers N, Berthiaume N, Polakowski J, Zinker B: Дифференциальные эффекты n-3 полиненасыщенных жирных кислот на метаболический контроль и сосудистую реактивность у мышей ob / ob с диабетом 2 типа. Обмен веществ. 2006, 55 (10): 1365-1374.
CAS PubMed Статья Google ученый
Чо HP, Накамура М.Т., Кларк С.Д.: Клонирование, экспрессия и регуляция питания дельта-6-десатуразы млекопитающих.J Biol Chem. 1999, 274 (1): 471-477.
CAS PubMed Статья Google ученый
Browning LM, Krebs JD, Moore CS, Mishra GD, O’Connell MA, Jebb SA: Влияние добавок длинноцепочечных полиненасыщенных жирных кислот n-3 на воспаление, чувствительность к инсулину и риск сердечно-сосудистых заболеваний в группе женщины с избыточным весом с воспалительным фенотипом. Диабет ожирения Metab. 2007, 9 (1): 70-80.
CAS PubMed Статья Google ученый
Кусуноки М., Цуцуми К., Накаяма М., Курокава Т., Накамура Т., Огава Х., Фукудзава И., Моришита М., Коиде Т., Мията Т.: взаимосвязь между сывороточными концентрациями насыщенных жирных кислот и ненасыщенных жирных кислот и индексом инсулинорезистентности модели гомеостаза у японских пациентов с сахарным диабетом 2 типа. J Med Invest. 2007, 54 (3-4): 243-247.
PubMed Статья Google ученый
Мори Й., Муракава Й., Катох С., Хата С., Йокояма Дж., Таджима Н., Икеда Й, Нобуката Х., Ишикава Т., Шибутани Й .: Влияние высокоочищенного этилового эфира эйкозапентаеновой кислоты на инсулинорезистентность в Оцуке. Лонг-Эванс Токусима Жировая крыса, модель спонтанного инсулиннезависимого сахарного диабета.Обмен веществ. 1997, 46 (12): 1458-1464.
CAS PubMed Статья Google ученый
Мори Ю., Муракава Ю., Йокояма Дж., Таджима Н., Икеда Ю., Нобуката Н., Исикава Т., Сибутани Ю.: Влияние высокоочищенного этилового эфира эйкозапентаеновой кислоты на инсулинорезистентность и гипертензию у чувствительных к соли крыс Даля. Обмен веществ. 1999, 48 (9): 1089-1095.
CAS PubMed Статья Google ученый
Нобуката Х., Исикава Т., Обата М., Шибутани Ю.: Длительное введение высокоочищенного этилового эфира эйкозапентаеновой кислоты предотвращает диабет и нарушения свертывания крови у самцов крыс WBN / Kob. Обмен веществ. 2000, 49 (7): 912-919.
CAS PubMed Статья Google ученый
Flachs P, Mohamed-Ali V, Horakova O, Rossmeisl M, Hosseinzadeh-Attar MJ, Hensler M, Ruzickova J, Kopecky J: Полиненасыщенные жирные кислоты морского происхождения индуцируют адипонектин у мышей, получавших диету с высоким содержанием жиров. .Диабетология. 2006, 49 (2): 394-397.
CAS PubMed Статья Google ученый
Икемото С., Такахаши М., Цунода Н., Маруяма К., Итакура Х, Эзаки О.: гипергликемия и ожирение у мышей, вызванные диетой с высоким содержанием жиров: различные эффекты диетических масел. Обмен веществ. 1996, 45 (12): 1539-1546.
CAS PubMed Статья Google ученый
Pighin D, Karabatas L, Rossi A, Chicco A, Basabe JC, Lombardo YB: Рыбий жир влияет на накопление жира в поджелудочной железе, активность комплекса пируватдегидрогеназы и секрецию инсулина у крыс, получавших диету, богатую сахарозой.J Nutr. 2003, 133 (12): 4095-4101.
CAS PubMed Google ученый
Сориа А., Чикко А., Евгения Д.М., Росси А., Ломбардо Ю.Б .: Диетический рыбий жир, обратное ожирение эпидидимальной ткани, гипертрофия клеток и инсулинорезистентность у дислипемической модели крысы, получавшей сахарозу, маленькая звездочка, закрашена. J Nutr Biochem. 2002, 13 (4): 209-218.
CAS PubMed Статья Google ученый
Peyron-Caso E, Fluteau-Nadler S, Kabir M, Guerre-Millo M, Quignard-Boulange A, Slama G, Rizkalla SW: Регулирование транспорта глюкозы и транспортера 4 (GLUT-4) в мышцах и адипоцитах при кормлении сахарозой крысы: действие поли- и мононенасыщенных жирных кислот N-3. Horm Metab Res. 2002, 34 (7): 360-366.
CAS PubMed Статья Google ученый
Suresh Y, Das UN: Длинноцепочечные полиненасыщенные жирные кислоты и химически индуцированный сахарный диабет.Влияние жирных кислот омега-3. Питание. 2003, 19 (3): 213-228.
CAS PubMed Статья Google ученый
Андерсен Г., Харнак К., Эрберсдоблер Х. Ф., Сомоза В. Диетическая эйкозапентаеновая кислота и докозагексаеновая кислота более эффективны, чем альфа-линоленовая кислота в улучшении чувствительности к инсулину у крыс. Энн Нутр Метаб. 2008, 52 (3): 250-256.
CAS PubMed Статья Google ученый
Nyby MD, Matsumoto K, Yamamoto K, Abedi K, Eslami P, Hernandez G, Smutko V, Berger ME, Tuck ML: диетический рыбий жир предотвращает сосудистую дисфункцию и окислительный стресс у крыс с гиперинсулинемией. Am J Hypertens. 2005, 18 (2 Pt 1): 213-219.
CAS PubMed Статья Google ученый
Mustad VA, Demichele S, Huang YS, Mika A, Lubbers N, Berthiaume N, Polakowski J, Zinker B: Дифференциальные эффекты n-3 полиненасыщенных жирных кислот на метаболический контроль и реактивность сосудов у диабетиков 2 типа. ob / ob мышь.Обмен веществ. 2006, 55 (10): 1365-1374.
CAS PubMed Статья Google ученый
Luo J, Rizkalla SW, Boillot J, Alamowitch C, Chaib H, Bruzzo F, Desplanque N, Dalix AM, Durand G, Slama G: Диетические (n-3) полиненасыщенные жирные кислоты улучшают действие инсулина адипоцитов и метаболизм глюкозы у инсулинорезистентных крыс: отношение к мембранным жирным кислотам. J Nutr. 1996, 126 (8): 1951-1958.
CAS PubMed Google ученый
Rizkalla SW, Alamowitch C, Luo J, Bruzzo F, Boillot A, Chevalier A, Slama G: Влияние диетического рыбьего жира на действие инсулина в жировых клетках контрольных и инсулинозависимых крыс. Ann N Y Acad Sci. 1993, 683: 213-217.
CAS PubMed Статья Google ученый
Бейкер PW, Гиббонс GF: Влияние диетического рыбьего жира на чувствительность метаболизма липидов в печени к регуляции инсулином. J Lipid Res. 2000, 41 (5): 719-726.
CAS PubMed Google ученый
Das UN: Нарушение активности дельта6- и дельта5-десатураз может быть фактором, предрасполагающим к развитию синдрома инсулинорезистентности. Простагландины Leukot Essent Fatty Acids. 2005, 72 (5): 343-350.
CAS PubMed Статья Google ученый
Morigi M, Angioletti S, Imberti B, Donadelli R, Micheletti G, Figliuzzi M, Remuzzi A, Zoja C, Remuzzi G: лейкоцитарно-эндотелиальное взаимодействие усиливается за счет высоких концентраций глюкозы и гипергликемии в NF-kB -зависимая мода.J Clin Invest. 1998, 101 (9): 1905-1915.
PubMed Central CAS PubMed Статья Google ученый
Kramer D, Shapiro R, Adler A, Bush E, Rondinone CM: инсулино-сенсибилизирующий эффект розиглитазона (BRL-49653) за счет регуляции переносчиков глюкозы в мышцах и жире крыс Zucker. Обмен веществ. 2001, 50 (11): 1294-1300.
CAS PubMed Статья Google ученый
Gross B, Staels B: агонисты PPAR: мультимодальные препараты для лечения диабета 2 типа. Лучшая практика Res Clin Endocrinol Metab. 2007, 21 (4): 687-710.
CAS PubMed Статья Google ученый
Ямаути Т., Камон Дж., Ваки Х, Тераучи Ю., Кубота Н., Хара К., Мори Й, Иде Т., Мураками К.: Гормон адипонектин, полученный из жиров, обращает вспять резистентность к инсулину, связанную как с липоатрофией, так и с ожирением. Nat Med. 2001, 7 (8): 941-946.
CAS PubMed Статья Google ученый
Brady LM, Lovegrove SS, Lesauvage SV, Gower BA, Minihane AM, Williams CM, Lovegrove JA: Повышенное содержание полиненасыщенных жирных кислот n-6 не ослабляет влияние длинноцепочечных полиненасыщенных жирных кислот n-3 на Чувствительность к инсулину или снижение уровня триацилглицерина у индийских азиатов. Am J Clin Nutr. 2004, 79 (6): 983-991.
CAS PubMed Google ученый
Lovegrove JA, Lovegrove SS, Lesauvage SV, Brady LM, Saini N, Minihane AM, Williams CM: умеренный прием добавок с рыбьим жиром меняет статус полиненасыщенных жирных кислот с низким содержанием тромбоцитов, длинноцепочечных n-3 и снижает концентрацию триацилглицерина в плазме в Британской Индии. -Азиатки. Am J Clin Nutr. 2004, 79 (6): 974-982.
CAS PubMed Google ученый
Minihane AM, Khan S, Leigh-Firbank EC, Talmud P, Wright JW, Murphy MC, Griffin BA, Williams CM: полиморфизм ApoE и добавление рыбьего жира у субъектов с фенотипом атерогенных липопротеинов.Артериосклер Thromb Vasc Biol. 2000, 20 (8): 1990–1997.
CAS PubMed Статья Google ученый
Псота Т.Л., Гебауэр СК, Крис-Этертон П: Диетическое потребление омега-3 жирных кислот и риск сердечно-сосудистых заболеваний. Am J Cardiol. 2006, 98 (4A): 3i-18i.
CAS PubMed Статья Google ученый
Рош HM, Гибни MJ: Влияние длинноцепочечных n-3 полиненасыщенных жирных кислот на метаболизм триацилглицерина натощак и после приема пищи.Am J Clin Nutr. 2000, 71 (1 доп.): 232С-237С.
CAS PubMed Google ученый
Сингх Р.Б., Ниаз М.А., Шарма Дж. П., Кумар Р., Растоги В., Мошири М: рандомизированное, двойное слепое, плацебо-контролируемое испытание рыбьего жира и горчичного масла у пациентов с подозрением на острый инфаркт миокарда: Индия эксперимент выживаемости при инфаркте — 4. Кардиоваск Лекарства Ther. 1997, 11 (3): 485-491.
CAS PubMed Статья Google ученый
Natvig H, Borchgrevink CF, Dedichen J, Owren PA, Schiotz EH, Westlund K: контролируемое испытание влияния линоленовой кислоты на заболеваемость ишемической болезнью сердца. Норвежский эксперимент с растительным маслом 1965–66 гг. Scand J Clin Lab Invest Suppl. 1968, 105: 1-20.
CAS PubMed Google ученый
Bemelmans WJ, Broer J, Feskens EJ, Smit AJ, Muskiet FA, Lefrandt JD, Bom VJ, May JF, Meyboom-de JB: Влияние повышенного потребления альфа-линоленовой кислоты и групповое обучение питанию на факторы риска сердечно-сосудистых заболеваний: исследование средиземноморского обогащенного альфа-линоленовой кислоты в Гронингене (MARGARIN).Am J Clin Nutr. 2002, 75 (2): 221-227.
CAS PubMed Google ученый
Сингх Р.Б., Дубнов Г., Ниаз М.А., Гош С., Сингх Р., Растоги С.С., Манор О, Пелла Д., Берри Е.М.: Влияние индо-средиземноморской диеты на прогрессирование ишемической болезни сердца у пациентов с высоким риском (Исследование сердца индо-средиземноморской диеты): рандомизированное слепое исследование. Ланцет. 2002, 360 (9344): 1455-1461.
PubMed Статья Google ученый
de Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N: Средиземноморская диета, традиционные факторы риска и частота сердечно-сосудистых осложнений после инфаркта миокарда: окончательный отчет Lyon Diet Heart Study. Тираж. 1999, 99 (6): 779-785.
CAS PubMed Статья Google ученый
Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, Jordan HS, Lau J: n-3 жирные кислоты из рыбы или добавок рыбьего жира, но не альфа-линоленовая кислота, преимущества исходов сердечно-сосудистых заболеваний в исследованиях первичной и вторичной профилактики: систематический обзор.Am J Clin Nutr. 2006, 84 (1): 5-17.
CAS PubMed Google ученый
Белый C: Предполагаемое мошенничество с исследованиями: трудности установления истины. BMJ. 2005, 331 (7511): 281-288.
PubMed Central PubMed Статья Google ученый
Wendland E, Farmer A, Glasziou P, Neil A: Влияние альфа-линоленовой кислоты на маркеры сердечно-сосудистого риска: систематический обзор.Сердце. 2006, 92 (2): 166-169.
PubMed Central CAS PubMed Статья Google ученый
Брауэр И.А., Катан М.Б., Зок П.Л .: Диетическая альфа-линоленовая кислота связана со сниженным риском смертельной ишемической болезни сердца, но с повышенным риском рака простаты: метаанализ. J Nutr. 2004, 134 (4): 919-922.
CAS PubMed Google ученый
Djousse L, Pankow JS, Eckfeldt JH, Folsom AR, Hopkins PN, Province MA, Hong Y, Ellison RC: Связь между диетической линоленовой кислотой и болезнью коронарной артерии в исследовании семейного сердца Национального института сердца, легких и крови. Am J Clin Nutr. 2001, 74 (5): 612-619.
CAS PubMed Google ученый
Djousse L, Hunt SC, Arnett DK, Province MA, Eckfeldt JH, Ellison RC: Диетическая линоленовая кислота обратно пропорциональна триацилглицерину плазмы: исследование семейного сердца Национального института сердца, легких и крови.Am J Clin Nutr. 2003, 78 (6): 1098-1102.
CAS PubMed Google ученый
Djousse L, Folsom AR, Province MA, Hunt SC, Ellison RC: Диетическая линоленовая кислота и атеросклероз сонных артерий: исследование семейного сердца Национального института сердца, легких и крови. Am J Clin Nutr. 2003, 77 (4): 819-825.
CAS PubMed Google ученый
Djousse L, Arnett DK, Pankow JS, Hopkins PN, Province MA, Ellison RC: диетическая линоленовая кислота связана с более низкой распространенностью гипертонии в исследовании сердца семьи NHLBI.Гипертония. 2005, 45 (3): 368-373.
CAS PubMed Статья Google ученый
Ascherio A, Rimm EB, Giovannucci EL, Spiegelman D, Stampfer M, Willett WC: Диетический жир и риск ишемической болезни сердца у мужчин: когортное последующее исследование в Соединенных Штатах. BMJ. 1996, 313 (7049): 84-90.
PubMed Central CAS PubMed Статья Google ученый
Campos H, Baylin A, Willett WC: Альфа-линоленовая кислота и риск нефатального острого инфаркта миокарда. Тираж. 2008, 118 (4): 339-345.
PubMed Central CAS PubMed Статья Google ученый
Mozaffarian D, Ascherio A, Hu FB, Stampfer MJ, Willett WC, Siscovick DS, Rimm EB: Взаимодействие между различными полиненасыщенными жирными кислотами и риском ишемической болезни сердца у мужчин. Тираж. 2005, 111 (2): 157-164.
PubMed Central CAS PubMed Статья Google ученый
Саймон Дж. А., Фонг Дж., Бернерт Дж. Т., Браунер В. С.: Сывороточные жирные кислоты и риск инсульта. Инсульт. 1995, 26 (5): 778-782.
CAS PubMed Статья Google ученый
Hu FB, Stampfer MJ, Manson JE, Rimm EB, Wolk A, Colditz GA, Hennekens CH, Willett WC: Диетическое потребление альфа-линоленовой кислоты и риск смертельной ишемической болезни сердца у женщин.Am J Clin Nutr. 1999, 69 (5): 890-897.
CAS PubMed Google ученый
Guallar E, Aro A, Jimenez FJ, Martin-Moreno JM, Salminen I, van’t VP, Kardinaal AF, Gomez-Aracena J, Martin BC: жирные кислоты омега-3 в жировой ткани и риск инфаркт миокарда: исследование EURAMIC. Артериосклер Thromb Vasc Biol. 1999, 19 (4): 1111-1118.
CAS PubMed Статья Google ученый
Sinclair AJ, ttar-Bashi NM, Li D: Какова роль альфа-линоленовой кислоты для млекопитающих ?. Липиды. 2002, 37 (12): 1113-1123.
CAS PubMed Статья Google ученый
Балк Е.М., Лихтенштейн А.Х., Чанг М., Купельник Б., Чу П., Лау Дж .: Влияние омега-3 жирных кислот на сывороточные маркеры риска сердечно-сосудистых заболеваний: систематический обзор. Атеросклероз. 2006, 189 (1): 19-30.
CAS PubMed Статья Google ученый
Burr ML, shfield-Watt PA, Dunstan FD, Fehily AM, Breay P, Ashton T., Zotos PC, Haboubi NA, Elwood PC: отсутствие пользы диетических рекомендаций для мужчин со стенокардией: результаты контролируемого исследования. Eur J Clin Nutr. 2003, 57 (2): 193-200.
CAS PubMed Статья Google ученый
ДеФилиппис А.П., Сперлинг Л.С.: Понимание омега-3. Am Heart J. 2006, 151 (3): 564-570.
CAS PubMed Статья Google ученый
Манциорис Э., Джеймс М.Дж., Гибсон Р.А., Клеланд Л.Г.: Замещение диеты растительным маслом, богатым альфа-линоленовой кислотой, увеличивает концентрацию эйкозапентаеновой кислоты в тканях. Am J Clin Nutr. 1994, 59 (6): 1304-1309.
CAS PubMed Google ученый
Панг Д., Имман-Фаринелли М.А., Вонг Т., Барнс Р., Кингхэм К.М.: Замена линолевой кислоты альфа-линоленовой кислотой не изменяет липиды крови у мужчин с нормолипидемией.Br J Nutr. 1998, 80 (2): 163-167.
CAS PubMed Google ученый
МакЛеннан П.Л., Даллимор Дж.А.: диетическое масло канолы изменяет жирные кислоты миокарда и подавляет сердечную аритмию у крыс. J Nutr. 1995, 125 (4): 1003-1009.
CAS PubMed Google ученый
Nestel PJ, Pomeroy SE, Sasahara T, Yamashita T, Liang YL, Dart AM, Jennings GL, Abbey M, Cameron JD: Артериальная податливость у субъектов с ожирением улучшается с помощью диетической растительной жирной кислоты n-3 из льняного семени. масло, несмотря на повышенную окисляемость ЛПНП.Артериосклер Thromb Vasc Biol. 1997, 17 (6): 1163-1170.
CAS PubMed Статья Google ученый
Раллидис Л.С., Пашос Г., Лиакос Г.К., Велиссариду А.Х., Анастасиадис Г., Зампелас А. Диетическая альфа-линоленовая кислота снижает уровень С-реактивного белка, сывороточного амилоида А и интерлейкина-6 у пациентов с дислипидемией. Атеросклероз. 2003, 167 (2): 237-242.
CAS PubMed Статья Google ученый
Knapp HR: Диетические жирные кислоты при тромбозе и гемостазе человека. Am J Clin Nutr. 1997, 65 (5 доп.): 1687S-1698S.
CAS PubMed Google ученый
Harris WS: n-3 жирные кислоты и липопротеины сыворотки: исследования на людях. Am J Clin Nutr. 1997, 65 (5 доп.): 1645S-1654S.
CAS PubMed Google ученый
Le Jossic-Corcos C, Gonthier C, Zaghini I, Logette E, Shechter I, Bournot P: Экспрессия фарнезилдифосфатсинтазы в печени подавляется полиненасыщенными жирными кислотами.Biochem J. 2005, 385 (Pt 3): 787-794.
PubMed Central CAS PubMed Статья Google ученый
Nestel P, Shige H, Pomeroy S, Cehun M, Abbey M, Raederstorff D: n-3 жирные кислоты эйкозапентаеновая кислота и докозагексаеновая кислота повышают системную артериальную эластичность у людей. Am J Clin Nutr. 2002, 76 (2): 326-330.
CAS PubMed Google ученый
Morris MC, Sacks F, Rosner B: Понижает ли рыбий жир кровяное давление? Метаанализ контролируемых исследований. Тираж. 1993, 88 (2): 523-533.
CAS PubMed Статья Google ученый
Мори Т.А., Уоттс Г.Ф., Берк В., Хилме Е, Пудди И.Б., Бейлин Л.Дж.: Дифференциальные эффекты эйкозапентаеновой кислоты и докозагексаеновой кислоты на сосудистую реактивность микроциркуляции предплечья у мужчин с гиперлипидемией и избыточным весом. Тираж.2000, 102 (11): 1264-1269.
CAS PubMed Статья Google ученый
Dabadie H, Motta C, Peuchant E, LeRuyet P, Mendy F: Вариации суточного потребления миристиновой и альфа-линоленовой кислот в положении sn-2 изменяют липидный профиль и текучесть мембран эритроцитов. Br J Nutr. 2006, 96 (2): 283-289.
CAS PubMed Статья Google ученый
Fuhrmann H, Miles EA, West AL, Calder PC: Мембранные жирные кислоты, окислительный взрыв и фагоцитоз после обогащения моноцитов / макрофагов P388D1 незаменимыми 18-углеродными жирными кислотами. Энн Нутр Метаб. 2007, 51 (2): 155-162.
CAS PubMed Статья Google ученый
Gueck T, Seidel A, Fuhrmann H: Влияние незаменимых жирных кислот на медиаторы тучных клеток в культуре. Простагландины Leukot Essent Fatty Acids.2003, 68 (5): 317-322.
CAS PubMed Статья Google ученый
Жоардар А., Дас С. Влияние жирных кислот, выделенных из пищевых масел, таких как горчица, льняное семя или кокос, на созревание астроцитов. Cell Mol Neurobiol. 2007, 27 (8): 973-983.
CAS PubMed Статья Google ученый
Burr G: Значение незаменимых жирных кислот.Труды Федерации. 1942, 224-233.
Google ученый
Fu Z, Sinclair AJ: Новый путь метаболизма альфа-линоленовой кислоты у морских свинок. Pediatr Res. 2000, 47 (3): 414-417.
CAS PubMed Статья Google ученый
Bowen RA, Clandinin MT: Диета с высоким содержанием 18: 3n-3 увеличивает содержание 18: 3n-3, но не 22: 6n-3, во всем теле, головном мозге, коже, жировых подушках придатка яичка и мышцах. детенышей крыс-сосунков.Липиды. 2000, 35 (4): 389-394.
CAS PubMed Статья Google ученый
Rokkones T: диетический фактор, необходимый для роста волос у крыс. Int Z Vitaminforsch Beih. 1953, 25 (1): 86-98.
CAS PubMed Google ученый
Файнс Р.Н., Синклер А.Дж., Кроуфорд М.А.: Исследования основных жирных кислот у приматов, потребности в линоленовой кислоте капуцинов.J Med Primatol. 1973, 2 (3): 155-169.
CAS PubMed Google ученый
Обата Т., Нагакура Т., Масаки Т., Маекава К., Ямасита К.: Эйкозапентаеновая кислота ингибирует образование простагландина D2 путем ингибирования циклооксигеназы-2 в культивируемых тучных клетках человека. Clin Exp Allergy. 1999, 29 (8): 1129-1135.
CAS PubMed Статья Google ученый
Cohen SL, Ward WE: льняное масло и развитие костей у растущих самцов и самок мышей. J. Toxicol Environ Health A. 2005, 68 (21): 1861-1870.
CAS PubMed Статья Google ученый
Gousset-Dupont A, Robert V, Grynberg A, Lacour B, Tardivel S: влияние n-3 PUFA на активность и экспрессию eNOS в клетках Ea hy 926. Простагландины Leukot Essent Fatty Acids. 2007, 76 (3): 131-139.
CAS PubMed Статья Google ученый
Griel AE, Kris-Etherton PM, Hilpert KF, Zhao G, West SG, Corwin RL: увеличение количества n-3 жирных кислот в рационе снижает уровень маркера резорбции костей у людей. Нутр Дж. 2007, 6: 2-10.
PubMed Central PubMed Статья CAS Google ученый
Шен С.Л., Петерсон Дж., Татум О.Л., Данн Д.М.: Влияние длинноцепочечных полиненасыщенных жирных кислот n-3 на медиаторы воспаления во время остеобластогенеза. J Med Food. 2008, 11 (1): 105-110.
CAS PubMed Статья Google ученый
Вайс Л.А., Барретт-Коннор Э., фон MD: Соотношение жирных кислот n-6 к n-3 и минеральная плотность костей у пожилых людей: исследование Ранчо Бернардо. Am J Clin Nutr. 2005, 81 (4): 934-938.
CAS PubMed Google ученый
Salvati S, Natali F, Attorri L, Raggi C, Di BA, Sanchez M: Стимуляция экспрессии гена протеолипидного белка миелина с помощью эйкозапентаеновой кислоты в клетках глиомы C6.Neurochem Int. 2004, 44 (5): 331-338.
CAS PubMed Статья Google ученый
Коломер Р., Морено-Ногейра Дж. М., Гарсия-Луна П. П., Гарсия-Перис П., Гарсия-де-Лоренцо А., Сарасага А., Кеседо Л., дель Л. Дж., Усан Л., Казимиро К.: N-3 жирные кислоты, рак и кахексия: систематический обзор литературы. Br J Nutr. 2007, 97 (5): 823-831.
CAS PubMed Статья Google ученый
Тисдейл MJ: Раковая кахексия. Langenbecks Arch Surg. 2004, 389 (4): 299-305.
PubMed Статья Google ученый
Тисдейл MJ: Путь убиквитин-протеасома как терапевтическая мишень для мышечного истощения. J Поддержка Oncol. 2005, 3 (3): 209-217.
CAS PubMed Google ученый
Джусто Н.М., Паскуар С.Дж., Сальвадор Г.А., Кастаньет П.И., Роке М.Э., Илинчета де Боскеро М.Г.: Липидный метаболизм в наружных сегментах стержня сетчатки позвоночных.Prog Lipid Res. 2000, 39 (4): 315-391.
CAS PubMed Статья Google ученый
Hulbert AJ, Rana T, Couture P: Ацильный состав фосфолипидов млекопитающих: аллометрический анализ. Comp Biochem Physiol B Biochem Mol Biol. 2002, 132 (3): 515-527.
CAS PubMed Статья Google ученый
Stillwell W, Wassall SR: Докозагексаеновая кислота: мембранные свойства уникальной жирной кислоты.Chem Phys Lipids. 2003, 126 (1): 1-27.
CAS PubMed Статья Google ученый
Ehringer W, Belcher D, Wassall SR, Stillwell W: Сравнение эффектов линоленовой (18: 3 омега-3) и докозагексаеновой (22: 6 омега-3) кислот на фосфолипидные бислои. Chem Phys Lipids. 1990, 54 (2): 79-88.
CAS PubMed Статья Google ученый
Hashimoto M, Hossain S, Yamasaki H, Yazawa K, Masumura S: Влияние эйкозапентаеновой кислоты и докозагексаеновой кислоты на текучесть плазматической мембраны эндотелиальных клеток аорты. Липиды. 1999, 34 (12): 1297-1304.
CAS PubMed Статья Google ученый
Hulbert AJ, Else PL: Мембраны как возможные кардиостимуляторы метаболизма. J Theor Biol. 1999, 199 (3): 257-274.
CAS PubMed Статья Google ученый
Hulbert AJ, Else PL: Механизмы, лежащие в основе стоимости жизни животных. Annu Rev Physiol. 2000, 62: 207-235.
CAS PubMed Статья Google ученый
Hulbert AJ: Жизнь, смерть и мембранные бислои. J Exp Biol. 2003, 206 (Pt 14): 2303-2311.
CAS PubMed Статья Google ученый
Pike LJ: Липидные рафты: наведение порядка в хаос.J Lipid Res. 2003, 44 (4): 655-667.
CAS PubMed Статья Google ученый
Brown DA, Лондон E: Структура и функция мембранных рафтов, богатых сфинголипидами и холестерином. J Biol Chem. 2000, 275 (23): 17221-17224.
CAS PubMed Статья Google ученый
Хэнкок Дж. Ф .: Липидные рафты: спорны только с упрощенной точки зрения.Nat Rev Mol Cell Biol. 2006, 7 (6): 456-462.
PubMed Central CAS PubMed Статья Google ученый
Партон Р.Г., Ханзал-Байер М., Хэнкок Дж. Ф.: Биогенез кавеол: структурная модель для индуцированного кавеолином образования домена. J Cell Sci. 2006, 119 (Pt 5): 787-796.
CAS PubMed Статья Google ученый
Murata M, Peranen J, Schreiner R, Wieland F, Kurzchalia TV, Simons K: VIP21 / кавеолин представляет собой холестерин-связывающий белок.Proc Natl Acad Sci USA. 1995, 92 (22): 10339-10343.
PubMed Central CAS PubMed Статья Google ученый
млн лет DW: Липидные медиаторы в мембранных рафтах являются важными детерминантами здоровья и болезней человека. Appl Physiol Nutr Metab. 2007, 32 (3): 341-350.
CAS PubMed Статья Google ученый
Cui J, Rohr LR, Swanson G, Speights VO, Maxwell T, Brothman AR: Гиперметилирование промотора гена кавеолина-1 при раке простаты.Простата. 2001, 46 (3): 249-256.
CAS PubMed Статья Google ученый
Engelman JA, Zhang XL, Lisanti MP: Гены, кодирующие человеческий кавеолин-1 и -2, локализованы совместно с локусом D7S522 (7q31.1), известным хрупким сайтом (FRA7G), который часто удаляется в человеческий рак. FEBS Lett. 1998, 436 (3): 403-410.
CAS PubMed Статья Google ученый
Энгельман Дж. А., Чжан XL, Лисанти М. П.: Последовательность и подробная организация генов кавеолина-1 и -2 человека, расположенных рядом с локусом D7S522 (7q31.1). Метилирование CpG-островка в 5′-промоторной области гена кавеолина-1 в клеточных линиях рака молочной железы человека. FEBS Lett. 1999, 448 (2-3): 221-230.
CAS PubMed Статья Google ученый
Cohen AW, Razani B, Wang XB, Combs TP, Williams TM, Scherer PE, Lisanti MP: Мыши с дефицитом Caveolin-1 демонстрируют инсулинорезистентность и дефектную экспрессию белка рецептора инсулина в жировой ткани.Am J Physiol Cell Physiol. 2003, 285 (1): C222-C235.
CAS PubMed Статья Google ученый
Хан AH, Pessin JE: Регулирование инсулином захвата глюкозы: сложное взаимодействие внутриклеточных сигнальных путей. Диабетология. 2002, 45 (11): 1475-1483.
CAS PubMed Статья Google ученый
Ямамото М., Тоя Ю., Швенке С., Лисанти М.П., Майерс М.Г., Исикава Ю.: Кавеолин является активатором передачи сигналов рецептора инсулина.J Biol Chem. 1998, 273 (41): 26962-26968.
CAS PubMed Статья Google ученый
Густавссон Дж., Парпал С., Карлссон М., Рамзинг С., Торн Х., Борг М., Линдрот М., Петерсон К. Х., Магнуссон К. Е., Стральфорс П. Локализация рецептора инсулина в кавеолах плазматической мембраны адипоцитов. FASEB J. 1999, 13 (14): 1961-1971.
CAS PubMed Google ученый
Чанг В.Дж., Ин Й.С., Ротберг К.Г., Хупер Н.М., Тернер А.Дж., Гамблиель Х.А., Де Г.Дж., Мамби С.М., Гилман А.Г., Андерсон Р.Г.: Очистка и характеристика кавеол гладкомышечных клеток. J Cell Biol. 1994, 126 (1): 127-138.
CAS PubMed Статья Google ученый
Kiss AL, Geuze HJ: Кавеолы могут быть альтернативными эндоцитотическими структурами в вызванных макрофагах. Eur J Cell Biol. 1997, 73 (1): 19-27.
CAS PubMed Google ученый
Lisanti MP, Scherer PE, Vidugiriene J, Tang Z, Hermanowski-Vosatka A, Tu YH, Cook RF, Sargiacomo M: Характеристика богатых кавеолином мембранных доменов, выделенных из богатого эндотелием источника: последствия для болезней человека. J Cell Biol. 1994, 126 (1): 111-126.
CAS PubMed Статья Google ученый
Суини М., Джонс К.Дж., Гринвуд С.Л., Бейкер П.Н., Таггарт М.Дж .: Ультраструктурные особенности гладких мышц и эндотелиальных клеток изолированных изобарических плацентарных и материнских артерий человека.Плацента. 2006, 27 (6–7): 635-647.
CAS PubMed Статья Google ученый
Li XA, Everson WV, Smart EJ: кавеолы, липидные рафты и сосудистые заболевания. Trends Cardiovasc Med. 2005, 15 (3): 92-96.
CAS PubMed Статья Google ученый
Браун Д.А., Лондон E: Структура и происхождение упорядоченных липидных доменов в биологических мембранах.J Membr Biol. 1998, 164 (2): 103-114.
CAS PubMed Статья Google ученый
Brown DA, Лондон E: Структура и функция мембранных рафтов, богатых сфинголипидами и холестерином. J Biol Chem. 2000, 275 (23): 17221-17224.
CAS PubMed Статья Google ученый
Саймонс К., Тоомре Д.: Липидные рафты и передача сигналов. Nat Rev Mol Cell Biol.2000, 1 (1): 31-39.
CAS PubMed Статья Google ученый
Саймонс К., Эхехальт Р: Холестерин, липидные рафты и болезни. J Clin Invest. 2002, 110 (5): 597-603.
PubMed Central CAS PubMed Статья Google ученый
Pike LJ: Липидные рафты: наведение порядка в хаос. J Lipid Res. 2003, 44 (4): 655-667.
CAS PubMed Статья Google ученый
Мелконян К.А., Остермейер А.Г., Чен Дж. З., Рот М.Г., Браун Д.А.: Роль липидных модификаций в нацеливании белков на устойчивые к детергентам мембранные рафты. Многие белки рафта ацилированы, а немногие пренилированы. J Biol Chem. 1999, 274 (6): 3910-3917.
CAS PubMed Статья Google ученый
Moffett S, Brown DA, Linder ME: липид-зависимое нацеливание G-белков на рафты. J Biol Chem. 2000, 275 (3): 2191-2198.
CAS PubMed Статья Google ученый
Young RM, Holowka D, Baird B: Окружение липидного рафта усиливает активность Lyn киназы, защищая тирозин в активном центре от дефосфорилирования. J Biol Chem. 2003, 278 (23): 20746-20752.
CAS PubMed Статья Google ученый
Fan YY, McMurray DN, Ly LH, Chapkin RS: Диетические (n-3) полиненасыщенные жирные кислоты ремоделируют липидные рафты Т-клеток мыши.J Nutr. 2003, 133 (6): 1913-1920.
CAS PubMed Google ученый
Fan YY, Ly LH, Barhoumi R, McMurray DN, Chapkin RS: Диетическая докозагексаеновая кислота подавляет рекрутинг Т-клеточной протеинкиназы C тета-липидного слоя и продукцию IL-2. J Immunol. 2004, 173 (10): 6151-6160.
CAS PubMed Статья Google ученый
Switzer KC, Fan YY, Wang N, McMurray DN, Chapkin RS: Диетические полиненасыщенные жирные кислоты n-3 способствуют индуцированной активацией гибели клеток в Th2-поляризованных мышиных CD4 + T-клетках.J Lipid Res. 2004, 45 (8): 1482-1492.
PubMed Central CAS PubMed Статья Google ученый
Li YC, Park MJ, Ye SK, Kim CW, Kim YN: Повышенные уровни богатых холестерином липидных рафтов в раковых клетках коррелируют с чувствительностью к апоптозу, индуцированной агентами, истощающими холестерин. Am J Pathol. 2006, 168 (4): 1107-1118.
PubMed Central CAS PubMed Статья Google ученый
Ma DW, Seo J, Davidson LA, Callaway ES, Fan YY, Lupton JR, Chapkin RS: n-3 PUFA изменяют липидный состав кавеол и локализацию резидентных белков в толстой кишке мышей. FASEB J. 2004, 18 (9): 1040-1042.
CAS PubMed Google ученый
Li Q, Zhang Q, Wang M, Zhao S, Ma J, Luo N, Li N, Li Y, Xu G, Li J: Эйкозапентаеновая кислота изменяет состав липидов в кавеолах и вызывает перемещение эндотелиального оксида азота. синтаза.Биохимия. 2007, 89 (1): 169-177.
PubMed Статья CAS Google ученый
Bousserouel S, Raymondjean M, Brouillet A, Bereziat G, Andreani M: Модуляция экспрессии гена циклина D1 и фактора ранней реакции роста-1 в гладкомышечных клетках крыс, обработанных интерлейкином-1бета, с помощью n-6 и n -3 полиненасыщенные жирные кислоты. Eur J Biochem. 2004, 271 (22): 4462-4473.
CAS PubMed Статья Google ученый
Чапкин Р.С., Ван Н., Фан Ю.Й., Луптон Дж. Р., Прайор И.А.: Докозагексаеновая кислота изменяет размер и распределение микродоменов клеточной поверхности. Biochim Biophys Acta. 2008, 1778 (2): 466-471.
PubMed Central CAS PubMed Статья Google ученый
Fan YY, McMurray DN, Ly LH, Chapkin RS: Диетические (n-3) полиненасыщенные жирные кислоты ремоделируют липидные рафты Т-клеток мыши. J Nutr. 2003, 133 (6): 1913-1920.
CAS PubMed Google ученый
Li Q, Zhang Q, Wang M, Liu F, Zhao S, Ma J, Luo N, Li N, Li Y: Докозагексаеновая кислота влияет на эндотелиальную синтазу оксида азота в кавеолах. Arch Biochem Biophys. 2007, 466 (2): 250-259.
CAS PubMed Статья Google ученый
Fan YY, Ly LH, Barhoumi R, McMurray DN, Chapkin RS: Диетическая докозагексаеновая кислота подавляет рекрутинг Т-клеточной протеинкиназы C тета-липидного растра и продукцию IL-2. J Immunol. 2004, 173 (10): 6151-6160.
CAS PubMed Статья Google ученый
Thies F, Miles EA, Nebe-von-Caron G, Powell JR, Hurst TL, Newsholme EA, Calder PC: Влияние пищевых добавок с длинноцепочечными полиненасыщенными жирными кислотами n-3 или n-6 на популяции и функции воспалительных клеток крови, а также молекулы адгезии, растворимые в плазме крови у здоровых взрослых. Липиды. 2001, 36 (11): 1183-1193.
CAS PubMed Статья Google ученый
Ферруччи Л., Керубини А., Бандинелли С., Бартали Б., Корси А., Лауретани Ф., Мартин А., Ндрес-Лакуева С., Сенин Ю., Гуральник Ю. М.: Связь полиненасыщенных жирных кислот в плазме с циркулирующими маркерами воспаления. J Clin Endocrinol Metab. 2006, 91 (2): 439-446.
CAS PubMed Статья Google ученый
Lopez-Garcia E, Schulze MB, Manson JE, Meigs JB, Albert CM, Rifai N, Willett WC, Hu FB: потребление (n-3) жирных кислот связано с плазменными биомаркерами воспаления и эндотелия. активация у женщин.J Nutr. 2004, 134 (7): 1806-1811.
CAS PubMed Google ученый
Bemelmans WJ, Lefrandt JD, Feskens EJ, van Haelst PL, Broer J, Meyboom-de JB, May JF, Tervaert JW, Smit AJ: Повышенное потребление альфа-линоленовой кислоты снижает С-реактивный белок, но имеет не влияет на маркеры атеросклероза. Eur J Clin Nutr. 2004, 58 (7): 1083-1089.
CAS PubMed Статья Google ученый
Rallidis LS, Paschos G, Papaioannou ML, Liakos GK, Panagiotakos DB, Anastasiadis G, Zampelas A: Влияние диеты, обогащенной альфа-линоленовой кислотой, на растворимые молекулы клеточной адгезии у пациентов с дислипидемией. Атеросклероз. 2004, 174 (1): 127-132.
CAS PubMed Статья Google ученый
Zhao G, Etherton TD, Martin KR, West SG, Gillies PJ, Kris-Etherton PM: Диетическая альфа-линоленовая кислота снижает воспалительные и липидные факторы риска сердечно-сосудистых заболеваний у мужчин и женщин с гиперхолестеринемией.J Nutr. 2004, 134 (11): 2991-2997.
CAS PubMed Google ученый
Sattar N, Murray HM, Welsh P, Blauw GJ, Buckley BM, Cobbe S, de Craen AJ, Lowe GD, Jukema JW: маркеры воспаления в большей степени связаны с риском смерти, чем нефатальных сосудистых событий ? PLoS Med. 2009, 6 (6): e1000099-e1000099.
PubMed Central PubMed Статья CAS Google ученый
Santoli D, Zurier RB: Жирные кислоты-предшественники простагландина E ингибируют выработку человеческого IL-2 по простагландин-E-независимому механизму. J Immunol. 1989, 143 (4): 1303-1309.
CAS PubMed Google ученый
Chu AJ, Walton MA, Prasad JK, Seto A: Блокада полиненасыщенными n-3 жирными кислотами индуцированной эндотоксином активации моноцитарного тканевого фактора опосредуется подавленной экспрессией рецептора в клетках THP-1. J Surg Res.1999, 87 (2): 217-224.
CAS PubMed Статья Google ученый
Де Катерина Р., Цибульский М.И., Клинтон С.К., Гимброн М.А., Либби П. Докозагексаеноат омега-3 жирных кислот снижает индуцированную цитокинами экспрессию проатерогенных и провоспалительных белков в эндотелиальных клетках человека. Артериосклер тромб. 1994, 14 (11): 1829-1836.
CAS PubMed Статья Google ученый
Khalfoun B, Thibault F, Watier H, Bardos P, Lebranchu Y: Докозагексаеновая и эйкозапентаеновая кислоты ингибируют производство интерлейкина-6 эндотелиальными клетками человека in vitro. Adv Exp Med Biol. 1997, 400B: 589-597.
CAS PubMed Google ученый
Де Катерина Р., Цибульский М.И., Клинтон С.К., Гимброн М.А., Либби П. Докозагексаеноат омега-3 жирных кислот снижает индуцированную цитокинами экспрессию проатерогенных и провоспалительных белков в эндотелиальных клетках человека.Артериосклер тромб. 1994, 14 (11): 1829-1836.
CAS PubMed Статья Google ученый
De CR, Libby P: Контроль молекул адгезии эндотелиальных лейкоцитов с помощью жирных кислот. Липиды. 1996, 31 (Дополнение): S57-S63.
Google ученый
Curtis CL, Hughes CE, Flannery CR, Little CB, Harwood JL, Caterson B: n-3 жирные кислоты специфически модулируют катаболические факторы, участвующие в деградации суставного хряща.J Biol Chem. 2000, 275 (2): 721-724.
CAS PubMed Статья Google ученый
Marion-Letellier R, Butler M, Dechelotte P, Playford RJ, Ghosh S: Сравнение цитокиновой модуляции гамма-лигандами рецептора, активируемого естественным пролифератором пероксисом, с синтетическими лигандами в кишечноподобных клетках Caco-2 и дендритных клетках человека. клетки — возможность диетической модуляции гамма-рецепторов, активируемых пролифератором пероксисом, при воспалении кишечника.Am J Clin Nutr. 2008, 87 (4): 939-948.
CAS PubMed Google ученый
Ren J, Chung SH: Противовоспалительный эффект альфа-линоленовой кислоты и механизм ее действия за счет ингибирования продукции оксида азота и индуцируемой экспрессии гена синтазы оксида азота через NF-kappaB и митоген-активируемую протеинкиназу. пути. J. Agric Food Chem. 2007, 55 (13): 5073-5080.
CAS PubMed Статья Google ученый
Ван Л., Рейтерер Г., Тоборек М., Хенниг Б. Изменение соотношения омега-6 и омега-3 жирных кислот может по-разному модулировать токсичность полихлорированного бифенила в эндотелиальных клетках. Chem Biol Interact. 2008, 172 (1): 27-38.
PubMed Central CAS PubMed Статья Google ученый
Zhao G, Etherton TD, Martin KR, Heuvel Vanden JP, Gillies PJ, West SG, Kris-Etherton PM: Противовоспалительные эффекты полиненасыщенных жирных кислот в клетках THP-1.Biochem Biophys Res Commun. 2005, 336 (3): 909-917.
CAS PubMed Статья Google ученый
Chou YC, Prakash E, Huang CF, Lien TW, Chen X, Su IJ, Chao YS, Hsieh HP, Hsu JT: Очистка и идентификация агонистов PPARальфа / гамма из Chlorella sorokiniana под контролем биопроба. Phytother Res. 2008, 22 (5): 605-613.
CAS PubMed Статья Google ученый
Singer P, Shapiro H, Theilla M, Anbar R, Singer J, Cohen J: Противовоспалительные свойства омега-3 жирных кислот при критических заболеваниях: новые механизмы и интегративная перспектива. Intensive Care Med. 2008, 34 (9): 1580-1592.
CAS PubMed Статья Google ученый
Chandrasekar B, Fernandes G: Снижение провоспалительных цитокинов и повышение экспрессии гена антиоксидантного фермента омега-3 липидами при волчаночном нефрите мышей.Biochem Biophys Res Commun. 1994, 200 (2): 893-898.
CAS PubMed Статья Google ученый
Ренье Дж., Скамен Э., ДеСанктис Дж., Радзиох Д. Диетические полиненасыщенные жирные кислоты n-3 предотвращают развитие атеросклеротических поражений у мышей. Модуляция секреторной активности макрофагов. Артериосклер тромб. 1993, 13 (10): 1515-1524.
CAS PubMed Статья Google ученый
Робинсон Д.Р., Уракадзе М., Хуанг Р., Таки Х., Сугияма Э., Нуэлл С.Т., Сюй Л., Йе ЭТ, Аурон ПЭ: пищевые морские липиды подавляют непрерывную экспрессию транскрипции гена интерлейкина-1 бета. Липиды. 1996, 31 (Дополнение): S23-S31.
CAS PubMed Статья Google ученый
Девчанд П.Р., Келлер Х., Петерс Дж.М., Васкес М., Гонсалес Ф.Дж., Вали В.: Путь PPARальфа-лейкотриена B4 к контролю воспаления. Природа. 1996, 384 (6604): 39-43.
CAS PubMed Статья Google ученый
Kliewer SA, Lenhard JM, Willson TM, Patel I, Morris DC, Lehmann JM: Метаболит простагландина J2 связывает гамма-рецептор, активируемый пролифератором пероксисом, и способствует дифференцировке адипоцитов. Клетка. 1995, 83 (5): 813-819.
CAS PubMed Статья Google ученый
Schmitz G, Ecker J: Противоположные эффекты жирных кислот n-3 и n-6.Prog Lipid Res. 2008, 47 (2): 147-155.
CAS PubMed Статья Google ученый
Stanford JL, King I, Kristal AR: Долгосрочное хранение эритроцитов и корреляции между эритроцитами и жирными кислотами в пище: результаты пилотного исследования. Nutr Cancer. 1991, 16 (3-4): 183-188.
CAS PubMed Статья Google ученый
Poppitt SD, Kilmartin P, Butler P, Keogh GF: Оценка состава фосфолипидных жирных кислот эритроцитов как биомаркера потребления МНЖК, ПНЖК или насыщенных жирных кислот в контролируемом перекрестном интервенционном исследовании.Lipids Health Dis. 2005, 4: 30-40.
PubMed Central PubMed Статья Google ученый
Карлссон М., Марилд С., Брандберг Дж., Лонн Л., Фриберг П., Страндвик Б. Фосфолипидные жирные кислоты сыворотки, жировая ткань и метаболические маркеры у подростков с ожирением. Ожирение (Серебряная весна). 2006, 14 (11): 1931-1939.
CAS Статья Google ученый
Австрия Дж. А., Ричард М. Н., Шахин М. Н., Эдель А. Л., Малкольмсон Л. Дж., Дюпаскье С. М., Пирс Г. Н.: Биодоступность альфа-линоленовой кислоты у субъектов после приема трех различных форм льняного семени. J Am Coll Nutr. 2008, 27 (2): 214-221.
PubMed Статья Google ученый
жирные кислоты, сигнализация клеток | Изучите науку в Scitable
Bergstrom, S.K. Простагландины: от лаборатории к клинике. (1982).
Берр, Г. О. и Берр, М. М. Новое заболевание, связанное с дефицитом, вызванное жестким исключением жиров из рациона. Журнал биологической химии 82, 345–367 (1929).
Берр Г.О., Берр М. М. и др. . О жирных кислотах, необходимых в питании. III. Журнал биологической химии 97 1–9 (1932).
Кори, Э. Логика химического синтеза: многоступенчатый синтез сложных карбогенных молекул (1990).
Девейн, В. А., Ханус, Л., и др. . Выделение и структура компонента мозга, который связывается с каннабиноидным рецептором. Наука 258, 1946–1949 (1992). DOI: 10.1126 / science.1470919.
Фитцджеральд, Г.А. ЦОГ-2 и не только: подходы к ингибированию простагландинов при заболеваниях человека. Nature Reviews Drug Discovery 2 , 879-890 (2003) DOI: 10.1038 / nrd1225.
Совет по пищевым продуктам и питанию, Медицинский институт национальных академий.Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей (2002).
Джастис, Э. и Каррутерс, Д. М. Сердечно-сосудистый риск и ингибирование ЦОГ-2 в ревматологической практике. Journal of Human Hypertension 19 , 1-5 (2005). DOI: 10.1038 / sj.jhh.1001777.
Вейн, Дж. Р. Ингибирование синтеза простагландинов как механизм действия аспирин-подобных препаратов. Природа (Новая биология) 231, 232–235 (1971).DOI: 10.1038 / 10.1038 / newbio231232a0.
Вейн, Дж. Р. Приключения и экскурсии в биотесте: ступеньки к простациклину (1982).
Самуэльссон Б. От исследований биохимических механизмов до новых биологических медиаторов: эндопероксиды простагландина, тромбоксаны и лейкотриены (1982).
Самуэльссон, Б. Лейкотриены: медиаторы немедленной гиперчувствительности, реакций и воспаления, Science 220 568–575 (1983) doi: 10.1126 / science.6301011.
Тернер, Дж. Г., Эллис, К., и др. . Сигнальный путь жасмоната. Растительная клетка 14, S153 – s164 (2002). DOI: 10.1105 / tpc.000679.
Химический синтез, ферментативное образование, перекисное окисление липидов и его биологические эффекты
Я участвовал в исследованиях полиненасыщенных жирных кислот с 1964 года, и этот обзор призван охватить некоторые из наиболее важных аспектов этой работы. Полиненасыщенные жирные кислоты следовали за мной на протяжении всей моей научной карьеры, и я опубликовал ряд исследований, касающихся их различных аспектов, таких как химический синтез, ферментативное образование, метаболизм, транспорт, физические, химические и каталитические свойства реконструированной десатуразной системы в организме человека. липосомы, перекисное окисление липидов и их эффекты.Первым проектом, в котором я принял участие, был органический синтез [1- 14 C] эйкоза-11,14-диеновой кислоты с целью продемонстрировать участие этого соединения в качестве возможного посредника в биосинтезе арахидоновой кислоты ». in vivo ». С 1966 по 1982 год я участвовал в нескольких проектах, посвященных изучению метаболизма полиненасыщенных жирных кислот. В восьмидесятые годы мы изучали белок, связывающий жирные кислоты. С 1990 года по настоящее время наша лаборатория интересовалась перекисным окислением липидов биологических мембран из различных тканей и разных видов, а также липосомами, приготовленными с фосфолипидами, богатыми ПНЖК.Мы протестировали действие многих антиоксидантов, таких как альфа-токоферол, витамин А, мелатонин и его структурные аналоги, а также конъюгированная линолевая кислота.
1. Введение
Пять десятилетий назад ПНЖК не представляли особого интереса, поскольку их единственная ценность заключалась в том, что они являются составными частями олифы. Они были известны как компоненты пищевых жиров, но считались функциональными только как источник калорий. В 1929 году Берр и его жена Милдред опубликовали статью [1], в которой они обнаружили, что устранение жира из рациона животных вызывает болезнь дефицита, а их последующие статьи показали, что эту болезнь можно предотвратить или вылечить добавлением жира. линолевой кислоты в рационе [2, 3].Таким образом, они убедительно доказали, что линолевая кислота является незаменимой жирной кислотой, и представили концепцию, согласно которой жиры больше не должны рассматриваться только как источник калорий и как носитель жирорастворимых витаминов, но что жиры обладают внутренней специфической питательной ценностью. Позже будет открыто гораздо больше о функциях незаменимых жирных кислот.
Мой первый опыт работы с полиненасыщенными жирными кислотами начался в 1964 году, когда меня приняли в качестве «научного сотрудника» без зарплаты в Cátedra de Bioquímica, Instituto de Fisiología, Facultad de Ciencias Médicas, Universidad Nacional de La Plata, Аргентина.Это было до эпохи молекулярной биологии, и ограничениями в биохимической науке были органическая и аналитическая химия. Моим наставником был профессор Родольфо Р. Бреннер, бывший ученик профессора Педро Каттанео, который много лет работал с растительными маслами. Р. Бреннер, почетный исследователь CONICET и почетный профессор Национального университета Ла-Платы, созданный в 1965 году вместе с доктором. Федерико Лелуар (Нобелевская премия по химии, 1970) и Андрес Стоппани (куратор премии Цезаря Мильштейна по физиологии и медицине, 1984 г.), Аргентинское общество биохимических исследований.Семнадцать лет спустя Бреннер основал Институт биохимических исследований Ла-Платы, основание которого восходит к 1956 году и служит двойной зависимостью CONICET / UNLP с 1982 года. Его основная цель — исследование биологических, биохимических и биофизических процессов, связанных с метаболизмом липидов. у различных организмов.
Полиненасыщенные жирные кислоты следовали за мной на протяжении всей моей научной карьеры, и я опубликовал ряд исследований, касающихся их различных аспектов, таких как химический синтез, механизм ферментативного образования, метаболизм, транспорт, физические, химические и каталитические свойства реконструированная система десатуразы в липосомах, перекисное окисление липидов и его биологические последствия, а также количественные методы его анализа.
В этой работе я хотел бы рассмотреть некоторые основные концепции химии и биохимии n-3 и n-6 ПНЖК, а затем я рассмотрю некоторые отдельные части исследования, в котором я участвовал, начиная с начала шестидесятых годов. до сих пор.
2. Химия и биохимия n-3 и n-6 ПНЖК: некоторые основные концепции
Жирные кислоты состоят из углеводородных цепей с карбоксильной группой на одном конце и метильной группой на противоположном конце (n или конец). Ненасыщенные жирные кислоты содержат в своей цепи одну или несколько двойных связей, не насыщенных водородом.ПНЖК содержат более одной из этих двойных связей, и обозначение n-3 или n-6 указывает, что первая двойная связь в углеводородной цепи расположена на третьем и шестом атомах углерода от n (или) конца, соответственно.
Обычно обозначаемые как «омега-3 или 6», полиненасыщенные жирные кислоты n-3 и n-6 (ПНЖК n-3 и n-6) входят в состав нашего рациона и содержатся как в овощах, так и в тканях животных. Однако они преимущественно сконцентрированы в рыбе, которая обычно считается лучшим источником этих жирных кислот (особенно длинноцепочечных n-3 ПНЖК) [4], тогда как n-6 ПНЖК относятся к другому значительному семейству диетических ПНЖК и являются в основном содержится в растительных маслах.
Среди компонентов этих двух классов ПНЖК (n-3 и n-6) рассматриваются -линоленовая кислота (-LNA, 18: 3 n-3) и линолевая кислота (LA, 18: 2 n-6). необходим для нашей диеты. Это связано с тем, что, в отличие от растительных клеток, клетки млекопитающих не имеют десатураз, способных специфически размещать двойные связи в положениях n-3 и n-6 углеродной цепи жирных кислот вдоль пути синтеза [5]. С этого момента наши клетки вместо этого снабжаются всеми ферментами, необходимыми для создания более длинных и ненасыщенных n-3 или n-6 ПНЖК из -LNA или LA (Δ6-десатураза, Δ5-десатураза и элонгаза).
Два совершенно разных синтетических пути существуют для создания длинноцепочечных n-3 и n-6 PUFA (рис. 1), и компонент одного класса не может быть обменен на PUFA другого класса. Посредством ряда синтетических стадий получают n-6 PUFA арахидоновую кислоту (AA, 20: 4 n-6), которая широко используется в мембранах животных и является предшественником многих биоактивных соединений, обычно включаемых под названием эйкозаноиды, выражение, производное от греческого слова eicosa (двадцать), обозначающего 20 атомов углерода в цепи АА.Среди эйкозаноидов есть простагландины, тромбоксаны и лейкотриены.
Эйкозапентаеновая кислота (EPA, 20: 5 n-3) представляет собой эквивалентную 20-углеродную жирную кислоту, синтезируемую путем n-3 PUFA, и содержит дополнительную двойную связь. Это предшественник эйкозаноидов, сопоставимых с теми, которые происходят из АК, но с меньшей степенью биологической активности. Докозагексаеновая кислота (DHA, 22: 6 n-3) является другой биологически значимой длинноцепочечной n-3 PUFA. Для этой жирной кислоты, начиная с EPA, был объяснен сложный синтетический путь, который включает стадии десатуразы, элонгазы и частичного пероксисомального окисления [6, 7].Фактически, это преобразование крайне неэффективно, о чем свидетельствует отсутствие увеличения DHA в плазме и тканях после приема пищевых добавок EPA [8]. Напротив, может происходить ретроконверсия DHA в EPA, и после приема DHA наблюдается небольшое увеличение EPA в плазме и тканях [9]. В целом, однако, полный синтетический путь производства EPA и DHA из -LNA не совсем эффективен, и для достижения достаточных уровней EPA и DHA в наших тканях мы должны получать их из внешних источников питания, особенно из рыб. , которые накапливают EPA и DHA вдоль пищевой цепи, начиная с фитопланктона [10].
3. Органический синтез [1-
14 C] полиненасыщенных жирных кислотВ течение нескольких лет преобразование C18: 2 n-6 в 20: 4 n-6 путем последовательного D6-десатурации-удлинения -Δ5-десатурация стала основным путем биосинтеза арахидоновой кислоты (рис. 2).
Однако 5 десятилетий назад альтернатива удлинение-Δ8-десатурация-Δ5-десатурация представляла интерес из-за появления промежуточных соединений в ткани млекопитающих (рис. 3), как и третья альтернатива (удлинение-Δ5-десатурация- Δ8-десатурация) учитывали, учитывая, что 20: 2 превращается в 5,11,14-20: 3 (сциадоновая кислота) под действием Δ5-десатуразы (рис. 4).
Имея это в виду и с целью получения дополнительной информации об альтернативных путях, показанных на рисунках 3 и 4, мы синтезировали 1- 14 C 11,14-C20: 2n-6.
Большой научный успех группы Бреннера был основан, в частности, на органической химии: синтез новых немеченых и меченых ПНЖК и их анализ с помощью газовой хроматографии. Как следствие этого, первым проектом, в котором я принял участие, был органический синтез [1- 14 C] эйкоза-11,14-диеновой кислоты.Эти меченые ПНЖК были синтезированы в сотрудничестве с профессором Альдо Митта из Национальной комиссии по атомной энергии Аргентины. Метаболизм [1- 14 C] эйкоза-11,14-диеновой кислоты был позже исследован с использованием микросомальных препаратов печени крыс.
Синтез немеченой и 14 C-меченой эйкоза-11,14-диеновой кислоты проводили следующим образом: моноин пропаргилбромид конденсировали с -алкин-1-хлоридом; хлорид полилинии частично гидрировали над катализатором Линдлара, и полученный полиенхлорид обрабатывали K14CN в диметилсульфоксиде.Полученный нитрил гидролизовали и превращали в метиловый эфир с помощью метанола-HCl, а затем высвобождали свободную жирную кислоту мягким щелочным гидролизом. Этот метод подходит для синтеза полностью цис-жирных кислот, рис. 5 [11].
4. Механизм, ферментативное образование и метаболизм полиненасыщенных жирных кислот
4.1. Относительное включение линолевой и арахидоновой кислот в фосфолипиды и триглицериды различных тканей крысы
Мои исследования биологических систем с ПУФАС начались в 1964 году с моей докторской диссертации под руководством профессора Р.Р. Бреннер под заголовком: «Исследование включения кислот, синтезированных крысами из линолевой кислоты, в триглицериды и фосфолипиды». В этих исследованиях крысам с дефицитом жира давали разные количества метиллинолеата в течение увеличивающихся периодов времени. Метиллинолеат чистотой 90% был получен из подсолнечного масла путем образования аддуктов мочевины и фракционной перегонки. Определяли жирнокислотный состав триглицеридов и фосфолипидов эпидидимальной жировой подушки, эпиренального жирового депо, кишечного жирового депо, печени и пула сердца, почек, легких и поджелудочной железы.Рассчитывали распределение общего количества линолевой и арахидоновой кислот, включенных в фосфолипиды и триглицериды, на крысу. Линолевая кислота, по-видимому, включается в фосфолипиды в основном за счет общего синтеза липидов, но не вытесняет эйкозатриеновую кислоту. Прямое вытеснение эйкоза-5,8,11-триеновой кислоты из фосфолипидов может быть вызвано арахидоновой кислотой, синтезированной из линолевой кислоты или содержащейся в рационе. Этот эффект не зависит от прерывания синтеза эйкозатриеновой кислоты.Прямая β-трансацилазная реакция типа, описанного Лендсом и Мерклом, очень вероятно может быть ответственна за такое смещение. Однако включение арахидоновой кислоты в фосфолипиды также будет следовать пути Кеннеди общего синтеза фосфолипидов. Это могло бы возникнуть из-за типа кривой арахидоновой кислоты после того, как эйкозатриеновая кислота была удалена из липидов [12].
4.2. Исследования прямого биосинтеза эйкоза-5,8,11-триеновой кислоты из эйкоза-8,11-диеновой кислоты и влияния диеты, не содержащей незаменимых жирных кислот, на десатурацию олеиновой, линолевой и эйкозадиеновой кислоты (n-9) Кислоты
Изучена окислительная десатурация [1- 14 C] эйкоза-8,11-диеновой кислоты до эйкоза-5,8,1-триеновой кислоты микросомами печени крыс, и кинетические условия, подходящие для измерения Определена удельная активность фермента.Было проанализировано сравнение различных диет по окислительной десатурации в положениях 5,6 и 6,7. Результаты этих исследований подтверждают предыдущий вывод, согласно которому 6-десатурация, а не 5-десатурация, является ключевым элементом управления синтезом ненасыщенных жирных кислот. 5-десатураза, вероятно, представляет собой вторичную регуляторную точку [13].
4.3. Механизм микросомальной стеароил-КоА-десатуразы печени крысы: исследования специфичности субстрата, взаимодействия ферментов и субстратов и функции липидов
. Спустя 10 лет после моего первого опыта с ПНЖК я стал участником исследования, которое, вне всяких сомнений, продемонстрировало, что механизм стеарил-коа десатуразы.В 1974 году я перешел из Cátedra de Bioquímica, Facultad de Ciencias Médicas, Universidad Nacional de La Plata, Аргентина, на факультет биохимии Университета Коннектикута, Центр здоровья, США.
В качестве международного сообщества Национальных институтов здравоохранения (NIH) я начал под руководством Филипа Стритматера проект с целью анализа физических, химических и каталитических свойств реконструированной системы десатуразы в яичном лецитине или димиристоиле. везикулы лецитина, лишенные детергента.Эта первоначальная характеристика механизма включает данные о субстратной специфичности десатуразы, взаимодействии субстрата с ферментом и возможной роли фосфолипида в переносе электронов, связывании субстрата и ограничивающей скорость стадии десатурации.
Стеароил-КоА десатураза представляет собой микросомальную оксидазную систему, необходимую для биосинтеза олеиновой кислоты. Три белковых компонента этой системы (цитохром b5 редуктаза, цитохром bs и терминальная оксидаза) были разделены, и ферментативно активная десатураза была восстановлена из очищенных компонентов.В результате этих исследований статья была опубликована в журнале J. Biol. Chem. под названием: «Механизм микросомальной стеарил-КоА десатуразы печени крысы: исследования субстратной специфичности, фермент-субстратных взаимодействий и функции липидов». Эти исследования, несомненно, открыли новые возможности для реакции десатурации жирных кислот [14].
5. Исследования белков, связывающих жирные кислоты.
В 1972 году Окнер и его сотрудники впервые описали белок, связывающий жирные кислоты в цитозоле слизистой оболочки кишечника, печени, миокарда и других тканей [15].
В восьмидесятые годы я стал профессором биохимии в Университете Ла-Платы, и наша лаборатория заинтересовалась белком, связывающим жирные кислоты, и начала серию исследований с целью получения информации о связывающей активности и механизме действия этого белка. . Ниже приведены результаты этих исследований.
5.1. Обмен пальмитиновой кислоты из цитозольных белков на микросомы, митохондрии и липидные пузырьки
Сефадекс G-75 продемонстрировал присутствие двух фракций со сродством к 1- 14 C пальмитиновой кислоте в надосадочной жидкости 105000 г гомогената печени крысы. гель-фильтрация.Фракция с наименьшей молекулярной массой была идентифицирована как белок, связывающий жирные кислоты, о чем судили по ее относительному объему элюирования в сефадексе G-75, ее характеристикам связывания с сульфобромофталеином и ингибированию связывания пальмитиновой кислоты флаваспидовой кислотой. Прерывистый градиент сахарозы использовали для изучения обмена пальмитиновой кислоты из этих цитозольных фракций на микросомы и митохондрии. Обе фракции из печени крысы были более эффективны, чем альбумин, в обмене пальмитиновой кислоты на твердый материал.Пальмитиновая кислота была заменена с белка, связывающего жирные кислоты, на липосомы. Этот и, возможно, другие цитозольные белки участвуют в транспорте жирных кислот в клетках [16].
5.2. Частичная очистка связывающего жирную кислоту белка фракционированием сульфата аммония
Путем фракционирования цитозоля печени крысы 70% насыщенным сульфатом аммония была получена растворимая фракция, показывающая высокое сродство к олеиновой кислоте. Связывание олеиновой кислоты с этой фракцией ингибировалось флаваспидовой кислотой.Молекулярная масса основного белка, присутствующего в этой фракции, составляла 12000, как определено электрофорезом в SDS-полиакриламидном геле. Эта растворимая фракция стимулировала перенос олеиновой кислоты из микросом в липосомы фосфатидилхолина, что продемонстрировано анализом переноса in vitro. Поведение этой фракции аналогично описанному для белка, связывающего жирные кислоты [17].
5.3. Перенос олеиновой кислоты из микросом в липосомы яичного лецитина: участие связывающего жирные кислоты белка
Перенос олеиновой кислоты из микросом или митохондрий в липосомы яичного лецитина стимулировался белком, связывающим жирные кислоты.Путем гель-фильтрации можно было продемонстрировать, что этот белок включает олеиновую кислоту в липосомы. Активность переноса белков, связывающих жирные кислоты, была выше при использовании микросом, а не митохондрий, что предполагает избирательное взаимодействие с различными типами мембран. Перенос олеиновой кислоты этим растворимым белком больше, чем перенос стеариновой кислоты. Результаты показывают, что белок, связывающий жирные кислоты, может участвовать во внутриклеточном транспорте жирных кислот [18].
5.4. Взаимодействие альбумина и белка, связывающего жирные кислоты, с мембранами: диссоциация олеиновой кислоты
Бычий сывороточный альбумин или белок, связывающий жирные кислоты, быстро теряют олеиновую кислоту при инкубации в присутствии липосом димиристоиллецитина.Это явление зависит от концентрации везикул, и никаких измеримых количеств белка, связанного с липосомами, не обнаружено. После гель-фильтрации на сефарозе CL-2B инкубированных смесей микросом, содержащих [1- 14 C] олеиновую кислоту и альбумин или связывающий жирную кислоту белок, можно было продемонстрировать ассоциацию жирной кислоты с растворимыми белками. И альбумин, и белок, связывающий жирные кислоты, стимулировали перенос олеиновой кислоты из микросом печени крысы в липосомы яичного лецитина.Эти результаты показывают, что альбумин более эффективен в связывании олеиновой кислоты, чем белок, связывающий жирные кислоты, что делает возможным селективную диссоциацию олеиновой кислоты во время ее взаимодействия с мембранами [19].
5.5. Замещение сульфобромфталеина олеиновой кислотой из альбумина и белка, связывающего жирные кислоты,
Абсорбция сульфобромфталеина изменяется при добавлении альбумина бычьей сыворотки или белка, связывающего жирные кислоты, при pH 8,4. Спектр сульфобромфталеина изменяется наиболее резко после добавления альбумина, чем в присутствии связывающего жирные кислоты белка, выделенного из печени крысы, что в первом приближении позволяет предположить, что связывающая способность альбумина намного выше, чем у связывающего жирные кислоты белка.Когда оба растворимых белка насыщены олеиновой кислотой, наблюдается снижение связывания сульфобромфталеина, что предполагает, что присутствие жирных кислот в этих растворимых белках может влиять на связывание других лигандов [20].
5.6. Связывающий жирные кислоты белок удаляет жирные кислоты, но не фосфолипиды из микросом Липосомы и обработанные ультразвуком везикулы
В этом исследовании представлены доказательства, указывающие на то, что жирные кислоты, но не фосфолипиды, удаляются из микросом или искусственных мембран (липосом, однослойных везикул) цитозольными препаратами печени мыши обогащен белком, связывающим жирные кислоты (FABP).Цитозольные белки могут действовать как акцепторы жирных кислот, но не фосфолипидов микросомального происхождения. Прямое доказательство было получено, когда липосомы, сделанные из фосфатидилхолина яичного желтка, содержащие как [ 14 C] меченые фосфолипиды, так и [1- 14 C] пальмитиновую кислоту, инкубировали с FABP. Используя обработанные ультразвуком везикулы в качестве доноров жирных кислот или фосфолипидов, белок, связывающий жирные кислоты печени мыши, был способен связывать пальмитиновую кислоту, но не фосфолипиды. Эти исследования показывают, что белок, связывающий жирные кислоты печени, может взаимодействовать с различными типами мембран, специфически повышая десорбцию жирных кислот [21].
5.7. Взаимодействие связывающего жирную кислоту белка с микросомами: удаление пальмитиновой кислоты и сложных эфиров ретинила
[ 14 C] пальмитиновая кислота или [3H] ретиниловые эфиры, включенные в микросомальные мембраны, удалялись цитозольной фракцией, обогащенной белком, связывающим жирные кислоты. Когда цитозоль печени мыши фракционировали 70% сульфатом аммония, получали осадок и растворимую фракцию. Растворимая фракция, содержащая белок, связывающий жирные кислоты, была способна удалять с микросомальных мембран [ 14 C] пальмитиновой кислоты или [3H] ретиниловых эфиров, тогда как фракция осадка не обладала способностью к удалению.Анализ ретиноидов показал, что 70% растворимая фракция сульфата аммония была обогащена эндогенными ретиниловыми эфирами по отношению к цитозолю или 70% фракции осадка сульфата аммония [22].
5.8. Белки, связывающие жирные кислоты в слизистой оболочке кишечника крупного рогатого скота
Цитозоль, полученный из слизистой оболочки кишечника крупного рогатого скота, содержит две белковые фракции, которые связывают сульфобромфталеин и способны удалять [1- 14 C] пальмитиновую кислоту из микросомальных мембран. Фракция высокомолекулярного белка (F1) увеличивает связывание сульфобромфталеина в 2 и 8 раз, соответственно, после нагревания при 60 ° C в течение 5 минут или делипидирования.Эти изменения не коррелируют со скоростью удаления пальмитиновой кислоты из микросом. Нативный или делипидированный F1 более эффективен, чем низкомолекулярный белок (F2) при удалении [1- 14 C] пальмитиновой кислоты из микросом. Две белковые фракции DE-I и DE-II, полученные из F1 с помощью DEAE-целлюлозной хроматографии, обладают способностью связывать пальмитиновую кислоту и сульфобромфталеин соответственно [23].
5.9. Свойства связывания пальмитиновой кислоты цитозольных белков, расположенных в зонах ворсинок и крипт слизистой оболочки кишечника крупного рогатого скота
Сравнивали способность цитозольных белков связывать пальмитиновую кислоту в трех препаратах, полученных путем дифференциального соскоба слизистой оболочки кишечника крупного рогатого скота.Данные показали, что активность связывания пальмитиновой кислоты зависела от положения, которое клетки занимали вдоль оси крипта-ворсинка, как показано на уровне активности щелочной фосфатазы. Белки со свойствами связывания пальмитата в цитозольных белках с высокой и низкой молекулярной массой в зоне ворсинок связывают 1,24 ± 0,41 и 1,54 ± 0,16 пмоль пальмитата / микрограмм белка, соответственно. Связывание снизилось до 0,50 ± 0,25 и 1,10 ± 0,23 пмоль пальмитата / микрограмм для белков в зоне крипт.Фракционирование сульфатом аммония и гель-фильтрационная хроматография показали, что низкомолекулярные цитозольные белки, полученные из легких сосков слизистой оболочки, обладают наивысшей активностью связывания пальмитата. Эти результаты предполагают, что цитозольные белки, расположенные в зоне ворсинок, могут играть роль в абсорбции жирных кислот [24].
5.10. Взаимодействие микросом печени крысы, содержащих насыщенные или ненасыщенные жирные кислоты, с белком, связывающим жирные кислоты
. удаления 14C-меченых жирных кислот с мембраны растворимым белком измеряли с использованием модельной системы.Больше ненасыщенных, чем насыщенных жирных кислот удаляли из микросом нативной печени, инкубированных с аналогичными количествами FABP. Перекисное окисление микросомальных мембран in vitro, опосредованное аскорбатом-Fe 2+ , привело к изменению его жирнокислотного состава со значительным снижением индекса пероксидируемости. Эти изменения в микросомах облегчили удаление олеиновой и линолевой кислот с помощью FABP, но удаление пальмитиновой и стеариновой кислот не изменилось. Предполагается, что этот эффект является результатом нарушения структуры мембраны после перекисного окисления с высвобождением свободных жирных кислот из чувствительных доменов [25].
6. Исследования перекисного окисления липидов
За последние четыре десятилетия интерес к полиненасыщенным жирным кислотам многократно увеличился, и количество опубликованных исследований растет с каждым годом. В настоящее время стимулом для этого интереса стало наблюдение, что ПНЖК и их метаболиты выполняют разнообразные физиологические роли, включая обеспечение энергией, структуру мембраны, передачу сигналов в клетках и регуляцию экспрессии генов. Кроме того, наблюдение, что ПНЖК являются мишенями перекисного окисления липидов, открывает новую важную область исследований.
Перекисное окисление липидов — один из основных результатов повреждения тканей, опосредованного свободными радикалами. Перекисное окисление жирных ацильных групп происходит в основном в мембранных фосфолипидах. Перекисное окисление липидов может значительно изменить физико-химические свойства липидных бислоев мембран, что приводит к серьезной клеточной дисфункции. Кроме того, в результате перекисного окисления липидов образуются различные побочные липидные продукты, некоторые из которых могут оказывать неблагоприятные и / или полезные биологические эффекты. Липиды, содержащие полиненасыщенные жирные кислоты, подвержены окислению, инициированному свободными радикалами, и могут вносить вклад в цепные реакции, которые усиливают повреждение биомолекул, как описано выше [26–29].Перекисное окисление липидов часто происходит в ответ на окислительный стресс, и при расщеплении гидропероксидов липидов в биологических системах образуется большое количество альдегидов (рис. свободные радикалы. До настоящего времени наиболее интенсивно изучаемыми альдегидами являются 4-гидрокси-2-ноненаль, 4-гидрокси-2-гексеналь и малоновый альдегид. Известно, что 4-гидрокси-2-ноненаль (HNE) является основным альдегидом, образующимся при перекисном окислении липидов n-6 полиненасыщенных жирных кислот, таких как линолевая кислота C18: 2 n-6 и арахидоновая кислота C20: 4 n-6.
С другой стороны, перекисное окисление липидов n-3 полиненасыщенных жирных кислот, таких как -линоленовая кислота C18: 3 n-3 и докозагексаеновая кислота C22: 6 n-3, генерирует близкородственное соединение, 4-гидрокси-2- гексеналь (HHE), который является потенциальным медиатором перехода митохондриальной проницаемости. 4-Гидрокси-2-алкенали представляют собой наиболее известные альдегидные вещества, образующиеся при перекисном окислении липидов. Среди них 4-гидрокси-2-ноненаль (HNE), как известно, является основным альдегидом, образующимся при перекисном окислении липидов n-6 полиненасыщенных жирных кислот, таких как линолевая кислота и арахидоновая кислота.
4-Гидроксиноненал (HNE) был идентифицирован три десятилетия назад как цитотоксический альдегид, образующийся во время индуцированного NADPH-Fe ++ перекисного окисления микросомальных липидов печени. С тех пор было доступно огромное количество отчетов, подтверждающих функцию этого соединения при различных процессах заболевания. HNE считается индикатором окислительного стресса и вероятным фактором ряда заболеваний.
Питательно важные ПНЖК опосредуют часть своей биоактивности за счет образования насыщенных кислородом метаболитов.Эти биоактивные липиды продуцируются посредством реакций, катализируемых ЦОГ (циклооксигеназа), LOX (липоксигеназа) и цитохром-Р450, а также неферментативным перекисным окислением липидов.
В этих реакциях образуются несколько видов, некоторые из которых могут образовываться более чем одним путем. Липидомика на основе МС обеспечивает селективность и чувствительность, необходимые для качественного и количественного анализа множества видов липидов в различных биологических системах, и может сделать возможным изучение этих медиаторов.
С 1990 года по настоящее время наша лаборатория заинтересовалась процессами перекисного окисления липидов и их биологическими последствиями. В течение этих двух десятилетий были проведены следующие исследования.
6.1. Сравнительное исследование реакции слизистой оболочки кишечника крупного рогатого скота и мыши на железозависимое перекисное окисление липидов
Степень перекисного окисления липидов in vitro, на что указывает продукция малонового альдегида, значительно различалась в гомогенатах слизистой оболочки кишечника крупного рогатого скота и мыши.Слизистая оболочка кишечника мыши была устойчивой к неферментативному перекисному окислению липидов, тогда как слизистая оболочка кишечника крупного рогатого скота — нет. Железозависимое перекисное окисление липидов в слизистой оболочке кишечника крупного рогатого скота зависит от положения, которое клетки занимают вдоль оси крипта-ворсинка. Добавление метанольных экстрактов из кишечника крупного рогатого скота к гомогенатам печени мышей приводило к значительному увеличению неферментативного перекисного окисления, тогда как экстракты из слизистой оболочки кишечника мышей не оказывали никакого эффекта [30].
6.2. Ингибирование хемилюминесценции микросом цитозольными фракциями, содержащими белок, связывающий жирные кислоты
. Были проведены исследования для определения взаимосвязи между хемилюминесценцией, инициированной Fe 2+ -аскорбат, и перекисным окислением липидов в микросомах печени, легких, почек и мозга крыс.Чтобы проследить динамику перекисного окисления липидов мембран, мы измеряли одновременно физические и биохимические изменения. Таким образом, мы определили жирнокислотный состав микросомальных мембран этих тканей после перекисного окисления с аскорбиновой кислотой и без нее. Фракционирование цитозольных белков сульфатом аммония с 70% насыщением давало растворимую фракцию (обогащенную белком, связывающим жирные кислоты), которая ингибировала зависимое от аскорбата-Fe 2+ перекисное окисление липидов. Ингибирующий эффект зависел от концентрации и не снимался нагреванием растворимой фракции в течение 5 мин при 100 ° C.Препараты из почек, легких, сердца и мозга показали аналогичное действие на перекисное окисление липидов микросомальных мембран печени. Предполагается, что сложные эфиры ретинила, связанные с белком, связывающим жирные кислоты, могут действовать как антиоксиданты против перекисного окисления липидов [31, 32].
6.3. Витамин А ингибирует хемилюминесценцию и перекисное окисление липидов микросом и митохондрий печени крыс.
Перекисное окисление липидов является одним из основных событий, вызванных окислительным стрессом, и особенно активно в тех тканях, мембраны которых богаты полиненасыщенными жирными кислотами.Поскольку было обнаружено, что ретиноиды эффективно действуют in vitro в качестве антиоксидантов и поглотителей радикалов, и, учитывая, что печень млекопитающих играет важную роль в метаболизме длинноцепочечных жирных кислот и витамина А, был проведен анализ, чтобы увидеть, может ли диета с добавлением витамина А изменить чувствительность мембран печени крыс к неферментативному перекисному окислению липидов in vitro. Другие исследователи показали, что витамин А действует как антиоксидант во многих клинических ситуациях; В нашей конкретной теме мы показали, что витамин А ингибирует хемилюминесценцию и перекисное окисление липидов в микросомах и митохондриях печени крыс.Таким образом, чтобы избежать артефактов и неправильной интерпретации, мы проследили процесс разложения, определив хемилюминесценцию и оценив потерю определенных жирных кислот с помощью индекса перекисляемости, рассчитанного на основе состава жирных кислот, определенного с помощью газожидкостной хроматографии. Результаты, полученные в настоящем исследовании, показывают, что микросомальные и митохондриальные мембраны печени крысы защищены витамином А при неферментативном липопероксидации.
В настоящем исследовании мы исследовали, может ли введение витамина А защитить микросомы и митохондрии печени крыс от перекисного окисления in vitro.Заметное снижение хемилюминесценции и перекисного окисления липидов было измерено в микросомальных мембранах крыс, получавших витамин А, по сравнению с контрольными животными. В мембранах, полученных от контрольных животных, состав жирных кислот был существенно изменен при воздействии перекисного окисления in vitro, опосредованного аскорбатом-Fe 2+ , со значительным уменьшением в митохондриях на 20: 4 n-6 и 22: 6 n-3. и 18: 2 n-6 и 20: 4 n-6 в микросомах. Как следствие, индекс перекисной окисляемости, параметр, основанный на максимальной скорости окисления определенных жирных кислот, был выше у животных, получавших добавки, чем в контрольной группе, когда анализировались оба типа мембран.Эти изменения были менее выражены в мембранах, полученных от крыс, получавших витамин А. Эти результаты согласуются с предыдущими результатами, которые показали, что витамин А может действовать как антиоксидант, защищающий мембраны от вредных воздействий [33].
6.4. Неферментативное перекисное окисление липидов, выделенных из микросом, митохондрий и ядер печени крысы
. Были проведены исследования для определения уровня липопероксидации аскорбата-Fe 2+ в зависимости от полярных и нейтральных липидов, выделенных из микросом, митохондрий и ядер печени крыс, подвергшихся воздействию. до инкубации при 37 градусах С в течение 140 мин.Были использованы три экспериментальных подхода: регистрация низкоуровневой хемилюминесценции, определение состава жирных кислот и измерение радиоактивности липидных форм каждого типа мембран в процессе перекисного окисления. Эмиссия мембранного света уменьшалась в порядке микросомы> митохондрии> ядра при использовании 1,5 мг белка каждого препарата. Индекс пероксидируемости сильно изменился у полярных липидов, тогда как у нейтральных липидов — нет. Наиболее чувствительными к перекисному окислению жирными кислотами были арахидоновая кислота C20: 4 n-6 и докозагексановая кислота C22: 6 n-3.Эксперименты, проведенные с мембранами, меченными in vivo, указывают на избирательное высвобождение радиоактивности из полярных, а не из нейтральных липидов в процессе перекисного окисления [34].
6.5. Неферментативное перекисное окисление липидов ядер печени крысы и фракций хроматина
В исследовании, описанном здесь, было проанализировано неферментативное (аскорбат-Fe 2+ ) перекисное окисление липидов ядер печени крысы и фракций хроматина. Хроматин, полученный обработкой ультразвуком ядер, взвешенных в 0.25 М сахарозу фракционировали методом дифференциального осаждения по следующей схеме: 3000, 12000 и 27500 г по 10 мин каждая. Фракция хроматина с наименьшей плотностью была получена путем осаждения холодным этанолом супернатанта, полученного при последнем центрифугировании. Световое излучение = хемилюминесценция, измеряемая как имп / мин / мг белка, уменьшалась в порядке тяжелая> фракция хроматина низкой плотности во время процесса перекисного окисления. Анализ жирных кислот с помощью газовой хроматографии показал, что фракции хроматина высокой плотности обогащены C20: 4 n-6 арахидоновой кислотой по сравнению с фракциями хроматина низкой плотности.Количество арахидоновой кислоты C20: 4 n-6 было выше во фракциях репрессированного хроматина по сравнению с количеством в транскрипционно активном хроматине, которое коррелирует с уровнем перекисного окисления липидов [35].
6,6. Ascorbate-Fe
2+ Перекисное окисление липидов микросом печени крыс: влияние витамина E и цитозольных белковВ настоящем исследовании мы изучили влияние внутрибрюшинного введения витамина E (100 мг / кг веса / 24 ч) на аскорбат (0,4 мМ) индуцировал перекисное окисление липидов микросом печени крыс.Мы также проанализировали влияние цитозольных белков печени на этот процесс. Результаты показывают, что индуцированное аскорбатом световое излучение было на 76% ниже в микросомах (1 мг белка), полученных от животных, получавших витамин Е, по сравнению с контролем. В присутствии цитозольного белка (1 мг) хемилюминесценция контрольных микросом уменьшалась на 55,8 и 59,5% при использовании цитозоля от контрольных и обработанных животных, соответственно. Хемилюминесценция микросом витамина E уменьшилась 25,03 и 22.08% при добавлении в среду цитозоля обоих типов. Цитозоль, подвергнутый диализу или обработанный при 70 ° C, также способен ингибировать перекисное окисление липидов контрольных микросом или микросом печени крыс с витамином E. С помощью газовой хроматографии мы проанализировали жирнокислотный состав нативных и перекисленных микросом обеих групп животных. Перекисное окисление затронуло в основном арахидоновую кислоту, и ее уменьшение было более очевидным в контрольных микросомах, чем в микросомах из группы, получавшей витамин E. С помощью ВЭЖХ мы проанализировали содержание витамина Е во всех используемых субклеточных фракциях.В микросомах из группы витамина Е содержание витамина было в 11 раз выше, чем в контроле (0,678 ± 0,1038 против 0,062 ± 0,0045 мкг г альфа-токоферола / мг белка соответственно), а в цитозоле из группа витамина Е была только в 2 раза выше, чем в контрольном цитозоле (0,057 ± 0,0051 против 0,025 ± 0,0015 мкг г альфа-токоферола / мг белка, соответственно) [36].
6,7. Влияние альфа-токоферола, полностью-транс-ретинола и ретинилпальмитата на неферментативное перекисное окисление липидов внешних сегментов стержня
Влияние токоферола, полностью-транс-ретинола и ретинилпальмитата на неферментативное перекисное окисление липидов, вызванное аскорбатом-Fe Исследовали 2+ мембран наружных сегментов палочек, выделенных из сетчатки крупного рогатого скота.Ингибирование излучения света (максимальная индуцированная хемилюминесценция) альфа-токоферолом, полностью транс-ретинолом и ретинилпальмитатом зависело от концентрации. Весь транс-ретинол показал значительную степень ингибирования перекисного окисления липидов, индуцированного аскорбатом-Fe 2+ , в мембранах наружных сегментов палочек, которая была в 10 раз выше, чем наблюдаемая в присутствии токоферола или ретинилпальмитата. Ингибирование перекисного окисления липидов мембран наружных сегментов палочек альфа-токоферолом и ретинилпальмитатом было почти линейным для концентрации до 0,5 мкмоль витамина / мг мембранного белка, тогда как полностью транс-ретинол демонстрировал линейность до 0,1 мкмоль витамина / мг мембранного белка.Инкубация внешних сегментов палочек с увеличивающимся количеством низкомолекулярных цитозольных белков, несущих I- [ 14 C] линолевую кислоту, [3H] ретинилпальмитат или [3H] полностью транс-ретинол, во время процесса перекисного окисления липидов приводила к чистому переносу лиганда из растворимого белка в мембраны. Линолевая кислота в 4 раза эффективнее переносилась на мембраны наружных сегментов стержня, чем полностью транс-ретинол или ретинилпальмитат. Инкубация наружных сегментов палочек с делипидированными низкомолекулярными цитозольными белками вызывает ингибирование перекисного окисления липидов.Ингибирующий эффект усиливался при использовании фракции растворимого белка сетчатки, содержащей альфа-токоферол. Эти данные убедительно подтверждают роль полностью транс-ретинола как основного антиоксиданта сетчатки и открывают путь для многих плодотворных исследований взаимодействия и точной роли низкомолекулярных цитозольных белков сетчатки, участвующих в связывании антиоксидантных гидрофобных соединений с наружным стержнем. сегменты [37].
6,8. Изменения n-6 и n-3 полиненасыщенных жирных кислот во время перекисного окисления липидов митохондрий, полученных из печени и нескольких областей мозга крысы: эффект альфа-токоферола
Эффект внутрибрюшинного введения альфа-токоферола (100 мг / кг веса / 24 ч) на аскорбате- (0–0.4 мМ) индуцированное перекисное окисление липидов митохондрий, выделенных из печени, полушарий головного мозга, ствола мозга и мозжечка крыс. Вызванное аскорбатом световое излучение в митохондриях печени почти полностью ингибировалось альфа-токоферолом (контрольная группа: 114,32 ± 14,4; группа витамина Е: 17,45 ± 2,84, импульсов в минуту × 10 -4 ). В митохондриях головного мозга 0,2 мМ аскорбат вызывал максимальную хемилюминесценцию, и существенных различий между обеими группами не наблюдалось. При сравнении трех областей мозга не наблюдалось значительных различий в значениях хемилюминесценции между контрольной группой и группами, получавшими витамин Е.Световое излучение, производимое митохондриальными препаратами, было намного выше в полушариях головного мозга, чем в стволе мозга и мозжечке. В митохондриях печени и головного мозга контрольной группы значительно снизился уровень арахидоновой кислоты (C20: 4-n-6) и докозагексаеновой кислоты (C22: 6-n-3). Докозагексаеновая в митохондриях печени из группы витамина Е снизилась на 30% при лечении аскорбиновой кислотой по сравнению с митохондриями, не содержащими аскорбиновой кислоты. В результате лечения витамином E в митохондриях печени крыс было обнаружено значительное увеличение C22: 6-n-3 (контрольная группа: 6.42 ± 0,12; группа витамина Е: 10,52 ± 0,46). Соотношение концентраций альфа-токоферола в митохондриях крыс, получавших витамин Е, и контрольных крыс было следующим: печень — 7,79; полушария головного мозга 0,81; ствол мозга — 0,95; мозжечок, 1,05. В митохондриях печени витамин E защищает от окислительного повреждения. Кроме того, концентрация витамина Е может увеличиваться в печени, но не в митохондриях мозга. Перекисное окисление липидов затронуло в основном арахидоновую (C20: 4-n-6) и докозагексаеновую (C22: 6-n-3) кислоты [38].
6.9. Легочный поверхностно-активный белок А ингибирует перекисное окисление липидов, стимулируемое гидропероксидом линолевой кислоты митохондрий и микросом легких крысы.
Реактивные формы кислорода играют важную роль в нескольких острых повреждениях легких. Ткань легких содержит полиненасыщенные жирные кислоты (ПНЖК), которые являются субстратами перекисного окисления липидов, что может привести к потере функциональной целостности клеточных мембран. В этом исследовании мы сравниваем in vitro защитный эффект легочного сурфактантного белка A (SP-A), очищенного из свиного сурфактанта, против перекисного окисления липидов аскорбат-Fe 2+ , стимулированного гидропероксидом линолевой кислоты (LHP) митохондрий и микросом. выделен из легкого крысы; лишенные аскорбата и LHP органеллы использовали в качестве контроля.Процесс измеряли одновременно по хемилюминесценции, а также по разложению PUFA общих липидов, выделенных из этих органелл. Добавление LHP к митохондриям или микросомам легких крысы вызывает заметное увеличение светового излучения; наибольшее значение активации было получено в микросомах (общая хемилюминесценция: 20,015 ± 1,735 × 10 5 имп / мин). Ингибирование перекисного окисления липидов (уменьшение хемилюминесценции) наблюдалось при добавлении возрастающих количеств (2.От 5 до 5,0 мкг) SP-A в митохондриях легких крысы и от 2,5 до 7,5 мкг SP-A в микросомах легких крысы. Тормозящий эффект достигает наибольших значений в митохондриях; таким образом, 5,0 мкг SP-A вызывают 100% ингибирование в этих мембранах, тогда как 7,5 мкг SP-A вызывают ингибирование 51,25 ± 3,48% в микросомах. Основное различие в жирнокислотном составе общих липидов, выделенных из нативных и перекисленных мембран, было обнаружено в содержании арахидоновой кислоты, которое снизилось с 9.От 68 ± 1,60% в нативной группе до 5,72 ± 1,64% в перекисленных митохондриях и от 7,39 ± 1,14% до 3,21 ± 0,77% в микросомах. Эти изменения были менее выражены в мембранах, обработанных SP-A; Например, в присутствии 5,0 мкг SP-A мы наблюдали общую защиту 20: 4 n-6 (9,41 ± 3,29%) в митохондриях, тогда как 7,5 мкг SP-A обеспечивали 65% защиту в микросомах. (5,95 ± 0,73%). В этих экспериментальных условиях SP-A оказывает меньшее ингибирующее действие на микросомы, чем на митохондрии.Были проведены дополнительные исследования перекисного окисления липидов митохондрий или микросом легких крыс с использованием равных количеств альбумина и даже большего количества по сравнению с SPA. Наши результаты показывают, что в наших экспериментальных условиях БСА не мог ингибировать перекисное окисление липидов, стимулированное гидропероксидом линолевой кислоты митохондрий или микросом легких крыс, что указывает на то, что этот эффект специфичен для SP-A [39].
Интерпретация этих данных, как мы увидим ниже, не так проста, как кажется.
7. Исследования с птицами
Полиненасыщенные жирные кислоты более восприимчивы к повреждению, вызванному реактивными формами кислорода, и чувствительность к перекисному окислению липидов возрастает в зависимости от количества двойных связей [40–42]. Хотя многие исследования проводились на млекопитающих, на птицах работ мало. Учитывая, что птицы являются исключением, поскольку они сочетают в себе высокий уровень метаболизма и максимальную продолжительность жизни, очень интересно изучить чувствительность мембран птиц к перекисному окислению липидов.Предыдущие работы демонстрируют, что митохондриальные мембраны различных тканей птиц по сравнению с млекопитающими аналогичного размера обладают низкой степенью ненасыщенности жирных кислот и более устойчивы к перекисному окислению липидов. Однако связь между чувствительностью к перекисному окислению липидов и размером тела до сих пор неизвестна, и это цель настоящего исследования. Исследование было выполнено с использованием митохондрий и микросом, выделенных из мозга следующих птиц: манона, перепела, голубь, утка и гусь.
Птицы производят незначительное количество митохондриальных активных форм кислорода (АФК) за счет потребляемой единицы кислорода [43, 44] и имеют митохондриальные мембраны, которые менее восприимчивы к повреждению, вызванному перекисным окислением липидов. АФК в основном атакуют атомы углерода, расположенные между двумя двойными связями; насыщенные и мононенасыщенные жирные кислоты не имеют такой конфигурации углерода в ацильных цепях и в значительной степени не подвержены влиянию ROS, тогда как цепи полиненасыщенных жирных кислот очень уязвимы для перекисного окисления липидов; этот процесс является автокаталитическим и вызывает необратимые повреждения мембраны и соседних клеточных структур.Восприимчивость мембран к окислительному повреждению определяется составом жирных кислот [42, 44–46].
Хотя с 1990 года птицы были выдающимися в литературе в качестве моделей для исследований старения, как в лабораторных, так и в полевых условиях; качество этих исследований варьируется. Наиболее интенсивные исследования старения по-прежнему ограничиваются несколькими видами [47].
Целью наших исследований с птицами было изучение взаимосвязи между размером тела, составом жирных кислот, MLSP и чувствительностью к перекисному окислению липидов митохондрий и микросом, выделенных из органелл разных видов птиц: манона, перепела, голубя, утки и т. Д. и гусь, представляющий 372-кратный диапазон массы тела.
Птицы — особенно долгоживущие виды — обладают специальными приспособлениями для предотвращения повреждения тканей, вызванного активными формами кислорода. Многие отчеты продемонстрировали, что птицы демонстрируют низкую степень ненасыщенности жирных кислот и перекисного окисления липидов по сравнению с млекопитающими аналогичного размера.
7.1. Неферментативное перекисное окисление липидов микросом и митохондрий, выделенных из печени и сердца голубя и крысы
Исследования были проведены для определения уровня аскорбата-Fe 2+ -зависимого перекисного окисления липидов митохондрий и микросом, выделенных из печени и сердца крысы и голубь.Измерения хемилюминесценции показывают, что процесс перекисного окисления липидов был более эффективным в митохондриях и микросомах из печени крысы, чем в тех же органеллах, полученных из голубя. Как в митохондриях, так и в микросомах печени обоих видов наблюдалось значительное снижение содержания арахидоновой кислоты во время перекисного окисления. Скорость C18: 2 n-6 / C20: 4 n-6 была в 4,5 раза выше у голубя, чем в печени крысы. Это наблюдение может объяснить различия, отмеченные при анализе светового излучения и индекса ненасыщенности обоих видов.Значительное уменьшение C18: 2 n-6 и C20: 4 n-6 в митохондриях печени голубя наблюдалось по сравнению с нативными органеллами, тогда как в микросомах печени голубя уменьшалось только C20: 4 n-6. В митохондриях печени крысы только арахидоновая кислота C20: 4 n-6 показала значительное снижение, тогда как в микросомах печени крысы C20: 4 n-6 и C22: 6 n-3 значительно снизились. Однако изменений в профиле жирных кислот митохондрий и микросом, выделенных из сердца голубя, не наблюдалось. В сердце в условиях перекисного окисления профиль жирных кислот, по-видимому, не отвечает за различную восприимчивость к процессу перекисного окисления липидов.Отсутствие связи между ненасыщенностью жирных кислот и чувствительностью к перекисному окислению, наблюдаемое в сердце, предполагает, что другие факторы могут участвовать в защите от перекисного окисления липидов в микросомах и митохондриях, изолированных от сердца [46].
7.2. Профили жирных кислот и перекисное окисление липидов микросом и митохондрий из печени, сердца и мозга
Cairina moschataИсследования были проведены для анализа состава жирных кислот и чувствительности к перекисному окислению липидов (LP) митохондрий и микросом из печени, сердца утки. , и мозг.Состав жирных кислот митохондрий и микросом зависит от ткани. В частности, арахидоновая кислота составляла 17,39 ± 2,32, 11,75 ± 3,25 и 9,70 ± 0,40% от общего количества жирных кислот в митохондриях сердца, печени и мозга, соответственно, но только 13,39 ± 1,31, 8,22 ± 2,43 и 6,44 ± 0,22% от общего количества жирных кислот. общее количество жирных кислот в микросомах сердца, печени и мозга, соответственно. Докозагексаеновая кислота составляла 17,02 ± 0,78, 4,47 ± 1,02 и 0,89 ± 0,07% от общего количества жирных кислот в митохондриях мозга, печени и сердца соответственно, но только 7.76 ± 0,53, 3,27 ± 0,73 и 1,97 ± 0,38% от общего количества жирных кислот в микросомах мозга, печени и сердца. Инкубация органелл с аскорбатом-Fe 2+ при 37 ° C вызвала стимуляцию LP, на что указывает увеличение светового излучения (хемилюминесценция (CL)) и снижение содержания арахидоновой кислоты до 5,17 ± 1,34, 8,86 ± 0,71 и 5,86 ± 0,68% от общего количества жирных кислот в митохондриях сердца, печени и мозга соответственно и до 4,10 ± 0,61 в микросомах печени. После ЛП докозагексаеновая кислота снизилась до 7.29 ± 1,47, 1,36 ± 0,18 и 0,30 ± 0,11% от общего количества жирных кислот в митохондриях мозга, печени и сердца. Статистически значимых различий в процентном содержании обеих перекисляемых жирных кислот (арахидоновой и докозагексаеновой) не наблюдали в микросомах сердца и мозга, и это совпадало с отсутствием стимуляции LP. Результаты указывают на тесную взаимосвязь между чувствительностью тканей к LP in vitro и концентрацией длинноцепочечных полиненасыщенных жирных кислот. Тем не менее, любой окислительный стресс in vitro, вызванный аскорбатом-Fe 2+ при 37 ° C, по-видимому, предотвращает деградацию арахидоновой и докозагексаеновой кислот в микросомах печени и мозга утки.Возможно, что из-за важных физиологических функций арахидоновой и докозагексаеновой кислот в этих тканях они защищены, чтобы поддерживать содержимое мембраны во время окислительного стресса [48].
7.3. Состав жирных кислот и перекисное окисление липидов, вызванное аскорбатом-Fe
2+ в различных органах гуся ( Anser anser )Во многих сообщениях показано, что птицы демонстрируют низкую степень ненасыщенности жирных кислот и перекисного окисления липидов по сравнению с млекопитающими аналогичного вида. размер тела.Целью настоящего исследования было изучить профили жирных кислот, неферментативное перекисное окисление липидов и уровни витамина Е в митохондриях и микросомах, полученных из печени, сердца и мозга гуся ( Anser anser ). Содержание ненасыщенных жирных кислот в митохондриях и микросомах всех исследованных тканей составляло примерно 60% с преобладанием C18: 1 n-9 + C18: 2 n-6 = 50%. Содержание 20: 4 n-6 + C22: 6 n-3 было значительно выше в органеллах мозга (приблизительно 16%) по сравнению с митохондриями и микросомами печени и сердца (прибл.4%). В то время как эти органеллы не подвергались воздействию перекисного окисления липидов, митохондрии головного мозга были сильно затронуты, на что указывало усиление хемилюминесценции и значительное снижение содержания арахидоновой и докозагексаеновой кислот. Эти изменения не наблюдались при перекисном окислении липидов микросом мозга. Содержание витамина Е в печени и сердце было выше, чем в митохондриях мозга (1,77 ± 0,06 и 1,93 ± 0,13 против 0,91 ± 0,09 нмоль / мг белка). Главный вывод этой статьи состоит в том, что более низкая степень ненасыщенности жирных кислот в митохондриях печени и сердца и более высокий уровень витамина Е, чем в митохондриях мозга, защищают эти ткани от перекисного окисления липидов [49].
7.4. Низкая степень ненасыщенности жирных кислот приводит к высокой устойчивости к перекисному окислению липидов в митохондриях и микросомах различных органов перепела (
Coturnix coturnix japonica )Птицы — особенно долгоживущие виды — имеют особые приспособления для предотвращения повреждения тканей, вызванного реактивным действием. формы кислорода. Целью настоящего исследования был анализ жирнокислотного состава и неферментативного перекисного окисления липидов митохондрий и микросом, полученных из печени, сердца и мозга перепела ( Coturnix coturnix japonica ), птицы-короткоживущей птицы.Жирные кислоты, расположенные в общих липидах печени, сердца и митохондрий и микросом крыс, определяли с помощью газовой хроматографии, а перекисное окисление липидов оценивали с помощью хемилюминесцентного анализа. Содержание ненасыщенных жирных кислот в митохондриях и микросомах всех исследованных тканей составляло приблизительно 50 и 40% соответственно с преобладанием C18: 1 n-9. Содержание C18: 2 n-6 в митохондриях мозга было значительно ниже по сравнению с митохондриями печени и сердца. В то время как содержание C20: 4 n-6 в митохондриях всех исследованных тканей и микросом мозга составляло приблизительно 6%, микросомы печени и сердца имели более низкие значения.C22: 6 n-3 отсутствовал в митохондриях печени, очень низкое содержание в микросомах печени и органеллах сердца (от 0,5 до 1%) и высокое содержание в органеллах мозга, причем митохондрии имеют наибольшее значение (11%). В то время как органеллы печени и сердца не были затронуты при перекисном окислении липидов, митохондрии мозга были сильно затронуты, на что указывает увеличение хемилюминесценции и значительное уменьшение C20: 4 n-6 и C22: 6 n-3. Эти результаты показывают, что низкая степень ненасыщенности жирных кислот в органеллах печени и сердца перепелов, недолговечных птиц, может дать преимущество за счет снижения их чувствительности к процессу перекисного окисления липидов [50].
7,5. Неферментативное перекисное окисление липидов микросом и митохондрий из печени, сердца и мозга птицы
Lonchura striata : Взаимосвязь с составом жирных кислотЦелью этого исследования было изучить состав жирных кислот и неферментативное перекисное окисление липидов (LP) митохондрий. и микросомы, полученные из печени, сердца и мозга Lonchura striata . Доля общих ненасыщенных жирных кислот составляла примерно 30-60% в органеллах всех исследованных тканей.Митохондрии головного мозга и обе органеллы печени показали самый высокий процент полиненасыщенных жирных кислот (ПНЖК) (30 и 18% соответственно). Содержание арахидоновой кислоты (АК) составляло 7% в митохондриях печени и мозга и 3% в митохондриях сердца. Процент докозагексановой кислоты (DHA) составлял 8% в митохондриях мозга и примерно 2-3% в митохондриях сердца и печени. Индекс перекисной способности митохондрий мозга и обеих органелл печени был выше, чем у органелл сердца и микросом мозга.Органеллы печени и митохондрии мозга были затронуты LP, на что указывало увеличение хемилюминесценции и уменьшение AA и DHA. Эти изменения не наблюдались при ЛП микросом мозга и обеих органелл сердца. Эти результаты показывают (1) PI положительно коррелирует с процентным содержанием PUFA и LP; (2) резистентность к LP, обнаруженная в органеллах сердца, будет способствовать защите сердца от окислительного повреждения [51].
7.6. Аллометрическое исследование жирных кислот и чувствительности к перекисному окислению липидов микросом мозга и митохондрий, выделенных от разных видов птиц
Целью этого исследования было изучить взаимосвязь между размером тела, составом жирных кислот и чувствительностью митохондрий и микросом к перекисному окислению липидов. выделены из мозга различных видов птиц: манона, перепела, голубя, утки и гуся, представляющих 372-кратный диапазон массы тела.Жирные кислоты общих липидов определяли с помощью газовой хроматографии, а перекисное окисление липидов оценивали с помощью хемилюминесцентного анализа. Аллометрическое исследование жирных кислот, присутствующих в митохондриях и микросомах мозга различных видов птиц, показало небольшое количество значимых аллометрических тенденций. В митохондриях процент мононенасыщенных жирных кислот был значительно ниже у более крупных птиц (;). Значительное аллометрическое увеличение содержания 18: 2 n-6 линолевой кислоты (;), полиненасыщенных (;) и общих ненасыщенных (;) в микросомах мозга, но не в митохондриях, может указывать на преимущественное включение этой жирной кислоты в эндоплазматический ретикулум головного мозга. более крупные виды птиц.В мозге всех исследованных птиц было высокое содержание докозагексаеновой кислоты. Однако митохондрии мозга, но не микросомы, изолированные от всех проанализированных птиц, показали значительное снижение арахидоновой и докозагексаеновой кислот во время перекисного окисления липидов. Аллометрические анализы хемилюминесценции не были статистически значимыми. В заключение, наши результаты показывают отсутствие корреляции между чувствительностью митохондрий и микросом к перекисному окислению липидов с размерами тела и максимальной продолжительностью жизни [52].
7,7. Высокая устойчивость к перекисному окислению липидов митохондрий и микросом сердца птиц: влияние массы и максимальной продолжительности жизни
Целью данного исследования было изучение связи между размером тела, составом жирных кислот и чувствительностью к перекисному окислению липидов митохондрий сердца и микросом, выделенных из виды птиц разного размера: манон ( Lonchura striata ), перепел ( Coturnix coturnix var. japonica ), голубь ( Columba livia ), утка ( Cairina moschata ) и гусь ( Anser) представляет собой 372-кратный диапазон массы тела.Жирные кислоты общих липидов определяли с помощью газовой хроматографии, а перекисное окисление липидов оценивали с помощью хемилюминесцентного анализа. Жирные кислоты, присутствующие в органеллах сердца различных проанализированных видов птиц, показали небольшое количество значимых аллометрических тенденций. В митохондриях, исходя из индивидуальных данных по жирным кислотам, пальмитолеиновая кислота (C16: 1 n-7) увеличивалась аллометрически (), в то время как стеариновая кислота (C18: 0) была отрицательно связана с массой тела (). Интересно, что ни одна из рассчитанных переменных жирных кислот, средних значений насыщенных, мононенасыщенных и полиненасыщенных жирных кислот (ПНЖК) и индекса ненасыщенности (UI) не показывала значительных вариаций, связанных с размером тела.В микросомах сердца содержание C18: 0 было значительно меньше () у птиц большего размера. Значительное аллометрическое увеличение линолевой кислоты (C18: 2 n-6) (), полиненасыщенных () и UI () наблюдалось у более крупных птиц. Общее количество n-6 жирных кислот митохондрий сердца не показало значимых различий, когда оно было коррелировано с массой тела птиц. Более того, для микросом были показаны положительные аллометрические отношения. Общие n-3 жирные кислоты митохондрий и микросом сердца не показали значимой корреляции с массой тела птиц.C16: 1 n-7, C18: 0 в митохондриях и C18: 0, C18: 2 n-6, PUFA, UI и PUFA n-6 в микросомах показали значительные различия, когда они коррелировали с максимальной продолжительностью жизни (MLSP). птиц. Поскольку световое излучение (хемилюминесценция), исходящее от сердечных органелл, не было статистически значимым, было получено отсутствие корреляции между чувствительностью к перекисному окислению липидов и размером тела или максимальной продолжительностью жизни. Эти результаты показывают, что высокая устойчивость птичьих сердец к атаке свободных радикалов не зависит от размера тела и может быть связана с сохранением сердечной функции [53].
8. Исследования с сетчаткой.
Сетчатка очень богата мембранами, содержащими полиненасыщенные жирные кислоты. Активные формы кислорода инициируют цепные реакции перекисного окисления липидов, которые повреждают сетчатку, особенно мембраны, которые играют важную роль в зрительной функции. Кроме того, биомолекулы, такие как белки или амино-липиды, можно ковалентно модифицировать продуктами разложения липидов. В мембранах сетчатки перекисное окисление липидов также обычно сопровождается окислением мембранных белков.Как следствие, перекисное окисление липидов может изменить расположение белков в бислоев и тем самым нарушить их физиологическую роль в функции мембраны. Здесь мы описываем несколько исследований перекисного окисления липидов мембранных фосфолипидов в сетчатке. Особое внимание уделяется молекулярным изменениям полиненасыщенных жирных кислот с очень длинной цепью, связанным с модификациями белков во время перекисного окисления мембран фоторецепторов. Кроме того, мы используем липосомы для анализа перекисного окисления липидов сетчатки.Конъюгированные диены, образованные из окисленных ПНЖК и продуктов TBARS, полученных в результате расщепления этих жирных кислот, расположенных в фосфолипидах, могут быть проанализированы во время перекисного окисления липидов липосом, состоящих из липидов сетчатки, с использованием Fe 2+ и Fe 3+ в качестве инициаторов.
Перекисное окисление полиненасыщенных жирных кислот (ПНЖК) в двухслойных липидных мембранах вызывает потерю текучести, падение мембранного потенциала, повышенную проницаемость для протонов и ионов кальция и, в конечном итоге, разрушение клеточных мембран из-за клеточных деформаций.Структурная и функциональная целостность клеточных мембран необходима для передачи сигналов, молекулярного распознавания и транспорта, клеточного метаболизма и т. Д. Ущерб, нанесенный биологическим системам реактивными формами кислорода, вовлечен в многочисленные патологические процессы, включая воспаление, дегенеративные заболевания, образование опухолей и вовлечен в физиологические явления, такие как старение. Инициирование — самая важная фаза перекисного окисления липидов, особенно в клеточном контексте; Профилактическая терапия заболеваний, связанных с перекисным окислением липидов, будет нацелена на процесс инициации.Действительно, многие глазные заболевания, включая глаукому, катаракту, диабетическую ретинопатию и дегенерацию сетчатки, приписываются процессам перекисного окисления липидов. Из-за интенсивного воздействия света и кислорода и высокого содержания в них ПНЖК, склонного к перекисному окислению липидов, сетчатка очень восприимчива к окислительному стрессу [54].
8.1. Липопероксидирование внешних сегментов палочек сетчатки крупного рогатого скота ингибируется растворимыми связывающими белками жирных кислот
В настоящем исследовании изучали, проявляют ли растворимые связывающие белки жирных кислот (FABP), присутствующие в нервной сетчатке, защиту от липопероксидации палочек in vitro. мембраны наружного сегмента (АФК).После инкубации АФК в системе аскорбат-Fe ++ при 37 ° C в течение 90–120 мин было обнаружено, что общее число импульсов в минуту, обусловленное эмиссией света (хемилюминесценция), было ниже в тех мембранах, которые инкубировались в присутствии растворимого связывания. белки для жирных кислот. Состав жирных кислот мембран наружных сегментов стержней был существенно изменен при неферментативном липопероксидировании со значительным снижением содержания докозагексаеновой кислоты (22: 6 n-3) и арахидоновой кислоты (20: 4 n-6).В результате индекс ненасыщенности — параметр, основанный на максимальной скорости окисления определенных жирных кислот, был выше в нативной и контрольной мембранах по сравнению с перекисными мембранами. Подобное снижение хемилюминесценции наблюдалось при добавлении возрастающих концентраций нативного или делипидированного FABP ретиналя, содержащих фракции, к мембранам наружных сегментов стержней. Эти результаты показывают, что растворимые белки со свойствами связывания жирных кислот могут действовать как антиоксидант, защищающий мембраны наружных сегментов стержней от вредного воздействия [55].
8.2. Влияние альфа-токоферола, полностью-транс-ретинола и ретинилпальмитата на неферментативное перекисное окисление липидов внешних сегментов стержня
Влияние токоферола, полностью-транс-ретинола и ретинилпальмитата на неферментативное перекисное окисление липидов, вызванное аскорбатом-Fe Исследовали 2+ мембран наружных сегментов палочек, выделенных из сетчатки крупного рогатого скота. Ингибирование излучения света (максимальная индуцированная хемилюминесценция) альфа-токоферолом, полностью транс-ретинолом и ретинилпальмитатом зависело от концентрации.Весь транс-ретинол показал значительную степень ингибирования перекисного окисления липидов, индуцированного аскорбатом-Fe 2+ , в мембранах наружных сегментов палочек, которая была в 10 раз выше, чем наблюдаемая в присутствии токоферола или ретинилпальмитата. Ингибирование перекисного окисления липидов мембран наружных сегментов палочек альфа-токоферолом и ретинилпальмитатом было почти линейным для концентрации до 0,5 мкмоль витамина / мг мембранного белка, тогда как полностью транс-ретинол демонстрировал линейность до 0,1 мкмоль витамина / мг мембранного белка.Инкубация наружных сегментов палочек с увеличивающимся количеством низкомолекулярных цитозольных белков, несущих I- [ 14 C] линолевую кислоту, [3H] ретинилпальмитат или [3H] полностью транс-ретинол, во время процесса перекисного окисления липидов приводит к образованию сети перенос лиганда с растворимого белка на мембраны. Линолевая кислота в 4 раза эффективнее переносилась на мембраны наружных сегментов стержня, чем полностью транс-ретинол или ретинилпальмитат. Инкубация наружных сегментов палочек с делипидированными низкомолекулярными цитозольными белками вызывает ингибирование перекисного окисления липидов.Ингибирующий эффект усиливался при использовании фракции растворимого белка сетчатки, содержащей альфа-токоферол. Эти данные убедительно подтверждают роль полностью транс-ретинола как основного антиоксиданта сетчатки и открывают путь для многих плодотворных исследований взаимодействия и точной роли низкомолекулярных цитозольных белков сетчатки, участвующих в связывании антиоксидантных гидрофобных соединений с наружные сегменты стержня [56].
8.3. Селективное ингибирование неферментативного перекисного окисления липидов фосфатидилсерина во внешних сегментах стержня с помощью альфа-токоферола
. В настоящем исследовании было исследовано, проявляет ли альфа-токоферол защиту от перекисного окисления липидов in vitro фосфолипидов, расположенных в мембранах наружных сегментов стержней (ROS).После инкубации ROS в системе аскорбат-Fe 2+ при 37 ° C в течение 160 мин было обнаружено, что общее число импульсов в минуту, вызванное световым излучением (хемилюминесценция), было ниже на мембранах, инкубированных в присутствии альфа-токоферола. Состав жирных кислот общих липидов, выделенных из мембран наружных сегментов палочек, был существенно изменен при неферментативном перекисном окислении липидов со значительным снижением содержания докозагексаеновой кислоты (22: 6 n-3). Включение альфа-токоферола (0.35 микромоль / мг белка) вызывает 43,37% ингибирования процесса перекисного окисления липидов, оцениваемого как хемилюминесценция (общее число импульсов в минуту, возникшее за 160 мин). Виды фосфолипидов, содержащие наибольшее количество докозагексаеновой кислоты, фосфатидилэтаноламина и фосфатидилсерина, были затронуты в большей степени, чем фосфатидилхолин, во время процесса перекисного окисления липидов. Однако не все фосфолипиды были одинаково защищены после добавления альфа-токоферола в среду инкубации. Фосфатидилхолин и фосфатидилэтаноламин не были защищены альфа-токоферолом; витамин обеспечивает селективную антиоксидантную защиту только для фосфатидилсерина.Эти результаты показывают, что альфа-токоферол может действовать как антиоксидант, защищающий мембраны наружных сегментов палочек от вредного воздействия посредством селективного механизма, который уменьшает потерю докозагексаеновой кислоты из фосфатидилсерина [57].
8.4. Белок, связывающий жирные кислоты сетчатки, снижает перекисное окисление липидов, стимулируемое гидропероксидами длинноцепочечных жирных кислот на внешних сегментах стержня
В настоящем исследовании мы исследовали эффект частично очищенного белка, связывающего жирные кислоты сетчатки (FABP), против неферментативного перекисного окисления липидов, стимулированного гидропероксидами. происходит из жирных кислот на мембранах наружного сегмента палочек (АФК).Гидропероксид линолевой кислоты (LHP), гидропероксид арахидоновой кислоты (AHP) и гидропероксид докозагексаеновой кислоты (DHP) получали из линолевой кислоты, арахидоновой кислоты и докозагексаеновой кислоты, соответственно, с помощью липоксидазы. Перекисное окисление мембран АФК проводили с использованием экспериментальной системы аскорбат-Fe + 2 . Изучено влияние на перекисное окисление АФК, содержащих различные количества гидропероксидов липидов (LOOH); АФК, лишенные экзогенно добавленного LOOH, использовали в качестве контроля. Процесс разложения измеряли одновременно путем определения хемилюминесценции и жирнокислотного состава общих липидов, выделенных из ROS.Добавление гидропероксидов к ROS привело к заметному увеличению светового излучения. Это увеличение зависело от концентрации гидропероксида. Наибольшее значение активации было произведено DHP. Уменьшение процента более полиненасыщенных жирных кислот (ПНЖК) (20: 4 n-6 и 22: 6 n-3) использовали для оценки изменений жирных кислот, наблюдаемых во время процесса. Мы сравнили жирнокислотный состав общих липидов, выделенных из природных АФК и пероксидированных АФК, которые инкубировали с гидропероксидами и без них.Основное различие в составе жирных кислот было обнаружено в содержании докозагексаеновой кислоты, которое снизилось на 45,51 ± 1,07% в группе, получавшей пероксид, по сравнению с нативными АФК; снижение было еще выше, 81,38 ± 1,11%, когда перекисное окисление липидов стимулировалось DHP. FABP сетчатки был частично очищен от цитозоля сетчатки. Впоследствии мы измерили его влияние на реакцию перекисного окисления липидов, вызванную LOOH. В результате мы наблюдали уменьшение хемилюминесценции (ингибирование перекисного окисления липидов) при добавлении возрастающих количеств (0.От 2 до 0,6 мг) FABP сетчатки до АФК. Ингибирующий эффект достигает максимального значения в присутствии ДГП (41,81 ± 10,18%). В этих условиях бычий сывороточный альбумин (БСА) оказывает меньшее ингибирующее действие (20,2 ± 7,06%), чем FABP [58].
8.5. Перекисное окисление, стимулированное гидропероксидами липидов на митохондриях пигментного эпителия сетчатки крупного рогатого скота: влияние клеточного ретинол-связывающего белка
В этом исследовании анализируется влияние клеточного ретинол-связывающего белка (CRBP), частично очищенного из цитозоля пигментного эпителия сетчатки (RPE), на неферментативный липидный липид. индуцируется гидропероксидами жирных кислот митохондриальных мембран, выделенных из бычьего РПЭ.Изучено влияние различных количеств (50, 75 и 100 нмоль) гидропероксида линолевой кислоты (LHP), гидропероксида арахидоновой кислоты (AHP) и гидропероксида докозагексаеновой кислоты (DHP) на перекисное окисление липидов митохондрий RPE; Митохондрии РПЭ, лишенные экзогенно добавленного гидропероксида, использовали в качестве контроля. Процесс измеряли одновременно путем определения хемилюминесценции, а также деградации полиненасыщенных жирных кислот (ПНЖК) общих липидов, выделенных из митохондрий РПЭ. Добавление гидропероксидов к митохондриям RPE вызывает заметное увеличение светового излучения, которое зависит от концентрации гидропероксида.Наибольшее значение активации было произведено LHP. Основное различие в жирнокислотном составе общих липидов, выделенных из нативных и пероксидированных митохондрий РПЭ, инкубированных с гидропероксидами и без них, было обнаружено в содержании докозагексаеновой кислоты, которое снизилось на 40,90 ± 3,01% в группе пероксидированных по сравнению с митохондриями нативных РПЭ. Снижение было значительно большим: 86,32 ± 2,57%, когда перекисное окисление липидов стимулировалось 100 нмоль LHP. Ингибирование перекисного окисления липидов (уменьшение хемилюминесценции) наблюдалось при добавлении возрастающих количеств (100-600 мкг) CRBP к митохондриям РПЭ.Ингибирующий эффект достигает максимальных значений в присутствии LHP [59].
8.6. Защитное действие индолеаминов на аскорбат-Fe in vitro
2+ -зависимое перекисное окисление липидов мембран внешнего сегмента стержня сетчатки крупного рогатого скотаМембраны внешнего сегмента стержня (ROS) очень уязвимы к автоокислению из-за высокого содержания в них длинноцепочечных полиненасыщенных жирные кислоты (ПНЖК). Мелатонин и N-ацетилсеротонин — это индоламины, синтезируемые в шишковидной железе [60, 61], сетчатке и других тканях.Эти соединения являются поглотителями свободных радикалов и косвенными антиоксидантами из-за их стимулирующего действия на антиоксидантные ферменты. Мы сравнили in vitro защитное действие мелатонина и N-ацетилсеротонина на индуцированное аскорбатом-Fe 2+ перекисное окисление липидов ПНЖК, расположенных в мембранах АФК. Этот процесс измеряли по хемилюминесценции и жирнокислотному составу общих липидов АФК. Мы исследовали возрастающие концентрации мелатонина (0–10 мМ) и N-ацетилсеротонина (0–2 мМ). В обоих случаях было обнаружено, что общее число импульсов в минуту, вызванное излучением света (хемилюминесценция), было ниже на тех мембранах, инкубированных в присутствии мелатонина или N-ацетилсеротонина, которые уменьшались пропорционально концентрации индола.Таким образом, 10 мМ мелатонин и 2 мМ N-ацетилсеротонин вызывали снижение общей хемилюминесценции (перекисного окисления липидов) на 51 ± 6 и 100% соответственно. Мы также заметили защиту ПНЖК: содержание докозагексаеновой кислоты значительно снижалось, когда мембраны подвергались окислительному повреждению. Это снижение составило от 37,6 ± 2,1% в нативных мембранах до 6,2 ± 0,8% в мембранах, подвергшихся перекисному окислению. Эти изменения были менее выражены в обработанных мембранах ROS; Например, в присутствии 10 мМ мелатонина или 2 мМ N-ацетилсеротонина мы наблюдали сохранение содержания 22: 6 n-3 (23.6 ± 1,2 и 39,1 ± 1,2% соответственно). Концентрация каждого соединения, необходимая для ингибирования 50% перекисного окисления липидов (IC50), составляла 9,82 мМ для мелатонина и 0,43 мМ для N-ацетилсеротонина, соответственно. N-ацетилсеротонин проявляет защитный эффект примерно в 20 раз выше, чем мелатонин [60].
8,7. Модификации липидных белков во время аскорбата-Fe
2+ Перекисное окисление фоторецепторных мембран: защитный эффект мелатонинаМембраны наружного сегмента стержня (ROSg) по существу представляют собой липопротеиновые комплексы.Родопсин, основной интегральный белок ROSg, окружен фосфолипидами, высоко обогащенными докозагексаеновой кислотой (22: 6 n-3). Эта жидкая среда играет важную роль в конформационных изменениях после фотоактивации. Таким образом, мембраны ROSg очень чувствительны к окислительному повреждению. Мелатонин, синтезируемый в шишковидной железе, сетчатке и других тканях, является акцептором свободных радикалов. Основной целью данной работы было изучение изменений в мембранах ROSg, выделенных из сетчатки крупного рогатого скота, подвергнутых неферментативному перекисному окислению липидов (индуцированному аскорбатом-Fe 2+ ) в различные промежутки времени (0–180 мин).Окислительный стресс контролировали по увеличению хемилюминесценции и изменениям жирных кислот. Кроме того, мы исследовали защитный эффект 5 мМ мелатонина in vitro. Было обнаружено, что общее число импульсов в минуту, вызванное световым излучением (хемилюминесценция), было ниже на мембранах, инкубированных в присутствии мелатонина. Содержание докозагексаеновой кислоты значительно снижалось, когда мембраны подвергались окислительному повреждению. Это снижение составило от 35,5 ± 2,9% в нативных мембранах до 12,65 ± 1,86% в мембранах, подвергшихся перекисному окислению в течение 180 мин.В присутствии 5 мМ мелатонина мы наблюдали сохранение содержания 22: 6 n-3 (23,85 ± 2,77%) в то же время перекисного окисления. Одновременно с этим с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) изучали изменения мембранных белков при окислительном стрессе. Потеря сульфгидрильных групп белка и повышенное включение карбонильных групп использовались в качестве биомаркеров окисления белка. В мембранах, подвергнутых воздействию Fe 2+ -аскорбат, мы наблюдали снижение количества тиолов белка с 50.9 ± 3,38 в нативных мембранах до 1,72 ± 2,81 нмоль / мг белка через 180 мин перекисного окисления липидов, связанного с увеличением включения карбонильных групп в белки с 7,20 ± 2,50 до 12,50 ± 1,12 нмоль / мг белка. В SDS-PAGE мы наблюдали снижение содержания всех белков, в основном родопсина, как следствие перекисного окисления. Мелатонин предотвращает как перекисное окисление липидов, так и окисление белков [61, 62].
8,8. Fe
2+ и Fe 3+ Инициированное перекисное окисление обработанных ультразвуком и необработанных липосом, состоящих из липидов сетчатки в различных водных средахСетчатка очень восприимчива к окислительному повреждению из-за высокого содержания полиненасыщенных жирных кислот (ПНЖК), в основном докозагексаеновой кислота (22: 6 н-3).Считается, что процесс перекисного окисления липидов вовлечен во многие физиологические и патологические процессы. Многие модельные мембраны можно использовать, чтобы узнать больше о проблемах, которые нельзя изучать в биологических мембранах. Обработанные ультразвуком липосомы (SL) и необлученные липосомы (NSL), полученные из липидов, выделенных из сетчатки крупного рогатого скота и характеризующиеся динамическим светорассеянием, подвергали перекисному окислению липидов в атмосфере воздуха при 22 ° C с Fe 2+ или Fe 3+ . в качестве инициатора в различных водных средах.Конъюгированные диены и триены, определяемые по поглощению при 234 и 270 нм, соответственно, и вещества, реагирующие с тиобарбитуровой кислотой, измеряются как функция времени. Перекисное окисление SL или NSL, инициированное 25 мкМ Fe 2 SO 4 в 20 мМ Трис-HCl, pH 7,4, привело к увеличению продукции TBARS после лаг-фазы в течение 60 минут. Инкубация обоих типов липосом в воде приводила к сокращению лаг-фазы до 30 мин. Когда перекисное окисление липидов проводили в 0,15 М NaCl, лаг-фаза полностью исчезла.С другой стороны, FeCl 3 (25 мкМ) индуцировал ограниченную продукцию TBARS только сразу после 30 мин инкубации. Когда Fe 2+ — или Fe 3+ -липидное перекисное окисление обоих типов липосом проводили в воде или 0,15 М NaCl, образование конъюгированных диенов и конъюгированных триенов было выше, чем в реакциях, проводимых в 20 мМ Трис- HCl pH 7,4. Наши результаты показали, что оба типа липосом были чувствительны к инициированному Fe 2+ — и Fe 3+ перекисному окислению липидов.Однако Fe 2+ продемонстрировал явно усиленное влияние на скорость перекисного окисления и стационарную концентрацию продуктов окисления. Мы подтвердили, что на перекисное окисление липосом из липидов сетчатки влияет не только тип инициатора, но и водная среда. Эта модель представляет собой полезную систему для изучения образования промежуточных продуктов и продуктов перекисного окисления липидов в водной среде [63].
8.9. Мелатонин и структурные аналоги не обладают антиоксидантными свойствами на Fe
2+ — инициированное перекисное окисление обработанных ультразвуком липосом, состоящих из липидов сетчаткиМелатонин и его структурные аналоги проявляют антиоксидантную активность in vivo, но их активность в модельных мембранах не очень хорошо известна.В этом исследовании мы исследовали антиоксидантную способность мелатонина и структурных аналогов при инициированном Fe 2+ перекисном окислении обработанных ультразвуком липосом, состоящих из липидов сетчатки. Индоламины сравнивали с бутилированным гидрокситолуолом (BHT), который был выбран в качестве эталонного стандарта из-за его высокой антиоксидантной способности. После добавления Fe 2+ в качестве инициатора перекисного окисления липидов наблюдали быстрое образование конъюгированных диенов. При добавлении увеличивающихся концентраций BHT начало реакции откладывалось, и начальные скорости реакции были ниже.Однако это снижение не было пропорционально увеличению концентрации. Начало реакции и начальные скорости реакции не изменялись в присутствии мелатонина и его структурных аналогов. Образование TBARS началось сразу после добавления Fe 2+ . Увеличение концентрации BHT позволило избежать появления TBARS. Изменений не наблюдалось в присутствии мелатонина или структурных аналогов. Липиды сетчатки показали высокое содержание докозагексаеновой кислоты 22: 6 (Δ4,7,10,13,16,19), характерное для этой ткани.Немного этой жирной кислоты было потеряно, когда обработанные ультразвуком липосомы были приготовлены с этими липидами сетчатки. Полиненасыщенные жирные кислоты (ПНЖК) значительно снизились после инкубации липосом с Fe 2+ в течение 1 часа. BHT сохранил ПНЖК, тогда как мелатонин и родственные ему индоламины — нет. Эти данные подтверждают гипотезу о том, что мелатонин и структурные аналоги не обладают антиоксидантными свойствами сами по себе в этой липосомной модельной системе [64].
9. Методологические аспекты
9.1. Краткая история газовой хроматографии
Хроматография восходит к 1903 году в работах русского ученого Михаила Семеновича Цветта. Немецкий аспирант Фриц Приор разработал твердотельную газовую хроматографию в 1947 году. Арчер Джон Портер Мартин, удостоенный Нобелевской премии за свои работы по развитию жидкостно-жидкостной (1941) и бумажной (1944) хроматографии, заложил основу для развития газовая хроматография, а позже он произвел жидкостно-газовую хроматографию (1950). Эрика Кремер заложила основу и руководила большей частью работы Приора.
Арчер Джон Портер Мартин был британским химиком, получившим в 1952 году Нобелевскую премию по химии за изобретение распределительной хроматографии с Ричардом Сингом. Мартин получил образование в Бедфордской школе и Кембриджском университете. Сначала работая в лаборатории физической химии, он перешел в лабораторию питания Данна, а в 1938 году перешел в научно-исследовательский институт шерстяной промышленности в Лидсе. Он был главой отдела биохимии компании Boots Pure Drug Company с 1946 по 1948 год, когда он присоединился к Совету медицинских исследований.Там он был назначен главой отдела физической химии Национального института медицинских исследований в 1952 году и был консультантом по химии с 1956 по 1959 год. Он специализировался в биохимии, в некоторых аспектах витаминов E и B2, а также в методах, которые заложили фундамент. для хроматографии. Он разработал распределительную хроматографию, работая над разделением аминокислот, а затем разработал газожидкостную хроматографию. Среди многих других наград он получил Нобелевскую премию в 1952 году.
9.2. Мой ранний опыт работы с газовой хроматографией
Мне повезло, что пятьдесят лет назад я начал заниматься газовой хроматографией. Я услышал об этом в 1963 году, сделал свои первые уколы в 1964 году и работаю над этим до сих пор.
Мой первый наставник, Родольфо Бреннер, рано осознал огромный потенциал газожидкостной хроматографии, и этот метод был самым важным аналитическим инструментом в нашем отделе в шестидесятые и семидесятые годы, когда я там работал. С тех пор и по сей день эта техника использовалась постоянно в нашей лаборатории.Современный GC был изобретен в 1952 году Джеймсом и Мартином [65]. Гриффин и Джордж (Лондон, Великобритания), вероятно, изготовили первую коммерческую систему ГХ в 1954 году, и вскоре за ними последовали несколько компаний, в том числе Perkin Elmer, Fisher / Gulf, Barber Coleman, Podbelniak (все из США) и Pye Unicam (Великобритания). в 1955 и 1956 гг.
9.3. Оценка состава жирных кислот
Когда я впервые применил газовую хроматографию в 1964 году, состав жирных кислот был определен с помощью газожидкостной хроматографии.Использовали аппарат Пая с ионизационным детектором и потоком аргона. Колонки имели длину 122 см и диаметр 4 мм и были заполнены 10% -ным полиэтиленгликольадипатом, приготовленным нами в лаборатории. Исходные образцы были обработаны при 180 ° C и 200 ° C, и состав, рассчитанный по поверхности пиков, был определен путем триангуляции, и результаты были представлены в процентах площади.
Теперь мы анализируем жирнокислотный состав с высокой точностью с помощью хромато-масс-спектрометрии.ГХ-МС анализы выполняются с использованием газового хроматографа Perkin Elmer Clarus 560D MS, оснащенного масс-селективным детектором с квадрупольным анализатором, детектором с фотоумножителем и инжектором с разделением / без разделения. В газовой хроматографической системе использовали капиллярную колонку Elite 5MS (Perkin Elmer) (30 м, внутренний диаметр 0,25 мм и глубину 0,25 мкм, м df). Температура колонки программируется от 130 до 250 ° C со скоростью 5 ° C / мин и 250 ° C в течение 6 минут. Температура инжектора установлена на 260 ° C, а температура на входе поддерживается на уровне 250 ° C.Разделенные инъекции выполняются с коэффициентом разделения 10: 1. Газ-носитель гелий используется при постоянной скорости потока 1 мл / мин. В масс-спектрометре масс-спектры электронной ионизации (EI +) записываются при энергии ионизации 70 эВ в режиме полного сканирования; 50–400 единиц массы. Температура источника ионизации установлена на 180 ° C. Состав жирных кислот липидных экстрактов определяется путем сравнения моделей массовой фрагментации их метилпроизводных с масс-спектрами из баз данных NIST.
9,4. Измерение хемилюминесценции: процесс перекисного окисления липидов связан с излучением света
Перекисное окисление липидов — это цепная реакция разветвления, которая включает четыре основных стадии: (1) инициирование цепи, (2) распространение цепи, (3) разветвление цепи и (4) ) обрыв цепи. Известно, что по крайней мере три реакции разрывают цепи: (а) взаимодействие двух радикалов, ведущих цепочки, (б) взаимодействие одного радикала с металлом с изменяющейся валентностью, и (в) реакция между таким радикалом и молекулой «антиоксиданта». :
Реакция особенно интересна, поскольку она сопровождается хемилюминесценцией, интенсивность которой может служить мерой концентрации свободных радикалов пероксида () в соответствии со следующим уравнением: где представляет собой квантовый выход хемилюминесценции и коэффициент, зависящий от чистой чувствительности прибора.представляет собой свободный радикал, образующийся из молекул липидов [66].
10. Общие замечания, выводы и перспективы
Было увлекательно следить за исследованиями полиненасыщенных жирных кислот в течение почти пяти десятилетий.
Теперь доступны точные методы измерения ПНЖК, прекурсоров и продуктов разложения.
Исходя из моего опыта, невозможно предсказать, какие аспекты исследований ПНЖК будут доминировать в будущем.
Основные моменты
В этом обзоре описаны исследования, касающиеся различных аспектов полиненасыщенных жирных кислот, таких как химический синтез, механизм ферментативного образования, метаболизм, транспорт, физические, химические и каталитические свойства реконструированной системы десатуразы в липосомах, перекисное окисление липидов, антиоксиданты. и их биологические последствия, а также количественные методы их анализа.
Сокращения
| 18: 2 n-6: | Линолевая кислота |
| 20: 4 n-6: | Арахидоновая кислота |
| 22: 6 n-3: | Докозагексаеновая кислота |
| 22: 5 n-3 (EPA): | Эйкозапентаеновая кислота |
| ПНЖК: | Полиненасыщенные жирные кислоты |
| ROS: | Активные формы кислорода. |
Благодарности
Автор благодарен своим наставникам: Родольфо Бреннеру и Филиппу Стритматтеру, всем кандидатам наук.D. студенты и пост-докт. Среди них следующие внесли наиболее значительный вклад в конкретный материал, рассматриваемый здесь: Розана Дзанетти, Моника Мармунти, Мариана Гавацца, Лукас Фурлан, Алехандро Паласиос, Наталья Фагали и Ана Гутьеррес. Он также признателен своим техническим специалистам: Сезару Арсемису, Аугусто Черрути и Хулиану Фернандесу, а также всем предыдущим сотрудникам: Сусане М. Моска, Беатрис Аванзатти, Ане Терраса, Маргарите Гуахардо, Гильермо Реборедо, Патрисио Леаден, Хосе Р. Баррионуэс. Диего Монтальти, Бернардо Иглесиас, Вивиана Пьерджакоми, Валентина Руис-Гутьеррес, Гарри Энох, Клара Китаска, Ласло Пушкаш, Хавьер Санчес Перона, Рикардо Чихуайлаф, Фернандо Виттвер, Педро Контрерас, А.Салибиан, Одалис Бланко и Элизабет де Армас. Эта работа была частично поддержана Институтом здравоохранения, грант No. HE-08267-03, исследовательский грант GM-15924, предоставленный Службой общественного здравоохранения США, Японским агентством международного сотрудничества (JICA), Национальным институтом фармакологии и броматологии секретарей общественного здоровья, Национальной комиссией по исследованиям и исследованиям. Nacional de La Plata, Consejo Nacional de Investigaciones Científicas y Técnicas, PIP 4097, PIP 0157 и Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT), PICT 13399.Австралийский университет Чили, Адрес научно-исследовательских проектов Внутренний код DID: S-2008-08 Ссылка на черновик: AGL2002-0019LI Финансируется Исследовательским советом CICYT (Межминистерская комиссия по науке и технологиям) Scientific Espana. Двустороннее сотрудничество Secyt-Аргентина NKTH Hungary HU / PA03-BI / 008 project.
БИОЛОГИЧЕСКИЕ ФУНКЦИИ ЭФФЕКТИВНЫХ ЖИРНЫХ КИСЛОТ — Университет Аризоны
Целью предлагаемого исследования является изучение молекулярной основы
дефицита незаменимых жирных кислот в сетчатке, которая является частью
мозга и представляет собой ценный и уникально доступный модель
нервной системы млекопитающих.Текущие знания показывают, что длинноцепочечные полиненасыщенные жирные кислоты
, полученные из незаменимых омега-3 жирных кислот
, могут играть важную роль в развитии сетчатки и мозга.
Исследования как на крысах, так и на макаках-резус указывают на заметное изменение
функции электрического ответа глаза из-за диетического изменения
содержания фосфолипидов мембран, содержащих докозагексаеновую кислоту
(22: 6omega3, сокращенно DHA). Эти исследования стимулировали обсуждение
вопроса о том, следует ли добавлять длинноцепочечные полиненасыщенные жирные кислоты
, такие как DHA, в смеси для младенцев.Более того,
вызывает повышенное беспокойство по поводу соотношения
незаменимых жирных кислот омега-3 / омега-6 в западной диете. Процесс зрения в стержнях сетчатки
запускается конформационным изменением зрительного белка родопсина
, встроенного в мембраны наружного сегмента стержня (ROS). Мы будем проверять гипотезу
о том, что свойства липидных и белковых компонентов мембраны
стержневого диска сетчатки определяют зрительную функцию посредством их влияния
на конформационный переход родопсина MI-MII, запускающее событие
при зрительном возбуждении.Дисковые мембраны
сетчатки для АФК чрезвычайно богаты фосфолипидами, содержащими высокий уровень полиненасыщенных жирных кислот
S, включая DHA и арахидоновую кислоту
(20: 4omega6). Мы предполагаем, что взаимодействия родопсина с полиненасыщенными мембранными липидами
модулируют свободную энергию конформационных состояний MI и
MII, тем самым изменяя ключевые этапы амплификации
с участием передающего сигнал G-белка (трансдуцина) и фосфодиэстеразы cGMP
. Это, в свою очередь, влияет на закрытие цГМФ-управляемых натриевых каналов мембраны
плазмы и, следовательно, на генерацию зрительного нервного импульса
.Изменения в содержании полиненасыщенных мембранных липидов
из-за диеты или болезни сдвигают равновесие MI-MII фотолизированного родопсина
и влияют на электрический ответ сетчатки. Методы фотолиза Flash
будут применяться и дорабатываться для мониторинга влияния
полиненасыщенных липидов на переход MI-MII родопсина
в мембранных рекомбинантах. Особое внимание будет уделено
исследованию роли как состава полиненасыщенных ацильных цепей
, так и состава полярных головных групп фосфолипидов мембраны
.Влияние полиненасыщенных мембранных фосфолипидов
на более поздние стадии амплификации зрительного фотоответа будет исследовано
, включая связывание и активацию G-белка
(трансдуцина) с фотолизированным родопсином и последующую активацию фосфодиэстеразы cGMP
. Наконец, спектроскопия ядерного магнитного резонанса (ЯМР)
даст дополнительные знания о физико-химических свойствах полиненасыщенных фосфолипидов
и их взаимодействиях с
визуальными белками в мембранах.Исчерпывающая картина роли полиненасыщенных фосфолипидов
в зрительном процессе будет предоставлена в
в связи с результатами диетических исследований дефицита незаменимых жирных кислот омега3
у животных и людей.
Омега-3 жирные кислоты: важный вклад | Источник питания
Организм человека может вырабатывать большинство необходимых ему жиров из других жиров или сырья. Это не относится к жирным кислотам омега-3 (также называемым жирами омега-3 и жирами n-3).Это основных жиров — организм не может произвести их с нуля, но должен получать их с пищей. Продукты с высоким содержанием Омега-3 включают рыбу, растительные масла, орехи (особенно грецкие), семена льна, льняное масло и листовые овощи.
Что делает жиры омега-3 особенными? Они являются неотъемлемой частью клеточных мембран по всему телу и влияют на функцию клеточных рецепторов в этих мембранах. Они служат отправной точкой для выработки гормонов, регулирующих свертывание крови, сокращение и расслабление стенок артерий и воспаление.Они также связываются с рецепторами в клетках, которые регулируют генетические функции. Вероятно, из-за этих эффектов было показано, что омега-3 жиры помогают предотвратить сердечные заболевания и инсульт, могут помочь контролировать волчанку, экзему и ревматоидный артрит, а также могут играть защитную роль при раке и других состояниях.
Омега-3 жиры являются ключевым семейством полиненасыщенных жиров. Есть три основных омега-3:
- Эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA) поступают в основном из рыбы, поэтому их иногда называют морскими омега-3.
- Альфа-линоленовая кислота (ALA), наиболее распространенная жирная кислота омега-3 в большинстве западных диет, содержится в растительных маслах и орехах (особенно в грецких орехах), семенах льна и льняном масле, листовых овощах и некоторых животных жирах, особенно в животные, откормленные травой. Человеческий организм обычно использует АЛК для получения энергии, а преобразование в ЭПК и ДГК очень ограничено.
Наиболее убедительные доказательства положительного воздействия жиров омега-3 связаны с сердечными заболеваниями. Эти жиры, по-видимому, помогают сердцу биться стабильно и не сбиваются в опасный или потенциально фатальный неустойчивый ритм.(1) Такие аритмии являются причиной большинства из 500 000 с лишним случаев сердечной смерти, которые ежегодно происходят в Соединенных Штатах. Жиры омега-3 также снижают кровяное давление и частоту сердечных сокращений, улучшают функцию кровеносных сосудов, а в более высоких дозах снижают уровень триглицеридов и могут ослабить воспаление, которое играет роль в развитии атеросклероза. (1)
Несколько крупных исследований оценивали влияние рыбы или рыбьего жира на сердечные заболевания. В Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardio (известном как испытание GISSI по профилактике) у переживших сердечный приступ, которые принимали 1-граммовую капсулу омега-3 жиров каждый день в течение трех лет, вероятность повторного сердечного приступа была ниже. атаку, инсульт или смерть от внезапной смерти, чем у тех, кто принимал плацебо.(2) Примечательно, что риск внезапной сердечной смерти снизился примерно на 50 процентов. В недавнем исследовании по вмешательству липидов, проведенном Агентством по охране окружающей среды Японии (JELIS), участники, принимавшие ЭПК и холестерин-снижающие статины, с меньшей вероятностью имели серьезное коронарное событие (внезапная сердечная смерть, смертельный или нефатальный сердечный приступ, нестабильная стенокардия или процедура открывать или обходить суженную или заблокированную коронарную артерию), чем те, кто принимал только статины. (3)
Большинство американцев потребляют гораздо больше других незаменимых жиров — жиров омега-6 — чем жиров омега-3.Некоторые эксперты выдвинули гипотезу о том, что повышенное потребление жиров омега-6 может создавать проблемы, сердечно-сосудистые и другие, но это не было подтверждено доказательствами на людях. (4) В последующем исследовании медицинских специалистов, например, соотношение омега-6 и омега-3 жиров не было связано с риском сердечных заболеваний, потому что оба они были полезны. (5) Многие другие исследования и испытания на людях также подтверждают пользу омега-6 жиров для сердечно-сосудистой системы. Хотя нет никаких сомнений в том, что многим американцам было бы полезно увеличить потребление жиров омега-3, есть доказательства того, что жиры омега-6 также положительно влияют на факторы риска сердечно-сосудистых заболеваний и уменьшают сердечные заболевания.
Исследователи внимательно изучают другой вид баланса, на этот раз между возможным воздействием морских и растительных жиров омега-3 на рак простаты. Результаты последующего исследования медицинских работников и других показывают, что мужчины, чьи диеты богаты ЭПК и ДГК (в основном из рыбы и морепродуктов), с меньшей вероятностью заболеют прогрессирующим раком простаты, чем люди с низким потреблением ЭПК и ДГК. (6) В то же время некоторые, но не все исследования показывают рост рака простаты и распространенного рака простаты среди мужчин с высоким потреблением АЛК (в основном из добавок).Однако этот эффект непостоянен. Например, в очень большом скрининговом исследовании рака простаты, легких, колоректального рака и яичников (PLCO) не было выявлено связи между приемом АЛК и ранним, поздним или запущенным раком простаты. (7)
Рецепты здоровья
Учитывая широкое значение и пользу морских омега-3 жирных кислот, важно есть рыбу или другие морепродукты один-два раза в неделю, особенно жирную рыбу (темное мясо), которая богата ЭПК и ДГК. Это особенно важно для беременных или планирующих забеременеть женщин и кормящих матерей.С третьего триместра до второго года жизни развивающийся ребенок нуждается в постоянном поступлении ДГК для формирования мозга и других частей нервной системы. Многие женщины избегают употребления в пищу рыбы из-за опасений, что ртуть и другие возможные загрязнители могут нанести вред их младенцам (9), однако доказательства вреда от недостатка жиров омега-3 гораздо более последовательны, и соотношение пользы и риска является очевидным. легко получается. (Чтобы узнать больше о разногласиях по поводу загрязнителей жирной рыбы, прочтите Рыба: друг или враг.)
В этой таблице перечислены распространенные продукты из рыбы и морепродуктов и их содержание омега-3 жирных кислот.
| Тип морепродуктов | Размер порции | Омега-3 жирные кислоты
(мг / порция) |
| Анчоусы | 2,0 унции | 1,200 |
| Сом (разводимый) | 5.0 унций | 253 |
| Зажимы | 3.0 унций | 241 |
| Треска (Атлантика) | 6,3 унции | 284 |
| Краб | 3,0 унции | 351 |
| Рыбные палочки (замороженные) | 3,2 унции | 193 |
| Палтус | 5.6 унций | 740 |
| Лобстер | 3,0 унции | 71 |
| Махи Махи | 5.6 унций | 221 |
| Мидии | 3.0 унций | 665 |
| Устрицы | 3,0 унции | 585 |
| Минтай (Аляска) | 2,1 унции | 281 |
| Лосось (дикий) | 6.0 унций | 1,774 |
| Лосось (выращенный) | 6.0 унций | 4 504 90 100 |
| Сардины | 2,0 унции | 556 |
| Гребешки | 3,0 унции | 310 |
| Креветки | 3.0 унций | 267 |
| Рыба-меч * | 3,7 унции | 868 |
| Форель | 2.2 унции | 581 |
| Тунец (альбакор) ** | 3,0 унции | 733 |
| Тунец (светлый, полосатый) | 3,0 унции | 228 |
ИСТОЧНИК: Mozaffarian D, Rimm EB. JAMA . 2006; 296: 1885-1899.
* Рыба-меч содержит большое количество ртути, как и акула, королевская макрель и кафельная рыба (иногда называемая золотым окунем или золотым окунем).Беременным или планирующим беременность женщинам, кормящим матерям и маленьким детям следует избегать этих видов рыбы с высоким содержанием ртути, но они могут съедать до 12 унций (в среднем два приема пищи) в неделю разнообразной рыбы и моллюсков с низким содержанием ртути. .
** Тунец Альбакор содержит больше ртути, чем консервированный светлый тунец. Беременным или беременным женщинам, кормящим матерям и маленьким детям следует ограничить потребление тунца альбакора одной порцией в неделю.
Список литературы
1. Лист А. Профилактика внезапной сердечной смерти с помощью n-3 полиненасыщенных жирных кислот. J Cardiovasc Med . (Хагерстаун). 2007; 8 Приложение 1: S27-29.
2. Пищевые добавки с n-3 полиненасыщенными жирными кислотами и витамином E после инфаркта миокарда: результаты исследования GISSI-Prevenzione. Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico. Ланцет . 1999; 354: 447-55.
3. Йокояма М., Оригаса Х., Мацузаки М. и др. Влияние эйкозапентаеновой кислоты на основные коронарные события у пациентов с гиперхолестеринемией (JELIS): рандомизированный открытый слепой анализ конечных точек. Ланцет . 2007; 369: 1090-98.
4. Уиллетт WC. Роль диетических жирных кислот n-6 в профилактике сердечно-сосудистых заболеваний. J Cardiovasc Med . (Хагерстаун). 2007; 8 Приложение 1: S42-5.
5. Mozaffarian D, Ascherio A, Hu FB и др. Взаимодействие между различными полиненасыщенными жирными кислотами и риском ишемической болезни сердца у мужчин. Тираж . 2005; 111: 157-64.
6. Лейтцманн М.Ф., Штампфер М.Дж., Мишо Д.С. и др.Потребление с пищей n-3 и n-6 жирных кислот и риск рака простаты. Ам Дж. Клин Нутр . 2004; 80: 204-16.
7. Коралек Д.О., Петерс Ю., Андриоле Г. и др. Проспективное исследование диетической альфа-линоленовой кислоты и риска рака простаты (США). Контроль причин рака . 2006; 17: 783-91.
8. Эйландер А., Хундшайд, округ Колумбия, Осендарп С.Дж., Транслер С., Зок PL. Влияние добавок длинноцепочечных полиненасыщенных жирных кислот n-3 на зрительное и когнитивное развитие в детстве: обзор исследований на людях. Простагландины Leukot Essent жирные кислоты . 2007; 76: 189-203.
9. Окен Э., Клейнман К.П., Берланд В.Е., Саймон С.Р., Рич-Эдвардс Дж.В., Гиллман М.В. Снижение потребления рыбы беременными женщинами после национального совета по ртути. Акушерский гинекол . 2003; 102: 346-51.
Условия использования
Содержание этого веб-сайта предназначено для образовательных целей и не предназначено для предоставления личных медицинских консультаций. Вам следует обратиться за советом к своему врачу или другому квалифицированному поставщику медицинских услуг с любыми вопросами, которые могут у вас возникнуть относительно состояния здоровья.Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте. Nutrition Source не рекомендует и не поддерживает какие-либо продукты.
Значение длинноцепочечных полиненасыщенных жирных кислот для здоровья человека | Клиническая и трансляционная медицина
Богио М., Радд П.М. (2013) Новые технологии и их влияние на исследования «омики». Curr Opin Chem Biol 17 (1): 1–3
CAS PubMed Статья Google ученый
Simo C, Cifuentes A, GarciaCanas V (2014) Основы передовых технологий омики: от генов до метаболитов. Elsevier Science Bv, Амстердам
Google ученый
Debnath M, Prasad GBKS, Bisen PS (2010) Технология Omics. молекулярная диагностика: перспективы и возможности. Springer, Нидерланды, Дордрехт, стр. 11–31
Книга Google ученый
Деннис Э.А. (2009) Липидомика присоединяется к эволюции омики.Proc Natl Acad Sci USA 106 (7): 2089–2090
CAS PubMed PubMed Central Статья Google ученый
Brown HA (2012) Липидомика: когда апокриф становится каноническим. Curr Opin Chem Biol 16 (1-2): 221–226
PubMed Central Статья CAS Google ученый
Hu CX, van der Heijden R, Wang M, van der Greef J, Hankemeier T, Xua GW (2009) Аналитические стратегии в липидомике и применения в открытии биомаркеров болезней.J Chromatogr B 877 (26): 2836–2846
CAS Статья Google ученый
Köfeler HC, Fauland A, Rechberger GN, Trötzmüller M (2012) Липидомика на основе масс-спектрометрии: обзор технологических платформ. Метаболиты 2 (1): 19–38
PubMed PubMed Central Статья CAS Google ученый
Dewick PM (2001) Ацетатный путь: жирные кислоты и поликетиды.В кн .: Лекарственные натуральные продукты: Биосинтетический подход, 2-е изд. Wiley, Chichester, p 35–120
Christie WW, Han X (2010) Выделение, разделение, идентификация и липидомный анализ липидным анализом, 4-е изд. Oily Press, Бриджуотер
Google ученый
Calder PC (2015) Функциональные роли жирных кислот и их влияние на здоровье человека. J Parenter Enteral Nutr 39 (Приложение 1): 18–32
Артикул Google ученый
Саянова О.В., Напье Ж.А. (2004) Эйкозапентаеновая кислота: пути биосинтеза и потенциал синтеза в трансгенных растениях. Фитохимия 65 (2): 147–158
CAS PubMed Статья Google ученый
Sprecher H, Chen Q, Yin FQ (1999) Регулирование биосинтеза 22: 5n-6 и 22: 6n-3: сложный внутриклеточный процесс. Липиды 34 (1): 153–156
Статья Google ученый
Buzzi M, Henderson RJ, Sargent JR (1997) Биосинтез докозагексаеновой кислоты в гепатоцитах форели происходит через 24-углеродные промежуточные соединения. Comp Biochem Physiol B Biochem Mol Biol. 116 (2): 263–267
CAS PubMed Статья Google ученый
Родригес К., Перес Дж. А., Хендерсон Р. Дж. (2002) Этерификация и модификация полиненасыщенных жирных кислот n-3 и n-6 гепатоцитами и микросомами печени тюрбо ( Scophthalmus maximus ).Comp Biochem Physiol B Biochem Mol Biol 132 (3): 559–570
PubMed Статья Google ученый
Venegas-Calerón M, Beaudoin F, Sayanova O, Napier JA (2007) Совместно транскрибируемые гены для биосинтеза длинноцепочечных полиненасыщенных жирных кислот у простейших Perkinsus marinus включают растительный кофермент 3-кетоацил FAE1 синтаза. J Biol Chem 282 (5): 2996–3003
PubMed Статья CAS Google ученый
Kothapalli KS, Ye K, Gadgil MS, Carlson SE, O’Brien KO, Zhang JY et al (2016) Положительный отбор на регуляторный полиморфизм вставок-делеций в FADS2 влияет на очевидный эндогенный синтез арахидоновой кислоты. Мол Биол Эвол 29: msw049
Google ученый
Burdge GC, Jones AE, Wootton SA (2002) Эйкозапентаеновая и докозапентаеновая кислоты являются основными продуктами метаболизма α-линоленовой кислоты у молодых мужчин. Br J Nutr 88 (04): 355–363
CAS PubMed Статья Google ученый
Hussein N, Ah-Sing E, Wilkinson P, Leach C, Griffin BA, Millward DJ (2005) Длинноцепочечная конверсия [13C] линолевой кислоты и α-линоленовой кислоты в ответ на заметные изменения в их потреблении с пищей у мужчин. J Lipid Res 46 (2): 269–280
CAS PubMed Статья Google ученый
Bradbury J (2011) Докозагексаеновая кислота (DHA): древнее питательное вещество для современного человеческого мозга. Питательные вещества 3 (5): 529–554
CAS PubMed PubMed Central Статья Google ученый
Plourde M, Cunnane SC (2007) Чрезвычайно ограниченный синтез длинноцепочечных полиненасыщенных веществ у взрослых: последствия для их диетической важности и использования в качестве добавок. Appl Physiol Nutr Metab 32 (4): 619–634
CAS PubMed Статья Google ученый
Jacobson DL, Gange SJ, Rose NR, Graham NMH (1997) Эпидемиология и оценочное бремя отдельных аутоиммунных заболеваний среди населения в США. Clin Immunol Immunopathol 84 (3): 223–243
CAS PubMed Статья Google ученый
Дэвидсон A, Diamond B (2001) Аутоиммунные заболевания. New Engl J Medicine Adv Inmunol 345: 340–350
CAS Статья Google ученый
Накадзава Д.Д. (2009) Аутоиммунная эпидемия: тела вышли из строя в несбалансированном мире. Touchstone / Simon & Schuster, Нью-Йорк
Google ученый
Симопулос А.П. (2001) Эволюционные аспекты диеты и незаменимых жирных кислот.Karger Publishers, Жирные кислоты Липиды New Find
Книга Google ученый
Simopoulos AP (2016) Увеличение соотношения омега-6 / омега-3 жирных кислот увеличивает риск ожирения. Питательные вещества 8 (3): 1–17
Артикул CAS Google ученый
Borges MC, Santos FDM, Telles RW, Correia M, Lanna CCD (2014) Полиненасыщенные жирные кислоты омега-3 и системная красная волчанка: что мы знаем? Rev Bras Reumatol 54 (6): 459–466
PubMed Статья Google ученый
Calder PC (2011) Жирные кислоты и воспаление: край между продуктами питания и фармацевтикой. Eur J Pharmacol 668 (Suppl): 50–58
Артикул CAS Google ученый
Calder PC (2013) Полиненасыщенные жирные кислоты омега-3 и воспалительные процессы: питание или фармакология? Br J Clin Pharmacol 75 (3): 645–662
CAS PubMed PubMed Central Статья Google ученый
Calder PC (2012) Механизмы действия (n-3) жирных кислот. J Nutr 142 (3): 592S – 599S
CAS PubMed Статья Google ученый
Buczynski MW, Dumlao DS, Dennis EA (2009) Комплексный омический анализ биологии эйкозаноидов. J Lipid Res 50 (6): 1015–1038
CAS PubMed PubMed Central Статья Google ученый
Смит В.Л., ДеВитт Д.Л., Гаравито Р.М. (2000) Циклооксигеназы: структурная, клеточная и молекулярная биология.Анну Рев Биохим 69: 145–182
CAS PubMed Статья Google ученый
Kuhn H, O’Donnell VB (2006) Воспаление и иммунная регуляция с помощью 12/15-липоксигеназ. Prog Lipid Res 45 (4): 334–356
PubMed Статья CAS Google ученый
Morisseau C, Hammock BD (2013) Влияние растворимой эпоксидгидролазы и эпоксиэйкозаноидов на здоровье человека.Annu Rev Pharmacol Toxicol 53: 37–58
CAS PubMed Статья Google ученый
Серхан К.Н., Чианг Н., Далли Дж., Леви Б.Д. (2015) Липидные медиаторы в разрешении воспаления. Cold Spring Harbor Perspect Biol 7 (2): a016311
Статья CAS Google ученый
Gross O, Thomas CJ, Guarda G, Tschopp J (2011) Инфламмасома: комплексный взгляд.Immunol Rev 243: 136–151
CAS PubMed Статья Google ученый
Latz E, Xiao TS, Stutz A (2013) Активация и регуляция инфламмасом. Nat Rev Immunol 13 (6): 397–411
CAS PubMed Статья Google ученый
Деннис Э.А., Норрис П.К. (2015) Эйкозаноидный шторм при инфекции и воспалении. Nat Rev Immunol 15 (8): 511–523
CAS PubMed PubMed Central Статья Google ученый
Pieters DJM, Mensink RP (2015) Влияние стеаридоновой кислоты на концентрацию триацилглицерина в сыворотке у субъектов с избыточным весом и ожирением: рандомизированное контролируемое исследование. Eur J Clin Nutr 69 (1): 121–126
CAS PubMed Статья Google ученый
Клеменс С.М., Берман Д.Р., Мозуркевич Е.Л. (2011) Влияние перинатальных добавок омега-3 жирных кислот на маркеры воспаления и аллергические заболевания: систематический обзор.BJOG 118 (8): 916–925
CAS PubMed Статья Google ученый
Norris PC, Dennis EA (2012) Омега-3 жирные кислоты вызывают драматические изменения в передаче сигналов TLR4 и пуринергических эйкозаноидов. Proc Natl Acad Sci USA 109 (22): 8517–8522
CAS PubMed PubMed Central Статья Google ученый
Maskrey BH, Megson IL, Rossi AG, Whitfield PD (2013) Растущее значение жирных кислот омега-3 в врожденном иммунном ответе: молекулярные механизмы и липидомные стратегии для их анализа.Mol Nutr Food Res 57 (8): 1390–1400
CAS PubMed Статья Google ученый
Benjamin EJ, Blaha MJ, Chiuve SE, Cushman M, Das SR, Deo R et al (2017) Статистика сердечных заболеваний и инсульта-2017 обновляет отчет Американской кардиологической ассоциации. Тираж 135 (10): E146 – E603
PubMed Статья Google ученый
Cannon CP (2007) Сердечно-сосудистые заболевания и изменяемые факторы риска кардиометаболизма.Clin Cornerstone 8 (3): 11–28
PubMed Статья Google ученый
Mozaffarian D, Appel LJ, Van Horn L (2011) Компоненты кардиозащитной диеты новые идеи. Тираж 123 (24): 2870–2891
PubMed Статья Google ученый
Saravanan P, Davidson NC, Schmidt EB, Calder PC (2010) Сердечно-сосудистые эффекты морских омега-3 жирных кислот.Ланцет 376 (9740): 540–550
CAS PubMed Статья Google ученый
Cunnane S, Drevon C, Harris W, Sinclair A, Spector A (2004) Рекомендации по потреблению полиненасыщенных жирных кислот здоровыми взрослыми. ISSFAL Newsl 11 (2): 12–25
Google ученый
Научный консультативный комитет по питанию (2004) Рекомендации по потреблению рыбы: преимущества и риски.Канцелярские товары офисные. TSO, Норвич. ISBN 0 11 243083 X. https://cot.food.gov.uk/sites/default/files/cot/fishreport200401.pdf
Kris-Etherton PM, Harris WS, Appel LJ, Nutrition C (2002) Потребление рыбы, рыбий жир, омега-3 жирные кислоты и сердечно-сосудистые заболевания. Тираж 106 (21): 2747–2757
PubMed Статья Google ученый
Харрис В.С., Миллер М., Тайге А.П., Дэвидсон М.Х., Шефер Э.Дж. (2008) Омега-3 жирные кислоты и риск ишемической болезни сердца: клинические и механистические перспективы.Атеросклероз 197 (1): 12–24
CAS PubMed Статья Google ученый
Mozaffarian D, Wu JHY (2011) Омега-3 жирные кислоты и влияние сердечно-сосудистых заболеваний на факторы риска, молекулярные пути и клинические события. J Am Coll Cardiol 58 (20): 2047–2067
CAS PubMed Статья Google ученый
Huang CW, Chien YS, Chen YJ, Ajuwon KM, Mersmann HM, Ding ST (2016) Роль полиненасыщенных жирных кислот n-3 в улучшении метаболического синдрома, вызванного ожирением, у животных и людей.Int J Mol Sci 17 (10): 29
Google ученый
Lalia AZ, Lanza IR (2016) Инсулино-сенсибилизирующие эффекты омега-3 жирных кислот: потеряны при переводе? Питательные вещества 8 (6): 24
Артикул CAS Google ученый
Ricciotti E, FitzGerald GA (2011) Простагландины и воспаление. Артериосклер Thromb Vasc Biol 31 (5): 986–1000
CAS PubMed PubMed Central Статья Google ученый
Imig JD (2012) Эпоксиды и растворимая эпоксидгидролаза в физиологии сердечно-сосудистой системы. Physiol Rev 92 (1): 101–130
CAS PubMed PubMed Central Статья Google ученый
Harris TR, Hammock BD (2013) Растворимая эпоксидгидролаза: структура гена, экспрессия и делеция. Ген 526 (2): 61–74
CAS PubMed PubMed Central Статья Google ученый
Серхан С.Н., Петазис Н.А. (2011) Резолвины и протектины в разрешении воспаления. Chem Rev 111 (10): 5922–5943
CAS PubMed PubMed Central Статья Google ученый
Ulu A, Harris TR, Morisseau C, Miyabe C, Inoue H, Schuster G et al (2013) Противовоспалительные эффекты полиненасыщенных жирных кислот омега-3 и растворимых ингибиторов эпоксидгидролазы при ангиотензин-II-зависимых гипертония. J Cardiovasc Pharmacol 62 (3): 285–297
CAS PubMed PubMed Central Статья Google ученый
Morin C, Fortin S, Rousseau E (2011) 19,20-EpDPE, биоактивный метаболит CYP450 моноациглицерида DHA, снижает чувствительность к Ca 2+ в легочных артериях человека. Am J Physiol Heart Circ Physiol 301 (4): h2311 – h2318
CAS. PubMed Статья Google ученый
De Lorgeril M, Salen P, Defaye P, Rabaeus M (2013) Последние данные о влиянии на здоровье жирных кислот омега-3 и статинов и их взаимодействии: ингибируют ли статины омега-3? BMC медицина.11 (1): 5
PubMed PubMed Central Статья CAS Google ученый
Hooper L, Thompson RL, Harrison RA, Summerbell CD, Ness AR, Moore HJ et al (2006) Риски и преимущества жиров омега-3 для смертности, сердечно-сосудистых заболеваний и рака: систематический обзор. BMJ 332 (7544): 752–760
CAS PubMed PubMed Central Статья Google ученый
Rizos EC, Ntzani EE, Bika E, Kostapanos MS, Elisaf MS (2012) Связь между добавлением омега-3 жирных кислот и риском серьезных сердечно-сосудистых заболеваний: систематический обзор и метаанализ. JAMA 308 (10): 1024–1033
CAS PubMed Статья Google ученый
Банг Х.О., Дерберг Дж. (1980) Липидный обмен и ишемическая болезнь сердца у гренландских эскимосов. В: Дрейпер HH (редактор) Достижения в исследованиях в области питания.Спрингер, Бостон, стр. 1–22
Google ученый
Burr ML, Gilbert JF, Holliday RM, Elwood PC, Fehily AM, Rogers S et al (1989) Влияние изменений в потреблении жира, рыбы и клетчатки на смерть и повторный инфаркт миокарда — диета и исследование повторного инфаркта (DART ). Ланцет 2 (8666): 757–761
CAS PubMed Статья Google ученый
Investigators GI-P (1999) Пищевые добавки с n-3 полиненасыщенными жирными кислотами и витамином E после инфаркта миокарда: результаты исследования GISSI-Prevenzione.Lancet 354 (9177): 447–455
Артикул Google ученый
Tavazzi L, Maggioni AP, Marchioli R, Barlera S, Franzosi MG, Latini R et al (2008) Эффект n-3 полиненасыщенных жирных кислот у пациентов с хронической сердечной недостаточностью (исследование GISSI-HF): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет 372 (9645): 1223–1230
PubMed Статья CAS Google ученый
Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y et al (2007) Эффекты эйкозапентаеновой кислоты на основные коронарные события у пациентов с гиперхолестеринемией (JELIS): рандомизированный открытый меточный, слепой анализ конечных точек. Ланцет 369 (9567): 1090–1098
CAS PubMed Статья Google ученый
Kromhout D, Giltay EJ, Geleijnse JM (2010) жирные кислоты n-3 и сердечно-сосудистые события после инфаркта миокарда.N Engl J Med 363 (21): 2015–2026
CAS PubMed Статья Google ученый
Kromhout D, Geleijnse JM, de Goede J, Griep LMO, Mulder BJM, de Boer MJ et al (2011) n-3 жирные кислоты, события, связанные с желудочковой аритмией, и фатальный инфаркт миокарда у пациентов с постинфарктным инфарктом миокарда при сахарном диабете. Уход за диабетом 34 (12): 2515–2520
CAS PubMed PubMed Central Статья Google ученый
Bowen KJ, Harris WS, Kris-Etherton PM (2016) Омега-3 жирные кислоты и сердечно-сосудистые заболевания: есть ли преимущества? Варианты лечения Curr Cardiovasc Med 18 (11): 69
PubMed PubMed Central Статья Google ученый
Harris WS, von Schacky C (2004) Индекс омега-3: новый фактор риска смерти от ишемической болезни сердца? Prev Med 39 (1): 212–220
CAS PubMed Статья Google ученый
Варбург О. (1956) О происхождении раковых клеток. Наука 123 (3191): 309–314
CAS PubMed Статья Google ученый
Tasevska N, Jiao L, Cross AJ, Kipnis V, Subar AF, Hollenbeck A. et al (2012) Сахара в диете и риск рака в исследовании диеты и здоровья NIH-AARP. Int J Cancer 130 (1): 159–169
CAS PubMed Статья Google ученый
Yao CH, Fowle-Grider R, Mahieu NG, Liu GY, Chen Y, Wang RC et al (2016) Экзогенные жирные кислоты являются предпочтительным источником мембранных липидов в пролиферирующих фибробластах. Cell Chem Biol 23 (4): 483–493
CAS PubMed PubMed Central Статья Google ученый
Bergers G, Benjamin LE (2003) Онкогенез и ангиогенный переключатель. Nat Rev Cancer 3 (6): 401–410
CAS PubMed Статья Google ученый
Gupta GP, Massague J (2006) Метастазирование рака: создание основы. Ячейка 127 (4): 679–695
CAS PubMed Статья Google ученый
Currie E, Schulze A, Zechner R, Walther TC, Farese RV (2013) Клеточный метаболизм жирных кислот и рак. Cell Metab 18 (2): 153–161
CAS PubMed PubMed Central Статья Google ученый
Zhang F, Du G (2012) Нарушение регуляции липидного обмена при раке.World J Biol Chem 3 (8): 167–174
PubMed PubMed Central Статья Google ученый
Kelloff G, Hoffman JM, Johnson B, Scher HI, Siegel BA, Cheng EY et al (2005) Прогресс и перспективы визуализации FDG-PET для ведения больных раком и разработки онкологических препаратов. Clin Cancer Res 11 (8): 2785–2808
CAS PubMed Статья Google ученый
Santos CR, Schulze A (2012) Липидный метаболизм при раке. FEBS J 279 (15): 2610–2623
CAS PubMed Статья Google ученый
Beloribi-Djefaflia S, Vasseur S, Guillaumond F (2016) Перепрограммирование липидного метаболизма в раковых клетках. Онкогенез 5 (1): e189
CAS PubMed PubMed Central Статья Google ученый
Менендес Дж. А., Лупу Р. (2007) Синтаза жирных кислот и липогенный фенотип в патогенезе рака.Nat Rev Cancer 7 (10): 763–777
CAS PubMed Статья Google ученый
Zaidi N, Swinnen JV, Smans K (2012) АТФ-цитратлиаза: ключевой игрок в метаболизме рака. Cancer Res 72 (15): 3709–3714
CAS PubMed Статья Google ученый
Baenke F, Peck B, Miess H, Schulze A (2013) Жирная привязанность: роль синтеза липидов в метаболизме рака и развитии опухоли.Dis Model Mech 6 (6): 1353–1363
CAS PubMed PubMed Central Статья Google ученый
Miryaghoubzadeh J, Darabi M, Madaen K, Shaaker M, Mehdizadeh A, Hajihosseini R (2013) Состав жирных кислот тканей при уротелиальной карциноме человека. Br J Biomed Sci 70 (1): 1–5
CAS PubMed Статья Google ученый
Jurczyszyn A, Czepiel J, Gdula-Argasinska J, Pasko P, Czapkiewicz A, Librowski T. et al (2015) Профиль жирных кислот в плазме у пациентов с множественной миеломой.Leuk Res 39 (4): 400–405
CAS PubMed Статья Google ученый
Mohammadzadeh F, Mosayebi G, Montazeri V, Darabi M, Fayezi S, Shaaker M. et al (2014) Жирнокислотный состав культивированной ткани карциномы молочной железы и эффект ингибирования стеароил-КоА-десатуразы 1. J рака груди 17 (2): 136–142
PubMed PubMed Central Статья Google ученый
Omabe M, Ezeani M, Omabe KN (2015) Липидный метаболизм и прогрессирование рака: недостающая цель в лечении метастатического рака. J Appl Biomed 13 (1): 47–59
Статья Google ученый
Balaban S, Lee LS, Schreuder M, Hoy AJ (2015) Ожирение и прогрессирование рака: играет ли роль метаболизм жирных кислот? Biomed Res Int 2015: 1–17
Статья CAS Google ученый
Zamaria N (2004) Изменение статуса полиненасыщенных жирных кислот и метаболизма при здоровье и болезнях. Reprod Nutr Dev 44 (3): 273–282
CAS PubMed Статья Google ученый
Gleissman H, Johnsen JI, Kogner P (2010) Омега-3 жирные кислоты при раке, защитники добра и убийцы зла? Exp Cell Res 316 (8): 1365–1373
CAS PubMed Статья Google ученый
Simopoulos AP (2008) Важность соотношения омега-6 / омега-3 жирных кислот при сердечно-сосудистых и других хронических заболеваниях. Exp Biol Med. 233 (6): 674–688
CAS Статья Google ученый
Хуанг CF, Freter C (2015) Липидный метаболизм, апоптоз и терапия рака. Int J Mol Sci 16 (1): 924–949
CAS PubMed PubMed Central Статья Google ученый
Cai W, Zhang K, Li PY, Zhu L, Xu J, Yang BY et al (2017) Дисфункция нервно-сосудистой единицы при ишемическом инсульте и нейродегенеративных заболеваниях: эффект старения. Старение Res Rev 34: 77–87
CAS PubMed Статья Google ученый
Bertram L, Tanzi RE (2005) Генетическая эпидемиология нейродегенеративных заболеваний. Исследование J Clin Investig 115 (6): 1449–1457
CAS PubMed PubMed Central Статья Google ученый
Tsuji S (2010) Генетика нейродегенеративных заболеваний: выводы из высокопроизводительного ресеквенирования. Hum Mol Genet 19 (R1): R65 – R70
CAS PubMed PubMed Central Статья Google ученый
Cunnane SC, Plourde M, Pifferi F, Begin M, Feart C, Barberger-Gateau P (2009) Рыба, докозагексаеновая кислота и болезнь Альцгеймера. Prog Lipid Res 48 (5): 239–256
CAS PubMed Статья Google ученый
McNamara RK (2010) Дефицит DHA и невропатология префронтальной коры при рецидивирующих аффективных расстройствах. J Nutr 140 (4): 864–868
CAS PubMed PubMed Central Статья Google ученый
Torres M, Price SL, Fiol-deRoque MA, Marcilla-Etxenike A, Ahyayauch H, Barcelo-Coblijn G et al (2014) Модификации мембранных липидов и терапевтические эффекты, опосредованные гидроксидокозагексаеновой кислотой на болезнь Альцгеймера.Biochim Biophys Acta Biomembr 1838 (6): 1680–1692
CAS Статья Google ученый
Бленноу К., де Леон М.Дж., Зеттерберг Х. (2006) Болезнь Альцгеймера. Ланцет 368 (9533): 387–403
CAS PubMed Статья Google ученый
Bazan NG (2009) Клеточные и молекулярные события, опосредованные передачей сигналов нейропротектина D1, полученного из докозагексаеновой кислоты, в выживании фоторецепторных клеток и защите мозга.Простагландины Leukot Essent Fatty Acids 81 (2–3): 205–211
CAS PubMed PubMed Central Статья Google ученый
McNamara RK, Jandacek R, Rider T, Tso P, Dwivedi Y, Pandey GN (2010) Селективный дефицит в составе докозагексаеновой кислоты эритроцитов у взрослых пациентов с биполярным расстройством и большим депрессивным расстройством. J Affect Disord 126 (1-2): 303-311
CAS PubMed PubMed Central Статья Google ученый
Astarita G, Jung KM, Berchtold NC, Nguyen VQ, Gillen DL, Head E et al (2010) Недостаточный биосинтез докозагексаеновой кислоты в печени коррелирует с когнитивными нарушениями при болезни Альцгеймера. PLoS ONE 5 (9): 1–8
Статья CAS Google ученый
Nasaruddin ML, Hölscher C, Kehoe P, Graham SF, Green BD (2016) Широкомасштабные изменения в составе жирных кислот в головном мозге субъектов с поздней болезнью Альцгеймера, обнаруженные с помощью ГХ-МС.Am J Transl Res 8 (1): 154–165
PubMed PubMed Central Google ученый
Cunnane SC, Schneider JA, Tangney C, Tremblay-Mercier J, Fortier M, Bennett DA et al (2012) Профили жирных кислот в плазме и мозге при легких когнитивных нарушениях и болезни Альцгеймера. J Alzheimers Dis 29 (3): 691–697
CAS PubMed PubMed Central Google ученый
Shahar DR, Schwarzfuchs D, Fraser D, Vardi H, Thiery J, Fiedler GM et al (2010) Потребление кальция в молочных продуктах, витамин D в сыворотке и успешная потеря веса. Am J Clin Nutr 92 (5): 1017–1022
CAS PubMed Статья Google ученый
Dyall SC (2015) Длинноцепочечные жирные кислоты омега-3 и мозг: обзор независимых и общих эффектов EPA, DPA и DHA. Front Aging Neurosci 7:52
PubMed PubMed Central Статья CAS Google ученый
Samieri C, Maillard P, Crivello F, Proust-Lima C, Peuchant E, Helmer C et al (2012) Длинноцепочечные жирные кислоты омега-3 в плазме и атрофия медиальной височной доли. Неврология 79 (7): 642–650
CAS PubMed Статья Google ученый
Heppner FL, Ransohoff RM, Becher B (2015) Иммунная атака: роль воспаления в болезни Альцгеймера. Nat Rev Neurosci 16 (6): 358–372
CAS PubMed Статья Google ученый
Heras-Sandoval D, Pedraza-Chaverri J, Perez-Rojas JM (2016) Роль докозагексаеновой кислоты в модуляции глиальных клеток при болезни Альцгеймера. J Neuroinflamm 13:61
Статья CAS Google ученый
Hashimoto M, Shahdat HM, Yamashita S, Katakura M, Tanabe Y, Fujiwara H et al (2008) Докозагексаеновая кислота разрушает фибрилляцию бета-амилоида (1-40) in vitro и одновременно подавляет уровни амилоида коры головного мозга Крысы, моделирующие болезнь Альцгеймера.J Neurochem 107 (6): 1634–1646
CAS PubMed Статья Google ученый
Grimm MOW, Mett J, Stahlmann CP, Haupenthal VJ, Blumel T, Stotzel H et al (2016) Эйкозапентаеновая кислота и докозагексаеновая кислота усиливают деградацию бета-амилоида, воздействуя на фермент, разлагающий инсулин. Biochem Cell Biol 94 (6): 534–542
CAS PubMed Статья Google ученый
Morgese MG, Tucci P, Mhillaj E, Bove M, Schiavone S, Trabace L et al (2017) Дефицит омега-3 в течение всей жизни вызывает депрессивное состояние через растворимый бета-амилоид. Мол нейробиол 54 (3): 2079–2089
CAS PubMed Статья Google ученый
Colaianna M, Tucci P, Zotti M, Morgese MG, Schiavone S, Govoni S. et al (2010) Растворимый β-амилоид1-42: критический игрок в производстве поведенческих и биохимических изменений, вызывающих депрессивное состояние? Br J Pharmacol 159 (8): 1704–1715
CAS PubMed PubMed Central Статья Google ученый
Osorio RS, Gumb T, Pomara N (2014) Уровни растворимого бета-амилоида и поздняя депрессия. Curr Pharm Des 20 (15): 2547–2554
CAS PubMed PubMed Central Статья Google ученый
Помара Н., Бруно Д. (2016) Большая депрессия может привести к повышению потенциально нейротоксичных бета-амилоидов независимо от болезни Альцгеймера. Am J Geriatr Psychiatr 24 (9): 773–775
Статья Google ученый
Hashimoto M, Katakura M, Hossain S, Rahman A, Shimada T., Shido O (2011) Докозагексаеновая кислота выдерживает нейротоксичность, вызванную α-бета (25-35), в клетках SH-SY5Y. J Nutr Biochem 22 (1): 22–29
CAS PubMed Статья Google ученый
Ledo JH, Azevedo EP, Clarke JR, Ribeiro FC, Figueiredo CP, Foguel D et al (2013) Бета-амилоид-олигомеры связывают депрессивное поведение и когнитивные нарушения у мышей. Mol Psychiatr 18 (10): 1053–1054
CAS Статья Google ученый
Ren HX, Luo CM, Feng YQ, Yao XL, Shi Z, Liang FY et al (2017) Полиненасыщенные жирные кислоты омега-3 способствуют выведению из мозга бета-амилоида, опосредуя функцию глимфатической системы. Faseb J 31 (1): 282–293
CAS PubMed Статья Google ученый
Остер Т., Пиллот Т. (2010) Докозагексаеновая кислота и синаптическая защита у мышей с болезнью Альцгеймера. Biochim Biophys Acta Mol Cell Biol Lipids 1801 (8): 791–798
CAS Статья Google ученый
Базан Н.Г. (2009) Нейропротектин D1-опосредованный противовоспалительный сигнал и передача сигналов выживания при инсульте, дегенерации сетчатки и болезни Альцгеймера. J Lipid Res 50 (Suppl): 400–405
Артикул CAS Google ученый
Goetz CG (2011) История болезни Паркинсона: ранние клинические описания и неврологические методы лечения. Cold Spring Harb Perspect Med 1: 1
Статья CAS Google ученый
Vinot N, Jouin M, Lhomme-Duchadeuil A, Guesnet P, Alessandri JM, Aujard F et al (2011) Жирные кислоты омега-3 из рыбьего жира снижают беспокойство, улучшают когнитивные функции и снижают спонтанную двигательную активность у нечеловеческих приматов . PLoS ONE 6: 6
Статья CAS Google ученый
Bousquet M, Saint-Pierre M, Julien C, Salem N, Cicchetti F, Calon F (2008) Благоприятные эффекты диетических полиненасыщенных жирных кислот омега-3 на вызванную токсинами дегенерацию нейронов на животной модели болезни Паркинсона болезнь.Faseb J 22 (4): 1213–1225
CAS PubMed Статья Google ученый
Озкан А., Парлак Н., Танриовер Г., Дилмак С., Улкер С. Н., Бирсен Л. и др. (2016) Защитный механизм докозагексаеновой кислоты в мышиной модели Паркинсона: роль гемоксигеназы. Neurochem Int 101: 110–119
CAS Статья Google ученый
Bousquet M, Gue K, Emond V, Julien P, Kang JX, Cicchetti F et al (2011) Трансгенное превращение омега-6 в омега-3 жирные кислоты на мышиной модели болезни Паркинсона.J Lipid Res 52 (2): 263–271
CAS PubMed PubMed Central Статья Google ученый
Ozsoy O, Seval-Celik Y, Hacioglu G, Yargicoglu P, Demir R, Agar A et al (2011) Влияние и механизм докозагексаеновой кислоты на мышиной модели болезни Паркинсона. Neurochem Int 59 (5): 664–670
CAS PubMed Статья Google ученый
Pomponi M, Loria G, Salvati S, Di Biase A, Conte G, Villella C et al (2014) Эффекты DHA при депрессии при болезни Паркинсона. Базальные ганглии 4 (2): 61–66
Статья Google ученый
da Silva TM, Munhoz RP, Alvarez C, Naliwaiko K, Kiss A, Andreatini R et al (2008) Депрессия при болезни Паркинсона: двойное слепое рандомизированное плацебо-контролируемое пилотное исследование омега-3 добавление жирных кислот. J Affect Disord 111 (2–3): 351–359
PubMed Статья CAS Google ученый
Дариос Ф., Давлетов Б. (2006) Омега-3 и омега-6 жирные кислоты стимулируют расширение клеточной мембраны, воздействуя на синтаксин 3. Nature 440 (7085): 813–817
CAS PubMed Статья Google ученый
Chytrova G, Ying Z, Gomez-Pinilla F (2010) Упражнения влияют на эффекты пищевых добавок DHA, воздействуя на мембранные синаптические системы. Brain Res 1341: 32–40
CAS PubMed Статья Google ученый
Алессандри Дж.М., Гесне П., Ванкассель С., Асторг П., Денис И., Ланжелье Б. и др. (2004) Полиненасыщенные жирные кислоты в центральной нервной системе: эволюция концепций и последствия для питания на протяжении всей жизни. Reprod Nutr Dev 44 (6): 509–538
CAS PubMed Статья Google ученый
Арима Х, Омура Т., Хаясака Т., Масаки Н., Ханада М., Сюй Д. и др. (2015) Снижение уровня фосфатидилхолина, содержащего докозагексаеновую кислоту, в переднем роге модели мыши с БАС.Неврология 297: 127–136
CAS PubMed Статья Google ученый
Илиева Е.В., Аяла В., Йове М., Дальфо Э., Какабелос Д., Поведано М. и др. (2007) Взаимодействие стресса окислительного и эндоплазматического ретикулума при спорадическом боковом амиотрофическом склерозе. Brain 130 (12): 3111–3123
PubMed Статья Google ученый
Аяла В., Гранадо-Серрано А.Б., Какабелос Д., Науди А., Илиева Е.В., Боада Дж. И др. (2011) Клеточный стресс вызывает патологические изменения TDP-43, связанные с дисфункцией ERK1 / 2: последствия для БАС.Acta Neuropathol 122 (3): 259–270
CAS PubMed Статья Google ученый
Cacabelos D, Ayala V, Granado-Serrano AB, Jove M, Torres P, Boada J et al (2016) Взаимодействие между TDP-43 и процессами, связанными с докозагексаеновой кислотой, при боковом амиотрофическом склерозе. Neurobiol Dis 88: 148–160
CAS PubMed Статья Google ученый
Fitzgerald KC, O’Reilly ÉJ, Falcone GJ et al (2014) Диетическое потребление полиненасыщенных жирных кислот ω-3 и риск бокового амиотрофического склероза.JAMA Neurol 71 (9): 1102–1110
PubMed PubMed Central Статья Google ученый
Петтит Л.К., Варсани С., Тадрос Дж., Вассилиу Э. (2013) Регулирование воспалительных свойств активированной микроглии с помощью докозагексаеновой кислоты и аспирина. Липиды Здоровье Dis 12:16
CAS PubMed PubMed Central Статья Google ученый
Yip PK, Pizzasegola C, Gladman S, Biggio ML, Marino M, Jayasinghe M. et al (2013) Эйкозапентаеновая кислота омега-3 жирных кислот ускоряет прогрессирование заболевания в модели бокового амиотрофического склероза.PLoS ONE 8:17
Google ученый
Shibata N, Yamada S, Uchida K, Hirano A, Sakoda S, Fujimura H et al (2004) Накопление связанного с белком 4-гидрокси-2-гексенала в спинном мозге пациентов со спорадическим боковым амиотрофическим склерозом . Brain Res 1019 (1-2): 170–177
CAS PubMed Статья Google ученый
Siriwardhana N, Kalupahana NS, Moustaid-Moussa N (2012) Польза для здоровья n-3 полиненасыщенных жирных кислот: эйкозапентаеновой кислоты и докозагексаеновой кислоты.В: Ким С.К. (ред.) Достижения в исследованиях пищевых продуктов и питания, том 65, значения и применения — животные и микробы. Elsevier Academic Press Inc, Сан-Диего, стр. 211–222
Google ученый
Hussein JS (2013) Жирные кислоты клеточной мембраны и здоровье. Int J Pharm Pharm Sci. 5 (3): 38–46
CAS Google ученый
Simopoulos AP (2013) Диетический дефицит жирных кислот омега-3 и высокое потребление фруктозы в развитии метаболического синдрома, метаболических нарушений мозга и неалкогольной жировой болезни печени.Питательные вещества 5 (8): 2901–2923
CAS PubMed PubMed Central Статья Google ученый
Fritsche KL (2015) Наука о жирных кислотах и воспалении. Adv Nutr 6 (3): 293S – 301S
CAS PubMed PubMed Central Статья Google ученый
Доменикиелло А.Ф., Китсон А.П., Базинет Р.П. (2015) Достаточно ли синтеза докозагексаеновой кислоты из α-линоленовой кислоты для снабжения мозга взрослого человека? Prog Lipid Res 59: 54–66
CAS PubMed Статья Google ученый
Глобальная организация по EPA и DHA Omega-3 (2015) Глобальные рекомендации по потреблению EPA и DHA. п. 17
ФАО (2010) Жиры и жирные кислоты в питании человека. Отчет экспертной консультации. Папка ФАО по питанию и питанию 1: 1–166
Google ученый
Authority EFS (2010) Научное заключение о диетических контрольных значениях жиров, включая насыщенные жирные кислоты, полиненасыщенные жирные кислоты, мононенасыщенные жирные кислоты, трансжирные кислоты и холестерин.EFSA J 8 (3): 1461
Артикул CAS Google ученый
Kus-Yamashita MMM, Mcdonald B, Ravacci G, Rogero MM, Santos RD, Waitzberg D et al (2016) Полиненасыщенные жирные кислоты: влияние на здоровье. Eur J Nutr Food Saf 6 (3): 111–131
Артикул Google ученый
Jensen CL (2006) Эффекты n-3 жирных кислот во время беременности и кормления грудью. Am J Clin Nutr 83 (Дополнение): 1452–1457
Google ученый
Koletzko B, Cetin I, Brenna JT, Grp P (2007) Потребление жиров с пищей для беременных и кормящих женщин. Br J Nutr 98 (5): 873–877
CAS PubMed Статья Google ученый
Morgese M, Trabace L (2016) Материнское недоедание в этиопатогенезе психических заболеваний: роль полиненасыщенных жирных кислот. Brain Sci 6 (3): 24
PubMed Central Статья Google ученый
